一种脂滴诱导及成像试剂及其制备方法和应用与流程
[0001]
本发明涉及生物技术,具体涉及一种脂滴诱导及成像试剂及其制备方法和应用。
背景技术:
[0002]
脂滴(lipid droplets,lds)是细胞内中性脂质的主要贮存场所,可以储存甘油三酯、甾醇酯和视黄酯等,是一种具有单层膜结构、表面被覆蛋白的多功能细胞器。近期研究发现,除了负责脂肪储存外,脂滴对于许多细胞功能也是必需的,例如脂质代谢、膜生物合成、细胞信号传导和炎症等。此外,越来越多的证据表明癌症的发生与脂滴的异常有关。脂滴的这些重要生物学功能迫切需要研究者们开发能够高效调控和监测细胞脂滴的试剂。但是目前的脂滴诱导试剂如环孢菌素,现已被列为一类致癌物;而临床使用的人氧化型低密度脂蛋白,则受限于其较短的保质期(一般在2-8℃保存时间为6周左右);至于目前最常用的长链脂肪酸的代表油酸,其水溶性差且无法标记脂滴。因此,开发能有效诱导细胞的脂滴产生并对其进行特异荧光成像的试剂十分必要。
技术实现要素:
[0003]
发明目的:针对现有技术存在的问题,本发明提供了一种脂滴高效诱导及荧光标记试剂,可以有效解决现有脂滴诱导试剂水溶性差,且无法对脂滴进行特异性的示踪,以及安全性不佳等缺点。
[0004]
本发明还提供一种脂滴诱导及成像试剂的制备方法和应用。
[0005]
技术方案:为实现上述发明目的,本发明所述一种脂滴诱导及成像试剂,所述试剂为负电不饱和甘油磷脂和尾部标记荧光的磷脂所构成的脂质体。
[0006]
其中,所述负电不饱和甘油磷脂为头部负电基团为磷脂酰丝氨酸(ps)、磷脂酰甘油(pg)、磷脂酰肌醇(pi)、磷脂酸(pa)或者双磷脂酰甘油(ca)的负电不饱和甘油磷脂。
[0007]
其中,所述负电不饱和甘油磷脂为烷烃链长度为14-18个碳原子且含有至少一个不饱和顺式双键的单链或者多链的负电不饱和甘油磷脂。
[0008]
其中,所述负电不饱和甘油磷脂为上述所述磷脂中的单一或任意比例混合磷脂。
[0009]
其中,所述尾部标记荧光磷脂的头部基团为磷脂酰胆碱(pc)、磷脂酰乙醇胺(pe)、磷脂酰丝氨酸(ps)、磷脂酰甘油(pg)、磷脂酰肌醇(pi)、磷脂酸(pa)或者其他磷脂分子头部基团。
[0010]
其中,所述尾部标记荧光的磷脂中所含荧光团为7-硝基苯并-2-氧杂-1,3-二唑基(nbd)、芘(pyrene)、二吡咯亚甲基二氟化硼(dpmb)、二苯基己三烯(dph)或者其他可接枝于磷脂尾链上的荧光分子。
[0011]
其中,所述尾部标记荧光的磷脂与负电不饱和甘油磷脂的质量比为1:20-1:500。
[0012]
本发明所述的脂滴诱导及成像试剂的制备方法,包括如下步骤:
[0013]
将尾部标记荧光的磷脂与负电不饱和甘油磷脂在氯仿或甲醇中混合均匀,吹干溶剂后进行真空干燥,加入磷酸缓冲液振荡水化后,室温下采用探头超声制备出脂质体,即为
脂滴诱导及成像试剂。
[0014]
本发明所述的脂滴诱导及成像试剂在脂滴诱导中的应用。
[0015]
本发明所述的脂滴诱导及成像试剂在脂滴特异性荧光成像中的应用。
[0016]
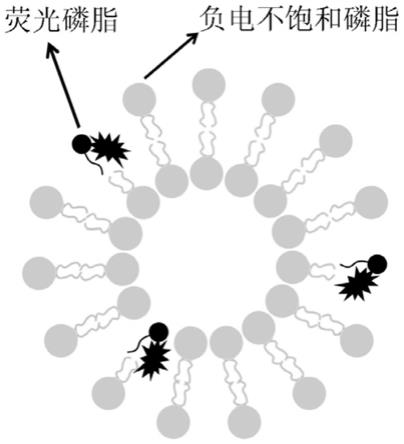
本发明提供了一种双组分脂质体试剂,是一种脂滴高效诱导及荧光标记成像试剂。本发明脂滴诱导及成像脂质体的结构见附图1。本发明所利用的尾部标记荧光的磷脂在结构上与普通磷脂相似的特性,其可以与普通磷脂(非荧光标记)组成多组分脂质体并随普通磷脂实现特定区域的定位和荧光成像,在本发明中,尾部标记荧光的磷脂被用来与负电不饱和甘油磷脂进行组合。由于本试剂中的负电不饱和甘油磷脂可以诱导细胞产生大量脂滴并在脂滴中稳定滞留,与负电不饱和甘油磷脂组成脂质体的荧光磷脂也随之定位于脂滴处,最终可以同时实现对脂滴的高效诱导和对脂滴的特异性荧光标记。
[0017]
此外,由于磷脂含有亲水性基团,其所构成的脂质体内腔和外部都是水溶液环境,水分散性好;实际可以替换成不同颜色荧光磷脂,从而实现不同颜色的脂滴荧光成像。
[0018]
有益效果:与现有技术相比,本发明试剂对细胞的毒性很低,诱导脂滴的效率有很大提高。此外,本发明还同时实现了细胞内脂滴的特异性荧光成像示踪。
[0019]
具体来说,本发明试剂具有以下优势:
[0020]
(1)相比于油酸等传统脂滴诱导试剂,本发明的脂质体水分散性良好,在不影响细胞活性的情况下,能有效地诱导细胞生成大量脂滴,这有利于其应用于细胞生物学领域;
[0021]
(2)本发明脂滴诱导试剂的主要成分甘油磷脂是细胞本身所含有的组分,因而具备良好的细胞相容性;
[0022]
(3)本发明中的荧光磷脂可以根据需要替换具有不同颜色发光的荧光磷脂,从而实现不同颜色的脂滴荧光成像;
[0023]
(4)本发明的脂滴诱导及成像试剂,原料来源广泛、生物利用度高,制备过程简单,有大规模生产应用的潜力。
附图说明
[0024]
图1为本发明脂滴诱导及成像脂质体的结构图;
[0025]
图2为本发明实施例1所用不饱和甘油磷脂及荧光磷脂的分子结构式;
[0026]
图3为本发明实施例1所得脂滴诱导及成像脂质体结构图;
[0027]
图4为双油酰磷脂酰丝氨酸/7-硝基苯并-2-氧杂-1,3-二唑基标记的磷脂酰丝氨酸(dops/nbd-ps)脂质体对a549肺癌细胞的毒性评价;
[0028]
图5为商品化脂滴诱导剂油酸对a549肺癌细胞的脂滴诱导显微镜观察结果;
[0029]
图6为dops/nbd-ps脂质体对a549肺癌细胞的脂滴诱导显微镜观察结果;
[0030]
图7为dops/nbd-ps脂质体对a549肺癌细胞的脂滴荧光成像结果。
具体实施方式
[0031]
下面结合附图和实施例对本发明作进一步说明。
[0032]
实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例中涉及的负电不饱和甘油磷脂和尾部标记荧光的磷脂均购买于美国avanti公司。实施例中的磷酸缓冲液均为细胞用磷酸缓冲液,ph为7.4,离子强度为150mm。
[0033]
实施例1
[0034]
(1)称取10mg的双油酰磷脂酰丝氨酸(dops,结构式见附图2)并将其溶于0.5ml氯仿,氮气吹干溶剂后置于真空干燥箱中室温干燥4小时。加入1ml的磷酸缓冲液振荡水化分散后,采用探头超声(163w,4分钟)制备出脂质体,命名为dops脂质体;
[0035]
(2)取0.2ml浓度为1mg/ml的尾部有nbd标记而头部为磷脂酰丝氨酸基团的荧光磷脂(命名为nbd-ps,结构式见附图2)(溶剂为氯仿),并与溶于0.5ml氯仿的dops(10mg)混合均匀,氮气吹干溶剂后置于真空干燥箱中室温干燥4小时。加入1ml的磷酸缓冲液水化分散后,采用探头超声(163w,4分钟)制备出脂质体,命名为dops/nbd-ps脂质体(结构见附图3)。
[0036]
实施例2
[0037]
不同饱和度的脂滴诱导及成像脂质体的构建:
[0038]
制备方法与实施例1相同,所不同的是,实施例1的(2)中所用dops替换为等质量的棕榈酰油酰磷脂酰丝氨酸(pops)。
[0039]
实施例3
[0040]
不同头部基团的脂滴诱导及成像脂质体的构建:
[0041]
制备方法与实施例1相同,所不同的是,实施例1的(2)中所用dops替换为等质量的双油酰磷脂酰甘油(dopg)、双油酰磷脂酰肌醇(dopi)、双油酰磷脂酸(dopa)或叠双油酰磷脂酰甘油(doca)。
[0042]
实施例4
[0043]
不同荧光标记的脂滴诱导及成像脂质体的构建:
[0044]
制备方法与实施例1相同,所不同的是,实施例1的(2)中所用nbd-ps替换为等质量的pyrene-ps(尾部pyrene标记的ps)、dpmb-ps(尾部dpmb标记的ps)或dph-ps(尾部dph标记的ps)。
[0045]
实施例5
[0046]
不同配比的脂滴诱导及成像脂质体的构建:
[0047]
制备方法与实施例1相同,所不同的是,实施例1的(2)中所用荧光磷脂与负电不饱和甘油磷脂的质量比由1:50(即0.2mg:10mg)替换为1:20(即0.5mg:10mg)或1:500(即0.02mg:10mg)。
[0048]
实施例6
[0049]
评价实施例1所制得的试剂的细胞毒性,具体操作如下:
[0050]
a549肺癌细胞在96孔板上培养24小时后(5%co
2
,37℃),将每孔原有的dmem培养基替换为100μl含有dops脂质体或dops/nbd-ps脂质体的dmem完全培养基(每孔中dops浓度分别为0、10、20、50、80、100、120、150μg/ml;对应的nbd-ps浓度则分别为0、0.2、0.4、1.0、1.6、2.0、2.4、3.0μg/ml),在培养箱中(5%co
2
,37℃)继续孵育24小时。随后用mtt法对细胞活性进行检测,结果见附图4。
[0051]
由图4可知,本发明试剂对a549细胞的毒性非常低,证明了本发明试剂具有良好的细胞相容性,安全性好。
[0052]
实施例7
[0053]
评价实施例1所制得的试剂的细胞脂滴诱导效果,具体操作如下:
[0054]
为了解细胞脂滴情况,a549肺癌细胞先在共聚焦培养板上培养24小时(5%co
2
,37
℃),然后将每孔原有的dmem培养基替换为100μl含有油酸的dmem完全培养基(油酸:120μm,即与后续100μg/ml dops的物质的量浓度)再继续孵育24小时,再经商品化脂滴染料bodipy 493/503(sigma)染色(10分钟,2nm)并利用共聚焦显微镜进行观察(激发波长为488nm,接收波段为495至555nm),结果见附图5。由图5可知,明场中的圆泡状结构与商品化脂滴染料bodipy 493/503的染色区域共定位良好,证明了明场中观察到的泡状结构是a549细胞中的脂滴,说明后期无需用商品化脂滴试剂荧光共染,明场中即可标明脂滴的位置,为实施例8中的本试剂脂滴成像作参照(商品化脂滴染料与本试剂荧光上有重叠或干扰)。
[0055]
为评价本发明试剂对细胞脂滴的诱导效果,a549肺癌细胞先在共聚焦培养板上培养24小时,然后将每孔原有的dmem培养基替换为100μl含有dops脂质体的dmem完全培养基(dops:100μg/ml),再放回培养箱中(5%co
2
,37℃)继续孵育24小时。随后,细胞经商品化脂滴染料bodipy 493/503染色(10分钟,2nm)并利用共聚焦显微镜进行观察,结果见附图6。由图6可知,明场和荧光场中都出现了大量的圆泡状结构,证明了细胞内脂滴的大量产生。对比图5和图6可知,dops脂质体能显著诱导细胞产生大量脂滴,并且诱导的效率高于同物质的量浓度的油酸。
[0056]
实施例8
[0057]
评价实施例1所制得的试剂的脂滴荧光成像效果,具体操作如下:
[0058]
a549肺癌细胞在共聚焦培养板上培养24小时后(5%co
2
,37℃),将每孔原有的dmem培养基替换为100μl含有dops/nbd-ps脂质体的dmem完全培养基(dops:100μg/ml;对应的nbd-ps:2μg/ml),再放回培养箱(5%co
2
,37℃)继续孵育24小时。随后,利用共聚焦显微镜进行观察(激发波长为488nm,接收波段为495至580nm),结果见附图7。
[0059]
由图5和图7可知,本发明试剂能使细胞产生大量脂滴,并且诱导的效率高于同物质的量浓度的油酸,同时还能对细胞产生的脂滴进行特异性的荧光标记。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1