由醇利用细菌以微生物制造蛋白质和PHB的制作方法
本申请要求2016年12月9日提交的美国临时申请第62/432,185号的权益,该案以全文引用的方式并入本文中。
技术领域
本发明涉及用于制造含较高蛋白质比聚羟基烷酸酯比率的生物质的微生物和方法,以及此类生物质在饲料和营养补充组合物中的用途。
背景技术:
治疗疾病以提高农场产出的方法是一个不受时间影响的目标。就这一点来说,抗生素已成为强效武器,但鉴于普遍的过度使用导致其它并发症并且对水产养殖中的水性环境带来特定难题,应当积极地寻求缓解疾病的替代方法(Defoirdt等人(2011)《微生物学新见(Curr Opin Microbiol)》14:251-258;Burridge等人(2010)《水产养殖(Aquaculture)》306:7-23)。有机酸已经被描述为能够对病原菌展现抑菌和杀菌特性(Ricke(2003)《家禽科学(Poult Sci)》632-639;Vázquez等人(2005)《水产养殖》245:149-161;Wang等人(2008)《水产养殖》281:1-4;Ng等人(2015)《水产养殖》449:69-77;Romano等人(2015)《水产养殖》435:228-236)。其作用模式引起细胞代谢耗竭,由此减少细胞生长且甚至导致细胞死亡(Hismiogullari等人(2008)《动物医学进展(J Anim Vet Adv)》7:681-684)。
经显示,给与约2g/L若干类型的短链脂肪酸(SCFA)使盐水虾旧金山卤虫(Artemia franciscana)测试样品的存活率加倍(Defoirdt等人(2006)《水产养殖》261:804-808)。然而,由于这些化合物特别易溶于水中,故SCFA可能不适合用于水产养殖。已发现呈细菌储存聚合物聚β-羟基丁酸酯(PHB)形式的替代物(Defoirdt等人(2009)《生物技术进展(Biotechnol Adv)》27:680-685)。这一化合物充当细菌的细胞内能量和碳储备(Tokiwa等人(2004)《生物技术快报(Biotechnol Lett)》26:1181-1189),以及针对氧化应激的保护剂(Koskimaki等人(2016)《自然-化学生物学(Nat Chem Biol)》12:332-338)。该化合物不可溶于水中并且经显示,其可生物降解成β-羟基丁酸(Bonartsev等人(2007)《应用微生物学当前研究和教育主题和趋势交流(Commun Curr Res Educ Top Trends Appl Microbiol)》295-307)。β-羟基丁酸可以对某些病原体,如弧菌属(Vibrio sp.)(Seghal等人(2016)《NPJ生物膜和微生物组(Npj Biofilm Microbiomes)》2:16002)或鮰爱德华氏菌(Edwardsiella ictaluri)(Situmorang等人(2016)《兽医微生物学(Vet Microbiol)》182:44-49)展现生长抑制作用,如同其它SCFA一样保护旧金山卤虫(A.franscicana)(Defoirdt等人(2007)《生物技术趋势(Trends Biotechnol)》25:472-497)并且是针对罗非鱼体内芽孢杆菌的潜在免疫刺激剂(Suguna等人(2014)《鱼类与有壳水生生物免疫学(Fish and Shellfish Immunnol)》36:90-97)。因此,如果通过饲料补充PHB且随后使其在水产养殖生物体的胃肠道中降解,则局部释放的PHB寡聚物可以诱导其有益的作用。在用旧金山卤虫进行的若干实验中,这一方法使感染病原体坎氏弧菌(Vibrio campbellii)的旧金山卤虫的存活率增加至73%(Halet等人(2007)《欧洲微生物学会联合会微生物生态学(FEMS Microbiol Ecol)》60:363-369);Defoirdt等人(2007)《环境微生物学(Environ Microbiol)》9:445-452)。
文献证实了在若干水生动物物种中展现积极影响的PHB的若干实例(Suguna等人(2014)《鱼类与有壳水生生物免疫学》36:90-97;Najdegerami等人(2015)《水产营养(Aquac Nutr)》doi:10.1111/anu.12386)。Najdegerami等人在若干剂量的PHB包含率下测试了欧洲海鲈幼鱼,并且观察到对肠道菌群组成的影响。相对于正常饲料处理的2.2倍初始鱼重量增加,补充有2%和5%纯化PHB(w/w)的饮食分别诱导初始鱼重量增加2.4倍和2.7倍(De Schryver等人(2010)《应用微生物学与生物技术(ApplMicrobiolBiotechnol)》86:1535-1541)。同时,这些处理显示鱼肠中最高的细菌范围加权的丰富度(range weighted richness)。基于分子分析,较高的膳食PHB水平诱导菌群组成的较大变化且由此说明,PHB可以对鱼类生长性能具有有益的影响并且肠道菌群结构可能与此现象紧密相关。
将2%和5%浓度的PHB提供给西伯利亚鲟(Siberian sturgeon)鱼苗,并跟踪胃肠道微生物群落。据观察,含有PHB的饮食引起较高的物种丰富度并且在2%纯化PHB下观察到最大丰富度。用含PHB饮食投喂西伯利亚鲟一般具有较差的饲料转化率,但当投喂含2%PHB的饮食时看来明显提高存活率并增进生长。(Najdegerami等人(2012)《欧洲微生物学会联合会微生物学生态学》79:25-33)
在对虾中观察到类似现象。(Laranja等人(2014)《兽医微生物学》173:310-317)从菲律宾虾培养池获得PHB积累混合细菌培养物(mixed bacterial culture,mBC;以细胞干重计48.5%PHB)以及两个PHB积累细菌分离株芽孢杆菌JL47(以细胞干重计54.7%PHB)和芽孢杆菌JL1(以细胞干重计45.5%PHB)并研究其改善南美白对虾(Penaeus monodon)后期虾苗(post-larvae,PL)的生长、存活率和健壮性(robustness)的能力。向虾PL1和虾PL30提供含PHB的细菌培养物的饲料30天,随后用致病性坎氏弧菌攻击。在致病性攻击之前,接受PHB积累细菌的虾的生长和存活率高于接受未添加细菌的饮食的虾。在暴露于致病性攻击之后,投喂PHB积累细菌的虾显示的存活率高于未处理的虾,表明虾的健壮性增加。当在通过水用致病性坎氏弧菌攻击期间,向虾PL30提供PHB积累细菌培养物时,观察到类似效果。作者测试了暴露于致死性氨应激的情形,但观察到投喂PHB积累细菌的虾与非PHB处理的虾之间无显著差异。
扭脱甲基杆菌(Methylobacterium extorquens)是在自然界作为叶共生体发现的一种天然存在的细菌。扭脱甲基杆菌除具有若干值得关注的生长特征外,这一微生物还产生PHB作为能量储存分子和/或作为针对应激的生理反应(Valentin和Steinbuchel(1993)《应用微生物学与生物技术》39:309-317)。历史上,在制造最高水平的PHB作为可生物降解塑料的前驱物方面已投入很大努力(Bourque等人(1995)《应用微生物学与生物技术》44:367-376)。由于细胞的碳预算通常是限定的,故制造PHB可以使碳流出远离所关注产物,包括类胡萝卜素、氨基酸或常见蛋白质含量。需要具有较低PHB产量且理想地,具有较高所关注蛋白质和其它有机化合物含量的细胞。操纵蛋白质:PHB比率以使蛋白质含量(例如>65%)与益生元效应之间达到最佳的能力将是特别合乎需要的。
通过减少不合需要的碳利用,可以潜在地增加生长速率,减少不合需要的副产物的碳用量并增加用于制造所希望产物的碳的利用率。此外,通过减少或移除累计超过1%总生物质的碳产物,如PHB或胞外多糖(Kim等人(2003)《世界微生物学与生物技术杂志(World J Microbiol Biotechnol)》19:357-361),可以有效地增加可用于人或动物食品的单细胞蛋白质源的某些配制物中的蛋白质或脂质的含量。
细胞可以具有若干形式的PHA/PHB,包括储存PHB、中链PHB和蛋白质缀合的PHB(Reussch(2014)《国际分子科学杂志(Iht JMol Sci)》14:10727-48)。这些形式的大小分别在每条聚合物链从10,000-10,000,000个、100-200个至10-20个残基的范围内。储存PHB是在许多细菌的细胞质中的蛋白质结合颗粒内发现。这些蛋白质包括PHA颗粒结合蛋白(phasin)外壳蛋白、PHB聚合酶、PHB解聚酶、调节蛋白和颗粒组织蛋白如PhaM(Jendrossek等人(2014)《环境微生物学(Enviro Microbiol)》16:2357-73)。
相对于可溶性有机酸如丁酸酯,长于6-12个残基的PHB聚合物不可溶于水中(Reussch(2014)《国际分子科学杂志》14:10727-48;Focarete等人(1999)《大分子(Macromolecules)》32:4184-4818)并因此可用于水产养殖饲料。控制PHB聚合物的量以及其平均长度的能力对于使可供生物体使用的有机酸的量最大化至关重要。较短的水不溶性聚合物PHA/PHB将在肠道中通过化学或酶消化而较完全地裂解成更容易利用且活性更强的有机酸化合物(Silva等人(2016)《世界水产养殖学会杂志(J World Aquaculture Soc)》47:508-18;Hoseinifar等人(2017)《水产养殖研究(Aquaculture Res)》48:1380-91)。
储存PHB的量和平均长度受环境条件、碳和氮源、总碳通量以及PHB聚合酶和解聚酶的相对活性影响(Anderson等人(1990)《微生物学评论(Microbiol Rev)》54:450-472)。此外,固有解聚酶的过度表达或从天然地降解PHB的生物体获得的异源PHB消化酶的表达(Sugiyama等人(2004)《现代微生物学(Cur Microbiol)》48:424-7;Hadrick等人(2001)《生物化学杂志(J Biol Chem)》276:36215-24)将减小PHB的量和平均聚合物长度,产生具有更易供生物利用的SCFA的优良饲料。
技术实现要素:
本文提供了用于制造聚羟基烷酸酯(PHA)(例如聚β-羟基丁酸酯(PHB))和蛋白质、饲料和营养补充组合物,以及通过消费所述饲料组合物提高动物生存力的微生物和方法。
在一方面,提供了非天然存在的微生物。在一些实施例中,所述非天然微生物制造出以重量计比作为所述非天然存在的微生物来源的亲本微生物低约1%至约99.9%的PHA产物和以重量计比所述亲本微生物高约1%至约250%的蛋白质。在一些实施例中,所述非天然存在的微生物可以制造出重量比是约1∶1000至约3∶1、或约1∶1000至约1∶6的PHA和蛋白质。在一些实施例中,由所述非天然存在的微生物制造的PHA产物是PHB。
在一些实施例中,所述非天然存在的微生物属于甲基单胞菌属(Methylomonas)、甲基杆菌属(Methylobacter)、甲基球菌属(Methylococcus)、甲基弯曲菌属(Methylosinus)、甲基孢囊菌属(Methylocyctis)、甲基微菌属(Methylomicrobium)、甲烷单胞菌属(Methanomonas)、嗜甲基菌属(Methylophilus)、甲基芽孢杆菌属(Methylobacillus)、甲基杆菌属(Methylobacterium)、生丝微菌属(Hyphomicrobium)、黄色杆菌属(Xanthobacter)、芽孢杆菌属(Bacillus)、副球菌属(Paracoccus)、诺卡菌属(Nocardia)、节杆菌属(Arthrobacter)、红假单胞菌属(Rhodopseudomonas)、假单胞菌属(Pseudomonas)、念珠菌属(Candida)、汉森酵母属(Hansenula)、毕赤酵母属(Pichia)、球拟酵母属(Torulopsis)、弧菌属(Vibrio)、埃希氏菌属(Escherichia)、产碱杆菌属(Alcaligenes)、罗尔斯通氏菌属(Ralstonia)、红细菌属(Rhodobacter)、酵母属(Saccharomyces)、贪铜菌属(Cupriavidus)、中华根瘤菌属(Sinorhizobium)、白霉菌属(Mucor)、短根瘤菌属(Bradyrhizobium)、耶氏酵母属(Yarrowia)、固氮菌属(Azotobacter)、集胞藻属(Synechocystis)、红酵母属(Rhodotorula)、气单胞菌属(Aeromonas)、磁螺菌属(Magnetospirillum)、富盐菌属(Haloferax)、显核菌属(Caryophanon)或闪杆菌属(Allochromatium)。例如,所述微生物可以属于甲基杆菌属,例如扭脱甲基杆菌。
在一些实施例中,所述非天然存在的微生物或作为所述非天然存在的微生物来源的亲本微生物经历基因修饰或人工预选以制造出相对于相应未修饰或未经选择的微生物升高水平的一种或多种类胡萝卜素化合物。例如,所述类胡萝卜素化合物可以选自但不限于β-胡萝卜素、番茄红素、视紫质、玉米黄素、叶黄素、角黄素、绿蝇黄质、海胆酮、隐黄质、虾青素、金盏花黄质、3-羟基海胆酮和/或紫菌红醚。
在一些实施例中,PHA是在所述非天然存在的微生物中的一个或多个细胞内颗粒中。
在一些实施例中,所述非天然存在的微生物包括一个或多个内源性PHA生物合成基因、PHA降解基因和/或PHA颗粒结合蛋白基因,或其外部调控序列中的一种或多种突变,使得PHA的制造减少或增加和/或产生聚合物长度分布改变的PHA。
在一些实施例中,所述突变包括一个或多个PHA生物合成基因(例如phaA、phaB和/或phaC)的缺失或表达减少,或使一种或多种PHA生物合成酶(例如phaA、phaB和/或phaC的基因产物)的酶活性降低。
在一些实施例中,所述突变包括一个或多个PHA降解基因(例如phaY、phaZ和/或hbd)的表达增加,或使一种或多种PHA降解酶(例如phaY、phaZ和/或hbd的基因产物)的酶活性增强。
在一些实施例中,所述突变包括一个或多个PHA颗粒结合蛋白基因(例如Mext_2223、Mext_2560和/或Mext_0493)的缺失或表达减少,或使一种或多种PHA颗粒结合蛋白(例如Mext_2223、Mext_2560和/或Mext_0493的基因产物)对细胞内PHA颗粒的结合亲和力降低。
在一些实施例中,所述非天然存在的微生物包括一个或多个异源基因,使得PHA的制造减少或增加。例如,所述非天然存在的微生物可以包括一个或多个异源PHA降解基因(例如phaY和/或phaZ),使得PHA的制造减少或产生聚合物长度分布改变的PHA。
另一方面,提供了包括如本文中所描述的非天然存在的微生物(生物质)的饲料和营养补充组合物。在一些实施例中,所述组合物可以包括重量比是约1∶1000至约3∶1、或约1∶1000至约1∶6的PHA和蛋白质。在一些实施例中,所述组合物中的PHA产物包括PHB。
在一些实施例中,所述饲料或营养补充组合物包括多种如本文所描述的非天然存在的微生物,其各自包括一个或多个PHA生物合成基因中的突变和/或一种或多种PHA颗粒结合蛋白中的突变,其中所述多种非天然存在的微生物各自以不同水平制造PHA(例如PHB)和蛋白质,并且其中所述非天然存在的微生物的组合提供在所述组合物中重量比是约1∶1000至约3∶1、或约1∶1000至约1∶6的PHA和蛋白质。
另一方面,提供了一种用于制造生物质的方法,所述方法包括在适于制造制造PHA(例如PHB)的微生物(例如,如本文中所描述的非天然存在的微生物,或天然存在的微生物)生长的条件下,在培养基中培养所述微生物,其中所述培养条件产生包含重量比是约1∶1000至约3∶1、或约1∶1000至1∶6的PHA:蛋白质的生物质。
在一些实施例中,所述微生物属于甲基单胞菌属、甲基杆菌属、甲基球菌属、甲基弯曲菌属、甲基孢囊菌属、甲基微菌属、甲烷单胞菌属、嗜甲基菌属、甲基芽孢杆菌属、甲基杆菌属、生丝微菌属、黄色杆菌属、芽孢杆菌属、副球菌属、诺卡菌属、节杆菌属、红假单胞菌属、假单胞菌属、念珠菌属、汉森酵母属、毕赤酵母属、球拟酵母属、弧菌属、埃希氏菌属、产碱杆菌属、罗尔斯通氏菌属、红细菌属、酵母属、贪铜菌属、中华根瘤菌属、白霉菌属、短根瘤菌属、耶氏酵母属、固氮菌属、集胞藻属、红酵母属、气单胞菌属、磁螺菌属、富盐菌属、显核菌属或闪杆菌属。例如,所述微生物可以属于甲基杆菌属,例如扭脱甲基杆菌。
在一些实施例中,所述培养条件包括一种或多种醇作为碳源用于制造所述生物质,例如但不限于甲醇、乙醇、甘油或其组合。
在一些实施例中,所述培养条件包括作为碳源的一种或多种醇和另外的一种或多种有机酸,例如但不限于甲酸酯、乙酸酯、丙酸酯、甘油酸酯、苹果酸酯、琥珀酸酯或其组合。
在一些实施例中,所述培养条件包括培养基通气。例如,培养基通气可以在培养基中产生约5%至约50%的溶解氧。
在一些实施例中,所述培养条件包括约20℃至约50℃的温度。
在一些实施例中,所述培养条件包括当培养物在600nm下测量的光学密度达到约50至约200时,移除所述培养基的约1O%至约90%部分,随后用等量的新鲜培养基更换,由此将PHA制造维持在相对恒定的水平。
在一些实施例中,所述培养条件包括连续移除培养基和微生物以及连续补充新鲜培养基。
在一些实施例中,所述微生物经历基因修饰或人工预选,以制造出相对于相应未修饰或未经选择的微生物升高水平的一种或多种类胡萝卜素化合物。例如,所述一种或多种类胡萝卜素化合物可以包括但不限于β-胡萝卜素、番茄红素、视紫质、玉米黄素、叶黄素、角黄素、绿蝇黄质、海胆酮、隐黄质、虾青素、金盏花黄质、3-羟基海胆酮和/或紫菌红醚。在一些实施例中,使经历基因修饰或人工预选以制造升高水平的一种或多种类胡萝卜素化合物的微生物生长的培养条件包括一种或多种醇作为碳源,例如但不限于甲醇、乙醇、甘油或其组合。在一些实施例中,所述培养条件包括作为碳源的一种或多种醇和另外的一种或多种有机酸,例如但不限于甲酸酯、乙酸酯、丙酸酯、甘油酸酯、苹果酸酯、琥珀酸酯或其组合。
在一些实施例中,所述方法中制造的PHA是在所述微生物中的一个或多个细胞内颗粒中。
在一些实施例中,所述微生物是非天然存在的微生物,其制造出以重量计比作为所述非天然存在的微生物来源的亲本微生物低约99.9%至约1%的聚羟基烷酸酯(PHA)产物和以重量计比所述亲本微生物高约1%至约250%的蛋白质。
在所述方法的一些实施例中,所述微生物是一种非天然存在的微生物,其包括一个或多个内源性PHA生物合成基因、PHA降解基因和/或PHA颗粒结合蛋白基因中的突变,使得PHA的制造减少或增加和/或产生聚合物长度分布改变的PHA。
在一些实施例中,所述非天然存在的微生物制造出聚合物大小长度分布改变的PHA聚合物。
在一些实施例中,所述非天然存在的微生物含有增加量的固有或异源PHA降解酶。
在一些实施例中,固有或异源PHA降解酶制造增加的非天然存在的微生物是饲料或营养补充剂的一种组分。
在一些实施例中,在饲料或营养补充剂内的非天然存在的微生物由于固有或异源PHA降解酶制造增加而保持额外的PHB降解活性。
另一方面,提供了一种饲料或营养补充组合物,其包括在如本文中所描述的方法中制造的生物质。
另一方面,提供了一种用于提高家畜、海产食品或水产养殖动物的生存力的方法,其包括向所述动物投喂包括在如本文所描述的方法中制造的生物质的饲料组合物,并且其中生存力相较于不包括PHA的饲料组合物增加至少约1%。在一些实施例中,所述PHA是PHB。在一些实施例中,所述饲料组合物包括多种微生物,其中所述多种微生物各自以不同水平制造PHA和蛋白质,并且其中所述微生物的组合提供所述组合物中重量比是约1∶1000至约3∶1、或约1∶1000至约1∶6的PHA和蛋白质。
附图说明
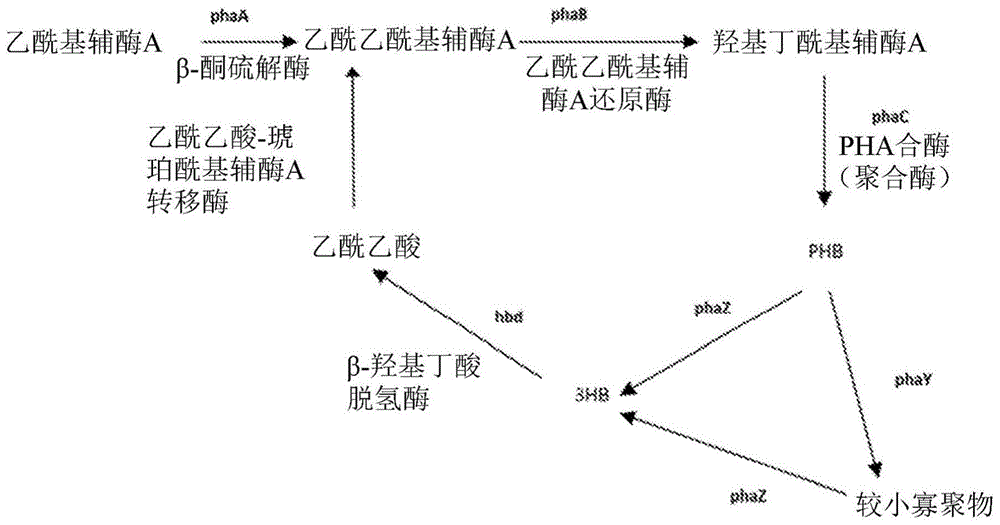
图1显示了PHA生物合成和降解路径的一个实施例的示意图。
图2A-2B显示了如实例1中所描述,PHA颗粒结合蛋白缺失对PHB制造的影响的结果。
图3显示了如实例2中所描述,通气水平对PHB制造的影响的结果。
图4A-4B显示了如实例2中所描述,温度对PHB制造的影响的结果。
图5显示了实例2中所描述的充排式(fill and draw)实验的结果。
图6A-6B显示了如实例2中所描述,细胞中PHB水平与蛋白质含量的相关性。
图7显示了如实例3中所描述,用含和不含PHB的饮食的虾的生存力。
图8显示了如实例2中所描述,甲醇-乙醇碳源对PHB制造水平影响的结果。
图9显示了如实例4中所描述,增加乙醇浓度对PHB制造的影响的结果。
图10A-10D显示了如实例5中所描述,由折射率检测器(RFID)得到的从细胞提取的PHB的凝胶渗透色谱法(GPC)迹线。
具体实施方式
本发明提供了微生物和培养微生物以制造具有有利于包括在饲料和营养组合物中的PHA(例如PHB)和蛋白质水平的生物质的方法。通过用遗传学方法或用发酵方法减少PHA制造,生物质中可以富集约40%至约70%或更高百分比的蛋白质含量。此外,还可以减小平均PHA聚合物长度以增加生物利用率。
定义
除非本文中另外定义,否则本文中所使用的所有技术和科学术语都具有与本发明所属领域的一般技术人员通常所理解相同的含义。Singleton等人,《微生物学与分子生物学词典(Dictionarv of Microbiologv and Molecular Biology)》,第二版,John Wiley and Sons,纽约(New York)(1994);以及Hale和Markham,《哈珀柯林斯生物学词典(The Harper Collins Dictionarv of Biology)》.Harper Perennial,纽约(NY)(1991)向技术人员提供了本发明中使用的许多术语的通用词典。与本文中所描述的方法和材料类似或等效的任何方法和材料均可用于实践或测试本发明。
除非另外指明,否则本发明的实践将采用在本领域技术范围内的分子生物学(包括重组技术)、微生物学、细胞生物学和生物化学的常规技术。以下文献中充分地说明了这些技术,例如:《分子克降实验指南(Molecular Cloning:ALaboratorv Manual)》,第二版(Sambrook等人,1989);《寡核苷酸合成(Oligonucleotide Synthesis)》(M,J,Gait编,1984:《现代分子生物学实验技术(Current Protocols in Molecular Biology)》(F.M.Ausubel等人编,1994);《PCR:聚合酶链反应(PCR:The Polymerase Chain Reaction)》(Mullis等人编,1994);以及《基因转移和表达实验指南(Gene Transfer and Expression:A Laboratory Manual)》(Kriegler,1990)。
本文中所提供的数字范围包括界定该范围的数字在内。
除非另外指明,否则核酸是从左向右沿5′至3′取向书写;氨基酸序列分别从左向右沿氨基至羧基取向书写。
除非上下文另外明确规定,否则“一个(种)(a/an)”和“所述”包括多个(种)指示物。
如本文所使用,术语“多核苷酸”是指具有任何长度和任何三维结构且呈单链或多链(例如单链、双链、三重螺旋等)的聚合形式的核苷酸,其含有脱氧核糖核苷酸、核糖核苷酸和/或脱氧核糖核苷酸或核糖核苷酸的类似物或修饰形式,包括修饰过的核苷酸或碱基或其类似物。由于遗传密码具有简并性,故可以使用超过一个密码子编码一种特定氨基酸,并且本发明涵盖编码特定氨基酸序列的多核苷酸。只要多核苷酸在使用条件下保持所希望的功能,就可以使用任何类型的修饰过的核苷酸或核苷酸类似物,包括增加核酸酶抗性的修饰(例如脱氧、2′-O-Me、硫代磷酸酯等)。出于检测或捕捉的目的,还可以并入标记,例如放射性或非放射性标记或锚,例如生物素。术语多核苷酸还包括肽核酸(PNA)。多核苷酸可以是天然存在的或非天然存在的。术语“多核苷酸”、“核酸”和“寡核苷酸”在本文中可互换使用。多核苷酸可以含有RNA、DNA或两者,和/或其修饰形式和/或类似物。核苷酸序列可以间杂有非核苷酸组分。一个或多个磷酸二酯键可被替代性连接基团置换。这些替代性连接基团包括但不限于磷酸酯被P(O)S(“硫代酸酯”)、P(S)S(“二硫代酸酯”)、(O)NR2(“酰胺化物”)、P(O)R、P(O)OR′、CO或CH2(“甲缩醛”)置换的实施例,其中各R或R′独立地是H或被取代或未被取代的烷基(1-20个C),其任选地含有醚(--O--)键、芳基、烯基、环烷基、环烯基或芳醛基。多核苷酸中的所有键不必都相同。多核苷酸可以是线性或环状的,或包含线性部分和环状部分的组合。
如本文所使用,“多肽”是指由氨基酸构成并且被本领域的技术人员视为蛋白质的组合物。在本文中使用氨基酸残基的常规单字母或三字母代码。术语“多肽”和“蛋白质”在本文中可互换地使用,意思指任何长度的氨基酸的聚合物。所述聚合物可以是线性或分支的,其可以包含修饰过的氨基酸,并且其可以间杂有非氨基酸。这些术语还涵盖天然修饰或通过介入;例如二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它操纵或修饰,如与标记组分缀合来修饰的氨基酸聚合物。所述定义内还包括例如含有一种或多种氨基酸类似物(包括例如非天然氨基酸等)以及本领域中已知的其它修饰的多肽。
如本文所使用,“载体”是指被设计成用于将核酸引入一种或多种细胞类型中的多核苷酸序列。载体包括克隆载体、表达载体、穿梭载体、质粒、噬菌体粒子、盒(cassette)等。
如本文所使用,术语“表达”是指基于基因的核酸序列产生多肽的过程。所述过程包括转录与翻译两者。
如本文所使用,“表达载体”是指含有DNA编码序列(例如基因序列)的DNA构建体,所述DNA编码序列可操作地连接至一个或多个能够实现所述编码序列在宿主中的表达的适合控制序列。所述控制序列包括实现转录的启动子、控制所述转录的任选的操纵子序列、编码适合mRNA核糖体结合位点的序列以及控制转录与翻译终止的序列。载体可以是质粒、噬菌体粒子或仅仅是潜在基因组插入物。在载体转化至适合宿主中后,其可以独立于宿主基因组复制和起作用,或在一些情况下,其可以整合至基因组本身中。质粒是表达载体的最常用形式。然而,本发明意欲包括提供等效功能并且是本领域中已知或变得已知的表达载体的此类其它形式。
“启动子”是指涉及结合RNA聚合酶以起始基因转录的调控序列。启动子可以是诱导型启动子或组成型启动子。“诱导型启动子”是在环境或发育调控条件下具有活性的启动子。
术语“可操作地连接”指的是指定元件的并接或布置,其允许所述指定元件协调地执行以发挥作用。例如,如果启动子控制编码序列的转录,则所述启动子是可操作地连接至所述编码序列。
“在转录控制下”是本领域中充分理解的术语,指示多核苷酸序列的转录取决于其可操作地连接至有助于转录起始或促进转录的元件。
“在翻译控制下”是本领域中充分理解的术语,指示在形成了mRNA之后发生的调控过程。
“基因”是指多肽制造中所涉及的DNA区段且包括在编码区之前和之后的区域以及在个别编码区段(外显子)之间的插入序列(内含子)。
如本文所使用,术语“宿主细胞”是指可以被用于制造多肽的重组表达载体转染以表达所述多肽的细胞或细胞系。宿主细胞包括单一宿主细胞的子代,并且子代可能由于天然、偶然或故意的突变而未必与原始亲本细胞完全相同(在形态或总基因组DNA互补序列方面)。宿主细胞包括在体内被表达载体转染或转化的细胞。
术语“重组”是指经过修饰以改变序列或表达特征的遗传物质(即,核酸、其编码多肽以及包含此类多核苷酸的载体和细胞),所述修饰是如通过使编码序列突变以产生改变的多肽;使编码序列与另一基因的编码序列融合;使基因处于不同启动子控制下;在异源生物体中表达基因;以降低或升高的水平表达基因;以不同于天然表达谱的方式有条件地或组成性表达基因等。一般来说,重组核酸、多肽和基于其的细胞已经历人工操纵,使得其与自然界中所发现的相关核酸、多肽和细胞不相同。
“信号序列”是指结合至蛋白质N末端部分的氨基酸序列,其有助于所述蛋白质的成熟形式从细胞分泌。成熟形式的细胞外蛋白质不含信号序列,所述信号序列在分泌过程期间裂解。
术语“选择性标记物”或“可选择标记物”是指能够在宿主细胞中表达以便能容易地选择含有引入的核酸或载体的宿主的基因。可选择标记物的实例包括但不限于赋予宿主细胞代谢优势如营养优势的抗微生物物质(例如潮霉素(hygromycin)、博莱霉素(bleomycin)、卡那霉素(kanamycin)或氯霉素(chloramphenicol))和/或基因。
术语“衍生自”涵盖术语“源自”、“自……获得”、“自……可获得”、“自……分离”和“自……产生”,并且一般指示一种指定材料在另一种指定材料中发现其来源或具有可以参照另一种指定材料描述的特征。
术语“培养”是指使细胞群,例如微生物细胞群在适合生长的条件下,在液体或固体培养基中生长。
关于多核苷酸或蛋白质的术语“异源”或“外源”是指并非天然地存在于指定细胞,例如宿主细胞中的多核苷酸或蛋白质。预期所述术语涵盖由天然存在的基因、突变的基因和/或合成基因编码的蛋白质。相比之下,关于多核苷酸或蛋白质的术语“同源”是指天然存在于细胞中的多核苷酸或蛋白质。
在将核酸序列插入细胞中的情形中,术语“引入”包括“转染”、“转化”或“转导”并且是指将核酸序列并入真核或原核细胞中,在所述真核或原核细胞中,核酸序列可被并入细胞的基因组(例如染色体、质粒、质体或线粒体DNA)中,转化成自主复制子,或短暂地表达。
“转染”或“转化”是指将外源多核苷酸插入宿主细胞中。外源多核苷酸可以维持未整合的载体形式,例如质粒,或者可以整合至宿主细胞基因组中。术语转染(transfecting/transfection)意图涵盖用于将核酸引入宿主细胞中的所有常规技术。转染技术的实例包括但不限于磷酸钙沉淀、DEAE-葡聚糖介导的转染、脂转染、电穿孔以及显微注射。
如本文所使用,术语“转化”、“稳定地转化”和“转基因的”是指细胞具有非天然(例如异源)核酸序列整合至其基因组中或作为游离型质粒维持多次传代。
如本文所使用,术语“回收”、“分离”、“纯化”和“分开”是指将一种材料(例如蛋白质、核酸或细胞)从与其天然地相关联的至少一种组分移开。例如,这些术语可以指一种材料大体上或基本上不含如在其天然状态如完整生物系统中所发现的通常与其一起存在的组分。
“信号序列”(又称为“前序列”、“信号肽”、“前导序列”或“前导肽”)是指在新生多肽的氨基末端处的氨基酸序列,该氨基酸序列使所述多肽靶向分泌路径,并且在转位于内质网膜中后从所述新生多肽裂解。
相关(和衍生物)蛋白质涵盖“变体”蛋白质。变体蛋白质与亲本蛋白质和/或彼此间会有少量氨基酸残基不同。在一些实施例中,不同氨基酸残基的数目是约1、2、3、4、5、10、20、25、30、35、40、45或50个中的任一个。在一些实施例中,变体有约1至约10个氨基酸不同。替代地或另外,如例如使用序列比对工具,如BLAST、ALIGN和CLUSTAL所测定,变体可以与参考蛋白质或核酸具有指定的序列一致性程度(参看下文)。例如,变体蛋白质或核酸可以与参考序列具有至少约30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或甚至99.5%氨基酸序列同一性。
如本文所使用,术语“类似序列”是指蛋白质内提供与参考蛋白质类似的功能、三级结构和/或保守残基的多肽序列。例如,在含有α螺旋或β折叠结构的表位区域中,类似序列中的替代氨基酸维持相同结构元件。在一些实施例中,提供了使变体酶展现相对于得到所述变体的亲本蛋白质类似或改善的功能的类似序列。
如本文所使用,“同源蛋白质”是指与参考蛋白质具有类似功能和/或结构的蛋白质。同源物可以来自进化相关或不相关的物种。在一些实施例中,同源物具有与参考蛋白质类似的四级、三级和/或一级结构,由此潜在地允许用来自同源物的类似区段或片段替代参考蛋白质中的区段或片段,且对参考蛋白质的结构和/或功能的破坏相较于用来自非同源蛋白质的序列替代所述区段或片段的情形减少。
如本文所使用,“野生型”、“天然”和“天然存在的”蛋白质是在自然界中发现的那些蛋白质。术语“野生型序列”是指自然界中可发现或天然存在的氨基酸或核酸序列。在一些实施例中,野生型序列是蛋白质工程改造计划,例如制造变体蛋白质的起点。
在至少两个核酸或多肽的情形中,短语“大体上类似”和“大体上一致”典型地是指,多核苷酸、多肽或者多肽的区域或结构域包含的序列相较于参考(例如野生型)多核苷酸、多肽或者多肽的区域或结构域具有至少约30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或甚至99.5%序列一致性。多肽的区域或结构域可以含有例如较长多肽序列内的至少约20、50、100或200个氨基酸。序列一致性可以使用已知程序如BLAST、ALIGN和CLUSTAL,使用标准参数测定。(参见例如Altshul等人(1990)《分子生物学杂志(J.Mol.Biol.)》215:403-410;Henikoff等人(1989)《美国国家科学院院刊(Proc.Natl.Acad.Sci.)》89:10915;Karin等人(1993)《美国国家科学院院刊》90:5873;和Higgins等人(1988)《基因(Gene)》73:237)。用于进行BLAST分析的软件通过美国国家生物技术信息中心(National Center for Biotechnology Information)公开可得。此外,还可以使用FASTA搜索数据库(Person等人(1988)《美国国家科学院院刊》85:2444-2448)。在一些实施例中,大体上一致的多肽的不同之处仅在于一个或多个保守氨基酸取代。在一些实施例中,大体上一致的多肽具有免疫交叉反应性。在一些实施例中,大体上一致的核酸分子在严格条件下(例如在中等至高严格度范围内)彼此杂交。
术语“类胡萝卜素”在本领域中应理解为是指衍生自类异戊二烯路径中间物的结构不同的类别的色素。类胡萝卜素生物合成中的定型步骤是由香叶基香叶基焦磷酸形成八氢番茄红素。类胡萝卜素可以是非环状或环状的,并且可以含有或可不含有氧,由此术语类胡萝卜素包括胡萝卜素和叶黄素两者。一般来说,类胡萝卜素是具有形式上衍生自五碳化合物IPP的共轭多烯碳骨架的烃类化合物,包括三萜(C30二脱辅基类胡萝卜素(diapocarotenoid))和四萜(C40类胡萝卜素)以及其氧化衍生物,和具有例如C35、C50、C60、C70、C80长度或其它长度的其它化合物。许多类胡萝卜素具有较强的光吸收特性,并且其长度范围可超过典型地由六个类异戊二烯单元组成的C200-C30二脱辅基类胡萝卜素,所述六个类异戊二烯单元的接合方式使得类异戊二烯单元的布置在所述分子中心处倒转,以使两个中心甲基处于1,6-位置关系,且其余非末端甲基处于1,5-位置关系。这种C30类胡萝卜素可以在形式上衍生自非环状C30H42结构,具有由共轭双键构成的较长中心链,是通过以下方式获得:(i)氢化、(ii)脱氢、(iii)环化、(iv)氧化、(v)酯化/糖基化,或这些方法的任何组合。C40类胡萝卜素典型地由八个类异戊二烯单元组成,所述类异戊二烯单元的接合方式是使得类异戊二烯单元的布置在分子中心处倒转,以使两个中心甲基处于1,6-位置关系,且其余非末端甲基处于1,5-位置关系。这种C40类胡萝卜素可以在形式上衍生自非环状C40H56结构,具有由共轭双键构成的较长中心链,是通过以下方式获得:(i)氢化、(ii)脱氢、(iii)环化、(iv)氧化、(v)酯化/糖基化,或这些方法的任何组合。C40类胡萝卜素的类别还包括由碳骨架重排或通过(形式上)移除此结构的一部分而产生的某些化合物。在自然界中已经鉴别出超过600种不同的类胡萝卜素。类胡萝卜素包括但不限于:环氧玉米黄质、金盏花红素、金盏花黄质、虾青素、角黄素、辣椒玉红素(capsorubrin)、β-隐黄质、α-胡萝卜素、β-胡萝卜素、β,ψ-胡萝卜素、δ-胡萝卜素、ε-胡萝卜素、海胆酮(echinenone)、3-羟基海胆酮、3′-羟基海胆酮、γ-胡萝卜素、ψ-胡萝卜素、4-酮基-Y-胡萝卜素、ζ-胡萝卜素、a-隐黄质、脱氧屈曲黄素(deoxyflexixanthin)、硅藻黄素(diatoxanthin)、7,8-二脱氢虾青素、二脱氢番茄红素、岩藻黄质、岩藻黄质醇(fucoxanthinol)、异海绵烯(isorenieratene)、β-异海绵烯、莴苣黄素(lactucaxanthin)、叶黄素、番茄红素、粘菌酮(myxobactone)、新黄质(neoxanthin)、链孢红素(neurosporene)、羟基链孢红素、多甲藻素、八氢番茄红素、视紫红质(rhodopin)、视紫红质葡糖苷、4-酮基-玉红黄质、管藻黄质、球形烯(spheroidene)、球形烯酮(spheroidenone)、螺菌黄素、红酵母烯(torulene)、4-酮基-红酵母烯、3-羟基-4-酮基-红酵母烯、尿酸酯(uriolide)、尿酸乙酸酯(uriolide acetate)、紫黄素(violaxanthin)、玉米黄素-β-二糖苷、玉米黄素以及C30类胡萝卜素。此外,类胡萝卜素化合物包括这些分子的衍生物,其可包括羟基、甲氧基、氧代、环氧基、羧基或醛官能团。另外,所包括的类胡萝卜素化合物包括酯(例如糖苷酯、脂肪酸酯)和硫酸酯衍生物(例如酯化叶黄素)。
“类异戊二烯路径”在本领域中应理解为是指制造或利用五碳代谢物焦磷酸异戊酯(IPP)的代谢路径。如本文所论述,有两个不同的路径可制造出共同的类异戊二烯前体IPP,即“甲羟戊酸路径”和“非甲羟戊酸路径”。术语“类异戊二烯路径”一般足以涵盖这些类型的路径。由IPP生物合成类异戊二烯是通过若干五碳异戊二烯亚单元的聚合发生。衍生自IPP的类异戊二烯代谢物的化学结构变化极大,包括环状和非环状分子两种。类异戊二烯代谢物包括但不限于单萜、倍半萜、二萜、固醇和多萜醇如类胡萝卜素。
术语“类异戊二烯化合物”是指通过以焦磷酸异戊烯酯(IPP)开始的路径得到的任何化合物,并且其是通过长度可为5、10、15、20、30或40个碳的异戊二烯单元头尾缩合形成。此处,术语“类异戊二烯色素”是指典型地具有较强光吸收特性的一类异戊二烯化合物。
术语“饲料预混合物”是指在加工之前,任选地在高温下将水产养殖饲料或动物/宠物食品组分混合至呈团粒或薄片形式的水产养殖饲料或动物或宠物食品组合物中的粗混合物。
水产养殖饲料组合物被用于制造“水产养殖产品”,其中所述产品是通常销售用于人消费的可收获的水产养殖的物种(例如有鳍鱼类、甲壳动物)。例如,鲑鱼在水产养殖中大量地生产且因此是水产养殖产品。水产养殖组合物还可用作水产养殖饲料生物体,例如小鱼,如磷虾、轮虫等的饲料,这些生物体是较大水产养殖生物体如食肉鱼类的食物源。此外,本文中所描述的水产养殖组合物可用作不打算作为其它生物体的食物的观赏鱼类、虾、养鱼者水产养殖等的饲料。
术语“水产养殖肉类产品”是指意图用于人消费的食物产品,其包括来自如上文所定义的水产养殖产品的至少一部分肉。水产养殖肉类产品可以是例如整条鱼或从鱼切下来的鱼片,其各自可作为食物消费。在一些实施例中,这种产品可被称作鱼类或海鲜产品。
术语“生物质”是指微生物细胞材料。生物质可以天然地制造,或可以由天然宿主或重组生产宿主发酵来制造。生物质可以呈完整细胞、全细胞溶解产物、均质化细胞、部分水解的细胞材料和/或部分纯化的细胞材料(例如微生物产生的油)的形式。
术语“加工过的生物质”是指已经历额外加工如干燥、巴氏灭菌(pasteurization)、破坏等的生物质,这些加工分别在下文更详细地论述。
术语“C-1碳基质”是指缺少碳-碳键的任何含碳分子。实例是甲烷、甲醇、甲醛、甲酸、甲酸酯、甲基化胺(例如单甲基胺、二甲基胺和三甲基胺)、甲基化硫醇和二氧化碳。
术语“C1代谢者(metabolizer)”是指能够使用单碳基质作为能量和生物质的唯一来源的微生物。C1代谢者典型地是能够生长的甲基营养菌和/或甲烷营养菌。
术语“甲基营养菌”意思指能够氧化不含碳-碳键的有机化合物的生物体。在甲基营养菌能够氧化CH4的情况下,所述甲基营养菌也是甲烷营养菌。
术语“甲烷营养菌”是指能够利用甲烷作为基质的原核生物。甲烷完全氧化成二氧化碳是通过需氧降解路径发生。可用于本发明中的甲烷营养菌的典型实例包括但不限于甲基单胞菌属、甲基杆菌属、甲基球菌属和甲基弯曲菌属。
术语“高生长甲烷营养细菌菌株”是指能够使用甲烷作为其唯一的碳和能量来源生长的细菌。
术语“PHA颗粒结合蛋白”是指通过结合至颗粒并增加所述颗粒的表面/体积比增进PHA制造的蛋白质,或通过与PHA合酶直接相互作用活化PHA合成速率或通过防止与其它细胞蛋白质结合至PHA颗粒有关的生长缺陷间接地促进PHA合成的蛋白质。(参见例如York等人(2001)《细菌学杂志(JBacteriol)》183(7):2394-97)
“生存力”是指引起存活或促进存活。例如,相对于另一饲料或营养补充剂,增加生存力的饲料产品或补充剂将增加收获的鱼类、无脊椎动物或其它动物的数目。
术语“溶解氧”(“DO”)是指易于供呼吸生物体使用的溶解于水中的游离氧的量。“溶解氧%”(“DO%”)是指以空气饱和百分比计的氧,并且与例如溶解氧的介质的温度、压力和盐度相关。DO%测量值=O2 mg/L/(在温度和盐度下的DO值)。DO%是基于在给定温度下的最大氧量的相对术语。例如,在较高温度下,例如50%DO的溶解氧的实际量会变少。
“连续”发酵或“分批馈料”是指将基质连续地添加至发酵罐中,同时以平稳速率移出产物和残留物的一种稳态发酵系统。
“半连续”或“充排式(fill and draw)”发酵是指通过定期地排出培养基并补充新鲜培养基使细胞在培养物中维持活跃地分裂状态的发酵过程。
“凝胶渗透色谱法”或“尺寸排阻色谱法”(SEC)是指基于大小分离分子的色谱方法。由于较大分子被排阻且不会渗透色谱基质中的孔,使得较大分子比较小分子更快地洗脱。通过使用包含分子量已知的多种组分的标准物,可以确定样品中分子的平均分子量和相对分布。针对分散聚合物样品存在若干分子质量测定,包括数量平均分子量(Mn)、重量平均分子量(Mw)、峰位分子量(Mp)和Z均分子量(Mz)。此外,多分散指数(PD)被用作聚合物分子量分布的宽度的量度。PD较小的聚合物的分子量更接近平均值。PD等于Mw除以Mn。
“改变的聚合物大小长度分布”是指聚合物的平均分子质量(Mw、Mn、Mp、Mz)或分布(PD)不同于比较菌株,例如野生型菌株。例如,引入将PHA聚合物裂解成较小寡聚物的酶将使Mw、Mn、Mp和Mz相较于原始亲本菌株减小。除非完全裂解,否则所得较小寡聚物也会增加多分散指数。
“具有减小的平均分子量的聚合物”是指如通过GPC,使用本领域中通常测定的分子量大小标准品所测量,具有减小的Mw、Mn、Mp或Mz的聚合物。
“可消化性”是指聚合物在酶、热或化学手段作用下降解成较小寡聚物或个别聚合物亚单元的能力。
微生物
非天然存在的微生物
在一些实施例中,提供了非天然存在的微生物,相较于作为所述非天然存在的微生物来源的亲本微生物,所述非天然存在的微生物以降低或升高的水平制造PHA(例如PHB)。亲本微生物可以是野生型微生物(即,在自然界中发现的微生物)或可以是非天然存在的突变型或基因工程改造(例如重组)的微生物。
在一些实施例中,本文中的非天然存在的微生物可以制造出比作为所述非天然存在的微生物来源的亲本微生物低约1%至约99.9%的PHA(例如PHB)和比所述亲本微生物高约1%至约250%的蛋白质。例如,本文中的非天然存在的微生物可以制造出比作为所述非天然存在的微生物来源的亲本微生物低约1%至约5%、约5%至约10%、约10%至约20%、约20%至约30%、约30%至约40%、约40%至约50%、约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约95%或约95%至约99.5%中的任一百分比的PHA(例如PHB),和比所述亲本微生物高约1%至约5%、约5%至约10%、约10%至约20%、约20%至约30%、约30%至约40%、约40%至约50%、约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、约100%至约110%、约110%至约120%、约120%至约130%、约130%至约140%、约140%至约150%、约150%至约160%、约160%至约170%、约170%至约180%、约180%至约190%、约190%至约200%、约200%至约210%、约210%至约220%、约220%至约230%、约230%至约240%或约240%至约250%中的任一百分比的蛋白质。
在一些实施例中,本文中的非天然存在的微生物可以制造出比作为所述非天然存在的微生物来源的亲本微生物高约100%至约300%的PHA(例如PHB)和比所述亲本微生物高约1%至约250%的蛋白质。例如,本文中的非天然存在的微生物可以产生比作为所述非天然存在的微生物来源的亲本微生物高约100%至约125%、约125%至约150%、约150%至约175%、约175%至约200%、约200%至约225%、约225%至约250%或约250%至约300%中的任一百分比的PHA(例如PHB),和比所述亲本微生物高约1%至约5%、约5%至约10%、约10%至约20%、约20%至约30%、约30%至约40%、约40%至约50%、约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约90%至约100%、约100%至约110%、约110%至约120%、约120%至约130%、约130%至约140%、约140%至约150%、约150%至约160%、约160%至约170%、约170%至约180%、约180%至约190%、约190%至约200%、约200%至约210%、约210%至约220%、约220%至约230%、约230%至约240%或约240%至约250%中的任一百分比的蛋白质。
本文中的非天然存在的微生物包括例如当在适于微生物生长和PHA(例如PHB)制造的条件下培养时制造出PHA的细菌、酵母、古细菌。在一些实施例中,所述微生物制造出以干细胞重量(dcw)计约0.1重量%至约50重量%的PHA,和每单位dcw约35%至约70%或更高百分比、约60%至约70%或约65%的蛋白质。例如,本文中的非天然存在的微生物可以制造每单位dcw约0.1%至约0.5%、约0.5%至约1%、约1%至约5%、约5%至约10%、约10%至约15%、约15%至约20%、约20%至约25%、约25%至约30%、约30%至约35%、约35%至约40%、约40%至约45%或约45%至约50%中的任一百分比的PHA(例如PHB),和约35%至约40%、约40%至约45%、约45%至约50%、约50%至约55%、约55%至约60%、约60%至约65%、约65%至约70%或大于约70%中的任一百分比的蛋白质。
在一些实施例中,所述非天然存在的微生物制造出PHA:蛋白质重量比是约1∶1000至约3∶1、约1∶1000至约1∶6、约1∶1至约2∶1、约1∶1至约3∶1、或约2∶1至约3∶1的PHA(例如PHB)和蛋白质。在一些实施例中,PHA:蛋白质比率是约1∶1000至约1∶500、约1∶500至约1∶100、约1∶100至约1∶50、约1∶50至约1∶10、约1∶10至约1∶6、约1∶6至约1∶2、或约1∶2至约1∶1。在一些实施例中,在本文所描述的任何PHA:蛋白质比率下,所述微生物可以制造出每单位dcw约35%至约70%或更高百分比、约60%至约70%或约65%的蛋白质,或约35%至约40%、约40%至约45%、约45%至约50%、约50%至约55%、约55%至约60%、约60%至约65%、约65%至约70%或大于约70%中的任一百分比的蛋白质。
在一些实施例中,本文中的非天然存在的微生物可以制造出平均分子量减小(Mw、Mn、Mp或Mz)、多分散性增加或可消化性增加的PHA聚合物。
由如本文中所描述的非天然存在的微生物制造的PHA(例如PHB)可以包含在细胞中的一个或多个细胞内颗粒中。
可以得到所述非天然存在的微生物的属的非限制性实例包括甲基单胞菌属、甲基杆菌属、甲基球菌属、甲基弯曲菌属、甲基孢囊菌属、甲基微菌属、甲烷单胞菌属、嗜甲基菌属、甲基芽孢杆菌属、甲基杆菌属、生丝微菌属、黄色杆菌属、芽孢杆菌属、副球菌属、诺卡菌属、节杆菌属、红假单胞菌属、假单胞菌属、念珠菌属、汉森酵母属、毕赤酵母属、球拟酵母属、弧菌属、埃希氏菌属、产碱杆菌属、罗尔斯通氏菌属、红细菌属、酵母属、贪铜菌属、中华根瘤菌属、白霉菌属、短根瘤菌属、耶氏酵母属、固氮菌属、集胞藻属、红酵母属、气单胞菌属、磁螺菌属、富盐菌属、显核菌属及闪杆菌属。
可以得到所述非天然存在的微生物的微生物物种的非限制性实例包括扭脱甲基杆菌(例如菌株AM1、DM4、CM4、PA1、DSMZ 1340)、杨树甲基杆菌(Methylobacterium populi)(BJ001)、耐辐射甲基杆菌(Methylobacterium radiotolerans)、结瘤甲基杆菌(Methylobacterium nodulans)、甲基杆菌4-46和其它甲基杆菌物种。
在一些实施例中,所述非天然存在的微生物是甲基营养细菌。
在一些实施例中,所述非天然存在的微生物被修饰成利用一种或多种醇作为碳源,包括但不限于甲醇、乙醇、丙醇和/或甘油。
在一些实施例中,所述非天然存在的微生物或作为所述非天然存在的微生物来源的亲本微生物经历基因修饰或人工预选,以制造相对于相应未修饰或未经选择的微生物升高水平的一种或多种类胡萝卜素化合物。所述一种或多种类胡萝卜素化合物可以包括但不限于β-胡萝卜素、番茄红素、玉米黄素、视紫质、玉米黄素、叶黄素、角黄素、绿蝇黄质、海胆酮、隐黄质、虾青素、金盏花黄质、3-羟基海胆酮和/或紫菌红醚。WO2015/021352 A2中提供了制造升高水平的一种或多种类胡萝卜素化合物的宿主细胞和用于制造这种微生物的方法的非限制性实例。
在一些实施例中,作为如本文中所描述的非天然存在的微生物来源的亲本微生物含有基因celA和/或类胡萝卜素基因(crtC、crtD和crtF)缺失。
本文中的非天然存在的微生物可以包括一种或多种突变,例如一个或多个PHA生物合成基因和/或一种或多种PHA颗粒结合蛋白中的突变。
在一些实施例中,所述微生物可以包括一个或多个内源性PHA生物合成基因,如但不限于phaA、phaB、hbd、phaY、phaC和/或phaZ,或其外部调控序列(即,启动子序列)中的突变。所述突变可以包括一个或多个PHA生物合成基因的缺失、一个或多个PHA生物合成基因的表达减少(例如由调控序列改变引起)或由所述生物合成基因编码的酶的酶活性降低,导致PHA(例如PHB)制造减少。在各种实施例中,通过降低PHA生物合成酶活性;通过缺失或修饰基因以降低PHA生物合成酶的转录、翻译或转录物稳定性;或通过增加(或引入)PHA降解酶的转录、翻译或转录物稳定性将使PHA(例如PHB)减少。
在一些实施例中,所述微生物可以包括使PHA(例如PHB)制造增加的突变。例如,可以对一个或多个PHA生物合成基因的调控序列进行修饰。在一些实施例中,突变使表达增加,或使PHA生物合成酶的转录、翻译或转录物稳定性增加,或使PHA降解酶的转录、翻译、转录物稳定性或活性降低。在一些实施例中,编码序列中的突变使一种或多种PHA生物合成酶的活性增加或使一种或多种PHA降解酶的活性降低。在一些实施例中,可以将外源PHA生物合成基因添加至所述微生物中,以引入所述生物体不具有的PHA生物合成活性,或增加内源性PHA生物合成基因的拷贝数。
在一些实施例中,所述微生物包括phaA多核苷酸序列、或SEQ ID NO:1中所描绘的多核苷酸序列的表达调控序列、或与SEQ ID NO:1具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸的突变,例如缺失所述多核苷酸序列的至少一部分、减少所述多核苷酸序列的表达和/或降低由所述多核苷酸所编码的β-酮硫解酶的酶活性。在一些实施例中,所述微生物包括编码β-酮硫解酶氨基酸序列,例如SEQ ID NO:2中所描绘的氨基酸序列或与SEQ ID NO:2具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持β-酮硫解酶的酶活性的氨基酸序列的多核苷酸的突变。
在一些实施例中,所述微生物包括phaB多核苷酸序列、或SEQ ID NO:3中所描绘的多核苷酸序列的表达调控序列、或与SEQ ID NO:3具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸的突变,例如缺失所述多核苷酸序列的至少一部分、减少所述多核苷酸序列的表达和/或降低由所述多核苷酸所编码的乙酰乙酰辅酶A还原酶的酶活性。在一些实施例中,所述微生物包括编码乙酰乙酰辅酶A还原酶氨基酸序列,例如SEQ ID NO:4中所描绘的氨基酸序列或与SEQ ID NO:4具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持乙酰乙酰辅酶A还原酶活性的氨基酸序列的多核苷酸的突变。
在一些实施例中,所述微生物包括phaC多核苷酸序列、或SEQ ID NO:5中所描绘的多核苷酸序列的表达调控序列、或与SEQ ID NO:5具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸的突变,例如缺失所述多核苷酸序列的至少一部分、减少所述多核苷酸序列的表达和/或降低由所述多核苷酸所编码的PHA合酶(聚合酶)的酶活性。在一些实施例中,所述微生物包括编码PHA合酶(聚合酶)氨基酸序列,例如SEQ ID NO:6中所描绘的氨基酸序列或与SEQ ID NO:6具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持PHA合酶(聚合酶)的酶活性的氨基酸序列的多核苷酸的突变。
在一些实施例中,所述微生物可以包括一个或多个PHA颗粒结合蛋白基因,如但不限于Mext_2223、Mext_2560和/或Mext_0493中的突变。所述突变可以包括一个或多个PHA颗粒结合蛋白基因缺失或表达减少、或PHA颗粒结合蛋白对细胞内PHA颗粒的结合亲和力降低,使得PHA(例如PHB)制造减少,产生更易消化的PHA或分子量分布改变的PHA。在一些实施例中,所述微生物可以包括增加一种或多种PHA颗粒结合蛋白的表达(例如通过增加启动子强度或基因拷贝数)的修饰,由此制造出较小、更易消化的PHA颗粒或分子量分布改变的PHA。
在一些实施例中,所述微生物包括Mext_0493多核苷酸序列、或SEQ ID NO:7中所描绘的多核苷酸序列的表达调控序列、或与SEQ ID NO:7具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸中的突变,例如缺失所述多核苷酸序列的至少一部分、减少所述多核苷酸序列的表达和/或降低由所述多核苷酸所编码的PHA颗粒结合蛋白对细胞内PHA颗粒的结合亲和力。在一些实施例中,所述微生物包括编码SEQ ID NO:8中所描绘的Mext_0493氨基酸序列或编码与SEQ ID NO:8具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持对细胞内PHA颗粒的结合亲和力的氨基酸序列的多核苷酸中的突变。
在一些实施例中,所述微生物包括Mext_2223多核苷酸序列、或SEQ ID NO:9中所描绘的多核苷酸序列的表达调控序列、或与SEQ ID NO:9具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸中的突变,例如缺失所述多核苷酸序列的至少一部分、减少所述多核苷酸序列的表达和/或降低由所述多核苷酸所编码的PHA颗粒结合蛋白对细胞内PHA颗粒的结合亲和力。在一些实施例中,所述微生物包括编码SEQ ID NO:10中所描绘的Mext_2223氨基酸序列或编码与SEQ ID NO:10具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持对细胞内PHA颗粒的结合亲和力的氨基酸序列的多核苷酸中的突变。
在一些实施例中,所述微生物包括Mext_2560多核苷酸序列、或SEQ ID NO:11中所描绘的多核苷酸序列的表达调控序列、或与SEQ ID NO:11具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸中的突变,例如缺失所述多核苷酸序列的至少一部分、减少所述多核苷酸序列的表达和/或降低由所述多核苷酸所编码的PHA颗粒结合蛋白对细胞内PHA颗粒的结合亲和力。在一些实施例中,所述微生物包括编码SEQ ID NO:12中所描绘的Mext_2560氨基酸序列或编码与SEQ ID NO:12具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持对细胞内PHA颗粒的结合亲和力的氨基酸序列的多核苷酸中的突变。
在一些实施例中,所述微生物可以过度表达一个或多个PHA降解基因,如但不限于phaY、phaZ、和/或hbd,使PHA(例如PHB)制造减少或产生分子量分布改变或可消化性增加的PHA。例如,过度表达可以包括改变一个或多个调控序列(例如增加启动子强度以增加转录)、改良核糖体结合序列以增加翻译,或增加基因拷贝数。替代地或另外,所述微生物可以用外源phaY、phaZ和/或hbd序列转化,如将所述序列添加至不表达这些基因的微生物中或作为额外拷贝或较高活性的酶添加至具有这些基因的内源性拷贝的微生物中。
在一些实施例中,所述微生物过度表达SEQ ID NO:17或SEQ ID NO:19或SEQ ID NO:25或SEQ ID NO:31或SEQ ID NO:40或SEQ ID NO:41中所描绘的phaY多核苷酸序列(例如通过改变一个或多个调控序列,使表达增加)或与SEQ ID NO:17或SEQ ID NO:19或SEQ ID NO:25或SEQ ID NO:31或SEQ ID NO:40或SEQ ID NO:41具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸。在一些实施例中,所述微生物过度表达编码PHA寡聚物水解酶,例如3-羟基丁酸酯寡聚物水解酶氨基酸序列,例如SEQ ID NO:18或SEQ ID NO:20或SEQ ID NO:26或SEQ ID NO:32中所描绘的氨基酸序列,或编码与SEQ ID NO:18或SEQ ID NO:20或SEQ ID NO:26或SEQ ID NO:32具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持PHA寡聚物水解酶,例如3-羟基丁酸酯寡聚物水解酶的酶活性(例如胞内或胞外PHA寡聚物裂解活性)的氨基酸序列的多核苷酸。
在一些实施例中,所述微生物过度表达SEQ ID NO:13或SEQ ID NO:15或SEQ ID NO:23或SEQ ID NO:27或SEQ ID NO:29或SEQ ID NO:36或SEQ ID NO:38或SEQ ID NO:39或SEQ ID NO:44中所描绘的phaZ多核苷酸序列(例如通过改变一个或多个调控序列,使表达增加),或与SEQ ID NO:13或SEQ ID NO:15或SEQ ID NO:23或SEQ ID NO:27或SEQ ID NO:29或SEQ ID NO:36或SEQ ID NO:38或SEQ ID NO:39或SEQ ID NO:44具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸。在一些实施例中,所述微生物过度表达编码PHA解聚酶,例如SEQ ID NO:14或SEQ ID NO:16或SEQ ID NO:24或SEQ ID NO:28或SEQ ID NO:30或SEQ ID NO:37或SEQ ID NO:45中所描绘的氨基酸序列,或编码与SEQ ID NO:14或SEQ ID NO:16或SEQ ID NO:24或SEQ ID NO:28或SEQ ID NO:30或SEQ ID NO:37或SEQ ID NO:45具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持PHA解聚酶活性,例如胞内或胞外PHA寡聚物裂解活性,例如通过硫解降解PHA的氨基酸序列的多核苷酸。
在一些实施例中,所述微生物过度表达SEQ ID NO:21中所描绘的hbd多核苷酸序列(例如通过改变一个或多个调控序列,使表达增加),或与SEQ ID NO:21具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸。在一些实施例中,所述微生物过度表达编码β-羟基丁酸脱氢酶氨基酸序列,例如SEQ ID NO:22中所描绘的氨基酸序列,或编码与SEQ ID NO:22具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持β-羟基丁酸脱氢酶的酶活性的氨基酸序列的多核苷酸。
在一些实施例中,所述微生物过度表达SEQ ID NO:42中所描绘的phaM多核苷酸序列(例如通过改变一个或多个调控序列,使表达增加),或与SEQ ID NO:42具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性的多核苷酸。在一些实施例中,所述微生物过度表达编码PHA颗粒相关氨基酸序列,例如SEQ ID NO:43中所描绘的氨基酸序列,或编码与SEQ ID NO:43具有至少约30、35、40、45、50、55、60、65、70、75、80、85、90、95、98或99%序列一致性并保持与PHA颗粒缔合的能力的氨基酸序列的多核苷酸。
天然存在的微生物
在一些实施例中,将制造PHA(例如PHB)的天然存在的微生物用于本文所描述的制造生物质的方法中。所述天然存在的微生物是例如在具有指定培养物生长培养基和碳源的生物反应器中培养。所选培养条件使得PHA制造水平和/或蛋白质水平和/或PHA:蛋白质比率相对于在天然存在条件下制造的这些物质的水平有所改变。
在一些实施例中,所述微生物是甲基单胞菌属、甲基杆菌属、甲基球菌属、甲基弯曲菌属、甲基孢囊菌属、甲基微菌属、甲烷单胞菌属、嗜甲基菌属、甲基芽孢杆菌属、甲基杆菌属、生丝微菌属、黄色杆菌属、芽孢杆菌属、副球菌属、诺卡菌属、节杆菌属、红假单胞菌属、假单胞菌属、念珠菌属、汉森酵母属、毕赤酵母属、球拟酵母属、弧菌属、埃希氏菌属、产碱杆菌属、罗尔斯通氏菌属、红细菌属、酵母属、贪铜菌属、中华根瘤菌属、白霉菌属、短根瘤菌属、耶氏酵母属、固氮菌属、集胞藻属、红酵母属、气单胞菌属、磁螺菌属、富盐菌属、显核菌属或闪杆菌属的天然存在的物种。
在一些实施例中,所述天然存在的微生物是扭脱甲基杆菌(例如菌株AM1、DM4、CM4、PA1、DSMZ 1340)、杨树甲基杆菌(BJ001)、耐辐射甲基杆菌、结瘤甲基杆菌、甲基杆菌4-46或其它甲基杆菌属物种。
在一些实施例中,所述天然存在的微生物是甲基营养细菌。
微生物转化
本领域中已知多种用于在宿主细胞中引入和表达外源多核苷酸的转化方案和构建体。
在某些实施例中,基因修饰将利用自由复制的质粒载体来进行克隆。这些载体可以包括被开发用于甲基杆菌属的较小IncP载体。这些载体可包括用于克隆的pCM62、pCM66或pHC41。(Marx,C.J.和M.E.Lidstrom,《微生物学(Microbiology)》(2001)147:2065-2075;Chou,H.-H.等人《公共科学图书馆-遗传学(PLoS Genetics)》(2009)5:e1000652)
在某些实施例中,基因修饰将利用自由复制的表达质粒,如pCM80、pCM160、pHC90或pHC91。(Marx,C.J.和M.E.Lidstrom,《微生物学》(2001)147:2065-2075;Chou,H.-H.等人《公共科学图书馆-遗传学》(2009)5:e1000652)
在某些实施例中,基因修饰将利用自由复制的表达质粒,所述表达质粒能够对诱导分子如二甲氨基二硫代甲酸铜(cumate)或无水四环素的水平起反应。这些表达质粒包括pHC115、pLC290、pLC291。(Chou,H.-H.等人,《公共科学图书馆-遗传学》,(2009)5:e1000652;Chubiz,L.M.等人,《BMC研究笔记(BMC Research Notes)》,(2013)6:183)
在某些实施例中,基因修饰将利用可再循环的抗生素标记物系统,如cre-lox系统。这一系统可以包括使用被开发用于扭脱甲基杆菌的pCM157、pCM158、pCM184、pCM351系列质粒。(Marx,C.J.和M.E.Lidstrom,《生物技术》,(2002)33:1062-1067)
在某些实施例中,基因修饰将利用转座子诱变。这可以包括在扭脱甲基杆菌(Marx,C.J.等人《细菌学杂志》(2003)185:669-673)中所展示的微型Tn5递送系统,如pCM639(D′Argenio,D.A.等人《细菌学杂志》(2001)183:1466-1471)。
在某些实施例中,基因修饰将利用直接引入染色体基因座中的表达系统。这一表达系统可以包括被开发用于扭脱甲基杆菌的pCM168、pCM172和pHC01质粒。(Marx,C.J.和M.E.Lidstrom,《微生物学》,(2001)147:2065-2075;Lee,M.-C.等人,《进化(Evolution)》,(2009)63:2813-2830)
在某些实施例中,基因修饰将利用基于sacB的系统,由sacB表达所提供的蔗糖敏感度而引起等位基因的无标记交换。所述系统可以包括最初用扭脱甲基杆菌测试的pCM433载体。(Marx,C.J.等人,《BMC研究笔记》,(2008)1:1)
微生物培养物
提供了用于制造生物质的方法。所述方法包括在适于微生物生长和制造含有重量比是约1∶1000至约2∶1的PHA:蛋白质的生物质条件下,在培养基中培养如本文中所描述的微生物。在一些实施例中,所述PHA是PHB。
如本文所描述,所述微生物可以是天然存在的,并且所选培养条件可影响培养物中制造的PHA的水平和/或培养物中制造的PHA:蛋白质的比率,或所述微生物可以是非天然存在的并且被工程改造或选择用于改变,即减少PHA制造和/或改变所制造的PHA:蛋白质比率。在一些实施例中,如本文所描述,所述微生物可以是非天然存在的,并且选择的培养条件还可以改变PHA水平、所制造的PHA:蛋白质比率、PHA的可消化性和/或PHA聚合物的分子量分布。
在所述微生物还制造一种或多种类胡萝卜素化合物(例如经历基因修饰或人工预选以制造升高水平的一种或多种类胡萝卜素化合物的微生物)的实施例中,制造出包括PHA和所述一种或多种类胡萝卜素化合物的生物质。
在各种实施例中,所述培养条件可以包括以下一种或多种:培养基通气(例如产生约5%至约50%的溶解氧浓度);培养基的温度(例如约20℃至约50℃的温度);包含以下、由以下组成或基本上由以下组成的碳源:一种或多种醇(例如甲醇、乙醇、甘油或其组合);以及半连续或连续发酵条件。
在一些实施例中,产生所希望的PHA水平和/或PHA:蛋白质比率的培养条件包括培养基通气。例如,可以对培养基通气以提供约5%至约50%、约5%至约10%、约10%至约15%、约15%至约20%、约20%至约25%、约25%至约30%、约30%至约35%、约35%至约40%、约40%至约45%、约45%至约50%、约5%至约25%、约10%至约35%、约20%至约40%或约25%至约50%,或至少约5%、10%、15%、20%、25%、30%、35%、40%、45%或50%中的任一百分比的溶解氧。
在一些实施例中,产生所希望的PHA水平和/或PHA:蛋白质比率的培养条件包括培养基的温度。例如,培养基的温度可以维持在约20℃至约50℃、约20℃至约25℃、约25℃至约30℃、约30℃至约35℃、约35℃至约40℃、约40℃至约45℃、约45℃至约50℃、约20℃至约30℃、约30℃至约40℃、约40℃至约50℃、约20℃至约35℃、约25℃至约40℃、约30℃至约45℃、约35℃至约50℃、约20℃至约40℃、约30℃至约50℃,或约20、25、30、35、40、45或50℃中的任一个。
所述培养基包括碳源、氮源、无机物质(例如无机盐)和微生物生长所需的任何其它物质(例如维生素、氨基酸等)。
碳源可以包括糖,如葡萄糖、蔗糖、乳糖、果糖、海藻糖、甘露糖、甘露糖醇和麦芽糖;有机酸,如乙酸、乳酸、反丁烯二酸、柠檬酸、丙酸、苹果酸、丙酮酸、丙二酸、琥珀酸和抗坏血酸;醇,如甲醇、乙醇、丙醇、丁醇、戊醇、己醇、异丁醇和甘油;油或脂肪,如大豆油、米糠油、橄榄油、玉米油、芝麻油、亚麻籽油等。所添加的碳源的量根据碳源的种类而变化,例如每升培养基约1g至约100g或约2g至约50g。
在一些实施例中,将C1碳基质提供给能够将这种基质转化成有机产物的微生物(例如甲基杆菌属、甲基单胞菌属、甲基杆菌属、甲基球菌属、甲基弯曲菌属、甲基孢囊菌属、甲基微菌属的微生物)。在某些实施例中,C1碳基质是选自甲烷、甲醇、甲醛、甲酸、甲基化胺、甲基化硫醇和二氧化碳。在某些实施例中,C1碳基质是选自甲醇、甲醛和甲基化胺。在某些实施例中,C1碳基质是甲醇。
在一些实施例中,产生所希望的PHA水平和/或PHA:蛋白质比率的培养条件包括碳源,所述碳源包含一种或多种醇,由一种或多种醇组成或基本上由一种或多种醇组成,所述醇如但不限于甲醇、乙醇和/或甘油。
氮源可以包括单独或组合形式的硝酸钾、硝酸铵、氯化铵、硫酸铵、磷酸铵、氨水、尿素等。所添加的氮源的量根据氮源的种类而变化,例如每升培养基约O.1g至约30g或约1g至约10g。
无机盐可以包括单独或组合形式的磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、磷酸二氢钠、硫酸镁、氯化镁、硫酸铁、硫酸亚铁、氯化铁、氯化亚铁、硫酸锰、氯化锰、硫酸锌、氯化锌、硫酸铜、氯化钙、碳酸钙、碳酸钠、硫酸钠等。无机盐的量根据无机盐的种类而变化,例如每升培养基约0.00001g至约10g。
可以包括单独或组合形式的特定必需物质,例如维生素、核酸、酵母提取物、蛋白胨、肉提取物、麦芽提取物、玉米浆、黄豆粕、干酵母等。所使用的特定必需物质的量根据物质的种类而变化,例如每升培养基约0.2g至约200g或约3g至约10g。
在一些实施例中,培养基的pH值被调至约pH2到约pH 12或约pH 6到约pH 9。培养基还可以包括一种或多种缓冲液,用以将培养物维持在所希望的pH值。许多缓冲液是本领域中已知的,并且包括磷酸盐、碳酸盐、乙酸盐、PIPES、HEPES和Tris缓冲液。本领域的普通技术人员可以容易地确定适于给定微生物的缓冲液。对于甲基杆菌属,Lee等人(2009)《进化》63:2813-2830所描述的常用培养基是由1mL微量金属溶液(向1升去离子水中以此次序添加以下各物:12.738g乙二胺四乙酸二钠盐二水合物、4.4g ZnS0-7H20、1.466g CaCI2-2H2O、1.012g MnCI2-4H20、0.22g(NH4)6Mo7O24-4H20、0.314g CuSO4-5H20、0.322gCoCl2-6H20和0.998g Fe3(SO4)2-7H20;每次添加之后维持pH 5.0)、100mL磷酸盐缓冲液(25.3g K2HPO4和22.5g NaH2PO4于1升去离子水中)、100mL硫酸盐溶液(5g(NH4)2(SO4)和0.98g Mg(SO4)2于1升去离子水中)和799mL去离子水组成。将所有组分分别加热灭菌,然后合并在一起。最近开发用于扭脱甲基杆菌的替代性培养基利用有机缓冲液,并且具有柠檬酸根螯合的微量金属混合物。培养是在通过振荡或通气/搅动提供的有氧条件下,在15℃至40℃且优选地在20℃至35℃的温度下进行,通常持续1至20天,且优选地持续1至4天。甲基杆菌属的惯例是30℃。用于制备M-PIPES培养基的方案描述于Delaney等人(2013)《公共科学图书馆·综合(PLoS One)》8:e62957的表S1中。USSN 61/863,701中的图2示出了被优化用于扭脱甲基杆菌的培养基的示例性配方。
为了产生微生物如甲基杆菌属的高密度培养物,使用分批馈料方法可能是有利的。0.5%至1%v/v(约120-240mM)的甲醇可以是良好耐受的,并因此,可以重复使用这一添加步长。关键地是,在甲醇上培养期间,pH水平下降,由此使用碱如KOH或NaOH将变得重要,以将pH值维持在约6.5。通气可以通过物理搅动,如叶轮;通过鼓入过滤过的空气或纯氧;或其组合来实现。为了降低制造成本,缓冲液可以从磷酸盐或PIPES更换成碳酸盐缓冲的介质。
在一些实施例中,使用了“充排式”方法,其中当培养物在600nm下达到所希望的光学密度(例如约50至约200)时,移除一部分培养基(例如约10%至约90%),随后用等量新鲜培养基更换,由此将培养物中的PHA(例如PHB)维持在相对恒定的水平,并由此产生含有所希望的PHA水平和/或所希望的PHA:蛋白质比率的生物质。
在一些实施例中,使用了“连续”方法,其中连续地添加新鲜培养基,同时以相同速率连续地移除培养基和微生物,保持培养物体积相对恒定,由此产生含有所希望的PHA水平、PHA分子量分布、可消化性和/或所希望的PHA:蛋白质比率的生物质。
微生物细胞可以例如通过常规手段如离心或过滤从培养物分离。所述细胞可以完整地分离,或可以被溶解以释放其内含物以供萃取或进一步加工。所述细胞或培养基可以经历适合溶剂的萃取。
组合物
提供了用作水产养殖饲料、或用作动物饲料、或用作人体营养补充剂的组合物以及制备所述饲料或营养补充组合物的方法,所述组合物含有来自如本文所描述培养的微生物细胞的加工或或未加工过的生物质。
饲料组合物或营养补充剂包括含PHA(例如PHB)的生物质,所述生物质是通过培养如本文所描述的一种或多种微生物制造,即通过培养如本文中所描述的非天然存在的微生物和/或通过对非天然存在的或天然存在的微生物施加如本文中所描述的产生所希望的PHA水平、PHA分子量分布、可消化性和/或PHA:蛋白质比率的培养条件来制造。
在某些实施例中,并入饲料或营养补充组合物中的生物质可以呈干燥或大体上干燥的形式,例如含有低于约20%、10%、5%或2%的水分。在某些实施例中,培养物是通过移除大体上全部上清液来分离,如通过过滤、沉降或离心分离。在某些实施例中,培养物收集和生物质的进一步加工不包括例如通过使用清洁剂或超声波实现的细菌溶解步骤。在某些实施例中,加工过的微生物细胞维持大体上完整的细胞膜。在一些实施例中,绝大部分(例如超过约5%、10%、20%、30%、50%或80%)细菌细胞可以维持加工过的生物质的活力。
饲料组合物可以含有以重量计至少约1%的生物质。在某些实施例中,饲料组合物被优化用于供鱼类、海产食品、人、家禽、猪、牛或其他动物消费。例如,饲料可以包括EPA、DHA和一种或多种必需氨基酸中的一种或多种。
还提供了用于制备饲料组合物的方法。在一些实施例中,所述方法包括:(a)在适当的培养基中培养如上文所描述的至少一种非天然存在的微生物;(b)浓缩培养基以提供生物质;(c)任选地提供额外饲料组分;以及(d)由所述生物质制造所述饲料组合物。在某些实施例中,步骤(b)包括离心。在某些实施例中,步骤(b)包括使生物质沉淀。在某些实施例中,步骤(b)包括过滤。在某些实施例中,所述方法还包括在步骤(a)之后,用化学试剂(例如表面活性剂或溶剂)预处理所述生物质以破坏所述生物质的细胞膜。在某些实施例中,所述方法还包括在步骤(a)之后,以机械方式破坏所述生物质的细胞膜。
可以并入富含如本文所描述制造的PHA(例如PHB)的单细胞蛋白质的饲料的实例包括例如宠物食品,如猫粮、狗粮等;观赏鱼类、养殖鱼类或甲壳动物等的饲料;农场饲养动物(包括家畜并且还包括水产养殖中饲养的鱼类或甲壳动物)的饲料。生物质的状态可以呈完整细胞、溶解或部分加工过的细胞形式。如本文中所描述制造的富含PHA的生物质或富含PHA的蛋白质任选地与额外热量或营养补充剂一起也可以并入食品或维生素补充剂中供人消费。包括如本文所描述制造的PHA或并入含如本文所描述制造的PHA的生物质的食品或饲料材料优选地适合作为目标接受者的生物体口味的。这一食品或饲料材料可以具有目前已知用于食品材料的任何物理特性(例如固体、液体、柔软的)。在一些实施例中,如本文中所描述制造的饲料将经历粒化工艺,例如在低于约1%、5%、10%、20%、25%、30%、40%、50%、60%或75%包含率下通过热或冷挤出工艺。在其它情形中,如本文所描述制造的富含PHA的生物质或富含PHA的蛋白质可以100%直接消费,或与呈液体形式、烘焙物形式或其它形式的另一物质组合,以形成包括但不限于各种类型的片剂、胶囊、可饮用剂、含漱剂等。
在一些实施例中,饲料或营养组合物或生物质包括额外的天然或异源PHA降解酶。
在一些实施例中,所述饲料或营养组合物或并入所述饲料或营养组合物中的生物质包括以重量计约0.1%至约0.5%、约0.5%至约1%、约1%至约5%、约5%至约10%、约10%至约15%、约15%至约20%、约20%至约25%、约25%至约30%、约30%至约35%、约35%至约40%、约40%至约45%或约45%至约50%中的任一百分比的PHA(例如PHB),以及以重量计约35%至约40%、约40%至约45%、约45%至约50%、约50%至约55%、约55%至约60%、约60%至约65%、约65%至约70%或大于约70%中的任一百分比的蛋白质。
在一些实施例中,所述饲料或营养组合物或并入所述饲料或营养组合物中的生物质包括PHA:蛋白质比率是约1∶1000至约2∶1、约1∶1000至约1∶6或约1∶1至约2∶1的PHA(例如PHB)和蛋白质。在一些实施例中,饲料组合物或生物质中的PHA:蛋白质比率是约1∶1000至约1∶500、约1∶500至约1∶100、约1∶100至约1∶50、约1∶50至约1∶10、约1∶10至约1∶6、约1∶6至约1∶2、或约1∶2至约1∶1、或约1∶1至约2∶1。
在一些实施例中,所述饲料或营养组合物或生物质具有生物利用率增加的PHA。在一些实施例中,相较于例如野生型或亲代菌株和/或在与本文所传授条件不同的培养条件,例如不同于本文所描述条件的改变PHA水平、所制造的PHA:蛋白质比率、PHA可消化性和/或PHA聚合物的分子量分布的培养条件下生长的菌株,所述PHA聚合物具有减小或改变的平均分子量(Mw、Mn、Mp或Mz)、增加的多分散性或增加的可消化性。
在一些实施例中,如本文中所描述的饲料或营养组合物包括多种微生物,这些微生物各自以不同水平制造PHA(例如PHB)(例如,如本文中所描述,包括减少或增加PHA制造的突变的一种或多种非天然存在的微生物,和/或已经在减少或增加PHA制造的条件下培养的一种或多种天然存在的微生物),并且所述组合物中微生物生物质的组合产生所希望的PHA和蛋白质浓度。例如,所述多种微生物可以被并入饲料或营养组合物中以制造包括以重量计约O.1%至约0.5%、约0.5%至约1%、约1%至约5%、约5%至约10%、约10%至约15%、约15%至约20%、约20%至约25%、约25%至约30%、约30%至约35%、约35%至约40%、约40%至约45%或约45%至约50%中的任一百分比的PHA(例如PHB),和以重量计约35%至约40%、约40%至约45%、约45%至约50%、约50%至约55%、约55%至约60%、约60%至约65%、约65%至约70%或大于约70%中的任一百分比的蛋白质的组合物。在一些实施例中,所述多种微生物可以被并入饲料或营养组合物中以制造包括PHA:蛋白质比率是约1∶1000至约2∶1、约1∶1000至约1∶6或约1∶1至约2∶1的PHA(例如PHB)和蛋白质的组合物。在一些实施例中,饲料组合物或生物质中的PHA:蛋白质比率是约1∶1000至约1∶500、约1∶500至约1∶100、约1∶100至约1∶50、约1∶50至约1∶10、约1∶10至约1∶6、约1∶6至约1∶2、或约1∶2至约1∶1、或约1∶1至约2∶1。
在一些实施例中,如本文中所描述的饲料或营养组合物包括制造PHA和/或额外天然或异源PHA降解酶的多种微生物。
还提供了制造鱼类或海产食品,包括养殖鱼类或海产食品,以及向所述鱼类或海产食品提供包括如本文所描述的饲料组合物的饮食的方法。
增强的生存力
提供了用于提高家畜或水产养殖(例如海产食品或鱼类)动物的生存力的方法。所述方法包括向所述动物投喂如本文所描述的饲料组合物,例如包括PHA:蛋白质重量比是约1∶1000至约2∶1的饲料组合物或包括所述PHA:蛋白质重量比的生物质,其中生存力相较于不包含PHA的饲料组合物增加至少约1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、75%、70%、75%、80%、85%、90%、100%、110%、120%、130%、140%、150%、160%、170%、180%、190%或200%或更高百分比。在一些实施例中,所述PHA是PHB。
以下实例旨在说明而非限制本发明。
实例
实例1.缺失PHA颗粒结合蛋白
使用扭脱甲基杆菌PA1基因组序列分析鉴别三种推定的PHA颗粒结合蛋白:Mext_0493、Mext_2223和Mext_2560。根据序列同源性,Mext_2223匹配AM1 gap 11并且Mext_2560匹配gap20。取决于培养条件,如体积、通气(较低DO导致PHB增加)、温度(超过30℃的温度会增加PHB)和馈料策略(养分限制导致增加),缺失Mext_2223使PHB制造显著减少(参见图2B):扭脱甲基杆菌KB0324中制造约1%PHB(约95%减少),而缺失Mext_2560引起20-50%减少。
扭脱甲基杆菌菌株基因型:
KB0203(PA1衍生细菌)
KB0254:KB0203ΔMext_0493
KB0262:KB0203ΔMext_2560
KB0271:KB0203ΔMext_0493ΔMext_2560
KB0324:KB0203ΔMext_0493ΔMext_2223
KB0325:KB0203ΔMext_2560ΔMext_2223
KB0326:KB0203ΔMext_0493ΔMext_2560ΔMext_2223
KB0218:KB0203的衍生细菌
KB0258:KB0218ΔMext_2560
KB0253:KB0218ΔMext_0493
KB0239:KB0203的衍生细菌
KB0256:KB0239ΔMext_0493
KB0261:KB0239ΔMext_2560
结果显示于图2A和2B中。数据是来自250mL摇瓶实验,其中生长培养基SP5(盐培养基)补充有0.2%(v/v)的甲醇。数据是以1L规模确定。
实例2.培养条件对PHB和蛋白质制造的影响
通气
图3显示研究氧(通气)减少的影响的实验的结果。通气研究是在32℃下于摇瓶中用SP5(盐和矿物质)培养基进行。在含25ml SP5+0.4%甲醇的125ml烧瓶中或在减少充氧的含15ml SP5+0.4%甲醇的100ml小口烧瓶中培养菌株KB0203、KB0262、KB0218和KB0258,“s”指示图中使用小口烧瓶。在发酵结束时,在4℃下以4000rpm离心细胞样品20分钟。接着,在0.05×磷酸盐缓冲生理盐水(PBS)溶液中洗涤沉淀一次,离心并冻干。通过用0.5mL浓硫酸处理约5mg冻干的细胞,并在100℃下保持30分钟,将细胞内PHB转化成巴豆酸。接着,冷却所述溶液,用2.5mL超纯水(MilliQ water)稀释,并以4300rpm离心20分钟。然后,稀释上清液以制备用于UPLC分析。在Waters 3100质量检测器UPLC-MS上,在0.5mL/min下,在50mm×1.7 C18 UPLC色谱柱上,使用60%超纯水+0.1%甲酸和40%甲醇+0.1%甲酸分析稀释过的样品。将样品的峰面积与以类似方式水解的PHB标准品的峰相比较。PHB是以干细胞重量(dcw)的百分比报导。
温度
使菌株KB0203在含有CHOI4培养基的1L平行生物反应器系统的容器中,在140ppm初始浓度的Dow Coming AFE1520消泡剂存在下生长72小时(Bourque等人(1995)《应用微生物学与生物技术》44:367-376)。初始OD600设定为0.2,DO是15%并且甲醇浓度使用Intempco控制系统恒定保持在0.2%。温度设定点是30℃、32℃、34℃和36℃制造。在发酵结束时,在4℃下以4000rpm离心细胞样品20分钟。接着,用0.05×磷酸盐缓冲生理盐水(PBS)溶液洗涤沉淀一次,离心并冻干。对干燥细胞称重以获得约5mg材料。如上所述执行PHB分析。将约4-5gm冻干的培养物送至New Jersey Lab(新泽西州特伦顿(Trenton,NJ)的NJFL,Inc.)进行近似分析。如图4A中所示,当温度增加超过30℃时,PHB制造增加。KB0203在36℃下生长不良。如上文所描述,使PHB制造量比KB0203低约25-50%的菌株KB0258在1L平行生物反应器系统的容器中生长约40小时。温度设定在30或32℃。当温度超过30℃时,也观察到PHB制造增加(图4B)。
充排式实验
执行“充排式”实验以研究对PHB制造的影响。如上文所描述,在含有CHOI4培养基的1L平行生物反应器系统的容器中培养菌株KB0203。一旦反应器在600nm下的光学密度达到100,就停止反应器并使用含有600ml新鲜CHOI4+0.2%甲醇的活性反应器体积的五分之一(150ml)接种下一反应器。在整个实验中,用新鲜CHOI4培养基更换排出的体积。对样品离心并用0.05×PBS洗涤细胞沉淀一次。接着,如上文所描述,将样品冻干并分析PHB和蛋白质含量。这一充排式策略允许在整个发酵过程中将PHB的水平维持在约12%,同时产生生物质。结果显示于图5中。
PHB水平和蛋白质含量的相关性
如图6A和6B中所示,经显示减少PHB制造可增加细胞中的蛋白质含量。图6A表示在各种发酵实验中用菌株KB0203和KB0258获得的汇集的PHB%和蛋白质%的平均值。由此显示低PHB水平与高蛋白质含量之间的较强相关性:当PHB水平降至低于5-6%时,蛋白质水平达到约70%。PHB水平受基因修饰(KB0258中PHA颗粒结合蛋白缺失)或发酵条件控制。
为了进一步探究蛋白质含量与PHB之间的相关性,比较由在不同条件下细胞于发酵罐中生长得到的多种结果。将野生型KB203与在PHA颗粒结合蛋白编码基因中具有多种缺失之一的一组菌株相比较。图6B显示这些菌株中蛋白质百分比与PHB百分比之间的相关性。
甲醇-乙醇共馈料对PHB制造的影响.
在30℃下,在含25ml培养基(SP5+Tmp)的250mL烧瓶中培养菌株KB0203和KB0258。在时间0、16、24、40和48小时的时候,向培养物馈送0.5%甲醇或0.3%甲醇+0.1%乙醇的混合物。在68小时的时候测量PHB作为终点。结果显示于图8中。依靠甲醇-乙醇共馈料生长引起PHB制造增加。
实例3.PHB对生存力的影响
虾数据
研究依靠在细菌生物质(BB)中含有PHB的饮食与依靠不含PHB的饮食的太平洋白虾,即南美白对虾(Litopenaeus vannamei)的存活率的比较。进行3次试验,每次6周。试验1利用3次处理,且每次处理重复4次。这是在半封闭的再循环系统中进行。将幼虾储存于12个贮槽中,并且每个水族箱(160L)中8只虾。基于历史结果,假定饲料转化率是1.8以及前两周大小加倍且之后是每周0.8-1.3g,计算固定比率。试验2利用6次处理,且每次处理重复4次。将幼虾储存于24个贮槽中,并且每个水族箱(80L)中10只虾。对虾计数,每周重新调整每天的饲料输入。在试验2和试验3中,再循环系统由连接至共用储集器、生物过滤器、珠粒过滤器、流体化生物过滤器和再循环泵的24个水族箱(135L)组成。使用标准投喂方案,对四个重复组的虾(在试验2中:0.98g初始平均重量,10只虾/贮槽;在试验3中:0.15g初始平均重量,10只虾/贮槽)提供饮食6周。
在每一生长试验结束时,对虾计数并进行组加权。测定平均最终重量、饲料转化率(FCR)(提供的饲料/(最终重量-初始重量))、重量增加(WG)((最终重量-初始重量)/初始重量×100%)、生物质和存活率。
在试验1和试验2中,将测试饮食配制为等氮和异脂质的(35%蛋白质和8%脂质)。在试验1中,将三种实验性饮食(T1D1-T1D3)配制成含有递增水平(0、6%和12%)的BB替代大豆粕(SBM)。
在试验2中,为了确定试验1中的结果并研究低BB包含水平的影响,将六种实验性饮食(T2D1-T2D6)配制成补充有递增水平(0、1%、2%、4%、6%和12%)的BB作为大豆粕(SBM)的替代。
在试验3中,配制五种实验性饮食(T3D1-T3D5)。T3D1、T3D2和T3D4与试验2中的饮食相同,其利用0、60和120g kg-1BB替代大豆粕(SBM)。以可消化蛋白质计,T3D3和T3D5分别包括BB替代与T3D2和T3D4相同比率的SBM。
结果显示于表1和图7中。
表1
实例4
为了确定增加乙醇对PHB百分比的影响,使500mL KB0203培养物在含变化量的甲醇和乙醇的摇瓶中生长。在生长65小时之后,收获培养物并如上所述分析PHB百分比。总的来说,观察到额外乙醇导致PHB水平降低,直至影响生长的水平。结果显示于图9中。
实例5
作为不溶于水的有机酸聚合物,PHB是水产养殖的理想养分。然而,许多细菌制造的较长PHB聚合物在离开消化道之前可能无法完全分解成可消化的有机酸。为了增加细菌PHB的可消化性,将内源基因和异源基因克隆至pLC291中并受启动子HP1和pMxaF(SEQ ID NO:34和35)驱动。这些基因中有数种是来自能够分解和利用PHB作为唯一碳源的生物体(Sugiyama等人(2004)《现代微生物学》48:424-7;Hadrick等人(2001)《生物化学杂志》276:36215-24;Anderson等人(1990)《微生物学评论》54:450-472;Focarete等人(1999)《大分子》32:4184-4818;Jendrossek等人(2002)《微生物学年评(Annu Rev Microbiol)》56:403-32)。
将这些质粒引入菌株KB203中;使500mL培养物在4L摇瓶中生长,收获并如上文所描述测定PHB含量。增加或引入PhaY、PhaZ、HBD和PHA颗粒结合蛋白蛋白质使得PHB含量改变(参见表2)。一般而言,增加PHB降解酶量会使PHB的量减少。PHA颗粒结合蛋白或PHB生物合成酶缺失使PHB的量减少。
较短的PHB聚合物是值得关注的,因为这些聚合物应更易于通过化学和酶加工来降解,使得3-羟基丁酸酯的利用率增加。为了确定PHA降解酶基因的表达的影响和固有PHA颗粒结合蛋白缺失的影响,利用凝胶渗透色谱法(GPC)。
为了提取PHB用于GPC,使500mL培养物在4L培养烧瓶中生长并收获。通过在30℃下,在甲醇和水的等量混合物中超声波处理冻干的细胞材料,随后在纯甲醇中超声波处理,从所述生物质材料中移除中性脂质和一些蛋白质。在干燥之后,通过添加氯仿并在60℃下超声波处理来提取PHB。通过将氯仿提取的PHB添加至冷甲醇中使其沉淀,使其集结,用额外甲醇洗涤并干燥。
将提取的PHB溶解于氯仿中达到1至10mg/mL,并在配备光电二极管阵列检测器(PDA)和折射率检测器(RFID)的Waters Alliance 2695 HPLC系统上,通过GPC分析。使用Waters Styragel HR色谱柱1、3和4,使用100%四氢呋喃(THF)作为流动相测定分子量。使用分子量是500至400K的聚苯乙烯标准品建立校准曲线。将100至250μl提取物注入0.9ml/min THF流中。将所得RFID峰与聚苯乙烯标准品相比较并使用Waters Empower 2测定聚合物大小(Mn、Mw、Mp)和多分散性。
表3显示内源性异源基因的PHA颗粒结合蛋白突变和表达对PHB聚合物长度和分布的影响。PHA颗粒结合蛋白基因缺失使得在摇瓶或发酵罐中生长的细菌中平均PHB聚合物长度明显减小。PhaY和PhaZ蛋白质的表达使平均PHB聚合物长度减小并因较小PHB寡聚物增加而增加多分散性。
图10A-10D显示从表达PhaZ_Rp(pE22A/C)、PhaZ7_P1(pE39A/C)或对照质粒(pKB200A/C)的菌株提取的PHB的GPC-RFID迹线。如通过自21-28分钟主峰和宽肩峰相对于对照菌株移位所见,两种酶使较小寡聚物的量增加。受较强pMxaF启动子(SEQ ID NO:35)驱动的PhaZ_Rp或PhaZ7_P1的表达增加产生较大部分的较小寡聚物(图10A-D中比较pE#A相对于pE#C)。
为了确定表达PhaZ_Rp或PhaZ7_P1的菌株中PHB是否会产生更易消化的聚合物,通过将硫酸从100%减少至60%,修改以上描述的用于测定PHB含量的方案。使用从表达PhaZ_Rp和PhaZ7_P1的菌株得到的生物质,发现相对于100%硫酸,在60%硫酸中表达这些酶产生的巴豆酸的量高于对照质粒(参见表4)。当比较KB203和平均制造出较小PHB聚合物的产类胡萝卜素菌株KB387时,观察到类似结果(参见表3)。这一数据展示,较小的PHA或PHB寡聚物更易于分解成可溶性活性有机酸。
实例6
包括馈送甲醇和乙醇组合的不同碳源可以改变PHB含量(参见上文)。为了发现不同碳源对PHB的影响,将甲醇、乙醇、甘油、甲酸酯、乙酸酯、琥珀酸酯、苹果酸酯及其组合馈送给在20×150mm管中的5mL培养物中的KB203和进化菌株KB287。向菌株馈送49.4、25.7或27.4mM的甲醇(M)、乙醇(E)、甘油(G),或10mM的甲酸酯(F)、乙酸酯(A)、琥珀酸酯(S)或苹果酸酯(Ma)三次,随后如上文所描述收集并分析PHB含量。添加或单独馈送乙醇、甘油、甲酸酯、琥珀酸酯和苹果酸酯使PHB含量相对于单独甲醇或其与甲醇的组合有所降低(参见表5)。
为了确定不同碳源是否还影响PHB聚合物大小分布,使KB203和KB287在4L烧瓶中生长并馈送甲醇、甲醇和乙醇或单独乙醇。从所得生物质中提取出PHB并如上所述,通过GPC分析。表6显示,相对于将甲醇作为唯一碳源,当在乙醇中生长时,KB287具有减小的平均聚合物长度。KB203在共馈送条件下具有减小的平均聚合物长度。
表2
表3
表4
表5
表6
尽管已出于清楚理解的目的,通过说明和实例相当详细地描述了前述发明,但本领域的技术人员将显而易见的是,可在不脱离所附权利要求书中所描绘的本发明的精神或范围的情况下,实行某些改变和修改。因此,所述描述不应解释为限制本发明的范围。
本文中所引用的所有出版物、专利和专利申请特此以全文引用的方式并入用于所有目的,且其引用程度就如同特定且个别地指示每一个别出版物、专利或专利申请是以引用的方式并入一般。
氨基酸和核苷酸序列
SEQ ID NO:1
说明:PhaA
Mext_3469,A9W7T5,β-酮硫解酶长度:
类型:DNA
长度:1185
生物体:扭脱甲基杆菌
SEQ ID NO:2
说明:PhaA
别名:Mext_3469、A9W7T5、β-酮硫解酶
长度:394
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:3
说明:PhaB
别名:Mext_3470、A9W7T6、乙酰乙酰基-CoA还原酶
长度:729
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:4
说明:PhaB
别名:Mext_3470、A9W7T6、乙酰乙酰基-CoA还原酶
长度:242
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:5
说明:PhaC
别名:Mext_3093、聚(R)-羟基烷酸合酶、A9VX26
长度:1818
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:6
说明:PhaC
别名:Mext_3093、聚(R)-羟基烷酸合酶、A9VX26
长度:605
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:7
说明:PhaP
别名:Mext_0493、PHA颗粒结合蛋白、A9W003
长度:324
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:8
说明:PhaP
别名:Mext_0493、PHA颗粒结合蛋白、A9W003
长度:107
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:9
说明:PhaP
别名:Mext_2223、PHA颗粒结合蛋白、A9W4W2
长度:357
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:10
说明:PhaP
别名:Mext_2223、PHA颗粒结合蛋白、A9W4W2
长度:118
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:11
说明:PhaP
别名:Mext_2560、PHA颗粒结合蛋白、A9W5U8
长度:477
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:12
说明:PhaP
别名:Mext_2560、PHA颗粒结合蛋白、A9W5U8
长度:
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:13
说明:PhaZ
别名:Mext_0594、DepA、细胞内PHB解聚酶、A9W0A2
长度:1245
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:14
说明:PhaZ
别名:Mext_0594、DepA、细胞内PHB解聚酶、A9W0A2
长度:414
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:15
说明:PhaZ
别名:Mext_4205、DepB、PHB解聚酶、A9VY20
长度:1365
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:16
说明:PhaZ
别名:Mext_4205、DepB、PHB解聚酶、A9VY20
长度:454
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:17
说明:PhaY1
别名:PhaY1_Re、PhaZ2、Q0K9H3、PhaZb、寡聚物水解酶、D-(-)-3-羟基丁酸酯寡聚物水解酶
长度:2274
类型:DNA
生物体:富养罗尔斯通氏菌
SEQ ID NO:18
说明:PhaY1
别名:PhaY1_Re、PhaZ2、Q0K9H3、PhaZb、寡聚物水解酶、D-(-)-3-羟基丁酸酯寡聚物水解酶
长度:718
类型:蛋白质
生物体:富养罗尔斯通氏菌
SEQ ID NO:19
说明:PhaY2
别名:PhaY2_Re、QOKBZ6、PhaZc、寡聚物水解酶、D-(-)-3-羟基丁酸酯寡聚物水解酶
长度:882
类型:DNA
生物体:富养罗尔斯通氏菌
SEQ ID NO:20
说明:PhaY2
别名:PhaY2_Re、QOKBZ6、PhaZc、寡聚物水解酶、D-(-)-3-羟基丁酸酯寡聚物水解酶
长度:293
类型:蛋白质
生物体:富养罗尔斯通氏菌
SEQ ID NO:21
说明:Hbd
别名:Mext_4730、3-羟基丁酸脱氢酶、A9W959
长度:786
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:22
说明:Hbd
别名:Mext_4730、3-羟基丁酸脱氢酶、A9W959
长度:261
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:23
说明:PhaZ
别名:Mext_3776、聚羟基烷酸酯解聚酶、A9VXH8
长度:1215
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:24
说明:PhaZ
别名:Mext_3776、聚羟基烷酸酯解聚酶、A9VXH8
长度:404
类型:蛋白质
生物体:扭脱甲基杆菌
SEQ ID NO:25
说明:PhaY
别名:PhaY_Rp、D-(-)-3-羟基丁酸酯寡聚物水解酶、细胞外3HB寡聚物水解酶、e3HBOH、Q9X6X9
长度:2226
类型:DNA
生物体:皮氏罗尔斯通氏菌
SEQ ID NO:26
说明:PhaY
别名:PhaY_Rp、D-(-)-3-羟基丁酸酯寡聚物水解酶、细胞外3HB寡聚物水解酶、e3HBOH、Q9X6X9
长度:741
类型:蛋白质
生物体:皮氏罗尔斯通氏菌
SEQ ID NO:27
说明:PhaZ
别名:PhaZ_Rp、P12625、ePHBDP、细胞外聚(3-羟基丁酸酯)解聚酶
长度:1467
类型:DNA
生物体:皮氏罗尔斯通氏菌
SEQ ID NO:28
说明:PhaZ
别名:PhaZ_Rp、P12625、ePHBDP、细胞外聚(3-羟基丁酸酯)解聚酶
长度:488
类型:蛋白质
生物体:皮氏罗尔斯通氏菌
SEQ ID NO:29
说明:PhaZ
别名:PhaZ_Ac、Q767A0、D(-)-3-羟基丁酸脱氢酶、bdh
长度:777
类型:DNA
生物体:食酸菌属SA1
SEQ ID NO:30
说明:PhaZ
别名:PhaZ_Ac、Q767A0、D(-)-3-羟基丁酸脱氢酶、bhd
长度:258
类型:蛋白质
生物体:食酸菌属SA1
SEQ ID NO:31
说明:PhaY
别名:PhaY_Ac、D-(-)-3-羟基丁酸酯寡聚物水解酶、Q9FlT8
长度:876
类型:DNA
生物体:食酸菌属SA1
SEQ ID NO:32
说明:PhaY
别名:PhaY_Ac、D-(-)-3-羟基丁酸酯寡聚物水解酶、Q9FlT8
长度:291
类型:蛋白质
生物体:食酸菌属SA1
SEQ ID NO:33
说明:lacZα
长度:814
类型:DNA
SEQ ID NO:34
说明:启动子和推定的RBS
别名:HP1
长度:320
类型:DNA
SEQ ID NO:35
说明:启动子和RBS
别名:pMxaF启动子
长度:326
类型:DNA
生物体:扭脱甲基杆菌
SEQ ID NO:36
说明:PhaZ1
别名:PhaZ1_Re、Q0KCI0、细胞内聚(3-羟基丁酸酯)解聚酶
长度:1260
类型:DNA
生物体:富养罗尔斯通氏菌
SEQ ID NO:37
说明:PhaZ1
别名:PhaZ1_Re、Q0KCI0、细胞内聚(3-羟基丁酸酯)解聚酶
长度:419
类型:蛋白质
生物体:富养罗尔斯通氏菌
SEQ ID NO:38
说明:PhaZ
别名:PhaZ_Rp、P12625、ePHBDP、细胞外聚(3-羟基丁酸酯)解聚酶
长度:1467
类型:DNA
生物体:皮氏罗尔斯通氏菌
SEQ ID NO:39
说明:PhaZ
别名:PhaZ_Ac、Q767A0、D(-)-3-羟基丁酸脱氢酶、bdh
长度:777
类型:DNA
生物体:食酸菌属SA1
SEQ ID NO:40
说明:PhaY
别名:PhaY_Ac、D-(-)-3-羟基丁酸酯寡聚物水解酶、细胞外3HB寡聚物水解酶、e3HBOH、Q9X6X9
长度:2226
类型:DNA
生物体:皮氏罗尔斯通氏菌
SEQ ID NO:41
说明:PhaY
别名:D-(-)-3-羟基丁酸酯寡聚物水解酶、Q9F1T8
长度:876
类型:DNA
生物体:食酸菌属SA1
SEQ ID NO:42
说明:PhaM
别名:PhaM_Rp
长度:792
类型:DNA
生物体:富养罗尔斯通氏菌
SEQ ID NO:43
说明:PhaM
别名:PhaM_Rp
长度:263
类型:蛋白质
生物体:富养罗尔斯通氏菌
SEQ ID NO:44
说明:PhaZ7、Q939Q9
别名:PhaZ7_P1
长度:1143
类型:DNA
生物体:Paucimonas lemoignei
SEQ ID NO:45
说明:PhaZ7、Q939Q9
别名:PhaZ7_P1
长度:380
类型:蛋白质
生物体:Paucimonas lemoignei
- 还没有人留言评论。精彩留言会获得点赞!