一种以胆酸为配基的混合模式色谱填料的制备与应用的制作方法
本发明涉及一种以胆酸为配基,疏水相互作用为主,阳离子静电作用为辅的模式色谱填料的制备方法及其用于鸡蛋清的纯化与分离,属于高效液相色谱技术和天然生物大分子分离纯化技术交叉领域。
背景技术:
目前,已有许多类型的混合模式色谱(mmc)迅速发展,常见的有反相液相色谱(rplc)/离子交换色谱(iec)、rplc/亲水相互作用色谱(hilic);hilic/iec、疏水相互作用色谱(hic)/iec或iec/hic,其中由于hic/iec和iec/hic模式具有分离条件温和,组分活性回收率高,色谱重现性好,以及流动相成本低、对环境污染小等特点,显示出优越的应用前景[johanssonb.l.,belewm.,erikssons.,gladg.,lindo.,maloiselj.l.,norrmann.journalofchromatographya,2003,1016:21-33.]。研究表明,在mmc法中,一种是多重作用力均具有主要作用的保留模式,另一种是主、辅机理的lc模式保留机制。前者如geng等报道的单柱二维液相色谱(2d-lc-1c)不但打破了一维模式分离的局限性,还节省了色谱材料,缩短了分离所需时间[gengx.d.,kec.y.,cheng.,liup.,wangf.,zhangh.q.,sun.x.journalofchromatographya,2009,1216:3553-3562.]。后者如用一种具有一个疏水基团(苯基)和一个带电基团(氨基)的苯乙胺分子作为配基制备的硅胶填料,在以疏水相互作用(hic)为主,弱阴离子交换(wax)为辅的mmc模式下对可以实现还原变性溶菌酶复性与同时纯化[gaod.,tanf.c.,wangw.p.,wang.l.l.chinesechemicalletters,2013,24:419-421.]。在以往报道中,我们用胆固醇作为配基制备了一种高效疏水相互作用色谱(hphic)固定相,研究显示,该固定相疏水性适中可以实现酸性蛋白胰岛素(insulin,pi5.0),中性蛋白肌红蛋白(myoglobin,pi7.0)以及3种碱性蛋白(α-chymotrypsina,pi9.2;cytochromec,pi9.4;lysozyme,pi11)的基线分离,完全显示出hic法保留机制[yangy.c.,quq.,liw.m.,yuanj.,reny.,wangl.l.journalofseparationscience,2016,39:2481-2490]。
胆酸是胆固醇的一种衍生物,学名3α,7α,12α-三羟胆烷酸,是人类四种主要胆汁酸中含量最丰富的一种。通常胆酸可通过乙醇结晶法、乙酸乙酯分离法从动物胆汁中提取。胆酸分子含有特殊的羧基、羟基的亲水基团和多环刚性的疏水基团,与胆固醇分子结构上相似,但其基团完全不同。
本发明以胆酸分子作为色谱配基,制备一种以硅胶为基质,疏水相互作用为主,阳离子静电作用为辅的混合模式色谱填料,并将该填料应用于鸡蛋清的纯化与分离。
技术实现要素:
本发明的目的在于将胆固醇的一种衍生物胆酸作为色谱填料配基,制备一种以疏水作用为主,阳离子静电作用为辅的混合模式色谱填料,该固定相是一种性能稳定、具有高选择性的高效疏水相互作用/弱阳离子交换混合模式色谱固定相,将该填料应用于鸡蛋清的纯化与分离,分别在高效疏水相互作用模式和弱阳离子交换模式下,获得纯度为99.8%的卵球蛋白(ovoglobulin)和99.5%的卵转铁蛋白ovt(ovotransfemin),其蛋白质量回收率均在96%以上。
为了实现上述任务,本发明采取解决技术方案如下:
1.以空白基质为原材料,以胆酸为配基,制备结构式(i)所示胆酸配基的硅胶基质混合模式色谱填料;
2、所述结构式(i)的色谱填料制备方法,包括以下步骤:
(1)将活化硅胶与硅烷偶联剂反应得到环氧基硅胶;
(2)将环氧基硅胶与胆酸反应得到高效疏水相互作用/弱阳离子交换混合模式色谱填料;
3、所述胆酸配基的色谱填料制备方法,其特征在于包括以下步骤:
(1)所用硅胶与15~20%盐酸按照1∶10~1∶20(g/ml,m/v)的比例反应,活化2~6小时,用蒸馏水反复洗至中性,120~150℃真空干燥12~24小时。形成的球状多孔硅胶其孔径在
(2)将干燥的活化硅胶和硅烷偶联剂kh560按照1∶1~1∶2(g/ml,m/v)加入装有浓度为45~55mmol/lnaac缓冲液(ph4.5~6.5)的三颈圆底烧瓶中,80~90℃下机械搅拌反应3~5h,反应结束后依次用naac缓冲液、甲醇、水洗涤干净,真空干燥后得到环氧基硅胶。
(3)将干燥的环氧基硅胶和胆酸按照1∶0.25(g/g,m/m)的比例加至干燥的圆底烧瓶中,再依次加入1∶30(g/ml,m/v)的干燥的1,4-二氧六环和对甲苯磺酸(胆酸∶对甲苯磺酸=1∶0.03,g/g,m/m),在100℃条件下机械搅拌反应4h。反应结束后分别用丙酮、甲醇、水清洗固定相,真空干燥,即得到色谱填料。
5.所述的高效疏水相互作用/弱阳离子交换混合模式色谱填料应用在标准蛋白分离与鸡蛋清样品纯化过程中,其特征在于:
(1)将该色谱填料用于标准蛋白的分离中,在高效疏水相互作用色谱(hphic)模式下可使六种(细胞色素-c、肌红蛋白、溶菌酶、α-糜蛋白酶原、α-淀粉酶和胰岛素)或七种(细胞色素-c、肌红蛋白、碳酸酐酶、牛血清白蛋白、α-糜蛋白酶原、α-淀粉酶和胰岛素)标准蛋白得到完全快速分离,在高效弱阳离子交换相互作用色谱(hpwcx)模式下可使三种标准蛋白(核糖核酸酶a、糜蛋白酶和溶菌酶)得到分离;
(2)将该色谱填料用于鸡蛋清样品的分离纯化,可分别在hphic模式和hpwcx模式下,获得纯度为99.8%卵球蛋白和99.5%卵转铁蛋白ovt,其蛋白质量回收率均在96%以上。
(3)所述的流动相a为3.0mol/l(nh4)2so4,20mmol/lkh2po4,ph7.0;流动相b为20mmol/lkh2po4,ph7.0;或者所述的a为20mmol/lkh2po4,ph6.5;流动相b为20mmol/lkh2po4,1.0mol/lnacl,ph6.5。
本发明的优点在于:(1)该高效疏水相互作用/弱阳离子交换混合模式色谱硅胶基质固定相能够利用静电基团的作用调节蛋白质在疏水相互作用色谱模式下的保留,从而高效分离纯化样品;(2)该填料装填的色谱柱对蛋白质的分离以及天然来源鸡蛋清中的蛋白质的分离纯化均具有很好的选择性和负载量;(3)该填料制备工艺简单成熟,条件温和,易于规模化。
附图说明
图1高效疏水相互作用/弱阳离子交换混合模式色谱填料在高效疏水相互作模式下对标准蛋白分离的色谱图。
图中:横坐标为保留时间(time),纵坐标为波长280nm处紫外吸收值(mau);
图1a为第一组标准蛋白,色谱峰顺序为1,溶剂峰;2,细胞色素-c(cyt-c);3,肌红蛋白(myo);4,溶菌酶(lys);5,α-糜蛋白酶原(α-chya);6,α-淀粉酶(α-amy);7,胰岛素(ins);
图1b为第二组标准蛋白,色谱峰顺序为1,溶剂峰;2,细胞色素-c(cyt-c);3,肌红蛋白(myo);4,碳酸酐酶(car);5,牛血清白蛋白(bsa);6,α-糜蛋白酶原(α-chya);7,α-淀粉酶;8,胰岛素(ins);色谱条件为:流动相a:3.0mol/l(nh4)2so4,20.0mmol/lkh2po4,ph7.0;流动相b:20.0mmol/lkh2po4,ph7.0;0-100%b线性梯度洗脱30min,延长100%b10min;检测波长280nm;流速1.0ml/min。
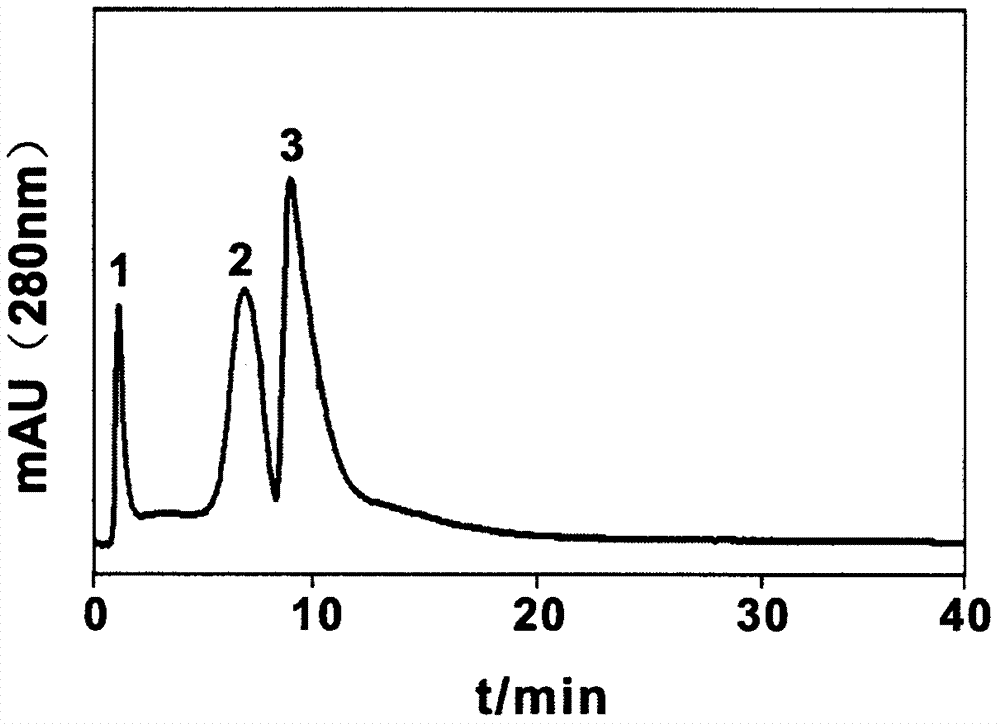
图2高效疏水相互作用/弱阳离子交换混合模式色谱填料在弱阳离子交换模式下对标准蛋白分离的色谱图。
图中:横坐标为保留时间(time),纵坐标为波长280nm处紫外吸收值(mau);色谱峰顺序为1,溶剂+核糖核酸酶a;2,α-糜蛋白酶原(α-chya);3,溶菌酶(lys);色谱条件为:流动相a:20mmol/lkh2po4,ph6.5;流动相b:20mmol/lkh2po4,1.0mol/lnacl,ph6.5;0-50%b线性梯度洗脱20min,50%流动相b延长10min;检测波长为280nm;流速为1.0ml/min。
图3高效疏水相互作用/弱阳离子交换混合模式色谱填料对鸡蛋清样品分离纯化的色谱图及目标色谱馏分的sds-15%page分析。
图中:图3a,图3b为鸡蛋清样品的分离纯化的色谱图,横坐标为保留时间(time),纵坐标为波长280nm处紫外吸收值(mau);图3c,图3d为对鸡蛋清样品分离目标色谱馏分的sds-15%page分析。
图3a为在弱阳离子交换模式下对鸡蛋清样品分离色谱图,其中流动相a:20mmol/lkh2po4,ph6.5;流动相b:20mmol/lkh2po4,1.0mol/lnacl,ph6.5;0-67%b线性梯度洗脱20min,67%流动相b延长10min;检测波长为280nm;流速为1.0ml/min。
图3b为在高效疏水相互作用模式对鸡蛋清样品分离的色谱图,其中流动相a:3.0mol/l(nh4)2so4,20.0mmol/lkh2po4,ph7.0;流动相b:20.0mmol/lkh2po4,ph7.0;0-100%b线性梯度洗脱30min,延长100%b10min;检测波长280nm;流速1.0ml/min。
图3c为hpwcx模式下对鸡蛋清样品分离目标色谱馏分的sds-15%page分析。电泳顺序:lane1:鸡蛋清样品;lane2:标准卵球蛋白ova(ovoglobulin);lane3:标准卵转铁蛋白ovt(ovotransfemin);lane4:标准溶菌酶(lys);lane5:色谱馏分1;lane6:色谱馏分2;lane7:色谱馏分3;
图3d为hphic模式下对鸡蛋清样品分离目标色谱馏分的sds-15%page分析。电泳顺序:lane1:鸡蛋清样品;lane2:标准卵球蛋白ova(ovoglobulin);lane3:标准卵转铁蛋白ovt(ovotransfemin);lane4:标准溶菌酶(lys);lane5:色谱馏分1;lane6:色谱馏分2;lane7:色谱馏分3;lane8:色谱馏分4;lane9:色谱馏分5
具体实施方式
以下通过实施例对本发明作进一步的描述:
实施例1
(1)高效疏水相互作用/弱阳离子交换混合模式色谱填料制备
以高纯球状硅胶作为空白基质,首先进行酸处理,将硅胶用20%的盐酸120℃回流4-6小时,冷却后用蒸馏水反复洗至溶液显中性,真空干燥过夜。然后将干燥好的硅胶用γ-缩水甘油氧丙基三甲氧基硅烷(kh-560)进行活化,即在50mmol/l的醋酸钠溶液中,90℃条件下缓慢滴加kh-560适量与硅胶反应4h后,依次用50mmol/l的醋酸钠溶液、甲醇、水洗涤,真空干燥得到环氧基硅胶。将胆酸与环氧基硅胶加入到干燥的1,4-二氧六环中,然后再加入对甲苯磺酸,在100℃条件下机械搅拌反应4h。反应结束后分别用丙酮、甲醇、水清洗填料,真空干燥即可。
(2)高效疏水相互作用/弱阳离子交换混合模式色谱填料分离性能和选择性考察
在疏水相互作用模式下,以细胞色素-c(cyt-c)、肌红蛋白(myo)、溶菌酶(lys)、α-糜蛋白酶原(α-chya)、α-淀粉酶(α-amy)和胰岛素(ins)六种蛋白作为第一组模型蛋白,以细胞色素-c(cyt-c)、肌红蛋白(myo)、碳酸酐酶(car)、牛血清白蛋白(bsa)、α-糜蛋白酶原(α-chya)、α-淀粉酶和胰岛素(ins)作为第二组模型蛋白,考察该填料的分离性能和选择性。将装填的色谱柱(100×4.6mmi.d.)用流动相a(3.0mol/l(nh4)2so4,20.0mmol/lkh2po4,ph7.0)平衡,将上述两组标准蛋白混合液50μl直接进样,然后线性梯度0-100%b(20.0mmol/lkh2po4,ph7.0)洗脱30min,流速1.0ml/min,并延长100%b10min,检测波长为280nm,见图1。
在弱阳离子交换相互作用模式下,以核糖核酸酶a(rnase-a)、α-糜蛋白酶原(α-chya)和溶菌酶(lys)作为模型蛋白,考察填料的分离性能和选则性。将装填的色谱柱(100×4.6mmi.d.)用流动相a(20mmol/lkh2po4,ph6.5)平衡,将上述三种标准蛋白混合液50μl直接进样,然后线性梯度0-50%b(20mmol/lkh2po4,1.0mol/lnacl)洗脱20min,50%流动相b延长10min;检测波长为280nm;流速为1.0ml/min,见图2。
实施例2
与实施例1类似,不同的是步骤(2)用高效疏水相互作用/弱阳离子交换混合模式色谱填料对鸡蛋清样品分离纯化,在弱阳离子交换相互作用模式下,将装填的色谱柱(100×4.6mmi.d.)用平衡缓冲液a(20mmol/lkh2po4,ph6.5)平衡,将鸡蛋清样品稀释五倍处理(20.0mmol/lkh2po4,ph6.5),上样50μl,采用0-67%b(20mmol/lkh2po4,1.0mol/lnacl,ph6.5)线性梯度20min,延长67%b10min,流速为1ml/min,收集色谱馏分,见图3a;在疏水相互作用模式下其所用流动相a(平衡缓冲液)为3.0mol/l(nh4)2so4,20.0mmol/lkh2po4,ph7.0,流动相b(复性缓冲液)为20mmol/lkh2po4,ph7.0进行洗脱,洗脱方式为0-100%b线性梯度30min,并延长100%b10min,流速为1ml/min,收集色谱峰,见图3b,图3c、3d为色谱馏分电泳分析。
- 还没有人留言评论。精彩留言会获得点赞!