多光阱控制装置和方法与流程
技术领域和背景
本发明涉及光镊,尤其是一种多光阱控制装置和方法。
光镊可被认为是单分子工具箱的支柱之一。所述方法通常包括在样本体积中应用一个或多个高度聚焦的激光束(“捕获光束”)以形成光阱。其物理原理可以用折射时发生的入射光子与捕获物体之间的动量转移(力)来解释。例如,当实验的几何形状包括折射率高于周围介质(例如玻璃和水)的球形物体(“微球”或“珠粒”)时,所产生的光学力生成稳定的三维光阱。光镊可以用于,例如,微米级物体的远程操作。一个应用包括在两个光学捕获的微球之间附着分子链,如dna分子。通过这种方式,可以操纵和控制dna的构象并对其施加和测量力。该信息可以用于研究dna的机械性质及其与蛋白质的相互作用。
传统上,一次使用一或两个光阱。然而,在许多生物学环境中,蛋白质同时与多段dna相互作用(例如,通过在dna中形成环而修复dna断裂或参与dna压实的蛋白质)。这种相互作用无法仅用两个光阱精确而可控地进行研究。典型的光镊应用不允许以可控方式定位不同的dna分子接触同时测量其中每一个的张力。此外,因为一次仅研究一个dna分子,这种应用的数据吞吐量较低。
能够同时操纵不同dna分子的仪器已经有报道。参见例如,m.c.noom,b.vandenbroek,j.vanmameren,g.j.l.wuite;“visualizingsingledna-boundproteinsusingdnaasascanningprobe”;naturemethods,4,1031-1036(2007)。该现有技术涉及一种设计,其中,光镊在多个位置之间分时共享(单个激光束的位置在使用声光偏转器——aod的独立位置之间交替),从而产生多个光阱。然而,在分时共享光镊中,每个位置的捕获在时间上是不连续的,从而导致其不稳定,存在力校准问题,并且通常不适合许多科学应用。
作为另一实例,参见i.devlaminck,m.t.j.vanloenhout,l.zweifel,j.denblanken,k.hooning,s.hage,j.kerssemakers,和c.dekker;"mechanismofhomologyrecognitionindnarecombinationfromdual-moleculeexperiments";molecularcell,46,616(2012)。在该现有技术中,双光镊与磁镊组合。在配置中,其中一个dna分子锚定在磁性球和玻璃表面之间。第二个dna分子在溶液中保持在两个光学捕获的球体之间。然而,在磁镊中使用表面束缚dna限制了仪器使用的灵活性和易用性,使得该方法,例如,与微流体平台不太相容。
因此,仍然希望能以可靠的方式连续操纵和监测多个光阱。
技术实现要素:
根据一个方面,本公开提供一种多光阱控制装置。所述装置包括捕获光束光学器件,其构造为提供多个同时活动的捕获光束。所述装置进一步包括可控光学器件,如可控反射镜,其构造为接收并重新定向捕获光束以控制至少三个光阱的各自位置。光阱是,例如,通过将重定向的捕获光束聚焦在样本体积中而形成。所述装置可以包括或耦合至一个或多个光检测器,如象限光电二极管或位敏检测器。每个检测器构造为接收来自样本体积的对应于相应光阱的相应部分的光。所述装置包括检测器光束光学器件,其构造为使检测器光束的路径与一个捕获光束重叠。检测器光束具有使其与所重叠的捕获光束区别开的光学特性。例如,检测器光束具有与一个或多个捕获光束不同的波长。例如,波长过滤器设置在位于样本体积和一个光检测器之间的光路中。波长过滤器构造为将具有检测器光束波长的光传递至检测器。
根据另一或进一步的方面,本公开提供一种多光阱控制方法。所述方法包括提供多个同时活动的捕获光束。所述方法进一步包括:重新定向捕获光束,以单独控制通过将重定向捕获光束聚焦在样本体积中形成的多个光阱的各自位置。从样本体积接收的光可以与光阱的状态相对应。检测器光束,例如,具有不同波长的检测器光束,与一个捕获光束重叠。在一个检测路径中,来自样本体积的光根据波长进行过滤。因此,只能(通过检测器)测量具有检测器光束波长的滤过光并将其用于监测光阱。例如,在上述装置或其它装置中,所述方法可以有利地实现。所描述的与所述装置相关的各种实施例也可以与所述方法组合,反之亦然。
传统上,通过基于光镊的正交偏振区分捕获光来监测一对光镊。然而,当增加第三捕获光束时,无法将其偏振与第一或第二光束的偏振区别,这意味着只能区分三个光阱中的一个。本发明人发现,通过将检测器光束与光学捕获光束重叠,由捕获光束形成的光阱的特性(如力)可以通过测量检测器光束的光监测。例如,检测光束可用于控制光阱的位置。例如,通过使用单独的检测器光束,可以在监测两个或更多光阱的同时使用三个或更多光阱。
通过提供具有第一偏振的第一捕获光束及具有正交第二偏振的其它捕获光束,第一光束可以,例如,经由偏振过滤器单独监测。通过将检测器光束与具有正交偏振的一个其它捕获光束重叠,也可以在总共使用三个或更多光阱时,单独监测第二光阱。例如,通过使用具有不同波长的检测器光束,可以克服具有最多两个不同偏振的单独光阱的限制。通过使一个捕获光束具有不同偏振,同时使一个或多个检测器光束与一个或多个其它捕获光束重叠,所需的检测器光束更少。例如,要监测三个或更多光阱中的两个,仅需要一个检测器光束。
有利地,三个或更多捕获光束的光可以具有相同的波长,例如,由单个光源产生。例如,通过使用一个或多个分束器,来自捕获光源的光可以分成两个或更多捕获光束。通过提供偏振分束器,源光束可以分成具有正交偏振的第一和第二捕获光束。例如,可以通过包括半透明反射面等的非偏振分束器,生成具有相同偏振方向的其它捕获光束。在将光束发送至样本体积之前,可以,例如,使用偏振和/或非偏振分束器组合光束。例如,非偏振光束组合器,如立方体等,可以用于组合具有相同波长和偏振的光束。
有利地,检测器光束的功率可以低于捕获光束。可以使用光束组合器将检测器光束与一个捕获光束重叠。通过在可控反射镜之前重叠光束,捕获光束的任意移动都自动伴随有检测器光束的相应移动。例如,可以用分色镜组合光束。可选地或额外地,检测器光束可以在可控反射镜之前插入分束器。如果需要,可以设置过滤器以确保只有一个捕获光束与检测器光束光重叠。通过提供具有与重叠的捕获光束相同偏振的检测器光束,检测器光束也可以通过偏振相关光学元件跟随捕获光束。
捕获光束可以,例如,通过可控反射镜和样本体积之间的物镜或其它透镜聚焦在样本体积内以形成光阱。有利地,物镜也可以用于将其它光束引导至样本体积中,如荧光显微镜的激发光束。进一步地,通过在可控反射镜和样本体积之间设置望远镜,可控反射镜旋转导致的角运动可以转化为在样本体积中的横向位移。优选地,用于聚焦捕获光束和检测器光束的光学构件尽可能地与波长无关,尤其是在使用不同波长的检测器光束时。除透镜外,可选地或额外地,可以使用曲面镜,如抛物面镜或球面镜聚焦和散焦光束。
通过提供至少四个光阱,可以独立操纵两个分子链。有利地,通过监测每个分子链的一个光阱,可以充分监测分子链上的力。因此,不需要监测所有四个光阱的力,并且可以使用相对简单的光学设置,例如,只使用一个检测器光束。例如,光检测器可以通过在第一检测器处测量具有第一偏振的光并且在第二检测器处测量具有检测器光束波长的光来监测至少两个光阱。通过为第一对光阱和第二对光阱提供个别聚焦控制(如单独的望远镜),可以使两个分子链在三维内相对移动。例如,第一和第二光阱焦面的位置可以相对于第三和第四光阱的焦面移动。可选地或额外地,每条分子链也可以使用多于两个光阱。例如,可以沿单个链的不同位置使用三个光阱,以使分子链折回到自身上。
应当理解的是,通过提供多个检测器光束和/或提供正交偏振的检测器光束,本公开可以应用于监测甚至更多光阱。两个或更多检测器光束可以,例如,通过彼此具有不同波长和/或偏振来区分。例如,可以通过将检测器光束的第一偏振与一个捕获光束重叠,并将检测器光束的第二偏振与另一个捕获光束重叠来监测两个光阱。可以通过波长过滤和偏振过滤的组合来隔离不同偏振的检测器光束。在该方案中,通过隔离所述捕获光束的不同(第一)偏振和波长,不用检测器光束即可监测第三光阱。除使用不同偏振的检测器光束外,替代地或可选地,不同波长也可以用于不同的检测器光束。检测器光束不需要太大功率,并且可以,例如,通过单独激光源和/或来自与捕获光束相同的激光源的非线性光学器件生成。
为了监测其它特性,如光阱保持的分子链之间或分子链内的相互作用,可以使用成像技术,如荧光显微技术或其它类型的(光学)标记。例如,激发光源可以构造为向样本体积提供激发光束,其中,分子链上的荧光团被激发光束激发产生荧光反应。荧光检测器可以构造为用于记录荧光反应,将其作为样本体积内位置的函数。有利地,发现本技术可以与荧光团在分子链上的聚焦激发相结合。由于一个或多个分子链保持在光阱的限定位置之间,激发焦点可以在光阱的所述位置之间扫描。为了改善背景抑制,可以使用共焦设置。焦点照明还可以提高分子成像的分辨率。为了进一步提高分辨率,可以使用损耗光束根据损耗曲线,即环形图,引发荧光团激发的受激发射损耗(sted)。通过在样本池,如流动池中提供样本体积,可以控制分子链的环境。例如,当微流体流动池将标记的蛋白质带到两个dna分子附近时,两个dna分子可以保持在一起。应当理解的是,本仪器允许在测量分子链之间和/或分子链与环境之间的相互作用时,对多个分子链,如dna进行可控操纵和监测。
本文所述的装置或方法可以用于,例如,相对于第二分子链定位第一分子链。该方法可以包括,例如,以上述方式提供至少四个捕获光束。用第一和第二光阱捕获沿第一分子链长度的两个位置,同时用第三和第四光阱捕获第二分子链。有利地,例如,可以通过测量力监测四个光阱中的至少两个。从而可以单独监测每条分子链上的力或张力。例如,通过沿分子链在特定位置或在分子链的一端或两端附接微球,可以捕获分子链。当分子链的第一部分被捕获时,分子链可以,例如,能够流拉伸,从而将第二部分朝第二光阱引导,定位在第一光阱下游。可以对多对光阱顺序或同时进行上述操作。为了检查分子链是否已经被捕获,例如,可以将光阱对分开,测量分子链上的力。当两个分子链被捕获时,一个或多个光阱可以设置为包括互相交叉或相交的分子链。例如,可以在三维内操纵第一和第二链以使其相互交叉,并随后将其合在一起以形成交叉点。每条分子链上的交叉点都可以通过光阱的相对定位控制。可选地或额外地,可以在一个或多个分子链上的特定位置设置标记,以方便分子链相对对准。可以在样本体积内提供与第一和/或第二分子链相互作用的其它分子,如蛋白质。如上所述,分子链彼此的相互作用和/或与其它分子的相互作用可以通过成像技术,如荧光显微技术和/或力位移测量监测。例如,可以在分子链上,如一对光阱之间的线上和/或交叉点附近,对样本体积内的激发焦点进行扫描。
附图说明
结合以下说明、所附权利要求和附图,可以更好地理解本发明所述装置、系统和方法的这些及其它特征、方面和优势。其中:
图1示意性示出多光阱控制装置的示例性实施例;
图2示意性示出更详细的实例;
图3a-3b示意性示出光学捕获和荧光成像的组合;
图4a-4c示意性示出用于同时捕获两条分子链的方法;
图5a-5c示意性示出用于交叉两条分子链的方法。
具体实施方式
除非另有说明,否则本文中使用的所有术语(包括技术和科学术语)均具有与根据说明书和附图背景所解读的本发明所属领域普通技术人员普遍理解的含义相同的含义。应当进一步理解的是,除非本文中明确说明,否则术语,如常用词典中定义的那些术语,应当理解为具有与其在相关技术背景下一致的意义,并且不应理解为具有理想化或过于正式的意义。在一些情况下,可能省略熟知设备和方法的详细描述,以免混淆本系统和方法的描述。本文所用术语的目的仅在于描述特定实施例,并非旨在限定本发明。在本文中,除非上下文有明确说明,否则使用单数形式“一”、“所述”旨在同样包括复数形式。术语“和/或”包括一个或多个相关条目中的任意一个及其所有组合。应当理解的是,术语“包括”和/或“包含”特指存在所述特征,但不排除存在或添加一个或多个其它特征。应当进一步理解的是,除非另有说明,否则当说到方法的特定步骤在另一步骤之后时,其既可以直接在所述另一步骤之后,也可以在执行所述特定步骤之前执行一个或多个中间步骤。类似地,应当理解的是,除非另有说明,当描述结构或构件之间的连接时,该连接既可以直接建立,也可以通过中间结构或构件建立。本文中提及的所有出版物、专利申请、专利及其它参考均整体以引用方式并入本文。在冲突的情况下,将以本申请文件(包括定义)为准。
本发明实现了多个光阱在三维内的连续生成和控制(无需声光偏转器——aod)。在一些方面,本发明可以作为利用光镊技术在三维内操纵多个(至少2个)dan分子的方法应用。两个或多个dna分子可以独立且以动态方式操纵,同时监测施加至每个分子上的力。当然,本发明的应用不限于dna,而是同样可以预见对其它线性分子或分子组装体的应用,包括但不限于,蛋白质、多糖、有机聚合物、碳纳米管和纤维无机材料。在分子链成像时,附接至分子链的分子(如蛋白质)也可以成像。为本方法和系统开发的光学设计可以允许与(荧光)显微技术和微流体方法整合为一体。这种整合可以允许改进dna事物领域的研究,如组织和修复。这样可以允许可视化和感知蛋白质如何介导dna分子之间的相互作用。
进一步的优势可包括,可以通过在同一实验同时使用多于一个dan底物增加单分子测量的数据吞吐量。进一步地,所述方法可以基于功率、波长和偏振分束的组合。这样可以实现激光在多个位置平均分布,同时保持每个光阱在各个位置持续存在(与分时共享法形成对照)。有利地,存在于样本中的所有光阱性能相同,并且珠粒(微球)持续被捕获。由于dna分子在溶液中悬浮,可以使用,例如,微流体方法,触发生化反应。可以将与多个dna分子同时相互作用时的各个dna分子和/或荧光蛋白可视化。
以下结合附图对本发明进行更充分地描述,附图中示出本发明的实施例。但是,本发明可以体现为许多不同形式并且不应该被理解为由本文中实施例限定。相反地,提供这些实施例以使本公开透彻完整,并向本领域技术人员充分传达本发明的范围。示例性实施例的描述旨在结合应视为整个书面说明书的一部分的附图进行阅读。在附图中,为了清晰,系统、构件、层和区域的绝对和相对尺寸可以放大。可以结合本发明可能的理想实施例和中间结构的示意图和/或横截面图来描述实施例。在说明书和附图中,一直采用相似标记指代相似元件。相关术语及其派生词应理解为表示当时所讨论的图中所描述或示出的方向。这些相关术语是为了方便描述,除非另有说明,否则不要求系统以特定朝向构造或操作。
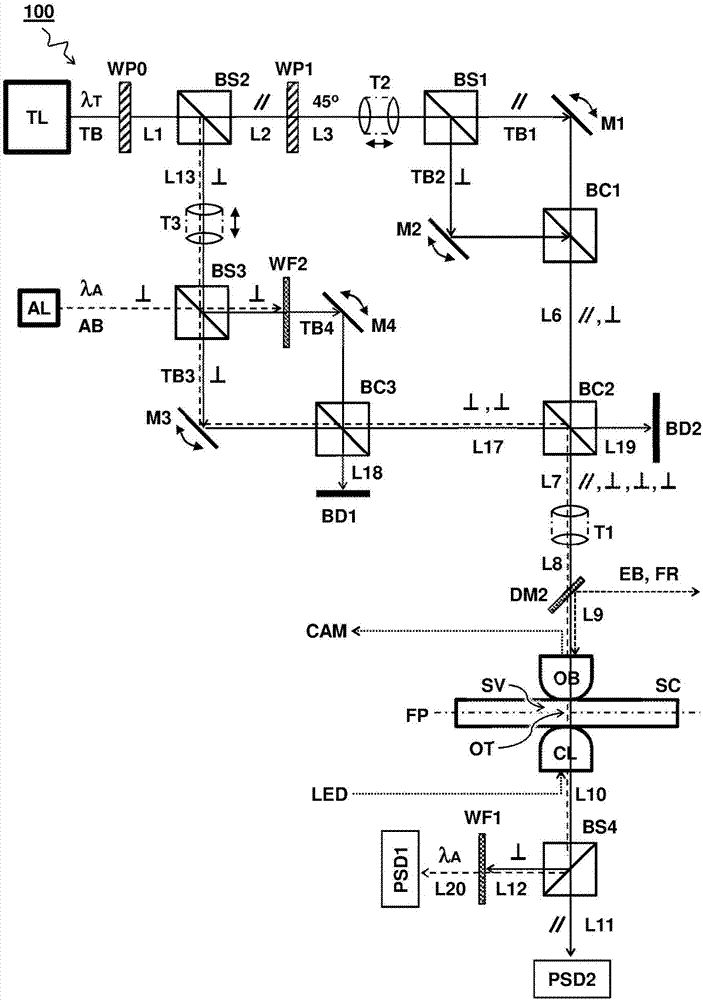
图1示出多光阱控制装置100的实施例。
在所示实施例中,装置包括捕获光束光学器件tl1、tl2、tl3,其构造为提供多个同时活动的捕获光束tb1、tb2、tb3。本文中使用的短语“同时活动”表示各个捕获光束可以在同一时间活动。这允许光束不间断地持续活动。持续活动的捕获光束构造可以与,例如,在不同时间间歇活动的分时共享光束构造区别开。通过提供持续活动的捕获光束,相应的光阱可以提供持续的力和/或改进的可靠性。
所述装置进一步包括:反射镜m1、m2、m3,其构造为接收并重新定向捕获光束tb1、tb2、tb3,以单独控制通过将重定向捕获光束聚焦在样本体积sv中形成的多个光阱ot1、ot2、ot3的各自位置。优选地,三个反射镜中的至少两个是可控制的以确定光束的相对位置。例如,反射镜m1可以是固定的。可选地,所有反射镜都是可控的。当然,可控反射镜可以包括任意光学和机械构件,用于控制捕获光束的方向和/或位置。反射镜优选为自动控制的。代替反射面,也可以使用反射元件来重新定向光束。可控反射镜通常包括致动器,如压电元件。
在所示实施例中,所述装置包括光检测器psd1、psd2。每个检测器构造为接收来自样本体积sv的对应于其中一个光阱ot3的部分光l11、l20。虽然可以提供单个检测器,但优选使用多个检测器来监测相应数量的光阱。检测器也可以部分或完全集成。例如,单个检测面可以检测多个光束,如在不同的传感器位置。检测器可以包括能够测量来自捕获光束和/或检测器光束的光的任意构件。例如,可以用像素或象限检测器或位敏检测器确定光束位置。
例如,检测器测量的光图案可以与物体(如位于光阱内或其附近的微球)的影响相对应。在一个实施例中,使用后聚焦面(bfp)干涉测量法确定珠粒或微球在光阱内的位置。在bfp干涉测量法中,珠粒散射的光与聚光镜(如聚光透镜cl)后聚焦面上捕获光束的其它光相互干涉。珠粒在光阱中的位置可以通过检测器上的干涉图案推断。从珠粒在光阱中的位置可以计算出施加在珠粒上的力。在珠粒大于焦点的实施例中,所有的光穿过珠粒,并且珠粒作为透镜,在(整个)光束从捕获焦点移位时使所述光束移位。除bfp检测外或代替bfp检测,珠粒还可以利用常规光照和相机成像。例如,在图2所示的实施例中,用led光源照射珠粒,得到的画面在相机cam上成像。
在所示实施例中,所述装置包括检测器光束光学器件al,其构造为使检测器光束ab的路径与其中一个捕获光束tb3重叠。通过在特定位置重叠两个光束并将所述光束设置为同一方向,通常可以实现对准。在一个实施例中,如图所示,检测器光束具有与重叠捕获光束tb3不同的波长λα。在一个实施例中,光检测器psd1构造为通过测量具有不同波长λα的检测器光束来监测光阱。可选地或额外地,检测器光束可以在其它方面不同于捕获光束,如偏振和/或(密度)(时间)调制。检测器光束的功率可以低于捕获光束,如低10%、5%或更少,如在0.001%~10%之间。在所示实施例中,所述装置包括波长过滤器wf,其设置在样本体积sv和光检测器psd1之间的光路中。波长过滤器wf构造为将具有检测器光束ab的波长λα的光传递至其中一个光检测器psd1。
在所示实施例中,捕获光束光学器件tl1、tl2、tl3构造为提供至少三个捕获光束tb1、tb2、tb3。第一捕获光束tb1设置为具有第一偏振(//),其它捕获光束tb2、tb3设置为具有第二偏振(⊥),第二偏振(⊥)与第一偏振(//)正交(例如,恰好或大约90°)。图中示出捕获光束光学器件为独立构件,但它们也可以部分或完全集成。捕获光束光学器件可以包括能够以期望偏振提供光束的任意构件或构件组合。所述构件可以包括一个或多个光源、偏振器、分束器、波片等。在一个实施例中,检测器光束光学器件al构造为使检测器光束ab与具有第二偏振(⊥)的一个其它捕获光束tb3重叠。在一个实施例中,检测器光束的波长λα不同于捕获光束tb2、tb3的波长。在一个实施例中,所述装置包括偏振过滤器pf,其设置在样本体积sv和第二光检测器psd2之间的光路中,并且构造为将具有第一偏振(//)的光传递至第二光检测器psd2。
在所示实施例中,所述装置包括光束组合器bc1、bc2,其设置在可控反射镜m1、m2、m3和样本体积sv之间的光路中。光束组合器构造为接收并组合来自可控反射镜的捕获光束tb1、tb2、tb3,并将组合的捕获光束朝样本体积sv引导。光束组合器可以,例如,包括颠倒构造的分束器。在一个实施例中,检测器光束光学器件包括光束组合器dm,其设置在捕获光源tl3和至少一个可控反射镜m3之间的光路中,可控反射镜m3对应于具有第二偏振(⊥)的一个其它捕获光束tb3。光束组合器包括反射面,其构造为将对准光束或捕获光束中的一个的透射与对准光束或捕获光束中另一个的反射重叠。例如,在所示实施例中,检测器光束光学器件包括分色镜dm,其设置在相应可控反射镜m3前方的其中一个其它捕获光束tb3的光路中。分色镜dm构造为反射检测器光束ab或捕获光束tb3中的一个,同时透射另一个。
在一个实施例中,所述装置包括非偏振光束组合器bc2,其构造为组合具有相同波长和偏振的两个或多个捕获光束。在另一个或进一步的实施例中,非偏振光束组合器bc2构造为组合具有相同波长的三个或多个捕获光束。由于光束组合器bc2是非偏振的,待组合的光束的偏振并不重要。相反地,偏振光束组合器(如图1中的bc1)只能用于组合两个具有不同偏振的光束。类似地,分色镜dm只能用于组合具有不同波长的光束。虽然非偏振光束组合器,如立方分束器,可能会(因反射)导致一些光束功率损耗,该构造可以有利地提供具有相同波长的三个或多个光束的精确组合和重叠。应当理解的是,因此,非偏振光束组合器能够为具有三个或多个同时活动光阱的本构造提供特别益处。
图2示出多光阱控制装置100的另一实施例。
在所示实施例中,捕获光束光学器件包括一个或多个分束器bs1、bs2、bs3。分束器构造为接收来自捕获光源tl的光束l1、l3、l13并将其拆分为两个或多个捕获光束tb1、tb2、tb3,并将捕获光束tb1、tb2、tb3朝相应的可控反射镜m1、m2、m3引导。在一个实施例中,至少一个分束器bs1包括偏振相关反射面,其构造为将来自捕获光源的光束l3拆分为具有第一偏振(//)的第一捕获光束tb1和一个具有第二偏振(⊥)的其它捕获光束tb2。在另一个或进一步的实施例中,至少一个分束器bs3包括半透反射面,其构造为将来自捕获光源的光束l13拆分为具有第二偏振(⊥)的两个其它捕获光束tb3、tb4。在一个实施例中,用于拆分来自捕获光源tl的光的分束器bs3构造为接收检测器光束ab并将检测器光束与至少一个拆分输出光束相组合。可选地,波长过滤器wf2可以设置在其中一个光束中,以防止检测器光束与第四捕获光束tb4传播。
所述装置还可以包括一个或多个光束组合器bc1、bc2、bc3。在一个实施例中,至少一个光束组合器bc1包括偏振相关反射面,其构造为将第一捕获光束tb1与一个或多个其它捕获光束tb2、tb3相组合。例如,光束组合器bc2可以包括颠倒构造的偏振分束器。在一个实施例中,至少一个光束组合器bc2包括半透反射面,其构造为将两个或多个其它捕获光束tb2、tb3相组合。例如,光束组合器bc2可以包括颠倒构造的非偏振分束器。
在所示实施例中,捕获光束光学器件包括捕获光源tl,其构造为向捕获光束提供捕获光。捕获光源可以集成在捕获光束装置100中或与之分离。在所示实施例中,检测器光束光学器件al包括对准光源al,其构造为向具有波长λα的检测器光束ab提供光,波长λα与捕获光的波长λt不同。对准光源可以集成在捕获光束装置100中或与之分离。对准光源可以与捕获光源一体形成。例如,来自单个光源的光可以,例如,通过非线性光学器件进行转换,从而提供具有不同波长λα、λt的光束。
在所示实施例中,检测器光束光学器件al构造为提供具有第二偏振(⊥)的检测器光束ab。在另一个或进一步的实施例中,偏振过滤器pf包括偏振分束器bs4,其构造为接收来自样本体积sv的光并将所述光拆分为具有第一偏振(//)的光束l11和具有第二偏振的光束l12。在另一个或进一步的实施例中,波长过滤器wf1设置在偏振分束器bs4和第二光检测器psd2之间,在具有第二偏振(⊥)的光束中。通过使检测器光束ab的偏振与第一光阱的偏振正交,偏振过滤器bs4可以同时过滤来自传递至检测器psd2的光束l11的对准光,而无需其它的波长过滤器。
在所示实施例中,所述装置包括物镜ob,其设置在可控反射镜m1、m2、m3和样本体积sv之间的光路中。物镜构造为接收捕获光束并将其聚焦在样本体积sv内,以形成光阱ot1、ot2。可选地或额外地,聚焦捕获光束也可以通过其它装置,如望远镜t1、t2和/或t3控制或实现。在所示实施例中,所述装置包括望远镜t1,其设置在可控反射镜m1、m2、m3和样本体积sv之间的光路中,并且构造为接收捕获光束tb1、tb2、tb3并将其朝样本体积sv重新定向。
在一个实施例中,例如,如图所示,所述装置包括至少四个可控反射镜m1、m2、m3、m4,用于控制至少四个光阱ot1、ot2、ot3、ot4的各自位置x、y。在另一个或进一步的实施例中,光检测器psd1、psd2构造为通过在第一检测器psd1处测量具有第一偏振(//)的光并且在第二检测器psd2处测量具有检测器光束波长λα的光来监测至少两个光阱。在另一个或进一步的实施例中,所述装置包括至少两个可控聚焦元件t2、t3,其中,第一聚焦元件t2构造为控制第一光阱ot1和第二光阱ot2的焦面的位置z,并且其中,第二聚焦元件t3构造为控制第三光阱ot3和第四光阱ot4的焦面的位置z。本文中使用xyz坐标系统的目的仅在于更好地说明相关位置和方向。当然,在不偏离本范围的情况下,也可以使用其它参考框架和坐标系统。
在一个实施例中(未示出),检测器光束光学器件构造为在相应可控反射镜前的光路中,将第一检测器光束与其它捕获光束中的第一捕获光束重叠,并且将第二检测器光束与其它捕获光束中的第二捕获光束重叠。第一和第二检测器光束可以具有彼此不同的波长和/或偏振。多个波长和/或偏振过滤器可以构造为(例如,在样本体积后方)隔离并单独测量所述两个或多个检测器光束。
独立于任何特定的硬件,本图还可以用于说明控制多个光阱(ot1、ot2、ot3)的相应方法。在一个实施例中,所述方法包括提供多个捕获光束(tb1、tb2、tb3)。所述方法可以进一步包括重新定向捕获光束(tb1、tb2、tb3),以单独控制通过将重定向捕获光束聚焦在样本体积(sv)中形成的多个光阱(ot1、ot2、ot3)的各自位置(x、y)。所述方法可以进一步包括接收来自样本体积(sv)的与光阱相对应的光(l11、l20)。所述方法可以进一步包括使检测器光束(ab)的路径与其中一个捕获光束(tb3)的路径重叠。在一个实施例中,检测器光束具有与重叠捕获光束(tb3)不同的波长(λα)。所述方法可以进一步包括根据波长过滤来自样本体积的光,并在第一通道内仅测量具有检测器光束(ab)的波长(λα)的滤过光。
在一个实施例中,所述方法包括提供至少三个捕获光束(tb1、tb2、tb3)。在进一步的实施例中,捕获光束中的第一捕获光束(tb1)设置为具有第一偏振(//),其它捕获光束(tb2、tb3)设置为具有第二偏振(⊥),第二偏振(⊥)与第一偏振(//)正交。在一个实施例中,检测器光束(ab)与具有第二偏振(⊥)的其中一个捕获光束(tb3)重叠,其中,检测器光束(ab)的波长(λα)不同于所述其它捕获光束(tb2、tb3)的波长。在一个实施例中,根据偏振过滤来自样本体积的部分光,并且第二通道仅用于测量具有第一偏振(//)的滤过光。
在所示实施例中,样本体积sv内设置有可选的激发光束eb。激发光激发荧光团fl可以导致能够记录的荧光反应fr。激发光束eb和/或荧光反应fr可以通过一个或多个分光镜,如本实施例中的dm2,耦合在样本内。在所示实施例中,光学led光源和相机cam用于将样本体积进一步成像。例如,相机可以包括ccd传感器。成像可以包括检测由光阱保持的珠粒。
参见所示特定实施例,偏振分束器bs1构造为接收捕获光l1的第一部分l3,并将第一部分l3拆分为一对正交偏振光束l4、l5。在该实施例中,提供第一可控反射镜m1和第二可控反射镜m2,其中,所述对可控反射镜m1、m2中的每一个构造为分别重新定向所述对正交偏振光束l4、l5中的一个,以分别操纵第一光阱ot1和第二光阱ot2的位置x、y。第一光束组合器bc1构造为接收第一对正交偏振光束l4、l5并输出组合光束l7。物镜ob构造为接收组合光束l7并将其聚焦在样本体积sv内以形成光阱。聚光透镜cl构造为在横穿样本体积sv后收集捕获光。偏振过滤器bs4构造为将收集的捕获光l10拆分为第二对正交偏振光束l11、l12。一对光检测器psd1、psd2构造为分别接收来自第三分束器bs4的第二对正交偏振光束l11、l12的至少部分l11、l20的相应位置x、y。所示装置包括第三可控反射镜m3,其构造为重新定向光束l14,以操纵第三光阱ot3。第四分束器bs4构造为将捕获光l1拆分为第一部分l3和第二部分l13,第一部分l3发送至第一和第二可控反射镜m1、m2,第二部分l13发送至第三可控反射镜m3。对准光源al构造为提供具有波长λα的检测器光束ab,波长λα与捕获光l1的波长λt不同。检测器光束与捕获光l1的第二部分l11对准,第二部分l11发送至第三可控反射镜m3并由第三可控反射镜m3重新定向。第二光束组合器bc2构造为组合来自可控反射镜m1、m2、m3、m4的光束。过滤器f2构造为将对准光l20传递至检测器psd1,同时过滤捕获光。
图3a示出可以与本捕获方法结合使用的一个或多个分子链的成像系统和方法实施例。图3b示出分子链ms。虽然图中示出单个分子链,所述系统也可以顺序或同时成像多个分子链。
根据一种实现方式,所述方法包括:提供包括一个或多个分子链ms的样本体积sv。样本体积sv中设置有,例如,具有激发焦点ef的激发光束eb,其中,当激发光束或激发焦点ef与荧光团fl重合时,分子链ms上的荧光团fl被激发光束或激发焦点ef激发会导致荧光反应fr。在一个实施例中,所述方法包括:扫描样本体积sv中的激发焦点ef。所述方法可以包括:捕获样本体积内的部分分子链ms,并使分子链ms沿捕获线ll延伸。所述方法可以包括:对准捕获线ll使其与扫描线sl重合,从而使扫描激发焦点ef与分子链ms重合。所述方法可以包括:将荧光反应fr记录为激发焦点ef沿扫描线sl的多个不同扫描位置x0的函数。
在一个实施例中,所述方法进一步包括:提供具有损耗焦点df的损耗光束db,损耗焦点df的损耗曲线与激发焦点ef的激发曲线重合,以及,根据损耗曲线产生荧光团fl激发的受激发射损耗(sted)。损耗曲线在激发焦点ef中央具有最小密度,以通过受激发射损耗(sted)减小受激荧光团的曲线尺寸(即自发荧光的发射曲线)。受激发射损耗(sted)显微技术是一种通过选择性地使荧光团失活来提供超分辨率的过程。利用这种方法,可以绕过常规显微技术的衍射极限以达到更好的分辨率。
如本文所述,所述方法可以包括:提供多个光阱ot以捕获附接至一个或多个分子链上多个位置的珠粒bd(如微球)。光阱ot可以设置为在各对珠粒bd之间形成多个捕获线,并且可以用于促进一个或多个捕获线ll排列成与一个或多个扫描线sl重合。
在一个实施例中,荧光反应fr记录在像面ip上。像面ip为样本体积sv中物面op的共轭焦面op*。物面op在第一方向x和第二方向y上延伸。激发焦点ef和捕获线ll对准至与物面op重合。像面ip中设置有空间针孔。空间针孔对准至与激发焦点ef的共轭焦点ef重合,以通过空间针孔将荧光反应fr传递至荧光检测器fd。
例如,与宽场照射相比,使用点聚焦照射可以照射样本体积的特定部分。这样,由于焦点处的较高密度,可以获得更高的信号,并且/或得到的信号可以与焦点位置相关联。在本实例中,荧光团由聚焦在分子链上的激发光照射。代替荧光,也可以采用其它(可选)机制和显微方法通过点聚焦照射探测分子链,如涉及拉曼光谱学,如cars(相干反斯托克斯拉曼光谱)显微技术等。可选地或额外地,可以使用非线性光学过程,如双光子激发。
在一个实施例中,沿例如对应于一个或多个捕获分子链的一个或多个扫描线,来回反复扫描激发焦点ef。可以在沿扫描线sl的多个不同扫描位置x0之间区分荧光反应fr,并将荧光反应fr通过多次扫描集成并且/或作为时间的函数记录。可选地或额外地,激发焦点ef可以将扫描集中在特定区域,如分子链之间的交叉点上或其附近。
所述方法可以由用于分子链ms成像的系统执行。在一个实施例中,所述系统可以包括样本池sc,其设置为提供包括一个或多个分子链ms的样本体积sv。所述系统可进一步包括激发光源el,其设置为用于在样本体积sv内提供具有激发焦点ef的激发光束eb,其中,当激发焦点ef与荧光团fl重合时,分子链ms上的荧光团fl被激发焦点ef激发会导致荧光反应fr。所述系统可以进一步包括光束扫描器m5,其设置为,例如,沿扫描线sl,扫描样本体积sv内的激发焦点ef。所述系统进一步包括光阱tl,其设置为用于捕获样本体积sv内分子链ms的端部或其它部分,并且,例如,使分子链ms沿平行于扫描线sl的捕获线ll延伸。所述系统进一步包括光束对准器(如通过控制反射镜m3与望远镜t1和/或t4形成),其设置为将捕获线ll对准至与扫描线sl重合,从而使扫描激发焦点ef与分子链ms重合。所述系统可以进一步包括荧光检测器fd,其设置为将荧光反应fr记录为激发焦点ef沿扫描线sl的多个不同扫描位置x0的函数。
在一个实施例中,所述系统进一步包括损耗光源dl和损耗光束光学器件m3、t3。损耗光源dl和损耗光束光学器件m3、t3设置为用于提供具有损耗焦点df的损耗光束db,损耗焦点df的损耗曲线与激发焦点ef的激发曲线重合,并且,根据损耗曲线产生荧光团fl激发的受激发射损耗(sted)。损耗曲线在激发焦点ef中央具有最小密度,以通过受激发射损耗(sted)减小受激荧光团的曲线尺寸(sizeoftheprofile)。
在一个实施例中,所述系统包括损耗焦点整形器pp,其设置为用于损耗曲线的整形,其中,损耗曲线包括垂直于捕获线ll延伸的最小密度平面。例如,如klar等人在文章中说明的那样(physicalreviewe,volume64,066613,"breakingabbe'sdiffractionresolutionlimitinfluorescencemicroscopywithstimulatedemissiondepletionbeamsofvariousshapes"),损耗焦点整形器pp可以,例如,包括相位板,其设置在损耗光束db中,用于损耗焦点曲线的整形。除相位板外,也可以使用其它方式实现sted焦点曲线,例如,将来自不同方向的两个连贯sted光束交叉以在光束之间提供线型干涉图案,或通过自适应光学器件。
在一个实施例中,光阱包括捕获光源tl和捕获光束光学器件(例如,上文中所述的光学器件),所述光学器件设置为用于提供光阱ot以捕获附接至分子链ms不同位置,如端部的珠粒bd。在使用中,光阱ot可以沿第一方向x设置,以在珠粒bd之间形成捕获线ll。
荧光团(或荧色物)是可以在受到光激发时再发射光的荧光化合物。针对本发明的目的,其可以包括,例如,量子点。荧光团通常会吸收特定波长的光能并以更长的波长发射光。在一个实施例中,分子链包括并且/或绑定至荧光团,以提供分子链的方便可视化。在一个实施例中,使用荧光染色方案为分子链染色。可以使用任意已知或有待研发的染色方案。可选地或额外地,除染色方案外,分子链自身也可以是荧光的,例如,包括一个或多个荧光部分。可选地或额外地,待研究的荧光反应物,如荧光蛋白质,可以绑定至分子链。这样,例如,分子链可以通过其自身的荧光性直接成像或通过绑定有荧光团的荧光分子间接成像。
在所示实施例中,光束tb、eb、fr和db用分色镜d1、d4、d7进行组合或拆分。当然,也可以使用其它方式组合/拆分光束,如纤维和/或衍射/折射光学器件,如棱镜和光栅。在所示实施例中,捕获光束tb由捕获光束检测器td检测,例如,以确定施加在分子链上的力。一旦分子链被捕获,该检测器也可以省略或关闭。
图4a-4c示出相对于第二分子链ms2定位第一分子链ms1的方法,其可以,例如,使用本发明的方法和系统执行。
在图中,所述方法包括提供本文中所述的四个捕获光束ot1、ot2、ot3、ot4。用第一和第二光阱ot1、ot2捕获沿第一分子链ms1长度的两个位置。用第三和第四光阱ot3、ot4捕获沿第二分子链ms2长度的两个位置。当然,光阱也可以以图示之外的其它构造与分子链组合,例如,分子链ms1可以由ot1和ot3捕获,而ms2可以由ot2和ot4捕获。
有利地,分子链承受或施加的力可以以下述方式监测。例如,第一或第二光阱ot1、ot2的捕获光束具有不同于其它捕获光束的第一偏振(//),以通过选择性地测量具有第一偏振(//)的光测量第一分子链ms1上的力。此外,第三或第四光阱ot3、ot4的捕获光束与检测器光束重叠,以通过选择性地测量具有检测器光束波长的光测量第二分子链ms2上的力。
如图4a所示,所述方法可以包括用第一光阱ot1捕获第一分子链ms1上的第一位置,用第三光阱ot3捕获第二分子链ms2上的第一位置,以及提供流fd以伸展第一和第二分子链ms1、ms2。在一个实施例中,如图4b所示,第二和第四光阱ot2、ot4设置在流fd下游,以捕获各分子链的另一部分。在一个实施例中,如图4c所示,当测量具有第一偏振(//)的光以测量第一分子链ms1上第一和第二光阱ot1、ot2之间的力时,第一和第二光阱ot1、ot2分开。在另一个或进一步的实施例中,当测量具有检测器光束波长的光以测量第二分子链ms2上第三和第四光阱ot3、ot4之间的力时,第三和第四光阱ot3、ot4分开。
图5a-5c示出使第一分子链ms1和第二分子链ms2交叉的方法。
在图5a所示的实施例中,第一和第二光阱ot1、ot2的焦面设置为在样本体积中具有第一深度z=1,而第二和第三光阱ot3、ot4的焦面设置为在样本体积sv中具有第二深度z=2,第二深度z=2不同于第一深度z=1。在图5b所示的实施例中,一个或多个光阱在各自焦面内沿侧向x、y移动,直到在一个焦面的投影图中,第一分子链ms1的长度与第二分子链ms2的长度交叉。在图5c所示的实施例中,第一分子链ms1和第二分子链ms2的焦面之间的距离z降低。其它构造也是有可能的,例如,其中,只有一个光阱的焦面变化,同时其它光阱的焦面保持不变。
在一个实施例中,焦面之间的距离z降低,以使第一分子链ms1和第二分子链ms2互相交叉。在一个实施例中,相对于第三和第四光阱ot3、ot3的侧向位置x、y控制第一和第二光阱ot1、ot2的侧向位置x、y,以使交叉点poi位于第一分子链ms1的预定位置和第二分子链ms2的预定位置。
在一个实施例中,在样本体积sv内提供与第一和/或第二分子链ms1、ms2相互作用的其它分子pr(如蛋白质)。
在一个实施例中,在沿第一分子链ms1的位置提供第一荧光标记ma1,并且在沿第二分子链ms2的位置提供第二荧光标记ma2。在进一步的实施例中,记录荧光图像以测量第一和第二荧光标记ma1、ma2的相对位置。在进一步的实施例中,根据测量的第一和第二荧光标记ma1、ma2的相对位置,光阱移动至将第一分子链ms1相对于第二分子链ms2对准。当然,也可以使用其它方法对准一个或多个分子链。
为了使描述清楚简洁,本文中描述的特征均作为相同或独立实施例的一部分,但是,应当理解的是,本发明范围可以包括具有所有或一些所描述特征组合的实施例。应当理解的是,虽然示出的示例性实施例是针对用于捕获和监测分子链的方法和系统,本领域技术人员同样能够想到为了实现类似功能和结果而具有本公开益处的其它替代方式。例如,光学和/或电学构件可以组合或拆分成一个或多个替代构件,例如,用曲面镜代替透镜或额外使用曲面镜、使用不同检测器或光源等。所讨论并示出的实施例的各种元件提供某些优点,如面向一个或多个分子尺寸链成像的高精确度和控制。当然,应当理解的是,上述任意一个实施例或过程可以与一个或多个其它实施例或过程相结合,以在发现和匹配设计中提供进一步改进和优势。应当理解的是,本公开内容为分子生物学的研究提供了特别优势,并且通常可以在操纵和/或监测分子尺寸的物体时应用。
尽管已经参照本发明的具体示例性实施例对本系统和方法进行了特别的详细描述,但还应当理解的是,本领域普通技术人员可以在不偏离本公开范围的情况下设计出许多修改和替代实施例。例如,公开为了执行特定方法或功能而布置和/或构造的设备或系统的实施例固有公开了该方法或功能,以及/或与其它公开的方法或系统的实施例相结合的方法或功能。此外,认为方法实施例固有公开其硬件的实现,其中,在可能的情况下,结合其它公开的方法或系统的实施例。此外,认为,例如,可以在非瞬时计算机可读存储介质上,体现为程序指令的方法固有公开为此类实施例。
最后,上述讨论旨的目的仅在于对本系统和/或方法的说明,并且不应理解为将所附权利要求限制于任何具体实施例或实施例组。因此,说明书和附图被视为说明性的,而非意在限制所附权利要求的范围。在解释所附权利要求时,应当理解的是,除非另有说明,否则词语“包括”不排除给定权利要求中所列出的元件或行为外其它元件或行为的存在;元件之前的词“一”或“一个”不排除存在多个这样的元素;权利要求中的任何附图标记均不限制其范围;几种“方式”可以由相同或不同项目或实现结构或功能表示;任意公开装置或其部分可以组合在一起或分离成其它部分。某些措施被记载在互不相同的从属权利要求中的事实不表示这些措施的组合不能被用于获得优势。特别地,权利要求的所有工作组合被认为是固有公开的。
- 还没有人留言评论。精彩留言会获得点赞!