微流控芯片和温敏材料复合系统及其制备方法和应用
本发明属于生物医学及其检测技术领域,涉及一种新的用于捕捉/分离/分析血液中循环肿瘤细胞的系统,具体为微流控芯片和温敏材料复合系统及其制备方法和应用。
背景技术:
循环肿瘤细胞(circulatingtumorcell,ctc),是指自发或手术、放化疗后,由肿瘤或转移病灶释放,进入外周血循环的肿瘤细胞,在一定条件下可发展为转移性病灶,是癌症患者出现术后复发和转移的主要原因。临床研究证实,外周血中的肿瘤细胞数量越多,患者生存期越短。目前已有证据显示,外周血循环肿瘤细胞的数目可以成为实体瘤患者预后和化疗有效性的预测指标。在一些患者体内,循环肿瘤细胞可能长期存在,成为潜在的复发病灶。相对于在外周血大量存在的白细胞和红细胞,ctc在外周血的含量较少。因此,开发一种能高精度、高敏感度捕捉并能够有效释放ctc的方法对于后续的计数、分子功能分析都有重大意义。
目前对于ctc的捕捉主要可以分为两大类。一类是基于ctc与血液中其他细胞成分物理性质的不同,如密度、大小、表面所带电荷不同来实现ctc和其他血液成分的分离。但由于血细胞的大小分布不均一,癌细胞的大小也会随着肿瘤细胞来源不同而变化,因此根据物理性质进行分离所得的ctc纯度不高,对后续的分析会造成一定困难。另一类是基于ctc的表面特异性抗原,如上皮细胞抗原epcam,肿瘤特异性标志物(如psa,cea,her-2等)。在这一类别中最具有代表性的是已被美国fda批准的cellsearchtm系统,该系统应用标记epcam抗体的磁珠捕获ctc,可用于检测乳腺癌、前列腺癌和结直肠癌患者外周血ctc。但该系统的捕获效率较低,较大程度存在血细胞的非特异性吸附,且所捕获的ctc已经失活,无法进行进一步的功能性分析和体外培养,并且常常存在假阳性和假阴性的问题。目前已有一些研究将微流控芯片与抗体捕获相结合增加了捕获细胞的几率,同时保留了细胞活性。但是这些方法也存在着一些问题,如白细胞的非特异性吸附,ctc与抗体结合后很难洗脱下来进行进一步分析等。
技术实现要素:
解决的技术问题:为了克服现有技术的不足,构建一种能够快速准确的从血液中捕捉、分离循环肿瘤细胞的系统,且对所捕获的细胞易于洗脱释放,便于后续对细胞的分析、培养等操作,本发明提供了微流控芯片和温敏材料复合系统及其制备方法和应用。
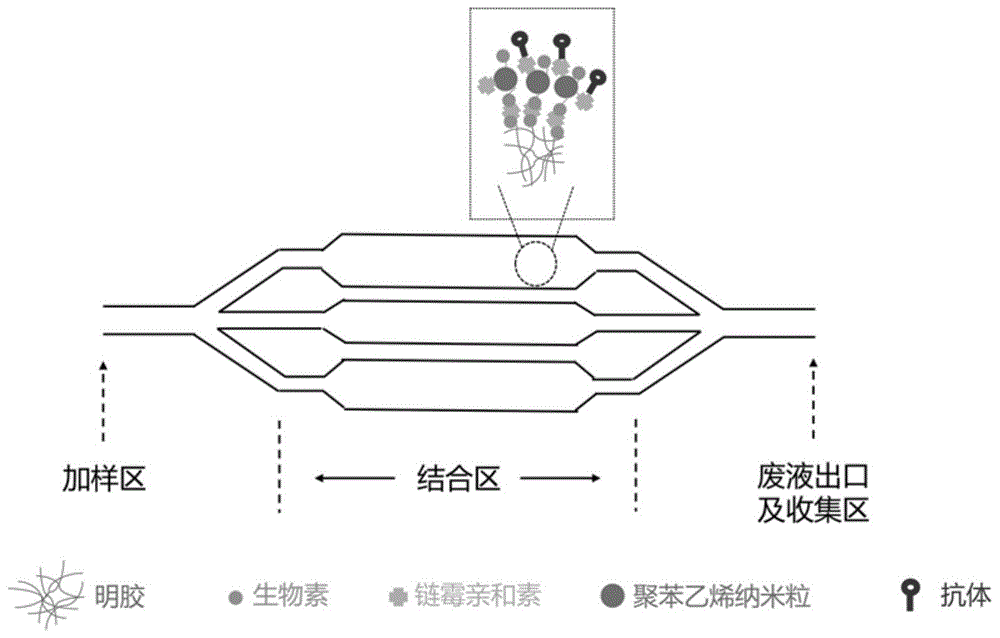
技术方案:微流控芯片和温敏材料复合系统,所述系统以鱼骨形微流控芯片为骨架,并对芯片内部进行改造,改造后的微流控芯片内部负载有温敏材料,所述系统以细胞骨架相关蛋白4作为检测指标。
优选的,所述温敏材料为表面包被生物素-fitc和链霉亲和素的聚苯乙烯。
以上任一所述微流控芯片和温敏材料复合系统的制备方法,所述方法包括以下步骤:
s1、将明胶溶液采用n-羟基磺酸基琥珀生物素(sulfo-nhs-biotin)功能化,并将溶液ph调至7.4,37℃下反应;反应结束后置于蒸馏水中透析,然后制成冻干粉;
s2、在聚苯乙烯表面包被生物素-fitc和链霉亲和素,制成纳米粒;
s3、采用s1的明胶冻干粉对微流控芯片内部进行改造;
s4、将s2制得的聚苯乙烯纳米粒注入改造后的微流控芯片内;
s5、将细胞骨架相关蛋白4抗体注入s4所得的微流控芯片内,待抗体与芯片内表面结合后用pbs缓冲液洗去未结合抗体,即制得微流控芯片和温敏材料复合系统。
优选的,其特征在于,s1中置于蒸馏水中透析48h以上,且每隔12h更换一次蒸馏水。
优选的,s3中改造的具体步骤如下:
(1)采用血浆对微流控芯片内部进行活化,然后将明胶-生物素溶液注入活化后微流控芯片内,静置反应,然后用pbs缓冲液冲洗干净;
(2)将链霉亲和素溶液注入步骤(1)处理后的微流控芯片内,静置孵育;
(3)重复以上步骤至少4次,以在微流控芯片内部形成多层明胶包被。
优选的,明胶-生物素溶液的质量浓度w/v为1%,链霉亲和素的质量浓度为100μg/ml。
优选的,s5中细胞骨架相关蛋白4抗体的质量浓度为20μg/ml。
以上任一所述微流控芯片和温敏材料复合系统在制备捕捉血液中肺癌循环肿瘤细胞的试剂盒中的应用。
以上任一所述微流控芯片和温敏材料复合系统在制备分离血液中肺癌循环肿瘤细胞的试剂盒中的应用。
以上任一所述微流控芯片和温敏材料复合系统在制备分析血液中肺癌循环肿瘤细胞的试剂盒中的应用。
以上应用中,将待测血液以2-200μl/min的速度从芯片注入口缓慢注入芯片。为了将捕获的ctc从芯片内表面脱离下来进行进一步的生物学分析,采用如下步骤:将微流控芯片加热至37℃,并保持10min;10min后,将脱离下来的细胞用pbs缓冲液2ml/l流速进行冲洗,在微流控芯片出口处收集细胞。
所述微流控芯片和温敏材料复合系统的工作原理在于:通过对微流控芯片进行改造,负载捕获ctc的纳米粒和温敏材料,纳米粒实现高效捕获ctc,然后通过温敏材料的响应释放捕获的ctc用于后续的分析。
有益效果:(1)本发明所述系统能够快速准确的从血液中捕捉、分离循环肿瘤细胞,其捕捉效率高、特异性好,平均捕获率达95%以上;(2)所述系统对于已捕获的循环肿瘤细胞易于洗脱,便于后续的分析、培养,平均释放率达97%以上;(3)所述系统操作简便,重复性好。
附图说明
图1是本发明所述复合系统的制备方法示意图;
图2本发明中复合系统的ctc捕获率;
图3本发明中复合系统捕捉的ctc,经洗脱细胞的释放染色图;
图4本发明中复合系统捕捉血液中ctc经洗脱收集的细胞分析进行甩片染色,(a)多核ctc(b)ctc团簇。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改和替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1
如图1所示,采用以下方法制备微流控芯片和温敏材料复合系统:
s1、将sulfo-nhs-biotin加入4%的明胶溶液中,使明胶功能化;将溶液ph调至7.4,37℃下反应2h;将反应后的溶液在蒸馏水中透析48h,蒸馏水每12h换一次;将溶液冻干,在4℃冰箱保存;
s2、在聚苯乙烯表面包被生物素-fitc和链霉亲和素,制成纳米粒,使其具有结合能力;
s3、采用s1的明胶冻干粉对微流控芯片内部进行改造;具体步骤如下:
(1)采用血浆对微流控芯片内部进行活化,然后将1%(w/v)明胶-生物素溶液注入活化后微流控芯片内,静置反应15min,然后用pbs缓冲液冲洗干净;
(2)将100μg/ml链霉亲和素溶液注入步骤(1)处理后的微流控芯片内,静置孵育15min;
(3)重复以上步骤至少4次,以在微流控芯片内部形成多层明胶包被。
s4、将s2制得的聚苯乙烯纳米粒注入改造后的微流控芯片内;
s5、将20μg/ml细胞骨架相关蛋白4抗体注入s4所得的微流控芯片内,待抗体与芯片内表面结合后用pbs缓冲液洗去未结合抗体,即制得微流控芯片和温敏材料复合系统。
实施例2
采用实施例1所述系统捕捉肺癌细胞,具体步骤如下:
(1)取100个荧光标记的人肺癌细胞分散于1mlpbs缓冲液中,将细胞悬液以100μl/min的速度从芯片注入口缓慢注入芯片;
(2)再以100μl/min的速度用pbs缓冲液对芯片进行冲洗,去除未结合的细胞;
(3)将芯片于倒置荧光显微镜下进行细胞计数,如图2所示,平均捕捉率可达95%以上;
(4)为了证明该芯片可以有效释放捕捉到的肿瘤细胞,将微流控芯片加热至37℃,并保持10min;10min后,将脱离下来的细胞用pbs缓冲液2ml/l流速进行冲洗,在微流控芯片出口处收集细胞,并进行细胞计数,平均释放率可达97%以上;洗脱后释放的细胞如图3所示。
实施例3
采用实施例1所述系统分离血液中肺癌循环肿瘤细胞,具体步骤如下:
(1)取患者血样5ml,以150μl/min的速度从芯片注入口缓慢注入芯片。
(2)再以100μl/min的速度用pbs缓冲液对芯片进行冲洗,去除血细胞和其他未结合的细胞;
(3)为了将捕获的ctc从芯片内表面脱离下来进行进一步的生物学分析,采用如下步骤:将微流控芯片加热至37℃,并保持10min;10min后,将脱离下来的细胞用pbs缓冲液2ml/l流速进行冲洗,在微流控芯片出口处收集细胞。
(4)分析洗脱下来的细胞:对细胞进行甩片染色,观察细胞的形态学特征和核染色,鉴别血液中的单核、多核ctc(图4a)及ctc团簇(图4b)。
- 还没有人留言评论。精彩留言会获得点赞!