CO2加氢合成甲醇膜反应器及总熵生产率最小优化方法
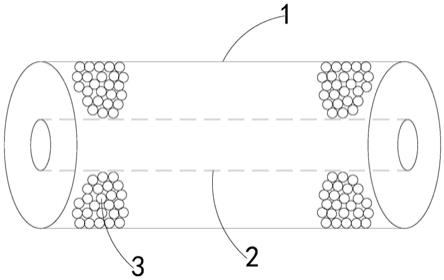
co2加氢合成甲醇膜反应器及总熵生产率最小优化方法
技术领域
1.本发明涉及co2加氢合成甲醇技术领域,尤其涉及一种co2加氢合成甲醇膜反应器及总熵生产率最小优化方法。
背景技术:
2.甲醇广泛应用于化工行业,可用于合成甲醛和醋酸等化学衍生物。甲醇还广泛应用于能源领域,它的辛烷值高,燃烧效率高;它在常温下是液体,可以作为储氢的载体。此外,它还是生物柴油和甲醇燃料电池的关键组成部分。甲醇合成工艺包括天然气合成甲醇、煤制甲醇、页岩气合成甲醇、生物制合成甲醇和等。由于天然气清洁且储量丰富,因此天然气合成甲醇在化工生产中占据重要地位。
3.在天然气合成甲醇的工艺流程中,天然气可通过水蒸气重整转化为富含甲烷、氢气(h2)、一氧化碳、氮气和co2的合成气,合成气在高压中温条件下合成甲醇。现有技术公开了对包含co2回收单元的天然气合成甲醇工艺流程进行了炯分析,结果表明优化甲烷蒸汽重整单元和甲醇合成单元具有提升整体性能的潜力。提高co2加氢合成甲醇(methanol synthesis via co2hydrogenation,msch)反应器的性能有利于天然气合成甲醇工艺流程的性能。受热力学平衡限制,msch反应器的甲醇产率和co2转化率依然较低。基于此,有必要对现有的反应器结构进行改进。
4.同时,基于经典热力学的msch反应器和膜反应器的研究不涉及化学反应速率的概念,而实际化学反应均是在“有限时间”内或“有限面积”上进行“有限速率”的反应。因此,迫切需要利用有限时间热力学对实际化学反应器进行研究。有限时间热力学是20世纪70年代由芝加哥学派创立的一个现代热力学分支(工程界也称为“熵产最小化”理论,通过将热力学、传热学、流体力学和化学反应动力学等传输科学的基础理论相结合,在“有限时间”或“有限尺寸”约束下,利用最优控制理论等方法求解各类能量转换装置在不同优化目标时的最优性能和最优构型。
5.在msch膜反应器的有限时间热力学研究方面,现有技术公开建立了msch膜反应器的一维瞬态模型,以甲醇产率最大为优化目标,在最大反应温度的约束下,得到了反应进口温度、冷却气进口温度和膜厚度的最优值。
6.熵产生率表征了反应器内不可逆过程的不可逆程度。根据gouy
‑
stodola理论可知,不可逆过程的内部炯损等于环境温度与过程熵产的乘积。现有技术还公开了以msch反应的熵产生率最小和总熵产生率最小为优化目标,利用非线性规划和最优控制方法,在甲醇收率固定的约束下,对msch反应器进行最优构型优化设计。
7.然而,目前并没有公开对msch膜反应器的总熵产生率最小的最优构型优化设计。
技术实现要素:
8.有鉴于此,本发明提出了一种co2加氢合成甲醇膜反应器及总熵生产率最小优化方法,以解决现有技术中的甲醇产率和co2转化率较低的技术问题。
9.第一方面,本发明提供了一种co2加氢合成甲醇膜反应器,包括:
10.反应管;
11.渗透管,其同轴设置在反应管内,所述渗透管的材料为羟基方钠石渗透膜,所述反应管与所述渗透管之间填充有催化剂。
12.可选的,所述的co2加氢合成甲醇膜反应器,所述催化剂为cuo/zno/al2o3催化剂。
13.第二方面,本发明还提供了一种所述的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,其特征在于,包括以下步骤:
14.向反应管中通入合成气,合成气在催化剂的作用下反应生成甲醇,反应中生成的水蒸气进入渗透管,渗透管内的水蒸气由吹扫气带出渗透管;
15.计算反应管管外热源与反应管内混合物之间的传热过程引起的局部熵产生率;
16.计算反应管内混合物和渗透管内混合物之间的传热过程引起的局部熵产率;
17.计算反应管内反应过程引起的局部熵产生率;
18.计算反应管内混合物粘性流动过程引起的局部熵产生率;
19.计算反应管内混合物和渗透管内混合物之间传质过程引起的局部熵产生率;
20.将上述各步骤中的局部熵产生率求和得到局部总熵产生率,局部总熵产生率在反应器轴向积分可得到总熵产生率;
21.以固定的甲醇收率为约束,以总熵产生率最小为优化目标,得到最优的反应管管外热源温度。
22.可选的,所述的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,反应管管外热源与反应管内混合物之间传热过程引起的局部熵产生率的计算方法采用以下公式:
23.σ
ht,r
=πd
ri
j
q,r
(1/t
rm
‑
1/t
a
)
24.其中,σ
ht,r
为反应管管外热源与反应管内混合物之间传热过程引起的局部熵产生率;d
ri
表示反应管内径;t
a
表示反应管管外热源温度;t
rm
表示反应管内混合物温度;j
q,r
表示通过反应管内壁的热流密度,其计算公式为:j
q,r
=u
r
(t
a
‑
t
rm
),u
r
表示为反应管管外热源和反应管内混合物之间的换热系数。
25.可选的,所述的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,反应管内混合物和渗透管内混合物之间的传热过程引起的局部熵产生率的计算方法采用以下公式:
26.σ
ht,m
=πd
mo
j
q,m
(1/t
mm
‑
1/t
rm
)
27.其中,σ
ht,m
表示反应管内混合物和渗透管内混合物之间的传热过程引起的局部熵产生率;d
mo
表示渗透管外径;t
mm
表示渗透管内混合物温度;j
q,m
表示通过渗透管的热流密度,其计算公式为:j
q,m
=u
m
(t
rm
‑
t
mm
),u
m
表示反应管内混合物与渗透管混合物之间的换热系数。
28.可选的,所述的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,计算反应管内反应引起的局部熵产生率具体包括:
29.反应管内发生的反应包括甲醇合成反应和逆水气变换反应,其中,甲醇合成反应为
30.逆水气变换反应为
31.反应管内反应引起的局部熵产生率的计算公式为
32.其中,i=1,2,为反应管内反应引起的局部熵产生率,ρ
c
为催化剂的颗粒密度,a
c,r
为反应管的截面积,ε
b
为催化剂床层孔隙率,η
i
为内扩散有效因子,r1为甲醇合成反应的反应速率,r2为逆水气变换反应的反应速率,
‑
δ
r
g1为甲醇合成反应的吉布斯自由能,
‑
δ
r
g2为逆水气变换反应的吉布斯自由能。
33.可选的,所述的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,反应管内混合物粘性流动引起的熵产生率的计算方法采用以下公式:
[0034][0035]
其中,c
rm
表示反应管内合成气的表面流速;
[0036][0037]
re
p
为反应管内合成气在催化剂床层流动的雷诺数,p
rm
为反应管内混合物的压力,g
rm
为反应管内混合物的质量流率。
[0038]
可选的,所述的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,反应管内混合物和渗透管内混合物之间传质过程引起的局部熵产生率的计算方法采用以下公式:
[0039][0040]
其中,表示通过渗透管的水蒸气的摩尔通量,r
g
表示热力学常数,表示渗透管内水蒸气分压,表示反应管内水蒸气分压。
[0041]
可选的,所述的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,所述吹扫气为氮气。
[0042]
可选的,所述的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,以固定的甲醇收率为约束,以总熵产生率最小为优化目标,得到最优的反应管管外热源温度之后还包括:以得到的最优的反应管管外热源温度为基础,进一步以总熵产生率最小为优化目标,得到最优的合成气进入反应管的温度。
[0043]
本发明的一种co2加氢合成甲醇膜反应器及总熵生产率最小优化方法相对于现有技术具有以下有益效果:
[0044]
(1)本发明的co2加氢合成甲醇膜反应器,通过在反应管内设置渗透管,渗透管由羟基方钠石渗透膜材料制成,反应中生成的水蒸气进入渗透管,渗透管内的水蒸气由吹扫气带出渗透管,如此使得反应不断朝正方向移动,进而提高ch3oh的产率;
[0045]
(2)本发明的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,以固定的甲醇收率为约束,以总熵产生率最小为优化目标,得到最优的反应管管外热源温度,与参考反应器相比,在甲醇产率固定的条件下,该case 1最优反应器的总熵产生率降低了7.96%;
[0046]
(3)本发明的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,进一步在case1反应器的基础上,以总熵产生率最小为优化目标,对反应管管外热源温度和合成气进
入反应管的温度同时进行优化,与参考反应器相比,在甲醇产率固定的条件下,该case2最优反应器的总熵产生率降低了10.89%。
附图说明
[0047]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0048]
图1为本发明的co2加氢合成甲醇膜反应器的结构示意图;
[0049]
图2为本发明的膜反应器的反应时通入吹扫气的示意图;
[0050]
图3为本发明的反应温度和反应管进口co2摩尔分数对甲醇收率的影响的仿真结果与实验结果对比图;
[0051]
图4为本发明的参考反应器和case 1最优反应器的管外热源温度、反应混合物温度和渗透管内混合物温度的沿程分布曲线图;
[0052]
图5为本发明的参考反应器和case 1最优反应器的传热过程引起的局部熵产生率(σ
ht,ref
和σ
ht,case 1
)的沿程分布曲线图;
[0053]
图6为本发明的case1最优反应器的总熵产生率(sg
t,case1
)、传热过程和化学反应过程引起的熵产生率(sg
ht,case1
和sg
r,case1
)与的关系曲线图;
[0054]
图7为本发明的case 2最优反应器的管外热源温度、反应混合物温度和渗透管内侧混合物温度的沿程分布曲线图;
[0055]
图8为本发明的case 2最优反应器和分别取565和580k时的case 1最优反应器的化学反应过程引起的局部熵产生率(σ
r,case2
,和)的沿程分布曲线图;
[0056]
图9为本发明的case 1最优反应器和case 2最优反应器的传热过程与2个子传热过程引起的局部熵产生率(σ
ht,case1
、σ
ht1,case1
、σ
ht2,case1
、σ
ht,case2
、σ
ht1,case2
和σ
ht2,case2
)的沿程分布曲线图。
具体实施方式
[0057]
下面将结合本发明实施方式,对本发明实施方式中的技术方案进行清楚、完整的描述,显然,所描述的实施方式仅仅是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
[0058]
如图1所示,本发明提供了一种co2加氢合成甲醇膜反应器,包括:
[0059]
反应管1;
[0060]
渗透管2,其同轴设置在反应管1内,渗透管2的材料为羟基方钠石渗透膜,反应管1与渗透管2之间填充有催化剂3。
[0061]
需要说明的是,本申请实施例中,反应管1、渗透管2均为空心的圆柱体状,并且渗透管2同轴套设在反应管1内,反应管1与渗透管2之间填充有催化剂3,催化剂3可催化co2与
h2反应生成ch3oh,渗透管2由羟基方钠石渗透膜材料制成,水蒸气可透过渗透管2进入渗透管2内,反应管1一端为进口、另一端为出口。该羟基方钠石渗透膜(h
‑
sod膜)为现有渗透膜,本申请并没有对该羟基方钠石渗透膜进行改进,具体的,该羟基方钠石渗透膜(h
‑
sod膜)对水的渗透性在1
×
10
‑7~3
×
10
‑7,对水和氢气、水和一氧化碳、水和co2的选择性大于75。
[0062]
在一些实施例中,催化剂为cuo/zno/al2o3催化剂,具体的该催化剂采用现有的催化剂。
[0063]
本申请的co2加氢合成甲醇膜反应器,如图2所示,在使用时,首先在反应管1的一端(进口端)且位于反应管1与渗透管2之间的空间通入合成气(包括co2、h2、co、ch4的混合气体)或直接通入co2与h2,co2与h2在催化剂的催化作用下在反应管1和渗透管2之间生成ch3oh,同时反应中生成的水蒸气经渗透管2渗透进入渗透管2内,同时在渗透管2的一端通入吹扫气,在吹扫气的作用下,带走水蒸气,如此使得反应不断朝正方向移动,进而提高ch3oh的产率。
[0064]
基于同一发明构思,本发明还提供了一种co2加氢合成甲醇膜反应器的总熵生产率最小优化方法,包括以下步骤:
[0065]
s1、向反应管中通入合成气,合成气在催化剂的作用下反应生成甲醇,反应中生成的水蒸气进入渗透管,渗透管内的水蒸气由吹扫气带出反应管;
[0066]
s2、计算反应管管外热源与反应管内混合物之间的传热过程引起的局部熵产生率;
[0067]
s3、计算反应管内混合物和渗透管内混合物之间的传热过程引起的局部熵产生率;
[0068]
s4、计算反应管内反应过程引起的局部熵产生率;
[0069]
s5、计算反应管内混合物粘性流动过程引起的局部熵产生率;
[0070]
s6、计算反应管内混合物和渗透管内混合物之间传质过程引起的局部熵产生率;
[0071]
s7、将上述各步骤中的局部熵产生率求和得到局部总熵产生率,局部总熵产生率在反应器轴向积分可得到总熵产生率;
[0072]
s8、以固定的甲醇收率为约束,以总熵产生率最小为优化目标,得到最优的反应管管外热源温度。
[0073]
需要说明的是,本申请实施例中管外热源温度指的是反应器外对反应管进行加热的热源温度。
[0074]
具体的,本申请实施例中,反应管管外热源与反应管内混合物之间传热过程引起的局部熵产生率σ
ht,r
的计算方法采用以下公式:
[0075]
σ
ht,r
=πd
ri
j
q,r
(1/t
rm
‑
1/t
a
)
[0076]
其中,d
ri
表示反应管内径;t
a
表示反应管管外热源温度;t
rm
表示反应管内混合物温度;j
q,r
表示通过反应管内壁的热流密度,其计算公式为:j
q,r
=u
r
(t
a
‑
t
rm
),u
r
表示为反应管管外热源和反应管内混合物之间的换热系数。
[0077]
具体的,本申请实施例中,反应管内混合物和渗透管内混合物之间的传热过程引起的局部熵产生率σ
ht,m
的计算方法采用以下公式:
[0078]
σ
ht,m
=πd
mo
j
q,m
(1/t
mm
‑
1/t
rm
);
[0079]
其中,d
mo
表示渗透管外径;t
mm
表示渗透管内混合物温度,具体的,本申请中渗透管
内的混合物包括水蒸气和吹扫气的混合物;
[0080]
j
q,m
表示通过渗透管的热流密度,其计算公式为:
[0081]
j
q,m
=u
m
(t
rm
‑
t
mm
),
[0082]
u
m
表示反应管内混合物与渗透管混合物之间的换热系数。
[0083]
具体的,本申请实施例中,计算反应管内反应引起的局部熵产生率σ
ri
具体包括:
[0084]
反应管内发生的反应包括甲醇合成反应和逆水气变换反应,其中,甲醇合成反应为
[0085]
逆水气变换反应为
[0086]
反应管内反应引起的局部熵产生率的计算公式为
[0087][0088]
其中,i=1,2,
[0089]
ρ
c
为催化剂的颗粒密度,a
c,r
为反应管的截面积,ε
b
为催化剂床层孔隙率,η
i
为内扩散有效因子,r1为甲醇合成反应的反应速率,r2为逆水气变换反应的反应速率,δ
r
g1为甲醇合成反应的吉布斯自由能,δ
r
g2为逆水气变换反应的吉布斯自由能。
[0090]
具体的,本申请实施例中,甲醇合成反应为放热的msch反应,逆水气变换反应为吸热反应,具体的,
[0091][0092][0093]
其中,p
k
为组分k的分压(这里的组分k的分压,指的是组分k在反应管内的分压,例如为反应管内co2的分压),κ
j
为各基元反应的吸附常数,为反应i的平衡常数,β为吸附项,κ
j
,和β的表达式为:
[0094]
κ
j
=a
j
exp(b
j
/r
g
t
rm
),j=1,2,3,4,5;
[0095][0096][0097][0098]
a
j
、b
j
均为常数;
[0099][0100]
r
g
表示热力学常数。
[0101]
具体的,本申请实施例中,反应管内混合物粘性流动引起的熵产生率σ
vf
的计算方法采用以下公式:
[0102][0103]
其中,c
rm
表示反应管内混合物的表面流速;
[0104][0105]
re
p
为反应管内混合物在催化剂床层流动的雷诺数,p
rm
为反应管内混合物的压力,g
rm
为反应管内混合物的质量流率。
[0106]
具体的,本申请实施例中,反应管内混合物和渗透管内混合物之间传质过程引起的局部熵产生率σ
mt
的计算方法采用以下公式:
[0107][0108]
其中,表示通过渗透管的水蒸气的摩尔通量,r
g
表示热力学常数,表示渗透管内水蒸气分压,表示反应管内水蒸气分压。
[0109]
具体的,本申请实施例中,吹扫气为氮气。使用氮气不仅可以吹带出渗透管内的水蒸气,同时氮气不参与反应。
[0110]
具体的,本申请实施例中,将上述各步骤中的局部熵产生率求和得到局部总熵产生率,局部总熵产生率在反应器轴向积分可得总熵产生率,以固定的甲醇收率为约束,以总熵产生率最小为优化目标,得到最优的反应管管外热源温度。
[0111]
即总熵产生率为:
[0112][0113]
sg
ht
、sg
r
、sg
vf
和sg
mt
分别为传热、化学反应、粘性流动和传质过程的熵产生率,σ
t
为各局部总熵产生率产生率之和,其中,l为反应管的长度;z表示反应器轴向坐标(以反应器进口为原点)。
[0114]
具体的,本申请中反应管中的能量守恒方程为:
[0115][0116]
其中,f
k
和c
p,k
分别为组分k的摩尔流率和定压摩尔热容,δ
r
h
i
为反应i的反应焓变。具体的,k中1~7分别代表co2、h2、co、ch3oh、h2o、n2、ch4七种组分。
[0117]
甲醇的收率ξ1和一氧化碳的收率ξ2由物量守恒方程描述:
[0118][0119][0120]
式中,为反应管进口处co2的摩尔流率,上标0代表各参数进口的状态。co2、氢气、一氧化碳和甲醇的摩尔流率为:
[0121][0122]
式中,v
k,i
为反应i中组分k的化学计量系数。具体的,i=1对应甲醇合成反应,i=2对应逆水气变换反应,例如代表反应1即甲醇合成反应中co2的化学计量系数,代表反应2即逆水气变换反应中co2的化学计量系数。
[0123]
水蒸气的摩尔流率为:
[0124][0125]
式中,为通过渗透膜的水蒸气的摩尔通量。
[0126]
本申请中,羟基方钠石渗透膜对水蒸气的渗透率通过渗透膜的水蒸气的摩尔通量为:
[0127][0128]
p
m,h2o
为渗透管内水蒸气的分压,p
mm
为渗透管内的压力,f
sweep
为吹扫气的摩尔流率,本申请中为氮气。
[0129]
渗透管内的物料守恒方程为:
[0130][0131]
代表渗透管内水蒸气的摩尔流率。
[0132]
渗透管内的能量守恒方程为:
[0133][0134]
式中,和为渗透管和反应管内水蒸气的焓。
[0135]
以下以具体实例进一步说明本申请的co2加氢合成甲醇膜反应器的总熵生产率最小优化方法。
[0136]
具体的,本申请中反应器做以下限定:反应混合物和吹扫气为理想气体;管外热源温度完全可控;膜反应器为一维拟均相活塞流反应器;反应器在径向的扩散和轴向的返混可以忽略;催化剂填充均匀,催化剂床层孔隙率为常数;羟基方钠石渗透膜对水蒸气的选择透过性为100%;内扩散有效因子η
i
为1;忽略渗透管内的压降。
[0137]
本申请以msch膜反应器的总熵产生率最小为优化目标,以完全可控的反应管管外热源温度(t
a
)、反应混合物进口温度和吹扫气进口温度为优化变量。以固定的甲醇收率(δch3oh
fixed
)为约束。本申请优化问题的目标和约束如下:
[0138][0139]
s.t.
[0140][0141]
其中,表示反应管出口的甲醇收率。
[0142]
本申请的优化问题中包含了7个微分方程组和若干辅助方程,方程数量多且相互耦合,因此无法直接得到优化问题的解析解,可以采用非线性规划进行数值求解。在非线性规划求解过程中,运用有限差分法(即微分方程的离散化处理),将反应器离散为n=1,2,...n个控制体。通过优化每一个控制体的管外热源温度(t
a
(n))、和使得总熵产生率达到最小,其中,表示反应混合物的进口温度,表示渗透管内混合物的进口温度。因此,优化变量共有n+2个。
[0143]
该非线性规划问题可以利用matlab优化工具箱里的“fmincon”函数进行优化,在优化过程中选择了序列二次规划(sqp)算法。在优化前需要设定优化变量的变化范围,本文优化变量的变化范围为:
[0144]
400≤t
a
(n)≤600
[0145][0146][0147]
优化目标可利用梯形积分进行表述如下:为了提高总熵产生率的计算精度,利用梯形积分对其进行计算,计算公式如下:
[0148][0149]
式中,δz=l/n为步长。
[0150]
约束为:
[0151][0152]
上述的优化问题旨在满足守恒方程和约束方程的条件下求解管外热源温度的最优轨迹使得总熵产生率最小,属于典型的最优控制问题。基于最优控制理论,可建立哈密顿函数:
[0153][0154]
式中,x(z)为状态变量,即t
rm
、p
rm
、ξ1、ξ2、和t
mm
,λ
m
(z)为相应的协态变量,t
a
(z)为控制变量,下标m代表状态变量。
[0155]
上式中,哈密顿函数由两部分组成,右侧第一项为局部总熵产生率,右侧第二项为协态变量与守恒方程约束的乘积。哈密函数不显含坐标z,根据哈密函数的性质可判断h[x(z),λ(z),t
a
(z)]为常数,该性质可用来检验优化结果的准确性。
[0156]
根据pontryagins极小值原理,最优控制问题的解需要满足状态方程:
[0157]
[0158]
协态方程:
[0159][0160]
极小值条件:
[0161][0162]
可得管外热源温度(t
a
(z)):
[0163][0164]
其中,代表反应混合物对应的协态变量。
[0165]
针对本申请优化问题的非线性规划和最优控制的数值优化方法。其中,非线性规划方法最多包含了n+2个优化变量,无法确保得到的解是全局最优解,而最优控制利用数学工具推导出了管外热源温度的最优路径,将寻优问题转化为包含边界条件的微分方程组求解问题,能够确保得到的解是全局最优解,并且降低了运算时间。本申请的最优控制问题包含了14个一阶微分方程,属于典型的两点边界值问题,现阶段可以利用matlab的bvp4c函数对其进行求解,然而,bvp4c函数对初始值较为依赖。因此,需要设置合理的初始值使得微分方程组的解收敛。本文利用fmincon计算得到的非线性规划的优化结果作为最优控制的初始值。
[0166]
msch膜反应器的操作参数、催化剂的几何参数、渗透膜的几何参数和物理参数等参考工业反应器的数据取值。本申请的msch膜反应器的几何参数由反应空速、各组分进口摩尔分数和长径比计算得到。表1列出了本申请的msch膜反应器的参数设置。
[0167]
表1
‑
msch膜反应器的参数设置
[0168]
[0169][0170]
具体的,表1中表示反应管进口co2进口摩尔分数,同理其他的均表示不同组分的进口处的摩尔分数,表示反应管进口的氢气摩尔流率,d
mi
表示渗透管的内径,ghsv表示反应混合物空速,δ
m
表示羟基方钠石渗透膜的厚度,表示反应管进口混合物温度,表示反应管进口混合物压力,表示渗透管进口处混合物温度,表示渗透管进口处混合物的压力,表示渗透管进口处水蒸气的摩尔流率。
[0171]
理想的反应动力学模型和合理的参数设置是msch膜反应器优化的必要条件。为了验证msch反应动力学和热力学参数的准确性,本申请建立了等温等压反应器模型,并利用klier等(klier k,chatikavanij v,herman r g,simmons g w.catalytic synthesis of methanol from co/h2 iv.the effects of carbon dioxide.j.catal.,1982,74(2):343
‑
360)的实验验证了模型的准确性。图3给出了反应温度和反应管进口co2摩尔分数对甲醇收率的影响的仿真结果与实验结果对比。由图3可得,随着反应管进口co2摩尔分数的增加,反应管出口的甲醇收率先增大后减小。这是由于,当增加时,msch反应速率增大,因此增大;当大于6%时,随着的增加,反应管进口一氧化碳摩尔分数降低,水汽变换反应减弱,氢气摩尔分数降低,因此减小。当反应管进口反应混合物温度等于523k,小于10%时,仿真结果与实验结果十分吻合。当等于508k时,仿真结果均与实验结果吻合。
[0172]
为了得到msch膜反应器的最小总熵产生率与相应的管外热源温度最优构型、反应管进口反应混合物温度和反应管进口吹扫气温度,分析优化变量和其他操作参数与几何参数对msch膜反应器的总熵产生率的影响程度,本申请的优化步骤如下:
[0173]
(1)case 1:以管外热源温度(t
a
)曲线为优化变量,优化得到case 1最优反应器的最小总熵产生率(sg
t,case1
)和管外热源温度(t
a,case1
)的最优构型。
[0174]
(2)case 2:在步骤(1)的基础上,研究sg
t,case1
和t
a,case1
随反应管进口反应混合物温度的变化规律,得到case 2最优反应器的最小总熵产生率(sg
t,case2
),管外热源温
度(t
a,case2
)的最优构型和反应管进口反应混合物温度的最优值。
[0175]
根据优化步骤,表2列出了case 1,case 2最优反应器的状态变量和协态变量的边界值。
[0176]
表2
‑
case 1,case 2最优反应器的状态变量和协调变量的边界值
[0177][0178][0179]
表2中上标“0”均表示参数位于反应管进口的状态,上表“1”表示参数位于反应管出口的状态。
[0180]
表3列出了参考反应器、case 1最优反应器、case 2最优反应器的熵产生率、甲醇产率、co2转化率和相应的优化变量取值。
[0181]
表3
‑
参考反应器、case 1、case 2最优反应器性能对比
[0182][0183]
由表3可知,与参考反应器相比,在甲醇产率固定的条件下,case 1、case2最优反应器的总熵产生率分别降低了7.96%,10.89%。其中,粘性流动过程和传质过程的总熵产率变化不大。由于甲醇产率固定,co2的转化率也基本不变。
[0184]
图4给出了参考反应器和case 1最优反应器的反应管管外热源温度、反应混合物温度和渗透管内混合物温度的沿程分布曲线。由图4可见,参考反应器和case 1最优反应器的反应混合物温度分布曲线(t
rm,ref
和t
rm,case1
)的变化趋势基本一致,均是先增大后减小,t
rm,ref
在反应器的末端略有升高。这是由于,msch反应是放热反应,在反应器进口附近,反应物料充足,反应速率快,因此反应混合物温度先升高。随着氢气摩尔分数的降低,吸热的水汽变换反应的反应速率提高,因此反应混合物的温度逐渐降低。由于出口附近参考反应器的管外热源温度(t
a,ref
)大于t
rm,ref
,因此t
rm,ref
在出口处略微升高。case 1最优反应器的管外热源温度(t
a,case1
)先升高,再降低最后升高,出口处的t
a,case1
与t
rm,case1
一致。这是由于,当t
a,case1
与t
rm,case1
的变化趋势保持一致时,管外热源和反应混合物之间的温差减小,传热的驱动力减小,传热引起的熵产生率也减小。由管外热源温度(t
a
(z))公式和表2中的取值可知,出口处的t
a,case1
等于t
rm,case1
,此时能够保证出口处传热过程引起的局部熵产生率为0。参考反应器和case 1最优反应器的渗透管内混合物温度(t
mm,ref
和t
mm,case1
)均呈线性增大,且变化幅度不大,这是由于渗透管内混合物的流动模式为层流流动,导致渗透管内混合物和反应混合物之间的传热系数较小,进而导致渗透管内混合物的吸热率较小。
[0185]
图5给出了参考反应器和case 1最优反应器的传热过程引起的局部熵产生率(σ
ht,ref
和σ
ht,case1
)的沿程分布曲线。由图5可见,σ
ht,ref
沿反应器无量纲轴向坐标先增大后减小,最后再增大;σ
ht,case1
沿先减小后增大,最后再减小,在等于0.3到0.8之间,σ
ht,case1
的变化不明显。σ
ht,ref
和σ
ht,case1
的沿程变化趋势分别与图4中的t
a,ref
与t
rm,ref
和t
a,case1
与t
rm,case1
的温差变化趋势一致。σ
ht,ref
和σ
ht,case1
与σ
ht
=0围成的面积分别代表参考反应器和case 1最优反应器的传热过程引起的总熵产生率(sg
ht,ref
和sg
ht,case1
)。由表3可
知,与sg
ht,ref
相比,sg
ht,case1
降低24.29%,与参考反应器的总熵产生率(sg
t,ref
)相比,case 1最优反应器的总熵产生率(sg
t,case1
)降低了7.96%。
[0186]
图6给出了sg
t,case1
、sg
ht,case1
和case 1最优反应器的化学反应过程引起的熵产生率(sg
r,case1
)与的关系。如图6所示,随着的增大,sg
t,case1
先减小后增大。当等于518 k时,得到了case 2最优反应器的最小总熵产生率(sg
t,case2
=0.741w
·
k
‑1),传热和化学反应过程的熵产生率(sg
ht,case2
=0.203w
·
k
‑1和sg
r,case2
=0.461 w
·
k
‑1)。与sg
t,case1
和sg
r,case1
相比,sg
t,case2
和sg
r,case2
分别降低了3.14%和22.78%;与sg
ht,case1
相比,sg
ht,case2
增加了63.71%。因此,在传热过程和化学反应过程引起的熵产生率的综合影响下,sg
t,case1
随的增加先减小再增大。由图6可见,随着的增加,sg
r,case1
先减小后增大,当时,sg
r,case1
最小,为0.291。由图6可见,随着的增加,sg
ht,case1
逐渐增大。
[0187]
图7给出了case 2最优反应器的管外热源温度、反应混合物温度和渗透管内侧混合物温度(t
a,case2
、t
rm,case2
和t
mm,case2
)的沿程分布曲线。由图4和图7可见,case 2最优反应器的反应混合物温度(t
rm,case2
)、管外热源温度(t
w,case2
)和渗透管内混合物温度(t
mm,case2
)与t
rm,case1
、t
w,case1
和t
mm,case1
的变化趋势基本一致。t
w,case2
和t
rm,case2
在端点处重合,这是由于case 2最优反应器释放了的约束,由表1可知,等于0,因此等于
[0188]
图8给出了case 2最优反应器和分别取565和580k时的case 1最优反应器的化学反应过程引起的局部熵产生率(σ
r,case2
,和)的沿程分布曲线。由图可见,σ
r,case2
和σ
r,case1
均是先急剧减小,再保持稳定,最后再减小到0。在反应器进口附近(图8中的
‘
i’区),σ
r,case1
均大于σ
r,case2
,当等于0.01
‑
0.2时(图8中的
‘
ii’区)σ
r,case1
均小于σ
r,case2
,当大于0.2后(图8中
‘
iii’区),σ
r,case1
均大于σ
r,case2
。随着的增加,在
‘
ii’区内化学反应产生的熵产生率降低,在
‘
i’区和
‘
iii’区内化学反应产生的熵产生率增大,当大于565k以后,
‘
i’区和
‘
iii’区内化学反应产生的熵产生率增大的速度明显超过
‘
ii’区内化学反应产生的熵产生率降低的速度,因此sg
r,case1
随着的增加,先减小后增加。
[0189]
图9给出了case 1最优反应器和case 2最优反应器的传热过程与2个子传热过程引起的局部熵产生率(σ
ht,case1
、σ
ht1,case1
、σ
ht2,case1
、σ
ht,case2
、σ
ht1,case2
和σ
ht2,case2
)的沿程分布曲线。如图所示,case 1和case 2最优反应器中渗透管内的混合物与反应混合物之间的传热过程引起的熵产生率(σ
ht2,case1
和σ
ht2,case2
)较小,这是由于渗透管内混合物和反应混合物之间的换热系数(u
m
)较小,导致渗透管内混合物与反应混合物之间的换热过程的热流率较小,进而导致σ
ht2,case1
和σ
ht2,case2
较小。σ
ht2,case2
略大于σ
ht2,case1
,这是由于与t
mm,case2
之间的差值大于t
rm,case1
与t
mm,case1
之间的差值。case 2最优反应器中反应混合物与管外热源之间的传热过程引起的熵产生率(σ
ht1,case2
)与t
rm,case2
和t
a,case2
之差的趋势一致。与case1最优反应器中反应混合物与管外热源之间的传热过程引起的熵产生率(σ
ht1,case1
)相比,σ
ht1,case2
更大。这是由于t
rm,case2
和t
w,case2
之差更大。因此,随着的增大,t
rm,case1
与t
w,case1
和t
mm,case1
之间的温差增大,进而导致sg
ht,case1
增大。
[0190]
以上所述仅为本发明的较佳实施方式而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1