锂回收方法与流程
1.本公开涉及从至少溶解有锂的被处理液回收锂的锂回收方法,尤其涉及从废锂离子电池回收锂时使用的锂回收方法。
2.另外,本公开涉及从至少溶解有钴和杂质金属的被处理液回收钴的钴回收方法,尤其涉及从废锂离子电池回收钴时使用的钴回收方法。
背景技术:
3.锂离子电池作为轻质且高能量密度的电池受到关注,被大量用作各种便携设备、电动汽车、电动助力自行车等的蓄电池。该锂离子电池的正极使用例如钴酸锂、镍酸锂等锂过渡金属氧化物作为正极活性物质,从废锂离子电池回收贵金属的钴、镍对于资源的有效利用而言极为重要,因此已提出了多种方法。
4.作为从废锂离子电池回收钴的方法,例如,专利文献1记载了如下方法:将废锂离子电池用硫酸浸出而使钴溶出,向该酸浸出液中添加碱而将ph调节至4~5,由此使与钴一起溶出的铝等杂质金属的盐以晶体的形式析出、沉淀后,再添加碱而将ph调节为7~10,使钴盐以晶体的形式析出、沉淀,由此回收钴。
5.另一方面,由于锂的价值低廉,从废锂离子电池回收锂的方法并没有提出多少方案。但是,锂离子电池的需求日益增加,预期将来废弃物会不断增加,因此如果能够高效地回收锂则也是有益的。
6.专利文献2记载了如下方法:将使用过的锂金属凝胶和固体聚合物电解质二次电池用硫酸溶解,向由此得到的含有硫酸锂的含硫酸锂液体中添加氢氧化锂或氢氧化铵进行中和,由此使杂质金属的盐(氢氧化铝)以晶体的形式析出并将其分离,然后在对含硫酸锂液体进行蒸发浓缩后进行碳酸化,由此使含硫酸锂液体中包含的锂形成碳酸锂晶体并析出,对其进行分离并回收。
7.现有技术文献
8.专利文献
9.专利文献1:日本专利第5077788号公报
10.专利文献2:日本特表2004
‑
508694号公报
技术实现要素:
11.发明要解决的问题
12.但是,专利文献2记载的方法中,从含硫酸锂液体去除杂质(氢氧化铝)时的中和中如果使用氢氧化铵,则中和后的含硫酸锂液体中包含作为无机盐的硫酸铵。若在含硫酸锂液体包含无机盐的状态下进行碳酸化,则含硫酸锂液体中的无机盐浓度会因浓缩而升高,因此也可能发生结晶化。从而在碳酸化时碳酸锂中包含无机盐,因此在所回收的碳酸锂的纯度降低方面存在改进余地。
13.为了解决上述课题,本公开的目的在于,提供能够从溶解有锂和无机盐的被处理
液以高纯度回收锂的锂回收方法。
14.用于解决问题的方案
15.本公开的一方式的锂回收方法的特征在于,其包括下述工序:浓缩工序,对至少溶解有锂和无机盐的被处理液进行蒸发浓缩;析晶工序,对上述浓缩工序后的被处理液进行冷却析晶,使无机盐以晶体的形式析出;第1固液分离工序,从上述析晶工序后的被处理液中分离包含无机盐的晶体的析出物;碳酸化工序,向上述第1固液分离工序后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐;和,第2固液分离工序,从被处理液中分离通过上述碳酸化工序而析出的包含碳酸锂的晶体的析出物。
16.根据本公开的一方式的锂回收方法,在碳酸化工序之前在浓缩工序中对被处理液进行蒸发浓缩,由此减少被处理液的液体量、增加被处理液中的锂浓度。由此在碳酸化工序中能够良好地提高碳酸锂的回收率。
17.进而,在浓缩工序后的析晶工序中对被处理液进行冷却析晶,由此降低蒸发浓缩后的被处理液的温度,使溶解度降低至被处理液中所含的无机盐发生结晶化为止。由此能够降低被处理液中的无机盐的浓度。而且,由于在碳酸化工序中升高被处理液的温度以降低碳酸锂的溶解度,因此被处理液中残留的无机盐的溶解度提高,能够抑制无机盐发生结晶化。由此,在碳酸化工序中回收碳酸锂时,能够提高碳酸锂的纯度。
18.发明的效果
19.根据本公开的锂回收方法,能够从溶解有锂和无机盐的被处理液中以高纯度回收锂。
附图说明
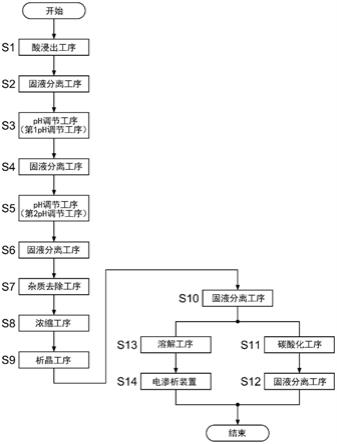
20.图1为示意性示出第一方式的锂回收方法的步骤的流程图。
21.图2为示出图1的锂回收方法中使用的处理装置的简要构成的示意图。
22.图3为示出双极膜电渗析装置的简要构成的示意图。
23.图4为示意性示出第一方式的锂回收方法的变形例的步骤的流程图。
24.图5为示出图4的锂回收方法中使用的处理装置的简要构成的示意图。
25.图6为示意性示出第一方式的锂回收方法的变形例的步骤的流程图。
26.图7为示出图6的锂回收方法中使用的处理装置的简要构成的示意图。
27.图8为示意性示出第2方式的锂回收方法的步骤的流程图。
28.图9为示出图8的锂回收方法中使用的处理装置的简要构成的示意图。
29.图10为示出双极膜电渗析装置的简要构成的示意图。
30.图11为示意性示出第2方式的锂回收方法的变形例的步骤的流程图。
31.图12为示出图11的锂回收方法中使用的处理装置的简要构成的示意图。
32.图13为示意性示出第2方式的锂回收方法的变形例的步骤的流程图。
33.图14为示出图13的锂回收方法中使用的处理装置的简要构成的示意图。
34.图15为示意性示出钴回收方法的步骤的流程图。
35.图16为示出图15的钴回收方法中使用的处理装置的简要构成的示意图。
36.图17为示出双极膜电渗析装置的简要构成的示意图。
37.图18为示意性示出钴回收方法的变形例的步骤的流程图。
38.图19为示出图18的钴回收方法中使用的处理装置的简要构成的示意图。
39.图20为拍摄实施例1的过滤残渣的表面状态而得的照片。
40.图21为拍摄实施例2的过滤残渣的表面状态而得的照片。
41.图22为拍摄实施例3的过滤残渣的表面状态而得的照片。
具体实施方式
42.以下参照附图说明本公开的锂回收方法的实施方式。需要说明的是,以下的说明中,“~”表示以上、以下。
43.第1方式的锂回收方法
44.本公开的第1方式的锂回收方法的特征在于,其包括下述工序:浓缩工序,对至少溶解有锂和无机盐的被处理液进行蒸发浓缩;析晶工序,对上述浓缩工序后的被处理液进行冷却析晶,使无机盐以晶体的形式析出;第1固液分离工序,从上述析晶工序后的被处理液中分离包含无机盐的晶体的析出物;碳酸化工序,向上述第1固液分离工序后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐;和,第2固液分离工序,从被处理液中分离通过上述碳酸化工序而析出的包含碳酸锂的晶体的析出物。
45.第0016段中记载的锂回收方法中,优选在上述浓缩工序中对上述第2固液分离工序后的被处理液的至少一部分进行蒸发浓缩。
46.另外,第0016或第0017段中记载的锂回收方法中,优选在上述浓缩工序之前还具有杂质去除工序,所述杂质去除工序至少去除被处理液中所含的钙和/或镁。
47.另外,第0016至第0018中任一段所述的锂回收方法中,优选还具有下述工序:溶解工序,使上述第1固液分离工序中从被处理液中分离出的析出物中所含的无机盐的晶体溶解而生成无机盐溶液;电渗析工序,对通过上述溶解工序而得到的无机盐溶液进行双极膜电渗析,由此从该无机盐溶液中与碱一起分离并回收无机酸。
48.另外,第0019段中记载的锂回收方法中,优选在上述浓缩工序中对利用上述双极膜电渗析而脱盐后的无机盐溶液进行蒸发浓缩。
49.另外,第0019或第0020段中记载的锂回收方法中,优选在上述电渗析工序之前还具有杂质去除工序,所述杂质去除工序通过开动无机盐溶液中所含的钙和/或镁等的电渗析而至少去除结垢等引起故障的物质。
50.另外,第0019至第0021中任一段所述的锂回收方法中,优选在上述电渗析工序之前还具有下述工序:重结晶工序,使无机盐溶液中所含的无机盐重结晶,并且从无机盐溶液中分离该无机盐的晶体;重溶解工序,溶解通过上述重结晶工序而得到的无机盐的晶体而生成无机盐溶液。
51.另外,第0019至第0022中任一段所述的锂回收方法中,优选将上述浓缩工序中产生的冷凝水用于上述溶解工序中的无机盐的溶解。
52.另外,第0019至第0022中任一段所述的锂回收方法中,优选将上述电渗析工序中回收的无机酸用于上述杂质处理工序中使用的螯合树脂或离子交换树脂的再生液。
53.另外,第0016至第0024中任一段所述的锂回收方法中,优选利用上述浓缩工序中产生的冷凝水来洗涤通过上述第1固液分离工序而得到的包含无机盐的晶体的析出物和/或通过上述第2固液分离工序而得到的包含碳酸锂的晶体的析出物。
54.另外,第0016至第0025中任一段所述的锂回收方法中,优选在上述浓缩工序之前还具有下述工序:酸浸出工序,将废锂离子电池用无机酸浸出而使锂溶出;ph调节工序,向通过上述酸浸出工序而得到的含锂液体中添加碱而调节ph,并且通过从含锂液体中分离通过上述ph调节工序而析出的析出物,由此生成被处理液。
55.另外,第0026段中记载的锂回收方法中,优选将上述第2固液分离工序后的被处理液的至少一部分作为上述ph调节工序中添加的碱进行再利用。
56.另外,第0026或第0027段中记载的锂回收方法中,优选将上述电渗析工序中回收的碱作为上述ph调节工序中添加的碱进行再利用、并且将上述电渗析工序中回收的无机酸作为上述酸浸出工序中使用的无机酸进行再利用。
57.另外,第0026至第0028中任一段所述的锂回收方法中,优选利用上述浓缩工序中产生的冷凝水来洗涤通过上述ph调节工序而析出的析出物。
58.另外,第0026至第0029中任一段所述的锂回收方法中,优选在上述酸浸出工序之前还具有对上述废锂离子电池进行焙烧的焙烧工序,并且在上述碳酸化工序中将上述焙烧工序中产生的排放气体作为二氧化碳混合到被处理液中。
59.根据本公开的第1方式的锂回收方法,通过在碳酸化工序之前在浓缩工序中对被处理液进行蒸发浓缩,从而减少被处理液的液体量,使被处理液中的锂浓度增大。由此,在碳酸化工序中能够良好地提高碳酸锂的回收率。
60.进而,通过在浓缩工序后的析晶工序中对被处理液进行冷却析晶,由此降低蒸发浓缩后的被处理液的温度、使溶解度降低至被处理液中所含的无机盐发生结晶化为止。由此,能够降低被处理液中的无机盐的浓度。而且,由于在碳酸化工序中升高被处理液的温度以降低碳酸锂的溶解度,因此被处理液中残留的无机盐的溶解度提高,能够抑制无机盐发生结晶化。由此,在碳酸化工序中回收碳酸锂时,能够提高碳酸锂的纯度。
61.图1示出关于本公开的第一方式的锂回收方法的实施方式中各工序的步骤,图2示出实施图1的锂回收方法的处理装置10的简要构成。本实施方式的锂回收方法除了适合于锂以外,还可以适宜用于处理包含盐酸、硫酸、氢氟酸、磷酸等强酸与钾、钠等碱金属或碱土金属的无机盐的被处理液,特别是可以适宜用于从废锂离子电池回收锂。以下以从废锂离子电池回收锂的情形为例进行说明。
62.本实施方式的锂回收方法具有:
63.‑
酸浸出工序s1,将废锂离子电池用无机酸进行浸出,使锂溶出;
64.‑
固液分离工序s2,从通过酸浸出工序s1得到的含锂液体中分离不溶残渣;
65.‑
ph调节工序s3、s5,向固液分离工序s2后的含锂液体中添加碱而调节ph;
66.‑
固液分离工序s4、s6,从ph调节工序s3、s5后的含锂液体中分离析出物;
67.‑
杂质去除工序s7,对从ph调节工序s3、s5后的含锂液体中分离析出物而得的被处理液进行螯合处理;
68.‑
浓缩工序s8,对杂质去除工序s7后的至少溶解有锂和无机盐的被处理液进行蒸发浓缩;
69.‑
析晶工序s9,对浓缩工序s8后的被处理液进行冷却析晶,使无机盐以晶体的形式析出;
70.‑
固液分离工序s10(相当于第0016段中记载的“第1固液分离工序”),从析晶工序
s9后的被处理液中分离包含无机盐的晶体的析出物;
71.‑
碳酸化工序s11,向固液分离工序s10后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐;和,
72.‑
固液分离工序s12(相当于第0016段中记载的“第2固液分离工序”),从被处理液中分离通过碳酸化工序s11而析出的包含碳酸锂的晶体的析出物。本实施方式的锂回收方法还具有:
73.‑
溶解工序s13,使固液分离工序s10中从被处理液中分离出的析出物中所含的无机盐的晶体溶解而生成无机盐溶液;和,
74.‑
电渗析工序s14,通过对溶解工序s13后的无机盐溶液进行双极膜电渗析,由此从该无机盐溶液中分离并回收碱和无机酸。
75.成为锂回收对象的废锂离子电池包括:由于以规定的充放电次数使用而充电容量降低的使用后的锂离子电池,以及电池制造工序中发生不良情况等的半成品、随着产品规格变更而产生的旧款库存品等。废锂离子电池可以进行了粉碎或焙烧处理,也可以为进行了粉碎和焙烧处理而到的粉末。
76.首先,在酸浸出工序s1中,将上述废锂离子电池用无机酸进行浸出,由此使锂以及例如铝、镍、钴、铁等金属溶出。作为无机酸,可以使用例如硫酸、盐酸、硝酸、磷酸等,本实施方式中从低成本且处理容易的角度出发使用硫酸。
77.酸浸出工序s1中,将废锂离子电池用无机酸进行浸出的方法没有特别限定,可以使用通常所进行的方法。例如,通过在酸浸出槽1内将废锂离子电池浸渍于例如硫酸水溶液等无机酸的水溶液并搅拌规定时间,得到溶解有上述的锂等金属的含锂液体。酸浸出工序s1中,水溶液中的无机酸的浓度优选为1mol~5mol/l,水溶液的温度优选为60℃以上。
78.接下来的固液分离工序s2中,对通过酸浸出工序s1得到的含锂液体例如进行过滤,由此从含锂液体中分离出不溶残渣。不溶残渣主要是不溶于无机酸的碳材料、金属材料、有机材料。作为进行固液分离的方法,可以使用例如加压过滤(压滤机)、真空过滤、离心过滤等各种过滤装置、倾析器式之类离心分离装置等公知的固液分离装置。需要说明的是,以下的固液分离工序s4、s6、s10、s12等中也同样。
79.接下来的ph调节工序s3、s5中,向固液分离工序s2之后的含锂液体(滤液)中添加碱而将ph调节到规定范围,由此从含锂液体中去除含锂液体中的上述金属中的除锂以外的金属。作为碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中从低成本且处理容易的角度出发使用氢氧化钠。
80.ph调节工序s3、s5中调节含锂液体的ph的方法没有特别限定,可以使用通常进行的方法。例如,通过在第1ph调节槽2和第2ph调节槽3内边搅拌含锂液体边添加例如氢氧化钠水溶液等碱的水溶液,使含锂液体中的除锂以外的金属以氢氧化物等无机盐的晶体形态析出、沉淀。在本实施方式中,ph调节工序s3、s5被分成了第1ph调节工序s3和第2ph调节工序s5。
81.第1ph调节工序s3中,通过添加碱而将含锂液体的ph调节为4~7、优选4~6、更优选4~5。由此,使含锂液体中的杂质金属(例如铝、铁)以氢氧化物(例如氢氧化铝、氢氧化铁)等无机盐的晶体形态析出、沉淀。第1ph调节工序s3中,优选在将含锂液体升温至例如30℃~80℃中的恒定温度的条件下进行。
82.第1ph调节工序s3中添加的碱的水溶液优选较稀,碱浓度小于1.0mol/l。由此,虽然详情如后所述,但能够在第1ph调节工序s3中抑制含锂液体中的钴与杂质金属一起以钴盐的晶体形态析出、沉淀和从含锂液体中被去除。但是,若碱浓度过低,则第1ph调节工序s3中需要大量使用碱的水溶液以调节ph,并且ph调节后的含锂液体的液体量也变多,因此碱浓度的下限优选为0.1mol/l以上。另外,为了有效抑制含锂液体中的钴在第1ph调节工序s3中从含锂液体中被去除,第1ph调节工序s3中添加的碱的水溶液的碱浓度优选为0.5mol/l以下,更优选为0.2mol/l以下。
83.需要说明的是,该第1ph调节工序s3中,为了减少ph调节中使用的碱的水溶液量,还可以向含锂液体中添加1.0mol/l以上的具有较高的碱浓度的碱的水溶液至含锂液体的ph小于4的规定值,在含锂液体的ph达到规定值后向含锂液体中添加小于1.0mol/l的具有较低的碱浓度的碱的水溶液,由此将含锂液体的ph调节为4~7。作为上述含锂液体的ph的规定值,可以设定在2~3的范围内。
84.在第1ph调节工序s3中析出、沉淀的析出物通过在接下来的固液分离工序s4中对含锂液体例如进行过滤而从含锂液体中分离。需要说明的是,第1ph调节工序s3中从含锂液体中去除的杂质金属中还可以包含铜等。固液分离工序s4中,优选用清洗液对析出物进行洗涤并且将洗涤后的洗涤废液与含锂液体(滤液)一起供给到接下来的第2ph调节工序s5中。由此,洗涤废液中所含的锂也可以与含锂液体中所含的锂一起从第2ph调节工序s5供给到碳酸化工序s11中,在后述的碳酸化工序s11中进行碳酸化,由此能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用后述浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。
85.第2ph调节工序s5中,向固液分离工序s4后的含锂液体(滤液)中添加碱而将ph调节到7以上、优选7~13、更优选7~11、进一步优选8~10的范围。由此,使含锂液体中的贵金属(例如钴、镍)以氢氧化物(例如氢氧化钴、氢氧化镍)等的无机盐的晶体形态析出、沉淀。第2ph调节工序s5中,优选在将含锂液体升温到例如30℃~80℃中的恒定温度的条件下进行。第2ph调节工序s5中添加的碱的水溶液的碱浓度没有特别限定,优选大于等于第1ph调节工序s3中使用的碱的水溶液的碱浓度,进一步优选碱浓度为0.2mol/l以上。
86.在第2ph调节工序s5中析出、沉淀的析出物在接下来的固液分离工序s6中通过对含锂液体进行例如过滤而从含锂液体中分离。需要说明的是,第2ph调节工序s5中从含锂液体中去除的贵金属还可以包含锰等。
87.另一方面,固液分离工序s6后的含锂液体(滤液)中,除了锂以外还由于酸浸出工序s1和ph调节工序s3、s5中添加的无机酸(本实施方式中为硫酸)和碱(本实施方式中为氢氧化钠)而溶解有无机盐(本实施方式中为硫酸钠(na2so4))。该ph调节工序s3、s5后的含锂液体相当于本公开的锂回收方法的“被处理液”。该被处理液中可以还溶解有钙、镁和二氧化硅中的至少1种。
88.固液分离工序s6中,优选用清洗液对析出物进行洗涤并且将洗涤后的洗涤废液与被处理液(滤液)一起供给到接下来的杂质去除工序s7中。由此,洗涤废液中所含的锂也能够与被处理液中所含的锂一起从杂质去除工序s7供给到碳酸化工序s11,在后述的碳酸化工序s11中进行碳酸化而能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用后述的浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进
行冷凝水的有效利用。
89.接下来的杂质去除工序s7中,至少将固液分离工序s6后的被处理液中所含的钙和/或镁等多价阳离子去除。通过将被处理液中作为杂质而包含的钙、镁等去除,从而在后述的浓缩工序s8中能够抑制在蒸发浓缩装置5的换热器的传热面上产生、附着水垢,能够使换热效率维持得较高。另外,若被处理液中包含钙、镁等,则在后述的电渗析工序s14中无机溶液所含的钙、镁等多价阳离子在双极膜电渗析装置9的阳离子交换膜内析出,有导致膜性能降低的担心。因此,通过预先进行钙、镁等的电渗析而从被处理液中去除结垢等引起故障的物质,能够防止对双极膜电渗析装置9的阳离子交换膜的不良影响,能够使电渗析的性能维持得较高。
90.杂质去除工序s7中,从被处理液中去除钙、镁的方法没有特别限定,例如可以使用多价阳离子去除装置4。多价阳离子去除装置4为去除钙离子、镁离子等2价以上的多价阳离子的装置,例如可例示出能够向填充有螯合树脂的柱中通入被处理液的构成。作为螯合树脂,可以使用能够选择性捕捉钙离子、镁离子的螯合树脂,可例示例如亚氨基二乙酸型、氨基磷酸型等。作为多价阳离子去除装置4,此外可列举添加有螯合剂者、利用离子交换树脂者等。需要说明的是,杂质去除工序s7中从被处理液中去除的杂质除了钙、镁以外还可以包含二氧化硅(硅酸根离子)。
91.接下来的浓缩工序s8中,对杂质去除工序s7后的被处理液进行加热而进行蒸发浓缩,即使被处理液中的水分蒸发,由此对被处理液进行浓缩。由此,被处理液的液体量减少、被处理液中的锂浓度增加。由此,在后述的碳酸化工序s11中能够提高碳酸锂的回收率。
92.浓缩工序s8中,优选将被处理液浓缩至如下浓度,所述浓度为锂在浓缩后的被处理液中例如不会以硫酸锂等锂盐的晶体形态析出的程度。由此,能够提高浓缩后的被处理液中的锂浓度,在后述的碳酸化工序s11中能够提高碳酸锂的回收率。
93.浓缩工序s8中,对被处理液进行蒸发浓缩的方法没有特别限定,例如,可以使用蒸发浓缩装置5。作为蒸发浓缩装置5,只要能够通过蒸发而将被处理液浓缩就没有特别限定,可以使用例如热泵型、喷射器(eductor)驱动型、蒸汽型、闪蒸型等公知的蒸发浓缩装置,优选热泵型的蒸发浓缩装置。使用热泵型的蒸发浓缩装置的情况下,能够显著抑制所用的能量。另外,通过在减压气氛下进行被处理液的浓缩,能够进一步实现节能。
94.接下来的析晶工序s9中,对浓缩工序s8后的被处理液进行冷却析晶。该析晶工序s9中降低蒸发浓缩后的被处理液的温度,使溶解度降低至被处理液中所含的无机盐发生结晶化为止,由此能够降低被处理液中的无机盐(本实施方式中为硫酸钠)的浓度。因此,在后述的碳酸化工序s11中回收碳酸锂时能够提高碳酸锂的纯度。
95.析晶工序s9中,对被处理液进行冷却析晶的方法没有特别限定,例如,可以使用冷却析晶装置6。冷却析晶装置6是使供给的被处理液在析晶槽内冷却、使作为目标的无机盐的晶体析出的装置。作为冷却析晶装置6,可以使用例如冷却方式为利用夹套、内部盘管的析晶装置、外部循环冷却式的析晶装置等公知的冷却析晶装置,没有特别限定。
96.析晶工序s9中,利用饱和溶解度、溶解度的温度依赖性根据无机盐而不同这一点,仅使目标无机盐的晶体析出。本实施方式中,利用了硫酸锂等锂盐的溶解度的温度依赖性小于硫酸钠等除锂盐以外的无机盐这一点。即,通过冷却至供给浓度下的锂盐的析出温度以上且除锂盐以外的无机盐的析出温度以下,从而使锂盐以外的无机盐以晶体的形式析
出。具体而言,作为用于使硫酸钠的晶体析出的冷却温度,为30℃以下,优选为5℃以上且20℃以下。此时,硫酸钠以硫酸钠十水合物(na2so4·
10h2o)的形态析出。
97.接下来的固液分离工序s10中,通过对析晶工序s9后的被处理液进行例如过滤,从被处理液中分离包含无机盐(本实施方式中为硫酸钠)的晶体的析出物。
98.接下来的碳酸化工序s11中,向分离出上述包含无机盐的晶体的析出物后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐,由此使被处理液中的锂以碳酸锂的晶体形态析出、沉淀。由此,能够以碳酸锂的形态回收被处理液中的锂。作为碳酸盐,可以使用例如碳酸钠、碳酸铵、碳酸钾等。
99.该碳酸化工序s11中,优选通过向被处理液中混合二氧化碳而使碳酸锂的晶体析出、沉淀。由此,在碳酸化工序s11中使用例如不含钠等碱金属的材料,能够抑制除锂以外的碱金属混入到所析出的碳酸锂晶体中。由此,能够回收纯度高的碳酸锂。
100.但是存在如下情况:若持续混合二氧化碳,则被处理液的ph降低,因此碳酸锂的析出量减少。因此,优选在被处理液的ph达到7以下之前停止二氧化碳的混合。另外,可以通过向被处理液中添加碱来避免ph降低的情况。此时,优选通过添加碱而使ph维持在9以上。作为添加的碱,可以使用氢氧化钠、氢氧化钾、氢氧化锂等。
101.碳酸化工序s11中,向被处理液中混合二氧化碳的方法没有特别限定,可以使用通常进行的方法。例如,可以一边在碳酸化槽7内搅拌被处理液一边用喷嘴以微细气泡的状态向被处理液中供给二氧化碳,由此能够向被处理液中均匀地混合二氧化碳,能够使被处理液中的锂与二氧化碳高效地进行反应。另外,也可以通过在二氧化碳气氛下对被处理液进行喷雾而与二氧化碳进行反应。
102.碳酸锂的溶解度会随着温度升高而降低,因此在碳酸化工序s11中优选使被处理液升温。由此,被处理液中的通过锂与二氧化碳的反应而产生的碳酸锂的溶解度降低,从而能够增加碳酸锂晶体的析出量。另外,通过使被处理液升温,由此能够增大残留于被处理液的无机盐(本实施方式中为硫酸钠)的溶解度、抑制无机盐的结晶。由此,能够抑制无机盐的晶体与碳酸锂的晶体一起析出,因此在碳酸化工序中回收碳酸锂时能够提高碳酸锂的纯度。
103.接下来的固液分离工序s12中,对碳酸化工序s11后的被处理液进行例如过滤,由此从含锂液体中分离包含碳酸锂的晶体的析出物。在固液分离工序s12中,通过用水等洗涤从含锂液体中分离出的析出物,从而能够去除杂质、提高碳酸锂的纯度。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。
104.固液分离工序s12后的被处理液(滤液)虽然没有特别限定,但是由于包含杂质而优选一部分以流出液形式排出、一部分再次在体系内进行循环。由此能够对被处理液中残留的锂进行回收,因此能够以高回收率回收锂。需要说明的是,上述的洗涤包含碳酸锂的晶体的析出物后的洗涤废液优选也与固液分离工序s12后的被处理液一起再次在体系内进行循环。
105.使固液分离工序s12后的被处理液再次在体系内进行循环时,虽然也可以供给到蒸发浓缩装置5中而在浓缩工序s8中进行蒸发浓缩,但是优选供给于第1ph调节槽2和/或第2ph调节槽3。固液分离工序s12后的被处理液为碱性,因此可以用作ph调节工序s3、s5中所
添加的碱。另外,固液分离工序s12后的被处理液若包含大量碳酸根离子(co
32
‑
),则在浓缩工序s8中进行蒸发浓缩时会在蒸发浓缩装置5的换热器的传热面上析出碳酸盐的晶体。而固液分离工序s2、s4后的含锂液体为酸性,因此可以用该含锂液体中和固液分离工序s12后的被处理液,使碳酸根离子成为二氧化碳而从该被处理液中逸出,从而能够防止浓缩工序s8中在蒸发浓缩装置5的换热器的传热面析出碳酸盐的晶体。
106.另一方面,将固液分离工序s10(冷却析晶装置6)中从被处理液中分离出的析出物中所含的无机盐(本实施方式中为硫酸钠)的晶体供给到溶解工序s13(溶解槽8)。溶解工序s13中,在溶解槽8内例如用水溶解无机盐的晶体使其达到期望的浓度,由此生成无机盐溶液。此时的温度没有特别限定,为能够溶解无机盐的晶体的温度即可。另外,无机盐的溶解中使用的水没有特别限定,优选利用浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。生成的无机盐溶液被供给于双极膜电渗析装置9。
107.接下来的电渗析工序s14中,利用双极膜电渗析装置9从溶解工序s13后的无机盐溶液中分离并回收碱和无机酸。作为双极膜电渗析装置9,例如,可以适宜使用图3所示的三室单元方式的双极膜电渗析装置,所述三室单元方式的双极膜电渗析装置是多个单元90层叠而成的,所述单元90在阳极95与阴极96之间具备阴离子交换膜91、阳离子交换膜92和2片双极膜93、94。本实施方式的双极膜电渗析装置9中,由阴离子交换膜91和阳离子交换膜92形成脱盐室r1,在阴离子交换膜91和一片双极膜93之间形成酸室r2,在阳离子交换膜92与另一片双极膜94之间形成碱室r3。在各双极膜93、94的外侧形成有阳极室r4和阴极室r5,阳极室r4中配置有阳极95,阴极室r5中配置有阴极96。
108.该电渗析工序s14中,向脱盐室r1中导入无机盐溶液,向酸室r2和碱室r3中分别导入纯水。由此,在无机盐溶液包含例如硫酸钠的情况下,在脱盐室r1中,钠离子(na
+
)通过阳离子交换膜92,硫酸根离子(so
42
‑
)通过阴离子交换膜91。另一方面,在酸室r2和碱室r3中,所供给的纯水在双极膜93、94中解离为氢离子(h
+
)和氢氧根离子(oh
‑
),在酸室r2中氢离子(h
+
)与硫酸根离子(so
42
‑
)结合而生成硫酸(h2so4),在碱室r3中氢氧根离子(oh
‑
)与钠离子(na
+
)结合而生成氢氧化钠(naoh)。由此,从酸室r2中回收作为无机酸的硫酸(h2so4),从碱室r3回收作为碱的氢氧化钠(naoh)。需要说明的是,导入到酸室r2和碱室r3中的纯水可以利用浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水。
109.脱盐室r1所排出的脱盐后的稀无机盐溶液(脱盐液)虽然没有特别限定,但是由于包含少量的锂而优选供给于浓缩工序s8(蒸发浓缩装置5)并在再次浓缩后在碳酸化工序s11中进行碳酸化。由此,能够以高回收率回收锂。需要说明的是,脱盐液在本实施方式中被供给于浓缩工序s8,但是当脱盐液中残留有钙和/或镁时,也可以将脱盐液供给到杂质去除工序s7。由此,可以在从脱盐液中去除钙、镁之后供给于浓缩工序s8。另外,脱盐液也可以供给于第1ph调节工序s3。由此,当脱盐液中残留有钴时,能够提高钴的回收率。
110.另外,从酸室r2回收的无机酸(本实施方式中为硫酸)虽然没有特别限定,但是优选供给于酸浸出槽1而在酸浸出工序s1中作为对废锂离子电池进行浸出的无机酸进行再利用。另外,优选供给于多价阳离子去除装置4而作为杂质处理工序s7中使用的螯合树脂或离子交换树脂的再生液进行再利用。
111.另外,从碱室r3回收的碱(本实施方式中为氢氧化钠)虽然没有特别限定,但是优选供给于ph调节槽2、3而在ph调节工序s3、s5中作为用于调节含锂液体的ph的碱进行再利
用。另外,优选供给于多价阳离子去除装置4而作为杂质处理工序s7中使用的螯合树脂或离子交换树脂的再生液进行再利用。
112.根据上述的本实施方式的锂回收方法,通过在碳酸化工序s11之前在浓缩工序s8中对被处理液进行蒸发浓缩,由此减少了被处理液的液体量、增大了被处理液中的锂浓度。由此,在碳酸化工序s11中能够良好地提高碳酸锂的晶体的回收率。
113.另外,在浓缩工序s8之后的析晶工序s9中,对被处理液进行冷却析晶,由此降低蒸发浓缩后的被处理液的温度,使溶解度降低至被处理液中所含的无机盐(本实施方式中为硫酸钠)发生结晶化为止,因此能够降低被处理液中的无机盐的浓度。而且,由于在碳酸化工序s11中升高被处理液的温度以降低碳酸锂的溶解度,因此被处理液中残留的无机盐的溶解度提高,能够抑制无机盐发生结晶化。由此,在碳酸化工序s11中回收碳酸锂时能够提高碳酸锂的纯度。
114.另外,根据本实施方式的锂回收方法,在碳酸化工序s11中不废弃回收碳酸锂晶体后的被处理液,而是使其在体系内进行循环来回收被处理液中残留的锂。由此,能够以高回收率回收锂。
115.另外,根据本实施方式的锂回收方法,使固液分离工序s10中从被处理液中分离出的析出物中所含的无机盐(本实施方式中为硫酸钠)的晶体在溶解工序s13中溶解而形成无机盐溶液之后,在电渗析工序s14中进行双极膜电渗析,由此从无机盐溶液中回收无机酸和碱,并且使脱盐后的稀无机盐溶液在浓缩工序s8中蒸发浓缩之后在碳酸化工序s11中回收稀无机盐溶液中所含的锂。由此,能够以高回收率回收锂。进而,通过使电渗析工序s14中回收的无机酸和碱循环到酸浸出工序s1、ph调节工序s3、s5、杂质去除工序s7中进行再利用,由此能够减少各工序s1、s3、s5、s7中使用的无机酸、碱的量。
116.另外,根据本实施方式的锂回收方法,在杂质去除工序s7中去除了被处理液中所含的钙、镁等多价阳离子。由此,在碳酸化工序s11之后的固液分离工序s12中分离析出物而得的被处理液中的杂质的量减少,由此能够使更多的固液分离工序s12后的被处理液再次在体系内进行循环。由此,能够更多地回收固液分离工序s12后的被处理液中残留的锂,因此能够以高回收率回收锂。进而,在电渗析工序s14中进行电渗析的无机溶液中的杂质的量也减少,因此能够防止双极膜电渗析装置9的阳离子交换膜由于结垢而性能降低,能够使双极膜的性能维持得较高。
117.另外,根据本实施方式的锂回收方法,将浓缩工序s8中产生的冷凝水用于各种处理中,因此能够有效利用冷凝水。另外,通过用冷凝水洗涤各固液分离工序s4、s6、s10、s12所得到的晶体,由此能够良好地提高各晶体的回收率。
118.以上对第一方式的锂回收方法的一实施方式进行了说明,但是第一方式的锂回收方法不限于图1和图2的实施方式,能够在不脱离本公开的主旨的限度内进行各种变更。
119.例如,图1和图2的实施方式中对浓缩工序s8之前的被处理液进行至少去除钙和/或镁的杂质去除工序s7,但是也可以代替该工序或在该工序的基础上对电渗析工序s14之前的无机盐溶液也同样地进行至少去除钙和/或镁的杂质去除工序。
120.另外,图1和图2的实施方式中将电渗析工序s14中回收的碱供给于第1ph调节工序s3和第2ph调节工序s5,但是也可以以仅供给于任一工序的方式构成。
121.另外,图1和图2的实施方式中ph调节工序s3、s5包括第1ph调节工序s3和第2ph调
节工序s5,但是根据废锂离子电池中所含的成分也可以以包括3个以上工序的方式构成或以仅包括1个工序的方式构成。
122.另外,图1和图2的实施方式中,如图4和图5所示在溶解工序s13之后且电渗析工序s14之前可以进行用于去除无机盐溶液中所含的例如二氧化硅等杂质的处理工序。该处理工序可以代替杂质去除工序s7或者在杂质去除工序s7的基础上进行。
123.具体而言,首先在重结晶工序s13
‑
1中使无机盐溶液中所含的无机盐(本实施方式中为硫酸钠)重结晶。使无机盐溶液中所含的无机盐重结晶的方法没有特别限定,例如,可以使用利用与上述析晶工序s9的冷却析晶装置6同样的冷却析晶装置10的冷却析晶。也即,可以利用在无机盐和二氧化硅之间饱和溶解度、溶解度的温度依赖性不同这点仅使无机盐的晶体析出,通过冷却到供给浓度下的二氧化硅的析出温度以上且无机盐的析出温度以下而使无机盐的晶体析出。此时,硫酸钠以硫酸钠十水合物(na2so4·
10h2o)的形式析出。需要说明的是,无机盐溶液可以事先浓缩到适合于无机盐进行析晶的无机盐浓度。在本实施方式中,重结晶工序s13
‑
1中使用了冷却析晶装置10,但是只要为析出高纯度晶体的析晶方法即可,例如,也可以使用蒸发析晶装置等。
124.在使无机盐的晶体再析出之后,在固液分离工序s13
‑
2中从包含无机盐的晶体的水溶液中分离该无机盐的晶体,回收经重结晶处理的无机盐晶体。作为固液分离方法,例如,可以使用加压过滤(压滤机)、真空过滤、离心过滤等各种过滤装置、倾析器型的离心分离装置等公知的固液分离装置。
125.然后,在重溶解工序s13
‑
3中,在重溶解槽11内例如用水溶解所回收的无机盐的晶体使其达到期望的浓度,从而再次生成无机盐溶液。此时的温度没有特别限定,只要为能够溶解无机盐的晶体的温度即可。另外,无机盐的溶解中使用的水没有特别限定,优选利用浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。再次生成的无机盐溶液被供给于双极膜电渗析装置9。需要说明的是,重结晶工序s13
‑
1至重溶解工序s13
‑
3中,从无机盐溶液中去除的杂质除了二氧化硅以外可以还包含钙和/或镁。
126.图4和图5的实施方式中,在电渗析工序s14之前去除了无机盐溶液中所含的二氧化硅。由此,在电渗析工序s14中进行电渗析的无机溶液中的杂质的量也减少,因此能够使双极膜的性能维持得较高。进而,在将电渗析工序s14之后的稀无机盐溶液(脱盐液)供给于蒸发浓缩装置5而在浓缩工序s8中再次进行蒸发浓缩时,脱盐液的杂质的量减少,从而在浓缩工序s8中能够抑制在蒸发浓缩装置5的换热器的传热面产生、附着水垢。而且,在碳酸化工序s11之后的固液分离工序s12中分离析出物而得的被处理液中的杂质的量减少,从而能够使更多的固液分离工序s12之后的被处理液再次在体系内进行循环。由此,能够更多地回收固液分离工序s12后的被处理液中残留的锂,能够以高回收率回收锂。
127.另外,图1和图2的实施方式中,如图6和图7所示,可以在酸浸出工序s1之前还具有对废锂离子电池进行焙烧的焙烧工序s0。焙烧工序s0中,对废锂离子电池进行焙烧的方法没有特别限定,可以使用公知的焙烧装置12。
128.图6和图7的实施方式中,将焙烧装置12(焙烧工序s0)中产生的排放气体供给到碳酸化槽7,在碳酸化工序s11中将排放气体作为二氧化碳混合到被处理液中。由此,能够减少碳酸化工序s11中使用的二氧化碳的量。需要说明的是,图4和图5的实施方式中也可以在酸
浸出工序s1之前进行对废锂离子电池进行焙烧的焙烧工序s0,这是不言而喻的。
129.第2方式的锂回收方法
130.本公开的第2方式的锂回收方法的特征在于,其包括下述工序:浓缩工序,对至少溶解有锂和无机盐的被处理液在压力低于大气压的低压下加热而进行蒸发浓缩;碳酸化工序,向上述浓缩工序后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐;和,固液分离工序,从被处理液中分离通过上述碳酸化工序而析出的包含碳酸锂的晶体的析出物,上述碳酸化工序中,将被处理液的温度设为大于等于上述浓缩工序中的被处理液的蒸发温度。
131.第0089段中记载的锂回收方法中,优选上述浓缩工序中在10kpa以上且70kpa以下的压力下对被处理液进行蒸发浓缩。
132.另外,第0089或第0090段中记载的锂回收方法中,优选在上述浓缩工序中对上述固液分离工序后的被处理液的至少一部分进行蒸发浓缩。
133.另外,第0089至第0091中任一项所述的锂回收方法中,优选还包括下述工序:溶解工序,在上述浓缩工序中使被处理液中所含的无机盐以晶体的形式析出,使从上述浓缩工序后的被处理液中分离出的析出物中作为晶体而包含的无机盐溶解,生成无机盐溶液;和,电渗析工序,对通过上述溶解工序而得到的无机盐溶液进行双极膜电渗析,由此从该无机盐溶液中与碱一起分离并回收无机酸。
134.另外,第0089至第0092中任一段所述的锂回收方法中,优选在上述浓缩工序之前还包括下述工序:酸浸出工序,将废锂离子电池用无机酸浸出而使锂溶出;ph调节工序,向通过上述酸浸出工序而得到的含锂液体中添加碱而调节ph,并且通过从含锂液体中分离通过上述ph调节工序而析出的析出物,由此生成被处理液。
135.另外,第0093段中记载的锂回收方法中,优选将上述固液分离工序后的被处理液的至少一部分作为上述ph调节工序中添加的碱进行再利用。
136.另外,第0093或第0094段中记载的锂回收方法中,优选将上述电渗析工序中回收的碱作为上述ph调节工序中添加的碱进行再利用、并且将上述电渗析工序中回收的无机酸作为上述酸浸出工序中使用的无机酸进行再利用。
137.根据本公开的第2方式的锂回收方法,通过在碳酸化工序之前在浓缩工序中对被处理液进行蒸发浓缩,从而减少被处理液的液体量,使被处理液中的锂浓度增大。由此,在碳酸化工序中能够良好地提高碳酸锂的回收率。
138.另外,浓缩工序中,通过在低压下对被处理液进行蒸发浓缩,从而与在大气压下对被处理液进行蒸发浓缩相比,能够降低蒸发浓缩后的被处理液的温度。因此,在之后的碳酸化工序中能够确保被处理液较大的升温空间,而且低压下被处理液的蒸发温度(被处理液中所含的水的沸点)降低,因此能够将被处理液的蒸发浓缩所需的能量抑制得较低,能够实现节能。并且,碳酸化工序中,若被处理液的温度低,则被处理液中所含的无机盐发生结晶化,从而使碳酸化时的被处理液的温度与浓缩工序中的被处理液的蒸发温度相比提高,被处理液中残留的无机盐的溶解度提高,能够抑制碳酸化时无机盐发生结晶化。另外,碳酸化时,若被处理液的温度高,则碳酸锂的溶解度降低,能够增加碳酸锂晶体的回收量。由此,能够提升以高收率得到高纯度的碳酸锂的效果。
139.图8示出关于本公开的第2方式的锂回收方法的实施方式的各工序的步骤,图9示
出实施图8的锂回收方法的处理装置10的简要构成。本实施方式的锂回收方法除了适合于锂以外,还可以适宜用于处理包含盐酸、硫酸、氢氟酸、磷酸等强酸与钾、钠等碱金属或碱土金属的无机盐的被处理液,特别是可以适宜用于从废锂离子电池回收锂。以下以从废锂离子电池回收锂的情形为例进行说明。
140.本实施方式的锂回收方法包括:
141.‑
酸浸出工序s1,将废锂离子电池用无机酸进行浸出,使锂溶出;
142.‑
固液分离工序s2,从通过酸浸出工序s1得到的含锂液体中分离不溶残渣;
143.‑
ph调节工序s3、s5,向固液分离工序s2后的含锂液体中添加碱而调节ph;
144.‑
固液分离工序s4、s6,从ph调节工序s3、s5后的含锂液体中分离析出物;
145.‑
杂质去除工序s7,对从ph调节工序s3、s5后的含锂液体中分离析出物而得的被处理液进行螯合处理;
146.‑
浓缩工序s8,对杂质去除工序s7后的至少溶解有锂和无机盐的被处理液进行蒸发浓缩;
147.‑
固液分离工序s9,从浓缩工序s8之后的被处理液中分离包含无机盐的晶体的析出物;
148.‑
碳酸化工序s10,向固液分离工序s9之后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐;和,
149.‑
固液分离工序s11,从被处理液中分离通过碳酸化工序s10而析出的包含碳酸锂的晶体的析出物。本实施方式的锂回收方法还具有:
150.‑
溶解工序s12,使固液分离工序s9中从被处理液中分离出的析出物中所含的无机盐的晶体溶解而生成无机盐溶液;和,
151.‑
电渗析工序s13,通过对溶解工序s12后的无机盐溶液进行双极膜电渗析,由此从该无机盐溶液分离并回收碱和无机酸。
152.成为锂回收对象的废锂离子电池与上述第1方式中相同。
153.首先,在酸浸出工序s1中,将上述废锂离子电池用无机酸进行浸出,由此使锂以及例如铝、镍、钴、铁等金属溶出。作为无机酸,可以使用例如硫酸、盐酸、硝酸、磷酸等,本实施方式中使用盐酸。
154.酸浸出工序s1中,将废锂离子电池用无机酸进行浸出的方法没有特别限定,可以使用通常所进行的方法。例如,通过在酸浸出槽1内将废锂离子电池浸渍于例如盐酸水溶液等无机酸的水溶液并搅拌规定时间,得到溶解有上述的锂等金属的含锂液体。
155.接下来的固液分离工序s2中,对通过酸浸出工序s1得到的含锂液体例如进行过滤,由此从含锂液体中分离出不溶残渣。不溶残渣主要是不溶于无机酸的碳材料、金属材料、有机材料。作为进行固液分离的方法,可以使用例如加压过滤(压滤机)、真空过滤、离心过滤等各种过滤装置、倾析器式之类离心分离装置等公知的固液分离装置。需要说明的是,以下的固液分离工序s4、s6、s9、s11等中也同样。
156.接下来的ph调节工序s3、s5中,向固液分离工序s2之后的含锂液体(滤液)中添加碱而将ph调节到规定范围,由此从含锂液体中去除含锂液体中的上述金属中的除锂以外的金属。作为碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中从低成本且处理容易的角度出发使用氢氧化钠。
157.ph调节工序s3、s5中调节含锂液体的ph的方法没有特别限定,可以使用通常进行的方法。例如,通过在第1ph调节槽2和第2ph调节槽3内边搅拌含锂液体边添加例如氢氧化钠水溶液等碱的水溶液,使含锂液体中的除锂以外的金属以氢氧化物等无机盐的晶体形态析出、沉淀。在本实施方式中,ph调节工序s3、s5被分成了第1ph调节工序s3和第2ph调节工序s5。
158.第1ph调节工序s3中,通过添加碱而将含锂液体的ph调节为4~7、优选4~6、更优选4~5。由此,使含锂液体中的杂质金属(例如铝、铁)以氢氧化物(例如氢氧化铝、氢氧化铁)等无机盐的晶体形态析出、沉淀。第1ph调节工序s3中,优选在将含锂液体升温至例如30℃~80℃中的恒定温度的条件下进行。
159.第1ph调节工序s3中添加的碱的水溶液优选较稀,碱浓度小于1.0mol/l。由此,虽然详情如后所述,能够在第1ph调节工序s3中抑制含锂液体中的钴与杂质金属一起以钴盐的晶体形态析出、沉淀和从含锂液体中被去除。但是,若碱浓度过低,则第1ph调节工序s3中需要大量使用碱的水溶液以调节ph,并且ph调节后的含锂液体的液体量也变多,因此碱浓度的下限优选为0.1mol/l以上。另外,为了有效抑制含锂液体中的钴在第1ph调节工序s3中从含锂液体中被去除,第1ph调节工序s3中添加的碱的水溶液的碱浓度优选为0.5mol/l以下,更优选为0.2mol/l以下。
160.需要说明的是,该第1ph调节工序s3中,为了减少ph调节中使用的碱的水溶液量,还可以向含锂液体中添加1.0mol/l以上的具有较高的碱浓度的碱的水溶液至含锂液体的ph小于4的规定值,在含锂液体的ph达到规定值后向含锂液体中添加小于1.0mol/l的具有较低的碱浓度的碱的水溶液,由此将含锂液体的ph调节为4~7。作为上述含锂液体的ph的规定值,可以设定在2~3的范围内。
161.在第1ph调节工序s3中析出、沉淀的析出物通过在接下来的固液分离工序s4中对含锂液体例如进行过滤而从含锂液体中分离。需要说明的是,第1ph调节工序s3中从含锂液体中去除的杂质金属中还可以包含铜等。固液分离工序s4中,优选用清洗液对析出物进行洗涤并且将洗涤后的洗涤废液与含锂液体(滤液)一起供给到接下来的第2ph调节工序s5中。由此,洗涤废液中所含的锂也可以与含锂液体中所含的锂一起从第2ph调节工序s5供给到碳酸化工序s10中,在后述的碳酸化工序s10中进行碳酸化,由此能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用后述浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。
162.第2ph调节工序s5中,向固液分离工序s4后的含锂液体中添加碱而将ph调节到7以上、优选7~13、更优选7~11、进一步优选8~10的范围。由此,使含锂液体中的贵金属(例如钴、镍)以氢氧化物(例如氢氧化钴、氢氧化镍)等的无机盐的晶体形态析出、沉淀。第2ph调节工序s5中,优选在将含锂液体升温到例如30℃~80℃中的恒定温度的条件下进行。第2ph调节工序s5中添加的碱的水溶液的碱浓度没有特别限定,优选大于等于第1ph调节工序s3中使用的碱的水溶液的碱浓度,进一步优选碱浓度为0.2mol/l以上。
163.在第2ph调节工序s5中析出、沉淀的析出物在接下来的固液分离工序s6中通过对含锂液体进行例如过滤而从含锂液体中分离。需要说明的是,第2ph调节工序s5中从含锂液体中去除的贵金属还可以包含锰等。
164.另一方面,固液分离工序s6后的含锂液体中,除了锂以外还由于酸浸出工序s1和
ph调节工序s3、s5中添加的无机酸(本实施方式中为盐酸)和碱(本实施方式中为氢氧化钠)而溶解有无机盐(本实施方式中为氯化钠(nacl))。该ph调节工序s3、s5后的含锂液体相当于本公开的锂回收方法的“被处理液”。该被处理液中可以还溶解有钙、镁和二氧化硅中的至少1种。
165.固液分离工序s6中,优选用清洗液对析出物进行洗涤并且将洗涤后的洗涤废液与被处理液(滤液)一起供给到接下来的杂质去除工序s8中。由此,洗涤废液中所含的锂也能够与被处理液中所含的锂一起从杂质去除工序s8供给到碳酸化工序s10,在后述的碳酸化工序s10中进行碳酸化而能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用后述的浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。
166.接下来的杂质去除工序s7中,至少将固液分离工序s6后的被处理液中所含的钙和/或镁等多价阳离子去除。通过将被处理液中作为杂质而包含的钙、镁等去除,从而在后述的浓缩工序s8中能够抑制在蒸发浓缩装置5的换热器的传热面上产生、附着水垢,能够使换热效率维持得较高。另外,若被处理液中包含钙、镁等,则在后述的电渗析工序s13中无机溶液所含的钙、镁等多价阳离子在双极膜电渗析装置9的阳离子交换膜内析出,有导致膜性能降低的担心。因此,通过预先开动钙、镁等的电渗析从被处理液中去除结垢等引起故障的物质,能够防止对双极膜电渗析装置9的阳离子交换膜的不良影响,能够使电渗析的性能维持得较高。
167.杂质去除工序s7中,从被处理液中去除钙、镁的方法没有特别限定,例如可以使用多价阳离子去除装置4。多价阳离子去除装置4为去除钙离子、镁离子等2价以上的多价阳离子的装置,例如可例示出:在内部具备离子交换树脂且使被处理液与离子交换树脂接触而能够吸附钙离子、镁离子的构成的装置。作为多价阳离子去除装置4,此外还可例示出:能够向填充有螯合树脂的柱中通入被处理液的构成的装置。作为螯合树脂,可以使用能够选择性捕捉钙离子、镁离子的螯合树脂,可例示例如亚氨基二乙酸型、氨基磷酸型等。另外,作为多价阳离子去除装置4,可列举添加有螯合剂者等。需要说明的是,杂质去除工序s7中从被处理液中去除的杂质除了钙、镁以外还可以包含二氧化硅(硅酸根离子)。
168.接下来的浓缩工序s8中,对杂质去除工序s7后的被处理液进行加热而进行蒸发浓缩,即,通过使被处理液中的水分蒸发来对被处理液进行浓缩。由此,被处理液的液体量减少、被处理液中的锂浓度增加。由此,在后述的碳酸化工序s10中能够提高碳酸锂的回收率。
169.该浓缩工序s8中,优选将被处理液蒸发浓缩至如下浓度,所述浓度为锂在浓缩后的被处理液中例如不会以氯化锂等锂盐的晶体形态析出的程度。由此,能够提高浓缩后的被处理液中的锂浓度,在后述的碳酸化工序s10中能够提高碳酸锂的回收率。
170.该浓缩工序s8中,通过被处理液的蒸发浓缩,被处理液中的无机盐有可能由于其浓度提高而发生结晶化。被处理液中所含的无机盐在浓缩工序s8中可以以晶体的形式析出,也可以不析出。在本实施方式中,在浓缩工序s8中被处理液中所含的无机盐以晶体的形式析出,并且在接下来的固液分离工序s9中从被处理液中分离析出物。
171.浓缩工序s8中,对被处理液进行蒸发浓缩的方法没有特别限定,例如,可以使用蒸发浓缩装置5。作为蒸发浓缩装置5,只要能够通过蒸发而将被处理液浓缩就没有特别限定,可以使用例如热泵型、喷射器(eductor)驱动型、蒸汽型、闪蒸型等公知的蒸发浓缩装置,优
选热泵型的蒸发浓缩装置。使用热泵型的蒸发浓缩装置的情况下,能够显著抑制所用的能量。
172.蒸发浓缩装置5通过连接有未图示的真空泵而使内部维持在低压,浓缩工序s8中,通过在压力低于大气压的低压下进行加热而使被处理液蒸发浓缩。对被处理液进行蒸发浓缩则被处理液的温度升高,但是在低压下与大气压下相比被处理液的蒸发温度(被处理液中所含的水的沸点)降低,因此在低压下进行蒸发浓缩可以使蒸发浓缩后的被处理液的温度相应地降低。因此,在后述的碳酸化工序s10中能够确保被处理液较大的升温空间。而且,在低压下被处理液的蒸发温度降低,因此能够将被处理液的蒸发浓缩所需的能量抑制得较低,能够实现节能。
173.蒸发浓缩装置5的内部压力、即对被处理液进行蒸发浓缩时的气氛压力没有特别限定,优选为10kpa以上且70kpa以下,更优选为15kpa以上且50kpa以下。从与上述压力的关系(饱和蒸气压曲线)方面考虑,被处理液的蒸发温度优选为45℃以上且95℃以下,更优选为55℃以上且80℃以下。
174.通过使上述压力为10kpa以上,能够使蒸发浓缩后的被处理液的温度为不过度降低的合适的低温,因此在后述的碳酸化工序s10中升高被处理液的温度时所需的能量可被抑制得较低。另外,蒸发浓缩装置5无需为耐压性能非常高的装置,因此能够将装置的制造成本抑制得较低。另一方面,通过使上述压力为70kpa以下,能够使蒸发浓缩后的被处理液的温度不过度升高、为合适的低温,因此在后述的碳酸化工序s10中能够充分确保被处理液较大的升温空间。另外,被处理液的蒸发浓缩所需的能量不会过度变大,能够有效地实现节能。
175.虽然省略了图示,但是在蒸发浓缩装置5底部的被处理液的液体蓄积部、或者在蒸发浓缩装置5与后述的碳酸化槽7之间的被处理液供给路径上设置有温度传感器,通过温度传感器来监视被处理液的蒸发温度(蒸发浓缩后的被处理液的温度)。另外,虽然省略了图示,但是在蒸发浓缩装置5的上部空间中设置有压力传感器,通过压力传感器监视蒸发浓缩装置5的内部压力(对被处理液进行蒸发浓缩时的气氛压力)。
176.接下来的固液分离工序s9中,通过对浓缩工序s8后的被处理液进行例如过滤,从被处理液中分离包含无机盐(本实施方式中为氯化钠)的晶体的析出物。
177.接下来的碳酸化工序s10中,向分离出上述包含无机盐的晶体的析出物后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐,由此使被处理液中的锂以碳酸锂的晶体形态析出、沉淀。由此,能够以碳酸锂的形态回收被处理液中的锂。作为碳酸盐,可以使用例如碳酸钠、碳酸铵、碳酸钾等。
178.该碳酸化工序s10中,优选通过向被处理液中混合二氧化碳而使碳酸锂的晶体析出、沉淀。由此,在碳酸化工序s10中使用例如不含钠等碱金属的材料,能够抑制除锂以外的碱金属混入到所析出的碳酸锂晶体中。由此,能够回收纯度高的碳酸锂。
179.但是存在如下情况:若持续混合二氧化碳,则被处理液的ph降低,因此碳酸锂的析出量减少。因此,优选在被处理液的ph达到7以下之前停止二氧化碳的混合。另外,可以通过向被处理液中添加碱来避免ph降低的情况。此时,优选通过添加碱而使ph维持在9以上。作为添加的碱,可以使用氢氧化钠、氢氧化钾、氢氧化锂等。
180.碳酸化工序s10中,向被处理液中混合二氧化碳的方法没有特别限定,可以使用通
常进行的方法。例如,可以一边在碳酸化槽7内搅拌被处理液一边用喷嘴以微细气泡的状态向被处理液中供给二氧化碳,由此能够向被处理液中均匀地混合二氧化碳,能够使被处理液中的锂与二氧化碳高效地进行反应。另外,也可以通过在二氧化碳气氛下对被处理液进行喷雾而与二氧化碳进行反应。
181.碳酸化工序s10中,被处理液的温度被设为大于等于浓缩工序s8中的被处理液的蒸发温度。碳酸化时如果被处理液的温度低,则被处理液中所含的无机盐(本实施方式中为氯化钠)可能发生结晶化。因此,通过在碳酸化工序s10中对被处理液进行升温、使碳酸化时的被处理液的温度高于被处理液的蒸发温度,由此碳酸化时被处理液中残留的无机盐的溶解度变大,能够抑制无机盐发生结晶化。由此,在碳酸化工序s10中回收碳酸锂时能够提高碳酸锂的纯度。
182.碳酸化时的被处理液的温度只要大于等于被处理液的蒸发温度就没有特别限定,优选高于被处理液的蒸发温度,优选低于100℃。作为碳酸化工序s10中使被处理液升温的方法,没有特别限定,例如,可以利用使用加热器等公知的加热手段来加热碳酸化槽7内的被处理液的方法。需要说明的是,也可以以在向碳酸化槽7供给被处理液之前预先用换热器等预热手段使被处理液升温的方式构成。
183.另外,被处理液的温度越高则碳酸锂的溶解度越降低。因此,通过在碳酸化工序s10中升高被处理液的温度,可使被处理液中的通过锂与二氧化碳的反应生成的碳酸锂的溶解度降低。由此,能够增大碳酸锂晶体的析出量。
184.由此,能够增加碳酸锂晶体的回收量且抑制无机盐晶体的析出量,因此能够以高效率得到高纯度的碳酸锂。
185.接下来的固液分离工序s11中,对碳酸化工序s10后的被处理液进行例如过滤,由此从含锂液体中分离包含碳酸锂的晶体的析出物。在固液分离工序s11中,通过用水等洗涤从含锂液体中分离出的析出物,从而能够去除杂质、提高碳酸锂的纯度。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。
186.固液分离工序s11后的被处理液(滤液)虽然没有特别限定,但是由于包含杂质而优选一部分以流出液形式排出、一部分再次在体系内进行循环。由此能够对被处理液中残留的锂进行回收,因此能够以高回收率回收锂。需要说明的是,上述的洗涤包含碳酸锂的晶体的析出物后的洗涤废液优选也与固液分离工序s11后的被处理液一起再次在体系内进行循环。
187.使固液分离工序s11后的被处理液再次在体系内进行循环时,虽然也可以供给到蒸发浓缩装置5中而在浓缩工序s8中进行蒸发浓缩,但是优选供给于第1ph调节槽2和/或第2ph调节槽3。固液分离工序s11后的被处理液为碱性,因此可以用作ph调节工序s3、s5中所添加的碱。另外,固液分离工序s11后的被处理液若包含大量碳酸根离子(co
32
‑
),则在浓缩工序s8中进行蒸发浓缩时会在蒸发浓缩装置5的换热器的传热面上析出碳酸盐的晶体。而固液分离工序s2、s4后的含锂液体为酸性,因此可以用该含锂液体中和固液分离工序s11后的被处理液,使碳酸根离子成为二氧化碳而从该被处理液中逸出,从而能够防止浓缩工序s8中在蒸发浓缩装置5的换热器的传热面析出碳酸盐的晶体。
188.另一方面,将在浓缩工序s8(蒸发浓缩装置5)中生成、在固液分离工序s9中从被处
理液中分离出的析出物中所含的无机盐(本实施方式中为氯化钠)的晶体供给到溶解工序s12(溶解槽8)。溶解工序s12中,在溶解槽8内例如用水溶解无机盐的晶体使其达到期望的浓度,由此生成无机盐溶液。此时的温度没有特别限定,为能够溶解无机盐的晶体的温度即可。另外,无机盐的溶解中使用的水没有特别限定,优选利用浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。生成的无机盐溶液被供给于双极膜电渗析装置9。
189.接下来的电渗析工序s13中,利用双极膜电渗析装置9从溶解工序s12后的无机盐溶液中分离并回收碱和无机酸。作为双极膜电渗析装置9,例如,可以适宜使用图10所示的三室单元方式的双极膜电渗析装置,所述三室单元方式的双极膜电渗析装置是多个单元90层叠而成的,所述单元90在阳极95与阴极96之间具备阴离子交换膜91、阳离子交换膜92和2片双极膜93、94。本实施方式的双极膜电渗析装置9中,由阴离子交换膜91和阳离子交换膜92形成脱盐室r1,在阴离子交换膜91和一片双极膜93之间形成酸室r2,在阳离子交换膜92与另一片双极膜94之间形成碱室r3。在各双极膜93、94的外侧形成有阳极室r4和阴极室r5,阳极室r4中配置有阳极95,阴极室r5中配置有阴极96。
190.该电渗析工序s13中,向脱盐室r1中导入无机盐溶液,分别向酸室r2和碱室r3中导入纯水。由此,在无机盐溶液包含例如氯化钠的情况下,在脱盐室r1中,钠离子(na
+
)通过阳离子交换膜92,氯化物离子(cl
‑
)通过阴离子交换膜91。另一方面,在酸室r2和碱室r3中,所供给的纯水在双极膜93、94中解离为氢离子(h
+
)和氢氧根离子(oh
‑
),在酸室r2中氢离子(h
+
)与氯化物离子(cl
‑
)结合而生成盐酸(hcl),在碱室r3中氢氧根离子(oh
‑
)与钠离子(na
+
)结合而生成氢氧化钠(naoh)。由此,从酸室r2中回收作为无机酸的盐酸(hcl),从碱室r3回收作为碱的氢氧化钠(naoh)。需要说明的是,导入到酸室r2和碱室r3中的纯水可以利用浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水。
191.脱盐室r1所排出的脱盐后的稀无机盐溶液(脱盐液)虽然没有特别限定,但是由于包含少量的锂而优选供给到蒸发浓缩装置5中并且在浓缩工序s8中再次进行蒸发浓缩。
192.另外,从酸室r2回收的无机酸(本实施方式中为盐酸)虽然没有特别限定,但是优选供给于酸浸出槽1而在酸浸出工序s1中作为对废锂离子电池进行浸出的无机酸进行再利用。另外,优选供给于多价阳离子去除装置4而作为杂质处理工序s7中使用的螯合树脂或离子交换树脂的再生液进行再利用。
193.另外,从碱室r3回收的碱(本实施方式中为氢氧化钠)虽然没有特别限定,但是优选供给于ph调节槽2、3而在ph调节工序s3、s5中作为用于调节含锂液体的ph的碱进行再利用。另外,优选供给于多价阳离子去除装置4而作为杂质处理工序s7中使用的螯合树脂或离子交换树脂的再生液进行再利用。
194.根据上述的本实施方式的锂回收方法,通过在碳酸化工序s10之前在浓缩工序s8中对被处理液进行蒸发浓缩,由此减少了被处理液的液体量、增大了被处理液中的锂浓度。由此,在碳酸化工序s10中能够良好地提高碳酸锂的晶体的回收率。
195.另外,碳酸化工序s10中,若被处理液的温度低则被处理液中所含的无机盐(本实施方式中为氯化钠)会发生结晶化,因此通过使被处理液升温、使碳酸化时的被处理液的温度高于蒸发温度,由此被处理液中残留的无机盐的溶解度提高,能够抑制碳酸化时无机盐发生结晶化。另外,碳酸化时,若被处理液的温度高则碳酸锂的溶解度降低,碳酸锂晶体的
回收量也会增加。由此,能够以高效率得到高纯度的碳酸锂。
196.另外,根据本实施方式的锂回收方法,在碳酸化工序s10中不废弃回收碳酸锂晶体后的被处理液,而是使其在体系内、如第1ph调节槽2、第2ph调节槽3、蒸发浓缩装置5等中进行循环来回收被处理液中残留的锂。由此,能够以高回收率回收锂。
197.另外,根据本实施方式的锂回收方法,使固液分离工序s9中从被处理液中分离出的析出物中所含的无机盐(本实施方式中为氯化钠)的晶体在溶解工序s12中溶解而形成无机盐溶液之后,在电渗析工序s13中进行双极膜电渗析,由此从无机盐溶液中回收无机酸和碱,并且使脱盐后的稀无机盐溶液在浓缩工序s8中蒸发浓缩之后在碳酸化工序s10中回收稀无机盐溶液中所含的锂。由此,能够以高回收率回收锂。进而,通过使电渗析工序s13中回收的无机酸和碱循环到酸浸出工序s1、ph调节工序s3、s5、杂质去除工序s7中进行再利用,由此能够减少各工序s1、s3、s5、s7中使用的无机酸、碱的量。
198.另外,根据本实施方式的锂回收方法,在杂质去除工序s7中去除了被处理液中所含的钙、镁等多价阳离子。由此,在碳酸化工序s10之后的固液分离工序s11中分离析出物而得的被处理液中的杂质的量减少,由此能够使更多的固液分离工序s11后的被处理液再次在体系内进行循环。由此,能够更多地回收固液分离工序s11后的被处理液中残留的锂,因此能够以高回收率回收锂。进而,在电渗析工序s13中进行电渗析的无机溶液中的杂质的量也减少,因此能够防止双极膜电渗析装置9的阳离子交换膜由于结垢而性能降低,能够使双极膜的性能维持得较高。
199.另外,根据本实施方式的锂回收方法,将浓缩工序s8中产生的冷凝水用于各种处理中,因此能够有效利用冷凝水。另外,通过用冷凝水洗涤各固液分离工序s4、s6、s9、s11所得到的晶体,由此能够良好地提高各晶体的回收率。
200.以上对第2方式的锂回收方法的一实施方式进行了说明,但是第2方式的锂回收方法不限于图8和图9的实施方式,能够在不脱离本公开的主旨的限度内进行各种变更。
201.例如,图8和图9的实施方式中对浓缩工序s8之前的被处理液进行至少去除钙和/或镁的杂质去除工序s7,但是也可以代替该工序或在该工序的基础上对电渗析工序s13之前的无机盐溶液也同样地进行至少去除钙和/或镁的杂质去除工序。
202.另外,图8和图9的实施方式中将电渗析工序s13中回收的碱供给于第1ph调节工序s3和第2ph调节工序s5,但是也可以以仅供给于任一工序的方式构成。
203.另外,图8和图9的实施方式中,ph调节工序s3、s5包括第1ph调节工序s3和第2ph调节工序s5,但是根据废锂离子电池中所含的成分也可以以包括3个以上工序的方式构成或以仅包括1个工序的方式构成。
204.另外,图8和图9的实施方式中,如图11和图12所示在溶解工序s12之后且电渗析工序s13之前可以进行用于去除无机盐溶液中所含的例如二氧化硅等杂质的处理工序。该处理工序可以代替杂质去除工序s7或者在杂质去除工序s7的基础上进行。
205.具体而言,首先在重结晶工序s12
‑
1中使无机盐溶液中所含的无机盐(本实施方式中为氯化钠)重结晶。使无机盐溶液中所含的无机盐重结晶的方法没有特别限定,例如,可以使用利用蒸发析晶装置13的蒸发结晶。蒸发结晶通过对无机盐溶液进行加热而使溶剂蒸发、提高无机盐的浓度,从而使无机盐的晶体析出。需要说明的是,无机盐溶液的蒸发优选在压力低于大气压的低压下进行。蒸发结晶中,也可以不另行设置蒸发析晶装置10、而是使
用蒸发浓缩装置5使无机盐溶液中所含的无机盐结晶。
206.在使无机盐的晶体再析出之后,在固液分离工序s12
‑
2中从包含无机盐的晶体的水溶液中分离该无机盐的晶体,回收经重结晶处理的无机盐晶体。作为固液分离方法,例如,可以使用加压过滤(压滤机)、真空过滤、离心过滤等各种过滤装置、倾析器型的离心分离装置等公知的固液分离装置。
207.然后,在重溶解工序s12
‑
3中,在重溶解槽11内例如用水溶解所回收的无机盐的晶体使其达到期望的浓度,从而再次生成无机盐溶液。此时的温度没有特别限定,只要为能够溶解无机盐的晶体的温度即可。另外,无机盐的溶解中使用的水没有特别限定,优选利用浓缩工序s8中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。再次生成的无机盐溶液被供给于双极膜电渗析装置9。需要说明的是,重结晶工序s12
‑
1至重溶解工序s12
‑
3中,从无机盐溶液中去除的杂质除了二氧化硅以外可以还包含钙和/或镁。
208.图11和图12的实施方式中,在电渗析工序s13之前去除了无机盐溶液中所含的二氧化硅。由此,在电渗析工序s13中进行电渗析的无机溶液中的杂质的量也减少,因此能够使双极膜的性能维持得较高。进而,在将电渗析工序s13之后的稀无机盐溶液(脱盐液)供给于蒸发浓缩装置5而在浓缩工序s8中再次进行蒸发浓缩时,脱盐液的杂质的量减少,从而在浓缩工序s8中能够抑制在蒸发浓缩装置5的换热器的传热面产生、附着水垢。而且,在碳酸化工序s10之后的固液分离工序s11中分离析出物而得的被处理液中的杂质的量减少,从而能够使更多的固液分离工序s11之后的被处理液再次在体系内进行循环。由此,能够更多地回收固液分离工序s11后的被处理液中残留的锂,能够以高回收率回收锂。
209.另外,图8和图9的实施方式中,如图13和图14所示,可以在酸浸出工序s1之前还具有对废锂离子电池进行焙烧的焙烧工序s0。焙烧工序s0中,对废锂离子电池进行焙烧的方法没有特别限定,可以使用公知的焙烧装置12。
210.图13和图14的实施方式中,将焙烧装置12(焙烧工序s0)中产生的排放气体供给到碳酸化槽7,在碳酸化工序s10中将排放气体作为二氧化碳混合到被处理液中。由此,能够减少碳酸化工序s10中使用的二氧化碳的量。另外,碳酸化工序s10中可以使被处理液升温。需要说明的是,图11和图12的实施方式中也可以在酸浸出工序s1之前进行对废锂离子电池进行焙烧的焙烧工序s0,这是不言而喻的。
211.上述实施方式的锂回收方法以从废锂离子电池回收锂的情况为例,但是本公开的锂回收方法不限于用于从废锂离子电池中回收锂的方法。
212.钴回收方法
213.从资源的有效利用的观点出发,从废锂离子电池中回收贵金属
‑
钴极为重要。但是,背景技术中的专利文献1所记载的从废锂离子电池中回收钴的方法存在如下课题:为了从酸浸出液中去除铝等杂质金属而将酸浸出液的ph设为4以上,此时钴盐的晶体也与杂质金属的盐的晶体一起析出、沉淀,钴与杂质金属一起从酸浸出液中被去除,此后回收钴时钴的回收率可能会降低。
214.为了解决上述课题,本公开的目的在于提供一种钴回收方法,其能够从溶解有钴和杂质金属的被处理液中以高回收率回收钴。
215.本发明人为了解决上述课题进行了深入研究,结果发现,通过调节至少溶解有钴
和杂质金属的被处理液的ph而使杂质金属的盐以晶体的形式析出时,若添加到被处理液中的碱的水溶液的浓度高,则钴盐的晶体与杂质金属的盐的晶体一起析出,钴与杂质金属一起从被处理液中被去除。基于这样的见解并进一步反复研究,结果完成了本公开的钴回收方法。即,本公开提供下述方式的钴回收方法。
216.本公开的钴回收方法的特征在于,其具有下述工序:第1ph调节工序,向至少溶解有钴和杂质金属的酸性的被处理液添加碱的水溶液而将ph调节为4~7,由此使该杂质金属的盐以晶体的形式析出;第1固液分离工序,从被处理液中分离通过上述第1ph调节工序而析出的包含杂质金属的盐的晶体的析出物;第2ph调节工序,向上述第1固液分离工序后的被处理液中添加碱的水溶液而将ph调节为7以上,由此使钴盐的晶体析出;和,第2固液分离工序,从被处理液中分离通过上述第2ph调节工序而析出的包含钴盐的晶体的析出物,其中,上述第1ph调节工序中添加的碱的水溶液的碱浓度小于1.0mol/l。
217.第0163段中记载的钴回收方法中,优选上述第1ph调节工序中添加的碱的水溶液的碱浓度为0.1mol/l以上。
218.另外,第0163或第0164段中记载的钴回收方法中优选:上述第1ph调节工序中,向被处理液中添加具有1.0mol/l以上的碱浓度的碱的水溶液,使得被处理液的ph达到小于4的规定值,之后向被处理液中添加具有小于1.0mol/l的碱浓度的碱的水溶液而将被处理液的ph调节为4~7。
219.另外,第0163至第0165中任一段所述的钴回收方法中,被处理液中溶解有锂,并且优选具有:浓缩工序,对上述第2固液分离工序后的被处理液进行蒸发浓缩;和,碳酸化工序,向上述浓缩工序后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐。
220.另外,第0166段中记载的钴回收方法中,优选进一步具有:第3固液分离工序,从被处理液中分离通过上述碳酸化工序而析出的包含碳酸锂的晶体的析出物;和,电渗析工序,对上述第3固液分离工序后的被处理液进行双极膜电渗析,由此从该被处理液中分离并回收碱,并且将上述电渗析工序中回收的碱作为上述第1ph调节工序和/或上述第2ph调节工序中使用的碱进行再利用。
221.根据本公开的钴回收方法,对于溶解有钴和杂质金属的被处理液,在通过第1ph调节工序从被处理液中去除杂质金属时用碱浓度小于1.0mol/l的稀的碱的水溶液进行被处理液的ph调节,由此能够抑制钴与杂质金属一起从被处理液中被去除。由此,能够使供给于第2ph调节工序的被处理液中的钴量维持得较高,因此在第2ph调节工序中能够以高回收率回收钴。
222.图15示出关于本公开的钴回收方法的实施方式的各工序的步骤,图16示出实施图15的钴回收方法的处理装置10的简要构成。本实施方式的钴回收方法以从废锂离子电池中不仅回收钴、还回收锂的情况为例进行说明。
223.本实施方式的钴回收方法具有:
224.‑
酸浸出工序s1,将废锂离子电池用无机酸进行浸出,使钴和锂溶出;
225.‑
固液分离工序s2,从通过酸浸出工序s1而得到的被处理液中分离不溶残渣;
226.‑
第1ph调节工序s3,向固液分离工序s2后的被处理液中添加碱的水溶液而将ph调节为4~7;
227.‑
固液分离工序s4(相当于第0163段中记载的“第1固液分离工序”),从被处理液中
分离通过第1ph调节工序s3而析出的包含杂质金属的盐的晶体的析出物;
228.‑
第2ph调节工序s5,向固液分离工序s4后的被处理液中添加碱的水溶液而将ph调节为7以上;
229.‑
固液分离工序s6(相当于第0163段中记载的“第2固液分离工序”),从被处理液中分离通过第2ph调节工序s5而析出的包含钴盐的晶体的析出物;
230.‑
浓缩工序s7,对固液分离工序s6后的被处理液进行蒸发浓缩;
231.‑
碳酸化工序s8,向浓缩工序s7后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐;
232.‑
固液分离工序s9(相当于第0167段中记载的“第3固液分离工序”),从被处理液中分离通过碳酸化工序s8而析出的包含碳酸锂的晶体的析出物;和
233.‑
电渗析工序s10,对固液分离工序s9后的被处理液进行双极膜电渗析,由此从该被处理液中分离并回收至少包含氢氧化锂的碱和无机酸。
234.成为锂回收对象的废锂离子电池与上述锂回收方法中相同。
235.首先,在酸浸出工序s1中,将上述废锂离子电池用无机酸进行浸出,由此使钴和锂以及例如铝、镍、铁等金属溶出。作为无机酸,可以使用例如硫酸、盐酸、硝酸、磷酸等,本实施方式中从低成本且处理容易的角度出发使用硫酸。
236.酸浸出工序s1中,将废锂离子电池用无机酸进行浸出的方法没有特别限定,可以使用通常所进行的方法。例如,通过在酸浸出槽1内将废锂离子电池浸渍于例如硫酸水溶液等无机酸的水溶液并搅拌规定时间,得到溶解有上述的钴等金属的酸性的被处理液。酸浸出工序s1中,水溶液中的无机酸的浓度优选为1mol~5mol/l,水溶液的温度优选为60℃以上。
237.接下来的固液分离工序s2中,对通过酸浸出工序s1得到的被处理液例如进行过滤,由此从被处理液中分离出不溶残渣。不溶残渣主要是不溶于无机酸的碳材料、金属材料、有机材料。作为进行固液分离的方法,可以使用例如加压过滤(压滤机)、真空过滤、离心过滤等各种过滤装置、倾析器式之类离心分离装置等公知的固液分离装置。需要说明的是,以下的固液分离工序s4、s6、s9等中也同样。
238.接下来的第1ph调节工序s3中,向固液分离工序s2后的被处理液(滤液)中添加碱的水溶液而将ph调节为4~7、优选4~6、更优选4~5。由此,从被处理液中去除被处理液的上述金属中的杂质金属(例如铝、铁)。作为碱,可以使用氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中使用氢氧化锂。
239.第1ph调节工序s3中,调节被处理液的ph的方法没有特别限定,可以使用通常进行的方法。例如,通过在第1ph调节槽2内边搅拌被处理液边添加例如氢氧化锂水溶液等碱的水溶液,从而使被处理液中的杂质金属以氢氧化物(例如氢氧化铝、氢氧化铁)等无机盐的晶体形态析出、沉淀。第1ph调节工序s3中,优选在将被处理液升温至例如30℃~80℃中的恒定温度的条件下进行。
240.第1ph调节工序s3中添加的碱的水溶液较稀,碱浓度小于1.0mol/l。由此,虽然详情如后所述,但能够在第1ph调节工序s3中抑制被处理液中的钴与杂质金属一起以钴盐的晶体形态析出、沉淀和从被处理液中被去除。但是,若碱浓度过低,则第1ph调节工序s3中需要大量使用碱的水溶液以调节ph,并且ph调节后的被处理液的液体量也变多,因此碱浓度
的下限优选为0.1mol/l以上。另外,为了有效抑制被处理液中的钴在第1ph调节工序s3中从被处理液中被去除,第1ph调节工序s3中添加的碱的水溶液的碱浓度优选为0.5mol/l以下,更优选为0.2mol/l以下。
241.需要说明的是,该第1ph调节工序s3中,为了减少ph调节中使用的碱的水溶液量,还可以向被处理液中添加1.0mol/l以上的具有较高的碱浓度的碱的水溶液至被处理液的ph小于4的规定值,在被处理液的ph达到规定值后向被处理液中添加小于1.0mol/l的具有较低的碱浓度的碱的水溶液,由此将被处理液的ph调节为4~7。作为上述被处理液的ph的规定值,可以设定在2~3的范围内。
242.在第1ph调节工序s3中析出、沉淀的析出物通过在接下来的固液分离工序s4中对被处理液例如进行过滤而从被处理液中分离。需要说明的是,第1ph调节工序s3中从被处理液中去除的杂质金属中还可以包含铜等。固液分离工序s4中,优选用清洗液对析出物进行洗涤并且将洗涤后的洗涤废液与被处理液(滤液)一起供给到接下来的第2ph调节工序s5中。由此,洗涤废液中所含的锂也可以与被处理液中所含的锂一起从第2ph调节工序s5供给到碳酸化工序s8中,在后述的碳酸化工序s8中进行碳酸化,由此能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用后述浓缩工序s7中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。
243.第2ph调节工序s5中,向固液分离工序s4后的被处理液(滤液)中添加碱的水溶液而将ph调节为7以上、优选7~13、更优选7~11、进一步优选8~10。由此,从被处理液中去除被处理液中的上述金属中的钴、以及镍等贵金属。作为碱,可以使用氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中使用氢氧化锂。
244.第2ph调节工序s5中,调节被处理液的ph的方法没有特别限定,可以使用通常进行的方法。例如,通过在第2ph调节槽3内边搅拌被处理液边添加例如氢氧化锂水溶液等碱的水溶液,由此使被处理液中的贵金属以氢氧化物(例如氢氧化铁钴、以及氢氧化镍)等无机盐的晶体形态析出、沉淀。由此,可以以氢氧化钴等钴盐形态回收被处理液中的钴。第2ph调节工序s5中,优选一边使被处理液升温到例如30℃~80℃中的恒定温度一边进行。第2ph调节工序s5中添加的碱的水溶液的碱浓度没有特别限定,优选大于等于第1ph调节工序s3中使用的碱的水溶液的碱浓度,进一步优选碱浓度为0.2mol/l以上。
245.在第2ph调节工序s5中析出、沉淀的析出物在接下来的固液分离工序s6中通过对被处理液进行例如过滤而从被处理液中分离。需要说明的是,第2ph调节工序s5中从被处理液中去除的贵金属还可以包含锰等。另一方面,固液分离工序s6后的被处理液(滤液)中,包含锂和无机酸的阴离子(例如硫酸根离子)。
246.固液分离工序s6中,优选用清洗液对析出物进行洗涤并且将洗涤后的洗涤废液与被处理液(滤液)一起供给到接下来的浓缩工序s7中。由此,洗涤废液中所含的锂也能够与被处理液中所含的锂一起从浓缩工序s7供给到碳酸化工序s8,在后述的碳酸化工序s8中进行碳酸化而能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s7中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。
247.需要说明的是,该第1ph调节工序s3和第2ph调节工序s5中,通过将使用的碱设为氢氧化锂,与使用氢氧化钠等其它碱金属的氢氧化物的情况相比能够抑制后述的碳酸化工
序s8中析出的碳酸锂的晶体中混入例如钠等除锂以外的碱金属。由此,能够回收纯度高的碳酸锂。
248.接下来的浓缩工序s7中,对固液分离工序s6后的含有锂的被处理液进行加热而进行蒸发浓缩,即使被处理液中的水分蒸发,由此对被处理液进行浓缩。由此,被处理液的液体量减少、被处理液中的锂浓度增加。由此,在后述的碳酸化工序s8中能够提高碳酸锂的回收率。
249.另外,浓缩工序s7中,通过对被处理液进行蒸发浓缩,能够提高浓缩后的被处理液的温度,在后述的碳酸化工序s8中能够提高碳酸锂的回收率。温度越高则碳酸锂的溶解度越低,因此在碳酸化工序s8中被处理液的温度升高则被处理液中的通过锂与二氧化碳的反应而生成的碳酸锂的溶解度降低,因此能够增加碳酸锂晶体的析出量。
250.浓缩工序s7中,优选将被处理液浓缩至如下浓度,所述浓度为锂在浓缩后的被处理液中例如不会以硫酸锂等锂盐的晶体形态析出的程度。由此,能够提高浓缩后的被处理液中的锂浓度,在后述的碳酸化工序s8中能够提高碳酸锂的回收率。需要说明的是,浓缩工序s7中析出了析出物的情况下,可以进行将其从被处理液中分离的固液分离工序。
251.浓缩工序s7中,对被处理液进行蒸发浓缩的方法没有特别限定,例如,可以使用蒸发浓缩装置5。作为蒸发浓缩装置5,只要能够通过蒸发而将被处理液浓缩就没有特别限定,可以使用例如热泵型、喷射器(eductor)驱动型、蒸汽型、闪蒸型等公知的蒸发浓缩装置,优选热泵型的蒸发浓缩装置。使用热泵型的蒸发浓缩装置的情况下,能够显著抑制所用的能量。另外,通过在减压气氛下进行被处理液的浓缩,能够进一步实现节能。
252.接下来的碳酸化工序s8中,向浓缩工序s7后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐,由此使被处理液中的锂以碳酸锂的晶体形态析出、沉淀。由此,能够以碳酸锂的形态回收被处理液中的锂。作为碳酸盐,可以使用例如碳酸钠、碳酸铵、碳酸钾等。
253.该碳酸化工序s8中,优选通过向被处理液中混合二氧化碳而使碳酸锂的晶体析出、沉淀。由此,在碳酸化工序s8中使用例如不含钠等碱金属的材料,能够抑制除锂以外的碱金属混入到所析出的碳酸锂晶体中。由此,能够回收纯度高的碳酸锂。
254.碳酸化工序s8中,向被处理液中混合二氧化碳的方法没有特别限定,可以使用通常进行的方法。例如,可以一边在碳酸化槽7内搅拌被处理液一边用喷嘴以微细气泡的状态向被处理液中供给二氧化碳,由此能够向被处理液中均匀地混合二氧化碳,能够使被处理液中的锂与二氧化碳高效地进行反应。另外,也可以通过在二氧化碳气氛下对被处理液进行喷雾而与二氧化碳进行反应。
255.碳酸锂的溶解度会随着温度升高而降低,因此在碳酸化工序s8中优选使被处理液升温。由此,被处理液中的通过锂与二氧化碳的反应而产生的碳酸锂的溶解度降低,从而能够增加碳酸锂晶体的析出量。
256.接下来的固液分离工序s9中,对碳酸化工序s8后的被处理液进行例如过滤,由此从被处理液中分离包含碳酸锂的晶体的析出物。在固液分离工序s9中,通过用水等洗涤从被处理液中分离出的析出物,从而能够去除杂质、提高碳酸锂的纯度。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s7中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够进行冷凝水的有效利用。需要说明的是,洗涤析出物后的洗涤废液优选与固液分离工序s9后的被处理液(滤液)一起供给于后述的电渗析工序s10的双极膜电渗析装置6。
257.接下来的电渗析工序s10中,将固液分离工序s9后的被处理液供给于双极膜电渗析装置6,由此从该被处理液中分离并回收碱和无机酸。作为双极膜电渗析装置9,例如,可以适宜使用图17所示的三室单元方式的双极膜电渗析装置,所述三室单元方式的双极膜电渗析装置是多个单元90层叠而成的,所述单元90在阳极95与阴极96之间具备阴离子交换膜91、阳离子交换膜92和2片双极膜93、94。本实施方式的双极膜电渗析装置9中,由阴离子交换膜91和阳离子交换膜92形成脱盐室r1,在阴离子交换膜91和一片双极膜93之间形成酸室r2,在阳离子交换膜92与另一片双极膜94之间形成碱室r3。在各双极膜93、94的外侧形成有阳极室r4和阴极室r5,阳极室r4中配置有阳极95,阴极室r5中配置有阴极96。
258.该电渗析工序s10中,向脱盐室r1中导入被处理液,向酸室r2和碱室r3中分别导入纯水。由此,在被处理液包含锂和无机酸的阴离子(本实施方式中为硫酸根离子)的情况下,在脱盐室r1中,锂离子(li
+
)通过阳离子交换膜92,硫酸根离子(so
42
‑
)通过阴离子交换膜91。另一方面,在酸室r2和碱室r3中,所供给的纯水在双极膜93、94中解离为氢离子(h
+
)和氢氧根离子(oh
‑
),在酸室r2中氢离子(h
+
)与硫酸根离子(so
42
‑
)结合而生成硫酸(h2so4),在碱室r3中氢氧根离子(oh
‑
)与锂离子(li
+
)结合而生成氢氧化锂(lioh)。由此,从酸室r2中回收作为无机酸的硫酸(h2so4),从碱室r3回收作为碱的氢氧化锂(lioh)。需要说明的是,导入到酸室r2和碱室r3中的纯水可以利用浓缩工序s7中对被处理液进行蒸发浓缩时产生的冷凝水。
259.脱盐室r1所排出的脱盐后的稀被处理液(脱盐液)虽然没有特别限定,但是由于包含少量的锂而优选至少一部分被供给于浓缩工序s7(蒸发浓缩装置5)或后述的浓缩工序s7之前的杂质去除工序(多价阳离子去除装置),再次在浓缩工序s7中浓缩后在碳酸化工序s8中进行碳酸化。由此,能够以高回收率回收锂。需要说明的是,脱盐液在本实施方式中被供给于浓缩工序s7,但是也可以供给于第1ph调节工序s3。由此,当脱盐液中残留有钴时,能够提高钴的回收率。
260.另外,从酸室r2回收的无机酸(本实施方式中为硫酸)虽然没有特别限定,但是优选供给于酸浸出槽1而在酸浸出工序s1中作为对废锂离子电池进行浸出的无机酸进行再利用。
261.另外,从碱室r3回收的碱(本实施方式中为氢氧化锂)虽然没有特别限定,但是优选供给于ph调节槽2、3而在ph调节工序s3、s5中作为用于调节被处理液的ph的碱进行再利用。
262.根据上述的本实施方式的钴回收方法,对于溶解有钴和杂质金属的被处理液,在第1ph调节工序s3中从被处理液去除杂质金属时用碱浓度小于1.0mol/l的稀的碱的水溶液进行被处理液的ph调节,从而能够抑制钴与杂质金属一起从被处理液中被去除。由此,能够使供给于第2ph调节工序s5的被处理液中的钴量维持得较高,因此在第2ph调节工序s5中能够以高回收率回收钴。
263.另外,根据本实施方式的钴回收方法,在第1ph调节工序s3中使用碱浓度小于1.0mol/l的稀的碱的水溶液,因此供给于其后的用于回收锂的碳酸化工序s8中的被处理液的液体量变多,但是通过在碳酸化工序s8之前在浓缩工序s7中对被处理液进行蒸发浓缩而减少被处理液的液体量。增大被处理液中的锂浓度。由此,在碳酸化工序s8中能够良好地提高碳酸锂的回收率。而且,供给于碳酸化工序s8的被处理液的温度随着被处理液的蒸发浓
缩而升高,因此碳酸锂的溶解度降低,能够增加碳酸锂的析出量。
264.需要说明的是,第1ph调节工序s3中,在将被处理液的ph调节为4~7时,可以如下进行来减少ph调节中使用的碱的水溶液的量,即,向被处理液中添加碱浓度为1.0mol/l以上的碱的水溶液直至被处理液的ph达到规定值,在被处理液的ph达到规定值之后,向被处理液中添加碱浓度小于1.0mol/l的碱的水溶液。
265.另外,根据本实施方式的钴回收方法,通过使电渗析工序s10中回收的无机酸和碱分别循环到酸浸出工序s1和ph调节工序s3、s5中而进行再利用,从而能够减少各工序s1、s3、s5中使用的无机酸、碱的量。
266.以上对本公开的钴回收方法的一实施方式进行了说明,但是本公开的钴回收方法不限于图15和图16的实施方式,可以在不脱离本公开的主旨的限度内进行各种变更。
267.例如,图15和图16的实施方式中,将电渗析工序s10中回收的碱供给于第1ph调节工序s3和第2ph调节工序s5,但是也可以以仅供给于任一工序的方式构成。
268.另外,图15和图16的实施方式中,对于通过电渗析工序s10而回收氢氧化锂后的稀被处理液(脱盐液),将至少一部分供给于浓缩工序s7,但是也可以代替该工序或在该工序的基础上以供给于电渗析工序s10的方式构成。
269.另外,图15和图16的实施方式中,在碳酸化工序s8之前具有浓缩工序s7,但是并非必须具有浓缩工序s7。需要说明的是,这种情况下可以以下述方式构成:对于通过电渗析工序s10回收氢氧化锂后的稀被处理液(脱盐液),将至少一部分供给于碳酸化工序s8。
270.另外,图15和图16的实施方式可以以下述方式构成:对于浓缩工序s7之前的被处理液和/或供给于电渗析工序s10的被处理液,去除被处理液中的2价以上的多价阳离子(代表性的是钙离子、镁离子)杂质。若被处理液中存在钙离子、镁离子等多价阳离子,有该多价阳离子在双极膜电渗析装置9的阳离子交换膜内析出、导致膜的性能降低的担心,通过事先从被处理液中去除多价阳离子,由此能够防止对双极膜电渗析装置9中的阳离子交换膜的不良影响。去除该多价阳离子的具体方案没有特别限定,例如,可以例示出能够向填充有螯合树脂的柱中通入被处理液的公知的多价阳离子去除装置。作为螯合树脂,可以使用能够选择性捕捉钙离子、镁离子的螯合树脂,可例示例如亚氨基二乙酸型、氨基磷酸型等。作为多价阳离子去除装置,此外可列举添加有螯合剂者、利用离子交换树脂者等。需要说明的是,从被处理液中去除的杂质除了钙、镁以外还可以包含二氧化硅(硅酸根离子)。
271.另外,图15和图16的实施方式中,如图18和图19所示,可以在酸浸出工序s1之前还具有对废锂离子电池进行焙烧的焙烧工序s0。焙烧工序s0中,对废锂离子电池进行焙烧的方法没有特别限定,可以使用公知的焙烧装置12。
272.图18和图19的实施方式中,将焙烧装置12(焙烧工序s0)中产生的排放气体供给于碳酸化槽7(碳酸化工序s8),作为二氧化碳混合到被处理液中。由此,能够减少碳酸化工序s8中使用的二氧化碳的量。
273.另外,图15和图16的实施方式中,浓缩工序s7以后的工序中的锂回收方法没有特别限定,可以为上述的本公开的锂回收方法。需要说明的是,上述实施方式的锂回收方法在酸浸出工序s1至固液分离工序s6中使用本公开的钴回收方法。
274.另外,上述实施方式的钴回收方法以从废锂离子电池回收钴的情况为例,但是本公开的钴回收方法不限于用于从废锂离子电池中回收钴的方法。
275.试验例
276.对于第1ph调节工序s3中添加的碱的水溶液的碱浓度,本发明人进行了以下试验。具体而言进行了下述处理:相对于具有下述表1所示的成分的被处理液200ml添加碱的水溶液,从而对被处理液的ph进行调节(第1ph调节工序s3)。作为添加的碱的水溶液,使用氢氧化锂水溶液。氢氧化锂水溶液的碱浓度设为0.2mol/l(实施例1)、0.5mol/l(实施例2)、1.0mol/l(实施例3),调节氢氧化锂水溶液的添加量而使被处理液的ph达到4.7。氢氧化锂水溶液的添加量在实施例1中为418.6ml,在实施例2中为168.5ml,在实施例3中为86.3ml。需要说明的是,通过添加氢氧化锂水溶液,被处理液中的锂含量在实施例1中为582mg,在实施例2中为585mg,在实施例3中为599mg,进一步增加。
277.[表1]
[0278][0279]
然后将ph调节后的被处理液用滤纸过滤,对通过过滤而得到的滤液中所含的各成分的含量进行测定。将其结果示于表2。
[0280]
[表2]
[0281][0282]
另一方面,对ph调节后的被处理液的通过过滤而得到的过滤残渣的表面状态进行了确认。将其结果示于图20至图22。需要说明的是,图20示出实施例1,图21示出实施例2,图22示出实施例3。根据图22,目视可确认实施例3的过滤残渣中包含氢氧化钴,而根据图20和图21,目视下未能确认到实施例1、2的过滤残渣包含氢氧化钴。
[0283]
根据以上的结果,由图20至图22可确认:在第1ph调节工序s3中添加到被处理液中的碱的水溶液的碱浓度为1.0mol/l时,被处理液进行ph调节后过滤残渣中包含较多的钴盐。另外,根据表2,在第1ph调节工序s3中添加到被处理液中的碱的水溶液的碱浓度为1.0mol/l时,ph调节后的被处理液(滤液)的钴回收率低于85%,而碱浓度小于1.0mol/l时ph调节后的被处理液(滤液)的钴回收率为85%以上,可确认被处理液(滤液)中残留了较多
的钴。
[0284]
由此,通过将第1ph调节工序s3中添加到被处理液中的碱的水溶液的碱浓度设为小于1.0mol/l,能够抑制在第1ph调节工序s3中钴与杂质金属(例如铝)一起从被处理液中被去除,能够使供给到接下来的第2ph调节工序s5的被处理液中的钴含量维持得较高。由此,在第2ph调节工序s5中能够以高回收率回收钴。
[0285]
附图标记说明
[0286]
s0
ꢀꢀꢀꢀꢀ
焙烧工序
[0287]
s1
ꢀꢀꢀꢀꢀ
酸浸出工序
[0288]
s3
ꢀꢀꢀꢀꢀ
第1ph调节工序(ph调节工序)
[0289]
s5
ꢀꢀꢀꢀꢀ
第2ph调节工序(ph调节工序)
[0290]
s7
ꢀꢀꢀꢀꢀ
杂质去除工序
[0291]
s8
ꢀꢀꢀꢀꢀ
浓缩工序
[0292]
s9
ꢀꢀꢀꢀꢀ
析晶工序
[0293]
s10
ꢀꢀꢀꢀ
固液分离工序(第1固液分离工序)
[0294]
s11
ꢀꢀꢀꢀ
碳酸化工序
[0295]
s12
ꢀꢀꢀꢀ
固液分离工序(第2固液分离工序)
[0296]
s13
ꢀꢀꢀꢀ
溶解工序
[0297]
s13
‑1ꢀꢀ
重结晶工序
[0298]
s13
‑3ꢀꢀ
重溶解工序
[0299]
s14
ꢀꢀꢀꢀ
电渗析工序。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1