一种逆水煤气反应制备合成气的Fe/CeO2催化剂
一种逆水煤气反应制备合成气的fe/ceo2催化剂
技术领域
1.本发明涉及材料科学技术领域,具体涉及一种逆水煤气反应制备合成气的fe/ceo2催化剂。
背景技术:
2.目前,汽车逐年增加,化石燃料(包括煤、石油和天然气等)的大规模使用,导致co2的大量排放,大量未经处理的co2直接排放至空气中,使大气中co2含量逐年升高。对人体、环境和经济造成严重危害。co2逆水煤气反应被认为是最有应用前景的方法之一,通过加氢反应将co2转化成更活泼的co,与h2一块形成合成气。目前常见的逆水煤气变换反应包括贵金属催化剂(如,pt、pd、au等)和非贵金属催化剂(如,cu、ni、fe等)。其中贵金属催化剂的催化效果较好,但资源稀缺且价格昂贵。而非贵金属催化剂:铜基催化剂选择性好,但活性和高温热稳定性较差;ni基催化剂催化活性好,但常常会产生ch4副产物,co选择性差。总的来讲,co2逆水煤气反应主要存在的问题:(1)贵金属催化剂成本高;(2)非贵金属催化剂低温催化活性低,难同时实现高转化率的同时兼具100%的co选择性;(3)催化剂易烧结;(4)制备方法复杂。因此,开发低温高活性兼具高选择性的催化剂是推动逆水煤气变换反应工业化应用的关键。
技术实现要素:
3.针对现有技术存在的上述不足,本发明旨在于提供一种逆水煤气反应制备合成气的fe/ceo2催化剂,以解决现有技术中催化剂成本高、非贵金属催化剂低温催化活性低、co选择性低、催化剂易烧结、制备方法复杂的问题。
4.为了解决上述技术问题,本发明采用如下技术方案:
5.一种逆水煤气反应制备合成气的fe/ceo2催化剂,所述fe/ceo2催化剂用于co2催化加氢制备合成气,使co2转化率为50%以上,co选择性为100%。
6.优选地,所述催化剂通过如下方法制备获得:
7.步骤1:将硝酸铈溶于水中,搅拌0.5~1h使其充分溶解后,用1mol/l的naoh溶液调其ph至9,搅拌后静止离心洗涤至中性,干燥后在250~600℃焙烧2~4h,得到载体ceo2;
8.步骤2:将硝酸铁溶于蒸馏水中,搅拌溶解后,加入步骤1得到的载体ceo2,静置搅拌并超声处理,然后蒸干并干燥,在250~600℃焙烧1~3h,得到产物fe/ceo2;其中,硝酸铁中fe元素的质量和ceo2的质量比为1~30%。
9.优选地,在步骤1中,焙烧温度为300~500℃。
10.优选地,在步骤2中,硝酸铁中fe元素的质量和ceo2的质量比为15~20%。
11.优选地,在步骤2中,焙烧温度为300~500℃。
12.本发明所述fe/ceo2催化剂用于co2催化加氢制备合成气具体步骤为:
13.步骤1:将所述催化剂放入反应器中,先通入h2并升温至300~600℃还原1h;其中,还原温度优选为400℃。
14.步骤2:步骤1结束后,在h2氛围中降温至380-500℃,通入体积比为co2:h2:ar=1:4:5的原料气进行反应。其中,反应温度优选为500℃。
15.本发明在对逆水煤气反应制备合成气的催化剂进行了解发现,贵金属催化剂(如,pt、pd、au等)催化效果较好,但资源稀缺且价格昂贵。而非贵金属催化剂(如,cu、ni、fe等)价格低廉,成为研究的热点,但其催化活性却不尽如人意。本发明在此基础上,考虑选用价格廉价且抗烧结的fe元素作为催化剂的原料,寻找较优的催化剂载体和较优的制备方法,并探寻最适的还原温度和负载量。本发明分别选择al2o3、ceo2、kit6、la2o3、mgo、mno作为催化剂载体,发现在相同fe含量(10wt.%)下,ceo2因其良好的氧化还原能力、高氧迁移率、成本低、碱度及良好的储放氧能力,作为载体能与金属fe协同高效促进低温rwgs,主要是由于:1)fe作为rwgs反应的活性金属,易释放外层电子来激活反应物分子,同时缺电子的ce和富电子的fe易产生强烈的电子效应;2)ce的加入,fe与ceo2之间良好的协同作用,利于fe物种溶入ceo2晶格,形成大量fe-o-ce固溶体,抑制了fe物种的晶粒生长,让fe在ceo2载体上形成高度分散并暴露更多的活性中心;3)前驱体中的fe氧化物物种可完全被还原为更利于rwgs反应的fe0活性物种,形成更多的金属活性位点;4)ceo2的氧空穴和碱性,均利于co2的吸附和活化,进而促进低温rwgs的高活性和高选择性。
16.此外,本发明还发现,不同的制备方法和不同还原温度也影响着催化剂的催化性能,浸渍法、络合法、沉淀法、软模板法均是制备催化剂的常用方法。
17.络合法主要是利用柠檬酸在高温时候释放气体加快金属的迁移,甚至部分组分随产生的气体流失,利于降低催化剂中金属物相的结晶度,从而使得金属活性组分得到更好的分散;但其由于结构上缺少支撑体,以及高温焙烧和还原过程使得金属的晶粒的生长不可控,从而导致最终形成晶粒尺寸较大的高结晶度金属物相,使金属活性组分出现团聚,最终影响催化效果。
18.软模板法制备过程复杂,且多为有机物之间的反应,在高温焙烧过程中,游离的水和表面活性剂容易受热分解,释放大量的h2o和co
x
等气体,促进了催化剂表面孤立的非晶态金属物种的形成,这在一定程度上保证了催化剂中金属活性组分良好的分散以及低的结晶度,虽然软模板法制备得到的催化剂最终在500℃时能够达到与浸渍法制备的催化剂相同的co2转换率,但是,软模板法制备得到的催化剂在前期温度对co2转换率提升效果不佳,使得其催化效果整体不如浸渍法,且软模板法制备过程复杂,不利于工业大规模应用。
19.沉淀法制备催化剂时,碱性环境中的金属离子被完全固定下来,减少了高温焙烧时的热流失,且粒子在生长过程中呈现出一种无序生长状态,使得催化剂晶粒尺寸无法得到有效的控制,晶粒尺寸较大,最终对催化剂催化效果的提升非常有限。
20.而浸渍法制备的催化剂具有发达的介孔结构、高的比表面积,特别是介孔内壁表面积,这将有利于增大反应物分子与活性组分物种的接触几率,从而提高吸附和活化反应物分子的能力,同时浸渍法制备方法简单,反应过程可控,具有良好的工业应用前景。
21.与现有技术相比,本发明具有如下有益效果:
22.本发明选用ceo2作为载体负载价格低廉且抗烧结fe元素作为催化剂,并通过浸渍法制成fe/ceo2催化剂;本发明所述催化剂同时兼具高co2转化率和高co选择性,co2转化率达51.61%,co选择性高达100%,且制备方法简单,反应过程可控,具有良好的工业应用前景。
附图说明
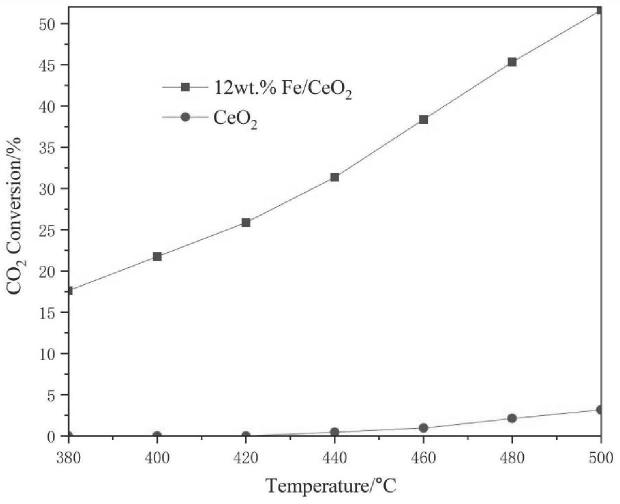
23.图1为实施例1催化剂对co2催化加氢时co2的转化率图。
24.图2为实施例1催化剂对co2催化加氢时co的选择性图。
25.图3为实施例1催化剂与fe基其他催化剂催化活性比较图。
26.图4为实施例1催化剂的xrd图。
27.图5为实施例1催化剂的n2吸-脱附等温线。
28.图6为实施例1催化剂的孔径分布图。
29.图7为实施例1中还原温度对催化剂co2催化加氢影响图。
30.图8为不同fe负载量对催化剂co2催化加氢影响图。
31.图9为不同fe负载量对co2催化加氢时co的选择性图。
32.图10为对比例不同制备方法制备催化剂催化活性比较图。
具体实施方式
33.下面将结合附图和实施例对本发明作进一步说明。
34.一、一种逆水煤气反应制备合成气的fe/ceo2催化剂
35.实施例1
36.ceo2的制备:20g硝酸铈加入360ml蒸馏水中,搅拌0.5h,充分溶解,1mol/l的naoh溶液调其ph至9,继续搅拌1h,静置24h,离心洗至中性,干燥1晚,500℃焙烧3h,即得载体ceo2。
37.fe/ceo2制备:0.721g硝酸铁溶入10ml蒸馏水中,搅拌溶解,加入0.88g ceo2,静置搅拌1h,超声15min,转入70℃水浴锅蒸干,100℃干燥1晚,300℃焙烧2h,即得产物fe/ceo2。
38.对比例
39.采用不同方法制备fe/ceo2催化剂,并对其催化活性进行验证。
40.浸渍法:采用实施例1中的fe/ceo2制备方法即得产物。
41.络合法:1.658g柠檬酸溶入10ml蒸馏水中,加入1.443g硝酸铁和2.019g硝酸铈,搅拌溶解,70℃水浴锅蒸干,90℃干燥1晚,300℃焙烧2h,即得产物。
42.沉淀法:2.886g硝酸铁和4.037g硝酸铈溶于80ml蒸馏水中,搅拌0.5h,充分溶解,1mol/l的naoh溶液调其ph至9,静置24h,离心洗至中性,100℃干燥1晚,300℃焙烧2h,即得产物。
43.软模板法:1gctab完全溶解于100ml蒸馏水中,40℃超声10min,同时称2.886g硝酸铁和4.037g硝酸铈溶于20ml蒸馏水中;将硝酸铁和硝酸铈的混合溶液缓缓加入ctab溶液中,搅拌10min,氨水滴定至ph=9,继续搅拌1h,放入水热斧中,90℃烘箱晶化12h,离心洗至中性,90℃干燥1晚,500℃焙烧2h,即得产物。
44.二、一种逆水煤气反应制备合成气的fe/ceo2催化剂的应用
45.将实施例和对比例制备的系列催化剂在常压微型固定床反应器中进行co2催化加氢活性测试。称取50mg前驱体装入直径为6nm u型石英管中,通入h2并程序升温至400℃先还原1h,还原结束后在h2氛围中降温至反应温度。通入体积比为co2:h2:ar=1:4:5的原料气,反应空速控制为60,000ml/g/h,待气流稳定后,用程序升温控制反应温度测试相应催化剂的co2催化加氢活性。反应前后的气体组成由配有tcd气相色谱(sc-200g)在线检测及分
析。co2转化率(式(1))和co选择性(式(2))计算公式分别如下:
46.co2conversion(%)=([co2]
in-[co2]
out
)/([co2]
in
)
×
100(1)
[0047]
coselectivity(%)=([co]
out
)/([co2]
in-[co2]
out
)
×
100(2)
[0048]
如图1和图2所示,纯ceo2的co2催化加氢性能很差,在500℃时,co2的转化率仅为3.17%。fe加入后,fe/ceo2复合催化剂的co2催化加氢性能大幅度提高,在500℃时,12wt.%fe/ceo2的co2的转化率和co的选择性分别高达51.61%和100%。
[0049]
如图3所示,与不同载体相比,相同负载量(10wt.%)时,fe/ceo2复合催化剂的催化加氢性能远高于目前常用的一些载体负载的催化剂,在500℃时,fe/kit6、fe/la2o3、femno、fe/al2o3和fe/mgo的co2转化率分别为7.81%、12.38%、13.94%、14.12%和20.21%,远低于fe/ceo2(48.20%)。由于载体会影响fe的初始分散和反应过程的团聚,进而影响催化性能,而fe与ceo2载体具有良好的协同作用,fe物种溶入ceo2晶格,形成大量fe-o-ce固溶体,抑制了fe物种的晶粒生长,使得fe在ceo2载体上高度分散。
[0050]
如图4所示,ceo2和fe/ceo2催化剂分别在2θ=28.5
°
、33.1
°
、47.4
°
、56.3
°
、59.2
°
,69.5
°
、76.8
°
和79.1
°
处观察到明显的xrd峰,归属于立方萤石型结构的ceo2(jcpds:34-0394)。在2θ=44.7
°
和65.1
°
处观察到明显的fe0物种的特征xrd峰(jcpds:87-0721)。ceo2催化剂形成了尖锐且高强度的特征xrd峰,这归因于在恒温结晶过程中,ce(oh)3的沉淀不断聚集,且制备ceo2催化剂时经历了高温焙烧和还原,促进了高结晶度ceo2晶相的形成。fe/ceo2催化剂中金属fe的特征xrd峰强度明显降低,这主要是由于fe物种的相对含量随着ce种类的相对含量的增加而减少。fe和ce间的相互作用,抑制了fe物种的晶粒生长,导致金属fe物种的结晶度显著降低。在fe/ceo2催化剂的xrd谱图中未观察到fe氧化物的特征xrd峰,这主要是由于相应催化剂中的fe氧化物处于高度分散状态或被h2完全还原。结果表明:在400℃条件下,fe/ceo2样品可被h2有效还原成金属fe。
[0051]
如图5和图6所示,采用低温n2吸附-脱附法测定了10wt.%fe/ceo2催化剂上n2吸附-脱附等温线和孔径分布,如图5所示,在p/p0=0-0.4时,10wt.%fe/ceo2催化剂上的吸脱附等温线基本重合,为催化剂孔道内的单分子层吸附;在p/p0=0.4-1.0时,各催化剂的吸脱附等温线出现突跃区,并形成了滞后环。根据iupac分类,10wt.%fe/ceo2催化剂的n2等温吸附-脱附曲线呈现出具有h3滞后环的iv型等温线,表明制得的10wt.%fe/ceo2催化剂具有良好的介孔结构。如图6所示,10wt.%fe/ceo2催化剂呈现双级介孔结构,孔径分布集中在5.4和15.2nm。其比表面积、孔体积和孔直径分别为60.08m2/g、0.12cm3/g和6.33nm。
[0052]
如图7所示,实施例1制备得到的催化剂在还原温度分别为300℃、400℃、500℃、600℃条件下先还原1h后再降至反应温度进行反应,本发明所述催化剂中,还原温度为400℃时,制备的催化剂催化活性最高。进一步升高还原温度到500℃和600℃,制得的催化剂的催化活性反而变差。故还原温度为400℃时,fe/ceo2催化剂具有最佳催化性能。
[0053]
以实施例1为例,改变实施例1中fe的负载量,依次制备fe负载量为1wt%、5wt%、10wt%、12wt%、15wt%的催化剂,并对其催化性能进行测试,得到图8和图9。如图8和图9所示,纯ceo2的co2催化加氢性能很差,在500℃时,co2的转化率仅为3.17%。由图8可见,fe加入后,fe/ceo2复合催化剂的co2催化加氢性能大幅度提高。且随着fe含量的增加,co2的转化率也增加,但当负载量达到12wt.%以上后,对催化性能的提升便不大了,因此,12wt.%fe/ceo2展现出最优的co2催化加氢性能,在500℃时,co2的转化率和co的选择性分别高达
51.61%和100%。随着fe含量的增加,fe/ceo2复合催化剂的催化性能增加幅度减缓,主要由于随金属fe的增加,催化剂活性组分fe的含量增加,相应的活性位点数量也增加,但达到一定负载量后,催化剂的催化活性就不再增加,甚至出现变差的现象,主要是由于随着fe含量的增加,fe物种的晶粒尺寸变大,金属fe的分散性变差。
[0054]
如图10所示,在催化加氢的反应温度为380-500℃范围内,不同制备方法制备的催化剂的co2加氢反应转化率随着反应温度的升高而增加。但采用浸渍法制备的fe/ceo2催化剂的催化活性最佳,这是由于浸渍法制备的fe/ceo2催化剂具有发达的介孔结构、高的比表面积,特别是介孔内壁表面积,这将有利于增大反应物分子与活性组分物种的接触几率,从而提高吸附和活化反应物分子的能力。
[0055]
与其他常用的非贵金属催化剂cu相比:cu基催化剂在水煤气变换(wgs)反应和加氢反应中表现出优异的催化氢化性能,cu在较低温度下对反应中间体的吸附强,故被广泛用于rwgs反应的研究,但研究发现,本发明所述fe/ceo2的催化活性远高于其他单组分负载型催化剂。
[0056]
表1 cu基催化剂用于rgws反应
[0057]
催化剂反应温度(℃)co2转化率(%)co选择性(%)文献zno:0.5cu500~25—wen等zno:1.5cu500~30—wen等zno:6.5cu500~31—wen等zno:3.5cu500~35—wen等1cu/zno500~27—wen等cu/ceo
2-hs500~40100zhang等cu/ceo
2-np500~30100zhang等cu/ceo
2-nc500~10100zhang等cu/ceo240031.34100zhou等1wt.%cu/β-mo2c500~22100zhang等3wt.%cu/β-mo2c500~20100zhang等5wt.%cu/β-mo2c500~17100zhang等10wt.%cu/β-mo2c500~10100zhang等12wt.%fe/ceo250051.61100本发明
[0058]
最后需要说明的是,以上实施例仅用以说明本发明的技术方案而非限制技术方案,本领域的普通技术人员应当理解,那些对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1