样本分析系统的制作方法
技术领域
本申请总体上涉及样本分析系统,确切地说,涉及用于检测样本中的生物材料的集成式采样-应答分析系统(sample-to-answer analysis system)。
背景技术:
分子检测是在分子级别进行的旨在检测被测样本中的生物材料如DNA、RNA和/或蛋白质的一项检测。分子检测已因其速度、灵敏度和特异性而开始表现为金标。例如分子试验被发现当在脑脊髓液中识别肠道病毒时比传统的培养法灵敏75%以上,并且现在被考虑作为此诊断法的金标(勒兰德等人,Clin.Microbiol Rev.2007,20:49-78)。
微阵列最主要用在研究实验室内作为勾画基因表达水平的工具,因为可以对单个样本进行数千次试验测试。微阵列尚未在临床实验室广泛用于分子检测,因为其操作复杂性和成本(通常每项检测要花费数百美元)。微阵列检测的高成本是因为以下三个基本限制条件:(1)通常依赖光刻法的多步骤制造工艺,(2)装置组合,其通常由玻璃基材或硅基材构成,有时包含复杂的微流体设计,用于执行长序列步骤,和/或(3)与操作这些非常复杂的检测相关的人工。因此,人们需要研发更经济划算的方法和装置来进行利用微阵列技术的分子检测。
技术实现要素:
本申请的一个方面涉及一种用于样本分析装置的一次性反应盒。该一次性反应盒包括多个容器和流动条。每个容器具有敞开的顶端和封闭的底端。多个容器中的至少一个预封装有样本分析作业所需要的试剂并且在该容器的顶端利用可去除的或可刺破的盖来封闭。流动条包括多个端口和与一个或多个端口相连通的一个或多个反应腔。每个反应腔包括微阵列。所述多个端口通过用于在所述多个端口和样本分析装置之间建立流体连通的一个或多个流体连通机构与该样本分析仪器相互作用。
本申请的另一个方面涉及流动条。流动条包括多个端口和多个反应腔。每个端口包括用于建立与样本纯化装置的流体连通的可刺破的隔膜或圆顶阀。每个反应腔装有微阵列并且与一个端口相连通。
本申请的另一方面涉及一种流动控制歧管。流动控制歧管包括歧管体、形成在该歧管体上且适于连接至供流装置的多个供流端口、形成在该歧管体内的多个柱塞通道以及可沿柱塞通道的长度运动的多个柱塞。每个柱塞通道在一端具有柱塞通道入口并在另一端具有柱塞通道出口。每个柱塞包括封贴在该柱塞所处的柱塞通道的内壁上的密封件。该柱塞从柱塞通道入口进入该柱塞通道。所述多个供流端口中的每一个供流端口在该柱塞通道的柱塞通道入口附近的位置处被连通至柱塞通道。
本申请的又一个方面涉及一种流动控制选择器。流动控制选择器包括具有多个输出端口的选择器通道和包括细长的杆和控制该杆的线性运动的马达的线性运动致动器。该细长的杆具有近端、远端和在该杆内围出的流体连通通道。该流体连通通道从在该杆的近端上的第一开口延伸至在该杆的远端上的第二开口。第一开口适于连接至流体源,该杆上的两个密封件连接于第二开口的侧旁,从而当该杆安放在选择器通道内时,这两个密封件封贴在选择器通道的内壁上并且在这两个密封件之间形成流体连通路径。当在第二开口和流动控制选择器的输出端口之间形成流体连通路径时,在流体源和流动控制选择器的输出端口之间建立起流体连通。
本申请的另一个方面涉及一种集成式样本分析系统。该系统包括:(1)样本制备/分析模块,其包括具有专门结合核酸的整块样本纯化装置和在具有亲水性内表面的反应腔内封装有微阵列的样本分析装置;(2)温控模块,包括具有导热温控囊的热循环器,该囊设计成在接纳温控物质时膨胀而抵接该反应腔的外表面,从而能实现在温控物质和反应腔内室之间的换热;和(3)布置用于采集在反应腔内的微阵列图像的成像装置。
附图说明
为了说明起见,除非另作说明,否则在不同附图中使用相同的附图标记表示相同的零部件。
图1是本发明的样本检测系统的简图。
图2是示出本申请的样本制备系统的简图。
图3示出了包括一次性盒的完整的样本检测系统的一个实施例。
图4示出了本发明的一次性盒的另一实施例。
图5示出了流动条盒的流动条部分的立体视图。
图6示出空气流速对DNA的CT值的扩增的影响。
图7A示出直线型8路选择器。
图7B是在选择器柱塞的远端上的O形圈密封结构的特写视图。
图8示出8通道歧管,其与8路选择器和8样本一次性盒相互作用。
图9示出自动化样本分析系统,凸现了抽样所需要的部件。
图10示出包含多阵列流动池的流动条的前视图和后视图。
图11示出在用于MRSA抽样和玻片PCR的2毫升96深井试剂板中的试剂布置形式的实施例。
图12A-12C示出在本申请的样本分析系统中的镜片设计的几个实施例。
图13示出在样本分析系统上的活MRSA的TruTip处理、芯片上PCR、芯片上清洗和图像获取之后的阵列图像。
具体实施方式
给出以下的具体说明是要使本领域的任何技术人员能够实现和利用本发明。为了解释,列出了特定的专用术语以便充分理解本申请。但对本领域技术人员来说,显然本发明的实施不需要这些特定细节。只是作为代表例子对具体实施例和应用做出描述。本说明书仅为发明原理的示范,并非旨在将本发明限制到所示出的特定实施例。
应结合附图来阅读本说明书,这些附图被认为是本发明的整个书面描述的一部分。附图不一定按照比例,本发明的某些特征可以按照放大比例来示出或者以略微示意性方式来示出,以便清楚简明。在说明书中,相对术语如“前”、“后”、“上”、“下”、“顶”和“底”及其衍生词应该被解释为是指所述的或者如所讨论的附图所示出的方位。使用相对术语是为了方便描述并且通常不打算要求特定方位。关于附接、接合等的术语例如“连接”和“附接”是指这样的关系,其中,多个结构被直接或间接地通过中间结构相互固定或相互附接,以及都可活动或刚性的附接或关系,除非另有明确说明。
本文所用的术语“样本”包括生物样本如细胞样本、细菌样本、病毒样本、其它微生物样本、得自哺乳动物体最好是人体的样本如组织样本、细胞培养样本、粪便样本和生物流体样本(例如血、血浆、血清、唾液、尿、脑液或脊髓液、淋巴液和乳头抽吸液)、环境样本如空气样本、水样、灰尘样本和土壤样本。
在后述实施例中使用的术语“整块”、“整块吸收剂”或“整块的吸收性材料”是指多孔的三维吸收性材料,其在单件中具有连续相通的孔结构。整块例如是按下述方式制备的:将先驱体注入、烧结或聚合到具有期望形状的模具中。术语“整块的”是指不同于彼此紧邻或相互压贴的两个或更多个过滤器。术语“整块吸收剂”或者“整块的吸收性材料”是指不同于被封装入滤床构型或被埋入多孔母材中的单独吸收性颗粒的集合体,在该母材中最终产物包含单独吸收性颗粒。术语“整块吸收剂”或“整块吸收性材料”也指不同于吸收性纤维或涂有吸收剂的纤维的集合物例如滤纸或涂有吸收剂的滤纸。
在以后所述的实施例中所用的术语“专门地结合”或“专门的结合”是指吸收剂与被分析物(如核酸)以足以使被分析物与样本中的其它成分(如蛋白质)或污染物区分开的特性结合。在一个实施例中,术语“专门地结合”是指吸收剂与样本中的被分析物以比在该吸收剂和样本内的其它成分之间的结合亲和性高至少10倍的结合亲和性来结合。本领域普通技术人员理解,被分析物与整块结合和从该整块洗脱的严紧性可以通过结合和洗脱缓冲剂配方来控制。例如核酸的洗脱严紧性可以通过利用氯化钾或氯化钠的盐浓度来控制。与蛋白质相比,核酸因其较高的负电荷而更耐洗脱。温度、pH和柔和去垢剂是可被用于有选择地结合和洗脱的其它处理。结合和洗脱的热稳定性可以利用加热单元、水浴、红外加热和/或吹向或吹入溶液的热风来保持。结合缓冲剂的运用是优选的,这因为需要评估改性洗脱缓冲剂对下游分析仪的影响。
下述实施例所采用的术语“核酸”是指个体核酸和核酸聚合链,包括具有任何长度的DNA和RNA,无论是自然发生或人工合成的(包含其类似物),或其改性物,尤其是已知出现在自然界中的那些改性物。根据本发明的核酸长度的例子包括但不限于适用于PCR产品(例如约50-700碱基对(bp))和人类基因组DNA(例如在从约千碱基对(Kb)至十亿碱基对(Gb)数量级)的长度。因此人们将会理解,术语“核酸”包含单核酸以及小片段的天然或人工的核苷、核苷酸延伸及其组合物,例如表达序列标签或基因片段,以及以包含个人基因和甚至完整的染色体的基因组材料为例的长链。术语“核酸”也包含肽核酸(PNA)和锁核酸(LNA)低聚物。
本文所用的术语“亲水面”是指这样的表面,其相对于滞留于该表面上的一滴纯水形成小于等于45°的接触角度。本文所用的术语“疏水面”是指这样的表面,其相对于滞留于该表面上的一滴纯水形成大于45°的接触角度。接触角度可以利用接触角度测角仪来测量。
本文所用的术语“可刺破的密封件”或“可刺破的盖”是指这样的密封件或盖,其可在本申请的样本分析系统的正常使用中被液体流通机构如移液器吸头刺破。可刺破的密封件或盖的例子包括但不限于膜片、软膜、带缝的橡胶(例如有机硅)垫或箔,其被热封、胶粘或卷边附接至容器或管子的开口。可刺破的密封件或盖允许将液态试剂封装在本发明的盒内。它也容许用充分防潮材料封装冻干型试剂,以保护冻干型试剂免受在同一盒内的液态试剂的影响。
集成式采样-应答样本分析系统(Integrated Sample-To-Answer Sample Analysis System)
本申请的一个方面涉及集成式采样-应答样本分析系统100,用于检测生物分子如DNA、RNA或者蛋白质。在某些实施例中,系统100包括样本处理模块110、温控模块120和检测模块130(图1)。
样本处理模块110制备分析用样本。这样的制备一般牵扯到利用样本纯化装置将相关分子例如DNA、RNA或蛋白质从原始样本中纯化或隔离出来。在一些实施例中,样本纯化装置是移液器吸头,其装有专门结合相关分子的过滤器。这样的过滤器的例子在美国专利US7,785,869和美国专利申请号12/213,942中有更具体的描述,这两篇文献的全文被参引并入于此。
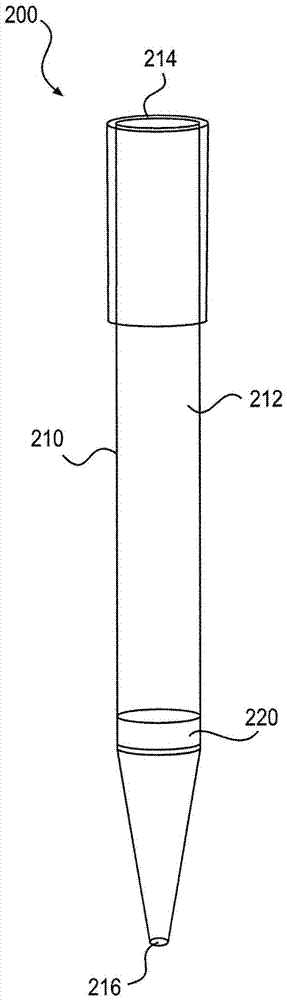
图2示出了样本纯化装置200的一个实施例,其包括外壳210和样本过滤器220。外壳210限定出在第一开口214和第二开口216之间的样本通道212。对外壳210的形状和尺寸没有特殊限制。在此实施例中,优选的外壳形状基本呈柱形,因而流动矢量在运行中是基本笔直的。在图2所示的实施例中,外壳210具有移液器吸头形状,即,第一开口214的直径大于第二开口216的直径,并且第一开口214的尺寸设定为能装配到移液器吸头上。样本过滤器220紧邻第二开口216安置,因而样本在经第二开口216被加入外壳210后马上被过滤。在一个实施例中,样本过滤器220与第二开口216相接。在另一个实施例中,样本过滤器220与第二开口216间隔1-20毫米的距离。在一些实施例中,整块样本过滤器是具有20-200微米平均孔径的玻璃料。在另一实施例中,样本过滤器220是整块过滤器,其包括具有不同孔隙率的两个部段:靠近第二开口216的第一部段221和通过第一部段221与第二开口216分隔开的第二部段222。在一个实施例中,第一部段的平均孔径为40-200微米,优选为40-60微米,第二部段的平均孔径为1-40微米,优选为1-20微米。
在另一实施例中,样本处理模块110包括亲和柱,该亲和柱填充有专门结合相关分子的介质。样本处理模块110还可包括流体处理装置如自动式移液管或液样移送泵。经过处理且富含相关分子的样本随后被送入反应腔并接受扩增反应或结合反应以检测样本中的相关分子。在一些实施例中,反应腔装有微阵列并且位于流动池(也称为“生物芯片”)内,如在美国专利申请号12/149,865和12/840,826中描述的那样,这两篇文献的全文被参引并入于此。简言之,流动池装有形成在平面基材上的微阵列和围绕该微阵列形成的反应腔。
微阵列可以是多核苷酸阵列或蛋白质/肽阵列。在一个实施例中,微阵列利用如例如在美国专利US5,741,700、US5,770,721、US5,981,734、US6,656,725和美国专利申请号10/068,474、11/425,667和60/793,176中所述的打印胶点法(printing gel spots method)来形成,所有这些文献的全文被参引用并入于此。平面基材可以是黑色、白色、透明或其它颜色的玻璃或塑料(膜和注射模制)。
反应腔有多个内表面,包括其上形成有微阵列的底面和朝向该底面且大致与该底面平行的顶面。所述多个内表面的至少其中一个是有助于反应腔充满的亲水面。在一个实施例中,反应腔的顶面是亲水面。在一些实施例中,流动池还包括用于将液态样本加入反应腔的可刺破和再封闭的隔膜(如圆顶阀)和将单向阀连至反应腔的样本通道。在其它实施例中,反应腔通过废液通道被连通至废液腔或吸收剂。
在其它一些实施例中,样本处理模块110还包括具有多个细胞溶解珠和磁搅动件的细胞溶解腔。细胞溶解是通过在有细胞溶解珠的情况下使磁搅动件在细胞溶解腔内转动来实现的。可以通过在磁搅动件周围产生转动磁场来造成磁搅动件转动。细胞溶解珠可以是颗粒状或球珠状材料,其硬度大于待溶解细胞的硬度。细胞溶解珠可以由塑料、玻璃、陶瓷或任何其它非磁性材料如非磁性金属珠制成。在某些实施例中,细胞溶解珠是关于一个轴线旋转对称的(如球形、圆形、椭圆形、卵形、蛋形和液滴形的颗粒)。在其它实施例中,细胞溶解珠呈多面状,在其它实施例中,细胞溶解珠是不规则形的颗粒。在其它实施例中,细胞溶解珠是带有凸起的颗粒。磁搅动件可以尤其是条状、十字形、V形、三角形、矩形、杆状或盘形的搅拌件。在一些实施例中,磁搅拌件呈矩形形状。在一些实施例中,磁搅动件呈双尖音叉形。在一些实施例中,磁搅动件呈V型形状。在一些实施例中,磁搅动件呈梯形形状。在某些实施例中,搅拌件的最长尺寸略小于容器直径(例如是容器直径的约75-95%)。在某些实施例中,磁搅动件涂覆有化学惰性材料例如聚合物、玻璃或陶瓷材料(如瓷)。在某些实施例中,该聚合物是生物相容聚合物如PTFE和聚对二甲苯。在申请号12/886,201中对磁溶解法(magnatic lysis method)做出了更详细的描述,该文献的全文被参引并入本文。
在一些实施例中,样本处理模块110包括一次性盒,该一次性盒包括:(1)多个容器,每个容器具有敞开的顶端和封闭的底端;(2)流动条,其包括多个端口,这些端口通过用于在该盒和样本分析装置之间建立流体连通的一个或多个流体连通机构与样本分析装置相互作用;和(3)多个反应腔,每个反应腔连通至流动条上的一端口。至少其中一个试剂容器预封装有样本分析作业所需的试剂并在该容器顶端用可刺破的盖来封闭。在一些实施例中,盒包括封装有冻干型试剂的一个或多个容器与封装有液态试剂的一个或多个容器的组合。在一些实施例中,盒还包括预封装有多个细胞溶解珠和磁搅动件的一个或多个容器。在其它实施例中,盒还包括预封装有吸收剂的一个或多个容器。
本文所用的术语“流体连通机构”是指该系统的任何能够在两个部位之间建立流体连通的装置或部件。流体连通机构的例子包括但不限于管子、管段、柱、通道、移液器吸头及其组合。
在其它一些实施例中,流动条还包括用于控制在该流动条内的流体流动(如从反应腔至废液腔的流体流动)的一个或多个针阀。
在其它实施例中,一次性盒还包括一个或多个样本纯化装置。在一个实施例中,一个或多个样本纯化装置(如TruTip)被用作用于在盒和样本分析装置之间建立流体连通的流体连通机构。
本文所用的术语“样本纯化装置”是指能够纯化、隔离或浓缩目标分子的任何装置。样本纯化装置的例子包括但不限于过滤器、亲和过滤器、亲和柱、层析柱和过滤器头如TruTip。在一个实施例中,样本纯化装置是包含专门结合核酸的整块过滤器的移液器吸头。
在其它实施例中,一次性盒中的每个端口装有连接器,用于建立与流体连通机构的流体连通。这样的连接器可包括可刺破的隔膜或圆顶阀。
在另一个实施例中,流动条还包括吸收来自反应腔的废试剂的吸收剂。在一个实施例中,吸收剂通过一个或多个针阀与一个或多个反应腔流体连通。吸收剂可以是能够滞留大量液体的任何材料。在一个实施例中,吸收剂由大量纤维制成。在另一个实施例中,吸收剂是通过热风粘合法(through-air bonding process)织造的非织造织物。非织造织物的组成纤维可以是亲水性合成纤维、浆料等的天然纤维素纤维或再生纤维素纤维。纤维可以涂覆或浸润有表面活性剂或亲水性油,以改善液体吸收性。不限于热风粘合法,在此所用的非织造织物可以通过任何其它工艺来制造,例如纺粘工艺、空气铺网工艺、射流喷网工艺等等。在其它实施例中,吸收剂是纤维素纸。
在其它的实施例中,一次性盒还包括通过所述多个端口之一连接至流动条的混合塔。
在一些实施例中,多个容器以96井板形式布置。该板可以装有预封装有冻干型试剂的一个或多个容器、装有预封装有液态试剂的一个或多个容器和可选的、装有预封装有吸收剂的一个或多个容器。该板还包括预封装有多个细胞溶解珠的磁搅动件的一个或多个容器。井的体积可以根据所需的试剂量而变。这些井可以具有相同的体积或不同的体积。在某些实施例中,该井的体积在50μL至5000μL范围内、50μL至500μL范围内、500μL至2500μL范围内和1000μL至5000μL范围内。在一个实施例中,这些井具有大约为2200μL的一致体积。
一次性盒通过在样本分析系统100上的一个或多个流体连通机构和流动控制歧管与样本分析系统100相连。流动控制歧管包括歧管体、形成在歧管体上且适合连接至供流装置的多个供流端口、形成在歧管体内的多个柱塞通道和可沿柱塞通道长度运动的多个柱塞。每个柱塞通道在一端具有柱塞通道入口并在另一端具有柱塞通道出口。每个柱塞包括封贴于该柱塞所处的柱塞通道的内壁上的密封。柱塞从柱塞通道入口进入柱塞通道。多个供流端口中的每个连接至柱塞通道并且位于柱塞通道的柱塞通道入口附近。柱塞通道出口装有连接至一个或多个样本纯化装置如TruTip的适配接头。
在一些实施例中,流动控制歧管还包括用于引导流体经过供流端口流动至期望的流体控制通道的通道选择器。在一个实施例中,通道选择器包括旋转阀。在其它实施例中,通道选择器包括具有多个输出端口的选择器通道和线性运动致动器。所述多个输出端口连接在流动控制歧管上的一个相应的供流端口。线性运动致动器包括马达和细长的杆,该杆具有近端、远端和在杆内围出的流体连通通道。流体连通通道从在杆近端上的一个或多个开口延伸至在杆远端上的一个或多个开口。在所述杆的近端上的一个或多个开口适于连通至供流装置。在所述杆的远端上的一个或多个开口侧接有两个密封件如O形圈。当该杆伸入选择器通道时,这两个密封件封贴于选择器通道的内壁并形成在选择器通道内的流体连通路径。当该杆被安置在选择器通道内的如下位置时,在供流装置与通道选择器的输出端口之间的流体连通得以建立:即,在“杆远端上的一个或多个开口”与“通道选择器的输出端口”之间的该流体连通路径得以形成。在一个实施例中,选择器通道具有当杆在选择器通道内移动时阻止选择器通道内的压力变化的排气孔。例如这样的排气孔将容许该杆在选择器通道内前移而不会经受背压。
温控模块120在扩增反应或者结合反应过程中控制温度。在某些实施例中,温控模块包括具有柔性温控表面的装置,如在美国专利US7,955,840和US7,955,841中描述的装置,这两篇文献的全文兹被引用纳入。在某些实施例中,该装置包括将温控物质加热到第一温度的第一加热器;将该温控物质加热到第二温度的第二加热器;位于第一加热器和第二加热器之间且与之串联的泵;包括一对囊的囊单元。每个囊被接合到囊座上并且通过不同的端口被连至所述第一和第二加热器。这对囊可用控制这对囊的温度的温控物质来充胀。这对囊以基本上相互间隔对置的方式来安置,从而这两个囊在充胀时能够接触就位于该间隔中的反应腔。在PCR反应中,泵定期间断地交替地在第一温度和第二温度将温控物质泵送入这对囊,以允许实现PCR。
在其它实施例中,该装置包括囊组件,其包括:设计用于从第一入口通道接纳温控流体且从第一出口通道排出温控流体的第一温控囊,设计用于从第二入口通道接纳温控流体并从第二输出通道排出温控流体的第二温控囊,保持温控流体处于第一温度且通过第一双通阀和第一三路连接器与第一和第二入口通道相连的第一换热器,保持温控流体处于第二温度且通过第一双通阀和第一三路连接器与第一和第二入口通道相连的第二换热器以及位于囊组件和换热器之间的泵。泵通过三路连接器被连接至第一和第二出口通道并通过第二双通阀被连接至第一换热器或者第二换热器。第一和第二温控囊均包括柔性导热表面,其在接纳温控流体后接触反应腔外表面的至少一部分。
检测模块130检测反应产物的存在。在某些实施例中,检测模块130包括设计用于采集在反应腔内的微阵列的图像的光学子系统。在某些实施例中,光学子系统专门设计用于在微阵列上的低级荧光检测。光学子系统利用共焦或近共焦的激光扫描仪,其在用紧密聚焦的激光束查询物平面过程中逐个像素地获取微阵列图像。激光扫描仪带来以下优点,空间均匀的灵敏性、宽广动态范围和失焦漫射光的有效排斥。
在其它实施例中,该光学子系统利用泛光照明式成像装置,其中所有的阵列单元(特征)被同时照明,并且多元光检测器例如CCD摄像机或是一下子全部获得微阵列图像,或是按照随后拼合的多个分帧的顺序。与激光扫描仪相比,基于CCD的成像装置具有简单的设计和较低的成本。对于在依赖不太复杂的微阵列(例如具有几百或更少的阵列单元)的成本敏感型应用中的独立式和内置式读取机来说,CCD系成像系统是有吸引力的选项。商用仪器一般采用冷却型CCD摄像机并采用昂贵的具有更强的集光能力的定制物镜镜头,其有助于在一定程度上平衡激发计划的低效。
在其它实施例中,光学子系统包含利用非冷却型CCD摄像机的成像装置。虽然非冷却型摄像机与冷却型相比一般具有相当高的暗电流,但该光学子系统可以通过下述做法提供所需要的灵敏度而不用曝光超过几秒:(1)提高激发强度,或者(2)采用具有高集光效率的物镜镜头,或者(3)综合利用上述两种做法。该光源可以是传统光源如金属卤化物灯泡或汞灯泡、基于激光的系统或者高亮度LED。
在一些实施例中,集成式样本分析系统包括:(1)样本制备/分析模块,包括具有专门结合核酸的整块样本纯化装置;在具有亲水性内表面的反应腔内封装有微阵列的样本分析装置;(2)温控模块,包括具有导热温控囊的热循环器,该导热温控囊在接纳温控物质时膨胀而抵接反应腔外表面,以便能实现在温控物质和反应腔内室之间的换热;和(3)成像装置,其能够采集在反应腔内的微阵列的图像。在一个实施例中,样本分析/制备模块还包括细胞溶解腔,在细胞溶解腔中装有许多细胞溶解珠和磁搅动件。
例子
例子1:原型的样本分析系统
如此研发出采样-应答样本分析系统:将磁溶胞、TruTip纯化、囊式热循环、PCR-微阵列生物芯片扩增、LED微阵列照明和凝胶单元微阵列成像技术集成到具有一次性盒的即时分子仪器(point-of-care molecular)中。
磁溶胞技术牵涉到外旋转磁体,其利用微型转动磁性搅棒用力将样本溶液中的组织/细胞与珠均质混合,该搅棒紧邻外磁体布置。此做法的特点是不需要机械或电气作用于消耗型仪器。在1毫升总体积内的1:1样本与珠之比的情况下利用该方法,在30秒内在离外磁体几毫米远的管子内获得了104cfu/mL每克阳性化脓性链球菌的细胞溶解。与用qPCR分析时的珠涡旋相比,此做法造成2.5循环改善。
TruTipTM核酸纯化装置(见图2)由多孔整块料构成。整块料是刚性的厚玻璃母材,其能实现以低加工费用简单插入移液器吸头中,并且其形状因素易于满足自动抽样方案。该方案(可能需要少到4分钟)包括经整块来回移液以便结合、清洗、空气干燥和洗脱。穿过多孔整块料来回循环改善了回收。整块料设计成具有大的孔隙度以在处理黏稠样本如鼻咽抽出液(NPA)时减小整块前后的反压。M.TB、牛痘、VEE、炭疽芽胞杆菌、鼠疫菌、流感A/B、化脓性链球菌、肺炎衣原体和MRSA的核酸纯化已经在样本类型例如NPA、鼻咽拭子(NPS)、血液、土壤、痰和尿中得以证明。利用由Rainin Electronic Pipettor和标准Qiagen套件所操作的TruTip获得的qPCR的比较结果表明,两种方法在广泛研究中均显示出相同的效率和回收率。但TruTip快了5倍,容纳更大的样本体积且不需要离心处理。
利用被加入5个不同的流感阴性NPA样本中的流感A(H3N2)和流感B对TruTip-epMotion系统进行了研究,所述样本得自Wadsworth中心(纽约市健康部门),其黏度是不同的(从低到高的粘液含量)。在10gcμL-1可重现地检测到流感A(100%)。在102gcμL-1可重现地检测到流感B(100%),此时10gcμL-1接近实时RT-PCR化验的检测极限。
经过纯化的核酸随后被加入PCR-微阵列生物芯片的微阵列腔。PCR微阵列生物芯片设计容许PCR在微阵列腔内扩增。生物芯片也可以具有废液腔以容许在保持闭合扩增子系统时的清洗。废液腔和微阵列腔通过微流体塞或针阀分隔开,其在热循环中限制反应混合物于微阵列腔。不同于其它,本发明方法不需要特殊的疏水涂层或处理。相反,事实表明,基于形状和材料的设计能限制液态反试剂在微阵列腔内,直到其它试剂如清洗溶液被加入。
上述的PCR微阵列生物芯片可被用于芯片上PCR和杂交后清洗。PCR微阵列生物芯片可以包括在双面带中的流体通道层并且亲水性覆膜被用以允许均匀且可预测的生物芯片灌注。这些生物芯片可以包括可刺破的止回阀(如迷你阀DS052)。该部件将保证闭合的扩增子装置。替代可选方式包括背封的加入(允许液体流经止回阀,而没有刺破它)和鲁尔操作阀的使用(只允许在接合时流动)。使用2.4毫米O形圈的塑料针阀是无阀策略的替代做法或补充做法,此时的反应腔与废液腔隔离开。这些阀忍受热循环并且制造成本低。
作为保证闭合扩增子工作流的手段,液体单向流入但未流出一次性PCR微阵列生物芯片。在一些实施例中,加入混合腔来保持工作流用于反应例如Allele Specific Primer Extension(APEX)。在一个实施例中,混合腔是延长的针阀,因而在PCR后,APEX缓冲剂和酶可被加入PCR微阵列生物芯片,同时允许该针阀上移该列,产生用于混合物的空间。在此例子中,下游阀将被关闭,入口处的止回阀将阻止液体离开生物芯片。也可注入空气来进一步加强混合,或者针阀的来回运动可能有助于混合。
微阵列由凝胶元件构成,它们在半球形多孔亲水聚合物的含水体积内具有空间优选的固定不动分子间距。试样悬浮在预聚合物溶液内,成图在表面上并且通过光聚合被共聚化以产生“胶滴”阵列。因此,使试样固定至基片上。聚合结构的最终结果是与表面固定不动的两维平面阵列相比的增强的冻干动力学、更高的试样固定不动能力和接近100倍的增强检测灵敏度。这些特点允许实现低成本光学仪器、快速冻干以及在松散聚合物相内完成附着化学的能力,这减轻了制造负担,进而降低了每台仪器的成本。另外,针对天然塑料可实施共聚合方法,其无需昂贵的玻璃基底。
PCR反应利用了专门设计的囊式热循环仪器,其中热控循环流体使一对囊膨胀以实现与PCR-微阵列生物芯片的紧密接触。作为实现囊式热循环仪器与相接的PCR和微阵列冻干的表示,1ng化脓性链球菌基因组DNA与PCR主混合物混合并被加入两个PCR-微阵列生物芯片中。与在传统的玻片热循环器上的3到4小时相比,热循环方案需要不到26分钟(在85℃,44次循环5秒,以及在50℃,30秒),而杂交不到15分钟。虽然使用厚(1mm)的玻璃基片,但因为以下三个原因而实现快速PCR扩增:
(1)不同于大金属块的延长冷却,快速跃变时间(约10℃/s)是可行的,因为使用流体切换。
(2)囊对与生物芯片基片的紧密接触导致了高导热性。利用传统方法的在加热件和反应容器之间的不良接触一般造成热效率相当之差。
(3)循环流体集中加热和冷却反应腔。对流一般是最有效的传热方式。
用成像装置检测扩增信号,该成像装置由单个LED和非冷却型CCD摄像机构成。
用于分子诊断仪器的预封装试剂减轻了装置复杂性。于是,Akonni已研发了一种一次性盒300,它可以通过可回撤的载具112被插入样本分析系统100(图3)。盒300包括一条可刺破的试剂容器310、一个或多个反应腔320和控制该流体从样本纯化装置340如TruTip至反应腔320的流动的流动条330。反应腔320可以形成在PCR微阵列生物芯片350内。试剂可以包含用于溶胞、纯化和PCR扩增的试剂。该管的盖312由可刺破的膜构成,其可利用热封、胶粘或围绕玻璃指管或塑料指管弯卷金属盖来固定。箔也可以被附接至塑料管如PCR管。盒300允许用充分防潮材料简单包封冻干型试剂,以保护它们免受液态试剂影响。移液器吸头能刺破该膜,从管中吸走试剂并将核酸和/或液体从一个管送至另一管。在此实施例中,流动条盒包括一次性TruTip340,其接合仪器上的移液器头,以进行纯化方案、试剂再水合和PCR-微阵列生物芯片加注。在一个实施例中,只有吸附至整块料的核酸从一个管被送至下一个管,于是液体留在各自管中,减小样本污染风险。再水合的含纯化样本的主混合物随后通过TruTip被注入PCR微阵列生物芯片,其随后被插在一对囊之间以便热循环。可刺破的止回阀限制扩增子至闭合系统,但允许清洗液流过阵列以便随后成像。在其它实施例中,TruTip340设计用来容纳过滤器,其专门结合相关的目标分子如蛋白质、肽、DNA、RNA或者其它生物分子。图4示出了盒300,它具有样本端口314和控制流体在生物芯片350内流动的针阀316。
图5示出盒300的流动条330部分。在此实施例中,流动条330包括用于接纳TruTip340的样本端口314和控制液体从反应腔320流到废液腔360的针阀316。在其它一些实施例中,流动条330还包括一个或多个磁性溶胞塔或混合塔(未示出)。
盒300中的容器310可以是塑料管、玻璃指管或板中的井(如96深井板)。包括一体式位置反馈型电位计的微型线性致动器可被用于从冻干玻璃指管和2毫升管(11mm直径)的底面反复配送和取回。在一个实施例中,整块被安置在移液器吸头顶面附近,增大了在整块下方的体积。这增大了不接触整块的体积,其可能有益于将试剂例如PCR缓冲剂移液到流动条中。PCR缓冲剂与整块料的接触可能将不希望的空气引入PCR缓冲剂,造成气泡。利用此实施例,单个移液器吸头可被用于所有步骤。另一个实施例是要使用多个吸头用于多个移液步骤。在一个实施例中,可刺破的一次性止回阀(如迷你阀)被压配安装在螺纹盖下,螺纹盖具有进出孔作为注入样本并提供接近TruTip的机构,没有在磁性转动中释放出气溶胶。疏水涂层型溶胞珠是尽量减小DNA吸附的手段,因而不需要将样本移送至单独的离液管的步骤。替代的TruTip设计包括不同的孔径大小(1-100微米)、不同的厚度(0.1-10毫米)、不同孔径的整块料(1-10)的堆叠物、具有孔径不同的部段的单个整块料和/或传统做法(例如珠涡旋、步进马达、多个移液器吸头)。为了减小PCR倍增复杂性,多个腔可被用来将PCR主混合物/样本试剂分到多个储器中。这可能对同时处理细菌和病毒的样本是有用的。
例2:多路选择器设计
此例子涉及下述装置的检测和设计过程:所述装置用于在8端口歧管的8个不同端口之间进行选择,以允许空气一次只流过单个端口。该装置被称为8路选择器,其被用来干燥在自动化液体处理系统上的移液器吸头。本系统利用8个移液器吸头来同时完成八份单独的样本制备。在一个实施例中,8路选择器设计用于容许来自共用空气源的空气流动,以干燥在移液器吸头内的基材。
A.检测流速
在将8路选择器集成到8端口歧管之前,进行测试来确定空气流速对在所用的DNA抽样和扩增过程中的交叉阈值(CT)的影响。简言之,该系统连接至流量计来测量流动。测试5个不同的新流速在DNA抽取和扩增过程中对CT值的影响。先前所用的人工流速作为控制流速被纳入本测试中,其导致约为23.5的控制CT值。如图6所示,所有被测流速所导致的CT值低于控制CT值。基于图6的结果,5升/分钟看上去是对八通道选择器来说最理想的流速,因为它导致最小的CT值。
B.8路选择器设计
几个设计可被用于8路选择器。首先,可选择的接近8端口流动条上的每个端口的通路可通过8路回转阀来控制,该阀可市购获得,但昂贵。
或者,可以使用线性致动器来控制空气经TruTip到达8端口中每个端口以实现附加干燥或在流动条中干燥该微阵列。如图7A和7B所示。线性致动器700包括马达750和具有近端720和远端730的杆710。杆710在远端730上包括两个O形圈732和734。杆710具有通道,其连通至在近端720的进气口和在远端730的一个或多个空气出口712。空气出口712位于两个O形圈732、734之间。杆710在选择器通道760内移动,该选择器通道与八个输出端口770相连。选择器通道760在远端具有排气孔780以阻止在通道内形成压力。如图7B所示,两个O形圈732和734是相对选择器通道760的内壁密封的,从而形成流体连通路径790。沿杆710的空心段向下流动并在空气出口712离开的空气将被限留在两个O形圈732和734之间,并且在任何时候只能经过该歧管的单个端口770流走。但是,可以调整两个O形圈732和734之间的距离,从而空气可以同时经两个以上的端口770逸出。相似地,多个O形圈可被用来形成多个流体连通路径,于是允许空气同时流向多个端口。
图8示出了八通道歧管800,其具有八个供流端口810、八个柱塞通道入口820、八个柱塞通道830和八个柱塞通道输出端口840,其连通至移液器吸头端口(即TruTip端口,未示出)。连通至相应的8路选择器阀端口770的供流端口810靠近柱塞通道830末端布置,以允许经由柱塞通道入口820进入柱塞通道830的柱塞(未示出)移动经过绝大部分长度,而不会改变移液器的抽吸和配送液体的流动动态情况。当进行空气干燥步骤的时候,柱塞可被回拉,从而空气能从所述8路选择器(如图7A和7B所示)经过供流端口810进入柱塞通道830并流出柱塞通道输出端口840。在一个实施例中,只有单个柱塞通道830将在任何时候对空气流动是敞开的。该空气将被迫流入移液器吸头,因为在歧管中的柱塞将位于供流端口810后,阻止空气逸出柱塞通道入口820。
另一个设计是允许所有8个移液器吸头同时暴露于共同的空气源。此设计将不需要选择用于空气流动的单个端口。
例3:自动化多样本检测系统
图9示出了自动化采样-应答系统900,它能够执行同时用于8个样本的抽样、玻片PCR和阵列成像。
A.样本纯化/抽取
系统900有三个主要的涉及样本纯化和抽取的子系统。这三个子系统包括吸头座910、板座920和柱塞系统930。吸头座1100将TruTip(未示出)固定至系统900并保持它们在X-Y平面内不动。但是,吸头座910被连接至致动器,致动器容许在Z平面内控制TruTip。也可以想到使所述TruTip在所有方向上移动(即不是固定不动的)。板座920固定2mL的96深井板921,其被用作头尾衔接运行所需要的所有试剂和样本的储器。板座920在X-Y平面内移动深井板921,容许TruTip在深井板921上的列与列之间移动。最后,与步进马达940相连的柱塞系统930控制TruTip可抽吸和配送的体积。
已经在系统900上进行多次抽样,在此利用在两种介质即水和鼻咽抽出液(NPA)中的基因组抗甲氧西林金黄色葡萄球菌DNA(gMRSA)和活MRSA。在系统900上的自动化抽样依赖2毫升深井板1201来容纳所有所需要的试剂,例如溶胞缓冲剂、清洗缓冲剂和洗脱缓冲剂(例如参见图11)。TruTip被插入板921的每列中,试剂经过通过吸头被触发以便样本纯化和抽样的发生。板的第一列装有样本和溶胞缓冲剂,该混合物(500-1000μL)流过吸头5-20个循环,取决于样本所在的介质。在一个实施例中,15个循环被用于水中的样本,20个循环被用于NPA中的样本。随后是清洗步骤,其需要触发清洗缓冲剂(500μL)达10个循环。接着,在TruTip内的基材被空气干燥,最终进行洗脱步骤,此时洗脱缓冲剂(50μL)通过吸头被触发另10个循环,在此缓冲剂中回收DNA。
在整个检测尝试中,已经确定了加入单向强风系统有助于干燥TruTip基材,容许更好回收得到DNA,即使与传统的人工抽样相比。空气干燥跟在清洗步骤后并且是正确干燥基材所需要的,每个吸头被单独干燥1分钟。残余的清洗缓冲剂可能影响回收并禁止聚合酶链反应(PCR)。250uL的水中100pg/μLgMRSA的人工抽样与自动抽样的对比表明,人工抽样平均为23.73的CT,而自动抽样平均为22.38,少了1.5循环。空气干燥成分被用到所有进一步抽样。
一旦完成对基因组MRSA的检测,则使用所有活细胞。使活MRSA室内生长并悬浮在盐水溶液中以获得0.5McFarland的最终浓度。这些细胞需要最初的溶胞步骤并且该步骤是人工进行的;但是,这可被纳入自动化系统中。细胞溶解利用如上所述的磁性溶胞来进行,利用50克Ceroglass的100-200微米陶瓷珠和250μL的gMRSA活细胞。细胞以100%速度被溶解2分钟,随后被置入2ml深井板的第一列。细胞也在使用前在100°C被热灭活15分钟,以阻止任何可能有的使用者感染。该试验遵循与在水中的MRSA相同的方案并且不需要附加的乙醇。平均CT为22.88,其等同于作为正控制而运行的100pg/μL样本。
在被加入NPA的活MRSA细胞上也检测样本纯化,其用于表示临床样本。该样本要求人工细胞溶解步骤以均质NPA并溶解MRSA细胞。对于此例子,在混有250μL的NPA的250μL的0.5McFarlandMRSA(热灭活)上进行细胞溶解。一旦细胞溶解处理完成了,则样本被加入附加含有250μL的95%乙醇(总体积1000μL)的溶胞结合缓冲剂中。该样本在样本分析系统上通过TruTip被触发20个循环,随后是清洗、空气干燥和洗脱步骤。在系统1000中抽取8个样本,并且实时结果表现出23.84的CT平均值,其等同于作为正控制而运行的100pg/μL样本。
B.玻片PCR
在系统900上执行的所有抽样被用于利用囊式热循环器完成玻片PCR并获得采样-应答结果。系统900实施例能够利用微阵列和囊式热循环器一次对8个样本执行玻片PCR。囊式热循环器有五个主要组成部分:储热器、储冷器、泵、一个或多个阀和囊或囊对。囊式热循环器的基本原理是要计算用于快速热循环的流过囊的液体的两个不同温度。储热器和储冷器必须在热循环可以开始之前首先被置于该温度。该泵迫使流体流过该通路并且依赖于选择阀来引导适温液体进入囊。囊或囊对在注入液体后围绕所插入的多腔流动池膨胀,多腔流动池包围它并传递正确温度。
如图10所示,多腔流动池1000具有在反应腔1020中被包围的8个独立的微阵列1010,该反应腔允许PCR混合物与阵列1010相互作用。多腔流动池1000通过壳体1110被固定至流动条1100,该壳体包围圆顶阀1120、针阀1130和吸收剂1140。壳体1110引导从2mL的96深井板经这些圆顶阀1120被移液至流动池1000的PCR混合物,所述圆顶阀也在热循环中起到密封作用,防止任何泄漏。针阀1130由容许其打开和关闭的线性致动器来控制。在打开位置,针阀1130允许在清洗步骤内的液体流动。在关闭位置,针阀1130帮助在热循环过程中将PCR混合物滞留在流动池1000的反应腔1010内。附接至壳体1110的吸收剂1140收集流过流动池1000后的所有清洗缓冲剂。
采样-应答检测的芯片上PCR部分以囊式热循环器热身启动开始。加热步骤被用来使热储器和冷储器分别达到88℃和51℃的期望温度。在此加热步骤中,PCR缓冲剂被安置在抽样过程所用的相同的2毫升96深井板中。芯片上PCR需要使用4列:PCR主混合物、1xSSPE、水和丙酮。图11示出示范性板的试剂布置。50毫升PCR缓冲剂利用自动系统被注入与8腔流动池相连的所有8个壳体端口。一旦所有8个腔充满,针阀被关闭且流动池被插入该囊且热循环启动。热循环参数是最初88℃持续2分钟,接着是88℃持续45秒和51℃持续90秒的40次循环。还有51℃持续5分钟的最终冷却步骤。一旦热循环结束,自动化系统就从囊中移走流动条,并且在室温进行冻干。冻干发生2小时并且随后3种不同的清洗液以1xSSPE、水和丙酮的50μL等分试样依次流入流动条和流动池阵列腔。丙酮是可选的微阵列干燥用试剂。
C.成像/分析
系统900具有集成式成像系统,其能够单独捕获所有8个微阵列的荧光。成像装置安装在活动平台上,其控制它在X-Y平面内的位置并且能够在Z平面内移动以聚焦。在芯片上PCR和清洗完成后,阵列被成像和分析。利用MCI软件和Akonni MRSA分析工作手册来完成分析。MCI软件采用固定周期法来确定在阵列上的每个样本的密度。每个阵列有4个相同的象限(例如每个试样在阵列上有四次)。一旦确定了密度,则除去最高值和最低值,从其它两个试样中取中间值。该中间值确定试样的总密度。为确定信号是否被确认为正或负,采用两个因数:dN20比例和Sigma比例。dN20点,即微阵列所包含的随机20基体无意义试样的混合物,被用来测量由例如不良清洗、交叉杂交和/或样本中过多的DNA的作用所引起的“生物噪音”。其测量强度以与信号点相同的方式来确定。每个试样的总强度随后被除以dN20信号的总强度。如果该比例大于1,则该信号被认为是可测的。Sigma也被用来确定该信号是否高于阈值。Sigma为图像中的背景(点不在的区域)的标准偏差。每个试样被除以3乘sigma,以计算点信噪比。用于确定该点是否被认为是检测事件的信噪比将被除以更大的值(dN20或3倍Sigma比)。该做法被用于所述分析。
图12A-12C示出了用于微阵列成像计划的斜角照明的实施例。图12A示出了用于微阵列成像的斜角照明总体概念。该系统的光学系统包括两个单独通道1210和1220。通道1220用于荧光激发,通道1210用于阵列成像。图12B是照明光学系统的一个例子,它包括以90度角转向照明光源的镜子,以允许相当一部分的照明光源平行于微阵列基片。图12C是集光光学系统的一个例子,它包括使采集光以90度角转向的镜子,以允许相当一部分的检测光学元件平行于微阵列基片。
如图12B和图12C所示,光学系统包括得自徕卡Microsystems(Bannockburn,IL)的高品质现成成像光学组件(物镜1230和匹配目镜1240)、紧凑型低噪单色1/3”CCD摄像机1250(Allied Vision Technologies加拿大公司,Burnaby,BC)和530nm高亮度LED(加拿大圣约瑟的Philips Lumileds Lighting公司)作为荧光激发源1260。不同于常用的、物镜被用于物体照明和成像的荧光显微镜落射光照明计划,该设计消除背景,因为激发光在物镜中漫射回和可能有的光学元件自体荧光。而且,以45°入射角度倾斜照明有助于引导由微阵列基材所反射的大部分激发光离开物镜。此设计得到由徕卡研发的Planapo2x物镜的远工作距离(39mm)和相对高的采光效率(NA=0.234)的支持,因为其立体显微镜的高端线。因为物镜是无穷远校正的,所以玻片的阵列表面应就位在透镜前焦平面上。发光滤光器1255(零件号FF01-593/40-25,Semrock,纽约罗切斯特,NY)位于物镜和目镜之间的无穷远空间内,双组成部分的光束扩展器包括平凹透镜1265和消色差双合透镜1270(零件号分别是LC1582-A和AC254-100-A-ML,新泽西州牛顿的Thorlabs)。光束扩展器(未示出)将整个透镜系统的放大倍数减小到0.75倍。利用具有1/3”规格和7.4μm像素大小的当前的CCD传感器,该放大调整容许达到12×18凝胶元件阵列以约10μm空间分辨率(受CCD阵列像素大小的限制)成像。荧光激发通道完成用于投射系统的科勒照明计划,其保证均匀(在3%以内)照明物平面,尽管LED(零件号M530L1,可得自Thorlabs)的发光区具有复杂结构。设置在集光透镜和聚光透镜之间的带通纯化滤光器(零件号FF01-525/45-25,Semrock)截断该LED发光光谱的与Cy3的荧光带重叠的长波翼。
图13示出了在利用本文所述的系统通过磁力溶胞的预处理步骤自动化TruTip处理水中的活MRSA样本后的代表性的实时PCR结果。附加的自动化处理步骤包括:随后通过在流动条壳体内的圆顶阀给微阵列流动池腔加注洗脱剂和PCR主混合物,关闭流动条针阀,将流动池插入热循环器的囊之间,在热循环后移走流动池,打开针阀,清洗,用丙酮干燥,用如图12A-12C所示的光学系统成像。检测六个试样。图13示出了在曝光时间为0.5s时的最终图像的例子。所有五个样本均利用全部试样进行检测,并且利用了MCI软件。
另一试验包含检测在NPA中的八个活MRSA样本中是否存在MRSA。如上所述执行对所有八个样本的随后处理。在本文所述的系统上自动进行处理的实时PCR结果如表1所示。利用如上所述的图像分析算法在所有八个样本中正确检测到MRSA。
表1:NPA中的活MRSA的检测
以上描述是为了教导本领域普通技术人员如何实施本发明,而不是想要详述所有那些对阅读了说明书的技术人员来说是显而易见的明显改动和变化。但所有这样的明显改动和变化想要被涵盖在由随后的权利要求所限定的本发明范围内。权利要求旨在涵盖那些有效实现了既定目标的组成部件和按照任意顺序的步骤,除非上下文明确做出相反指示。
- 还没有人留言评论。精彩留言会获得点赞!