用于检测生物状况的系统和方法与流程
本发明要求2012年12月17日提交的Kasdan等人的美国临时专利申请61/737,854,2012年12月17日提交的Kasdan等人的美国临时专利申请61/737,856,以及2012年12月17日提交的美国专利申请No.13/716,246的优先权,这些文献的内容以引用方式并入本文。
技术领域
本发明总体涉及检测生物状况的仪器和方法,更具体而言本发明涉及用于检测少的流体样品中的生物状况的方法和仪器。
背景技术:
存在着多种难以诊断的医学状况。通常,医生的诊断是基于该医生所观察的患者症状的结合。这有时会导致误诊。此外,通常患者对治疗(药品或其他模式)产生应答后,医生才观察到。
许多实验室测试是在肌体样本或流体上在诊断平台中实施的,从而测定患者的生物状况。然而,这些测试在诊断实验室中是离线实施的。通常,实验室服务仅在一天中单一的8小时转换中提供,并往往是劳动密集的。本领域一些现有技术的公开包括尤其包括US 8,116,984,US2006215155和US2012187117。
尽管上文提及了多个发明,但是提供能够用于检测和诊断患者生物状况的改进的仪器和方法仍是未被满足的需要。
发明概述
本发明的一些方面的目的是提供了用于检测和诊断患者的生物状况的改进的仪器和方法。
在本发明的一些实施方案中,提供了用于检测和诊断患者的生物状况的改进的方法、仪器和试剂盒。
在本发明的其他实施方案中,描述了一种方法和试剂盒,其用于快速检测由患者得到的样品中的生物部分。
在本发明的另一些实施方案中,公开了一种方法和试剂盒,其用于检测由患者得到的少的流体样品中的生物部分。
因此,根据本发明的实施方案,提供了用于实施测定化学状态的检验的自容系统,该系统包括:
a)其中用于实施所述的检验的固定盒,该盒适用于容纳:至少一种适于与样品反应的至少一种试剂;以及至少一种报告功能,其适用于报告所述的至少一种试剂与所述的样品的反应,从而报告检验的结果;
b)机械控制器,其包含:
i.第一推动手段,其适用于由外部将力施加在所述的盒上,从而释放所述的至少一种试剂;
ii.至少一个第二推动手段,其适用于施加可移动的力,从而引起流体在所述的盒中沿着第一方向移动,并且在所述的力移动时,使得流体沿着所述的第一方向的相反方向移动;
c)适用于检测所述的反应的光学读取器;以及
d)适用于接收光学读取器的数据并处理该数据以测定化学状态的处理器。
此外,根据本发明的实施方案,所述的盒进一步包含适用于在用于检测至少一种报告功能的盒上对准读取通道的排列手段。
此外,根据本发明的实施方案,所述的盒进一步包含多个流体开放通道,所有的流体开放通道彼此都是液体连通的。
此外,根据本发明的实施方案,所述的盒适用于在接收流体样本后被密封,并且适用于使预定量的样品通过多个流体开放通道的至少一部分。
此外,根据本发明的实施方案,所述的盒进一步包含至少一个可充气的变形弹性室,其适用于在流体通道中施加负压力和正压力的至少一种。
此外,根据本发明的实施方案,所述的至少一个变形弹性室适用于进一步将在密封的机载储存室中存储的至少一种试剂与预定量的样品在反应室中接触,从而引起所述的反应。
此外,根据本发明的实施方案,所述的第一推动手段与机载储藏室相邻设置,使得在移动时适用于使储存室上易碎的密封断裂。
而且另一方面,根据本发明的实施方案,所述的排列手段适用于在用于在预定量的样品中检测反应的盒上对准读取通道的排列手段。
此外,根据本发明的实施方案,多个流体开放通道的一些通道的横截面为0.1至2mm2。
注意,根据本发明的实施方案,预定量为10至500微升的体积。
此外,根据本发明的实施方案,所述的盒适用于将多个机载试剂与样品和反应产物的至少一种相接触。
在一些情况下,根据本发明的实施方案,所述的盒适用于引发多种机载试剂与样品和反应产物的至少一者之间发生级联顺序的反应。
此外,根据本发明的实施方案,所述的盒包含至少一个反应室,其体积为200至10000微升。
此外,根据本发明的实施方案,所述的系统进一步包含位于盒外部的温度控制装置,该装置适用于控制反应温度。
此外,根据本发明的实施方案,所述的盒的保质期为6至24个月。
重要的是,根据本发明的实施方案,所述的盒是无阀的。
注意,根据本发明的实施方案,所述的检验为流式细胞仪检验。
此外,根据本发明的实施方案,所述的化学状态为生物化学状态。
此外,根据本发明的实施方案,所述的生物化学状态表明了生物状况。
此外,根据本发明的实施方案,所述的样品为生物样品。
在一些情况下,根据本发明的实施方案,所述的生物样品为肌体样品。
此外,根据本发明的实施方案,所述的肌体样品选自血液,血清,血浆,尿,唾液,脑脊液(CSF),浆液,腹膜液和滑液血液,尿,血浆,血清和唾液。
此外,根据本发明的实施方案,所述的盒是无阀的。
此外,根据本发明的实施方案,所述的盒为一次性微流体盒。
而且另一方面,根据本发明的实施方案,所述的样品通过毛细管部分引入至所述的盒中。
此外,根据本发明的实施方案,所述的盒包含以下元件的至少一种:
i. 贮液器;
ii. 泵;
iii. 导管;
iv. 小型化流动池;
v. 运输通道;
vi. 读取通道
vii. 微流体元件;
viii. 压缩气体保持元件;
ix. 压缩气体释放元件;
x. 喷嘴元件;
xi. 混合元件;
xii. 风箱元件;
xiii. 适用于根据特定的顺序启动所述的元件的软件;以及
xiv. 根据特定的顺序启动所述的元件的硬件。
此外,根据本发明的实施方案,设置在所述的盒中的至少一种试剂包含以下的至少一种:
a.至少一种靶向抗体;
b.至少一种阳性对照识别抗体;以及
c.至少一种阴性对照识别检测部分。
此外,根据本发明的实施方案,设置于所述的盒中的至少一种试剂包含至少一种参照组合物,其包含以下的至少一种:
a.靶向信号参照组合物;以及
b.参照识别器组合物。
此外,根据本发明的实施方案,设置于所述的盒中的至少一种试剂包含以下的至少一种:
a.阳性对照部分;以及
b.阴性对照部分。
此外,根据本发明的实施方案,设置于所述的盒中的至少一种试剂包含至少一种脓毒病生物标志物。
因此,根据本发明的另一个实施方案,提供了测定受试对象中生物状况的方法,该方法包括:
a.将由所述的受试对象得到的样品在本文所述的系统中温育预定的时间段;以及
b.接收对至少一种报告功能产生应答的指示,从而根据化学状态,提供受试对象中生物状况的指示。
此外,根据本发明的另一个实施方案,所述的生物状况选自血液疾病,例如白血病,血小板减少症,免疫系统疾病,局部感染,泌尿系统紊乱,自身免疫病和脓毒病。
此外,根据本发明的另一个实施方案,所述的指示是定量的。
此外,根据本发明的另一个实施方案,所述的方法是在20分钟内完成的。
因此,根据本发明的另一个实施方案,提供了用于测定哺乳动物受试对象中生物状况的方法,该方法包括:
a.当所述的受试对象具有生物状况时,将由所述的受试对象得到的样品与至少一种组合物在本文所述的系统中温育预定的时间段,从而形成至少一种反应产物;以及
b.接收至少一种反应产物的指示,从而提供所述的受试对象中生物状况的指示,其中所述的至少一种反应产物为对所述的系统中的至少一种报告元件产生的应答。
因此,根据本发明的另一个实施方案,提供了测定受试对象中测定受试对象中脓毒病的存在或缺乏情况的自动化方法:
a.将由所述的受试对象得到的血液样品与荧光标记的结合部分在本文所述的系统中相接触,所述的部分对脓毒病标志物具有特异性,其中所述的血液样品的体积为50μL或更少;以及
b.检测所述的样品中所述的结合部分的存在、缺乏或水平,由此在20分钟内测定在所述的受试对象中脓毒病的存在或缺乏情况。
此外,根据本发明的实施方案,其中所述的脓毒病标志物为CD64。
此外,根据本发明的实施方案,所述的脓毒病标志物为CD163。
此外,根据本发明的实施方案,所述的方法进一步包括将所述的血液样品与对第二脓毒病标志物具有特异性的第二荧光标记的结合部分相接触。
此外,根据本发明的实施方案,所述的脓毒病标志物为CD64,所述的第二脓毒病标志物为CD163。
因此,根据本发明的另一个实施方案,提供了用于实施测定自容式固定盒中化学状态的检验的方法,该方法包括:
a.将样品引入至本文所述的系统中;
b.将至少一种试剂与所述的样品反应;以及
c.检测与至少一种报告功能有关的信号,所述的至少一种报告功能适用于报告所述的至少一种试剂与所述的样品的反应,由此测定所述的化学状态。
此外,根据本发明的实施方案,所述的方法进一步包括形成至少一种产物,以及检测与所述的产物有关的信号。
此外,根据本发明的实施方案,所述的检验为流式细胞仪检验。
此外,根据本发明的实施方案,所述的化学状态为生物化学状态。
此外,根据本发明的实施方案,所述的生物化学状态表明了生物状况。
此外,根据本发明的实施方案,所述的样品为生物样品。
此外,根据本发明的实施方案,所述的生物样品为肌体样品。
此外,根据本发明的实施方案,所述的肌体样品选自血液,血清,血浆,尿,唾液,脑脊液(CSF),浆液,腹膜液和滑液。
此外,根据本发明的实施方案,所述的至少一种试剂包含以下的至少一种:
a.细胞表面标志物;
b.细胞染色;
c.与固体载体结合的试剂;
d.化学指示剂;以及
e.生物细胞指示剂。
此外,根据本发明的实施方案,所述的细胞表面标志物选自CD64,CD4,CD8,干细胞指示剂,微小残留病灶指示剂和淋巴细胞亚型指示剂。
此外,根据本发明的实施方案,所述的细胞染色选自白细胞分类指示剂、细胞凋亡指示剂。
此外,根据本发明的实施方案,与固体载体结合的试剂选自固定化酶、固定化底物、血浆蛋白珠、抗体珠、抗原珠和ELISA检验。
此外,根据本发明的实施方案,所述的化学指示剂选自颜色指示剂,浊度指示剂,pH指示剂,吸附指示剂,放射指示剂和化学反应指示剂。
此外,根据本发明的实施方案,所述的生物细胞指示剂选自细胞周期阶段指示剂,细胞增殖指示剂,细胞因子指示剂,代谢指示剂和细胞凋亡指示剂。
此外,根据本发明的实施方案,所述的至少一种试剂包含至少2种试剂。
此外,根据本发明的实施方案,所述的至少2种试剂包含以下至少一种:
a.细胞表面标志物和细胞元素染色;
b.细胞表面标志物和血浆蛋白珠检验;
c.细胞表面标志物和溶液改变标志物;
d.细胞元素染色和血浆蛋白珠检验;以及
e.细胞元素染色和溶液改变标志物。
此外,根据本发明的实施方案,所述的生物状况选自血液疾病,例如白血病,血小板减少症,免疫系统疾病,局部感染,泌尿系统紊乱,自身免疫病和脓毒病。
因此,根据本发明的另一个实施方案,提供了一种用于在固定盒中形成化学反应的方法,该方法包括:
将至少一种组合物储存在本文所述的盒中;以及
启动所述的盒内的至少一个可充气的室,从而向所述的至少一种试剂提供至少一种压力,由此诱导所述的化学反应。
因此,根据本发明的实施方案,提供了一种用于评价患者的生物状况的试剂盒,该试剂盒包含:
a)用于接收生物样本以及用于将所述的样本与至少一种组合物结合的一次性元件;
b)包含至少一个检测器部分的至少一种组合物,从而形成反应产物,其中所述的检测器部分适用于与所述的样品反应;以及
c)适用于提供反应产物的指示的至少一种报告元件,从而提供化学个体存在的指示。
此外,根据本发明的实施方案,所述的试剂盒进一步包含:
d)使用该试剂盒的说明书。
此外,根据本发明的实施方案,所述的一次性元件为一次性盒。
此外,根据本发明的实施方案,所述的一次性盒为一次性微流体盒。
此外,根据本发明的实施方案,所述的一次性微流体盒包含以下元件的至少一种:
a)贮液器;
b)泵;
c)导管;
d)小型化流动池;
e)运输通道;
f)微流体元件;
g)压缩气体保持元件;
h)压缩气体释放元件;
i)喷嘴元件;
j)混合元件;
k)风箱元件;
l)适用于根据特定的顺序来启动所述的元件的软件;以及
m)根据特定的顺序来启动所述的元件的硬件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少2种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少3种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少4种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少5种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少10种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少20种所述的元件。
此外,根据本发明的实施方案,所述的一次性微流体盒包含至少30种所述的元件。
根据本发明的实施方案,微流体试剂盒被构造成能够在1个小时内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在30分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在15分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在10分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在5分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在1分钟内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在30秒内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在10秒内提供快速指示。
根据本发明的另一个实施方案,微流体试剂盒被构造成能够在1秒内提供快速指示。
因此,根据本发明的实施方案,提供了用于实施快速生物检验的微流体检验试剂盒,该试剂盒包含:
a)包含反应物的一次性元件,该一次性元件适用于接收包含生物个体的样品以及将所述的反应物与所述的生物个体结合从而形成反应产物;以及
b)适用于提供快速指示所述的反应物消失的至少一种报告元件,由此提供生物个体的快速检验。
因此,根据本发明的实施方案,提供了用于实施生物个体的快速检验的微流体检验试剂盒,该试剂盒包含:
a)包含反应物的一次性元件,该一次性元件适用于接收包含生物个体的样品以及将所述的反应物与所述的生物个体结合从而形成反应产物;以及
b)适用于提供快速指示所述的反应物出现的至少一种报告元件,由此提供生物个体的快速检验。
因此,根据本发明的实施方案,提供了用于评价生物状况的组合物,该组合物包含:
a.包含以下至少一种的样品组合物:
i.包含靶向部分的肌体样本;
ii.阳性对照部分;以及
iii.阴性对照部分;
b.包含以下至少一种的检测组合物:
i.至少一个靶向抗体;
ii.至少一个阳性对照识别抗体;以及
iii.至少一个阴性对照识别检测部分或特征;以及
c.包含以下至少一种的至少一种参照组合物;
i.靶向信号参照组合物;以及
ii.参照识别器组合物。
因此,根据本发明的另一个实施方案,提供了用于评价生物状况的组合物,该组合物包含:
a.包含以下至少一种的样品组合物:
iii.包含靶向部分的肌体样本;
iv.阳性对照部分;以及
v.阴性对照部分;
b.包含以下至少一种的抗体组合物:
vi.至少一种靶向抗体(CD64抗体);
vii.至少一种阳性对照识别抗体(CD163);以及
viii.至少一种阴性对照识别抗体或特征;以及
c.包含以下至少一种的至少一种参照组合物:
ix.靶向信号参照组合物;以及
x.参照识别器组合物。
此外,根据本发明的实施方案,所述的组合物进一步包含至少一种调节部分,其包含:
d.至少一种溶解试剂;以及
e.至少一种稀释剂。
此外,根据本发明的实施方案,所述的生物状况选自血液疾病,例如白血病,血小板减少症,免疫系统疾病,局部感染,泌尿系统紊乱,自身免疫病和脓毒病。
此外,根据本发明的实施方案,肌体样本选自血液,血清,血浆,尿,唾液,脑脊液(CSF),浆液,腹膜液和滑液。
根据本发明的另一个实施方案,所述的靶向部分包括嗜中性粒细胞上的CD64表面抗原。
此外,根据本发明的另一个实施方案,所述的阳性对照部分包含单核细胞,所述的阴性对照包含淋巴细胞。
此外,根据本发明的实施方案,所述的靶向部分为嗜中性粒细胞上的CD64,所述的阳性对照部分包含单核细胞上的CD64的表达,所述的阴性对照部分包含不具有CD64表达的淋巴细胞。
此外,根据本发明的实施方案,所述的靶向指示剂与至少一个靶向抗体上的信号部分结合。
此外,根据本发明的实施方案,所述的至少一种参照组合物包含珠。
此外,根据本发明的实施方案,所述的珠包含聚苯乙烯微珠。
此外,根据本发明的实施方案,所述的靶向抗体参照组合物包含第一荧光信号,所述的参照识别器组合物包含第二荧光信号。
此外,根据本发明的实施方案,所述的第一荧光信号包含FITC,所述的第二荧光信号包含Starfire Red fluor。
因此,根据本发明的实施方案,提供了识别样品中生物标志物的方法,该方法包括:
a.将所述的样品与荧光标记的结合部分相接触,其中所述的荧光标记的结合部分特异性地结合所述的生物标志物;
b.由至少一部分所述的标记样品中检测第一荧光信号;
c.由荧光标记的颗粒的群体中检测第二荧光信号,其中所述的群体包含经过固定时间后的已知的荧光强度;以及
d.将第一荧光信号对第二荧光信号归一化,由此定量生物标志物,
其中所述的归一化包括使用包含软件的装置,其中所述的软件能够比较第一和第二荧光信号。
此外,根据本发明的实施方案,所述的生物标志物为脓毒病生物标志物。
此外,根据本发明的实施方案,所述的生物标志物为CD64或CD163。
此外,根据本发明的实施方案,所述的样品为血液样品。
根据本发明的另一个实施方案,所述的结合部分的荧光标记和所述的颗粒的荧光标记是相同的荧光标记。
此外,根据本发明的实施方案,所述的结合部分为抗体。
根据本发明的实施方案,所述的软件能够识别特定的多种荧光标记的颗粒。
此外,根据本发明的实施方案,所述的单独的荧光信号包含至少一个第一荧光信号和至少一个第二荧光信号。
此外,根据本发明的实施方案,所述的荧光标记的结合部分靶向样品中的第一细胞群体和第二细胞群体。
根据本发明的另一个实施方案,检测结合部分与第二细胞群体的结合为样品提供了内部阳性对照。
此外,根据本发明的实施方案,所述的结合部分为抗CD64抗体,所述的第一细胞群体包含多形核白细胞。
此外另一方面,根据本发明的实施方案,所述的第二细胞群体包含单核细胞。
根据本发明的实施方案,所述的方法进一步包括测定样品中至少一个细胞群体存在情况的步骤,从而为样品提供了内部阴性对照,其中所述的样品未与所述的结合部分结合。
因此,根据本发明的另一个实施方案,提供了用于评价生物状况的组合物,该组合物包含:
a.包含以下一种的样品组合物
i.包含靶向部分的肌体样本;
ii.阳性对照部分;以及
iii.阴性对照部分;
b.包含以下至少一种的抗体组合物:
iv.至少一种靶向抗体;
v.至少一种阳性对照识别抗体;以及
vi.至少一种阴性对照识别抗体或特征;以及
c.包含以下至少一种的至少一种参照组合物:
vii.靶向抗体参照组合物;以及
viii.参照识别器组合物。
根据本发明的实施方案,所述的组合物进一步包含至少一个调节部分,其包含:
a)至少一种溶解试剂;以及
b)至少一种稀释剂。
因此,根据本发明的另一个实施方案,提供了测定受试对象中脓毒病的存在或缺乏情况的方法,该方法包括:
a)将由所述的受试对象得到的血液样品与对脓毒病标志物具有特异性的荧光标记的结合部分相接触,其中所述的血液样品的体积为50μL或更少;以及
b)检测所述的样品中结合部分的存在、缺乏或水平,从而测定所述的受试对象中脓毒病的存在或缺乏情况。
因此,根据本发明的另一个实施方案,提供了定量样品中生物标志物的方法,该方法包括:
a)将所述的样品与荧光标记的结合部分相接触,其中所述的荧光标记的结合部分特异性地结合所述的生物标志物;
b)由至少一部分所述的标记样品中检测第一荧光信号;
c)由荧光标记的颗粒的群体中检测第二荧光信号,其中所述的群体包含经过固定时间后的已知的荧光强度;以及
d)将第一荧光信号对第二荧光信号归一化,由此定量生物标志物,其中所述的归一化包括使用包含软件的装置,其中所述的软件能够比较第一和第二荧光信号。
根据一些实施方案,所述的样品可以是液体,根据其他的实施方案,所述的样品可以是胶体或悬液。根据其他的实施方案,所述的样品可以是固体,例如粉末或晶体形式。
用于现有技术的诊断检验的典型周转时间为30-120分钟。通常,浪费在等待实验室结果中的时间可以导致患者进一步恶化,有时还会导致死亡。在一些情况下,医生必须在不具有实验室结果的情况下行动。这可以导致为患者提供了错误的治疗。本发明提供了快速检验以解救生命并为患者提供快速正确的治疗。
因此,根据本发明的实施方案,提供了测定受试对象中脓毒病的存在或缺乏的自动化方法,该方法包括:
a)将由所述的受试对象得到的血液样品与对脓毒病标志物具有特异性的荧光标记的结合部分相接触,其中所述的血液样品的体积为50μL或更少;以及
b)检测所述的样品中结合部分的存在、缺乏或水平,从而在20分钟内测定所述的受试对象中脓毒病的存在或缺乏情况。
此外,根据本发明的实施方案,所述的脓毒病标志物为CD64。
此外,根据本发明的实施方案,第二脓毒病标志物为CD164。
此外,根据本发明的实施方案,所述的方法进一步包括将所述的血液样品与对第二脓毒病标志物具有特异性的第二荧光标记的结合部分相接触。
此外,根据本发明的实施方案,所述的脓毒病标志物为CD64,所述的第二脓毒病标志物为CD163。
此外,根据本发明的实施方案,所述的结合部分为抗体。
此外,根据本发明的实施方案,所述的检测部分是在能够接收所述的样品并且能够检测所述的结合部分的装置中实施的。
此外,根据本发明的实施方案,所述的方法进一步包括通过检测荧光标记的颗粒的群体来校准所述的装置的步骤。
根据本发明的另一个实施方案,所述的颗粒包含与荧光标记的结合部分相同的荧光标记。
此外,根据本发明的实施方案,所述的方法进一步包括颗粒的第二群体,其中所述的颗粒包含与所述的第二荧光标记的结合部分相同的荧光标记。
此外,根据本发明的实施方案,所述的方法进一步包括在检测所述的荧光标记的结合部分之后实施内部校准。
注意,根据本发明的实施方案,所述的校准是在少于5分钟内完成的。
根据一些实施方案,所述的颗粒为微珠。
此外,根据本发明的实施方案,所述的方法是在少于15分钟内实施的。
此外,根据本发明的实施方案,所述的方法进一步包括测定所述的样品中至少一个细胞群体的存在情况的步骤,从而为所述的样品提供内部阴性对照,其中所述的样品未与所述的结合部分结合。
通过本发明优选实施方案的以下的详细描述,以及附图将更全面地理解本发明。
附图简述
现在,参照以下示例性附图,连同某些优选的实施方案来描述本发明,这样可以更全面地理解本发明。
现在详细地特定地参照附图,强调所示的具体情况为举例的方式并且仅是为了示例性地讨论本发明的优选的实施方案,并且是为了提供认为哪些方面最有用且容易地理解本发明的原理和概念方面的描述而列出的。就此而言,并未试图更详细地显示本发明的结构细节,只示出基础理解本发明所必需的细节,这些描述以及附图对于本领域的那些技术人员而言显而易见的是本发明的多种形式可以如何体现在实践中。
附图中:
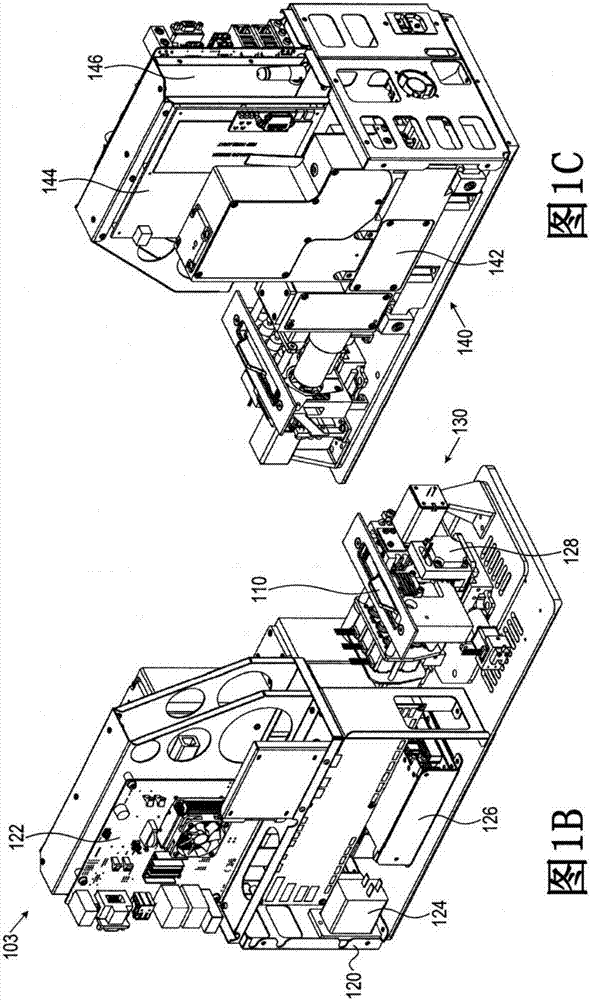
图1A为根据本发明的实施方案,用于检测生物状况的系统的简化三维正视图;
图1B为根据本发明的实施方案,用于检测生物状况的读取器组件的简化三维内部正视图;
图1C为根据本发明的实施方案,用于检测生物状况的读取器组件的简化三维内部后视图;
图2A为根据本发明的实施方案,用于检测生物状况的光学读取器组件的简化拆分图;
图2B为根据本发明的实施方案,用于检测生物状况的光学读取器组件的光电倍增管的简化拆分图;
图3A显示根据本发明的实施方案,读取器光学器件组件、盒操作单元和前向散射检测单元;
图3B显示根据本发明的实施方案,读取器光学器件组件的右视图;
图3C显示根据本发明的实施方案,读取器光学器件组件的左视图;
图3D为根据本发明的实施方案,前向散射检测组件;
图3E为根据本发明的实施方案,前向散射检测组件的侧视图;
图4A显示根据本发明的实施方案,读取器组件的剖视图;
图4B显示根据本发明的实施方案,读取器组件的拆分右视图;
图4C显示根据本发明的实施方案,读取器组件的左视拆分图;
图4D显示根据本发明的实施方案,盒操作单元(CHU)的后视图;
图4E显示根据本发明的实施方案,盒操作单元(CHU)的正视图;
图5为根据本发明的实施方案,读取器光学器件组件的拆分图;
图6为根据本发明的实施方案,图1A所示系统的一次性盒的简化示意图;
图7A为根据本发明的实施方案,读取器光学器件组件的光学排布的简化示意图;
图7B为根据本发明的实施方案,读取器光学器件组件的光学排布的另一个简化示意图;
图8A为根据本发明的实施方案,在图7A或7B的光学单元中多波长激发的一个实例的示意图;
图8B显示根据本发明的实施方案,传输的图形输出,其为用于图7B的二向色滤光片的波长的函数,其中使用图8A的多波长激发;
图8C为根据本发明的实施方案,光学单元的部件的示意图,其中使用了图8A的多波长激发以及图7B的二向色滤光片;
图9A为根据本发明的实施方案,图1A所示系统的取样盒的示意图;
图9B显示根据本发明的实施方案,在流式细胞仪装置中一次性盒的示意图;
图10为根据本发明的实施方案,用于医学状况快速测定的方法的简化流程图;
图11为根据本发明的实施方案,显示参照珠(RM)相对于由人类患者得到的样品(PMN)而言,在经过一定时间后光学输出的三维图;
图12A-12C显示根据本发明的实施方案,参照珠和由人类患者得到的样品在经过一定时间后光学输出的图;
图13A为根据本发明的实施方案,盒组件的外部侧视图;
图13B为根据本发明的实施方案,盒组件的内部侧视图;
图14A-14O显示根据本发明的实施方案,盒组件中处理事件的顺序;
图15为根据本发明的实施方案,微流体分光光度计读取的示意图;
图16为根据本发明的实施方案,用于光学处理的流程图;
图17A-17B为根据本发明的实施方案,绘制的用户界面的使用步骤的示意图;
图18为根据本发明的实施方案,显示信号处理软件的作用的盒的框图;
图19A为根据本发明的实施方案,用于生物检测的算法的流程图;
图19B为根据本发明的实施方案,用于生物检测的算法的流程图;
图20A-20B显示根据本发明的实施方案,显示带宽层次化和平滑的阵列;
图21A-21B为根据本发明的实施方案,用于解决观察信号的fluor分解的示意图;
图22A-22B为根据本发明的实施方案时,使用具有MESF检测与具有FACS检测的FITC珠的系统性能的比较图;
图23A-23B显示根据本发明的实施方案,使用Alexa 488MESF的系统性能的线性图示;
图24为根据本发明的实施方案,显示CD4-CD8检验在经过一定时间后的光学输出的三维图;
图25为根据本发明的实施方案,显示CD4-CD8检验的聚类分析的图示;
图26-27为根据本发明的实施方案,显示图25的聚类分析的聚类分离性的图示;
图28为根据本发明的实施方案,不同阵列选择的比较表;
图29A为根据本发明的实施方案,用于由散点图选择数据组的算法的具体实施流程图;
图29B为根据本发明的实施方案,用于由散点图选择数据组的算法的一般实施流程图;
图30为根据本发明的实施方案,显示4个不同事件组的4个fluor信号的散点矩阵;
图31A为根据本发明的实施方案,Starfire Red(SFR)信号值的数据的柱状图;
图31B为根据本发明的实施方案,图31A所示的柱状图的多项式及其一阶导数和二阶导数的图;
图32A为根据本发明的实施方案,PE488特征值的数据的柱状图;
图32B为根据本发明的实施方案,与图32A中的柱状图以及相应的一阶导数和二阶导数拟合的多项式;
图33A为根据本发明的实施方案,PE488特征值的数据的柱状图;
图33B为根据本发明的实施方案,与图33A中的柱状图以及相应的一阶导数和二阶导数拟合的多项式;
图34A为根据本发明的实施方案,Diode 1通道特征值的数据的柱状图;以及
图34B显示根据本发明的实施方案,与图34A中的柱状图以及相应的一阶导数和二阶导数拟合的多项式;
在所有的附图中,相同的参数识别为相同的部件
优选实施方案的详细描述
在详细描述中,列出了多个特定的细节,从而提供了对本发明的完全理解。但是,本领域的那些技术人员应该理解的是这些为具体的实施方案,并且本发明还可以以不同的方式的实施,这些方式体现了本文所述的和所要求的本发明的特征化的特性。
Kasdan等人的国际专利申请公开No.WO2011/128893描述了医学状况快速测定的装置、系统和方法,并以引用方式并入本文。
现在参照图1A,其为根据本发明的实施方案,用于检测生物状况的系统101的简化三维正视图,其中所述的系统101包含读取器组件100和盒110。
图1A示出了读取器组件100和盒110。所述的盒插在读取器组件中,如所示。一旦所述的盒插在读取器组件中,则所有的检验预分析处理和分析便可以自动实施。分析结果显示在用户界面触屏115上,其还用于控制读取器的操作。
图1B显示根据本发明的实施方案,用于检测生物状况的读取器组件100的简化三维内部正视图。
读取器组件的内部构件示于图1B中。可见左视图120,其显示ITX计算机,Galil电动机控制器124,电子电源126,插入至盒操作单元(CHU)128中的盒110,以及向前散射检测器130。此外,可见右视图140,其显示读取器光学器件142,数据获取板144,以及常规的电子印制电路板146。
现在参见图2A,其为根据本发明的实施方案,用于检测生物状况的读取器光学器件组件200的简化拆分图。图2B为根据本发明的实施方案,用于检测生物状况的光学器件读取器组件的光电倍增管250的另一个简化拆分图。
图2A显示读取器光学器件组件200的主要模块部件。除了顶视图222以外,还可见光学器件组件的全部侧视图220。激光单元203在其散热组件221中包含激光以及光束扩展器223。所述的组件进一步包含激发和发射收集光学器件204。此外,读取器光学器件组件还包含光电倍增管组件202,激光镜盖205,PMT镜盖206,改进的M6固定螺丝207,盒钳208,以及多个螺丝209-211。如图2A中所示组装读取器光学器件组件。
图2B显示PMT组件的细节。PMT组件的侧视图和底视图分别显示为侧视图270和底视图272。PMT组件的主要元件包含PMT盒251,PMT光栅组件252,PMT桥接组件255,PMT盖258,PMT单元259,PMT透镜组件260,PMT针孔螺帽261,针孔262,针孔罩263,以及调节杆265。
图3A显示根据本发明的实施方案,读取器光学器件组件310、盒操作单元312和前向散射检测单元314。
图3B显示根据本发明的实施方案,完整的读取器光学器件组件的右视图。
图3C显示根据本发明的实施方案,读取器光学器件组件的左视图。
图3D为根据本发明的实施方案,前向散射检测组件130。该组件包含LED 352,从而在自动聚焦过程中照明读取通道,例如读取通道(图14M);堵塞358,用于阻挡低角散射;以及透镜356,用于收集检测光电二极管(前向散射检测器130,图1B)的所需的前向散射。
图3E为根据本发明的实施方案,前向散射检测组件130的侧视图。该图中显示照明透镜350,收集透镜356,357和358,以及检测光电二极管360。
图4A显示根据本发明的实施方案,读取器组件130的剖视图。其为在前面和侧面显示其构件的读取器组件的剖视图。这些构建包含ITX板122,盒操作单元128,以及前向散射检测组件130。
图4B显示根据本发明的实施方案,读取器组件129的拆分右视图。该图中的3个主要的构件为读取器光学器件组件142,盒操作单元128以及前向散射检测模块130。
图4C显示根据本发明的实施方案,读取器组件的左视拆分图。该图显示ITX计算机板122,盒操作单元128,前向散射检测模块130,以及读取器光学组件142的另一侧。
图4D显示根据本发明的实施方案,盒操作单元(CHU)128的后视图。在该图中,可以看见插入盒110的手柄199。其中配置传感器412,从而检测发动机410和执行器414的位置(其适用于压制泡),以及在发动机的柄417上可以看见执行器416(940,图9,1415,1417,图14A-L)。提供开口418用于显微镜的物镜438,从而观察盒上的读取通道。
图4E显示根据本发明的实施方案,盒操作单元(CHU)的正视图。该图显示盒操作单元(CHU)128的正视图。在该图中,可以看见盒110上部的手柄。提供了用于观察微流体路径的端口420。该端口通过照相机430观察,以便确保盒内进行正确操作。提供另一个开口441用于前向散射离开盒操作单元,并可以通过前向散射检测组件130观察。
图5显示根据本发明的实施方案,读取器组件130的拆分图。
图6为根据本发明的实施方案,用于医学状况快速测定的一次性盒6050的简化示意图;
一次性盒6050适用于接收体积流体,例如但不限于血液,尿,血清或血浆。一次性盒可以构造并配置,从而具有多个不同的部分6052,6054,6056和6058。部分6052为体液吸入部分,其适用于由患者(或动物)直接或间接接收体液,并且这部分可以用作体液的贮液器。
一次性盒6050在所述的多个部分之间包含流体传输手段,例如但不限于空气压力、液体压力、机械手段和它们的组合。体液吸入部分6052适用于将预定量的体液(体液样品6051)传输至预分析样品处理部分6054。
在预分析样品处理部分6054中,在体液上实施至少一个预备步骤,例如但不限于:
a)与至少一种抗体温育;
b)与至少一种抗原温育;
c)体液中至少一种类型的细胞的染色;
d)体液的至少一种类型的细胞的酶溶解;
e)体液的至少一种类型的细胞的渗透溶解;
f)加热或冷却体液的至少一部分;
g)将参照材料加入体液中;以及
h)与体液的至少一种元素发生化学反应。
然后,将体液的预处理样品由预分析样品处理部分6054传输至样品激发/相互作用的区域或部分6056。这种预处理样品可以以连续的或分批的模式传输至样品激发/相互作用的部分6056。
图7A为根据本发明的实施方案,读取器光学器件组件400的光学排布的简化示意图。
激光440或其他合适的光源提供光束442,其可以定向于多个光学元件,包括二向色滤光片443,光束分裂器444,聚焦透镜445,针孔446,以及硅读取器单元447,用于记录朝向样品450定向通过物镜438并返回至光学单元的光束442得到的信号。其他的光学元件可以包括光学衰减器448,高通滤光片449,聚焦透镜451,狭缝452,凹光栅453,以及PMT阵列454。元件的这种排布(代表了本发明的实施方案)可以用于激发光生成,将其聚焦在样品上,收集样品中由激发光与荧光团的相互作用而得到的反射的或发射的光信号,并记录所述的返回的光,以便测定样品响应于由激光440得到的光照而产生的荧光。
参照图7A,激光照明442被二向色滤光片443反射通过物镜438,并聚焦在包含流动颗粒458的通道上。该照明激发了附着在蛋白质标志物上的荧光团,其中所述的蛋白质标志物与所述的细胞结合。
所得的荧光照片被物镜438收集,并且由于更长波长的这种发射通过二向色滤光片443,并被光束分裂器444反射通过高通滤光片449。高通滤光片阻挡了任何反射的激光照明。聚焦透镜451将多波长发射照明聚焦在狭缝452上。凹光栅453在多波长下通过狭缝成像在PMT阵列454的元件上。这完成了创建荧光发射的多谱线检测的过程。
尽管物镜收集的大部分照明被光束分裂器444反射,但是允许一小部分通过,并通过聚焦透镜445通过针孔446聚焦在硅读取器元件447上,其可以为单一光电二极管或焦平面阵列,例如CCD传感器。在聚焦操作过程中,当该读取器单元447上的信号最大时,取得最佳焦点。当该信号最大时,PMT阵列454上的信号强度也最大。
现在参照图7B,其为根据本发明的实施方案,读取器光学器件组件400(图7A)的光学排布460的另一个简化示意图。
参照图7B,如图7A中,激光照明被二向色滤光片472反射通过物镜474,并聚焦在包含流动颗粒的通道上。该照明激发了附着在蛋白质标志物上的荧光团,其中所述的蛋白质标志物与所述的细胞结合。所得的荧光照片被物镜474收集,并且由于更长波长的这种发射通过二向色滤光片472,并被光束分裂器468反射通过高通滤光片470。高通滤光片470阻挡了任何反射的激光照明。聚焦透镜466将多波长发射照明聚焦在狭缝478上。凹光栅482在多波长下通过狭缝成像在PMT阵列476的元件上。这完成了创建荧光发射的多谱线检测的过程。尽管物镜474收集的大部分照明被光束分裂器468反射,但是允许一小部分通过,并通过针孔464聚焦在硅读取器元件462上。在聚焦操作过程中,当该读取器单元上的信号最大时,取得最佳焦点。当该信号最大时,PMT阵列476上的信号强度也最大。
图8A为根据本发明的实施方案,在图7A或7B的光学单元中多波长激发的一个实例的示意图。
现在参照图8A,其为根据本发明的实施方案,在图7A或7B的光学单元中多波长激发的一个实例的示意图500。图8A-8C显示图7A和7B中光学构造的扩展,从而允许多激发的波长。
图8A显示用于结合不同波长的多重激光从而产生包含所有波长的单一同轴光束514的构造。可以使用二向色镜504结合2种不同的波长,例如绿色502和红色506。光束之一,红色506被二向色镜反射,而第二光束,绿色502通过二向色镜,从而产生包含2种波长的单一光束508,黄色。这种结合波长的光束现在可以用作朝向第二二向色镜516的输入之一,其中第三波长512被第二二向色镜反射,从而产生包含所有3个波长的单一同轴光束510。
现在参照图8B,其显示根据本发明的实施方案,传输的图形输出520,其为用于图7B的二向色滤光片500的波长的函数,其中使用图8A的多波长激发。
与图8C的镜子552相似或一致的多波段二向色镜(未示出)用于通过物镜554照明样品(图8C),同时允许所得的辐射在所有波长下都通过二向色镜552,除了多光束激发514的那些(图8A)。
按照这种方式,使用单一波长的相同的epi-构型事实上对二向色镜552而言可以适当地改变,并加入多重激光502,506,512,从而提供多波长激发,同时实际上保持单一激发系统的所有检测波长。
转向图8C,可见根据本发明的实施方案,光学单元的部件550的示意图,其中使用了图8A的多波长激发以及图7B的二向色滤光片。在一些情况下,部件550可以替代亚系统475(图7B)。
表1.用于本发明的代表性构件的代表值
尽管很多之前的讨论集中于本发明一些实施方案的光学元件,但是本文所提出的诊断系统的重要构件之一为一次性样品盒。
现在参照图9A,其为根据本发明的实施方案,图1A的取样盒110的示意图。盒650包含预分析构件652,样品(未示出)可以引入至其中。
所述的样品通常为全部或部分(血清等)的血液。另外或备选地可以使用其他液体样品。在预分析构件652中,允许样品与预包装于构件652中的化学品相互作用。该相互作用可以是被动的,或者包括主动混合。
在分析构件652中包含的化学品可以为湿态或干态,并且通常包含与荧光探针结合的抗体。可以针对与预定的生物标志物等的结合能力来预先选择抗体。在典型的试验中,预定量(通常少于50微升)的血液被引入至一次性盒650的预分析构件652中。将所述的样品与预分析构件652中存在的化学试剂主动混合预定的时间段,通常少于10分钟。然后通过即将讨论的手段使所述的样品移动通过毛细管区域653,在此,其暴露于由物镜638传递的光束642。在毛细管区域652中,样品流动的方向通过箭头显示。
毛细管区域653被设计成可以使颗粒流以单行通过光束642。这种排布可以计数颗粒的数量以及对颗粒的单独查询,从而测定各颗粒上生物标志物的存在情况(通过它们相关的荧光标签)。此类物理排布允许检测各颗粒上一种或多种生物标志物(而与颗粒特定的性质无关,例如大小、形状和数量)。
最后,具有收集构件654,其接收暴露于光束642后的样品。这是废物区,并且可以是完全自容式的清除,以用于样品制备、分析和废物收集。注意一次性盒可以为任何相关的形状,并且为了理解其构件和功能,如图6所示。
如上文提及的那样,在预分析处理从而允许荧光标签与细胞/颗粒结合后的样品必需在光学单元产生的光束642下流动(未示出)。这种流动通常为“单行的”,从而允许精确地测定各分析细胞上的细胞特异性标志物。诱导流动的方法包括但不限于电学刺激、化学诱导和真空拉动。在电学刺激系统中,在跨越毛细管区域653上施加电荷,从而诱导电荷颗粒由预分析构件652向收集构件654移动。可以通过细胞计数器施加电荷,一次性盒650可以放置于其中或者是外部来源的。
备选地,毛细管区域可以包含促进样品由左侧向右侧移动的化学特征(亲水性/疏水性;正电荷/负电荷),如图9A所示。备选地,可以对收集构件654施加真空,从而由预分析构件652将样品拉动通过毛细管区域653。可以使用其他方法使液体样品在光束642之下移动,以用于分析。
如本文所述,光学器件和样品处理可以分别处理。此类排布并非是强制的,在一次性盒中可以包含适当样品分析所必需的一些光学特征。
现在参照图9B,其显示根据本发明的实施方案,在流式细胞仪装置中一次性盒800(例如系统100)的示意图。现在注意力转向图9B,其显示毛细管区域853的放大图。
在毛细管区域853中,颗粒沿着箭头880所示意的方向流动。颗粒890流动通过物镜838,其发出光842通过毛细管853。流动限制元件894可以存在于毛细管区域853中,从而促进颗粒890以几乎单行的方式移动通过光842。多个颗粒一起通过可以通过处理软件分辨。
可以通过光842照明颗粒890上的分子标志物895,并且其荧光将被临近的光电倍增管899捕获。光电倍增管899可以区分荧光的波长,因此生物标志物895存在于颗粒890上。因此,本发明的系统可以测定哪些生物标志物存在于颗粒890上,其可以在本发明的系统中检测。光电倍增管899可以具有用于区分精细波长的多个管或元件的阵列,并且备选地,可以使用薄膜、CCD或其他合适的光接收读取单元来替代该光电倍增管899。应该理解的是在传输构造下,图9B显示系统101的构造(图1)的一个实施方案,其中检测器(光电倍增管899)设置于盒800的物镜838的对面。
本发明的系统包含适用于运行诊断过程的控制软件。应该理解的是控制软件可以为流式细胞仪的整合部件,或者备选地,安装于相关的计算装置122中(图1B),其可以包括但不限于笔记本电脑、iPod、iPad、手机或大型计算机。
现在参照图10,其为根据本发明的实施方案,用于医学状况快速测定的方法的简化流程图1000。应该理解的是,本发明所述的方法描绘了用于测定患者健康状态的本发明的一个非限定性实施方案。此外,其他实施方案也可以解释为本发明的一部分。
在体液提供步骤1002中,诸如血液、尿、血清或血浆之类的体液由人类或动物患者提供。通常,所述的样品为新鲜的,但是也可以是储存的、冷冻的或冻融的样品。所述的流体通常为液体,并且在4-37℃的温度下。
在体液引入步骤1004中,部分或所有的体液样品6051(图6)被引入至一次性盒中(110,图1A)。
在反应步骤1006中,流体样品在盒中与至少一种反应物反应,从而形成处理的样品。根据一些实施方案,该步骤是在预分析样品处理部分6054(图6)中实施的,如下文中详细描述的那样。
在冲击步骤1008中,辐射冲击在处理的样品上,例如但不限于样品激发/相互作用部分6056,由此在光学单元142的方向上形成多个光谱不同的信号(图1C,参见上文所述)。
在光谱辐射检测步骤1010中,多个光谱不同的信号由多个辐射检测器454(图7A)检测。检测剂输出数据。
此后,在数据处理步骤1012中,输出数据由信号处理器6036(图6)和/或计算机122(图1C)来处理,从而提供表示医学状况的输出。
图11为根据本发明的实施方案,显示参照珠(RM)相对于由人类患者得到的样品(PMN)而言,在经过一定时间后光学输出的三维图。
图11显示根据本发明的实施方案,显示参照珠(RM)相对于由人类患者得到的样品(PMN)而言,在经过一定时间后光学输出的三维图。在6个波段(500-525nm,525-550nm,550-575nm,575-600nm,600-625nm以及625至650nm)中,辐射的振幅示于适用于各样品的时间的图中。不同的荧光团具有不同的辐射光谱。可以理解的是在各波长下光谱含量或形状、以及振幅都与使用吖啶橙(AO)染色的嗜中性粒细胞和包含明亮的光谱荧光团的参照珠(RM)明显不同。AO辐射的峰为525-550nm波段,而RM的峰为500-525nm波段,并且在任何波段中都比AO具有明显更大的振幅。
图12A-12C显示根据本发明的实施方案,参照珠和由人类患者得到的样品在经过一定时间后光学输出的图。
转向图12A-12C,可见根据本发明的实施方案,参照珠和由人类患者得到的样品在经过一定时间后光学输出的图。在这些二维附图中,由各波段得到的踪迹叠加在相同的图上。图12A显示图12B中由嗜中性粒细胞得到的框中的脉冲。由这些图可见,525-550nm通道中的振幅超出了500-525nm通道中的振幅,其为AO的特征。图12C显示AO染色嗜中性粒细胞发射光谱与RM发射光谱的比较。500-525nm波段中光谱的相对振幅与525-550nm波段中的相对振幅明显区分为2个荧光团。此外,RM发射的最大振幅显著大于AO的最大振幅。
本发明所述的并示出的本发明的系统提供了用途,例如但不限于4个以下设想的情况中的至少一种:
a)当为了作出精确的诊断测定而需要多重信息(例如生物标志物和白细胞状态)时;
b)当为了测定患者在疾病曲线上的位置时必须进行多种相继的测量时;
c)当快速需要白细胞和相似数据并且处于POC环境下时;以及
d)当在波长中荧光信号重叠并且对于给定的波长范围需要测定各信号的相对贡献时。
本发明包含用于适当的数据分析以及将原始荧光数据转换成相对生物标志物的实际浓度的软件和算法。
图13A为根据本发明的实施方案,盒组件1300的外部侧视图;图13B显示根据本发明的实施方案,盒组件1300的内部侧视图1350。
图14A-14O显示根据本发明的实施方案,盒组件中处理事件的顺序。
图14A-14O为根据本发明的实施方案,用于检测生物状况的系统101(图1A)操作的一组相继的示意图。
在图14A中,血液样品1401进入样本接收元件1418,并充满室1404。
在图14B中,包含处理组合物120(图1)的泡1420被挤压,并且抗体混合物与10微升的血液样品混合。
在图14C中,混合风箱1415被挤压,这影响了抗体混合物与10微升血液样品在第一混合室1412中的混合,从而形成第一混合物1403。
在图14D中,风箱被释放,混合物1403沿着扭曲的通道1413被虹吸,并进入第二混合室1411中。在风箱被释放时,第一混合物由第二混合室沿着扭曲的通道返回至第一混合室中。每次风箱被挤压时,混合物都向第二室移动,并且每次风箱被释放,混合物都完全或部分返回至第一室中。这种混合可以多次实施。
图14E-14G中,第二组合物泡1422被挤压,从而释放第二组合物122(图1)(例如溶解组合物),从而形成第二混合物1405。第二混合物通过加压风箱1415进行混合,第二混合物沿着扭曲的通道1413由第二混合室返回至第一混合室。每次风箱被挤压,混合物都向第二室1411移动,并且每次风箱被释放,混合物都完全或部分返回至第一室1412中。这种混合可以多次实施。
在图14H-14J中,包含第三组合物124(图1)(例如对照参照物)的第三泡1424被释放至第二混合室中,由此形成第三组合物1407。第三混合物通过挤压风箱1415进行混合,第三混合物沿着扭曲的通道1413由第二混合室返回至第一混合室中。每次风箱被挤压,混合物都向第二室1411移动,并且每次风箱被释放,混合物都完全或部分返回至第一室1412中。这种混合可以多次实施。
在图14J-14M中,挤压读取风箱1417,其迫使第三组合物的一部分趋于读取小管1430。
在图14N-14O中,由第三组合物得到的颗粒1460沿着通道1452由所述的小管1430中流向读取区1450。细胞通过读取区,并被一束或多束激光1462,1463激发。至少一个激发激光束1464冲击在细胞1460上,并通过检测器1470来检测放射束1466。在一个实例中,这为细胞放射荧光,并且检测器1470为分光光度计。
图15为根据本发明的实施方案,微流体分光光度计读取的示意图。
单个细胞1505在微流体通道(参见图14M,1452)中流动通过检测区。此外,使用与多波长荧光标签缀合的抗体而标记的靶向细胞1520流动通过检测区。二极管激光器1530将光线/光束1510冲击在细胞和靶向细胞上。细胞和靶向的细胞放射不同的发射光谱(未示出)。光栅1540通过栅格将发射光谱分散成其构成波长1550。
光电倍增管(PMT)阵列1560或雪崩二极管阵列在相当于8个光谱区域的8个不同的空间位置处检测荧光。
图16为根据本发明的实施方案,光学处理1600方法的流程图。
在形成激光步骤1602中,形成激光激发光束的形状。
在反射步骤1604中,激发光束被二向色镜504反射(图8A,或者图7B的472),并通过物镜474(图7B)达到读取通道1452(图14M)上。
在前向散射测量步骤1606中,测量读取通道中由颗粒1460得到的前向散射(图14N),以检测事件。
此后,在通过步骤1608中,颗粒的荧光放射可以通过二向色镜,并由光束分裂器468反射至检测路径中。
在成像步骤1610中,部分未被反射的发射光束通过光束分裂器到达图像传感器上,例如硅检测器462(图7B)。
在平行的步骤1610中,被反射的光束部分被过滤至光束过滤步骤1612中的检测路径中,从而仅允许高于激发波长的波长通过滤光片。
在聚焦步骤1614中,由步骤1612得到的过滤的光束聚焦在针孔或狭缝上,从而选择待分析的读取区域。
此后,在分散步骤1616中,分散的针孔或狭缝被分散并成像在多元件电光检测器(图6,6034)上。
图17A-17B为根据本发明的实施方案,绘制的用户界面的使用步骤的示意图。
在供入动力时,第一屏幕1702显示出通知用户的信息:系统正在实施自检,以及倒计时指示器1703。一旦自检完成,检验选择屏幕1704出现。用户触摸对应于待实施检验的按钮。下一屏幕1706用于进入患者识别。这可以通过触摸触控板1709的数字或通过扫描条形码来进行。一旦进入完成,用户触摸向前按钮1707,并且要求用户插入盒1708的屏幕出现。一旦用户插入盒,所述的系统便检查以确保通过其条形码标签识别的盒对应于所选的检验,并开始所述的处理。在实施处理的同时,显示屏幕1710,其示出了处理的进程和剩余的时间。一旦预分析和分析处理完成,结果便显示在屏幕1712上,以及所述的结果位于可能结果1713范围内某处的指示。在用户触摸“进入下一屏幕指示器”1711后,指导用于移动盒1714的屏幕出现。用户具有使用另一样品重复该检验的选择(通过按压重复图标175或者在屏幕1716上显示最近的结果)。
现在参照图18,其为根据本发明的实施方案,图1A系统101的一次性盒1850用于快速测定医学状况的方法的简化图。
当实施一次性盒1850的方法时,体液(例如但不限于血液,尿,血清或血浆)由供者转移至盒1851中。所述的一次性盒的方法包括实施分析和诊断1852,1854,1856和1858的多个步骤。在步骤1852中,体液吸入步骤由患者(或动物)直接或间接接收体液,并将体液转移至贮液器。
所述的一次性盒1850使用流体运输手段从而使流体移动,例如但不限于空气压力、液体压力、机械手段和它们的组合。体液吸入部分1852适用于将预定量的体液(体液样品1851)传输至预分析样品处理部分1854。
在预分析样品处理部分1854中,在体液上实施至少一个预备步骤,例如但不限于:
i)与至少一种抗体温育;
j)与至少一种抗原温育;
k)体液中至少一种类型的细胞的染色;
l)体液的至少一种类型的细胞的酶溶解;
m)体液的至少一种类型的细胞的渗透溶解;
n)加热或冷却体液的至少一部分;
o)将参照材料加入体液中;以及
p)与体积流体的至少一种元素发生化学反应。
然后,将体液的预处理样品由预分析样品处理部分1854转移至样品激发/相互作用的区域或部分1856。用于激发/相互作用1856的这种预处理样品的转移可以以连续的或分批的模式实施。
样品激发/相互作用1856的部件将样品定位,从而位于激发照明的光路上。激发照明使辐射(例如可见光范围内或范围外的相干或非相干辐射)通过,而进入至预处理样品中。由预处理样品所得的发射或多个发射被检测1834,并处理1836,从而产生总结所述的分析和诊断的报告1812。
多谱线发射检测1834接收到在多个光谱带中预处理样品的发射。在一些情况下,这些谱带为非重叠的谱带。多谱带发射检测1834适用于使代表该谱带的数据通过至多光谱荧光信号处理1836。
多谱带荧光信号处理1836可以包含2个或多个子元件(未示出),包括:
a)光子计数分析;
b)其他检测分析元件(未示出),其用于测量多谱带发射检测1834的其他光学输出。
所述的方法进一步包含用过样品的一次性方法1858,其用于接收由样品激发/相互作用处理得到的样品。
所述的方法进一步包含:计算机程序1810,该计算机程序适用于接收与多个光谱不同的信号有关的数据;以及处理器,其适用于处理所述的数据,并输出至少一个与所述的医学状况有关的输出。所提供的一种类型的输出为可视输出,其被输出至计算机的屏幕1812上。
图19A为根据本发明的实施方案,用于区分不同颗粒的方法600的简化流程图。
用于处理的输入为一种时间数列,其得自8通道光电倍增管阵列601中的每个通道。此外,引入由多个散射通道609得到的数据。可以单独地使用各个光谱相关算法606和分散算法607处理各荧光时间数列和分散时间数列,从而使其平滑并减少噪声。2种可行的处理方法为矩形波串求平均算法602和匹配滤波算法604。此外,各通道组可以是相关的,从而产生多光谱相关606。这些衍生的时间数列的一种或多种可以用于测定事件的位置。
一旦事件位于8通道时间数列中,便使用最小均方误差拟合610来测定事件的组成(就已知的荧光团特征而言)。现在根据已知的fluor的组成来描述所述的事件。如此描述的各事件与由8个时间数列(用于该事件及其描述612)得到的数据一起储存在事件储存器中,即记忆。基于数据储存器中各事件的fluor组成,可以测定颗粒的类型。例如嗜中性粒细胞616可表征为附着在CD64抗体(图5中示为W1)上的单一fluor。因此,主要表征为附着在CD64抗体上的单一fluor的事件识别为嗜中性粒细胞。
相似地,单核细胞618可表征为fluor W1和W2,这样具有这些fluor特征的事件识别为单核细胞。相似地,珠620可表征为具有fluor W1和W3的事件。淋巴细胞622不表达明显的荧光,但是可通过它们的散射作为识别事件。与荧光团的任何已知的组合都不匹配的事件识别为排斥626。
鉴于识别事件的群体,测定嗜中性粒细胞群体的中值强度和珠群体的中值强度。嗜中性粒细胞中值与珠中值的比值为所需的Leuko64指数。阳性对照值测定为与单核细胞结合的CD64荧光团的中值强度除以珠群体上相同荧光团的中值强度。阴性对照值测定为与淋巴细胞结合的CD64荧光团的中值强度。这些在实施Leuko64步骤中是重要步骤。
图19B为根据本发明的实施方案,用于生物监测1900的算法的流程图。
图19B示意性示出CD4/CD8检验是通过测定事件储存器1912中各事件的颗粒类型来实施。完成该颗粒选择的一种方法是使用K均值聚类基于图25中所示的特征Alexa 488,PE 488N和PEAF 488N来测定事件储存器中的数据聚类。基于这3个特征,由于藻红蛋白(PE)fluor会附着在CD4抗体上,所以PE 488N为大值的事件分类为CD4阳性淋巴细胞1938。由于Alexa 488fluor会附着在CD8抗体上,所以Alexa 488为大值的事件分类为CD8阳性淋巴细胞1940。由于PEAF 488N fluor会附着在CD3抗体(其由淋巴细胞表达以排除其他WBC)上,所以PEAF 488N为大值的事件分类为淋巴细胞。组1942具有大值的PEAF 488N,但具有小值的PE 488N和Alexa 488,这相当于不表达CD4或CD8的淋巴细胞。最后,对于不表达CD3的那些事件而言,非淋巴细胞WBC 1936可以通过泛WBC抗体来测定,并排斥不表达泛WBC抗体的那些事件。
图20A-20B显示根据本发明的实施方案,带宽层次化及平滑的阵列。
图20A和20B显示所述的系统对具有F488特征的荧光珠产生的典型应答。由500nm至700nm中,在25nm的带宽下,应答分别为2010,2020,2030,2040,2050,2060,2070和2080。所述的踪迹代表由8通道荧光检测得到的输出,或者具有噪声,其表征为踪迹的中值被减除。高于背景水平的大信号为通过长度为10的矩形波串平均值平滑的原始信号。F488特征的峰值发生在525nm至549nm的范围内,为2020。下一最高值发生在500nm至524nm的范围内,为2010,在每个25nm带宽下振幅降低,为2030,2040,2050,2060,2070和2080。
图21A-21B为根据本发明的实施方案,用于解答观察信号的fluor分解的示意图。
图21A为就信号值矢量或多个矢量b(相当于所观察的8通道发射值x)而言,用于解答矩阵方程Ax=b的Matlab函数。Matlab中的\函数用于使用Matlab表达x=A\b来解答x。
图21B为fluor特征的表,该fluor特征用作图21A中所述的矩阵A。
图22A-22B为根据本发明的实施方案,使用具有MESF检测与具有FACS检测的FITC珠的系统性能的比较图。
图22A显示本发明的线性与Becton Dickinson FACS流式细胞仪的线性的比较。FITC MESF珠的表列中值示于表2210中的列2211中。FACS流式细胞仪的中值荧光强度水平(在任意的单元中)示于列2212中,而本发明的中值荧光强度水平示于列2213中。列2214显示其中值为本发明的基础的事件的数量。本发明的值的完整范围的线形图示于2220中,而FACS流式细胞仪的显示图示于2230中。此外,这些附图的每幅图都显示出沿着相关值的平方R2的所有点的最佳拟合线。这些图的比较显示本发明与FACS流式细胞仪的性能相当。
图22B显示本发明2240的线性与FACS流式细胞仪2250的线性在局限于最初的4个最小数据点范围内的比较。再次证明了相当的性能。
图23A-23B显示根据本发明的实施方案,使用Alexa 488 MESF的系统性能的线性图示。
图23A和23B显示当所述的系统在增加快速2310和流速2330下运行时,对于Alexa Fluor 488 MESF珠系列,本发明的线性性能。在这种情况下,性能的量度为对事件的长度归一化的F488特征。这种归一化的特征命名为F488N。表格名单2320和2340概括了用于回归线拟合的统计。
图24为根据本发明的实施方案,显示光学输出在CD4-CD8检验的时间范围内的三维图。
图24为显示对于30秒的时间间隔,在各检测器中事件发射的相对振幅的表面图。由左至右运行的规格2440为在10μs间隔中。由右至左运行的规格2450并由1至8编号为检测器元件。8对应于波段1,对应于波段2,最后,1对应于波段8。在图25中2510中显示的、藻红蛋白标记的CD4事件的实例为踪迹2430。在图25中2520中显示的、Alexa Fluor 488标记的CD8事件的实例为踪迹2410。最后,在图25中在组2530中显示的、仅由Alexa Fluor 610标记的非CD4非CD8淋巴细胞的实例为踪迹2420。
图25为根据本发明的实施方案,显示CD4-CD8检验的聚类分析的图示。
图25为显示对特征Alexa 488N,PE488N和PEAF488N应用K均值聚类的结果的散点矩阵。各聚类2510,2520和2530的含义在图19B的说明中描述。
图26-27为根据本发明的实施方案,显示图19A的聚类分析的聚类分离性的图示。
图26为显示实施CD64检验所需的嗜中性粒细胞、单核细胞、淋巴细胞和参照珠群体的4色分离的散点图。最左侧的一列2710显示完全的4色分离。顶部的框2720显示基于波段2(Alexa488),NE和LY与MO和BEADS分离;以及基于波段4(PE),MO与BEADS分离。
中间框2730显示基于波段6(A610),LY与NE分离。
底部框2740显示基于波段8(Starfire Red),珠与细胞分离。
由于所述的分离是基于单独的狭窄波段(非特征),所以45度聚类2750,2760,2770显示在2个波段中存在放射,在各情况下,其均如所预计的可以由下表中的放射特征可见的那样。
图28为根据本发明的实施方案,不同阵列选择的比较表。
图28为由Hamamatsu Corporation制作的光电倍增管阵列的表列名单。H95308通道阵列为在当前现有发明的实施中使用的一种。本领域的任一技术人员应该理解的是可以通过使用16或32通道阵列产物来取得更高的分辨率或更高程度的光谱取样。
图29A为根据本发明的实施方案,用于由散点图选择数据组的算法2900的特定实施流程图。
图29A中的算法为在图29B中用于选择各组3010,3020,3030和3040(图30)并测定各组中特定参数值的一般算法2950的特定实施方法。
在第一排序特征步骤1304中,使用Star Fire Red(SFR)特征将波段和特征值1302的完整数据库排序(由最小的SFR特征值最大SFR特征)。
在第二步骤1320中,如图14A中所示,用于选择组1210的SFR特征值的柱状图分析。在图31A中的柱状图1400中,在组1402的上端为小组1404。下一步骤为由所有的数据库中除去该组,如图29A步骤1322中所示。除去的组为珠数据库1324。
然后,按照如下方式操作波段和特征值的数据库,其中珠的数据库被除去1340。在排序步骤1342中,根据其PE(藻红蛋白)特征,由最小值最大PE(藻红蛋白)特征来组织数据。
在分析PE柱状图建立步骤1344中,操作所述的数据,从而找到与单核细胞相应的组。
在提取单核细胞数据库步骤1346中,提取波段和特征值1348的单核细胞数据库。然后按照如下方式进一步处理波段和特征值的数据库(其中珠和单核细胞被除去1360)。根据PEAF特征排序步骤1362,根据PEAF(全名为488)(参见上文中的珠和PE)特征以一定的顺序来组织集合1360。
在分析PEAF柱状图以找到与淋巴细胞步骤1364相应的组中,分析集合1360以测定任何数据是否具有与淋巴细胞相应的行为。
在提取步骤1366中,由集合1360提取波段和特征值1368的淋巴细胞数据库,并且剩余的数据库为波段和特征值的数据库,其中珠、单核细胞和淋巴细胞被除去1380。
在二极管1特征步骤1382的顺序中,根据二极管1特征来分析数据库1380(参见上文)。然后,在分析步骤1384中分析数据库1380,从而找到具有嗜中性粒细胞性质的数据组。
在提取步骤1386中,具有非嗜中性粒细胞1388的性质的数据组被除去。在计算步骤1392中使用剩余的组1392(假设为嗜中性粒细胞),从而由组的参数来计算所需的度量。
现在参照图29B,其为根据本发明的实施方案,用于由散点图选择数据组的算法1350的一般实施流程图。
在第一排序特征步骤1305中,使用第一特征来排序波段和特征值1303的数据库。
在第二步骤1321中,如图31A中用于选择组3010所示例那样,用于找到与第一特征1325相应的组的第一特征值的柱状图分析。在图31A中的柱状图1400中,在组1402的上端为小组1404。应该注意这只是选择所述的组的一种方式,并且可以使用其他的方法(组合使用了其他的数据集合的值)。下一不做是由所有的数据库中除去该组,如图31B的步骤1323所示。除去组为第一特征数据库1325。
然后,按照如下方式操作波段和特征值的数据库,其中第一数据库被除去1341。在排序步骤1343中,根据其第二特征来组织所述的数据。
在分析第二特征柱状图集合步骤1345中,操作所述的数据,从而找到与第二特征相应的组。
在提取第二特征数据库步骤1347中,提取波段和特征值1349的第二特征数据库。然后,按照如下方式进一步处理波段和特征值的数据库,其中第一和第二特征组被除去1361。根据第i特征排序步骤1363,集合1361根据其第i特征以一定的顺序组织。
在分析第i柱状图以找到与第i特征步骤1365相应的组中,分析集合1361以测定任何数据是否具有与第i特征相应的行为。
在第i特征提取步骤1367中,由集合1381提取波段和特征值1369的第i特征数据库,并且剩余的数据库为第一、第二和第i特征组被除去1381的波段和特征值的数据库。
在通过第N特征步骤1383的顺序中,根据第N特征分析数据库1381。然后,在分析步骤1385中分析数据库1381,从而找到具有性质的数据组,其中所述的性质不具有第N特征性质。
在提取步骤1387中,除去具有非第N特征1397的性质的数据组。在计算步骤1393中使用剩余的组1395(假设为第N组),从而由所述的组的参数来计算所需的度量。
图31A为根据本发明的实施方案,Starfire Red(SFR)特征值的数据的柱状图31400。
图31B显示根据本发明的实施方案,图31A所示的柱状图3100的多项式3152、其一阶导数3156和二阶导数3158的图3150。
参见图31B,用于测定图31A中上方组3104的方法。充分度(sufficient degree)的多项式3152与图14B所示的柱状图数据3154(如图31A中所示,集合3104)拟合。计算该多项式的一阶导数3156和二阶导数3158。一阶导数的多个零3160通过方形块沿着零线来表示。其中多项式为最大并具有零阶倒数3162的点通过方形块表示,其中具有X。柱状图中的该点对应于大组3102的峰(图31A)。多项式的倒数的下一零3164对应于柱状图中大组的末端。柱状图中高于该值的所有的点都在小组中。由于所述的数据库已经基于SFR488的值由最小至最大排序,并且柱状图水平轴也由SFR488的最小值至最大值排序,所以大组结束的点为SFR488值,SFR488排序的数据库中高于上述值的记录将被除去,并且如图31A中所示,识别为波段和特征值的珠数据库3104。
图32A为根据本发明的实施方案,PE488特征值的数据的柱状图3200。
图32B显示根据本发明的实施方案,与图32A中的柱状图拟合的多项式,以及相应的一阶导数3256和二阶导数3258。
现在,使用PE488特征,将数据库中剩余的记录由最小至最大再次排序。PE488特征值3202的柱状图3200示于图32A中。此外,在这种情况下,在大组3202的右侧具有小组3204,其中所述的大组与所需的单核细胞群体对于。图32B显示与图32A中柱状图3200的数据3254拟合的多项式3252,以及相应的一阶导数和二阶导数。如之前所述,上方组3204是按照与SFR488柱状图的上方组相同的方式测定的。应该注意,尽管在这2种情况中仅分析并使用一维柱状图作为用于选择所需的群体的基础,但是可以使用由数据库中的各记录得到的多个字段(field)来实施组的选择。
如图31A所示,单核细胞组3204由所述的数据库中除去,其中所述的数据库主要包含淋巴细胞,嗜中性粒细胞和其他颗粒,例如未溶解的红细胞和其他碎片。
图33A为根据本发明的实施方案,PEAF488特征值的数据3302的柱状图3300。
图33B显示根据本发明的实施方案,与由图33A得到的柱状图数据3354拟合的多项式3352,以及相应的一阶导数3356和二阶导数3358。
现在,使用与淋巴细胞相应的PEAF488特征,将数据库中的记录再次排序记录。PEAF488特征的柱状图3300示于图33A中,并且与其一阶导数和二阶导数拟合的相应的多项式示于图33B中。在这种情况下,上文概括的过程还适用于识别和由大组3302中去除柱状图上方末端出现的小组3304。现在,如图29A所示去除淋巴细胞组,从而得到数据库1380,其现在主要包含嗜中性粒细胞,以及其他的颗粒,例如未溶解的红细胞和其他碎片。
尽管使用具有F488特征的荧光团标记嗜中性粒细胞1391,但是由于溶液中未结合的荧光团,所以其他颗粒表现为表达这种特征。但是,其他颗粒比嗜中性粒细胞小,该嗜中性粒细胞现在包含通过二极管1(前向散射检测器)通道测量的最大前向散射的组。二极管1通道的柱状图示于图34A中。
图34A为根据本发明的实施方案,二极管1通道特征值的数据的柱状图1700。
图34B显示根据本发明的实施方案,与由图34A中的柱状图得到的数据1754拟合的多项式1752,以及相应的一阶导数1756和二阶导数1758。
如上文所述,选择对应于较大的颗粒的上方组1704(图34A),其为嗜中性粒细胞。这完成了将原始数据库1302分解成图29A中所示的4个不同的事件组(1324,1348,1368,1391)。
在各组中,各参数可以由数据库中的字段(field)来计算。实例示于下表中。
观察一列包含组的名称。NAM一列为组中事件的数量。MEDUG一列为该组特征的中值。例如,在SFR488一排中,SFR488特征中值为978.72。MEDF488一列包含特定组的F488特征的中值。MED波段2一列包含组中波段2值的中值。MED波段2N一列包含组中波段2N值的中值。INDEX488一列包含该组的MEDF488值与SFR488组的值的比值。相似地,INDEX波段2和INDEX波段2N为该组的波段2和波段2N的中值与SFR488组的中值的比值。
尽管已经说明对应于白细胞亚型的特定的组以及基于这些组来计算特定指数的特定算法,但是本领域的任一技术人员无论何时需要由数据库选择组并计算数值(基于与图29B总图中所示的这些组有关的参数),都可以使用这种基本的方法。
可以根据一些实施方案来使用其他合适的操作或一组操作。一些操作或一组操作可以例如基本连续地重复预定的重复数量,或者直至一种或多种状况得到满足。在一些实施方案中,一些操作可以平行、按顺序或以其他合适的执行顺序实施。
本文中使用诸如“处理”、“计算机计算”、“计算”、“测定”、“建立”、“分析”、“检查”之类的数据所进行的讨论可以指计算机、计算平台、计算系统或其他电子计算装置的操作(多次)和/或处理(多次),其将在计算机的寄存器和/或存储器内以物理(例如电子)量描绘的数据操作和/或转换成在计算机寄存器和/或存储器或其他信息储存介质(可以储存指令从而实施操作和/或处理)内以物理量类似描绘的其他数据。
一些实施方案可以采用完全硬件实施方案,完全软件实施方案或包括硬件和软件元件的实施方案的形式。一些实施方案可以在软件中实施,其包括但不限于固件,常驻软件,微代码等。
一些实施方案可以使用客户/服务器结构,出版者/订阅者结构,完全集中的结构,部分集中的结构,完全分布的结构,部分分布的结构,可升级的对等计算(P2P)结构,其他合适的结构,或它们的组合。
一些实施方案可以采用可得自计算机可用或计算机可读介质(其提供了计算机或任何指令执行系统使用的或与它们关联的程序代码)的计算机程序产品的形式。例如计算机可用或计算机可读介质可以为或可以包括任何装置,其可以包含储存、通讯、传播或传输指令执行系统、仪器或装置使用的或与它们关联的程序。
在一些实施方案中,所述的介质可以为或者可以包括电子、磁性、光学、电磁、红外(IR)、半导体系统(或者仪器或装置)或者传播介质。计算机可读介质的一些证明实例包括半导体或固体存储器、磁带、可移动的计算机磁盘、随机存取存储器(RAM)、只读内存(ROM)、硬磁盘、光盘等。光盘的一些证明实例包括光盘只读存储器(CD-ROM)、可读写式光盘(CD-R/W)DVD等。
在一些实施方案中,适用于储存和/或执行程序代码的数据处理系统可以包括例如通过系统总线与存储元件直接或间接偶联的至少一种处理器。存储元件可以包括例如在程序代码实际执行过程中使用的局部存储器、大规模存储和CPU缓存,其可以提供至少一些程序代码的暂时储存,以便减少在执行过程中必须由大规模存储恢复的代码的次数。
在一些实施方案中,输入/输出或者I/O装置(包括但不限于键盘、显示器、标准鼠标等)可以与系统直接偶联,或者通过干涉I/O控制器偶联。在一些实施方案中,网络适配器可以与所述的系统偶联,从而使数据处理系统能够通过例如干涉私人或公共网络而与其他数据处理系统或远程打印机或存储装置偶联。在一些实施方案中,调制解调器、电缆调制解调器和以太网卡为多种网络适配器的证明实例。可以使用其他合适的构件。
一些实施方案可以通过软件、硬件或者软件和/或硬件的任何组合来实施,它们可以适用于特定的应用或者根据特定的设计要求。一些实施方案可以包括单元和/或亚单元,其可以完全或部分地彼此分离或结合在一起,并且可以使用特定的多用途或通用处理器或控制器来实施。一些实施方案可以包括缓冲器、寄存器、栈、存储单元和/或存储器单元,以用于暂时或长期存储数据或者促进具体实施的操作。
例如可以使用机器可读介质或制品来实施一些实施方案,其中所述的介质或制品可以存储指令或一组指令,如果这些指令被机器执行,则可以使该机器实施本文所述的方法和/或操作。此类机器可以包括例如任何合适的处理平台,计算平台,计算装置,处理装置,电子装置,电子系统,计算系统,处理系统,计算机,处理器等,并且可以使用硬件和/或软件的任何合适的组合来实施。机器可读介质或制品可以包括例如储存单元,储存装置,储存制品,储存介质,存储装置,存储制品,存储介质和/或存储单元的任何合适的类型,例如存储器,可移动或不可移动的介质,可擦除或不可擦除介质,可写入或可擦写介质,数字或类似的介质,硬盘驱动器,软盘,光盘只读存储器(CD-ROM),可读光盘(CD-R),可擦写光盘(CD-RW),光盘,磁性介质,多种类型的数字多功能光盘(DVD),磁带(tape),磁带(cassette)等。指令可以包括任何合适类型的代码,例如源代码,编译代码,编译码,执行码,静态码,动态码等,并且可以使用任何合适的高水平,低水平,面向对象的,可视化,编辑的和/或编译的程序语言(例如C,C++,Java,BASIC,Pascal,Fortran,Cobol,汇编语言,机器代码等)来实施。
参照一个或多个实施方案、本文所述的功能、操作、构件和/或特征可以与参照一个或多个其他的实施方案、本文所述的一种或多种其他的功能、操作、构件和/或特征结合,或者可以组合使用,反之亦然。
可以使用一种或多种计算机可用或计算机可读介质(多种)的任何组合。计算机可用或计算机可读介质可以为例如但不限于电子、磁性、光学、电磁、红外线、半导体系统、仪器、装置或传播介质。计算机可读介质的更多的具体实例(非穷举的列出)包括以下这些:具有一条或多条电线的电连接,便携式计算机软盘,硬盘,随机存取存储器(RAM),只读存储器(ROM),可擦可编程序只读存储器(EPROM或闪存),光纤,便携式光盘只读存储器(CDROM),光存储装置,传播介质(例如支持互联网或内联网的那些)或者磁存储装置。注意所述的计算机可用或计算机可读介质甚至为其上印有程序的纸或另一种合适的介质,其中所述的程序可以通过例如光扫描纸或其他介质而被电子捕获,然后编辑、汇编或以合适的方式(如果需要)进行其他的处理,然后储存在计算机存储器中。在本文件的内容中,计算机可用或计算机可读介质可以为任何介质,其可以包含储存、通讯、传播或传输指令执行系统、仪器或装置使用的或与它们关联的程序。计算机可用介质可以包括传播数据信号,其中以基带或部分载波的形式收录了计算机可用的程序代码。计算机可用程序代码可以使用任何合适的介质传播,包括但不限于无线、有线、光纤电缆、RF等。
用于实施本发明的操作的计算机程序代码可以用一种或多种编程语言的任何组合来编写,包括面向对象的编程语言,例如Java,Smalltalk,C++等;以及传统的程序设计语言,例如“C”编程语言或类似的编程语言。程序代码可以完全在用户计算机上执行,部分在用户计算机上执行,作为独立软件包,部分在用户计算机上并且部分在远程计算机上,或者完全在远程计算机或服务器上。在后面的方案中,远程计算机可以通过任何类型的网络与用户的计算机连接,包括局域网(LAN)或广域网络(WAN),或者可以与外部计算机连接(例如使用因特网服务提供者通过互联网)。
本文中根据本发明的实施方案,参照方法、仪器(系统)和计算机程序产品的流程图和/或框图描述了本发明。应该理解的是,可以通过计算机程序指令来实施流程图和/或框图中的各框中的操作以及流程图和/或框图中的多个框中的操作的组合。这些计算机程序指令可以提供给通用计算机、专业计算机或其他可编程的数据处理仪器的处理器,从而制造机器,这样通过计算机或其他可编程数据处理装置的处理器执行的指令创建了用于在流程图和/或框图的一个或多个框中所指定的功能/行动的手段。
此外,这些计算机程序指令还可以储存在可以指导计算机或其他可编程数据处理装置仪特定的方式发挥功能的计算机可读介质中,这样储存在计算机可读介质中的指令产生了制造制品,包括实施在流程图和/或框图的一个或多个框中所指定的功能/行动的指令手段。
此外,计算机程序指令还可以下载至计算机或其他可编程数据处理仪器中,从而产生在计算机或其他可编程仪器上实施的一系列操作步骤,由此产生计算机实施的过程,这样在计算机或其他可编程仪器上执行的指令提供了用于实施在流程图和/或框图的一个或多个框中所指定的功能/行动的过程。
附图中的流程图和框图示出了根据本发明的多个实施方案的系统、方法和计算机程序产品的结构、功能和可行实施的操作。就此而言,流程图或框图中的各框中的操作可以代表代码的模块、节段或部分,其包括用于实施指定逻辑功能(多个)的一个或多个可执行指令。此外,还应该注意在一些备选的实施中,框中注释的功能可以以并非按照附图中注释的顺序发生。例如连续示出的2个框实际上可以大体上同时执行,或者多个框有时可以以倒序来执行,这取决于所涉及的功能。此外,还应该注意框图和/或流程图的各框中的操作以及框图和/或流程图中的框中操作的组合可以通过特殊用途的硬件基系统来实施,其中所述的系统执行了指定的功能或行动,或者特殊用途的硬件和计算机指令的组合。
尽管上文所述的实施方案主要解决了随后在合适的处理器上执行的软件代码测试范围的评估,但是本文所述的方法和系统还可以用于评估固件代码的测试范围。固件胆码可以以任何合适的语言书写,例如C语言。在本发明的内容和权利要求中,此类代码还可以作为一种软件代码。
本发明的盒可以构造和配置,使得处理组合物包含附着在表面(例如珠)上的蛋白质。蛋白质附着于其表面上的多个珠或者其他结构元件可以通过以下任意一种或多种方法来实施的:
●简单附着,例如通过静电或疏水相互作用吸附在表面上,诱捕至固定化聚合物中等;
●非共价或物理附着;
●所述的蛋白质与珠表面共价结合;
●生物识别(例如生物素/链霉亲和素);
●需要2个步骤:第一层是通过硅烷化学形成的,使得表面呈现反应性基团(例如环氧基,氨基,巯基等),以及第二层(例如待固定的蛋白质或连接体分子)通过固定化的反应性基团而共价附着;
●与装置内表面上的官能化聚合物涂层共价附着,或者与金表面上的自组装单层(SAM)的游离末端连接。
反应类型可以包括抗原-抗体结合、夹心(例如抗体-抗体-抗体)、物理诱捕、受体-配体、酶-底物、蛋白质-蛋白质、适体、共价结合或生物识别中的任意一种或多种。
表2显示本发明的仪器100和方法的一些代表性应用。
表2.本发明的仪器和方法的一些生物应用
应该理解的是所述的方法的每一步骤都可以采取预定的时间段来实施,并且在这些步骤之间可以为温育和/或等待步骤,为了简化,图中未示出。
根据一些实施方案,样本或样品的体积为低于200μL,低于100μL,低于50μL,低于25μL或低于11μL。
通常,样品的总体积为10至1000μL,100至900μL,200至800μL,300至700μL,400至600μL,或者420至500μL。
根据一些实施方案,处理组合物室106,108,110(也称为泡)的体积为大约1μL至1000μL。根据其他的实施方案,样本的体积为大约10μL至200μL。根据其他的实施方案,样本的体积为大约1,10,20,30,40,50,60,70,80,90,100,120,140,160,180,200,250,300,350,400,450或500μL。
根据一些实施方案,处理组合物120,122,124的体积为最多大约500μL。根据其他的实施方案,样本的体积为最多大约200μL。根据其他的实施方案,样本的体积为最多大约500,450,400,350,300,250,200,180,160,140,120,100,90,80,70,60,50,40,30,20,10或1μL。
根据一些实施方案,反应物的体积为至少大约1μL。根据其他的实施方案是,样本的体积为大约10μL。根据其他的实施方案,样本的体积为至少大约1,10,20,30,40,50,60,70,80,90,100,120,140,160,180,200,250,300,350,400,450或500μL。
多种处理组合物的转移顺序对于反应顺序而言是重要的,并且通常是预定的。
读取区1450(图14M-N)可以配置并构造用于一个或多个评价步骤。这些可以包括以下步骤的任意一种或它们的组合:
a)其中通过的辐射的转移;
b)随即发生冲击辐射;
c)检测反射、折射和/或透射的辐射;
d)检测发射的辐射;
e)捕获其一个或多个图像;
f)对捕获的图像实施图像分析;
g)测量处理样本的电学特征;
h)随即发生冲击声能;
i)检测其中的声能;以及
j)分析上述任意一个或多个步骤的输出。
根据一些实施方案,将所述的盒引入至Kasdan等人的国际专利申请公开No.WO2011/128893所述的系统中,该文献以引用方式并入本文。
根据一些实施方案,所述的仪器可以具有用于显示结果的机载手段,例如比色试纸(未示出)。此外或备选地,所述的结果在显示单元中显示,其与仪器100分开并远离。
血液样品通常为由患者最新移出的全血。全血主要包含红细胞(也称为RBC或红血球)、血小板和白血球(也称为白细胞)(包括淋巴细胞和嗜中性粒细胞)。嗜中性粒细胞(特别是活化的嗜中性粒细胞)的数量增加通常是在炎症(特别是由于细菌感染、环境暴露和一些癌症)开始(急性)阶段的血流中发现。
CD64(分化群64)为完整的膜糖蛋白类型,也称为Fc受体,其以高的亲和性与单体的IgG型抗体结合。与目前医学实践中使用的标准的诊断测试相比,嗜中性粒细胞CD64表达的定量提供了感染/脓毒病的改进的诊断检测。
CD163(分化群163)为CD163基因编码的人类蛋白质。此外,其已经显示标记了单核细胞/巨噬细胞系的细胞。
通常,样品总体积为10至1000μL,100至900μL,200至800μL,300至700μL,400至600μL,或者420至500μL。
根据一些实施方案,处理组合物室106,108,110(也称为泡)的体积为大约1μL至1000μL。根据其他的实施方案,样本的体积为大约10μL至200μL。根据其他的实施方案,样本的体积为大约1,10,20,30,40,50,60,70,80,90,100,120,140,160,180,200,250,300,350,400,450或500μL。
根据一些实施方案,处理组合物120,122,124的体积为最多大约500μL。根据其他的实施方案,样本的体积为最多大约200μL。根据其他的实施方案,样本的体积为最多大约500,450,400,350,300,250,200,180,160,140,120,100,90,80,70,60,50,40,30,20,10或1μL。
根据一些实施方案,反应物的体积为至少大约1μL。根据其他的实施方案是,样本的体积为大约10μL。根据其他的实施方案,样本的体积为至少大约1,10,20,30,40,50,60,70,80,90,100,120,140,160,180,200,250,300,350,400,450或500μL。
使用本发明的系统100完成检验所需的时间根据多种因素改编,其非限定性实例包括本发明所述的那些。在一些实施方案中,完成检验所需的时间为大约0.5至100分钟。在其他的实施方案中,完成检验所需的时间为大约1至20分钟。在其他的实施方案中,完成检验所需的时间为大约1至10分钟。在一些实例中,完成检验所需的时间为大约1,2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,50,60,80或100分钟。
实施例
实施例1
应用No.1–CD64感染与脓毒病
制备用于接收血液样品的盒110(图1)。该盒包含多个处理组合物室106,108,110,其适用于分别容纳相应数量的处理组合物120,122,124。这些组合物在US 8,116,984和Davis,BH等人(2006)中进一步详细的描述,该文献以引用方式并入本文。简言之,试剂A包含鼠科单克隆抗体(包含缓冲的生理盐水)、试剂B(10x浓缩的延龄草裂解液(包含氯化铵))和试剂C(使用Starfire Red和异硫氰酸荧光素(FITC)标记的5.2μm聚苯乙烯珠的悬液(包含0.1%叠氮化钠和0.01%Tween 20))的混合物。
表3.使用CD64和CD163抗体来检测脓毒病的本发明方法的步骤的时间顺序
在脓毒病的情况下,“归一化”是指取得靶向群体的荧光发射中值与参照珠群体荧光发射中值的比值。
根据一些实施方案,读取器可以包含光电子芯,其能够识别和检测荧光信号。此外,用户的读取器还可以表明结果相对于参照范围所落入的区域。
这些公开的内容在适用于教导其他的或备选的细节、特征和/或技术背景的条件下以引用方式并入本文。
应该理解的是本发明的应用不限于本文所包含的说明或附图所示的描述中列出的细节。本发明能够用于其他实施方案并且能够以多种方式实施和进行。本领域的那些技术人员可以容易地理解多种修改和改变在不脱离所附的权利要求书中和由该权利要求书定义的范围的条件下可以用于上文所述的本发明的实施方案中。
参考文献
Assicot,Marcel,et al."High serum procalcitonin concentrations in patients with sepsis and infection."The Lancet 341.8844(1993):515-518.
Aulesa,C.,et al."Validation of the Coulter LH 750in a hospital reference laboratory."Laboratory Hematology 9.1(2003):15-28.Hawkins,Robert C."Laboratory turnaround time."The Clinical Biochemist Reviews 28.4(2007):179.
Ault,Kenneth A."Flow cytometric measurement of platelet function and reticulated platelets."Annals of the New York Academy of Sciences 677.1(1993):293-308.
Blajchman,Morris A.,et al."Bacterial detection of platelets:current problems and possible resolutions."Transfusion medicine reviews 19.4(2005):259-272.
Bodensteiner,David C."A flow cytometric technique to accurately measure post‐filtration white blood cell counts."Transfusion 29.7(1989):651-653.
Cheson,Bruce D.,et al."National Cancer Institute-sponsored Working Group guidelines for chronic lymphocytic leukemia:revised guidelines for diagnosis and treatment."Blood 87.12(1996):4990-4997.
Christ-Crain,Mirjam,et al."Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections:cluster-randomised,single-blinded intervention trial."Lancet 363.9409(2004):600-607.
Cristofanilli,Massimo,et al."Circulating tumor cells,disease progression,and survival in metastatic breast cancer."New England Journal of Medicine 351.8(2004):781-791.
Davis,Bruce H.,et al."Neutrophil CD64is an improved indicator of infection or sepsis in emergency department patients."Archives of pathology&laboratory medicine 130.5(2006):654-661.
Dieye,Tandakha Ndiaye,et al."Absolute CD4 T-cell counting in resource-poor settings:direct volumetric measurements versus bead-based clinical flow cytometry instruments."JAIDS Journal of Acquired Immune Deficiency Syndromes 39.1(2005):32-37.
Divers,S.G.,et al."Quantitation of CD62,soluble CD62,and lysosome‐associated membrane proteins 1 and 2 for evaluation of the quality of stored platelet concentrates."Transfusion 35.4(2003):292-297.
Drexler,Hans G.,et al."Diagnostic value of immunological leukemia phenotyping."Acta haematologica 76.1(1986):1-8.
Dziegiel,Morten Hanefeld,Leif Kofoed Nielsen,and Adela Berkowicz."Detecting fetomaternal hemorrhage by flow cytometry."Current opinion in hematology 13.6(2006):490.
Fischer,Johannes C.,et al."Reducing costs in flow cytometric counting of residual white blood cells in blood products:utilization of a single platform bead free flow rate calibration method."Transfusion 51.7(2011):1431-1438.
Graff,Jochen,et al."Close relationship between the platelet activation marker CD62 and the granular release of platelet-derived growth factor."Journal of Pharmacology and Experimental Therapeutics 300.3(2002):952-957.
Guerti,K.,et al."Performance evaluation of the PENTRA 60C+automated hematology analyzer and comparison with the ADVIA 2120."International journal of laboratory hematology 31.2(2009):132-141.
Hershman,M.J.,et al."Monocyte HLA‐DR antigen expression characterizes clinical outcome in the trauma patient."British Journal of Surgery 77.2(2005):204-207.
Hilfrich,Ralf,and Jalil Hariri."Prognostic relevance of human papillomavirus L1 capsid protein detection within mild and moderate dysplastic lesions of the cervix uteri in combination with p16 biomarker."Analytical and Quantitative Cytology and Histology 30.2(2008):78-82.
Hillier,Sharon L.,et al."A case–control study of chorioamnionic infection and histologic chorioamnionitis in prematurity."New England Journal of Medicine 319.15(1988):972-978.
Hoffmann,Johannes JML."Neutrophil CD64 as a sepsis biomarker."Biochemia Medica 21.3(2011):282-290.
Kibe,Savitri,Kate Adams,and Gavin Barlow."Diagnostic and prognostic biomarkers of sepsis in critical care."Journal of Antimicrobial Chemotherapy 66.suppl 2(2011):ii33-ii40.
LaRosa,Steven P.,and Steven M.Opal."Biomarkers:the future."Critical care clinics 27.2(2011):407.
Liu,N.I.N.G.,A.H.Wu,and Shan S.Wong."Improved quantitative Apt test for detecting fetal hemoglobin in bloody stools of newborns."Clinical chemistry 39.11(1993):2326-2329.
Lotan,Yair,et al."Bladder cancer screening in a high risk asymptomatic population using a point of care urine based protein tumor marker."The Journal of urology 182.1(2009):52-58.
Masse,M.,et al."Validation of a simple method to count very low white cell concentrations in filtered red cells or platelets."Transfusion 32.6(2003):565-571.
Matic,Goran B.,et al."Whole blood analysis of reticulated platelets:improvements of detection and assay stability."Cytometry 34.5(1998):229-234.
McDonald,C.P.,et al."Use of a solid‐phase fluorescent cytometric technique for the detection of bacteria in platelet concentrates."Transfusion Medicine 15.3(2005):175-183.
Michelson,Alan D."Flow cytometry:a clinical test of platelet function."Open Access Articles(1996):290.
Miller,E.M.;Freire,S.L.S.;Wheeler,A.R."Proteomics in Microfluidic Devices"In Encyclopedia of Micro-and Nanofluidics;Li,D.Q.,Ed.;Springer:Heidelberg,Germany,2008;Vol.3,pp 1749-1758.."
Moro,Ricardo,et al."A new broad-spectrum cancer marker."Vitro Diagnostic Technology(2005).
Perry,Sara E.,et al."Is low monocyte HLA-DR expression helpful to predict outcome in severe sepsis?."Intensive care medicine 29.8(2003):1245-1252.
Ramakumar,Sanjay,et al."Comparison of screening methods in the detection of bladder cancer."The Journal of urology 161.2(1999):388-394.
Rawstron,Andy C.,et al."Quantitation of minimal disease levels in chronic lymphocytic leukemia using a sensitive flow cytometric assay improves the prediction of outcome and can be used to optimize therapy."Blood 98.1(2001):29-35.
Rodriguez,William R.,et al."Amicrochip CD4 counting method for HIV monitoring in resource-poor settings."PLoS medicine 2.7(2005):e182.
Rylatt,D.B.,et al."An immunoassay for human D dimer using monoclonal antibodies."Thrombosis research 31.6(1983):767-778.
Sacks,David B.,et al."Guidelines and recommendations for laboratory analysis in the diagnosis and management of diabetes mellitus."Clinical Chemistry 48.3(2002):436-472.
Segal,H.C.,et al."Accuracy of platelet counting haematology analysers in severe thrombocytopenia and potential impact on platelet transfusion."British Journal of Haematology 128.4(2005):520-525.
Stein,Paul D.,et al."D-dimer for the exclusion of acute venous thrombosis and pulmonary embolism:a systematic review."Annals of internal medicine 140.8(2004):589.
Sutherland,D.Robert,et al."The ISHAGE guidelines for CD34+cell determination by flow cytometry."Journal of hematotherapy 5.3(1996):213-226.
Wang,Chao,et al."Reticulated platelets predict platelet count recovery following chemotherapy."Transfusion 42.3(2002):368-374.
- 还没有人留言评论。精彩留言会获得点赞!