川崎氏症的诊断与治疗的制作方法
本发明主张于2014年7月24日申请的美国临时申请案第62/028,633号的优先权,该发明的内容以全文引用的方式并入本文中。
【现有技术】
川崎氏症(KD)(一种于较小儿童中观测到的多系统炎症)可导致急性血管炎,最为显著影响冠状动脉。在没有治疗的情况下,大约20至25%的罹患KD的儿童发展成冠状动脉畸形(CAA)。静脉注射用免疫球蛋白(IVIG)治疗可将CAA的发病率减低至约5%,然而早期检测是必要的。
KD诊断是困难的,尤其于早期阶段。目前,KD诊断是基于临床症状,包括发烧持续≥5天、两侧结膜充血无渗出物、多形性疹、唇及口变化(唇红斑及皲裂、草莓舌、和口咽黏膜扩散性充血)、四肢变化(手足红斑及水肿)、以及颈部淋巴结病变(直径≥1.5cm)。然而,KD与其他病状间的临床特征及实验室参数的重叠使诊断难以确定,及尚无特定实验室试验。
因此,经由实验室分析鉴别特异性生物标记以促进KD诊断对于预防严重KD后遗症,尤其是CAA具有价值。
技术实现要素:
本文所述的是一种诊断个体的川崎氏症的方法。该方法包括检测来自疑似罹患川崎氏症的个体的样品中的生物标记量,该生物标记是IL-7F、sCD40L、MPIF-1、E-选择素、IP-10、或IL-33;及将该量与截止量进行比较;其中若该量高于或低于该截止量,则该个体确定为罹患川崎氏症。于一实施例中,该生物标记是IP-10并且若该量高于该截止量,则该个体确定为罹患川崎氏症。该样品可在自该个体开始发烧的0至10天(例如,5天)内自该个体获得。
此外,本文描述一种治疗个体的川崎氏症的方法。该方法包括检测来自疑似罹患川崎氏症的个体的第一样品中的生物标记第一量,该生物标记是IL-7F、sCD40L、MPIF-1、E-选择素、IP-10、或IL-33,其中该第一量高于或低于截止量;及向该个体施用针对川崎氏症的治疗。于一实施例中,该生物标记是IP-10并且该第一量高于该截止量。该治疗是静脉注射用免疫球蛋白(IVIG)或IVIG及类固醇。第一样品可自该个体开始发烧的0至10天(例如,5天)内自该个体获得。该方法可进一步包括在施用该治疗之后自该个体获得第二样品;检测于该第二样品中的生物标记量;并且若于该第二样品中的量高于该截止量,则继续该治疗或施用不同治疗。
本文中亦揭示一种监测个体的川崎氏症的治疗的方法。该方法包括检测于该治疗之前或期间第一时间点时自该个体获得的第一样品中的生物标记第一量,该生物标记是IL-7F、sCD40L、MPIF-1、E-选择素、IP-10、或IL-33;检测在第二时间点时自该个体获得的第二样品中的生物标记第二量;将该第一量及与第二量进行比较;并且基于该比较制定治疗决策。该生物标记可以是IP-10并且该治疗是静脉注射用免疫球蛋白(IVIG)。
于任一以上方法中,该样品可以是体液样品(例如,血液、血清、血浆、脑脊髓液、尿液、或唾液样品)。免疫测定法可用于检测该样品中的生物标记量。例如,该免疫测定法可以是ELISA、蛋白质阵列、流式细胞计数法、建立于磁珠上的多重免疫测定、蛋白质印迹、点印迹、或酶联免疫斑点法(ELISPOT)。IP-10的1,318pg/mL的截止血浆量可用于任一以上方法中。于一实施例中,该患者群体是汉族。
本文亦描述一种用于诊断个体的川崎氏症或监测个体的川崎氏症的治疗的试剂盒。该试剂盒可包括用于检测生物标记量的试剂(例如,抗体)或装置(例如,试验条、固态载体、芯片或盘)。该生物标记可以是IL-7F、sCD40L、MPIF-1、E-选择素、IP-10或IL-33。
一或多个实施例的细节于下列描述中进行阐述。
【附图简单说明】
图1是一组显示于川崎氏症(KD)的急性阶段期间蛋白质量的图。于非KD发烧对照(n=20)及KD患者(n=37)中使用Bio-Plex系统测量血浆细胞因子量。发烧对照(n=20)及KD病例(n=37)中的自蛋白质阵列鉴定的血浆E-选择素、MPIF-1、及IP-10的量是经由酶联免疫吸附测定法来确定。IL-17F、IL-33、sCD40L、E-选择素、MPIF-1、及IP-10的p值分别为1.5×10-2、4.7×10-3、2.8×10-2、8.6×10-3、2.3×10-8、及4.1×10-11。每个点表示自单个个体变化<5%标准偏差下的3次分析的平均值。*,p<0.05、**,p<0.01、***,p<0.001;不成对史都登氏(Student′s)t试验。
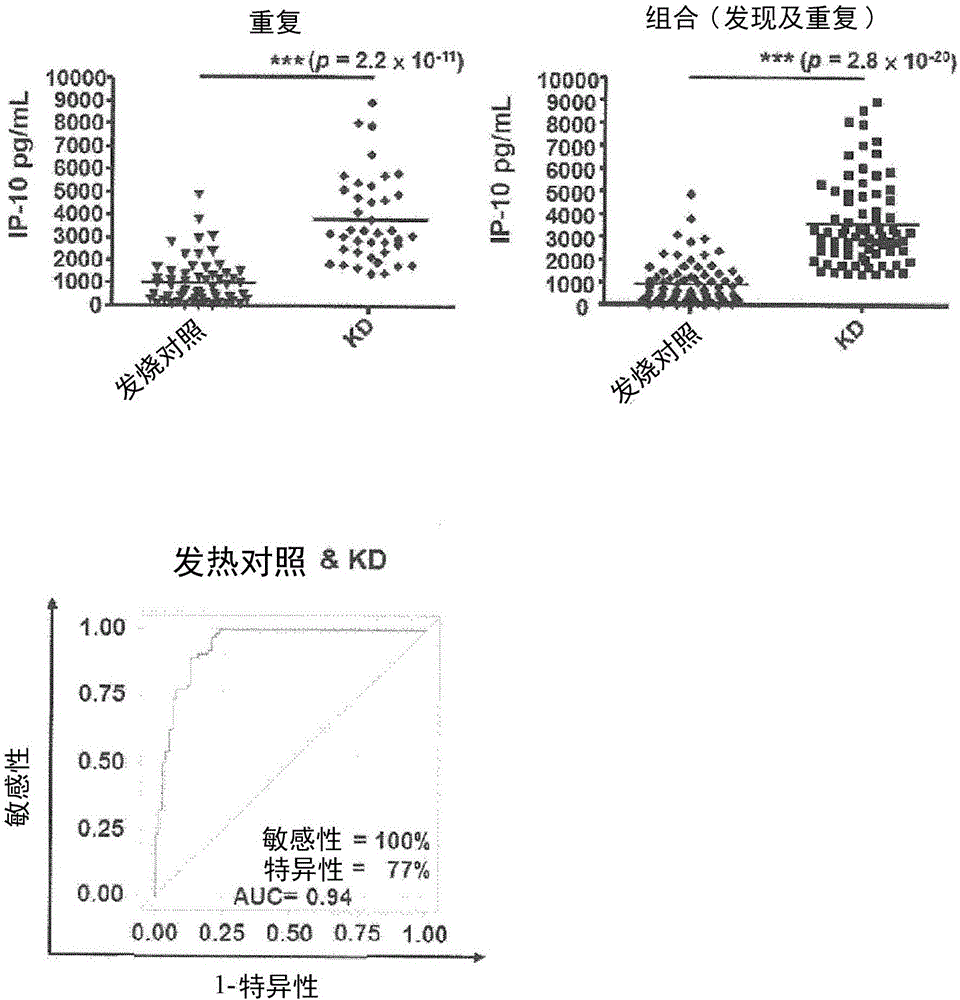
图2是一组显示自发现及重复研究的发烧对照及KD患者的组合数据及具有IP-10的血浆量的川崎氏症的预测模型的接受者操作特征(ROC)曲线的图。于发烧对照(n=57)及KD患者(n=40)中的血浆IP-10量是经由使用酶联免疫吸附测定法(ELISA)来确定。发烧对照(n=77)及KD病例(n=77)中的那些亦使用ELISA测量。***,p<0.001;不成对史都登氏T试验。每个点表示自单个个体变化<5%(标准偏差/平均值)下的3次测定的平均值。基于该组合数据,于KD患者中的血浆IP-10量的ROC曲线是相对发烧对照绘制。生物标记的最佳截止值是作为其最大敏感性及特异性的总和来测定。
图3是显示于盲法验证研究中的IP-10的血浆量的图。于该验证研究(患者<6岁)中(其包括发烧对照(C-F,n=37)、不完全KD患者(K-1,n=3)、及KD患者(K,n=20))的血浆IP-10量是使用酶联免疫吸附测定法来确定。误差线表示三个平行值的标准偏差。
图4A是显示自开始发烧<4天(平均值,3.4±0.90天;范围,1至4天)或开始发烧>5天(平均值,6.0±1.05天;范围,5至8天)获得的KD患者血液中的IP-10血浆量的位图。每个点表示自单个个体变化<5%(标准偏差/平均)下的3次分析的平均值。
图4B是显示在IVIG治疗之前或一周之后45个KD患者的血浆IP-10量的图。
图5是一组显示于急性KD患者的T细胞中的细胞表面趋化因子受体CXCR3的图。左图:开口曲线表示经抗CXCR3抗体染色的CD3+T细胞的荧光活化细胞筛检器直方图。患者KD-1至KD-6是KD的急性阶段。HD表示健康供体。右图:汇总自3个健康供体及6个急性KD患者的CD3+T细胞中的CXCR3的平均荧光强度的柱状图。**,p<0.01,不成对史都登氏t试验。
【实施方式】
出乎意料地发现罹患KD的个体中的特定生物标记量不同于非KD发烧症状个体中的。
生物标记包括IL-17F(Genbank登录号NP_443104)、IL-33(Genbank登录号NP_001186570)、sCD40L(Genbank登录号NP_001289682)、CCL23/MPIF-1(Genbank登录号NP_665905)、E-选择素(Genbank登录号NP_000441)、及CXCL10/IP-10(Genbank登录号NP 001556)。已发现KD患者中的IL-7F、sCD40L、MPIF-1、E-选择素、及IP-10的量高于非KD发烧个体中的。KD患者中的IL-33量低于非KD发烧个体中的。
因此,可检测疑似罹患KD的个体(例如显示KD症状的个体)的样品中的一或多种生物标记量,及与其对应预定的截止量进行比较以判定该个体是否罹患KD。例如,若个体中的IP-10量高于对应截止量,则指示该个体罹患KD。本文所述的任何生物标记可用于与其他诊断试验、生物标记或KD的风险因素组合以诊断KD。
样品可以是体液样品,例如血液、血清、血浆、脑脊髓液、尿液、或唾液样品。样品中的生物标记量可使用多种方法测定,例如ELISA、蛋白质阵列、流式细胞计数法、建立于磁珠上的多重免疫测定法、蛋白质印迹、点印迹、或ELISPOT。于一个例示性方法中,将个体的血浆或血液样品点于滤纸上,其可经干燥及储存。然后经干燥的血液或血浆斑点可用于ELISA中以检测及量化该样品中的生物标记量。参见例如Aabye等人,PLoS ONE,7(6);e39228,2012年6月。特异性识别上述生物标记的抗体是市售的或可使用相关技艺中已知方法生产。
生物标记的预定截止量(其表示非KD个体中的相同生物标记量)可基于KD患者及非KD个体组中的生物标记的代表量确定。非KD个体可包括具有与KD的临床特征及/或实验室参数重叠的疾病或症状(例如,持续发烧、皮疹、幼年型类风湿性关节炎、特定病毒及细菌感染(诸如猩红热及毒性休克症候群),及示于下表2中的症状)的个体。应用适合统计分析于所获得的生物标记量以确定区分KD患者与非KD个体(尤其具有临床上类似KD的症状的非KD个体)的截止量。
本文所述的生物标记(例如,IP-10)可用于KD的早期诊断。例如,疑似罹患KD的个体中的生物标记量可于该个体开始发烧的0至10天内(例如,小于3天、小于4天、小于5天、或小于10天)检测。然后将经检测的生物标记量与对应截止量进行比较以确定该个体是否罹患KD。如上所述,早期诊断及因此早期介入治疗可预防KD的严重并发症。
一些KD患者不显示KD的所有典型症状。上述方法可用于此种KD病例(即,不完全或非典型KD)的诊断。
使用一或多种上述生物标记确定个体罹患KD之后,可施用针对KD的治疗给该个体。早期治疗降低个体的冠状并发症的风险。IVIG已显示可使患者退烧及降低发展冠状畸形的风险。此外,可用阿司匹林控制发烧。一些患者可能需要第二剂量的IVIG以退烧。一些患者对IVIG无反应。在那些情况中,可向该个体施用其他治疗。此种替代治疗包括抗TNF-α抗体(例如,英利昔单抗(Infliximab))及IVIG与类固醇的组合。
任何上述生物标记亦可用于监测KD的治疗。经历KD治疗(例如,IVIG)的患者中的KD生物标记量可在多个时间点(例如,在治疗之前及在开始治疗之后的一周内的一或多个时间点)处测定。在治疗期间,生物标记量趋向其对应截止量的变化指示该治疗是有效的。例如,于一时间点处的患者的IP-10量比于早期时间点处的量更低指示该治疗是有效的。若于后期时间点处的生物标记量等于或不显著不同于在早期时间点处的量(例如,于开始治疗之前或刚好于开始治疗之后),则指示该治疗需继续(例如,等于或高于前剂量的IVIG的另一剂量)或需施用替代治疗。换言之,在治疗期间的个体中的KD生物标记量可用于制定治疗决策(例如,继续或终止治疗,或施用不同治疗)。
此外,任何上述生物标记亦可用于评估针对KD的候选化合物或治疗的疗效。KD生物标记量可于向个体施用该化合物或治疗之前、期间、及/或之后测定。
用于诊断或监测KD的治疗的试剂盒可包括用于检测KD生物标记(例如,IP-10)量的试剂或装置(例如,试验条、固态载体、或盘)。该试剂可以是特异性针对KD生物标记的抗体。该装置亦可包括(例如,涂覆)特异性针对KD生物标记的抗体。
下列具体实例仅视为说明,而不绝以任何方式限制本发明剩余部分。在没有进一步详细阐述情况下,据信本领域技术人员可基于本文的说明,最大限度地利用本发明。本文所引述的所有公开案以全文引用的方式并入本文中。此外,以下所提出的任何机制不以任何方式限制本申请专利范围的范围。
实施例
我们登记214名具有发烧及KD临床特征暗示的儿童。他们中仅100名经诊断为KD。使用无偏、大规模、定量蛋白质阵列全面分析其血浆样品的细胞因子、趋化因子、及细胞黏附分子。此研究分3个阶段进行:发现、重复、及盲法验证。于发现阶段期间[n(KD)=37,n(对照)=20],相比于对照,KD患者在急性阶段期间的介白素-17F、sCD40L、E-选择素、CCL23(MPIF-1)、及CXCL 10(IP-10)的表达上调。观察到IP-10量的显著增加(KD,3,037±226.7pg/mL;对照,672±130.4pg/mL;p=4.1×10-11)。组合的发现及重复数据(n(KD)=77,n(对照)=77)的接受者操作特征分析显示,IP-10量具有高曲线下面积值(0.94[95%置信区间,0.9055-0.9778];敏感性,100%;及特异性,77%)。在最佳截止值为1,138pg/mL下,盲法验证研究证实IP-10量是KD的良好预测器。在静脉注射用免疫球蛋白治疗下,IP-10量回到正常。IP-10、CXCR3的下游受体于急性KD患者的T细胞中被活化。
该研究是由中国医药大学附属医院(China Medical University Hospital)、高雄长庚纪念医院(Kaohsiung Chang Gung Memorial Hospital)、及台湾中央研究院的机构评审组(Institutional Review Board)及机构评审组的伦理机构批准。自个体及其家长获得书面知情同意书。
患者
我们登记214名具有发烧及KD临床特征暗示的汉族儿童。他们中仅100名经最终诊断为KD。此种KD儿童的人口统计学及临床特征显示于表1。最终诊断为非KD的114名儿童显示于表2。
参与该研究的儿童是自台湾的不同地理区域的医疗中心招募,长庚纪念医院系统(包括于台湾南部及北部的四个医院)及中国医药大学附属医疗中心(包括于台湾中部的3个地区医院)。KD是使用已知临床诊断标准进行诊断。参见Newburger等人,Pediatrics.2004;114:1708-1733;及Kim及Dedeoglu,Curr Opin Pediatr.2005;17:695-702。100个KD患者中,37个是包含于研究的发现阶段,40个包含于重复阶段,及23个包含于盲法验证阶段,其包括3个具有不完全KD表现的患者(iKD是定义为存在≤4种日本标准的主要症状)。参见Newburger等人,Circulation.2004;110:2747-2771。
表1 此研究中登记的患者的人口统计学及临床特征
所有变量数据表示为平均值±标准偏差(SD)。KD,川崎氏症;FC,发烧对照。
表2. 214例儿童患者的最终诊断
细胞因子、趋化因子、及细胞黏附分子的多重分析及量化
将获自研究个体的新鲜肝素化血样以2,000g离心10min。然后将血浆样品分成等分试样及储存于-80℃以供进一步分析。样品以一式两份使用Bio-Plex ProTM人类Th-17细胞因子板15-Plex(Bio-Rad,Hercules,CA,USA)运行。将细胞因子的完整清单(IL-1β、IL-4、IL-6、IL-10、IL-17A、IL-17F、IL-21、IL-22、IL-23、IL-25、IL-31、IL-33、IFN-γ、sCD40L、及肿瘤坏死因子[TNF]-α)以此种分群量化,其检测限值及再现性提供于产品手册中。使用15不同组载有对各细胞因子特异的捕捉单抗的荧光染色珠粒。使用Bio-Plex蛋白质阵列系统(Bio-Rad)测量及量化信号。使用与Bio-Plex管理软件版本3.0(Bio-Rad)整合的Bio-Plex蛋白质阵列系统进行分析。使用Bio-Plex校准试剂盒(Bio-Rad)调整报告子共轭物发射波长。使用Bio-Plex验证试剂盒版本3.0(Bio-Rad)验证个别珠粒特征的流体力学性能、一致光学对准、双黏体(doublet)辨别及鉴定。针对初始筛选,使用人类蛋白质阵列(AAH-CYT-G8-8;Raybiotech Inc.,Norcross,GA,USA)检测6个KD患者的血浆,该阵列评估54种趋化因子及CAM以鉴定在KD中显示表达上调的蛋白质。完全趋化因子/CAM名称可于raybiotech.com网站中得到。经由使用酶联免疫吸附测定法(ELISA)来进一步量化剩余KD患者中经鉴定的上调基因,即,IL-9、IP-10、E-选择素、及MPIF-1。E-选择素、MPIF-1、及IP-10ELISA的检测限度分别是30pg/mL、7pg/mL、及8pg/mL。验证IP-10的再现性(组内测定法(intra-assay):CV<10%;组间测定法(inter-assay):CV<12%)及特异性;此ELISA试剂盒显示与所试验的任何细胞因子无交叉反应性。根据制造商说明书(RayBiotech Inc.),稀释范围为1∶2至1∶20。
流式细胞计数法
周边血液单核细胞是经由Ficoll-Isopaque密度梯度分离法(Pharmacia Fine Chemicals,Uppsala,Sweden)自肝素化血液分离。使用识别人类CD3(UCHTI;BD Biosciences,San Jose,CA,USA)或CXCR3(IC6/CXCR3;BD Biosciences)的独特荧光染料缀合的单抗进行免疫表型分析。在PBMC细胞经稀释抗体(1∶200)于室温下培养1小时后,其经由使用FACS Calibur装置(BD Biosciences)的多色流式细胞计数法检测。使用CellQuest获取软件(BD Biosciences)获得数据,及针对每个实验中的分析记录0.5至2.0×106个结果。
统计分析
使用不成对史都登氏t试验及Prism4软件(GraphPad,San Diego,CA,USA)评估统计显著性。使用SAS软件,版本9.3(SAS Institute Inc.,Cary,NC,USA)进行接受者操作特征(ROC)曲线分析。ROC曲线绘制敏感性及1-特异性的图及提供敏感性及特异性跨连续预测器的一系列截止点的汇总。使用方差分析及逻辑回归分析测定组间差异。每个候选生物标记的最佳截止值作为其最大敏感性及特异性的总和来测定。
血浆谱:发现研究
使用细胞因子多重系统及蛋白质阵列,总共分析69个炎症细胞因子。在初始筛选中,测定20个非KD发烧对照及37个KD患者中的15个细胞因子的血浆量。KD患者中的IL-17F及sCD40L的量显著高于发烧对照。参见图1。发现仅一个细胞因子IL-33下调。参见图1。虽然IL-1β在KD小鼠模型中的冠状病变发展中具关键性,于本研究中,急性KD患者中的IL-1β的血浆量没有显著提高(数据未显示)。
针对剩余54种炎症细胞因子及CAM,使用蛋白质组方法来鉴定于随机选自发现阶段的6个KD患者的急性阶段期间所获得的一组血浆样品中的候选生物标记。将此种数据与那些具有非KD发烧及皮疹的对照进行比较。KD患者中的10种细胞因子或CAM的平均表达量至少高于对照1.3倍。参见表3。于这10种蛋白质中,KD患者中的IL-9、IP-10、E-选择素、及MPIF-1的平均表达显示至少增加2倍,及于所有6个所试验患者中发现此结果。此外,急性阶段KD患者中的PDGF-AA、IL-2R-α、CD14、IGF-II、及Siglec-5基因下调,此显示比对照下降至少1.8倍(<60%,数据未显示)。然后以较大样品尺寸(20个非KD发烧对照及37个KD患者)进行ELISA以量化候选生物标记(IL-9、IP-10、E-选择素、及MPIF-1)。针对急性阶段KD患者,与蛋白质阵列数据一致,IP-10、MPIF-1、及E-选择素量存在显著增加。参见图1。然而,当样品尺寸增加时,IL-9量的增加变得不显著(数据未显示)。于6个候选KD生物标记(IL-17F、IL-33、sCD40L、E-选择素、MPIF-1、及IP-10)中,相比于对照(672±130.4pg/mL),KD患者中的IP-10(3,037±226.7pg/mL)显示最显著的增加(KD患者的值相对于非KD发烧对照的值,p值=4.1×10-11)。参见图1。
表3 自急性阶段川崎氏症(KD)患者的血浆的10种所选择的编码趋化因子及CAM的候选基因的信号强度
所有测试以一式两份进行。内部阴性对照用于测定正信号的截止率。使用蛋白质阵列筛选6个KD患者及2个对照(Ctr)个体。Ctr-1是具有非KD发烧的儿童个体。Ctr-2是正常健康个体。仅显示超过1.3的趋化因子及CAM的KD/Ctr比(KD患者的平均值/对照病例的平均值)。
IP-10量:重复研究及组合研究
为了进一步验证IP-10的作用,进行包含额外40个KD患者及57个非KD发烧对照的重复研究。如图2显示(上左图),此研究亦显示相对在那些发烧对照中的,KD患者中的IP-10量显著增加。当将自重复研究的数据与那些发现研究中的组合时(组合研究),相比于77个非KD发烧对照(921±106.2pg/mL),77个KD患者的IP-10量(3,587±210.2pg/mL)显著增加(KD患者的值相对于非KD发烧对照的值,p值=2.8×10-20)。参见图2(上右图)。
为了进一步确认IP-10作为KD诊断中的生物标记的作用,使用自组合研究的IP-10值进行ROC曲线分析。当非KD发烧患者用作对照时,IP-10显示0.94的极高的曲线下面积(AUC)值(95%置信区间,0.9055-0.9778)。参见图2(下图)。如经由最大敏感性及特异性的总和所定义,以1,138pg/mL的血浆IP-10量作为最佳截止值,相比于非KD发烧对照,IP-10显示高敏感性(100%)及特异性(77%)。参见图2(下图)。
盲法验证研究
最后研究阶段使用来自60个疑似罹患KD的儿童的血浆样品进行。测量以盲法方式示踪的样品中的血浆IP-10量,及结果是非盲法及进行分析。使用1,318pg/mL的截止值,29个样品是IP-10阳性且31个是IP-10阴性。29个IP-10阳性样品中的22个经成功诊断为KD(包括2个iKD病例);剩余7个样品经诊断为非KD发烧。参见图3。31个IP-10阴性样品中30个来自非KD发烧对照及1个是iKD患者。总言之,1,318pg/mL的IP-10截止值显示良好区分23个KD患者及37个非KD发烧对照的能力(敏感性,96%[22/23];特异性,81%[30/37])。
血浆IP-10量与发烧时限及静脉注射用免疫球蛋白治疗的关联
为了确定增加的IP-10量是否可于KD早期阶段检测到,检测自开始发烧的4天内(平均值,3.4±0.90天;范围,1至4天)获得的37个KD样品,及将结果与疾病后期阶段(平均值,开始发烧的6.0±1.05天;范围,5至8天)获得的46个样品的那些进行比较。于早期疾病阶段的IP-10量显著增加(3,054±331.0pg/mL)。参见图4A。使用1,318pg/mL作为最佳截止值,37个KD患者中81%(30个)于非常早期阶段(<4天)经鉴定,同时46个KD患者中96%(44个)于急性阶段(>5天)中经鉴定。
亦于开始IVIG治疗之前或一周之后检测45个患者中的IP-10量。在IVIG治疗下,于治疗之前的高IP-10量回归正常(治疗之前,3,323±224.9pg/mL;治疗之后,348±64.8pg/mL),除1个抵抗第一轮IVIG治疗及需要第二次治疗的KD患者之外。参见图4B。
于T细胞中的细胞表面趋化因子受体CXCR3
IP-10下调于T细胞中的细胞表面趋化因子受体CXCR3。为了确定KD患者的增加的IP-10量的下游效应,分析于6个KD患者的T细胞中的CXCR3的细胞表面表达。测量CD3+T细胞的平均荧光强度(MFI),及相比于3个健康供体的MFI,急性阶段KD患者中的MFI3.3倍下降。参见图5。于撤消阶段,CXCR3的表达量恢复正常(数据未显示)。
其他实施例
本说明书揭示的所有特征可以任何组合组合。本说明书揭示的每个特征可经由用于相同、相当、或类似目的的替代特征替代。因此,除非另有明确说明,否则所揭示的每个特征仅是一系列相当或类似特征的一实例。
许多实施例已进行描述。然而,应了解可在不偏离本发明之精神及范围下作出多种改良。因此,其他实施例于下列权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!