全血样品的稳定化的制作方法
本申请要求保护2014年8月15日提交的美国临时申请序列号62/037,632和2014年8月7日提交的美国临时申请序列号62/034,481的权益。前述申请的完整内容通过引用方式并入本文。
联邦赞助的研究和开发
本发明根据美国国家卫生研究院资助的基金编号EB002503和EB012493借助美国政府支持做出。美国政府在本发明中享有某些权利。
技术领域
本发明用于使血液样品例如临床血液样品稳定化以便储存的方法。
背景技术:
外周血是门诊中最频繁接近的组织,并且在血液学、输血、免疫学、再生医学和肿瘤学中分离血源性细胞具有广泛的临床和科学重要性。最新微工程学(microengineering)进展已经大大增进我们分离纯的细胞群体及进行高通量多维分析的能力(1)。快速增长的血液芯片(blood-on-a-chip)技术领域已经扩展至多种应用,从分离T细胞供HIV病情监测(2)和多重检测细胞因子分泌(3);创伤和烧伤患者中中性粒细胞的基因表达谱(gene expression profiling)(4);富集CD34+造血干细胞(5);至最小侵入性检测来自母体血液的有核红细胞(nucleated red blood cells,RBC)(6)以及罕见循环型肿瘤细胞供诊断癌症(7)及鉴定可药化突变(8)。
然而,类似于任何组织,全血(whole blood,WB)离体迅速劣化。降解事件如养分丧失、氧化应激、摩尔渗透压浓度(osmolarity)和pH变化,和有毒代谢副产物蓄积,迅速开始。在数小时内,中性粒细胞发生活化、突发性氧化作用以及坏死和凋亡。血液沉降造成物理应激,并且因在加速附带损伤和交叉活化的局促空间中机械压缩坏死性细胞而加重降解。血液样品的运输产生了诱导溶血和血小板活化的失控振荡。这些损伤不仅影响样品中目的细胞的活力和功能,还极大影响广泛应用的富集技术。例如,散播表面抗原造成基于抗体的分选作用无效。红细胞叠连(rouleaux formation)可能挟裹稀有细胞。特别地,有效分选细胞必需的微流体分选技术受棘红细胞(echinocyte,形成毛刺的衰老红细胞)、血小板活化和凝固以及细胞聚集破坏。
对于其他复杂的全血保存策略,认为否则可能有效抑制生物化学反应的低温范围和降解过程不相容,主要原因在于冷诱导的血小板活化。因而,在现代输血医学中,全血一般在室温储存并且在24小时以内处理成各种组分供专门储存(9)。鉴于许多临床相关测定法如测序和表达谱在大型医学中心或诊断实验室中性能最佳,血液储存和运输的后勤需要(logistical needs)对基于血液的下一代医疗技术扩散带来严重约束。
将大大得益于全血保存改善的许多应用当中包括分离从实体瘤散布并且能够使转移灶血液学扩散的循环型肿瘤细胞(circulating tumor cells,CTC)。高级微流体技术已经能够实现从癌症患者的外周血样品分离这些极端稀有的细胞(10个亿血细胞中一个),并且已经在使用这些细胞及其分子特征标识用于诊断、预后、鉴定可药化突变以及产生患者特异性药物筛选模型方面取得显著进展。然而,这些下游测定法严重依赖保留分子信息和细胞功能的有活力的、未固定CTC的分离。血液降解不仅限制CTC的分子分析,还干扰这些极端稀有细胞的精确微流体分离。
技术实现要素:
全血离体快速降解(rapid degradation of whole blood ex vivo)对多种下一代医疗技术中利用血源性细胞带来后勤约束。本文中描述了几种方法,每种方法可以单独或组合使用,以保存全血样品供多种临床应用。示例性应用包括但不限于:富集白细胞亚型如T细胞或中性粒细胞供细胞因子测定法和免疫测定法;从脐带血或外周血分离祖细胞供移植;从母体血液分离胎儿细胞供诊断;和分选循环型肿瘤细胞供检测和治疗癌症。
因此,本发明提供用于使全血样品稳定化的方法。该方法包括:从受试者获得全血样品,并且向样品引入Ficoll 70以在样品中产生2-20%(w/v)Ficoll 70。
还提供用于使全血样品稳定化的方法。这些方法包括从受试者获得全血样品并向样品引入胱天蛋白酶抑制剂和任选的保存制剂(preservative formulation)。
还提供用于使全血样品稳定化的方法。这些方法包括从受试者获得全血样品,并且向样品引入保存制剂,其中保存制剂包含48mM HEPES、0.44mM腺嘌呤、6.75mM甘露糖醇、0.77mM N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine)和8.5mM NaCl。
还提供用于使全血样品稳定化的方法。这些方法包括从受试者获得全血样品;并且向样品引入血小板抑制剂(platelet inhibitor,PI)。
还提供用于使全血样品稳定化的方法,所述方法包括:从受试者获得全血样品,并且向样品引入以下的一种以上:FFicoll 70以在样品中产生2-20%(w/v)Ficoll 70;胱天蛋白酶抑制剂;包含48mM HEPES、0.44mM腺嘌呤、6.75mM甘露糖醇、0.77mM N-乙酰-L-半胱氨酸和8.5mM NaCl的保存制剂;和/或血小板抑制剂(PI)。
在一些实施方案中,添加Ficoll 70以在样品中产生至少10%Ficoll70。
在一些实施方案中,胱天蛋白酶抑制剂是Q-VD-OPh((3S)-5-(2,6-二氟苯氧基)-3-[[(2S)-3-甲基-2-(喹啉-2-羰基氨基)丁酰基]氨基]-4-氧代戊酸)((3S)-5-(2,6-difluorophenoxy)-3-[[(2S)-3-methyl-2-(quinoline-2-carbonylamino)butanoyl]amino]-4-oxopentanoic acid)、Z-VAD-FMK(甲基(3S)-5-氟-3-[[(2S)-2-[[(2S)-3-甲基-2-(苯基甲氧基羰基氨基)丁酰基]氨基]丙酰基]氨基]-4-氧代戊酸酯)(methyl(3S)-5-fluoro-3-[[(2S)-2-[[(2S)-3-methyl-2-(phenylmethoxycarbonylamino)butanoyl]amino]propano yl]amino]-4-oxopentanoate)、Q-VD(OMe)-OPh((S)-甲基5-(2,6-二氟苯氧基)-3-((S)-3-甲基-2-(喹啉-2-羧酰胺基)丁酰胺基)-4-氧代戊酸酯)((S)-methyl 5-(2,6-difluorophenoxy)-3-((S)-3-methyl-2-(quinoline-2-carboxamido)butanamido)-4-oxopentanoate)、或Boc-D-fmk(5-氟-3-[(2-甲基丙烷-2-基)氧羰基氨基]-4-氧代戊酸甲酯)(methyl 5-fluoro-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-oxopentanoate)。在一些实施方案中,添加足够的胱天蛋白酶抑制剂至样品以实现2-10uM,例如,约5uM的终浓度。
在一些实施方案中,保存制剂包含24-48mM HEPES、0.11-0.44mM腺嘌呤、2.25-6.75mM甘露糖醇、0.39–1.54mM N-乙酰-L-半胱氨酸、0-13.5mM右旋糖(dextrose)、和0-17mM NaCl。在一些实施方案中,保存制剂包含48mM HEPES、0.44mM腺嘌呤、6.75mM甘露糖醇、0.77mM N-乙酰-L-半胱氨酸和8.5mM NaCl。
在一些实施方案中,使血液稳定化以便在20-25℃储存。
在一些实施方案中,将血液例如在20-25℃维持或储存72-96小时。
在一些实施方案中,PI是替卡格雷(ticagrelor)、西洛他唑(cilostazol)、普拉格雷(prasugrel)、双嘧达莫(dipyridamole)、普拉格雷(prasugrel)、替罗非班(Tirofiban)、依替巴肽(eptifibatide)、氯吡格雷(clopidogrel)或KF38789。
在一些实施方案中,将PI添加至样品以实现0.01-100ug/mL、例如0.01-1ug/ml,例如0.01-0.5ug/mL的终浓度。
在一些实施方案中,使血液稳定化以便在2-25℃储存。在一些实施方案中,使血液稳定化以便在4℃储存。在一些实施方案中,方法包括在4℃维持样品。权利要求4、5或13-16的方法中,将样品在2-25℃维持或储存至少24、36、48、72或96小时。例如,可以将样品保持72小时(对于中性粒细胞稳定化)和至少96小时(对于红细胞稳定化)
如本文所用,短语“向样品引入”可以意指向样品添加某物,或将样品添加至某物(例如,将样品放入已经包含添加物的管中)。
本发明的方法特别可用于供临床诊断法和实验室诊断法(如全血微流体评价法和可以指示免疫系统功能的中性粒细胞移行测定法(migration assay)(例如,在败血症诊断中))的样品。
可能根据多种因素选择在特定情况下待使用的本文所述方法。例如,如果需要运送患者样品至另一个位置,例如,运送至临床实验室,并且冷藏不是选项,则可以选择任选具有胱天蛋白酶抑制剂的优化保存剂。对于运送后将使用微流体装置评价的样品,可以选择任选具有胱天蛋白酶抑制剂的优化保存剂,同时还包含血小板抑制剂。
除非另外限定,否则本文中所用的全部技术与科学术语具有如本发明所属领域的普通技术人员通常理解的相同含义。本文中描述了用于本发明中的方法和材料;也可以使用本领域已知的其他合适方法和材料。材料、方法和实施例仅为示例性的,而不旨在限制。本文所提及的全部出版物、专利申请、专利、序列、数据库输入项和其他参考文献通过引用的方式完整并入。在矛盾的情况下,本说明书(包括定义)将居主导。
本发明的其他特征和优点将从以下发明详述和附图并且从权利要求书显而易见。
附图说明
图1A-B.(A)显示全血(左)和含有10%F70的血液(右)的红细胞沉降率(erythrocyte settling rate,ESR)测量的代表性图像。(B)72小时范围内全血(WB)和含不同F70浓度血液中的血液样品的ESR(WB,n=11;0%F70,n=9;5%F70,n=8;10%F70,n=11;15%F70,n=9)。0%F70表示用无F70的RPMI培养基处理的对照条件。误差线代表平均值的95%置信区间(confidence interval,CI)。
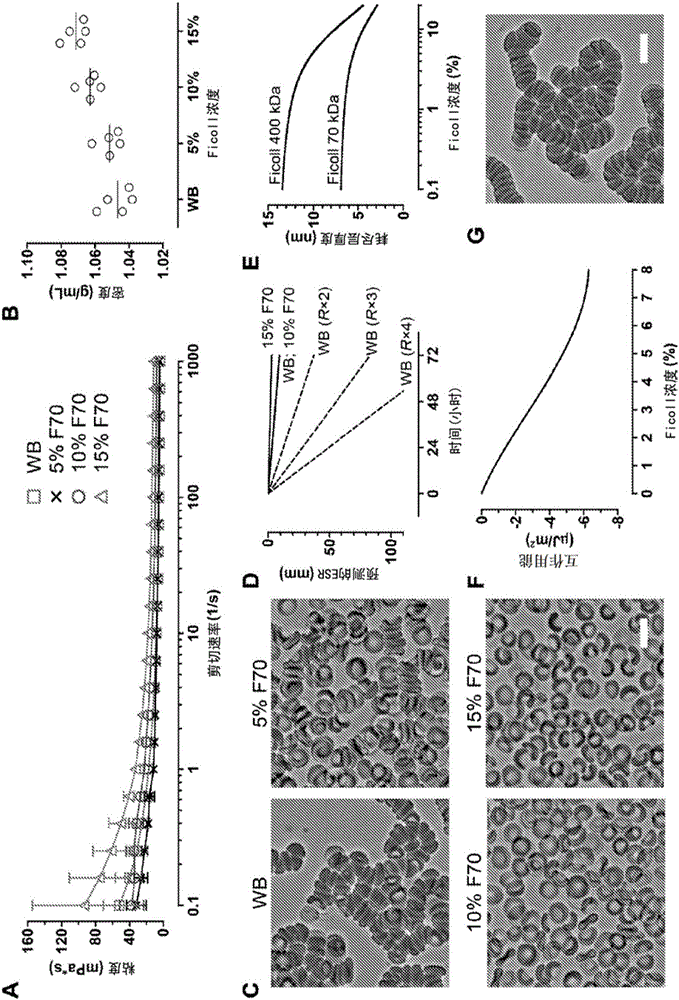
图2A-G.(A)随剪切速率变化的血液样品粘度(WB,n=5;5%F70,n=4;10%F70,n=5;15%F70,n=5)。(B)在不同F70浓度存在下血液样品的密度。(C)当样品未受扰动20分钟时,在全血(WB)中的RBC自发地形成聚集物。RBC聚集在5%F70存在下被大幅度抑制,并且在10%和15%F70存在下被彻底阻止。比例尺表示10μm。(D)从沉降速度计算的ESR估计值。这里,假定RBC为半径(R)4μm和密度1.1g/cm3的球状体;流体密度和粘度使用相应F70条件下的测量值。作为单细胞,沉降极端缓慢,无论介质是什么(WB,10%F70,和15%F70)。然而,细胞聚集有效地增加粒子半径(即,R×2,R×3,等)并因而大幅度增加沉降率。(E)在Ficoll 70kDa或400kDa聚合物存在下,在一系列体积浓度(bulk concentrations)时RBC表面上耗尽层(depletion layer)的计算厚度。(F)在一系列体积浓度时Ficoll 400kDa的最小互作用能(interaction energy)。负能量表示造成RBC聚集的吸引力。归因于Ficoll 70kDa的互作用能通常是非负的并且因此未显示。(G)RBC在5%Ficoll 400kDa存在下立即聚集。比例尺表示10μm。
图3A-B.(A)的WB或10%F70中存储长达72小时的RBC的代表性相差图像(phase-contrast images)。棘红细胞是含有毛刺的RBC。比例尺表示10μm。(B)不同F70浓度下历经72小时储存的血液样品中棘红细胞的百分数(WB,n=9;0%F70,n=8;5%F70,n=6;10%F70,n=7;15%F70,n=6)。误差线代表平均值的95%置信区间(CI)。
图4A-F.(A)新鲜血液(0小时)、和作为全血或在10%F70内储存72小时的血液中染色中性粒细胞的高倍率(100×)显微图像。新鲜中性粒细胞的胞核显示明显分段的多小叶形态(0小时),这种形态在10%F70中保存得比WB更好。比例尺表示10μm。(B)在WB或10%F70中储存72小时后Sytox Blue染色阳性(即,膜受损)的白细胞或中性粒细胞的百分数。(C)在WB或10%F70中储存72小时后胱天蛋白酶-3/7活性染色阳性的白细胞或中性粒细胞的百分数。(D)伴随胞质残余物的高度分散的胞核物质存在于储存的血液中。比例尺表示10μm。(E)用针对中性粒细胞弹性蛋白酶(elastase)和组蛋白-DNA复合物的抗体、和DAPI染色的健康中性粒细胞(上行)和中性粒细胞胞外诱捕网(neutrophil extracellular trap)(NET;末行)的免疫荧光法图像。注意亮视野图像中与单个RBC相比而言的大面积NET。比例尺代表10μm。(F)储存72小时的血液样品内中性粒细胞弹性蛋白酶的定量。在新鲜血液样品中,中性粒细胞弹性蛋白酶以37.8±16.5mU/mL血液(n=7)的水平检检出。作为阳性对照,用佛波醇肉豆蔻酸酯乙酸酯(phorbol myristate acetate,NET的强力诱导物;n=7)刺激的新鲜全血增加该水平至81.4±64.4mU/mL。
图5.在WB或10%F70中储存24、48、和72小时后Sytox Blue染色阳性的白细胞的百分数(WB,n=10;10%F70,n=10)。WB中的白细胞在48小时(p<0.05)和72小时(p<0.001)比10%F70中的白细胞显著没有活力,两因素ANOVA及Bonferroni事后检验。
图6A-C.(A)在全血中环境条件下储存的红细胞的图像揭示了棘红细胞(球状的推测细胞(spherical,speculated cells))的形成。(B)在储存24-96小时的时间后,样品可以在2mM腺苷存在下于37℃温育4小时以减少棘红细胞数目,基本上使红细胞复苏(revitalizing)。(C)随时间推移观察到患者全血中红细胞的降解(n=5)。CS-原始制剂(CS-Original formulation)的有效性几乎与具有支持已复苏红细胞的有限能力的对照相同。从改良Taguchi表上条件18产生的制剂揭示了支持72小时储存后红细胞复苏的优越能力,而96±1%的红细胞表现健康。
图7.侧向散射相对于CD45(side scatter v CD45)散点图中白细胞的分布如预期,每个细胞群体之间区别明显。然而,在72小时环境储存后,白细胞群体偏移。稍后确定大部分偏移的细胞是凋亡/死亡的中性粒细胞。
图8A-I.将中性粒细胞从新鲜的健康供体血液分离并添加至培养基(IMDM,20%FBS)。对照(仅培养基)和处理(凋亡/坏死抑制剂+培养基)。在环境储存后的0、24、48、72和96小时检查样品。(A)新鲜中性粒细胞、(B)96小时对照中性粒细胞和(C)96小时Q-VD-OPh处理的中性粒细胞的侧向散射相对于CD45表达。(D)随时间推移监测对照样品和处理的样品以测量CD45表达的变化,(E)确定每种条件下死亡中性粒细胞的数和(F)凋亡性中性粒细胞的数目。亮视野图像拍摄自Wright-Giemsa染色涂片,后者来自(G)新鲜中性粒细胞、(H)96小时储存后的对照中性粒细胞和(I)96小时储存后Q-VD-OPh处理的中性粒细胞。
图9A-B.中性粒细胞储存在两种条件下-高营养对照条件(IMDM+20%FBS),和IMDM中Q-VD-OPh+20%培养基。(A)Q-VD-OPh处理的样品(72小时储存后)中保留对fMLP的移行反应(migratory response),与新鲜分离的中性粒细胞的移行反应几乎不可区分。然而,在对照条件下,移行活性存在明显损失。(B)中性粒细胞功能的这种保留还依据其移行速度观察到,其中Q-VD-OPh处理的样品维持与新鲜分离的中性粒细胞可比较的速度。
图10.作为温度函数的血小板活化。将血小板在4-37℃的温度温育20分钟(时间点#1)并且在血小板活化表面标记物染色和成像流式细胞术(imaging flow cytometry)之前,加热到37℃持续1小时(时间点#2)或与5mM EDTA(与EDTA)组合。PAC-1是GPIIb/IIIa的活性形式并且CD62P的表达是血小板脱粒(degranulation)的标记物。通过评估表达细胞表面活化标记物的血小板百分数,确定血小板活化。我们的数据显示血小板的冷诱导活化与两种表面蛋白(CD62/p-选凝素和GPIIa/IIIa)相关,并且血小板活化的最大变化出现在37℃和22℃之间。
图11.多种血小板抑制剂的优化/选择。我们按一系列浓度检验了一系列血小板抑制剂,包括替罗非班、依替巴肽(Tocris)、氯吡格雷(Sigma)和KF38789(Tocris)。在血小板活化表面标记物染色并且使用成像流式细胞术处理之前,将血小板在4℃或22℃温育20分钟。通过评估表达细胞表面标记物(包括PAC-1和CD62/p-选凝素)的血小板百分数,确定血小板活化。在检验的血小板抑制剂当中,替罗非班显示最有前景的结果,而冷处理的血小板在0.01-0.5ug/mL的剂量活化最少。
图12A-I.无毒血小板抑制剂混合物。将全血在摇床上与替罗非班(0.1-0.5ug/mL)温育10分钟,之后储存。在室温或4℃储存期间,不摇动血液。在储存后,将EDTA(2-5mM)在摇动期间添加至血液长达75分钟。无PI表示未向样品添加血小板抑制剂。(A)比较具有或没有血小板抑制剂混合物的情况下0小时和72小时冷储存或室温储存时、血小板活化表面标记物PAC-1的表达。(B)比较具有或没有血小板抑制剂混合物的情况下0小时和72小时冷储存或室温储存时、血小板活化表面标记物CD62P的表达。(C)确定血小板活化百分数的相关设门(gating)和血小板活化组(platelet activation panel)的代表性流式细胞术图像。(D)显示用我们的血小板抑制剂混合物完全抑制血小板功能的血小板凝集测定描迹(Platelet aggregometry trace)。使用凝血酶为激动剂(1单位/500μl全血)以诱导血小板活化。(E)使用成像流式细胞术,测定血小板与白细胞的相互作用,而血小板-白细胞相互作用由CD41和CD45双重正向信号定义。血小板抑制剂混合物能够完全逆转血小板-白细胞相互作用。
图13.在冷保存期间保留RBC形态。棘红细胞(具有不同推测形状的RBC)常在离体血液样品观察到并且为细胞应激的指标。获得棘红细胞计数使用标准血液涂片、相差成像(使用100×物镜)和每种实验条件下跨两幅图像(从不同视野采集的)计数100个RBC。数据比较了血小板抑制剂混合物(储存前添加的替罗非班0.1-0.5ug/mL;储存后添加的EDTA2-5mM)存在和不存在下,0小时对冷储存和室温72小时储存。全血冷储存可以保留多达80%RBC的形态长达72小时。添加我们的血小板抑制剂混合物未对棘红细胞形成造成任何有害作用。
图14.冷储存期间的WBC活化。使用成像流式细胞术,使用细胞表面活化标记物(包括CD66b和CD11a),确定WBC活化百分数。数据比较了血小板抑制剂混合物(储存前十分钟添加的替罗非班0.1-0.5ug/mL;储存后添加的EDTA 2-5mM)存在和不存在下,0小时对冷储存和室温72小时储存。加阴影数据点表示从健康供体采集的数据,而空心圆表示从癌症患者采集的数据。如与室温储存相比,冷储存时WBC活化减少。添加我们的血小板抑制剂混合物不活化WBC。在健康供体和癌症患者中观察到这些趋势。
图15.72小时冷储存期间WBC活力的保留。使用活染液(钙黄绿素AM蓝)和死染液(胱天蛋白酶3/7),通过成像流式细胞术评估冷储存的WBC与室温储存的WBC的活力。活细胞定义为钙黄绿素阳性和胱天蛋白酶阴性细胞,而死细胞定义为胱天蛋白酶阳性细胞。基于低CD45表达和高CD16表达,对粒细胞设门,而无粒细胞(agranulocytes)显示高CD45表达。数据比较了血小板抑制剂混合物(储存前十分钟添加的替罗非班0.1-0.5ug/mL;储存后添加的EDTA2-5mM)存在和不存在下,0小时对冷储存和室温72小时储存。冷储存的WBC的活力比室温储存的血液更好。添加血小板抑制剂混合物不影响WBC活力。
图16.冷储存期间的LNCaP活力。使用活染液(钙黄绿素AM蓝)和死染液(胱天蛋白酶3/7),通过成像流式细胞术评估冷储存的稀有癌细胞与室温储存的稀有癌细胞的活力。活细胞定义为钙黄绿素阳性和胱天蛋白酶阴性细胞,而死细胞定义为胱天蛋白酶阳性细胞。使用EPCAM细胞表面标记物,对LNCaP细胞设门。数据比较了血小板抑制剂混合物(储存前十分钟添加的替罗非班0.1-0.5ug/mL;储存后添加的EDTA 2-5mM)存在和不存在下,0小时对冷储存和室温72小时储存。无PI表示未向样品添加血小板抑制剂。加阴影数据点表示从健康供体采集的数据,而空心圆表示从癌症患者采集的数据。冷储存的稀有细胞的活力可能比室温储存的血液更好。添加血小板抑制剂混合物不影响稀有细胞活力。在健康供体和癌症患者中观察到这些趋势。
图17A-F.通过CTC-iChip处理冷储存的血液。血小板抑制剂令CTC-iChip处理新鲜血液和低温(4℃)下储存3天的血液成为可能。这里,所用的血小板抑制剂(PI)是0.5μg/mL替罗非班或1μg/mL替罗非班+依替巴肽20μg/mL(储存前添加)。在iChip处理之前15分钟添加EDTA(2-5mM)至血液样品。(A)图像描述了在不存在血小板抑制剂情况下的严重凝血。该图像显示在CTC-iChip的过滤阵列的第一阶段借助Vybrant DyeCycle Green(Life Technologies)的DNA荧光染色。比例尺表示100μm。(B)说明作为目标容量(5-6mL)百分数的经CTC-iChip处理的总血容量的图表。数据比较了具有和没有血小板抑制剂混合物的新鲜血液和储存血液。(C)经CTC-iChip处理的全血的血液通量或流量(mL/小时),所述CTC-iChip比较了具有和没有血小板抑制剂混合物的新鲜血液和储存血液。(D)基于实际处理容量计算,iChip分选后的加标循环型肿瘤细胞(spiked circulating tumor cell)(CTC)的回收率。这个回收百分数仅基于处理的血液容量,所述处理的血液容量在(B)中所示的芯片阻塞情况下大幅度降低。CTC绝对回收率因此低得多并且可以依据回收百分数×处理的容量计算。(E)CTC-iChip耗尽白细胞的对数转换的倍数。耗尽越高,富集的CTC群体越纯。4个对数耗尽转换成10000倍耗尽,这意指含有5×106个白细胞/mL血液的常见血液样品将在富集的CTC产物仅留下500个白细胞/mL处理的血液。(F)进入CTC产物的红细胞(RBC)残余(Carryover)/μL血液。
图18.iChip分选后培养CTC。将循环型肿瘤细胞加标入血液(2000-5000个细胞/mL)并且由CTC-iChip富集。铺种并培养从iChip产物收集的CTC。使用Bright-Glo萤光素酶测定体系,依据发光量对细胞生长定量。将发光信号对作为iChip处理后立即启动培养之日时的第0日信号归一化。包括不进行任何iChip处理的阳性对照。
图19.iChip分选后的单细胞PCR(左)和质谱流式细胞术(mass cytometry)。(左)将LNCaP细胞加标入血液(2000个细胞/mL)、借助iChip分离,并且微操作用于单细胞转录剖析(参考文献30,Ozkumur 2013Sci Transl Med)。所示的数据代表前列腺癌特异性基因的平均表达。在每种储存条件中,随机选择4个细胞并剖析。(右)从采用LNCaP细胞的相同实验富集的iChi产物的质谱流式细胞术。与室温相比,在冷储存下更好地保留了上皮细胞黏附分子(epithelial cell adhesion molecule,EPCAM)的表达。
具体实施方式
改善保存全血为广泛类型的临床应用和科学应用创造了机会。以活力状态保存不仅对多种应用如输血和组织再生重要,对需要可能在固定期间严重受损的高品质分子材料的诊断性检验也重要(19)。本文中描述了几种方法,每种方法可以单独或组合使用,以保存全血样品供多种临床应用。示例性应用包括但不限于:富集白细胞亚型如T细胞或中性粒细胞供细胞因子测定法和免疫测定法;从脐带血或外周血分离祖细胞供移植;从母体血液分离胎儿细胞供诊断;和分选循环型肿瘤细胞供检测和治疗癌症。
方法1.使流体相中的血液样品稳定化
尽管针对纯化血液组分设计的保存解决方案有进展,但是保存全血的进展相对有限,并且尚未进行解决基础性血液沉降问题的尝试。如本文中所示,可以通过物理稳定化,最小化血液沉降和相关的细胞降解。
血液沉降可以根据简单的物理学理解。对于粘稠液体中的单一球状体沉降,球状体重量受浮力(buoyancy force)和斯托克斯拖曳力(Stokes’drag force)平衡,假设沉降速度为其中ρp是球状体密度,ρf是流体密度,μ是流体粘度,g是重力,并且R是球状体半径。因此,沉降速度与(球状体和流体之间的)密度差异和半径的平方成正比,并且与流体粘度成反比。该等式解释了为何红细胞聚集(R增长)增加红细胞沉降率(erythrocyte settling rate,ESR)。
为了实现血液的悬浮储存,我们选择因其中性电荷和高亲水性具有高度生物相容性的多糖Ficoll。也可以使用物理化学特性相似的聚合物,如葡聚糖和聚乙二醇,例如,葡聚糖40kDa聚合物。我们首先检验Ficoll聚合物在3天期间在室温阻止血液沉降的能力并探索相关机制。我们随后研究该处理是否影响例行血细胞富集方法学,并且研究物理稳定化对储存的血细胞的形态、活力和各种生物学过程的影响。
将Ficoll聚合物引入血液中是简单的并且与白细胞富集的常见测定法相容。物理稳定化抑制了红细胞聚集、棘红细胞形成,维持白细胞活力并且阻止中性粒细胞的NETosis。
生物物理稳定化的益处
就处理和细胞保护而言,抑制RBC聚集向血液样品赋予几个益处。首先并且最重要地,几乎完全阻止血液沉降,这消除了连续混合的需要,并且因此可以促进储存和运输以及要求反复、连续血液采样的实验室测定法。此外,这种方法通过降低血液的低剪切粘度,改善血液的流变学特性(图2A)。在全血中,最初需要额外的应力以分散RBC聚集物,从而产生特征性剪切稀化行为(20,27)。添加F70允许血液样品在低剪切范围更容易地流动(图2A),这在微流体应用中特别有意义。实际上,已经利用小聚合物在临床环境下改善血液灌流(perfusion)(28,29)。
尽管其简单,物理稳定化大幅度改善多种类型血细胞的保存。红细胞,占全部血细胞总体积的99%,在F70存在下保留下其双凹形态。这个结果应当有益于多种应用,如基于尺寸的细胞分选(例如,过滤)、或依赖于细胞的流体体动力特性(如确定性侧向位移)的微流体过程(30)。白细胞,尤其脆弱的中性粒细胞,展示优越的完整性和减少的凋亡。另外,在血液储存中抑制NET形成具有重要意义。已知活化中性粒细胞释放混合有中性粒细胞酶的染色质纤维以形成NET(31)。NET保护免受感染,但是还可以促进血栓形成(32)和自身免疫反应(33)。另外,已经提出储存的输血用RBC单位中NET释放(17)造成输血相关性急性肺损伤(34)。我们假设NET组分—如DNA、中性粒细胞弹性蛋白酶和髓过氧化物酶—的存在对全血中的其他细胞诱导附带损伤并且加速整个血液样品的降解。因此,保存全部血细胞在其中目的细胞不是血液学的应用方面甚至至关重要。例如,分选和分析稀有循环型肿瘤细胞(1/109个血细胞)为临床管理癌症保持了作为非侵入液态活组织检查的巨大潜力(35)。血液学细胞的降解不仅对稀有循环型肿瘤细胞造成附带损伤,还不利地影响依赖于血细胞的确定生物特性和物理特性的细胞分选技术。
我们方案的易实施性和Ficoll聚合物的可获得性可以提供改善现有程序和测定法的机会。例如,免疫学测定法有时在24小时延迟时进行以考虑标本运送。在冷冻保存之前短期储存脐带血多至48小时也是常见实践。在这些时间期限范围内,已经发现粒细胞(其中>90%是中性粒细胞)降解不利地影响T细胞测定法(36,37)。Ficoll维持、尤其在较短时间期限范围内维持中性粒细胞完整性的能力(图5)可以立即用于相似的应用中。
总之,通过使用至少5%、10%或15%Ficoll 70使血液在均匀悬液中稳定化,因此最小化细胞降解并且限制细胞毒性分解产物释放,我们已经阻止血液沉降和再混合的恶性循环并且因而解决了样品储存和运输中的基础性机制问题。
方法2.优化的保存制剂
在第二种方法中,开发了任选的包含胱天蛋白酶抑制剂的优化保存制剂。这种制剂特别适用于临床样品及将要在环境(例如,20-25℃)温度维持的全部样品。
多种胱天蛋白酶抑制剂是本领域已知的;泛胱天蛋白酶抑制剂包括Q-VD-OPh((3S)-5-(2,6-二氟苯氧基)-3-[[(2S)-3-甲基-2-(喹啉-2-羰基氨基)丁酰基]氨基]-4-氧代戊酸),Z-VAD-FMK(甲基(3S)-5-氟-3-[[(2S)-2-[[(2S)-3-甲基-2-(苯基甲氧基羰基氨基)丁酰基]氨基]丙酰基]氨基]-4-氧代戊酸酯),Q-VD(OMe)-OPh((S)-甲基5-(2,6-二氟苯氧基)-3-((S)-3-甲基-2-(喹啉-2-羧酰胺基)丁酰胺基)-4-氧代戊酸酯)、或Boc-D-fmk(5-氟-3-[(2-甲基丙烷-2-基)氧羰基氨基]-4-氧代戊酸甲酯)。在一些实施方案中,胱天蛋白酶抑制剂是Q-VD-OPh,一种具有强力抗凋亡特性的广谱胱天蛋白酶抑制剂。
保存制剂可以例如是下文显示的CS-18,并且可以包含Q-VD-OPh(例如,2-10uM,例如,约5uM)、24-48mM HEPES、0.11-0.44mM腺嘌呤、2.25-6.75mM甘露糖醇、0.39–1.54mM N-乙酰-L-半胱氨酸、0-13.5mM右旋糖、和0-17mM NaCl。优选的配方是48mM HEPES、0.44mM腺嘌呤、6.75mM甘露糖醇、0.77mM N-乙酰-L-半胱氨酸和8.5mM NaCl。
方法3.伴有血小板抑制作用的冷储存
在第三种方法中,将血小板抑制剂添加至样品,之后将样品冷却并保冷,例如,在2-25℃。血小板抑制剂防止血小板活化和聚集,所述活化和聚集干扰分离技术,包括但不限于基于抗体的细胞富集法和微流体血细胞分选法。多种血小板抑制剂是本领域已知的,包括环氧合酶(cyclooxygenase)抑制剂(例如,乙酰水杨酸和三氟柳(Disgren));腺苷二磷酸(ADP)受体抑制剂(例如,氯吡格雷(Plavix)、普拉格雷(EFFIENT)、替卡格雷(BRILINTA)、或噻氯匹定(ticlopidine)(Ticlid));磷酸二酯酶抑制剂(例如,西洛他唑(Pletal));蛋白酶激活受体-1(PAR-1)拮抗剂(例如,沃拉帕沙(vorapaxar)(Zontivity));糖蛋白IIB/IIIA抑制剂(例如,阿昔单抗(abciximab)(ReoPro)、依替巴肽(Integrilin)、罗昔非班(roxifiban)、奥波非班(roxifiban)或替罗非班(Aggrastat));腺苷再吸收抑制剂(例如,双嘧达莫(Persantine));血栓烷(thromboxane)抑制剂(例如,血栓烷合酶抑制剂或血栓烷受体拮抗剂如特鲁曲班(Terutroban));或P-选凝素介导细胞黏附抑制剂(例如,KF38789(3-[7-(2,4-二甲氧苯基)-2,3,6,7-四氢-1,4-硫氮杂卓-5-基]-4-羟基-6-甲基-2H-吡喃-2-酮)((3-[7-(2,4-Dimethoxyphenyl)-2,3,6,7-tetrahydro-1,4-thiazepin-5-yl]-4-hydroxy-6-methyl-2H-pyran-2-one)))。在优选的实施方案中,血小板抑制剂是糖蛋白IIB/IIIA抑制剂,例如,替罗非班、罗昔非班、奥波非班、依替巴肽或阿昔单抗。在一些实施方案中,是添加足够量的血小板抑制剂至样品以产生0.01-100ug/ml,例如,0.01-1ug/ml,例如,0.01-0.5ug/mL的剂量。
实施例
本发明在以下实施例中进一步描述,所述实施例不限制权利要求书所述的本发明范围。
实施例1.全血保存中物理稳定化的作用
在尝试改善全血样品保存时,我们解决了储存这种流体组织中基础性但是遭忽视的方面,即,血液沉降。血液沉降不仅诱导机械应力,还压迫血细胞并加速由活化和正在降解的白细胞引起的附带损伤。我们发现,聚合物Ficoll 70kDa在72小时期间使血液样品稳定化并且阻止血液沉降,这主要通过抑制红细胞聚集做到。这种方法是与常见的白细胞富集技术(包括红细裂解和免疫磁性纯化)相容。与多种措施中沉降的血液(包括棘红细胞形成和白细胞活力和凋亡)相比,物理稳定化与优异的细胞保存相关。令人瞩目地,中性粒细胞的完整性保留并且中性粒细胞弹性蛋白酶—中性粒细胞胞外诱捕网的标记物—的释放显著减少。这项研究首次显示,可以使用生物材料阻止血液沉降并且这在一系列诊断技术中具有意义。
材料和方法
实施例1中使用以下材料和方法。
血液样品和添加Ficoll
血液样品从健康志愿者获得或购自Research Blood Components(Brighton,MA)。全部血液样品均吸入酸式枸橼酸盐右旋糖-A(Acid Citrate Dextrose,ACD-A)管(BD真空采血管(Vacutainer);8.5mL)并且在4小时内使用。
全血(WB)在无任何调整的情况下使用。为了将Ficoll 70kDa(GE Healthcare)聚合物引入血液中,将浓缩的Ficoll母液(20%、40%和60%w/v)溶解于补充有10mM HEPES(Life Technologies)的RPMI 1640培养基(无酚红;Life Technologies)中,过滤除菌,并且按体积比1:3添加至全血。例如,为了配制含5%F70的血液,使用前,将1份20%Ficoll添加至3份WB并且混合(HulaMixer;Life Technologies)10至15分钟。对于0%F70样品,将1份RPMI添加至3份WB,产生75%血液体积分数。血液样品在室温储存在无菌、气密管中,无扰动。
红细胞沉降率测定法
使用符合标准化Westergren方法尺度的移液管(Dispette 2;Fisherbrand),用1.3mL全血或Ficoll-血液进行红细胞沉降率(ESR)测定法。在24、48、和72小时记录以毫米计的ESR。
流变学
使用具有钢制双壁同心圆柱体几何形状的TA Instruments Discovery HR-3流变仪,进行库特(Couette)流变测量。每个实验使用8.5mL样品。按0.1/秒至1000/秒的剪切速率获得数据点,每十秒(decade)5个点。
血细胞的形态学评估
为了计数棘红细胞,将样品温和地混合,之后将一滴(约10μL)转移至玻璃载片、涂片并使用EVOS FL细胞成像系统(Life Technologies),使用相差显微术(phase-contrast microscopy)按40倍成像。每份样品计数约100个随机RBC并且通过其明显的毛刺鉴定棘红细胞。
根据标准程序进行Wright-Giemsa染色。简而言之,将一滴(约10μL)样品在玻璃载片上涂片,风干、在100%甲醇中固定,并浸在Wright-Giemsa染液(Sigma)中30秒,之后在去离子水中淋洗。在Nikon Eclipse90i显微镜上使用Nikon100×Apo VC100×/1.40油物镜,以Nikon DS-Ri1彩色照相机(12比特;1280×1024分辨率)采集图像。
白细胞富集和产率定量
使用红细胞裂解液(Miltenyi Biotec)进行红细胞裂解。在裂解后,将细胞按300×g慢速旋转,用10mL RoboSep缓冲液(Miltenyi Biotec)洗涤,再次离心,重悬于600μL RoboSep缓冲液中,并使用Beckman Z2Coulter计数器计数。根据制造商的方案,使用EasySep人中性粒细胞富集试剂盒(Stemcell Technologies)进行中性粒细胞富集。简而言之,将耗尽抗体混合物(depletion antibody cocktail)与(通过RBC裂解获得的)富集的白细胞混合,随后与磁性粒子温育。EasySep磁体随后用来固定不想要的细胞,因为将无标签的中性粒细胞倾入另一支锥形管。将富集的中性粒细胞随后再旋转(re-spun)并重悬于含有0.3%BSA和10mM HEPES的1mL RPMI培养基中,计数并染色以进行成像流式细胞术。
用于表面标记物和细胞活力的成像流式细胞术
使用配备40倍物镜、6条成像通道和405nm、488nm及642nm激光的ImageStreamXMark II成像流式细胞仪(Amnis Corporation),进行成像流式细胞术。为了分析细胞活力和CD45表达,在RBC裂解后,将富集的白细胞重悬于HEPES缓冲盐水的0.1%BSA中并且在适用情况下用以下抗体和染液染色:DRAQ5(1μM;Cell Signaling Technologies)、Sytox Blue(1μM;Life Technologies)、CellEvent胱天蛋白酶-3/7Green检测试剂(0.75μM;Life Technologies)、FITC缀合的CD45抗体(1:500;克隆5B1;Miltenyi Biotec)、PE缀合的CD66b抗体(1:125;克隆G10F5;Stemcell Technologies)、和PE-Cy7缀合的CD16抗体(1:200或1:333;克隆3G8;BD Biosciences)。使用胞核标记物DRAQ5,对单细胞设门。通过双阳性CD66b和CD16鉴定中性粒细胞。为了分析富集后的中性粒细胞活化,将细胞用DRAQ5(1μM;Cell Signaling Technologies)、VioBlue缀合的CD45抗体(1:100;克隆5B1;Miltenyi Biotec)、Alexa Fluor 488缀合的CD11b抗体(1:500;克隆ICRF44;Stemcell Technologies)、PE缀合的CD66b抗体(1:125;克隆G10F5;Stemcell Technologies)和PE-Cy7缀合的CD16抗体(1:333;克隆3G8;BD Biosciences)染色。
用于NET可视化的免疫荧光染色和显微术
在室温,将聚-L-赖氨酸包覆玻璃载片上的血涂片于100%甲醇中固定,风干,用4%多聚甲醛固定并且封闭和透化(2%山羊血清+0.1%Triton X-100)4小时。随后将载玻片与0.3%牛血清白蛋白中的抗中性粒细胞弹性蛋白酶兔pAb(25μg/mL;Calbiochem)和抗-H2A-H2B-DNA小鼠单抗(克隆PL2-6;1μg/mL)在4℃温育过夜。接着,将载玻片与Alexa Fluor 488缀合的山羊抗兔IgG和Alexa Fluor555缀合的山羊抗小鼠IgG(均为1:500;Life Technologies)在室温温育45分钟,用PBS淋洗,并使用含DAPI的VECTASHIELD封片剂(Mounting Medium)(Vector Laboratories)封片。在Nikon Eclipse90i显微镜上使用Nikon S Plan Fluor ELWD 60x/0.70物镜,以QImaging Retiga 2000R照相机采集图像。
中性粒细胞弹性蛋白酶的定量
将血液样品温和地混合,加温至37℃持续4小时以释放NET内容物至血浆中,并且用PBS稀释至最终血液体积分数25%,之后按2000×g离心5分钟。随后将上清液小心地转移至新离心管并储存在-80℃供进一步处理。使用SpectraMaxM5谱仪(Molecular Devices),根据制造商的方案使用中性粒细胞弹性蛋白酶活性分析试剂盒(Cayman Chemical Company),定量中性粒细胞弹性蛋白酶的水平,。作为NETosis的阳性对照,将佛波醇肉豆蔻酸酯乙酸酯(100nM)在温育前添加至新鲜全血。
统计分析
数值数据报告为均数±标准偏差。配对比较使用Mann-Whitney检验。为了比较密度,我们对线性趋势使用单因素ANOVA,随后事后检验。为了随时间推移比较WB和F70条件,我们对配对比较使用两因素ANOVA,随后进行Bonferonni事后检验。全部统计分析均用Prism 5(GraphPad)进行。
实施例1.1血液的生物物理稳定化
我们用Westergren方法中所用的标准化移液管定量ESR(图1A)。无Ficoll的全血迅速沉降,在24小时达到62.6±26.5mm并且在48小时和72小时进一步分别达到78.9±20.0和84.9±15.6mm(图1B)。为了将Ficoll70kDa(F70)引入血液中,我们将浓缩的F70母液(溶解于RPMI培养基中)按比率1:3混合至血液样品以产生所示的最终F70浓度(w/v)。添加5%、10%和15%F70在全部测量的时间点大大减少ESR(图1B;在24、48、和72小时与WB相比p<0.0001)。令人印象深刻地,10%和15%F70在72小时期间几乎完全阻止沉降(ESR分别是7.3±3.1mm和4±1.6mm;图1B)。为了证实稳定化效果归因于F70,但不归因于添加的培养基,通过用RPMI按稀相同比率释全血,我们未发现ESR差异(0%F70,图1B;在全部时间点与WB相比p>0.05)。
为了理解Ficoll聚合物如何使全血稳定化,我们表征了其在血液沉降方面相关的流变学特性,即,粘度、密度和细胞聚集作用。我们首先按0.1/秒至1000/秒的剪切速率对血液样品进行库特粘度分析。全血显示剪切稀化行为,其中粘度从剪切速率0.1/秒时的51.9±18.9cP降至剪切速率1000/秒时的4.1±0.4cP(图2A)。添加15%F70增加了血液样品的低剪切粘度(与WB相比,剪切速率≤0.398/秒时p<0.01)并保留剪切稀化特征(图2A)。与之相反,5%和10%F70未显著地改变全血的粘度(图2A)。令人惊讶地,这两种F70浓度在低剪切范围显示比15%F70更低的粘度(对于5%F70与15%F70,剪切速率≤0.631/秒时p<0.05;对于10%F70与15%F70,剪切速率≤0.251/秒时p<0.01)。WB、5%F70、10%F70和15%F70的密度分别是1.047±0.009μg/mL、1.051±0.007μg/mL、1.063±0.006μg/mL和1.071±0.006μg/mL(图2B;p<0.0001,单因素ANOVA连同线性趋势事后检验)。
密度增加最少(对于15%F70,仅2.3%)和粘度变化不明显(对于5%和10%F70而言)提示Ficoll通过阻止RBC聚集使全血稳定化。基于沉降速度vs的ESR估计值显示,只要RBC作为单细胞沉降,甚至在全血中沉降最少(<10mm)(图2D)。因为沉降速度随粒子半径的平方缩放(scale),所以RBC聚集对ESR的增加贡献最明显(图2D)。我们以实验方式证实,全血中RBC在数分钟内迅速聚集,而添加F70大大抑制聚集(图2C)。值得注意地,10%和15%F70完全阻止聚集(图2C)并且充分解释了这两种实验条件下ESR估计值和测量值之间的一致性。
不希望受理论约束,我们还研究了稳定化的机制。全血中血液沉降受大分子血浆蛋白存在下的RBC自发聚集驱动,其中最充分地研究了纤维蛋白原(约340kDa;流体动力学半径约11nm)(20,21)。涉及RBC聚集的分子力可以由耗尽相互作用(depletion interaction)机制描述(22),该机制声称,邻近RBC表面优选排除具有大流体动力学半径(>>4nm)的大分子,因而诱导导致RBC聚集的渗透力(osmotic force)(即,耗尽力)(22,23)。这种力可以由蛋白质聚合物和非蛋白质聚合物产生并且解释了常用来加速RBC沉降以富集白细胞的大分子羟乙基淀粉(>130kDa)和Ficoll400kDa(半径=10nm)的聚集效应。然而,不太了解的是小分子聚合物通过减少耗尽层中渗透力(因其穿透这个局促空间的能力所致)(23,26),反而抑制RBC聚集(24,25)。为了理解这个耗尽模型是否也与我们的Ficoll聚合物实验研究结果一致,根据Neu和Meiselman的理论配方(22),我们计算了在70kDa(半径=5.1nm)或400kDa Ficoll(半径=10nm)存在下RBC之间的互作用能。这里,我们考虑了因RBC表面上带负电荷的糖被(glycocalyx)所致的静电排斥力以及由聚合物排除作用诱导的耗尽力,计算渗透特性时考虑Ficoll分子的球体形状。我们发现,较大的Ficoll 400kDa导致耗尽层足够厚(图2E)以减少总互作用能至负值(即,吸引力;图2F)。相反,互作用能在Ficoll 70kDa存在下普遍为非负。我们还实验地证实Ficoll 400kDa(5%)导致RBC聚集(图2G)。
实施例1.2红细胞保存
我们继续确定全血样品的物理稳定化是否改善红细胞的保存。RBC衰老的明显特征是丧失双凹盘形态和出现毛刺,称作棘红细胞(图3A)。我们对沉降的全血或Ficoll稳定化的血液中因储存所致的棘红细胞的百分数定量(图3B)。全血中的棘红细胞水平从0小时处的6.6±11.6%增加至24、48、和72小时处分别为52.2±25.4%、63.2±25.9%和78.8±21.1%。添加5%、10%、或15%F70显著地降低储存后棘红细胞水平(图3B;在24、48和72小时对于5%F70相对于WB,分别是p<0.05、<0.01、<0.001;在24、48和72小时对于10%或15%F70相对于WB,p<0.001)。如预期,仅添加RPMI(0%F70)不影响棘红细胞形成(在全部时间点p>0.05)。
实施例1.3与白细胞富集方法学的相容性
涉及血细胞的许多测定法要求以高纯度分离所需群体的富集步骤。我们确定F70-稳定化的血液是否与富集白细胞的常见技术相容。我们发现,F70不影响RBC的例行低渗裂解(hypotonic lysis)并且产生与全血样品可比的白细胞产率(WB为46.7±1.8%,而10%F70为43.9±1.9%,n各自=3,p=0.2)。流式细胞分析显示白细胞标记物CD45表达无改变(相对荧光,WB为54±13×103,而10%F70为56±21×103,n各自=6,p=1.0),提示与基于表面抗原的常见富集技术相容。我们进一步检验了一种中性粒细胞富集的免疫磁性负向选择测定法并且获得与全血可比的产率(WB为30.7%±8.2%,而10%F70为29.2%±10.5%,n各自=4,p=0.89)和纯度(WB为99.0%±1.0%,而10%F70为99.0%±0.8%,n各自=4,p=1.0)。重要地,Ficoll处理并未活化中性粒细胞(CD11b相对荧光,WB为123±36×103,而10%F70为123±15×103,n各自=4,p=0.89)。
实施例1.4白细胞保存
为了检验物理稳定化是否改善白细胞保存,我们观察Wright-Giemsa染色的血涂片上的白细胞形态并使用流式细胞术测定细胞活力。在全血中储存72小时后,中性粒细胞和它们明显的多小叶胞核形态显示清晰的瓦解(disintegration)迹象。比较时,中性粒细胞形态在Ficoll稳定化的血液中更好地保留(图4A)。为了研究与细胞死亡相关的事件,我们使用鉴定膜受损(Sytox Blue)细胞以及凋亡(胱天蛋白酶-3/7活性阳性)细胞的染液进行成像流式细胞术。在全血中储存72小时后,28.2%±10.2%的白细胞对Sytox(图4B)染色阳性并且32.5%±13.1%呈胱天蛋白酶活性阳性(图4C)。相反,血液中以10%F70稳定化的白细胞受损最小(12.1%±3.5%膜损伤;与WB相比p=0.0009;图4B)并且凋亡少得多(13.2%±3.3%胱天蛋白酶阳性;与WB相比p=0.0286;图4C)。这些保存益处在脆弱的中性粒细胞上特别明显。在全血中,41.8%±15.9%的中性粒细胞出现膜受损(图4B)和48.3%±19.9%为胱天蛋白酶阳性(图4C);与相比,这些值分别与Ficoll稳定化的血液中的13.4%±4.5%(p<0.0001;图4B)和15.6%±4.5%(p=0.0286;图4C)进行比较。超过93%的Sytox-阳性细胞还对胱天蛋白酶活性染色阳性,这表明大部分细胞因凋亡而死亡。
最近,在未经历去白细胞(leukoreduced)的储存红细胞单位中已发现中性粒细胞胞外诱捕网(NET)(17)。中性粒细胞明显降解导致我们研究NET形成。在储存样品获得的血涂片上,我们观察到经常覆盖大面积的高度分散的胞核物质(图4D),提示NET形成。采用中性粒细胞特异性标记物-中性粒细胞弹性蛋白酶以及组蛋白-DNA复合物的免疫荧光染色(图5B)证实储存的血液样品中存在NET(图4E)(18)。为了定量NETosis的程度,我们用ELISA测量了储存后中性粒细胞弹性蛋白酶的血浆水平。在72小时,我们发现弹性蛋白酶在WB中与10%F70相比较的2.2倍差异(63.6±21.1mU/mL与29±11.2mU/mL;p=0.0023;图4F)。
实施例2:环境条件下全血中的红细胞和白细胞稳定化
当前的红细胞保存剂,如CPD和AS-1,需要在采血24小时内去白细胞(leukoreduction),随后在4℃储存红细胞。另外,就发明人所知,这些解决方案尚未对患者样品验证,这些样品倾向于更快速地降解(基于我们对转移性乳腺癌患者样品的经验)。目前上市的全血保存剂(如CellSave)利用固定剂(fixative)使细胞膜和蛋白质稳定化。固定导致细胞死亡和复杂的RNA提取。因此,本发明实施例描述了开发保存剂以使患者全血样品中的活红细胞稳定化并在全血中保存活白细胞。两种方法均已经优化以使样品在环境条件下稳定化以促进样品运送。
材料和方法
实施例2中使用以下材料和方法。
开发在环境条件下健康供体全血中保存红细胞的制剂。开发了称作CS-原始(原始混合物溶液(cocktail solution original))的初始制剂以稳定化来自健康供体全血的红细胞(表1)。将CS在水中配制并按比率17:3的血液:保存剂添加至ACD抗凝管(anticoagulant tube)中采集的血液。表1中所示的浓度是血液中保存剂组分的终浓度。在添加保存剂后,将样品用血气(blood gas)(5%O2,5%CO2)充气并密封。随后将样品在21℃储存所需的时间量(24-96小时)。在储存阶段后,向血液添加20mM腺苷溶液,从而终浓度是2mM。随后将血液在37℃温育4小时,同时间歇混合促进红细胞形状复苏。随后光学地检查样品以定量棘红细胞(不规则或受损红细胞)的数目。
表1
用于患者红细胞稳定化的Taguchi优化保存制剂。将CS-原始优化,以使转移性乳腺癌患者血液中的红细胞稳定化。表1显示根据Taguchi实验设计方法的改良L18正交阵列的结构。使用碳酸氢钠,调节HEPES母液(1M)至pH 7.4。如上文所述检查每种制剂,包括储存后4小时腺苷复苏步骤。
检验环境条件下储存的全血中的白细胞降解。在ACD抗凝管中采集健康供体外周血。在0小时和72小时,将血液分成两个1mL等分量以检验白细胞。对于72小时样品,将血液添加至15mL falcon管并且用5%O2/5%CO2/90%N2脱气,随后储存在环境条件下暗柜的气密容器中。使用流式细胞术处理剩余1mL样品,以建立侧向散射相对于CD45强度。这个检验频繁用于流式细胞术中,以区分各个白细胞群体(中性粒细胞、淋巴细胞等)。
对凋亡抑制剂和坏死抑制剂作为中性粒细胞保存剂的评价。使用来自人中性粒细胞富集试剂盒的推荐方案和试剂(Stemcell Technologies;Vancouver,不列颠哥伦比亚省,加拿大),通过从健康供体全血的负向选择来分离中性粒细胞。通过使用Coulter计数器Z1(Beckman Coulter;Brea,加利福尼亚州)计数直径8-30μm的粒子,确定产率。将中性粒细胞储存在IMDM+20%FBS中并且不处理(对照)或用1.25μL/mL DMSO(Sigma-Aldrich;St.Louis,密苏里州)、5μM Q-VD-OPh(Apex Bio;休斯顿,德克萨斯州)、50μM尼克鲁斯汀-1(Necrostatin-1)(Cayman Chemical;Ann Arbor,密西根州)或50μM Boc-D-FMK(Apex Bio;休斯顿,德克萨斯州)处理。在分离后和在21℃储存24、48、72和96小时后立即处理匹配的样本。将样品用R-藻红蛋白缀合的膜联蛋白V、SYTOX绿、Hoechst33342(均来自Life Technologies;Carlsbad,加利福尼亚州)和别藻蓝蛋白缀合的CD45(Huntington Valley)染色并使用ImageStreamXMk成像。II成像流式细胞仪(Amnis Corporation;西雅图,华盛顿州)。
实施例2.1用于患者红细胞稳定化的Taguchi优化保存制剂。
对快速降解的转移性乳腺癌患者样品检验时,设计成使健康供体全血中红细胞稳定化的CS-原始制剂无效。因此制作改良Taguchi表(上表1)以指导CS制剂的优化。迄今,最有前景的制剂是来自Taguchi表的条件18。
图6显示,这种制剂提供与对照和CS-原始样品相比,腺苷处理后复苏红细胞的优越能力(n=5,在76小时对腺苷处理的样品作图)。
因此,CS-原始制剂足以使来自健康供体样品的红细胞(在环境条件下作为全血储存)稳定化,但是它对可能更快速降解的患者样品的稳定化并不理想。然而,使用改良Taguchi实验设计方法联合储存后复苏步骤(与腺苷温育4小时),该制剂优化,对储存72小时的样品产生优越的保护作用(条件18,在图中显示6)。
实施例2.2在环境条件下储存的白细胞中观察到广泛的CD45生物标记物降解。
在环境条件下采集并储存全血长达72小时,以确定储存对生物标记物表达的影响。图7显示,与新检验的白细胞相比,在环境条件下CS-原始中储存的白细胞出现CD45表达显著减少。
Q-VD-OPh,一种具有强力抗凋亡特性的广谱胱天蛋白酶抑制剂(参见Caserta等人,Apoptosis 2003;8:345–352),成功地稳定化环境条件下储存的中性粒细胞。由于已知中性粒细胞离体快速变质,我们怀疑这个细胞群体是图7中观察到的荧光偏移的主要原因。因此,我们简化该实验以检验培养基(IMDM+20%FBS)中储存的分离中性粒细胞,而非全血。这种简化允许更彻底和更快速地评价潜在的凋亡/坏死抑制剂。基于其广谱胱天蛋白酶抑制剂活性,选择凋亡抑制剂Q-VD-OPh和Boc-D-fmk。先前已经报告Q-VD-OPh是低浓度(5uM)时有效的强力凋亡抑制剂。如图8A-I揭示,Q-VD-OPh在非常敏感的中性粒细胞群体内高度有效地抑制凋亡,并且它还发挥作用在环境储存条件下以将活力从约24小时延伸至96小时的作用(值得指出的是,对照条件本身也对中性粒细胞具有稳定化影响,如采用HBSS或IMDM的实验仅导致稳定<24小时的中性粒细胞更快速地降解)。此外,Q-VD-OPh有效地保留CD45生物标记物表达。具体而言,如图8C中所示,在96小时环境储存后,中性粒细胞几乎与采集后立即检验的那些中心粒细胞不可区分。可选地,对照条件下储存的来自相同供体的中性粒细胞在96小时已经发生明显降解(图8B)。
实施例2.3Q-VD-OPh保护中性粒细胞功能。
尽管图8中的数据表明Q-VD-OPh能够保留环境条件下储存的中性粒细胞的活力和CD45生物标记物表达,但是它的确未显示这些细胞是否仍有功能。为了确定这些条件下储存的中性粒细胞是否仍能够向fMLP梯度移行,我们利用先前为此目的开发的微流体装置。简而言之,向两个外室(outer chamber)添加fMLP,一种中性粒细胞化学引诱物(chemoattractant)。外室通过一系列通道与内室连接,产生梯度。内室随后用中性粒细胞填充。立即评估新鲜分离的中性粒细胞以建立0时移行反应,随后,在72小时和96小时环境储存后检验保存的中性粒细胞以进行比较。图9A显示Q-VD-OPh处理的样品的移行反应与新鲜分离的中性粒细胞可比较,而对照显示显著的功能降低。图9B还表明,中性粒细胞向梯度移行的速度与新鲜的中性粒细胞相同。该数据表示Q-VD-OPh保留中性粒细胞功能。
因此,Q-VD-OPh处理的中性粒细胞在环境储存条件下稳定72-96小时。另外,活力和CD45生物标记物表达稳定化长达96小时,一种在对未处理的中性粒细胞上的显著改善。
实施例3.冷保存全血以分离CTC
本实施例描述开发全血稳定化的新策略。这些方法可以用于意图用于分离循环型肿瘤细胞(CTC)的样品,例如,使用称作CTC-iChip的微流体装置。成功分析患者样品目前要求新鲜采集的血液,原因在于患者血液离体快速变质。因此,全血稳定化将允许在运送至为有效CTC分离配备的集中式机构期间保存患者样品。
材料和方法
实施例3中使用以下材料和方法。
样品采集
全血从马萨诸塞总医院内部的健康受试者采集或购自Research Blood Components(Brighton,MA)。受试者未服用药物,包括已知影响血小板功能的那些(例如,在静脉切开术(phlebotomy)之前48小时内非甾体类抗炎药或阿司匹林)。要求受试者避免大强度运动(在静脉切开术之前至少4小时)并且不是吸烟者。使用19-23号针,将全部血液样品均吸入酸式枸橼酸盐右旋糖-A(ACD-A)管(BD真空采血管;8.5mL),尽管血小板凝集测定用血液采集过程仅使用19-21号针。在3-4小时采集内使用全部血液。将标本在室温(20℃至25℃)不摇动的情况下保持供血小板凝集测定,而摇动全部其他标本。
用血小板抑制剂和EDTA处理血液样品
使用的血小板抑制剂包括:替罗非班(Sigma)、依替巴肽(Tocris)、氯吡格雷(Sigma)、KF38789(Tocris)。在涉及血小板抑制剂(例如,替罗非班、依替巴肽等)处理的全部实验条件中,将这些化合物添加至血液样品并通过柔和摇动10分钟混合,之后处理样品供其他测定法或储存。除非另外声明,否则在测定法之前15分钟添加EDTA(即,在样品储存期间不存在EDTA)。
血涂片
使用根据标准程序的楔形技术,手工制备外周血涂片。将血液吸(约6μl)至载玻片上,使用第二块载玻片均匀涂片(按30-45°角度)并风干。将血涂片用甲醇(100%)固定,用Giemsa-Wright染液(SIGMA)染色30秒,并且迅速转移至蒸馏水,之后风干。将载玻片用Permount封片,之后使用Nikon Eclipse 90i显微镜、Nikon 100×Apo VC 100x/1.40油物镜和Nikon DS-Ri1彩色照相机(12比特;1280×1024分辨率)成像。每份样品计数约100个随机RBC并且将其分类为棘红细胞(基于明显的多刺突出物)或健康RBC。
成像流式细胞术
使用配备40倍物镜、和405nm、488nm及642nm激光的Image Stream Mark II成像流式细胞仪(Amnis Corporation),确定血小板活化和细胞活力。对于血小板活化组,将1μl全血与PBS和如下的荧光标记抗体组合:Pacific Blue缀合的CD41(1:150;克隆HIP8;Biolegend)、FITC缀合的PAC-1(1:10;克隆PAC-1(RUO(GMP));BD Pharmingen)、PE缀合的CD62P(1:100;克隆AK-4;BD Pharmingen)、APC缀合的CD63(1:10;克隆H5C6;Biolegend)、PE/Cy7缀合的CD45(1:100;克隆HI30;Abcam)。对于白细胞活力组,将6μl全血与194μl RPMI(含有Hepes)和如下的荧光标记抗体/活力染液组合:钙黄绿素蓝AM(10μM;Life Technologies)、CellEventTM胱天蛋白酶-3/7Green(5μM;Life Technologies)、PE缀合的CD66b(1:125,克隆g10f5,Stemcell Technologies)、PE-cf594缀合的CD45(1:400,克隆HI30,BD Pharmingen)。为了检测全血中稀有细胞的活力,如Yu等人(2014)中所述2,将雄激素敏感性前列腺腺癌细胞(LNCaP)或衍生自乳腺癌患者的细胞系按300,000个细胞/mL加标至全血中。处理用于成像流式细胞术的稀有细胞遵循与上文对白细胞活力所述的相同程序,以下例外:PE缀合的EpCAM(1:250,克隆VU1D9,Cell Signaling Technologies)。对于WBC活化组,将6μl全血与194μl Hepes和如下的荧光标记抗体组合:Pacific Blue缀合的CD41(1:100;克隆HIP8;Biolegend)、Alexa Fluor 488缀合的CD11b(1:500;克隆ICF;Stemcell Technologies)、PE缀合的CD11a(1:20;克隆38;Abd Serotec)、PE-cf594缀合的CD45(1:800;克隆HI30,BD Pharmingen)、DRAQ5(1:1000;Life Technologies)。
凝集测定
冻干的胶原蛋白(可溶性牛犊皮肤)、凝血酶和利托菌素(ristocetin)从Chrono-Log Corporation(Havertown,PA)获得并且使用无菌蒸馏水复原(reconstitute)。聚集实验在全血中使用电阻抗在两通道Chrono-Log 700系列全血/光学发光凝集测定仪上进行并使用AGGRO/LINK8软件分析。在以搅拌棒速度为1200转/分钟的情况下添加激动剂之后,将全血在37℃温育5分钟并且每份样品测试10分钟。胶原蛋白、利托菌素和凝血酶的激动剂浓度分别是2ug/mL、1mg/mL、1单位/mL。采集的数据包括最大聚集(%)、聚集曲线斜率、在6分钟时的曲线下面积以及在添加激动剂和聚集启动之间的消逝时间(延迟相)。
微流体分离加标循环型肿瘤细胞
用血小板抑制剂处理血液样品和储存条件。
将培养的肿瘤细胞系(衍生自乳腺癌患者的VCaP、LNCaP或CTC系)按2000-3000个细胞/毫升血液加标至健康供体血液样品中。此后,将血液样品分成适宜的体积并且用血小板抑制剂替罗非班(0.5或1μg/mL)或依替巴肽(20μg/mL)处理,之后将它们立即地储存或继续进行微流体处理。将样品在室温或4℃、遮光和不摇动的情况下储存。血小板抑制剂混合物包含在微流体处理前15分钟添加至血液样品的EDTA(2-5mM)。每种实验条件处理5-6mL血液样品。
使用CTC-iChip的微流体分选
使用先前公开的CTC-iChip(Ozkumur等人,2013.Sci.Transl.Med.5(179):179ra471;Karabacak等人,2014.Nat.Protoc.9(3):694–710)连同进一步增强通量和纯度的轻微修改,进行加标肿瘤细胞的分离。简而言之,将加标的全血与生物素化(biotinylated)的CD45抗体、CD66b抗体和CD16抗体温育,随后添加链霉亲和素偶联的Dyna珠(Invitrogen),之后,将它装入加压的注射器以便在CTC-iChip中处理。在iChip中,血液首先穿过一个移除大型聚集物的过滤阵列并且随后到达基于尺寸移除血浆、血小板和红细胞的流体动力分选台。富集的有核细胞随后排列成单行,从而通过磁泳(magnetophoresis)有效耗尽Dyna珠靶向的白细胞。最后,富集的肿瘤细胞历经移除残余血小板和红细胞的第二个流体动力分选阵列。随后在产物出口中,在含有1%普兰尼克(Pluronic)的PBS缓冲液中收集剩下的高度富集的肿瘤细胞。根据公开的方案(Karabacak等人,2014.Nat.Protoc.9(3):694–710)进行加标细胞的计数和白细胞的残余。
iChip处理后循环型肿瘤细胞系的体外培养
萤光素酶标记的乳腺CTC系用于定量细胞生长(Yu等人,2014.Science.345(6193):216–20)。将血液样品用3000个CTC/mL血液加标,并且用iChip处理6mL血液。随后将富集的CTC产物慢速旋转(spun down),重悬于2mL CTC培养基(Yu等人,2014)中,并且在低黏附24孔板中按每孔500uL培养(总计4孔)。在分析当日,根据制造商的方案,使用Bright-Glo萤光素酶测定系统(Promega)确定来自该孔的400uL细胞和活细胞数目。使用SpectraMax M5微量平板读数仪(Molecular Devices)测量发光信号。作为阳性对照,直接培养来自相同CTC系的细胞并用相同方法测定,在血液或iChip分选时无任何加标过程。将这些细胞在500uL介质中调节至4500个细胞并且在相同平板中培养。
RNA提取和RNA品质评估
在选择性裂解RBC后,使用标准方案从WBC提取总RNA。简而言之,将1体积血液与5体积EL缓冲液(QIAGEN)组合,在冰上温育15分钟,涡旋混合,离心(400x g,10分钟,4℃),并且移除上清液。WBC重悬于250μl PBS(每1mL起始血液)中并且与750μlLS试剂组合。在室温温育5分钟后,添加200μl氯仿并剧烈涡旋混合,伴以室温间断温育。将样品以12,000x g离心15分钟(4℃)并移除水层,之后用100%异丙醇沉淀。最后,将样品以12,000x g离心10分钟(4℃)并将沉淀物(pellet)用75%乙醇洗涤,风干和重悬于TE缓冲液中。通过在260nm下在分光光度计上读取吸光度,使用在260/280nm的吸光度比率作RNA纯度指标(A260/280比率=1.8-2),确定RNA浓度。使用Bioanalyzer和RNAPico试剂盒(Agilent Technologies),按照标准方案确定RNA品质和RIN值。
实施例3.1作为温度函数的血小板活化
在各种温度测试血小板以理解冷储存和血小板活化之间的关系。还进行这些实验以鉴定藉此可以使血小板活化最小化而最大限度保留全血组分的最佳储存温度。
图10中展示的数据显示,血小板的冷诱导活化(如%PAC-1活化所佐证,左图)与两种表面蛋白(CD62/p-选凝素和GPIIa/IIIa)相关,并且血小板活化的最大变化出现在37℃和22℃之间。
实施例3.2多种血小板抑制剂的优化/选择
假设上文鉴定的表面标记物(CD62/p-选凝素和GPIIa/IIIa)在阻塞CTC-iChip微流道的血小板聚集物中发挥至关重要作用。CD62/p-选凝素与脱粒(导致周围血小板的补充(recruitment)和活化的过程)相关;提示抑制将妨碍信号传导至附近血小板并且使信号放大最小化。另外,活化的GPIIb/IIIa和CD62/p-选凝素介导了血小板-血小板、血小板-白细胞和血小板-CTC相互作用,并且与微流体装置本身相互作用,导致不当的细胞分选、阻塞和缓慢流量。因此,我们检验了一系列血小板抑制剂,包括替罗非班(Sigma)、依替巴肽(Tocris)、氯吡格雷(Sigma)和KF38789(Tocris)。
图11中提出的数据显示渐增剂量的血小板抑制剂本身可以造成血小板活化,并且渐增剂量的血小板抑制剂可以增加血小板-白细胞相互作用的量。此外,血小板抑制剂和活化的剂量反应呈温度依赖性。在检验的血小板抑制剂当中,替罗非班显示最有前景的结果,而冷处理的血小板在0.01-0.5ug/mL的剂量活化最少。
实施例3.3无毒血小板抑制剂混合物
我们测量在全血冷储存或室温储存72小时后的、优化血小板抑制剂混合物(含有0.1-0.5ug/mL和2-5mM EDTA)对活化标记物表达和血小板功能的影响。图12A-I中提供数据。PAC-1表达(GPIIa/IIIa的活性形式)在冷储存的血液中增强并且这可以用我们的血小板抑制剂混合物逆转(12A、12C)。CD62P表达在储存期间增强,但是血小板抑制剂混合物未逆转细胞表面表达(图12B、12C)。尽管未逆转CD62P细胞表面表达,但血小板抑制剂混合物可以完全逆转血小板-白细胞相互作用,特别地对于粒细胞群体是这样,并且血小板抑制剂混合物完全抑制血小板聚集/功能(图12D-I)。
实施例3.4冷保存期间保留RBC形态
在血液采集数小时内,血液中观察到毛刺状球形红细胞–称作棘红细胞。棘红细胞常在离体血液样品观察到并且为细胞应激的指标。棘红细胞为依赖于细胞特定尺寸、形状和挠性以实现高效快速分选的微流体应用带来主要的混乱(complications)。由于红细胞占99%的血液容量,这些结构性变化显著地干扰CTC分离时的微流体过程,因为这些球状棘红细胞在流体动力细胞分选平台中像有核细胞一样偏转。
如图13中所示,比较冷储存与室温储存全血长达72小时,冷储存可以保留多达80%RBC的形态。另外,添加血小板抑制剂混合物(替罗非班加EDTA)未对棘红细胞形成造成任何有害作用。
实施例3.5冷储存期间的WBC活化
鉴于冷储存对血小板活化的影响,我们还测量了冷储存对WBC活化的影响。数据显示,与室温储存相比,冷储存时WBC活化减少。此外,添加血小板抑制剂混合物(替罗非班加EDTA)不活化WBC。在健康供体和癌症患者中均观察到这些趋势。参见图14。
实施例3.6 72小时冷储存期间WBC活力的保留
使用成像流式细胞术,我们利用活染液(钙黄绿素蓝)和死染液(胱天蛋白酶3/7),测量冷储存的WBC与室温储存的WBC的活力。图15中展示的结果显示,冷储存的WBC的活力比室温储存的血液更好。添加血小板抑制剂混合物不影响WBC活力。
实施例3.7 72小时冷储存期间WBC RNA完整性的保留
尽管WBC活力在冷储存时增强(实施例3.6,图15),我们还测量了储存血液的RNA完整性。由于RNA最敏感的生物材料之一,我们将此视为稳健的保存标记物。结果显示,在48小时储存时,室温储存和冷储存的血液的RNA完整性相似,并且在72小时储存后,冷储存的RNA保持完整,而室温储存的血液严重变质。
实施例3.8冷储存期间的LNCaP活力
使用成像流式细胞术,我们利用活染液(钙黄绿素蓝)和死染液(胱天蛋白酶3/7),测量冷储存的稀有癌细胞与室温储存的稀有癌细胞的活力。数据显示(参见图16),冷储存的稀有细胞的活力可能比室温储存的血液更好。添加血小板抑制剂混合物不影响稀有细胞活力。在健康供体和癌症患者中观察到这些趋势。
实施例3.9通过CTC-iChip处理冷储存的血液
血小板抑制剂令CTC-iChip处理新鲜血液和低温4℃下储存3天的血液成为可能。这里,所用的血小板抑制剂(PI)是0.5μg/mL替罗非班或1μg/mL替罗非班+依替巴肽20μg/mL。在iChip处理之前15分钟添加EDTA(2-5mM)至血液样品。结果显示以下:
在血小板抑制剂不存在的情况下或因室温(RT)储存72小时所致的iChip阻塞在过滤阵列的第一阶段导致严重阻塞。图17A中的图像显示借助Vybrant DyeCycle Green(Life Technologies)的DNA荧光染色,这说明细胞捕集在阻塞物中。比例尺表示100μm。
iChip阻塞导致可以处理的血液量大幅度下降;参见图17B。该图表说明了作为目标容量(5-6mL)百分数的经处理的血容量。在血小板抑制剂和EDTA存在下,可以处理约90%的血液容量;残余容量损耗归因于样品转移和管路中的死体积并且在微流体芯片中是标准的。
阻塞还严重减少CTC-iChip的流量或通量(图17C)。
图17D中显示基于实际处理容量计算的、iChip分选后加标的细胞回收率。在血小板抑制剂不存在的情况下或在室温储存后,相当部分的加标细胞损失并且在富集的产物中不可回收。注意,该回收百分数仅基于处理的血液容量,所述处理的血液容量在(17B)中所示的芯片阻塞情况下大幅度降低。CTC绝对回收率因此低得多并且可以依据回收百分数×处理的容量计算。
图17E中显示iChip耗尽白细胞的对数转换倍数。耗尽越高,富集的CTC群体越纯。为了理解数字,4个对数耗尽转换成10000倍耗尽,这意指含有5×106个白细胞/mL血液的常见血液样品将在富集的CTC产物仅留下500个白细胞/mL处理的血液。血小板抑制剂和EDTA的使用明显地改善耗尽,假定通过阻止血小板-白细胞相互作用(图12)并因而允许白细胞-耗尽抗体抵达做到这点。在室温储存72小时的血液还出现低耗尽,可能因白细胞降解所致(图15)。
图17F显示进入CTC产物的红细胞(RBC)残余/μL血液。室温储存的血液样品显示假定因RBC降解所致的较高RBC残余,所述较高RBC残余改变棘红细胞的形状和形式(图13)并且不能在iChip的流体动力分选阶段中有效移除。
实施例3.10 iChip分选后培养CTC
使用Bright-Glo萤光素酶测定体系,依据发光量对细胞生长定量。将发光信号对作为iChip处理后立即启动培养之日时的第0日的信号归一化。包括不进行任何iChip处理的阳性对照。
如图18中所示,在血小板抑制剂存在下,分选自新鲜血液样品的CTC(0小时)显示几乎与阳性对照相同的生长速率,从而提示微流体处理和血小板抑制剂和EDTA处理对CTC无毒。在加标的血液样品在4℃储存72小时后,可以将CTC分选和体外再培养,尽管有再启动增殖的轻微延迟。如与4℃储存的CTC相比,从室温储存72小时的血液样品获得的CTC显示分选后增殖能力降低。
参考文献
1.Toner M,Irimia D.2005.Blood-on-a-chip.Annu.Rev.Biomed.Eng.7:77–103
2.Cheng X,Irimia D,Dixon M,Sekine K,Demirci U,et al.2007.A microfluidic device for practical label-free cd4(+)t cell counting of hiv-infected subjects.Lab Chip.7(2):170–78
3.Zhu H,Stybayeva G,Macal M,Ramanculov E,George MD,et al.2008.A microdevice for multiplexed detection of t-cell-secreted cytokines.Lab Chip.8(12):2197–2205
4.Kotz KT,Xiao W,Miller-Graziano C,Qian W-J,Russom A,et al.2010.Clinical microfluidics for neutrophil genomics and proteomics.Nat.Med.16(9):1042–47
5.Stephens M,Talary MS,Pethig R,Burnett AK,Mills KI.1996.The dielectrophoresis enrichment of cd34+cells from peripheral blood stem cell harvests.Bone Marrow Transplant.18:777–82
6.Huang R,Barber T a,Schmidt M a,Tompkins RG,Toner M,et al.2008.A microfluidics approach for the isolation of nucleated red blood cells(nrbcs)from the peripheral blood of pregnant women.Prenat.Diagn.28(10):892–99
7.Nagrath S,Sequist L V,Maheswaran S,Bell DW,Irimia D,et al.2007.Isolation of rare circulating tumour cells in cancer patients by microchip technology.Nature.450(7173):1235–39
8.Maheswaran S,Sequist L V,Nagrath S,Ulkus L,Brannigan B,et al.2008.Detection of mutations in egfr in circulating lung-cancer cells.N.Engl.J.Med.359(4):366–77
9.Hardwick J.2008.Blood processing.ISBT Sci.Ser.3:148–76
10.Huestis DW,Glasser L.1994.The neutrophil in transfusion medicine.Transfusion.34(7):630–46
11.Arrington PJ,McNamara JJ.1975.Effect of agitation on platelet aggregation and microaggregate formation in banked blood.Ann.Surg.181(2):243–44
12.Gervin AS,Mason KG,Buckman RF.1978.The effect of agitation of stored human blood on microaggregate formation.Transfusion.
18(1):73–78
13.Miyamoto M,Sasakawa S.1987.Studies on granulocyte preservation.iii.effect of agitation on granulocyte concentrates.Transfusion.27(2):165–66
14.Afonso G,Scotto M,Renand A,Arvastsson J,Vassilieff D,et al.2010.Critical parameters in blood processing for t-cell assays:validation on elispot and tetramer platforms.J.Immunol.Methods.359(1-2):28–36
15.Brown CH,Leverett LB,Lewis CW,Alfrey CP,Hellums JD.1975.Morphological,biochemical,and functional changes in human platelets subjected to shear stress.J.Lab.Clin.Med.86(3):462–71
16.Reimers RC,Sutera SP,Joist JH.1984.Potentiation by red blood cells of shear-induced platelet aggregation:relative importance of chemical and physical mechanisms.Blood.64(6):1200–1206
17.Fuchs T a,Alvarez JJ,Martinod K,Bhandari A a,Kaufman RM,Wagner DD.2013.Neutrophils release extracellular dna traps during storage of red blood cell units.Transfusion.53(12):3210–16
18.Fuchs T a,Abed U,Goosmann C,Hurwitz R,Schulze I,et al.2007.Novel cell death program leads to neutrophil extracellular traps.J.Cell Biol.176(2):231–41
19.Klopfleisch R,Weiss a T a,Gruber a D.2011.Excavation of a buried treasure--dna,mrna,mirna and protein analysis in formalin fixed,paraffin embedded tissues.Histol.Histopathol.26(6):797–810
20.Chien S,Usami S,Dellenback RJ,Gregersen MI,Nanninga LB,Guest MM.1967.Blood viscosity:influence of erythrocyte aggregation.Science.157(3790):829–31
21.Lowe GD.1987.Blood rheology in vitro and in vivo.Baillieres.Clin.Haematol.1(3):597–636
22.Neu B,Meiselman HJ.2002.Depletion-mediated red blood cell aggregation in polymer solutions.Biophys.J.83(5):2482–90
23.Armstrong JK,Wenby RB,Meiselman HJ,Fisher TC.2004.The hydrodynamic radii of macromolecules and their effect on red blood cell aggregation.Biophys.J.87(6):4259–70
24.Jan KM,Usami S,Chien S.1982.The disaggregation effect of dextran 40 on red cell aggregation in macromolecular suspensions.Biorheology.19(4):543–54
25.Toth K,Wenby RB,Meiselman HJ.2000.Inhibition of polymer-induced red blood cell aggregation by poloxamer 188.Biorheology.37(4):301–12
26.Neu B,Armstrong JK,Fisher TC,Meiselman HJ.2001.Aggregation of human rbc in binary dextran-peg polymer mixtures.Biorheology.
38(1):53–68
27.H,Gaehtgens P,Hirsch H.1968.On the shear rate dependence of red cell aggregation in vitro.J.Clin.Invest.47(6):1447–54
28.Bergan JJ.1965.Low molecular weight dextran in treatment of severe ischemia.Arch.Surg.91(2):338
29.Orringer EP,Casella JF,Ataga KI,Koshy M,Adams-Graves P,et al.2001.Purified poloxamer 188 for treatment of acute vaso-occlusive crisis of sickle cell disease:a randomized controlled trial.JAMA.
286(17):2099–2106
30.Ozkumur E,Shah AM,Ciciliano JC,Emmink BL,Miyamoto DT,et al.2013.Inertial focusing for tumor antigen-dependent and-independent sorting of rare circulating tumor cells.Sci.Transl.Med.5(179):179ra47
31.Brinkmann V,Zychlinsky A.2012.Neutrophil extracellular traps:is immunity the second function of chromatin?J.Cell Biol.198(5):773–83
32.Brill A,Fuchs TA,Savchenko AS,Thomas GM,Martinod K,et al.2012.Neutrophil extracellular traps promote deep vein thrombosis in mice.J.Thromb.Haemost.10(1):136–44
33.Garcia-Romo GS,Caielli S,Vega B,Connolly J,Allantaz F,et al.2011.Netting neutrophils are major inducers of type i ifn production in pediatric systemic lupus erythematosus.Sci.Transl.Med.3(73):73ra20
34.Thomas GM,Carbo C,Curtis BR,Martinod K,Mazo IB,et al.2012.Extracellular dna traps are associated with the pathogenesis of trali in humans and mice.Blood.119(26):6335–43
35.Yu M,Stott S,Toner M,Maheswaran S,Haber D a.2011.Circulating tumor cells:approaches to isolation and characterization.J.Cell Biol.192(3):373–82
36.Nicholson JK,Jones BM,Cross GD,McDougal JS.1984.Comparison of t and b cell analyses on fresh and aged blood.J.Immunol.Methods.73(1):29–40
37.De Rose R,Taylor EL,Law MG,Van Der Meide PH,Kent SJ.2005.Granulocyte contamination dramatically inhibits spot formation in aids virus-specific elispot assays:analysis and strategies to ameliorate.J.Immunol.Methods.297(1-2):177–86
其他实施方案
应当理解尽管已经将本发明结合其发明详述加以描述,但前述说明书意在说明并且不意在限制本发明的范围,所述范围由所附权利要求书的范围限定。其他方面、优点和修改处于所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!