微流控微滴检测和分选的制作方法
本发明涉及微流控领域,并且具体涉及用于检测微流控微滴(microfluidicdroplet)和微滴内的颗粒,以及分选微滴的方法。这些方法允许量化微滴内颗粒的特性和活动。为此,本发明提供了包含适当标记的颗粒的微流控微滴。本发明还提供了微流控装置和系统,其具有使其特别适用于本发明的方法的特性。
背景技术:
基于微滴的微流控具有用于高通量筛选应用的巨大潜力。将单细胞包封在微滴中允许以非常高的通量(例如,达每天数十万个样品)筛选细胞产物如抗体。例如,可以将单个抗体分泌细胞(例如,杂交瘤细胞或b细胞)和目标重组药物靶标(例如酶)一起包封在微滴中。然后添加酶的荧光底物将揭示哪些微滴包含释放抑制酶活性的抗体的细胞并促进这些抗体的特异性分选。然而,对于许多筛选应用,共包封(除抗体分泌细胞之外)另外的报道细胞而非重组酶将是非常有用的。该报道细胞可以根据抗体的期望效果例如在g蛋白偶联受体(gpcr)的抗体结合时刺激或抑制细胞途径,调节荧光信号(例如,在微滴中可以容易地检测的报道酶的表达;如β-gal)。gpcr是大多数最畅销药物和所有处方药物中约40%的靶标。
这种筛选的关键步骤是产生容纳这两种细胞类型的微滴,优选以单细胞水平产生。非确定性细胞包封受到泊松统计学的限制,意味着每个微滴的细胞数量显著变化。已经描述了替代的确定性包封方法,然而,直到今天尚未证明两种不同细胞类型的可靠共包封,尤其是不以单细胞水平。因此,在微滴中几乎不能进行需要以单细胞水平共包封两种不同细胞类型(如药物筛选所需的;例如,分泌抗体的一个b细胞和指示抗体对细胞靶标的作用的另外的报道细胞)的基于细胞的测定。这是因为每个微滴中的细胞占据率(occupancy)不能被严格控制的事实,包括抗体结合测定所需的细胞和珠的受控共包封。此外,抗体结合的定量分析是具有挑战性的,因为珠(和与其结合的任何荧光标记对象)可以浮出焦平面和/或浮出激光点的中心(具有最高强度)。
为了克服这些限制,本发明人开发了新的分选装置和分选方法,其允许选择任何期望微滴占据率的微滴,包括存在两种不同的细胞类型如抗体分泌细胞(或任何其他“效应细胞”)和报道细胞。此外,他们开发了一种系统,更具体地说是微滴中的结合配偶体(bindingpartner)的一种特定标记方法,其允许即使目标对象在焦平面之外或在最强激光点之外,也能够进行定量结合测定。总之,这将在药物筛选和抗体探索方面有多种应用,具有年销售额超过500亿美元的市场。
技术实现要素:
在第一方面,本发明涉及微流控微滴,其包含与一定量的第一可检测标记相关联的单第一颗粒和与一定量的第二可检测标记相关联的潜在颗粒结合配偶体,其中第一可检测标记的量是已知的和/或基本上等同于与包含在另外的微流控微滴中的另外的单颗粒相关联的第一可检测标记的量。
在第二方面,本发明涉及用于量化将根据第一方面的微流控微滴中的颗粒与潜在颗粒结合配偶体之间结合的方法,其包括以下步骤:
(i)测量第一可检测标记的信号,
(ii)测量第二可检测标记的信号,以及
(iii)使用第一可检测标记的信号将第二可检测标记的信号归一化,
其中第二可检测标记的归一化信号表示颗粒与潜在颗粒结合配偶体之间的结合的量。
在第三方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的方法,其包括以下步骤:
(a)将包含一种或更多种颗粒的微流控微滴进料到包含检测点的检测通道中,
(b)相比于具有球形形状时的同一微流控微滴,至少在检测通道中的检测点处限制微流控微滴内颗粒的至少垂直移动,以及
(c)在检测点处检测包含在微流控微滴中的至少一种颗粒。
在第四方面,本发明涉及微流控微滴群,其中大于50%的微流控微滴各自包含至少两种类型的单颗粒,特别地至少两种细胞类型的单细胞(即,两种单细胞各自为不同的细胞类型)。
在第五方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的微流控装置,其包含具有检测点的检测通道,特征在于,所述装置被设计成使得相比于具有球形形状时的同一微流控微滴,至少在检测点处的检测通道中限制或可以限制微流控微滴内颗粒的至少垂直移动。
在第六方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的微流控装置,其包含具有检测点的检测通道,特征在于其包含在检测通道下游的分选通道,所述分选通道具有用于基于所检测颗粒的信号来分离微流控微滴的分选接合部(junction),其中分选接合部与检测点之间的距离为500μm或更小,优选小于球形微流控微滴的直径的10倍。
在第七方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的微流控装置,其包含具有检测点的检测通道,特征在于其包含在检测通道下游的分选通道,所述分选通道具有用于基于所检测颗粒的信号来分离微流控微滴的分选接合部,其中所述装置的分选通道和/或检测通道在检测点的下游、分选接合部的上游弯折(kink)或具有弯曲部(bend)。
在第八方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的微流控装置,其包含具有检测点的检测通道,特征在于其包含在检测通道下游的分选通道,所述分选通道具有用于基于所检测颗粒的信号来分离微流控微滴的分选接合部,其中所述装置还包含用于将流体注入到分选通道中的在分选接合部上游且在检测点下游的一个或更多个流体入口。
在第九方面,本发明涉及微流控系统,其包含:
-根据第五方面、第六方面、第七方面和/或第八方面的微流控装置,和
-检测装置,其用于在检测点处检测包含在检测通道中微流控微滴中的至少一种颗粒。
在第十方面,本发明涉及本发明的微流控微滴、装置和系统用于本发明方法的用途。
附图说明
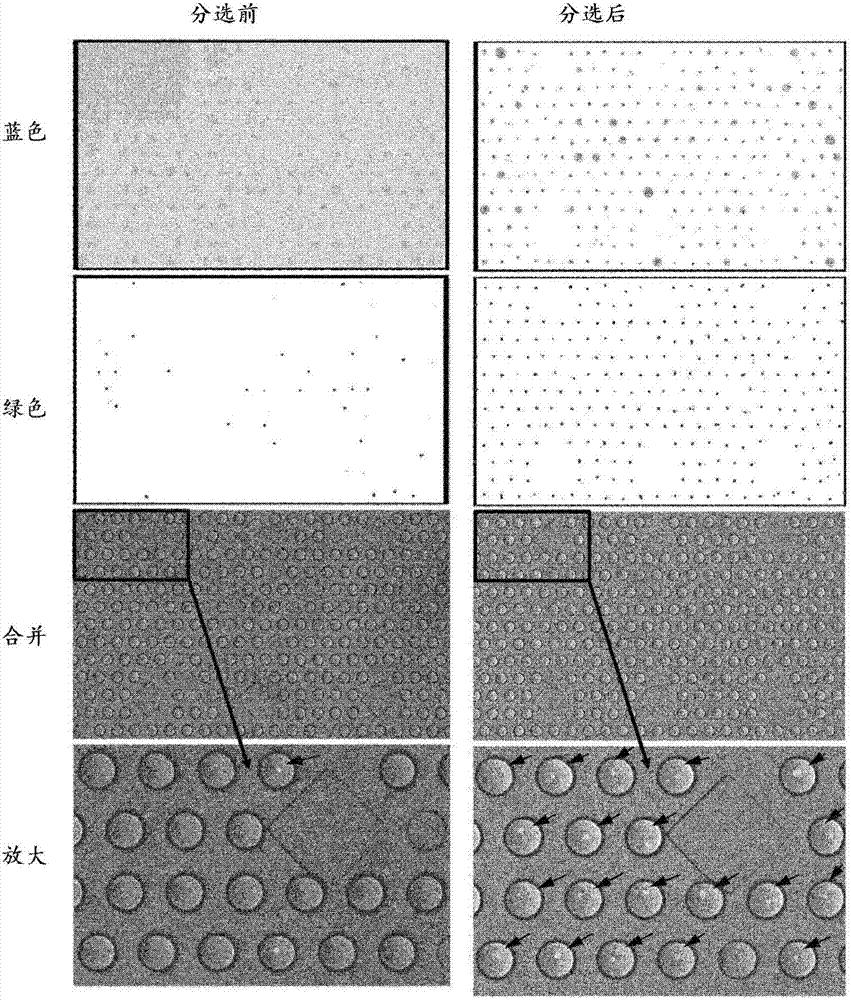
图1:两种不同细胞类型的共包封。a)通过用荧光染料染色可以实现容纳各类型正好一种细胞的微滴的主动分选。在包封之前,用不同的荧光染料(例如,钙黄绿素-am-蓝和钙黄绿素红-橙)染色每种细胞类型。在形成微滴之后,对显示双阳性荧光信号的样品进行介电泳分选(dielectrophoreticsorting)。仅将这些微滴用于下游筛选过程(使用绿色通道中的测定信号),如通过芯片外孵育起始并随后再注射到第二微流控装置中。b)使用单色(绿色)染色的空微滴(左)和被占据的微滴(右)的荧光信号。c)显示两个通道中的荧光信号(高峰和低峰)的双阳性样品的荧光信号。
图2:通过分选使容纳两种不同细胞类型的微滴富集。用钙黄绿素-am(在绿色通道中可见)或钙黄绿素-紫罗兰(在蓝色通道中可见)染色杂交瘤细胞。随后,分选在每个荧光通道中显示一个峰的微滴并捕获在第二微流控芯片中。可以观察到在分选之后容纳这两种类型细胞的微滴(由箭头指示)的明显富集。
图3:新分选芯片的设计。为了在测量包封在微滴中的颗粒/细胞的荧光时提高灵敏度,与常规的分选装置相比,增加了多个特征。虽然之前描述的微滴分选器足够大以处理100μm的微滴(如培养真核细胞所需的),但是当使用40倍物镜(顶部的内矩形)时,检测点和分选分路器(divider)不在同一视场中。然而,新开发的分选芯片(下图)是这种情况。为了实现非常紧凑的设计,使分选电极和分选通道相对于检测通道倾斜45°。此外,与该设计的其余通道相比,检测通道更窄且更浅(右下图)。这样,微滴在y轴和z轴上被压缩,从而限制被包封的颗粒/细胞的空间自由度。此外,检测点与分选分路器之间的附加进油口允许微调微滴在分选接合部的轨道。
图4:使检测通道与分选通道成45°角的优点。在通常的分选配置(左图)中,当使用灵敏度测量所需的高放大倍数时,检测点(白色)与分选接合部之间的距离(d)不在同一视场中(矩形)。这导致非常难以调整所有分选参数(例如,流量,电、声或光学脉冲的持续时间,或者开阀次数)以进行可靠的分选。相反地,如果分选通道相对于检测点以一定角度布置(右图),则所有相关特征都在同一视场中。注意,在这两种情况下,距离d(如黑线所示)是相同的。
图5:荧光颗粒在微滴中的位置对测量的荧光强度的影响。即使在使用具有相同数量荧光团的荧光颗粒(例如,结合的绿色荧光标记的抗体)时,测量的荧光信号也可以变化。例如,如果颗粒在焦平面之外(左上,2),则与在焦平面内的颗粒(1)相比,荧光峰(右上)更弱。对于在激光聚焦中心之外的颗粒也是如此(中图)。然而,通过对珠使用第二荧光颜色(例如,橙色荧光染料;由下图中的箭头和/或标记“b”指示)可以克服该问题:虽然各种颜色仍然随珠在微滴内的位置而变化,但是归一化信号(例如,绿色/橙色)不会,或者至少程度低得多。这样,可以定量地测量结合的绿色抗体的数量,而与珠在微滴内的位置无关。
图6:荧光信号的归一化。为了证明该方法的可行性,仅用钙黄绿素绿或额外地还用钙黄绿素-蓝染色细胞。当相对于彼此绘制各个荧光通道的信号时(上图),不同的群变得可见(下图):仅用绿色染料染色的细胞显示出强烈变化的强度,这是由其在微滴内的任意位置引起的(右侧,虚线椭圆)。然而,所有双重染色细胞都位于直线上(右侧,实线椭圆),意味着其归一化信号几乎相同。
图7:fluoresbrite珠信号的归一化。a/b)当仅对单荧光通道(例如,绿色范围(a)或蓝色范围(b))进行分析时,微滴中的6μmfluoresbrite珠显示出非常宽的荧光强度分布(由黑色箭头指示),原因是珠在微滴内自由浮动。c)当以蓝色信号归一化绿色信号时,可以使珠浮在微滴内的影响最小化(由白色箭头指示)。
具体实施方式
在下面详细描述本发明之前,应理解,本发明不限于本文描述的特定方法、方案和试剂,因为这些可以改变。还应理解,本文使用的术语仅用于描述特定实施方案的目的,并不旨在限制本发明的范围,本发明的范围仅由所附权利要求限制。除非另外定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的相同的含义。
优选地,本文使用的术语如“amultilingualglossaryofbiotechnologicalterms:(iupacrecommendations)”,leuenberger,h.g.w,nagel,b.和
在本说明书的整个文本中引用了多个文件。无论在上文还是在下文,本文引用的每个文件(包括所有专利、专利申请、科学出版物、制造商的具体说明、说明书等)都通过引用整体并入本文。本文中任何内容均不解释为承认本发明无权先于在先发明的这些公开内容。
在下文中,将描述本发明的要素。这些要素与具体实施方案一起列出,然而,应理解,它们可以以任何方式和任何数量组合以产生另外的实施方案。描述的多个实例和优选实施方案不应被解释为将本发明仅限于明确描述的实施方案。本说明书应理解为支持并包括将明确描述的实施方案与任何数量的所公开和/或优选的要素组合的实施方案。此外,除非上下文另外指明,否则本申请中所有描述的要素的任何排列和组合都应视为被本申请的说明书公开。
在整个说明书和所附权利要求书中,除非上下文另有要求,否则词“包括”及变体如“包含”和“含有”应理解为暗指包括所述整体或步骤或者整体或步骤的组,但不排除任何其他整体或步骤或者整体或步骤的组。如本说明书和所附权利要求中所使用的,除非内容另有明确规定,否则单数形式包括复数对象。
在第一方面,本发明涉及微流控微滴,其包含与一定量的第一可检测标记相关联的单第一颗粒和与一定量的第二可检测标记相关联的潜在颗粒结合配偶体,其中第一可检测标记的量是已知的和/或基本上等同于与包含在另外的微流控微滴中的另外的单颗粒相关联的第一可检测标记的量。
优选地,第二可检测标记的量也是已知的和/或对于所有潜在颗粒结合配偶体基本上是相同的。
术语“微流控微滴”是指包封水性液体的一定尺寸的水性微区室。微流控微滴的尺寸通常表示为微滴为球形形状时的直径。直径通常在20μm与400μm之间,优选在30μm与350μm之间、在40μm与300μm之间、在40μm与250μm之间、在40μm与200μm之间或在40μm与100μm之间(其中各个较窄的范围优于前述较宽的范围,并且“在...之间”包括所提到的值)。在一个优选的实施方案中,微流控微滴的直径在微滴中最大颗粒(例如,第一颗粒或另外的颗粒)的直径的2与20倍之间,优选在3与18倍之间、在4与16倍之间、或在5与14倍之间或在6与12倍之间(其中各个较窄的范围优于前述较宽的范围,并且“在...之间”包括所提到的值)。优选地,微滴的直径由上述绝对和相对参数两者限定。例如,直径为:
(i)在20μm与400μm之间、在30μm与350μm之间、在40μm与300μm之间、在40μm与300μm之间、在40μm与250μm之间、在40μm与200μm之间或在40μm与100μm之间,并且在微滴中最大颗粒(例如,第一颗粒或另外的颗粒)的直径的2与20倍之间,
(ii)在20μm与400μm之间、在30μm与350μm之间、在40μm与300μm之间、在40μm与300μm之间、在40μm与250μm之间、在40μm与200μm之间或在40μm与100μm之间,并且在微滴中最大颗粒(例如,第一颗粒或另外的颗粒)的直径的4与16倍之间,或者
(iii)在20μm与400μm之间、在30μm与350μm之间、在40μm与300μm之间、在40μm与300μm之间、在40μm与250μm之间、在40μm与200μm之间或在40μm与100μm之间,并且在微滴中最大颗粒(例如,第一颗粒或另外的颗粒)的直径的6与12倍之间。
或者,微流控微滴的尺寸也可以由体积限定。例如,其通常小于1微升(μl)。优选地,其小于500纳升(nl)、小于250nl、小于150nl、小于100nl或小于50nl。在一个优选的实施方案中,其在0.05nl与150nl之间,优选在0.05nl与125nl之间、在0.05nl与100nl之间、在0.05nl与80nl之间或在0.05nl与4nl之间(其中各个较窄的范围优于前述较宽的范围,并且“在...之间”包括所提到的值)。
可获得很多种的区室化或微胶囊化方法(benita,s.著(1996).microencapsulation:methodsandindustrialapplications.drugsandpharmaceuticalsciences.swarbrick,j.编辑.newyork:marceldekker)并且可以用来形成根据本发明使用的微流控微滴。事实上,文献中已经确定了多于200种微胶囊化或区室化方法(finch,c.a.(1993)encapsulationandcontrolledrelease.spec.publ.-r.soc.chem.138,35)。这些包括膜包封的水性囊泡如脂质囊泡(脂质体)(new,r.r.c.著(1990).liposomes:apracticalapproach.thepracticalapproachseries.rickwood,d.&hames,b.d.编辑.oxford:oxforduniversitypress)和非离子表面活性剂囊泡(vanhal,d.a.,bouwstra,j.a.&junginger,h.e.(1996).nonionicsurfactantvesiclescontainingestradiolfortopicalapplication.inmicroencapsulation:methodsandindustrialapplications(benita,s.著),第329至347页.marceldekker,newyork.)。优选地,本发明的微区室由乳液形成;两个不混溶液相的非均相体系(其中一个相分散在另外的相中)形成作为微观尺寸的微滴(becher,p.(1957)emulsions:theoryandpractice.reinhold,newyork;sherman,p.(1968)emulsionscience.academicpress,london;lissant,k.j.编辑.emulsionsandemulsiontechnology.surfactantsciencenewyork:marceldekker,1974;lissant,k.j.编辑.emulsionsandemulsiontechnology.surfactantsciencenewyork:marceldekker,1984)。乳液可以由不混溶液体的任何合适组合产生。优选地,本发明的乳液具有作为以微滴形式存在的相的水(包含颗粒和其他组分)和作为周围基质(这些微滴悬浮在其中)的疏水性不混溶液体(优选为油)。这样的乳液被称为“油包水”。这有这样的优点,水相被以离散的微滴区室化。外相,优选地为疏水性油,通常是惰性的。可以通过添加一种或更多种表面活性试剂(表面活性剂)来使乳液稳定。这些表面活性剂在水/油界面处起作用以防止(或至少延迟)相的分离。可以使用许多油和许多乳化剂来产生油包水乳液;最近的汇编列出了超过16,000种表面活性剂,其中许多被用作乳化剂(ash,m.和ash,i.(1993)handbookofindustrialsurfactants.gower,aldershot)。合适的油在下面列出。
优选地,在微流控系统中产生、处理和/或控制水性微区室。该技术基于对连续液体流动通过微制造通道的操作。液体流动的驱动可以通过外部压力源、外部机械泵、集成机械微型泵或者通过毛细管力与电动机制的组合来实现。可以用基于mems技术的高灵敏度微流控流动传感器实现连续流动系统中的过程监测能力,所述传感器提供低至纳升范围的分辨率。
微流控装置通常由直径为约十微米至几百微米的通道网络组成,其中可以以特定顺序注入少量试剂、混合并孵育一段特定时间。通过使用阀(夹断通道的特定区域)或两相微流控(其中被不混溶油相包围的水性微滴充当封闭容器)产生独立的区室,可以使测定高度并行化。这些方法能够显著降低测定体积(皮升至纳升),并大大改善通量。例如,可以以每秒大于1,000个的速率产生微滴。此外,已经开发了用于以相似速率分开、融合和分选微滴的微流控模块,从而提供了模拟经典实验规模(benchtop)程序的操作库。
在一个优选的实施方案(适用于本文的所有方面)中,装置特别是通道足够大以处理包含真核细胞的微滴。换句话说,装置特别是通道足够大以处理本文所述尺寸的微滴,特别是100μm微滴。
因此,本文所述的微区室也称为“微流控微滴”,例如油包水乳液的“微流控微滴”(schaerli和hollfelder,thepotentialofmicrofluidicwater-in-oildropletsinexperimentalbiology.molbiosyst(2009),第5卷(12),第1392至404页)。
“不混溶液体”优选为疏水性液体,优选为油。油相应允许微区室相对于聚结是稳定的,具有接近于水的粘度和/或相对于其中包含的生物试剂是惰性的。可以使用多种油。低粘度硅油溶胀。聚二甲基硅氧烷也称为pdms或二甲聚硅氧烷。pdms是广泛用于制造微流控芯片的聚合物,并且其是矿物有机聚合物(含有硅氧烷家族的碳和硅的结构),可以改变微流控通道的截面尺寸,并且如果发生溶胀其会影响微流控装置的流动特性。硅油也可以用于以玻璃制造的微流控装置,所述装置对于这些油是不可渗透的。高粘度硅油可以用于pdms装置,pdms装置以显著提高泵送高精度硅油通过微通道所需的压力为代价而具有最小的溶胀。烃油也可以以一定粘度范围获得,并且这样的益处,存在很多它们的可以使油包水乳液稳定的市售表面活性剂。然而,其也使pdms溶胀,并且倾向于表现出被包封有机试剂的较差保留,所述有机试剂通常部分可溶于这些油。用于本发明的方法的优选油是氟碳油(或氟化油),因为即使这些油的低粘度形式也不会使pdms溶胀。此外,其倾向于表现出滴中试剂的优异保留,并且对气体具有高溶解度,允许氧气和二氧化碳被动地扩散进出微区室,以用于不受干扰的细胞呼吸。这允许细胞在包封后在氟碳油乳液中存活数小时。然而,氟碳油的缺点在于,由于与硅油和烃油相比,其普遍性低得多,因此用于使氟碳化合物包水乳液稳定的市售表面活性剂较少。表面活性剂可用于降低油-水界面的表面张力并使微滴聚结最小。选择使用哪种表面活性剂对于限制微区室之间的试剂转移也是重要的。baret(2012labchip12,422)中给出了用于基于微滴的微流控的表面活性剂的全面综述。用于基于微滴的微流控的表面活性剂通常由亲水性头部基团和疏水性尾部组成。这些分子的两亲性使其能够在微滴的油-水界面处组装,从而降低其界面张力并提高稳定性。表面活性剂的头部基团的化学特性影响微滴界面的生物相容性。具有非离子头部基团的表面活性剂是优选的,因为其使大分子(例如蛋白质和dna)吸附到微滴界面最小化,最小程度地影响本发明的方法。可以在实验室容易地合成的合适含氟表面活性剂是本领域已知的,并且描述于例如clausell-tormosj等2008chem.biol.15,427-37或sadtler等1996angew.chem.int.ednengl.35,1976-8中。水相的添加剂还可以通过增加小分子在微滴中的保留和最小化油-水界面处的吸附来提高生物相容性。可以混合不同的油以优化用于特定应用的乳液的特性,并且用于容易地表征所选择的组合的特性的方法是本领域已知的(kaltenbach等2012labchip12,4185)。
术语“颗粒”是指足够小以在微流控微滴中的任何物体,并且其可以用本文限定的可检测标记进行标记。优选地,其选自细胞、珠、病毒、蛋白质和纳米颗粒。细胞可以是任何原核细胞或真核细胞。优选地,其为真核细胞,例如酵母细胞、植物细胞或动物细胞。动物细胞包括昆虫、线虫、鱼和哺乳动物细胞。更优选地,其为哺乳动物细胞,例如小鼠、大鼠、猴或人细胞。例如,其可以是异质细胞群(例如,来自组织)的随机细胞,或者其可以是例如通过facs选择的特别选定细胞。此外,其可以是来自细胞系或同质培养物(例如原代细胞的同质培养物)的细胞,其中“原代”意指直接来源于组织或有机体且未被操作成具有改变的特性(例如无限分裂)。细胞的其他实例是发育中的细胞、干细胞或癌细胞。细胞的优选实例为抗体产生细胞(例如,b细胞或杂交瘤细胞)和报道细胞,所述报道细胞例如优选通过荧光发送由抗体产生细胞产生的抗体对报道细胞的影响(例如,激活或抑制受体(优选g蛋白偶联受体))。
“珠”(也称为“微珠”)是直径达1微米(优选0.5μm至500μm)的均匀聚合物颗粒,其表面可以与生物实体如细胞、蛋白质(包括抗体和/或核酸以及如下所述的可检测标记)结合或偶联。本文所提及的珠通常是聚乙烯或聚苯乙烯珠或者由凝胶基质制成的珠,所述凝胶基质例如包被有蛋白质/肽/抗原如细胞抗原(例如,细胞表面抗原)。
术语“病毒”是指仅在宿主有机体的活细胞内复制的小感染原。优选地,其为致病病毒,更优选为在哺乳动物中(特别是在人中)致病的病毒,例如来自疱疹病毒科、腺病毒科、乳头瘤病毒科、多瘤病毒科、痘病毒科、指环病毒科、细小病毒科、呼肠孤病毒、冠状病毒科、星状病毒科、杯状病毒科、黄病毒科、小核糖核酸病毒科、披膜病毒科、弹状病毒科、丝状病毒科、副粘病毒科、沙粒病毒科、布尼亚病毒科、正粘病毒科、逆转录病毒科或肝dna病毒科(hapadnaviridae)。
本文使用的术语“蛋白质”表示具有特定二级结构和三级结构的多肽,其可以与另外的分析物,特别是与其他生物分子(包括其他蛋白质、dna、rna、脂质、代谢物、激素、趋化因子和小分子)相互作用。其可以是天然的(即,不被人改变的)或重组蛋白。优选地,除上文所限定的蛋白质如抗体之外,其是细胞表面展示的分子、受体或受体配体。
本文使用的术语“纳米颗粒”是指直径为约1nm至1000nm,优选为1nm至100nm的颗粒。纳米颗粒的组分可以包括金属如金、银、铜、铝、镍、钯、铂、其合金,半导体材料如cdse、cds、inas、inp、或其芯/壳结构,或者有机颗粒如由有机聚合物、脂质、糖或其他有机材料(例如聚苯乙烯、乳胶、丙烯酸酯或多肽)制成的颗粒。这样的有机颗粒可以任选地包含一些无机材料,然而,无机材料的量小于50%、小于25%、小于10%、小于5%或小于1%。
术语“第一颗粒”简单地指微流控微滴中包含的颗粒。“第一”本身并不描述任何特性或者与任何特性相联系,除非这是通过引用第一颗粒而特别限定的;其仅仅是区分一个/种颗粒与另外的颗粒的术语。
术语“另外的颗粒”是指可以与第一颗粒相同或不同的另外的颗粒,并且其包含在另外的微流控微滴(优选如第一方面的微流控微滴限定的微流控微滴)中,其中优选地,第一微滴和另外的微滴的颗粒或潜在颗粒结合配偶体不同。术语“另外的颗粒”也可以理解为“一个/种或更多个/种另外的颗粒”,即其涉及包含在一个或更多个另外的微流控微滴中的一个/种或更多个/种另外的颗粒。
术语“相关联”是指由于直接或间接相互作用而引起的非随机空间邻近。如本文所使用的,相互作用是如下关于第一可检测标记和第二可检测标记限定的直接或间接结合,或者颗粒与潜在颗粒结合配偶体之间的结合。其也可以意指例如当颗粒为细胞时,可检测标记可以包含在颗粒中,例如位于颗粒内。
本文使用的术语“可检测标记”(或“标志物”或“标签”)是指任何种类的物质,当与其相关联时,其能够指示另外的物质或物质的复合物(特别是本文所限定的颗粒或潜在颗粒配偶体的复合物)的存在。可检测标记可以是与待检测物质连接或者被引入或并入待检测物质中的物质。优选的是适用于进行检测,此外任选地进行定量的可检测标记,例如发出可检测信号,优选可测量信号,优选光信号的可检测标记。合适标记的实例包括染料、荧光团、荧光纳米颗粒(例如,量子点或lipidot)、发色团、放射性标记、金属胶体、酶(例如,碱性磷酸酶、荧光素酶、β-半乳糖苷酶或辣根过氧化酶)、或者化学发光或生物发光分子。在本发明的上下文中,合适的可检测标记优选为其肽序列被遗传接枝到重组蛋白质中或重组蛋白质上的蛋白质标签。蛋白质标签优选为荧光标签。荧光标签用于给出关于蛋白质的可见读出。gfp及其变体(例如,具有不同荧光光谱的突变gfp)和rfp及其变体(例如,具有不同荧光光谱的突变rfp)是最常用的荧光标签。gfp/rfp的更先进应用包括将其用作折叠报道物(如果折叠,则为荧光,如果未折叠,则为无色)。荧光团的另外的实例包括荧光素、若丹明和硫代吲哚花青染料cy5。
术语“第一可检测标记”是指始终与第一颗粒相关联且任选地与上述限定的另外的颗粒相关联的可检测标记。与第一颗粒相关联且任选地与另外的颗粒相关联的第一可检测标记的量可以是已知的。在其仅与第一颗粒相关联的情况下,即在没有另外的颗粒的情况下,该量是已知的。然而,与第一颗粒相关联的第一可检测标记的量不需要是已知的。在这种情况下,第一标记还与上述限定的另外的颗粒相关联(即,在单个第一标记分子各自与第一颗粒和另外的颗粒连接的意义上来说,是同一类型的标记,但不是同一分子),其中与第一颗粒相关联的第一标记的量基本上等同于与另外的颗粒相关联的第一标记的量,事实上基本上等同于与所有另外的颗粒相关联的第一标记的量。与第一颗粒相关联且任选地与另外的颗粒相关联的第一可检测标记的量不为0。
优选地,第一可检测标记与第二可检测标记不同。特别地,如果第一可检测标记和第二可检测标记是染料,特别地是荧光染料,则其颜色不同,即发射的光的波长不同。
在一个优选的实施方案中,第一颗粒与第一标记的相关联是直接结合或经由接头的间接结合。“直接结合”可以是非共价结合,但优选为第一可检测标记与第一颗粒的没有另外的分子作为中间体的共价结合。“间接结合”优选为第一可检测标记与第一颗粒的具有另外的分子作为中间体(即具有接头)的非共价结合(例如,通过生物素-链霉亲和素相互作用)或共价结合。
术语“第二可检测标记”是指始终与潜在颗粒结合配偶体相关联的可检测标记。在一个优选的实施方案中,潜在颗粒结合配偶体与第二标记的相关联是通过直接结合或通过经由接头的间接结合。“直接结合”优选为第二可检测标记与潜在颗粒结合配偶体的没有另外的分子作为中间体的共价结合或非共价结合。“间接结合”优选为第二可检测标记与潜在颗粒结合配偶体的具有另外的分子作为中间体(即具有接头)的非共价结合或共价结合。此外,根据颗粒和潜在结合配偶体是否结合,第二可检测标记也与第一颗粒相关联或不与第一颗粒相关联。在一个优选的实施方案中,第一颗粒与第二标记的相关联是通过经由潜在颗粒结合配偶体的间接结合。因此,颗粒和第二标记之间的相关联取决于潜在颗粒结合配偶体是否与颗粒结合,并且与颗粒相关联的第二标记的量取决于潜在结合配偶体与颗粒的亲和性以及当颗粒上存在多于一个结合位点时的结合位点的数量。优选地,潜在颗粒结合配偶体与颗粒之间的结合通过非共价键,例如通过静电相互作用、疏水性相互作用、氢键和/或范德华力实现。在一个优选的实施方案中,潜在颗粒结合配偶体与颗粒之间的结合是特异性的。本文使用的“特异性结合”是指结合反应,其例如在未特异性结合的不同颗粒或潜在结合配偶体存在的情况下,结合配偶体(例如,潜在颗粒结合配偶体或颗粒)存在的确定性。通常,“特异性结合”是指平衡解离常数kd,其优选地在室温下或在适合于保持细胞的温度(例如约34℃至40℃、35℃至39℃、36℃至38℃、或优选地约37℃)下,小于约10-5m(例如,10-6m、10-7m、10-8m、10-9m、10-10m、10-11m和10-12m或更小)。如何测量平衡解离常数的方法是本领域公知的。优选的方法使用bia
在一个优选的实施方案中,与第一颗粒相关联的第二标记的量可以基本上不同于与另外的颗粒相关联的第二标记的量,其中“可以”意指这并不一定如此。在一个相关的实施方案中,其是基本上不同的。两者优选地包括与第一颗粒和/或另外的颗粒相关联的第二标记的量为0的可能性。虽然在这种情况下,潜在颗粒结合配偶体与颗粒之间未结合,但是微流控微滴仍然还包含潜在颗粒结合配偶体和第二可检测标记。“基本上不同”意指不是本文所限定的基本相同。
通常,构思在于可以分析潜在颗粒结合配偶体与第一颗粒的结合,优选结合的量。这包括其中所有潜在结合配偶体相同并且颗粒不同的实施方案(颗粒测试/筛选),以及其中颗粒相同并且潜在结合配偶体不同的实施方案(颗粒结合配偶体测试/筛选)。因此,设想在前面的实施方案中,第一颗粒的潜在颗粒结合配偶体与另外的颗粒的潜在颗粒结合配偶体相同;以及在后面的实施方案中,第一颗粒与另外的颗粒相同。
术语“潜在颗粒结合配偶体”是指任何类型的结合配偶体,其中“潜在”意指颗粒结合配偶体可以或可以不结合同一微流控微滴内的颗粒。优选地,颗粒结合配偶体选自抗体、抗体衍生物、抗体模拟物、噬菌体、mrna-多肽复合物、mrna-核糖体-多肽复合物、细胞、病毒、肽、蛋白质、核酸、适配体和小分子。
术语“抗体”是指单克隆抗体和多克隆抗体二者,即能够识别抗原或半抗原的任何免疫球蛋白或其部分。示例性抗体是iga、igd、ige、igg、igm、igy或igw。在一个特定实施方案中,抗体由抗体产生细胞例如b细胞或杂交瘤细胞在同一微流控微滴内产生。
如本文使用的术语“抗体衍生物”是指包含至少一个抗体可变结构域但不具有抗体(如iga、igd、ige、igg、igm、igy或igw)的整体结构的分子,然而仍然能够结合靶分子。所述衍生物可以是但不限于功能性(即,靶结合,特别是靶特异性结合)抗体片段如fab、fab2、scfv、fv、或其部分,或者免疫球蛋白的其他衍生物或组合如纳米抗体、双抗体、微型抗体、骆驼科单结构域抗体、单结构域或fab片段、可变区的重链和轻链的结构域(如fd、vl(包括vλ和vκ)、vh、vhh)以及由免疫球蛋白结构域的两个β-链通过至少两个结构环连接而组成的微型结构域。优选地,抗体衍生物是单价的。更优选地,衍生物是单链抗体,最优选具有结构vl-肽接头-vh或vh-肽接头-vl。
术语“肽接头”在此方面中是指1至100个氨基酸的肽链。在一些优选的实施方案中,肽接头的最小长度为至少1、2、3、4、5、6、7、8、9或10个氨基酸。在另一些优选的实施方案中,根据本发明的肽接头的最大长度为100、95、90、85、80、75、70、65、60、55、50、45、40、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21或20个氨基酸。长度的优选范围为5至25个和10至20个氨基酸。优选肽接头为柔性肽接头,即在连接在一起的结构域之间提供柔性。如果氨基酸较小并且不具有阻止氨基酸链旋转或弯曲的大体积侧链,则通常会增加这样的柔性。因此,本发明的肽接头优选具有增加的小氨基酸含量,特别是甘氨酸、丙氨酸、丝氨酸、苏氨酸、亮氨酸和异亮氨酸。优选地,肽接头的至少20%、30%、40%、50%、60%、70%、80%、90%或更多的氨基酸为小氨基酸。在一个优选的实施方案中,接头的氨基酸选自甘氨酸和丝氨酸,即所述接头是聚甘氨酸或聚甘氨酸/丝氨酸接头,其中“聚”意指接头中至少50%、60%、70%、80%、90%或甚至100%甘氨酸和/或丝氨酸残基的比例。在一些特别优选的实施方案中,根据本发明的肽接头的上述优选最小长度和最大长度可以组合。
如本文使用的术语“抗体模拟物”是指与抗体一样可以特异性结合抗原但与抗体在结构上不相关的有机化合物。其通常是摩尔质量为约3kda至20kda的人工肽或蛋白质。抗体模拟物的非限制性实例为affibody、affilin、affimer、affitin、anticalin、avimer、darpin、fynomer、kunitz结构域肽、monobody、蛋白a的z结构域、γb晶体、泛素、半胱氨酸蛋白酶抑制剂(cystatin)、来自嗜酸热硫化叶菌(sulfolobusacidocaldarius)的sac7d、脂质运载蛋白、膜受体的a结构域、锚蛋白重复基序、fynsac7d、fyn的sh3结构域、蛋白酶抑制剂的kunits结构域、纤连蛋白的第10个iii型结构域、合成杂二价或杂多价配体(josan等,bioconjugchem.201122(7):1270-1278;xu等,pnas2012109(52)21295-21300;shallal等,bioconjugchem.201425(2)393-405)、或者合成或非合成肽配体(例如来自(随机)肽文库)。合成肽配体具有用于结合特定靶分子的非天然存在的氨基酸序列。本发明上下文中的肽配体通常为受限(即,具有一些结构元件例如存在引起β转角或β折叠片层的氨基酸,或者例如由于存在二硫键合的cys残基而被环化)或不受限(线性)的小于约50个氨基酸残基(优选地小于约40个氨基酸残基)的氨基酸序列。在小于约40或50个氨基酸残基的肽配体中,优选约10至约30个氨基酸残基的肽配体。
术语“噬菌体”是指在细菌中感染和复制的病毒。在一个优选的实施方案中,噬菌体展示与噬菌体异源的(即,外来的)肽或蛋白质,根据本发明其为潜在颗粒结合配偶体。该实施方案基于噬菌体展示,其是用于研究与由噬菌体展示的肽或蛋白质的相互作用的技术。在该技术中,将编码目标蛋白质的基因插入到噬菌体外壳蛋白基因中,引起噬菌体在其内部包含该蛋白质的基因的同时在其外部展示该蛋白质,使得基因型与表型之间关联。然后可以针对颗粒筛选这些展示性噬菌体,以检测所展示的肽或蛋白质与颗粒之间的相互作用。这样,可以在称为体外选择的过程中筛选和扩增肽或蛋白质的大文库。优选的噬菌体是m13噬菌体、fd丝状噬菌体、t4噬菌体、t7噬菌体和λ噬菌体。
术语“mrna-多肽复合物”是指用于mrna展示的复合物。mrna展示是用于体外蛋白质和/或肽进化以产生可以与期望靶标结合的分子的展示技术。该过程产生翻译的肽或蛋白质,其经由嘌呤霉素连接与其祖mrna相关联。然后复合物在选择步骤中与固定靶标结合。然后结合良好的mrna-蛋白质融合体逆转录成cdna并且其序列通过聚合酶链式反应扩增。所得物是编码对目标分子具有高亲和性的肽的核苷酸序列。还参见lipovsek和pliickthun,journalofimmunologicalmethods290(2004)51-67。
术语“mrna-核糖体-多肽复合物”是指用于核糖体展示的复合物。核糖体展示是用于进行体外蛋白质进化以产生可以与期望配体结合的蛋白质的技术。该过程产生翻译的蛋白质,其与其祖mrna相关联,所述祖mrna作为复合物被用于在选择步骤中与固定配体结合。然后结合良好的mrna-蛋白质杂合体逆转录成cdna并且其序列通过pcr扩增。最终所得物是可以用于产生紧密结合的蛋白质的核苷酸序列。还参见lipovsek和plückthun,journalofimmunologicalmethods290(2004)51-67。
术语“细胞”是指如上限定的细胞。
术语病毒是指仅在宿主有机体的活细胞内复制的小感染原。优选地,其为致病病毒,更优选为在哺乳动物中(特别是在人中)致病的病毒,例如来自疱疹病毒科、腺病毒科、乳头瘤病毒科、多瘤病毒科、痘病毒科、指环病毒科、细小病毒科、呼肠孤病毒、冠状病毒科、星状病毒科、杯状病毒科、黄病毒科、小核糖核酸病毒科、披膜病毒科、弹状病毒科、丝状病毒科、副粘病毒科、沙粒病毒科、布尼亚病毒科、正粘病毒科、逆转录病毒科或肝dna病毒科。优选地,如果颗粒是病毒,则潜在颗粒结合配偶体不是病毒。
作为潜在颗粒结合配偶体的蛋白质可以是天然蛋白质或重组蛋白质。优选地,除上述所限定的蛋白质(如抗体)之外,其为展示在或存在于细胞、受体或受体配体的表面上的蛋白质。
作为潜在颗粒结合配偶体的核酸可以是天然核酸或重组核酸。优选的核酸为dna、rna及其核酸类似物。核酸类似物为与天然存在的rna和dna在结构上相似的化合物。核酸是核苷酸的链,核苷酸由三部分构成:磷酸骨架、褶皱状(pucker-shaped)戊糖(核糖或脱氧核糖)和四种核碱基之一。类似物可以具有这些的任意变化。通常,类似物核碱基尤其可以赋予不同的碱基配对和碱基堆积特性。实例包括可以与所有四种标准碱基配对的通用碱基。核酸类似物也被称为人工核酸,包括肽核酸(pna)、吗啉代、锁核酸(lna)、二醇核酸(gna)和苏糖核酸(tna)。通过分子骨架的变化区分这些中的每一个与天然存在的dna或rna。优选的核酸类似物为l-核糖核酸适配体(l-rna适配体,商品名spiegelmer),其是由l-核糖单元形成的rna样分子。其为天然寡核苷酸的镜像并且为适配体形式。由于其l-核苷酸,其高度抗核酸酶的降解。
术语“适配体”是指与特定靶分子结合的寡核苷酸或肽分子。适配体通常通过从大的随机序列池中对其进行选择而产生,但是天然适配体也存在于核糖开关中。
术语“小分子”是指分子量为50道尔顿至约2,500道尔顿,优选地为200道尔顿至800道尔顿的分子。在一个优选的实施方案中,所述小分子来源于文库例如小分子抑制剂文库。小化合物文库包括多种化学化合物,并且已经由多种来源(包括化学合成分子和天然产物)中的任意来源组装,或者已经通过组合化学技术产生。其可以包括特定结构的化学化合物或特定有机体(如植物)的化合物。通常,小化合物可以来源于或选自合成或天然化合物的文库。例如,合成化合物文库可从maybridgechemicalco.(trevillet,cornwall,uk)、chembridgecorporation(sandiego,ca)或aldrich(milwaukee,wi)商购获得。天然化合物文库例如可从timtecllc(newark,de)获得。或者,可以使用细菌、真菌、植物和动物细胞以及组织提取物形式的天然化合物文库。此外,可以使用组合化学合成产生测试化合物作为单独的化合物或作为混合物。使用组合化学制成的化合物的集合在本文中被称为组合文库。
术语“已知”涵盖由第三方提供的知识或本身预先确定的知识。
术语“基本上等同的量”是指等效量,并不一定意指完全相同。当提供“基本上等同的量”时,其确定为基于在技术上可行可以被技术人员认为是基本上相同、相似或相当的量。其中,在极限内的偏差是正常且可接受的。在一个优选的实施方案中,偏差可以达±200%、±100%、±50%,达±40%,达±30%,达±20%,或者甚至仅达±10%或±5%,优选由任意参照颗粒(如第一颗粒),由具有至少三种颗粒的群的中值的颗粒(其中,如果该群中的颗粒数目为偶数以使得两种颗粒可以提供中值,则针对中值取具有与该群的平均值接近的值的颗粒),或者由至少两种颗粒的群的平均值计算得到。因此,可以使用术语“基本上相似的量”来代替术语“基本上等同的量”。设想如果标记方法对于颗粒群(例如,至少两种或至少三种颗粒的群)未实现期望的均匀性,即基本上等同的量,则具有期望的均匀性,即具有期望量的标记的颗粒可以选自通过标记方法产生的起始群,例如用如下所述的本发明的第三方面的方法,其包括分选步骤(d)的方法。
在一个特定实施方案中,微流控微滴还包含与一定量的第三可检测标记相关联的(i)颗粒非结合剂或(ii)不结合潜在颗粒结合配偶体的第二颗粒。
术语“颗粒非结合剂”或“颗粒的非结合剂”是指在同一微流控微滴内不结合颗粒的任何类型的化合物或结构。优选地,颗粒结合配偶体选自抗体、抗体衍生物、抗体模拟物、噬菌体、mrna-多肽复合物、mrna-核糖体-多肽复合物、细胞、病毒、肽、蛋白质、核酸、适配体和小分子。更优选地,其类型与潜在颗粒结合配偶体相同,即如果潜在结合配偶体是抗体,则颗粒非结合剂是抗体,如果潜在结合配偶体是抗体衍生物,则颗粒非结合剂是抗体衍生物、等。
“不结合潜在颗粒结合配偶体的第二颗粒”或简单地“第二颗粒”是如上所限定的与第一颗粒不同的颗粒,然而其可以是相同类型的,即如果第一颗粒是细胞,则第二颗粒也是细胞,如果第一颗粒是珠,则第二颗粒也是珠、等。
术语“第三可检测标记”是指始终分别与颗粒非结合剂或第二颗粒相关联的可检测标记。在一个优选的实施方案中,颗粒非结合剂或第二颗粒分别与第三标记的相关联是直接结合或经由接头的间接结合。“直接结合”优选为第三可检测标记分别与颗粒非结合剂或第二颗粒的没有另外的分子作为中间体的共价或非共价结合。“间接结合”优选为第三可检测标记分别与颗粒非结合剂或第二颗粒的具有另外的分子作为中间体(即具有接头)的非共价或共价结合。分别由于颗粒非结合剂不结合颗粒或者第二颗粒不结合潜在颗粒结合配偶体,因此第三可检测标记分别(i)不与第一颗粒或另外的颗粒或者(ii)不与潜在颗粒结合配偶体相关联。通常,第三可检测标记与第一可检测标记和第二可检测标记是不同的,即可区分的。
使用颗粒非结合剂或不结合潜在颗粒结合配偶体的第二颗粒的构思包括实施例4中所举例说明的反筛选(counter-screen),即可以筛选第一颗粒与潜在颗粒结合配偶体之间的结合同时筛掉(screeningagainst)第一颗粒与颗粒非结合剂之间或潜在颗粒结合配偶体与第二颗粒之间的结合。
该方面中的筛选和筛掉可以包括用本文所述的分选(特别是关于本发明的第三方面)分选第一颗粒与潜在颗粒结合配偶体之间结合并且第一颗粒与颗粒非结合剂之间或潜在颗粒结合配偶体与第二颗粒之间未结合的微流控微滴。
在一个优选的实施方案中,本发明涉及第一方面的多个微流控微滴,其中所有微流控微滴中的颗粒相同,并且微流控微滴之间的潜在颗粒结合配偶体不同,或者所有微流控微滴中的潜在颗粒结合配偶体相同,并且微流控微滴之间的颗粒不同。
在一个特定实施方案中,多个微流控微滴中的每个微流控微滴包含颗粒非结合剂或不结合潜在颗粒结合配偶体的第二颗粒。
术语“群”或“多个”意指“多于一个”。在一些优选的实施方案中,其意指多于10个、多于20个、多于30个、多于40个、多于50个、多于100个、多于250个、多于500个或多于1000个。
在第二方面,本发明涉及用于量化根据第一方面的微流控微滴中的颗粒与潜在颗粒结合配偶体之间的结合的方法,其包括以下步骤:
(i)测量确定第一可检测标记的信号,
(ii)测量第二可检测标记的信号,以及
(iii)使用第一可检测标记的信号将第二可检测标记的信号归一化,
其中第二可检测标记的归一化信号表示颗粒与潜在颗粒结合配偶体之间的结合的量。
所有术语具有如上所限定的含义,并且关于这些术语所限定的实施方案也适用于第二方面的方法。
在一个特定实施方案中,所述方法用于量化根据第一方面的微流控微滴中的颗粒与颗粒结合配偶体之间的结合,其包括以下步骤:
(i)测量第一可检测标记的信号,
(ii)测量第二可检测标记的信号,以及
(iii)使用第一可检测标记的信号将第二可检测标记的信号归一化,
其中第二可检测标记的归一化信号表示颗粒与颗粒结合配偶体之间的结合的量。
优选地,第二可检测标记的信号在微流控微滴内与第一可检测标记的信号相同的位置处(更优选地在同一时间,即同时)进行测量。
“测量信号”是指测量信号的强度或者在微滴内任何位置处(即不一定在微滴内标记的位置处)测量可检测标记的信号强度。信号的强度在微滴内根据可检测标记的位置变化,但是通过使用两种可检测标记即第一标记和第二标记以及归一化步骤来补偿任意(包括另一)位置处的测量。该归一化步骤使得能够将结合量化而不考虑标记在微滴内的位置和测量信号的位置,只要所有标记的信号在相同位置进行测量即可,参见图5。用于进行检测的方法取决于所使用的可检测标记。优选地,可检测标记发出光信号。光信号可以例如通过光传感器如光电倍增管、cmos或ccd摄像机来测量。如果可检测标记是可激发的,则确定量的步骤可以包括激发步骤(例如用激光源)。在一个优选的实施方案中,信号是激光诱导的荧光,并且通过激光光谱法检测信号,即确定该量。
如本文使用的“归一化”是指用步骤(ii)的第一可检测标记的信号的值来调整步骤(i)的第一可检测标记的信号的值。原理上,任何调整都以归一化为目的,例如通过任何数学运算如加、减、乘、除或其任何组合进行调整。在一个优选的实施方案中,步骤(iii)包括将第二标记的信号的值除以第一标记的信号的值。
在另一个优选的实施方案中,优选地除上述相除之外,更优选地在相除之前,步骤(iii)还包括通过减去第二可检测标记背景,将第二标记的信号归一化。第二可检测标记背景是与颗粒不相关联的第二可检测标记的信号。其可以例如在微流控微滴中的这样的位置处确定:微流控微滴内的第一可检测标记的信号为0或最小。或者,其是对照微流控微滴中的第二标记的信号,对照微流控微滴可以是空的(即,至少不含可检测标记,或者甚至不含颗粒和潜在颗粒结合配偶体),或者其与根据第一方面的微流控微滴的不同点仅在于在对照微流控微滴中第二标记与第一颗粒不相关联,即在于与第二标记结合的潜在颗粒结合配偶体未特异性结合颗粒,或者在于第一颗粒不存在于对照微流控微滴中。
在一个特定实施方案中,第二方面的方法包括步骤(iv):测量如上所限定的与颗粒非结合剂或不结合潜在颗粒结合配偶体的第二颗粒相关联的第三可检测标记的信号。
在第三方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的方法,其包括以下步骤:
(a)将包含一种或更多种颗粒的微流控微滴进料到包含检测点的检测通道中,
(b)相比于具有球形形状时的同一微流控微滴,至少在检测通道中的检测点处限制微流控微滴内颗粒的至少垂直移动,以及
(c)在检测点处检测包含在微流控微滴中的至少一种颗粒。
术语“通道”可以意指通过赋予材料图案或者通过任何合适的材料去除技术而在材料中形成的凹部(recess)或腔,或者可以意指与安装在凹部或腔中的任何合适的流体传导结构组合的凹部或腔,例如管,毛细管等。通常,其是指直径为3000μm或更小、2000μm或更小、1000μm或更小,优选为900nm、800nm、700nm、600nm、500nm、400nm、300nm、200nm、150nm、100nm、50nm或更小的微通道,优选直径为20nm至3000μm,优选为20nm至1000μm,更优选为20nm至100μm。在一个优选的实施方案中,通道是微流控网络的一部分。如果通道不具有圆形截面,则通道的高度和/或宽度取决于针对上述直径给出的尺寸。
本文描述了多种类型的通道,例如进料通道、检测通道、分选通道和分支通道。这些术语不一定将一个通道类型与另一个通道类型相区分,因为这些术语部分地描述了边界并未在所有情况下都被限定的通道部分。例如,进料通道与其下游的检测通道合并,并且检测通道与其下游的分选通道合并。清晰的界限只是分选接合部,其是分选通道结束且分支通道开始的地方。另外,通道或通道部分可以通过其高度和任选地宽度(如下面所限定的)或者通过其具有的其他特征(例如检测点、分选装置等)来区分。
术语“检测通道”是指可以在“检测点”处检测微流控微滴或其内容物的通道或通道的一部分。优选地,至少在检测点处检测通道的一个或更多个壁,更优选所有壁是透明的。
术语“垂直移动”是指当检测通道,特别是包含检测通道的微流控装置(例如,芯片)处于其预期的空间取向或位置(例如平放置在水平区域上)时,在重力方向或与重力相反的方向上在微流控微滴内的颗粒移动或移动空间。
“限制”垂直移动是指减小微流控微滴内颗粒的垂直移动或移动空间。这可以例如通过限制微滴内颗粒可以移动的垂直空间,即通过使微滴变形而导致垂直空间减小来实现。在一个优选的实施方案中,至少在检测点处检测通道的高度小于球形形状时微滴的直径,即通道高度减小导致微滴变形,从而导致垂直空间减小。在另一个实施方案中,在检测通道之下或之上,优选地在检测点处的电极可以通过施加ac电压以足以使微滴变形导致微滴内的垂直空间减小的力将微滴拉到通道的底部或顶部。
在一个优选的实施方案中,步骤(b)包括相比于具有球形形状时的同一微流控微滴,至少在检测通道中的检测点处也限制微流控微滴内颗粒的水平移动。术语“水平移动”是指与如上所限定的垂直移动成90°角的移动。这可以例如通过限制微滴内颗粒可以移动的水平空间,即通过使微滴变形而导致水平空间减小来实现。在一个优选的实施方案中,至少在检测点处检测通道的宽度小于球形形状时微滴的直径,即通道宽度减小导致微滴变形,从而导致水平空间减小。在另一个实施方案中,在检测通道的一侧上,优选地在检测点处的电极可以通过施加ac电压以足以使微滴变形而导致水平空间减小的力将微滴拉到通道的侧面。
因此,在一个优选的实施方案中,颗粒的垂直移动和任选地水平移动通过通道高度和任选地宽度和/或通过介电泳进行限制。在前一种情况下(高度和宽度限制),微流控微滴至少在检测点处在检测通道中形成塞(plug),即其充满通道的截面并且只是流体(不混溶液体)的薄膜围绕微流控微滴。
术语“球形形状”是指在空间中没有被限制且在其不移动时的微滴的形状。优选地,球形微滴的直径是均匀的,即在任何点处都是相同的,偏差达1%、2%、3%、4%、5%,或达10%。
术语“检测”颗粒是指确定颗粒的存在或不存在。在一个优选的实施方案中,通过检测与颗粒相关联的标记(例如上述所限定的第一标记)来检测颗粒。检测装置是本领域中公知的,并且包括上述指出的装置,例如光传感器,例如光电倍增管,cmos或ccd摄像机,或者检测电极。通常,检测装置适合于检测如本文所限定的颗粒和/或标记微流控微滴。特别地,关于标记,检测装置适合于测量标记的信号的强度,优选地适合于测量标记的信号。因此,在一个优选的实施方案中,检测装置检测与一种或更多种颗粒相关联的标记,并且任选地,检测装置测量与一种或更多种颗粒相关联的标记的信号。
在一个特别优选的实施方案中,步骤(c)中的检测包括根据第二方面的方法的量化。
在一个实施方案中,在步骤(a)中通过检测通道上游的进料通道将微流控微滴进料到检测通道中,特征在于进料通道的高度和宽度使得微流控微滴内颗粒的垂直移动和水平移动不受限制,即使得微流控微滴具有球形形状。特别地,微流控微滴不会在进料通道中形成塞。术语“进料通道”是指将流体和其中的微流控微滴递送到检测通道的通道。
在一个优选的实施方案中,检测通道和进料通道的特征在于,至少在检测点处检测通道的高度和任选的宽度小于进料通道的高度和任选的宽度的100%、90%、70%、60%、50%、40%、30%、20%或小于10%。优选地,至少在检测点处检测通道的高度和任选的宽度为20μm至50μm,优选为30μm至40μm,和/或进料通道的高度和任选的宽度为50μm至3000μm,优选为100μm至1000μm。
此外,检测通道的特征可以在于,至少在检测点处检测通道的高度和任选的宽度小于包含在与检测通道相同的微流控装置中所有通道的平均高度和任选地平均宽度的100%、90%、70%、60%、50%、40%、30%、20%或小于10%。优选地,至少在检测点处检测通道的高度和任选的宽度为20μm至50μm,优选为30μm至40μm,和/或包含在与检测通道相同的微流控装置中所有通道的平均高度和任选地平均宽度为50μm至3000μm,优选为100μm至1000μm。
在一个优选的实施方案中,第三方面的方法还包括步骤(d):在检测通道下游的分选通道中,优选地在分选通道末端的分选接合部处,基于颗粒的检测,特别是基于检测的颗粒的信号,分选微流控微滴。
术语“分选”是指基于微流控微滴的特性,优选基于其内容物(包括如上所述的一种或更多种颗粒、潜在颗粒结合配偶体和/或与潜在颗粒结合配偶体结合的颗粒的存在或不存在),选择或分离微流控微滴。上文还描述了如何检测这些内容物。
术语“分选通道”是指可以使用分选装置(如分选分路器)来分选微流控微滴的通道或通道的一部分,即分选通道优选地包含分选分路器。术语“分选分路器”是指包含具有分选接合部的分选通道的通道几何结构,其中分选通道分支成至少2、3、4、5、6、7、8、9或至少10个分支通道。与分选分路器相关联的通常是分选力或操作装置,其可以基于介电泳(x.hu等,marker-specificsortingofrarecellsusingdielectrophoresis.procnatlacadsciusa102,15757(2005年11月1日)),阀(a.y.fu,c.spence,a.scherer,f.h.arnold,s.r.quake,amicrofabricatedfluorescence-activatedcellsorter.natbiotechnol17,1109(1999年11月),光学(z.c.landry,s.j.giovanonni,s.r.quake,p.c.blainey,optofluidiccellselectionfromcomplexmicrobialcommunitiesforsingle-genomeanalysis.methodsinenzymology531,61(2013)),声学(l.schmid,d.a.weitz,t.franke,sortingdropsandcellswithacoustics:acousticmicrofluidicfluorescence-activatedcellsorter.labonachip14.3710(2014年10月7日)),或流偏转,优选电流偏转(p.s.dittrich,p.schwille,anintegratedmicrofluidicsystemforreaction,high-sensitivitydetection,analchem.;75(21):5767-74.(2003))。
因此,分选分路器可以是dep分选分路器、声电泳(acoustophoresis)分选分路器、基于微型阀的分选分路器、压电分选分路器或动态流偏转分选分路器。优选的是dep分选分路器。在一个特定实施方案中,dep分选分路器是光诱导介电泳(odep)分选分路器。
因此,关于还包括步骤(d)的实施方案,分选通道优选地包含分选分路器,该分选分路器包含分选接合部,在该分选接合部处分选通道分支成至少两个分支通道。在一个更优选的实施方案中,分选通道还包含微滴操作装置,其优选地选自上述装置,更优选为介电泳(dep)力操作装置。
在一个优选的实施方案中,分选通道的高度和宽度以及优选的分支通道的高度和宽度使得微流控微滴内颗粒的垂直移动和水平移动不受限制,即使得微流控微滴具有球形形状。特别地,微流控微滴在分选通道中以及优选地在分支通道中不形成塞。
在一个优选的实施方案中,检测通道和分选通道(以及优选的分支通道)的特征在于,至少在检测点处检测通道的高度和任选的宽度小于分选通道(以及优选的分支通道)的高度和任选的宽度的100%、90%、70%、60%、50%、40%、30%、20%或小于10%。优选地,至少在检测点处检测通道的高度和任选的宽度为20μm至50μm,优选为30μm至40μm,和/或分选通道(以及优选的分支通道)的高度和任选的宽度为50μm至3000μm,优选为100μm至1000μm。
在一个特定的实施方案a中,第三方面的方法还包括用放大倍数为至少20倍,优选为至少30倍,更优选为至少40倍或甚至至少50倍的物镜监测微流控微滴的检测和分选二者(即,在物镜的同一视场内)。优选地,使用具有所述物镜的显微镜进行该检测和分选。对于该实施方案,有利的是,检测点与分选接合部之间的距离为500μm或更小、400μm或更小、300μm或更小、200μm或更小、或者100μm或更小,其中各种情况下的最小距离为至少50μm。优选地,独立于或包括上述限制,该距离小于球形形式微流控微滴的直径的10倍、9倍、8倍、7倍、6倍、5倍或甚至3倍。在这方面,术语“距离”不是指微滴在通道中经过的距离,而是指点之间的最短空间距离,与通道路径无关。
在可与实施方案a组合的一个特定实施方案b中,在不直的意义上说,分选通道和/或检测通道在检测通道的检测点的下游、分选接合部的上游弯折或具有弯曲部。在这方面,“弯折”或“具有弯曲部”优选地意指具有至少5°、10°、20°、30°、40°、45°、50°、60°、70°、80°或90°,优选10°至90°,更优选10°至45°的侧向(即,从顶视图向左或向右)角。这有利地有助于实现检测点与分选接合部之间的短距离。
在可与实施方案a和/或b组合的一个特定实施方案c中,第三方面的方法还包括通过分选接合部上游的流体入口将流体注入到分选通道中,由此控制通过的微滴,以促进分选。这意味着(此处以及在本文的相应实施方案中)流体被注入检测通道的检测点的下游,以及相应的流体入口在检测点的下游且在分选接合部的上游。“控制通过的微滴”优选地意指将其间隔至彼此的最小或限定距离和/或将其间隔以使其聚集在分选接合部附近。在一个优选的实施方案中,微滴被间隔开使得两个连续微滴之间的距离是微滴直径的至少10倍、8倍、6倍、4倍或2倍。使微滴聚集在分选接合部附近意指通过附加的流体入口聚集以调整微滴的轨迹,以使得在不存在如上所述的方式(例如dep、阀等)的任何微滴操作下,使微滴通过最终进入废物通道,即在其中表现出不期望的表型的微滴被冲走的通道。废物通道优选为至少两个分支通道中的一个。
在一个优选的实施方案中,不管检测和/或分选决定如何,所有微滴都以相同的方式受到控制,即控制不是分选。该实施方案的优点在于,仅需要最小和/或均匀的脉冲来进行分选,即将微滴轻推(nudge)到分选接合部处的分支通道中或者甚至轻推到分选接合部的上游,以及脉冲的强度并不是必须通过改变微滴在通道内的位置来调整。优选地,控制微滴基于来自以下的信息:本文所述的检测装置和/或(可能附加的)摄像机或检测电极关于微滴在通道中(特别是在分选通道中)的位置,优选地关于其与通道壁的距离、与分选分路器的距离和/或与在前的微滴有关的检测之间的距离或时间。
在第三方面方法的一个优选实施方案中,颗粒是细胞,并且微流控微滴被分选成包含两种不同细胞类型的细胞,优选两种不同的单细胞,例如抗体产生细胞和报道细胞,报道细胞优选通过荧光发出由抗体产生细胞产生的抗体对报道细胞作用(例如,激活或抑制受体,优选g蛋白偶联受体)的信号。在该实施方案中,两种不同的细胞类型(优选两种不同的单细胞)携带不同的可检测标记。换句话说,在该优选的实施方案中,微流控微滴包含一种或更多种不同的颗粒,所述颗粒是不同细胞类型的细胞,各自与不同的可检测标记(优选荧光标记)相关联,并且细胞在步骤(c)中通过可检测标记被检测,以及微流控微滴在步骤(d)中被分选成包含不同细胞类型的至少两种不同的细胞,优选至少两种不同的单细胞。
在第三方面方法的另一个优选实施方案中,微流控微滴包含颗粒,所述颗粒是细胞或包被有抗原的珠和如上所限定的潜在颗粒结合配偶体例如抗体、抗体衍生物或抗体模拟物,并且以颗粒与潜在颗粒结合配偶体之间结合的特定量(例如特定最小量)的结合分选微流控微滴。
在一个特定实施方案中,第三步的方法在分选步骤(d)之后包括步骤(e):鉴定或分析所分选的一个或更多个微流控微滴中的颗粒和/或潜在颗粒结合配偶体(或其来源,如果在微流控微滴中产生潜在颗粒结合配偶体,例如由b细胞或杂交瘤细胞产生抗体)。这使得能够确定哪种颗粒结合哪种潜在颗粒结合配偶体。例如,如果潜在颗粒结合配偶体是抗体,则可以通过rt-pcr扩增相应b细胞或杂交瘤的抗体编码基因,并测序以获得关于抗体的结构信息。
在第四方面,本发明涉及微流控微滴群,其中大于50%,优选地大于60%、70%或80%,更优选地大于90%或者甚至大于95%的微流控微滴包含至少两种类型的单颗粒,特别地至少两种细胞类型的单细胞。这样高的百分比可以用第三方面的包括分选步骤的方法实现,但不能通过不同类型的两种或更多种单颗粒或细胞的非确定性或甚至确定性包封实现。因此,在一个优选的实施方案中,使用第三方面的还包括上述分选步骤(d)(优选与上述实施方案a、b和/或c中的一个或更多个的特征组合)的方法来产生所述群。在该方法中,为了实现所述群,将微流控微滴分选成包含至少两种类型的单颗粒或细胞。
在第五方面,本发明涉及用于检测包含在微流控微滴中的一个或更多个微粒的微流控装置,所述微流控装置包含具有检测点的检测通道,特征在于该装置被设计成使得相比于具有球形形状时的同一微流控微滴,至少在检测点处的检测通道中限制微流控微滴内颗粒的至少垂直移动。
在一个优选的实施方案中,该装置被设计成使得相比于具有球形形状时的同一微流控微滴,至少在检测点处的检测通道中也限制微流控微滴内颗粒的水平移动。
如本文使用的术语“微流控装置”通常是指可以通过其在一些实施方案中以微米尺度并且在一些实施方案中以纳米尺度输送材料,特别是流体运载材料(例如液体)的装置。因此,微流控装置可以包括微米尺度特征、纳米尺度特征、及其组合。
在本发明的上下文中,该术语还指a)包含多个封闭微通道结构(其各自包含一个或更多个封闭微通道和/或微腔)的装置,以及b)这些微通道结构用于输送和处理在纳升至微升范围内并且可以包含反应物(包括例如分析物和试剂)的液体等分试样,特别是如上所述的微流控微滴。液体等分试样通常是水性的。输送和处理通常是分析和/或制备过程方案的一部分。装置中的微通道结构的数量可以大于1、2、3、4、5、10、25或50,并且通常低于500,例如低于100。
示例性微流控装置通常包括尺寸为约毫米级或更小的结构或功能特征,这些特征能够以约数百μl/小时或更小的流量操作流体。通常,这样的特征包括但不限于通道、流体储存器、反应室、混合室和分离区。在一些实例中,通道包括为约20μm至约3000μm(优选地至约1000μm)的至少一个截面尺寸。以此数量级使用尺寸允许在更小的区域中并入更多数量的通道,并且使用更小体积的流体。
在一个优选的实施方案中,微流控装置是微流控芯片。如本文中使用的“芯片”是指具有多个一维、二维或三维微结构或微尺度结构的固体基底,在所述结构上可以进行某些过程,例如物理、化学、生物、生物物理或生物化学过程等。微结构或微尺度结构(如通道和阱(well)、电极元件、电磁元件)被并入到基底上,制造在基底上或以另外方式连接在基底上,以促进芯片上的物理、生物物理、生物、生物化学、化学反应或过程。芯片可以在一个维度上薄,并且可以在其他维度上具有多种形状,例如矩形、圆形、椭圆形或其他不规则形状。本发明芯片的主表面的尺寸可以显著变化,例如为约1mm2至约0.25m2。优选地,芯片的尺寸为约4mm2至约50cm2,其中特征尺寸为约1mm至约5cm。芯片表面可以是平坦的或不平坦的。具有非平坦表面的芯片可以包含在表面上制造的通道或阱。
优选地,微流控装置(特别地微流控芯片)由光学透明聚合物或玻璃制成。一种特别优选的透明聚合物是聚(二甲基硅氧烷)(pdms)。pdms芯片可以例如通过软刻蚀来制造(squires和quake.microfluidics:fluidphysicsatthenanoliterscale.reviewsofmodernphysics,2005,第77卷)。其他合适的聚合物为例如ormocomp、聚甲基丙烯酸甲酯(pmma)、sifel、环烯烃共聚物(coc)、聚偏二氟乙烯(pvdf)或聚苯乙烯(ps)。
术语“被设计成使得...”是指如上关于第三方面的方法所描述的涉及限制移动的特征。优选地,其是指通过通道高度和任选的宽度和/或通过介电泳所限制的颗粒的垂直移动和任选的水平移动。
在另一个实施方案中,第五方面的装置包含以下的一个或更多个:
(i)在检测通道上游的进料通道,
(ii)在检测通道下游的分选通道,和/或
(iii)至少两个分支通道,
全部如上所述。
除了关于本发明上述方面所描述的特征之外,第五方面的装置还可以包含一个或更多个集成电极、微型阀、微型泵、微滴产生器和/或激光光谱设置。“集成”意指嵌入在两层如上所述的装置材料(例如,玻璃或pdms)之间或设置在装置(优选芯片)顶部上。
通常,电极可以实现芯片上的功能,例如电阻抗谱、电泳、安培检测、温度传感、电加热(例如,以提供适合于维持细胞的温度,如约34℃至40℃、35℃至39℃、36℃至38℃或优选约37℃)、产生电渗流和/或高电压微流控实验。示例性电极为场电极、检测电极以及加热电极和传感电极。场电极用于传导电流并产生用于控制电渗流的电场。检测电极用于测量流体通道中液体的局部电导率或阻抗。检测电极特别可以用于例如计数和表征微流控微滴中的颗粒,特别是细胞。加热电极和传感电极用作芯片上的电加热器和温度传感器,以提供方便的方式来加热微通道内的流体并测量温度。如果微流控微滴包含细胞,即如果本发明的方面的颗粒是细胞,则这是特别有用的。虽然加热电极和传感电极可以彼此独立地使用,即,虽然装置可以包含加热电极或传感电极,但是优选其包含两者,甚至更优选加热电极和传感电极在功能上耦合,并且根据用传感电极测量的温度由反馈环路控制加热电极,以使得保持期望的温度,特别是如上所述适合于维持细胞的温度。在电极与微流控通道之间,可以施加绝缘层。
如本文使用的术语“微型阀”通常涉及相对于流体可以选择性地进入以下两种不同状态中的一种的阀:其中流体可以通过阀的阀打开状态和其中流体被阻止通过阀的阀关闭状态。微型阀控制微流控装置内流体的路径、时序和分离。通常,微型阀可以以机械、气动、电动、通过相变或通过引入外力来致动。因此,微型阀可以独立地选自(即,装置可以包含不同的微型阀):电动微型阀、气动微型阀、夹管微型阀、相变微型阀、爆破微型阀和braille销夹管微型阀。优选地,微型阀独立地选自气动微型阀、braille销夹管微型阀、相变微型阀和爆破微型阀。电动微型阀在连续流动系统中运行,充当使用电渗流将流体从一个通道转换到另一个通道的流体路由器。气动微型阀通常依赖于柔性膜来控制流动通道中的流动模式。夹管微型阀通过使用机械压力使如上所限定的装置材料(例如pdms)物理变形来运行。相变微型阀在材料(例如石蜡、水凝胶或水溶液)的不同相之间交替以调节流动。爆破微型阀是一次性使用阀,当流动阻力被克服时或当牺牲膜被分解时打开。最后,braille销夹管微型阀通过braille显示器的机械销产生局部压力,braille显示器通常用于与盲人通信,并代表一种廉价且易于编程的阀控制方法。夹紧点可以但不一定是阀点。在后者的情况下,每个销压在填充有液体的储存器上,储存器充当活塞将压力传递到基于膜的气动阀。
本文使用的术语“微型泵”是指可以提供力用于使微通道内的液体或气体排出的结构。本领域已知多种泵送机构。优选地,“微型泵”是正排量型的,其中泵产生高于大气压的正压力,并且更高的压力耦合至少一个微流控通道。差压引起气体或液体的移动。“集成微型泵”也称为“集成压力源”、“芯片上微型泵”或“芯片上压力源”,是指这样的微型泵配置,其是微流控装置不可分割的部分并且优选不可逆地连接在其上。因此,在本发明的微流控装置中,微型泵负责产生时间性的体积式流体移动,并用于减少运行微流控装置所需的外部硬件的量。通常,微型泵是主动或被动的。被动微型泵依赖于例如与微结构化表面接触的小流体体积自发地沿使蒸气、流体和固体界面之间的自由能最小化的方向移动的现象,这是由于液体的表面张力与表面的化学组成和形貌之间的相互作用的结果。或者,其可以依赖于位于微通道的入口/出口处的微滴的表面张力来驱动流动。其中,流量由微滴的曲率决定,其进而由分配的流体量控制。然而,优选的是主动微型泵,因为其适合于计算机控制。主动微型泵依赖于外部信号以启动和停止泵送活动。该外部信号增加控制泵速率和时间行为的能力。优选地,主动微型泵独立地选自(即,装置可以包含不同的微型泵):注射器微型泵、气动膜微型泵、压电微型泵、braille销微型泵、电化学微型泵、电渗微型泵、声学微型泵、磁流体动力微型泵、电流体动力微型泵和气体渗透微型泵;更优选地,主动微型泵独立地选自注射器微型泵、气动膜微型泵和braille销微型泵。
注射器微型泵是泵送装置,其包含注射器,即限定在其中活塞、柱塞或类似结构可滑动以从其中喷出流体的腔、室或类似结构的筒体、壳体或类似结构。注射器泵实现流体的精确驱动。气动膜微型泵通常基于现有的微型阀设计,其具有串联致动以在微通道中产生蠕动的多个这样的阀。简而言之,流体体积(“团块(bolus)”)被束缚在激活的泵送膜之间,并且通过泵送膜的顺序激活而单向移动。因此,团块将移动离开其初始位置,从而在微通道中产生体积位移。压电微型泵依赖于在被供给电流时经受形状变化的压电装置材料。耦合到(优选薄的)隔膜的由压电材料施加的应力可以用于泵送流体。使用braille显示器的推销(push-pin)操作braille销微型泵,其被程序化成以蠕动模式操作。电化学微型泵利用由(例如kno3)水溶液的电解产生的气体泵送流体通过微通道。通过使用连接到微通道的电极调整电流振幅和脉冲,可以实现流动。电渗微型泵依赖于电渗流,电渗流是由施加在多孔材料、毛细管、膜或具有带电壁的微通道之间的电场所引起的液体整体运动。例如当在至少两个电极之间施加dc电场时,在微通道壁处将经受高的力,从而引起电荷和流体通过微通道移动。声学微型泵依赖于声流,声流是指以下现象:(i)可压缩流体经受由声源驱动的高频振荡,其中非线性相互作用产生稳定电流或(ii)不可压缩流体在障碍物或界面附近振荡。特别地,基于声风、eulerian流和kundt粉尘的声流流动适用于微流控装置(参见suhandkangonacousticseparationin″encyclopediaofmicrofluidicsandnanofluidics″,springerreference,第1卷,第25至32页)。磁流体动力微型泵驱动在经受跨微通道垂直施加的电场和磁场的导电液体中的流体流动。所得洛伦兹力在垂直于电场和磁场二者方向的液体上产生,因此使得流体被泵送通过微通道。电流体动力微型泵利用电润湿来操作称为数字微流控(digitalmicrofluidics)的电极阵列之上的流体的离散微滴。电润湿是由于在固体与电解质之间施加电场而产生的两者之间的接触角的变化。用气体可渗透微流控装置材料(如pdms)操作气体渗透微型泵。工作原理是去除气体可渗透材料中存在的所有残留气体(例如,通过将装置置于真空中15分钟至20分钟)将在微通道中产生局部真空,这可以将流体拉动通过通道。关于上述微型阀和微型泵的综述,参见au等,micromachines2011,2,179-220。
术语“微滴产生器”是指在不混溶相中产生单分散水或油微滴流的结构。微流控微滴产生器通过组合两种或更多种不混溶流体流并对非连续相产生剪切力而使其破裂成离散的微滴来起作用。优选的微滴产生器是聚焦流微滴产生器和t形微滴产生器。聚焦流微滴产生器基于位于分散相的侧面或围绕分散相(被聚焦或芯流体)的连续相流体(聚焦或壳流体),从而在这两种流体被挤出通过的孔口附近引起微滴破裂。t形微滴产生器使用微通道t接合部,在此利用各来自朝向该接合部的一个方向的油与水性流之间的界面不稳定性在交叉处自发地形成微滴。关于产生微滴的另一些方法,参见上述区室化或微胶囊化方法。
在一个特定实施方案a中,装置还包含检测通道下游的用于基于所检测颗粒的信号来分离微流控微滴的分选通道,其中分选分路器与检测点之间的距离为500μm或更小,优选小于球形微流控微滴直径的10倍、9倍、8倍、7倍、6倍、5倍或甚至3倍。在这方面,术语“距离”不是指微滴在通道中经过的距离,而是指点之间的最短空间距离,与通道路径无关。该实施方案的优点在于使用放大倍数为至少20倍,优选至少30倍,更优选至少40倍或甚至至少50倍的物镜可以更容易地监测微流控微滴的检测和分选二者(即,在物镜的同一视场内)。优选地,使用具有所述物镜的显微镜进行该检测和分选。
在可与实施方案a组合的一个特定实施方案b中,如上所述,装置的分选通道和/或检测通道弯折或具有弯曲部。这有利地有助于实现检测点与分选接合部之间的短距离。
在可与实施方案a和/或b组合的一个特定实施方案c中,装置还包含在分选接合部的上游且在检测点的下游的一个或更多个流体入口,以用于将流体注入到分选通道中。流体的注入是为了控制通过的微滴,以促进分选。“控制通过的微滴”优选地意指将其间隔至彼此的最小或限定距离和/或将其间隔以使其聚集在分选接合部附近。在一个优选的实施方案中,微滴被间隔开以使得两个连续微滴之间的距离是微滴直径的至少10倍、8倍、6倍、4倍或2倍。使微滴聚集在分选接合部附近意指通过附加的流体入口聚集以调整微滴的轨迹,以使得在不存在如上所述的方式(例如dep、阀等)的任何微滴操作下,使微滴通过最终进入废物通道,即在其中表现出不期望的表型的微滴被冲走的通道。废物通道优选为至少两个分支通道中的一个。
在一个优选的实施方案中,管理一个或更多个流体入口以使得不管检测和/或分选决定如何,所有微滴都以相同的方式受到控制,即对其控制不是分选。这具有这样的优点,仅需要最小的脉冲来进行分选,即将微滴轻推到分选接合部处的分支通道中或者甚至轻推到分选接合部的上游。术语“管理”意指受控,并且仅用于避免与微滴的控制混淆。优选地,流体入口由控制装置(如cpu)管理,所述控制装置从本文所述的检测装置和/或(可能附加的)摄像机接收关于微滴在通道中(特别是在分选通道中)的位置的信息,优选关于其与通道壁的距离的信息。
上述实施方案a、b和c各自的附加装置特征对于本发明的方法本身各自是有利的,即没有表征第五方面装置的装置特征,也就是说没有装置被设计成使得相比于具有球形形状时的同一微流控微滴,至少在检测点处的检测通道中限制微流控微滴内颗粒的至少垂直移动的特征。
因此,在第六方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的微流控装置,其包含具有检测点的检测通道,特征在于其包含在检测通道下游的分选通道,所述分选通道具有用于基于所检测颗粒的信号来分离微流控微滴的分选接合部,其中分选接合部与检测点之间的距离为500μm或更小(如上所述),优选小于球形微流控微滴直径的10倍、9倍、8倍、7倍、6倍、5倍或甚至3倍。
优选地,该微流控装置的特征还在于以下中的一个或更多个:
(i)所述装置被设计成使得相比于具有球形形状时的同一微流控微滴,至少在检测点处的检测通道中限制微流控微滴内颗粒的至少垂直移动,
(ii)所述装置的分选通道和/或检测通道如上所述弯折或具有弯曲部,和/或
(iii)所述装置还包含在分选接合部的上游且在检测点的下游的一个或更多个流体入口,以用于将流体注入到分选通道中。
第六方面的装置可以如关于本发明第五方面的装置所述进一步进行改进。
另外,在第七方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的微流控装置,其包含具有检测点的检测通道,特征在于其包含在检测通道下游的分选通道,所述分选通道具有用于基于所检测颗粒的信号来分离微流控微滴的分选接合部,其中所述装置的分选通道和/或检测通道如上所述弯折或具有弯曲部。
优选地,该微流控装置的特征还在于以下中的一个或更多个:
(i)所述装置被设计成使得相比于具有球形形状时的同一微流控微滴,至少在检测点处的检测通道中限制微流控微滴内颗粒的至少垂直移动,
(ii)其中分选接合部与检测点之间的距离为500μm或更小(如上所述),优选小于球形微流控微滴直径的10倍、9倍、8倍、7倍、6倍、5倍或甚至3倍,和/或
(iii)所述装置还包含在分选接合部的上游且在检测点的下游的一个或更多个流体入口,以用于将流体注入到分选通道中。
第七方面的装置可以如关于本发明第五方面的装置所述进一步进行改进。
另外,在第八方面,本发明涉及用于检测包含在微流控微滴中的一种或更多种颗粒的微流控装置,其包含具有检测点的检测通道,特征在于其包含在检测通道下游的分选通道,所述分选通道具有用于基于所检测颗粒的信号来分离微流控微滴的分选接合部,其中所述装置还包含在分选接合部的上游且在检测点的下游的一个或更多个流体入口以用于将流体注入到分选通道中。
优选地,该微流控装置的特征还在于以下中的一个或更多个:
(i)所述装置被设计成使得相比于具有球形形状时的同一微流控微滴,至少在检测点处的检测通道中限制微流控微滴内颗粒的至少垂直移动,
(ii)其中分选接合部与检测点之间的距离为500μm或更小(如上所述),优选小于球形微流控微滴直径的10倍、9倍、8倍、7倍、6倍、5倍或甚至3倍,和/或
(iii)所述装置的分选通道和/或检测通道如上所述弯折或具有弯曲部。
第八方面的装置可以如关于本发明第五方面的装置所述进一步进行改进。
微流控装置可以单独存在或可以是微流控系统的一部分。因此,在第九方面,本发明涉及微流控系统,其包含:
-根据第五方面、第六方面、第七方面和/或第八方面的微流控装置,和
-检测装置,其用于在检测点处检测包含在检测通道中微流控微滴中的至少一种颗粒。
优选地,检测装置是能够进行图案和/或信号识别的光传感器,例如光电倍增管,cmos或ccd摄像机,或者检测电极或成像装置(优选实时的),其中图案例如是微流控微滴或微流控微滴内的颗粒,并且其中信号例如是来自如本文所述的可检测标记的信号。在一个优选的实施方案中,成像装置包含摄像机和用于处理图像数据的单元(如计算机)。
在一些相关的实施方案中,微流控系统还可包含以下中的一个或更多个:用于将流体引入系统和/或通过系统的一个或更多个泵;一个或更多个高电压放大器;检测设备或系统如显微镜;一个或更多个阀;激光光谱设置,包含激光光源和光检测器;数据存储系统;和/或用于控制装置内的流体输送和/或方向,监测并控制装置中流体所经受的环境条件(例如温度、电流等)的控制系统。
在一个优选的实施方案中,微流控系统包含具有物镜的显微镜,其中物镜的放大倍数为至少20倍,优选至少30倍,更优选至少40倍或甚至至少50倍。
在第十方面,本发明涉及本发明的微流控微滴、装置和系统用于本发明方法的用途。特别地,涉及第一方面的微流控微滴用于第二方面的方法的用途。此外,涉及第五方面、第六方面、第七方面或第八方面的装置或者第九方面的微流控系统用于第二方面的方法的用途。此外,涉及第五方面、第六方面、第七方面或第八方面的装置或者第九方面的微流控系统用于第三方面的方法的用途,特别地,其中第三方面的方法包括如上所述的分选微流控微滴的步骤(d)。
通过以下实施例对本发明进行描述,这些实施例仅解释为举例说明性的而不限制本发明的范围。
实施例1
在第一个实施例中,本发明用于选择分泌结合人gpcr的抗体的b细胞。用gpcr的胞外结构域免疫小鼠,并在一些加强注射之后,从脾中分离b细胞。然后单独地将这些b细胞与用alexa-fluor405(在405nm处激发,在450nm处发射)标记的抗鼠二抗以及包被有gpcr的生物素化细胞外结构域和以不同于二抗的波长发射的附加生物素化染料(例如bio-alexa488或bio-alexa568)二者的8μm链霉亲和素珠一起包封在微滴中。将微滴在芯片外孵育几个小时(以使得微滴内部一抗的充分细胞分泌),然后再注射到上述检测和分选芯片中。通过激光光谱法测量各个微滴的二抗(以量化一抗与珠的结合)和生物素化染料(以确定珠在焦平面外的距离和/或激光点的最大强度)的荧光信号。在特定包封的b细胞分泌与包被有gpcr的珠结合的抗体的情况下,荧光标记的二抗也被固定在珠表面上。这在微滴通过激光时产生强而窄的荧光发射峰。相反地,如果由b细胞分泌的抗体不与珠结合,则观察到宽的低强度荧光峰。在珠在焦平面内和/或最大强度激光点内的情况下,生物素化染料的信号最大。相反地,如果珠在焦平面之外和/或在最大强度激光点之外,则测得的荧光信号会更弱。因此,将测得的二抗的荧光峰强度除以珠的最大峰强度允许定量地确定一抗与gpcr的结合,而与珠在微滴内的位置无关。因此,可以将这个归一化的值用作分选标准,以用于特异性分离容纳分泌与gpcr结合的抗体的b细胞的微滴。在分选步骤之后,通过rt-pcr扩增单独阳性分选的b细胞的抗体编码基因,并测序以揭示期望抗体的同一性。
实施例2
进行抗体对gpcr的激动作用的筛选。用gpcr的胞外结构域免疫小鼠,并在一些加强注射之后,从脾中分离b细胞。平行地,用钙黄绿素-蓝染色在gpcr活化(例如,通过短寿命gfp的表达)后产生绿色细胞内荧光信号的报道细胞。在下一步中,将b细胞和报道细胞共包封在微滴中,并孵育几小时以使得微滴内的抗体充分分泌。随后,将微滴再注入到微流控装置中以进行分选,例如如本文所述。对于分选,将绿色信号(表示gpcr活化)除以蓝色信号(表示报道细胞与焦平面和最强激光点的接近度),并收集显示该归一化参数的最高值的微滴。在分选步骤之后,通过rt-pcr扩增单独阳性分选的b细胞的抗体编码基因,并测序以揭示期望抗体的同一性。
实施例3
进行抗体对gpcr的拮抗作用的筛选。用gpcr的胞外结构域免疫小鼠,并在一些加强注射之后,从脾中分离b细胞。然后用非特异性染料如钙黄绿素-橙染色这些b细胞。平行地,用钙黄绿素-蓝染色在gpcr活化后产生绿色细胞内荧光信号的报道细胞。在下一步中,将b细胞、报道细胞和活化目标gpcr的药物共包封在微滴中,并孵育几小时以使得微滴内的抗体充分分泌。在不含任何分泌拮抗性抗体的b细胞的所有微滴中,报道细胞显示出强的绿色信号(由于药物的存在)。相反地,容纳分泌拮抗性抗体的b细胞的微滴消除了这种报道信号并表示目标表型。然而,如果特定微滴根本没有容纳报道细胞,则将检测到相同的表型(在绿色通道中)。在没有额外的措施的情况下,这将不可避免地导致选择许多假阳性b细胞。为了克服这个问题,在将微滴再注入到具有多个特定特征的分选装置中之后,以多色方式分析微滴以提高灵敏度:使用具有检测通道的芯片,其中微滴至少在z-维度上被压缩,并且使用45°角的分选通道首先分析存在正好一个b细胞(一个橙色峰)和一个报道细胞(一个蓝色峰)的微滴。只有满足该标准且额外地在绿色通道中显示没有或至少大大降低的测定信号的微滴被分选出。在分选步骤之后,通过rt-pcr扩增单独阳性分选的b细胞的抗体编码基因,并测序以揭示期望抗体的同一性。
实施例4
进行抗体与抗原如基质金属蛋白酶-1(mmp-1)的特异性结合的筛选。该筛选包括针对也与mmp-2结合的抗体的直接反筛选。用mmp-1的肽免疫小鼠,并在一些加强注射之后,从脾中分离b细胞。然后单独地将这些b细胞与用alexa-fluor405(在405nm处激发,在450nm处发射)标记的抗鼠二抗以及包被有mmp-1和bio-488二者的生物素化肽的8μm链霉亲和素珠一起包封在微滴中。此外,另外将包被有mmp-2和bio-alexa568的8μm链霉亲和素包被珠共包封在微滴中。对于分选,仅收集对于将405nm处的荧光信号除以488处的信号强度(表示与靶抗原mmp-1有效结合的归一化值)显示出强值,同时对于将405nm处的荧光信号除以568处的信号强度(表示不期望的与mmp-2结合的归一化值)显示出没有或仅有微弱的值的微滴。这样,可以确定mmp-1的高度特异性结合剂,其不与mmp-2结合。在分选步骤之后,通过rt-pcr扩增单独阳性分选的b细胞的抗体编码基因,并测序以揭示期望抗体的同一性。
实施例5
对微流控微滴内的染色细胞的可靠检测是具有挑战性的,因为细胞可以漂浮到焦平面和/或激光点的中心之外,导致发射的光具有高度可变的强度。为了克服这个问题,本发明人设计了一种具有特殊几何结构的新型分选芯片(图3和4):首先,通道中发生检测的部分(激光束聚焦在其上)与芯片的其余部分相比更窄且更浅(例如,与其余通道相比<50%)。这意味着微滴被转变成塞(完全填充通道的微滴),并且被包封的细胞在y维度(其中细胞可以离激光点的中心更近或更远)和z维度(其中细胞可以离焦平面更近或更远)二者上具有更小的空间自由度。值得注意的是,将整个芯片设计成窄而浅的通道是不可行的,否则堵塞发生得更加频繁。相反地,本发明的分选芯片具有不同的深度和宽度以用于分析和分选步骤。
荧光读出的灵敏度也可以通过使用高放大倍数物镜来提高。然而,对于能够处理足够大以培养哺乳动物细胞的微滴(通常直径为约100μm)的分选装置,当使用例如40倍物镜时,很难在同一视场中具有分析点和分选分路器。这是由于大微滴需要相比于30μm微滴分选器更大的通道尺寸的事实,而且还因为用于介电泳分选的电极的显着空间要求。本发明人设计了一种非常紧凑的分选芯片,其中即使使用40倍物镜时,分析点和分选分路器也在同一视场中(两者之间的距离小于500μm)。该紧凑设计也通过在检测和分选微滴的通道中具有成45°角的弯折来实现(参见图4)。该分选芯片的另一个特征是在压缩部(constriction)的下游但在分选分路器的上游的附加进油口。这允许微调微滴朝向分选接合部的轨迹。如果芯片包括这些新特征之一,则芯片是有利的,但是如果组合其中的多于一个或全部,则特别有利。
实施例6
将6μmfluoresbrite珠(在不同波长处同时发射的珠;可从polysciencesinc.商购获得)包封在微滴中并分析所得的荧光信号。所有珠具有近似相同数量的荧光团,并且因此在荧光强度方面应该表现出非常小的变化。然而,当仅分析单个荧光通道(例如,绿色或蓝色范围)时,观察到非常宽的荧光强度分布(参见图7a、b)。这是由于珠在微滴内部自由浮动的事实,意味着其可以在焦平面和/或激光点的中心的内部或外部。然而,当以蓝色信号将绿色信号归一化(例如,通过除相应的值)时,可以使该效应最小化(参见图7c)。所有事件大致在同一对角线上,意味着尽管在仅观察单个荧光通道时存在其强烈的信号变化,但是根据归一化双色读出结果对这些事件进行分选导致对具有相当的荧光强度的珠的收集。
- 还没有人留言评论。精彩留言会获得点赞!