长波长电压敏感染料的制作方法
相关申请的交叉引用
本申请根据35u.s.c.§119要求于2015年7月28日提交的临时申请序列号62/197,905的优先权,该临时申请的公开内容通过引用并入本文中。
政府许可权利
本发明是在由国立卫生研究院拨发的第ns078561号拨款下由政府支持进行的。政府对本发明具有一定的权利。
本公开提供水溶性远红至近红外(nir)发射化合物、制备所述化合物的方法以及所述化合物的用途。
背景技术:
可兴奋细胞例如神经元和心肌细胞的膜电位(vmem)的快速变化在定义这些特化细胞的细胞信号传导和生理学特征中起着核心作用。典型地,通过膜片钳电生理学来监测和测量vmem,其中连接至目标细胞的微电极能够以精细时间分辨率来高度敏感地记录膜电压。然而,电极的使用是高度侵入性的,限制对单细胞胞体的记录(空间钳位误差),并且具有极低通量。
技术实现要素:
本公开提供用于光学电压感测的光稳定的近红外(nir)平台的设计和合成。本公开的化合物是一类nir电压敏感染料,其利用光致电子转移(pet)触发来对膜电压进行光学探测。本文公开的化合物在活细胞中显示明亮的膜定位的nir荧光,具有高的光稳定性,并且在神经元中显示优异的电压敏感性。本公开的化合物可与用于细胞器的荧光染色剂、ca2+指示剂和电压敏感荧光蛋白一起使用;并且可与光遗传学致动器结合使用。本公开的化合物的高速度、敏感性、光稳定性和nir荧光分布使所述化合物成为用于非侵入性地研究神经元活动的有用平台。
本公开提供包含式i的结构的化合物:
其中a1选自ch2、chr'、cr'2、nh、o、s、se、te、sih2、sihr'、sir'2、geh2、gehr'、ger'2、snh2、snhr'、snr'2、pbh2、pbhr'或pbhr'2,其中r'选自由以下组成的组:h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基和任选地被取代的(c1-c11)杂炔基;x1-x11独立地选自n或c,其中当x基团是n时,则r基团不存在;并且r1-r15独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基、任选地被取代的(c1-c11)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环,并且其中r1至r5中的至少一个是磺酸酯基。
在另一实施方案中,本公开还提供包含式i(a)的结构的化合物:
其中,r2-r11独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c6)烷基、任选地被取代的(c1-c5)杂烷基、任选地被取代的(c1-c6)烯基、任选地被取代的(c1-c5)杂烯基、任选地被取代的(c1-c6)炔基、任选地被取代的(c1-c5)杂炔基、任选地被取代的(c5-c7)环烷基、任选地被取代的(c5-c7)环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环。
在又一实施方案中,本公开提供包含以下结构的化合物:
在另一实施方案中,本公开提供包含以下结构的化合物:
本公开还提供包含式ii的结构的化合物:
其中,a1选自ch2、chr'、cr'2、nh、o、s、se、te、sih2、sihr'、sir'2、geh2、gehr'、ger'2、snh2、snhr'、snr'2、pbh2、pbhr'或pbhr'2,其中r'选自由以下组成的组:h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基和任选地被取代的(c1-c11)杂炔基;w1是分子线部分;x1、x2和x4-x11独立地选自n或c,其中当x基团是n时,则r基团不存在;r1、r2和r4-r15独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基、任选地被取代的(c1-c11)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环。
本公开还提供包含式ii(a)的结构的化合物:
其中,l1选自由以下组成的组:
以及上述的任何组合;a1-a8各自独立地选自ch2、chr'、cr'2、nh、o、s、se、te、sih2、sihr'、sir'2、geh2、gehr'、ger'2、snh2、snhr'、snr'2、pbh2、pbhr'或pbhr'2,其中r'选自由以下组成的组:h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基和任选地被取代的(c1-c11)杂炔基;x1、x2和x4-x42独立地选自n或c,其中当x基团是n时,则r基团不存在;r1、r2和r4-r54独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基、任选地被取代的(c1-c11)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环;并且n1-n8独立地为选自0至10的整数。
在一特定实施方案中,本公开进一步提供包含式ii(b)的化合物:
其中,x1、x2和x4-x20独立地选自n或c,其中当x基团是n时,则r基团不存在;r2、r4-r11和r16-r26独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c6)烷基、任选地被取代的(c1-c5)杂烷基、任选地被取代的(c1-c6)烯基、任选地被取代的(c1-c5)杂烯基、任选地被取代的(c1-c6)炔基、任选地被取代的(c1-c5)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环;并且n1是0至5的整数。
在某一实施方案中,本公开提供包含式ii(c)的结构的化合物:
其中,r16、r17、r19和r20独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c6)烷基、任选地被取代的(c1-c5)杂烷基、任选地被取代的(c1-c6)烯基、任选地被取代的(c1-c5)杂烯基、任选地被取代的(c1-c6)炔基、任选地被取代的(c1-c5)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环;n1是0至5的整数。
在又一实施方案中,本公开还提供包含以下结构的化合物:
在另一实施方案中,本文公开的化合物具有以下特征中的一个或多个:在用入射光激发时,所述化合物发射远红至近红外光;所述化合物是水溶性的;所述化合物表现出最小的溶剂化显色;所述化合物在酸性或碱性环境中不发生螺环化;和/或所述化合物可发生光致电子转移。在另一实施方案中,本文公开的化合物的特征在于,在用入射光激发时发射远红至近红外光;是水溶性的;表现出最小的溶致变色效应;在酸性或碱性环境中不发生螺环化;以及可发生光致电子转移。
本公开还提供使细胞成像的方法,其包括:使所述细胞与本文公开的化合物接触;用具有第一波长的光照射所述细胞;通过检测具有第二波长的光使所述细胞成像,其中光的所述第一波长和所述第二波长具有不同的波长,并且其中所述具有所述第二波长的光在远红至近红外区/波长中。在另一实施方案中,所述方法进一步包括:使所述细胞与一种或多种额外的光遗传学工具接触;以及通过在一个或多个额外波长处检测光发射使所述细胞成像。光遗传学工具的实例包括但不限于gfp、ca2+指示剂、基于cpgfp的电压传感器和视紫红质通道蛋白2(chr2)。
本公开提供测量可兴奋细胞中的膜电位变化的方法,其包括:使所述可兴奋细胞与本文公开的化合物接触;刺激所述细胞以诱发动作电位;以及通过光学采样或电采样来测量动作电位放电。在另一实施方案中,使用电子倍增电荷耦合器件来测量所述光学采样。在又一实施方案中,使用全细胞电流钳或通过场刺激来刺激所述可兴奋细胞。可兴奋细胞的实例包括但不限于神经元、心肌细胞、肌细胞或分泌细胞。在又一实施方案中,所述方法探测神经元的膜电位。
在一特定实施方案中,本公开还提供试剂盒,所述试剂盒包含:包含本文公开的化合物于缓冲溶液中的等分试样,或包含本文公开的化合物于缓冲溶液中的、随后在使用前被稀释的浓缩溶液。
附图说明
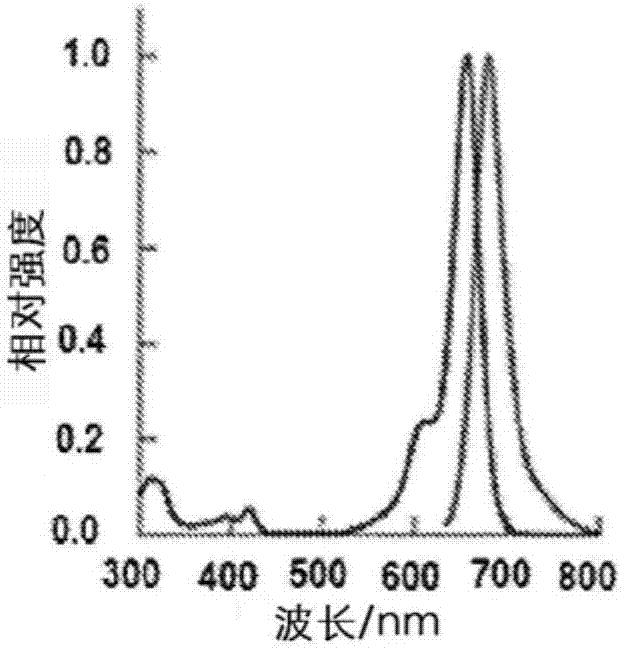
图1a-f提供跨膜电位berkeleyred传感器1(berst1)的体外和细胞表征。(a)在水性缓冲液(50mmtbs,ph7.5,0.1%sds)中的berst1的吸收(蓝色)和发射(红色)光谱。在635nm下提供激发。(b)berst1和vf2.1.cl染料在hek细胞中的光稳定性。给细胞加载200nmberst1或vf2.1.cl,然后以162w/cm2在631nm(berst1)或475nm(vf2.1.cl)下连续照射10分钟。以20秒间隔采集图像。绘制来自加载染料的细胞的标准化荧光强度对时间的曲线。洋红色圆圈表示berst1染色的细胞,绿色圆圈表示vf-2.1.cl染色的细胞。误差棒是n=6个独立实验的平均值的标准误差。用berst1进行多色落射荧光成像。给hek细胞加载1μmberst1、1μmhoechst33342和5μm罗丹明123。(c)定位于细胞膜的berst1荧光,(d)定位于线粒体的罗丹明123荧光,(e)定位于细胞核的hoechst33342荧光,以及(f)hek细胞的透射光dic。比例尺为10μm。
图2a-e显示berkeleyred的光谱表征。(a)在水性缓冲液中的br的吸收(蓝色)和发射(红色)光谱。在(b)各种介电常数(通过从10%至90%变动的二
图3a-c显示(a,b)berkeleyred和(c)berst1在hek细胞中的落射荧光成像。(a)用1μmbr染色并用631nm光(188w/cm2)照射的细胞显示可忽略的细胞荧光。(b)图(a)的增亮显示少量的染料内化,在细胞内和细胞外空间之间具有非常差的对比度。(c)用1μmberst1染色并用631nm光照射(80w/cm2,其光强度2.4×低于图(a)中的光强度)的细胞。观察到清楚的膜染色。所有的成像参数和显示设置对于图(a)和(c)是相同的,除了光强度,所述光强度对于berst1的照射为2.4×低。比例尺为20μm。
图4a-bberst1在hek细胞中的电压敏感性。(a)在全细胞电压钳条件下berst1染色的hek细胞的荧光分数变化(δf/f)对时间的曲线。将细胞保持在-60mv,并以20mv的增量步进至超极化或去极化电位(±100mv)。(b)δf/f对最终膜电位的曲线。(误差棒是来自三种不同培养物的n=15个细胞的平均值的±标准误差)。
图5a-d显示用berst1的动作电位(ap)可视化。(a)大鼠海马神经元(b)用1μmberst1染色,并进行场刺激以诱发动作电位,(c)光学记录所述动作电位。光学采样频率为500hz,用emccd相机在63倍放大率下采集。比例尺为10μm。在独立的实验中,神经元经历全细胞电流钳,并进行刺激以诱导动作电位放电。双重电记录和光学记录(1.8khz帧率)显示在图(d)中。黑色迹线是电生理学记录,红色圆圈表示光学响应。在黑色迹线中,在动作电位之前和之后,显而易见小的刺激伪迹。
图6a-e提供加载或未加载1μmberst1的大鼠海马神经元中细胞电生理学参数的比较。在加载染料和无染料的条件下评估诱发的动作电位。对于n=12和n=11个细胞的未加载的神经元和加载1μmberst1的神经元取动作电位的平均值。许多电生理学参数没有统计学显著差异,包括(a)峰值动作电位振幅,(b)如通过半峰全宽所测量的动作电位持续时间,(c)细胞电容,(d)上升时间,或(e)衰减时间。非配对t检验,p>0.5。误差棒是sem。
图7a-h显示用berst1对gfp阳性大鼠海马神经元中的诱发活动进行成像。通过场刺激来诱发来自(a)表达gfp和(b)用berst1染色的神经元的动作电位,并在面板(a)和(b)中所示的感兴趣区域中记录(c-h)。在5hz下提供刺激,并在500hz下光学记录。
图8a-c显示在gfp标记细胞中用berst1的自发电压成像。(a)表达gfp和(b)用berst1染色的大鼠海马神经元的落射荧光图像。比例尺为20μm。(c)来自图(a)和(b)的神经元中的自发活动的光学迹线。迹线旁边的数字对应于图(b)中所示的细胞。光学采样速率为500hz。迹线经背景补偿,并且漂白在clampfit中进行了校正。
图9a-e提供用berst1和gcamp6s的双重电压和ca2+成像。(a)用berst1染色和(b)表达gcamp6s的大鼠海马神经元的落射荧光图像。比例尺为20μm。(c)图(a)和(b)的神经元在场刺激期间连续ca2+和电压成像。电压-(上面的)和ca2+-(下面的)诱导的荧光变化。在所示频率下,(d)电压-(左侧)和(e)ca2+-(右侧)诱导的对一系列动作电位的荧光响应。对于berst1,光学采样速率为500hz,对于gcamp6s,光学采样速率为40hz。
图10a-f显示用经遗传编码的电压荧光蛋白和小分子电压敏感染料的双色电压成像。(a)用berst1染色和(b)表达电压敏感荧光蛋白asap1的大鼠海马神经元的落射荧光图像。通过(c)berst1染色或(d)asap1荧光的电压功能成像的放大区域。放大区域对应于图(a)和(b)中的白色方框。所有比例尺均为20μm。通过(e)berst1荧光(上面的迹线)或asap1荧光(下面的迹线)的变化而检测的通过5hz场刺激诱发的一系列动作电位。(f)从图(e)放大的单个动作电位。洋红色为berst1,绿色为asap1荧光。光学采样速率为1.25khz。迹线经背景校正,但未经漂白校正。
图11a-e提供berst1在大鼠海马神经元中的交叉激发。图a-c表示加载1μmberst1并在(a)631nm、(b)475nm或(c)390nm(对于所有波长,9.7w/cm2)下激发的来自培养物的神经元的相同区域。比例尺为20μm。(d)对于每种激发条件,将680nm下的相对发射强度定量。误差棒是n=5个独立细胞的±sem。(e)在631nm(6.7w/cm2)或390nm(3.3w/cm2)光下激发时,用berst1染色的神经元的电压敏感性。对于631nm和390nm激发,荧光分数变化经计算分别为每100mv26%δf/f和28%δf/f(n=4个独立的细胞)。
图12a-c提供berst1和br的体外交叉激发。水性缓冲液(50mmtbs,ph7.5,0.1%sds)中的(a)berst1和(b)br在不同激发波长下的发射扫描。(c)对于berst1(黑色棒)和br(灰色棒),680nm下的相对荧光发射强度对激发波长。
图13a-f提供用berst1和chr2的光电生理学。(a)表达yfp-chr2和(b)用berst1染色的大鼠海马神经元的落射荧光图像。图(b)上的插图是由虚线白色方框所刻区域。插图图像是用于收集图(d)和(f)的数据的单帧。比例尺为20μm(图a/b)和10μm(图(b)的插图)。表达yfp-chr2并用berst1染色的神经元的、由光遗传学刺激诱发的膜电位变化的同时(c)电生理学和(d)光学记录。以5hz的速率以5ms脉冲提供青色光(475nmled,80mw/cm2)。图(c)和(d)的红色虚线方框中突出显示的动作电位的(e)电生理学和(f)光学记录的放大图。光学采样速率为1khz。光学迹线经背景校正,但未经漂白校正。
图14a-e用berst1和chr2的全光电生理学。(a)用berst1染色和(b)表达yfp-chr2的大鼠海马神经元的落射荧光图像。(c)图(a)中的白色方框的放大图。该图像是用于收集图(d)和(e)的数据的单帧。比例尺为20μm。在(d)10hz或(e)5hz的速率下,对图(a-c)中的神经元用5ms脉冲青色光(475nm,0.08w/cm2)的光遗传学刺激的,光学响应(上面的)和电生理学(下面的)响应。以20khz的采样速率在附着细胞的膜片钳配置中获得电生理学记录。在1khz下采集的光学迹线未经漂白校正。
图15a-g提供使用berst1和chr2来扰乱网络活动。在两个独立的3秒周期内,用475nm光(80mw/cm2,5ms,5hz,青色棒)刺激(a)用yfp-chr2转染和(b)用berst1染色的培养的大鼠海马(c)神经元,以诱发yfp-chr2表达细胞中的活动。比例尺为20μm。(d)来自图(c)中的dic图像的神经元的示意图,颜色编码以匹配(e-g)中的相应迹线。蓝色chr2+细胞被描绘为可能与视场中的其它神经元连接。在(e)光学记录期和(f)随后的试验期间,用scmos相机在500hz下采集berst1响应的光学记录,间隔约30秒(双斜线)。迹线的编号和颜色指代图(a-d)中的特定神经元。红色方框表示出于清楚的目的在图(g)中被放大的迹线区域。在图(g)中提供灰色虚线,以帮助视觉估计berst1染色的神经元的峰定时(spiketiming)。
图16显示表达yfp-chr2的神经元。比例尺为20μm。总图像面积为665×665μm。虚线方框表示图15的近似成像区域。
图17显示2,5-二溴苯磺酸异丙酯的1hnmr。
图18显示2,5-二溴苯磺酸异丙酯的13cnmr。
图19显示溴-br的1hnmr。
图20显示溴-br的13cnmr。
图21显示br的1hnmr。
图22显示br的13cnmr。
图23显示berst1的1hnmr。
图24显示berst1的13cnmr。
图25显示berst1在254nm和650nm下的hplc迹线。
图26显示用h+淬灭后衍生自2,5-二溴苯磺酸异丙酯的有机锂试剂(粗反应混合物)的1hnmr谱。
具体实施方式
除非上下文另有明确规定,否则本文和所附权利要求书中所用的单数形式“一(a)”、“一(an)”和“所述(the)”包括复数指代物。因此,例如,提到“一荧光团”包括多个此类荧光团并且提到“所述电压敏感染料”包括提到一种或多种电压敏感染料或其本领域技术人员已知的等效物,等等。
此外,除非另有说明,否则“或”的使用意指“和/或”。类似地,“包含(comprise、comprises、comprising)”、“包括(include、includes和including)”可换用并且不意具有限制性。
应当进一步理解,当各种实施方案的描述使用术语“包含”时,所属领域技术人员将理解在一些特定情况下,实施方案可以可选地使用用语“基本上由……组成”或“由……组成”来加以描述。
出于描述和公开可以结合本文中的描述来使用的方法的目的,本文中所提到的所有出版物的全部内容均以引用方式并入本文中。此外,关于在出版物中出现的与本公开中明确定义的术语类似或相同的任何术语,在所有方面以本公开中明确提供的术语的定义为准。
除非另有定义,否则本文中所用的所有技术和科学术语都具有与本公开所属领域的一般技术人员所通常理解的含义相同的含义。尽管许多与本文所述的那些方法和试剂类似或等效的方法和试剂可用于实践所公开的方法和组合物,但现在描述示例性方法和材料。
术语“烷基”是指包含碳和氢原子的含有在碳之间的共价单键的有机基团。通常,除非另有说明,否则本公开中所用的“烷基”是指含有1至30个碳原子的有机基团。如果存在超过1个碳,那么所述碳可以线性方式连接,或者如果存在超过2个碳,那么所述碳还可以分支方式连接而使得母链含有一个或多个仲碳、叔碳或季碳。除非另有说明,否则烷基可被取代或未被取代。
术语“烯基”是指包含碳和氢原子的含有至少一个在两个碳之间的共价双键的有机基团。通常,除非另有说明,否则本公开中所用的“烯基”是指含有1至30个碳原子的有机基团。尽管c1-烯基可与母链的碳形成双键,但三个或更多个碳的烯基可含有超过一个双键。在某些情况下,烯基会共轭,在其它情况下,烯基不会共轭,并且在又一些其它情况下,烯基可具有共轭延伸和非共轭延伸。另外,如果存在超过1个碳,那么所述碳可以线性方式连接,或者如果存在超过3个碳,那么所述碳还可以分支方式连接而使得母链含有一个或多个仲碳、叔碳或季碳。除非另有说明,否则烯基可被取代或未被取代。
术语“炔基”是指包含碳和氢原子的含有在两个碳之间的共价三键的有机基团。通常,除非另有说明,否则本公开中所用的“炔基”是指含有1至30个碳原子的有机基团。尽管c1-炔基可与母链的碳形成三键,但三个或更多个碳的炔基可含有超过一个三键。如果存在超过1个碳,那么所述碳可以线性方式连接,或者如果存在超过4个碳,那么所述碳还可以分支方式连接而使得母链含有一个或多个仲碳、叔碳或季碳。除非另有说明,否则炔基可被取代或未被取代。
本公开中所用的术语“环烷基”是指含有至少3个碳原子但不超过12个碳原子的烷基,这些碳原子经连接而使得所述烷基形成环。出于本公开的目的,“环烷基”涵盖1至12个环烷基环,其中当所述环烷基大于1个环时,那么所述环烷基环经接合而使其连接、稠合或其组合。环烷基可被取代或未被取代,或在超过一个环烷基环的情况下,一个或多个环可未被取代,一个或多个环可被取代,或其组合。
本公开中所用的术语“环烯基”是指含有至少3个碳原子但不超过12个碳原子的烯烃,这些碳原子经连接而使得所述烯烃形成环。出于本公开的目的,“环烯基”涵盖1至12个环烯基环,其中当所述环烯基大于1个环时,那么所述环烯基环经接合而使其连接、稠合或其组合。环烯基可被取代或未被取代,或在超过一个环烯基环的情况下,一个或多个环可未被取代,一个或多个环可被取代,或其组合。
本公开中所用的术语“芳基”是指仅含有碳作为环原子的、具有离域π电子云的共轭平面环体系。出于本公开的目的,“芳基”涵盖1至12个芳基环,其中当所述芳基大于1个环时,所述芳基环经接合而使其连接、稠合或其组合。芳基可被取代或未被取代,或在超过一个芳基环的情况下,一个或多个环可未被取代,一个或多个环可被取代,或其组合。
本公开中所用的术语“杂环”是指含有至少1个非碳环原子的环结构。出于本公开的目的,“杂环”涵盖1至12个杂环的环,其中当所述杂环大于1个环时,所述杂环的环经接合而使其连接、稠合或其组合。杂环可为杂芳基或非芳香族的,或在超过一个杂环的环的情况下,一个或多个环可为非芳香族的,一个或多个环可为杂芳基,或其组合。杂环可被取代或未被取代,或在超过一个杂环的环的情况下,一个或多个环可未被取代,一个或多个环可被取代,或其组合。通常,非碳的环原子为n、o、s、si、al、b或p。在存在超过一个非碳的环原子的情况下,这些非碳的环原子可为相同元素或不同元素(例如n和o)的组合。杂环的实例包括但不限于:单环杂环,例如氮丙啶、环氧乙烷、硫杂丙环、氮杂环丁烷、氧杂环丁烷、硫杂环丁烷、吡咯烷、吡咯啉、咪唑烷、吡唑烷、吡唑啉、二氧戊环、环丁砜、2,3-二氢呋喃、2,5-二氢呋喃、四氢呋喃、噻吩烷、哌啶、1,2,3,6-四氢-吡啶、哌嗪、吗啉、硫代吗啉、吡喃、噻喃、2,3-二氢吡喃、四氢吡喃、1,4-二氢吡啶、1,4-二
单独或作为后缀或前缀使用的术语“杂环基团”、“杂环部分”、“杂环的”或”杂环基”是指已从中移除一个或多个氢的杂环。
出于本公开的目的,当用作前缀(例如杂烷基、杂烯基、杂炔基或杂烃)时,术语“杂”是指一个或多个碳原子被作为母链一部分的非碳原子替代的指定烃。此类非碳原子的实例包括但不限于n、o、s、si、al、b和p。如果在杂基母链中存在超过一个非碳原子,那么该原子可为相同元素或可为不同元素(例如n和o)的组合。
术语“混合环体系”是指含有至少两个环并且其中所述环通过连接、稠合或其组合而接合在一起的任选地被取代的环结构。混合环体系包含不同环类型的组合,所述不同环类型包括环烷基、环烯基、芳基和杂环。
就烃、杂环等来说,术语“未被取代”是指其中母链不含取代基的结构。
就烃、杂环等来说,术语“被取代”是指其中母链含有一个或多个取代基的结构。
术语“取代基”是指取代氢原子的原子或原子团。出于本公开的目的,取代基将包括氘原子。
术语“烃”是指仅含有碳和氢的原子团。可用于本公开的烃的实例包括但不限于烷烃、烯烃、炔烃、芳烃和苄基烃(benzyls)。
术语“官能团”或“fg”是指分子内负责那些分子的特征性化学反应的特定原子团。无关于官能团所属分子的大小,相同官能团都将经历相同或类似的化学反应,但其相对反应性可被附近的官能团改变。官能团的原子通过共价键彼此连接并且连接到分子的其余部分。可用于本公开的fg的实例包括但不限于被取代或未被取代的烷基、被取代或未被取代的烯基、被取代或未被取代的炔基、被取代或未被取代的芳基、被取代或未被取代的杂烷基、被取代或未被取代的杂烯基、被取代或未被取代的杂炔基、被取代或未被取代的环烷基、被取代或未被取代的环烯基、被取代或未被取代的杂芳基、被取代或未被取代的杂环、卤素、羟基、酸酐、羰基、羧基、碳酸酯、羧酸酯、醛、卤代甲酰基、酯、过氧氢基、过氧基、醚、原酸酯、甲酰胺、胺、亚胺、酰亚胺、叠氮基、偶氮、氰酸酯、异氰酸酯、硝酸酯、腈、异腈、亚硝基、硝基、亚硝基氧、吡啶基、巯基、硫化物、二硫化物、亚磺酰基、磺基、硫氰酸酯、异硫氰酸酯、硫羰基、膦基、膦酰基、磷酸酯、si(oh)3、ge(oh)3、sn(oh)3、si(sh)4、ge(sh)4、aso3h、aso4h、p(sh)3、as(sh)3、so3h、si(oh)3、ge(oh)3、sn(oh)3、si(sh)4、ge(sh)4、sn(sh)4、aso3h、aso4h、p(sh)3、so2、so3-和as(sh)3。
如本文所用,波浪线与连接至原子的另一线相交指示此原子共价键结至存在但并未描绘于所述结构中的另一实体。波浪线不与线相交而连接至原子指示此原子通过键或其他类型的可识别的缔合与另一原子相交。
可兴奋细胞如神经元和心肌细胞的膜电位(vmem)的快速变化在定义这些特化细胞的细胞信号传导和生理学特征中起着核心作用。典型地,通过膜片钳电生理学地监测和测量vmem,其中连接至目标细胞的微电极能够以精细时间分辨率来高度敏感地记录膜电压。然而,电极的使用是高度侵入性的,限制对单细胞胞体的记录(空间钳位误差),并且具有极低通量。用于记录电压的光学技术代表对这些问题的可行解决方案,因为它们具有最小的侵入性,需要递送传感器和光子,并且可具有高通过量。长期以来,ca2+成像被用作用于电压的直接光学测量的替代物,部分是因为无论是基于小分子还是基于荧光蛋白的稳健的成像剂都是敏感的,适用于宽范围的生物学环境,并且具有多种颜色。ca2+成像的使用仅提供vmem变化的不完美近似,因为细胞内[ca2+]([ca2+]i)上升由vmem的去极化触发。另外,由于[ca2+]i瞬变持续数百毫秒,并且由于ca2+传感器本身可以缓冲[ca2+]i的上升和下降,因此分辨快闪神经元事件变得不可能或困难,从而需要广泛的去卷积方案。
因此,直接电压成像是有吸引力的,因为它可以提供vmem的直接读出,同时仍然实现ca2+成像的空间分辨率、高通量和最小的侵入性。近来,对通过使用小分子、荧光蛋白、两者的组合、或视蛋白来开发荧光电压传感器重新有了兴趣。
本文公开的电压敏感染料在nir窗口中具有激发和发射谱,这使得本文公开的化合物能够与其它光学工具整合。例如,质膜的去极化导致本文公开的化合物的nir荧光的快速增加(例如,每100mv,≥24%δf/f)。另外,对于像组织切片或整个动物那样的较厚生物样品中的成像,nir激发和发射谱(650-900nm)是理想的,因为较低能量光子减少组织损伤,减少散射,被更少的内源性生色团吸收,并产生较低水平的自发荧光。在直接对比中,voltagefluor或vf染料,一种依赖于由vmem的变化调节的光致电子转移(pet)的用于电压感测的小分子平台,由于具有位于电磁波谱的蓝色/绿色区域中的激发和发射谱而显著受到限制。由于这些vf染料在480-515nm范围内被激发并且在约530nm发射,因此,它们的发射与许多有用的光学工具明显重叠,所述光学工具例如gfp、稳健的ca2+传感器如oregongreenbapta和gcamp家族,以及光遗传学工具如视紫红质通道蛋白2(chr2)。因此,本文公开的化合物避免了与使用vf染料或其它化合物在较短波长成像有关的缺点。
此外,本公开的化合物可与用于细胞器的荧光染色剂、ca2+指示剂和电压敏感荧光蛋白一起使用;并且可与光遗传学致动器如视紫红质通道蛋白2(chr2)(其利用蓝光)结合使用,本公开的化合物的红移光谱分布使得能够在神经元中实现光电生理学。
本公开因此描述了用于电压感测应用的染料化合物的设计、合成和表征。本公开的化合物显示明亮的膜定位的荧光,具有高的光稳定性,并且极其电压敏感。这些化合物可以检测例如培养的海马神经元中的动作电位并且与许多其它光学工具容易地接口。因此,本公开的化合物理想地适用于使用gfp、ca2+指示剂例如gcamp、基于cpgfp的电压传感器例如asap1以及光遗传学工具例如chr2的多色成像。与chr2一起使用本公开的化合物允许在单个细胞和神经元微回路中非侵入性地记录和控制膜电位。
包含本公开的化合物的分子探针在测量膜电位方面具有重要作用,因为本公开的化合物不需要任何遗传操作,可以递送至所有细胞类型,快速响应于快速的电压变化,并且可以在宽的颜色范围内进行调节。此外,在本文公开的某些实施方案中,所述化合物可进一步包含基于亚苯基亚乙烯基分子线的平台。因此,本文公开的化合物的发射谱可以基于分子线平台的结构修饰或通过对荧光团进行微小的改变而进行调节。因此,本公开的化合物是用于在各种系统中绘制膜电位动态的极有价值的工具。
在一个实施方案中,本公开提供具有式i的结构的化合物:
其中,
a1选自ch2、chr'、cr'2、nh、o、s、se、te、sih2、sihr'、sir'2、geh2、gehr'、ger'2、snh2、snhr'、snr'2、pbh2、pbhr'或pbhr'2,其中r'选自由以下组成的组:d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基和任选地被取代的(c1-c11)杂炔基;
x1-x11独立地选自n或c,其中当x基团是n时,则r基团不存在;并且
r1-r15独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基、任选地被取代的(c1-c11)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环。在另一实施方案中,式ii的r1至r5中的至少一个是磺酸酯基。
在另一实施方案中,本公开提供具有式i(a)的结构的化合物:
其中,
r2-r15独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c6)烷基、任选地被取代的(c1-c5)杂烷基、任选地被取代的(c1-c6)烯基、任选地被取代的(c1-c5)杂烯基、任选地被取代的(c1-c6)炔基、任选地被取代的(c1-c5)杂炔基、任选地被取代的(c5-c7)环烷基、任选地被取代的(c5-c7)环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环。
在又一实施方案中,本公开提供具有以下结构的化合物:
在又一实施方案中,本公开提供具有式ii的结构的化合物:
其中,
a1选自ch2、chr'、cr'2、nh、o、s、se、te、sih2、sihr'、sir'2、geh2、gehr'、ger'2、snh2、snhr'、snr'2、pbh2、pbhr'或pbhr'2,其中r'选自由以下组成的组:d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基和任选地被取代的(c1-c11)杂炔基;
w1是分子线部分;
x1、x2和x4-x11独立地选自n或c,其中当x基团是n时,则r基团不存在;
r1、r2和r4-r15独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基、任选地被取代的(c1-c11)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环。在另一实施方案中,r1、r2、r4和r5中的至少一个是磺酸酯基。
在一个实施方案中,本公开还提供包含式ii(a)的结构的化合物:
其中,
l1选自由以下组成的组:
以及上述的任何组合;
a1-a8各自独立地选自ch2、chr'、cr'2、nh、o、s、se、te、sih2、sihr'、sir'2、geh2、gehr'、ger'2、snh2、snhr'、snr'2、pbh2、pbhr'或pbhr'2,其中r'选自由以下组成的组:d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基和任选地被取代的(c1-c11)杂炔基;
x1、x2和x4-x42独立地选自n或c,其中当x基团是n时,则r基团不存在;
r1、r2和r4-r54独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c12)烷基、任选地被取代的(c1-c11)杂烷基、任选地被取代的(c1-c12)烯基、任选地被取代的(c1-c11)杂烯基、任选地被取代的(c1-c12)炔基、任选地被取代的(c1-c11)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环;并且
n1-n8独立地为选自0至10的整数。
在另一实施方案中,r1、r2、r3和r4中的至少一个是磺酸酯基。
在另一实施方案中,本公开提供包含式ii(b)的结构的化合物:
其中,
x1、x2和x4-x20独立地选自n或c,其中当x基团是n时,则r基团不存在;
r2、r4-r11和r16-r26独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c6)烷基、任选地被取代的(c1-c5)杂烷基、任选地被取代的(c1-c6)烯基、任选地被取代的(c1-c5)杂烯基、任选地被取代的(c1-c6)炔基、任选地被取代的(c1-c5)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环;并且n是1至5的整数。
在另一实施方案中,本公开提供具有式ii(c)的结构的化合物:
其中,
r16、r17、r19和r20独立地选自h、d、任选地被取代的fg、任选地被取代的(c1-c6)烷基、任选地被取代的(c1-c5)杂烷基、任选地被取代的(c1-c6)烯基、任选地被取代的(c1-c5)杂烯基、任选地被取代的(c1-c6)炔基、任选地被取代的(c1-c5)杂炔基、任选地被取代的环烷基、任选地被取代的环烯基、任选地被取代的芳基、任选地被取代的杂环、任选地被取代的混合环体系,其中一个或多个相邻的r基团可连接在一起以形成一个或多个选自包括环烷基、环烯基、杂环、芳基和混合环体系的组的取代环;
n是0至5的整数。
在又一实施方案中,本公开提供具有以下结构的化合物:
应当进一步注意,对于本文所述的任何结构(例如,式i、i(a)、ii、ii(a)、iii),本文进一步涵盖前述结构的任何共振形式。例如,具有式iii的结构的化合物可以包括如下的共振结构:
应当进一步理解,虽然本文描述的式表示为具有带电荷的物质,但本文也涵盖不带电荷的物质。因此,所述式应当被视为除了所描述的带正电荷的氮和带负电荷的硫基团之外,提供不带电荷的基团。
在本文所述的某些实施方案中,本公开的化合物的特征在于,为电压敏感的并且在用入射光激发时,发射在近红外(nir)区域的光。本文所述化合物的优点包括来自生物样品的最小干扰吸收和荧光、廉价的激光二极管激发以及减少的散射和增强的组织穿透深度。在另一实施方案中,本文描述的化合物的特征还在于水溶性和/或表现出最小的溶致变色效应。
在一特定实施方案中,本公开提供包含本文公开的化合物的用于探测神经元中的膜电位动态的传感器。在又一实施方案中,所述传感器通过光致电子转移(pet)触发。
在某一实施方案中,本公开提供使用本文公开的化合物的方法,其包括:用入射光激发所述化合物;测量所述化合物的远红至近红外光的发射。在另一实施方案中,对由所述化合物在650nm至800nm处发射的光进行定量。在又一实施方案中,对由所述化合物在650nm至685nm处发射的光进行定量。在另一实施方案中,所述化合物可以通过使所述化合物暴露于波长为380nm至640nm的入射光来激发。在又一实施方案中,入射光具有约630nm或约390nm的波长。在特定实施方案中,本文公开的化合物可用于细胞成像、药物筛选和电压感测的方法中。在另一实施方案中,所述化合物理想地适用于探测神经元中的膜电位动态。在又一实施方案中,本文公开的化合物可用于筛选影响膜电位/离子通道的药物或针对药物安全性和/或效力进行筛选。
本公开提供用于筛选测试样品,例如影响生物细胞中的膜电位的潜在治疗药物的方法。这些方法包括在存在和不存在(对照测量)测试样品或试剂下测量膜电位。对照测量通常用含有除假定药物以外的测试样品的所有组分的样品进行。检测到在测试试剂存在下相对于对照的膜电位变化,表明测试试剂具有活性。膜电位也可以在存在或不存在已知活性(即,标准试剂)或假定活性(即,测试试剂)的药理学试剂下来测定。通过本文公开的方法检测的膜电位的差异允许将测试试剂的活性与标准试剂的活性相比较。应当认识到,药物筛选方案的许多组合和排列是本领域技术人员已知的,并且它们可以容易地适于与本文公开的膜电位测量方法一起使用以鉴定影响膜电位的化合物。本公开涵盖本文公开的膜电位测定技术与所有这些方法的组合的用途。
在特定的应用中,本公开提供鉴定调节膜中离子通道、泵或交换器的活性的化合物的方法,其包括:(a)给细胞加载本公开的化合物(即,电压敏感染料),其如本文所述测量膜电位;(b)测定膜电位;(c)使所述细胞暴露于测试样品/试剂;(d)重新测定膜电位并与(b)中的结果进行比较以确定测试样品的效果;(e)任选地,将膜暴露于调节离子通道、泵或交换器的刺激,并重新测定膜电位,并与(d)中的结果进行比较以确定测试样品对刺激响应的影响。
如本文所用,离子通道包括但不限于钠、钙、钾、非特异性阳离子和氯离子通道,它们中的每一个可以是组成性开放的、电压门控的、配体门控的,或由细胞内信号传导途径控制。
可被筛选的生物细胞包括但不限于哺乳动物细胞的原代培养物、直接或在原代培养之后从哺乳动物组织分离的细胞。细胞类型包括但不限于白细胞(whitebloodcell)(例如白细胞(leukocyte))、肝细胞、胰腺β细胞、神经元、平滑肌细胞、肠上皮细胞、心肌细胞、神经胶质细胞等。本公开还包括使用重组细胞,其中已通过基因工程插入并表达离子转运蛋白、离子通道、泵和交换器。细胞通常是哺乳动物细胞,例如l-m(tk-)细胞、神经母细胞瘤细胞、星形细胞瘤细胞和新生儿心肌细胞。
本文所述的筛选方法可以在生长于或沉积在固体表面上的细胞上进行。一种常见的技术是使用微量滴定板孔,其中荧光测量是由市售的荧光板读取器进行的。本公开包括在自动和半自动系统中的高通量筛选。
术语“膜电位调节剂”是指能够改变细胞或亚细胞隔室的静息或刺激膜电位的组分。该术语包括独立的化合物、离子通道、受体、孔形成蛋白或这些组分的任何组合。
试剂盒也是本公开的一个特征。所述试剂盒的实施方案包含至少一种根据本文所述的任何一种通式的化合物。此类试剂盒适用于基于光致电子转移的电压感测应用。在其它实施方案中,此类试剂盒适用于药物筛选(例如,筛选影响膜电位/离子通道的药物或针对药物安全性和效力进行筛选)。在一些实施方案中,所述试剂盒还包含至少一种缓冲液,在所述缓冲液中所述化合物在与可兴奋细胞结合使用时,将允许感测可兴奋细胞的膜电位的变化。或者,缓冲液可以作为浓缩溶液提供,随后在使用前对其进行稀释。在某些实施方案中,所述化合物可以被预先量取至一个或多个容器(例如试管或比色杯)中,并且随后通过将缓冲液和测试样品加入所述容器中进行检测。
所述试剂盒还可包括一个或多个在其中可进行检测的容器,例如一次性试管或比色杯。所述试剂盒还可以包括用于执行检测的说明书。
下面的实施例旨在说明而非限制本公开。尽管这些实施例是可能使用的典型实施例,但可以选择性地使用本领域技术人员已知的其它方法。
实施例
化学合成和表征的一般方法。化学试剂和溶剂(无水的)购自商业供应商,并且未经进一步纯化即使用。所有反应均在n2下在烘箱干燥的烧瓶中进行。薄层色谱(tlc)(silicycle,f254,250μm)和制备型薄层色谱(ptlc)(silicycle,f254,1000μm)在预涂覆硅胶的玻璃衬底板上进行,通过在uv光下荧光淬灭来显像。快速柱色谱使用强制空气流在0.5-1.0巴下,在silicyclesilicaflashf60(230-400目)上进行。nmr谱在brukeravb-400mhz,100mhz、avq-400mhz,100mhz、brukerav-600mhz,150mhz上测量。nmr谱在配备tci冷冻探针附件的brukeravii-900mhz,225mhz上测量。化学位移以百万分率(ppm)表示,并参照cdcl37.26ppm,77.0ppm。偶合常数报告为赫兹(hz)。分裂模式表示如下:s,单峰;d,双峰;sep,七重峰;dd,双二重峰;ddd,双组二重峰;dt,双三重峰;td,三二重峰;以及m,多重峰。高分辨率质谱(esiei)通过加州大学伯克利分校的qb3/化学质谱服务测量。高效液相色谱(hplc)和低分辨率esi质谱在耦联至advioncms-lesi质谱仪的agilentinfinity1200分析仪器上进行。用于分析型hplc的柱是phenomenexlunac18(2)(4.6mmi.d.×150mm),流速为1.0ml/min。流动相为具有0.05%甲酸的mq-h2o(洗脱剂a)和具有0.05%甲酸的hplc级乙腈(洗脱剂b)。用梯度10-100%洗脱剂b在254nm和650nm下监测信号20分钟。
光谱研究。在dmso中制备br和berst1的原液(1.0-10mm),并用含有0.10%(w/w)sds的tbs(50mmtris-hcl,ph7.5,0.15mnacl)溶液稀释(1:100至1:1000稀释)。使用shimadzu2501分光光度计(shimadzu)和quantamastermaster4l-format扫描荧光分光光度计(photontechnologiesinternational)来记录uv-vis吸收和荧光光谱。荧光计配备有lps-220b75-w氙灯和电源、带有集成点火器的a-1010b灯罩、可切换814光子计数/模拟光电倍增管检测单元和md5020电机驱动器。在1cm路径长度的石英比色杯(starnacells)中测量样品。相对量子产率在含有0.10%(w/w)sds的tbs溶液中或在ch3oh中测量,并参照在ch3oh中的甲酚紫,其量子产率为0.54。
细胞培养。将人胚肾293t(hek)细胞传代并平板接种至预涂覆有聚-d-赖氨酸(pdl;1mg/ml;sigma-aldrich)的12mm玻璃盖玻片上,以提供约15%和50%的融合度分别用于电生理学和成像。将hek细胞接种并维持在补充有4.5g/ld-葡萄糖、10%fbs和1%glutamax的达尔伯克氏改良伊格尔培养基(dmem)中。
在冷的无菌hbss(无ca2+,无mg2+)中,从第18天胚胎斯普拉格-道来(spraguedawley)大鼠(charlesriverlaboratory)解剖海马。除非另有说明,否则所有解剖产品都是由invitrogen提供的。将海马组织在37℃下用胰蛋白酶(2.5%)处理15分钟。使用火抛光的巴斯德吸管,在补充有5%胎牛血清(fbs;thermoscientific)、2%b-27、2%1md-葡萄糖(fisherscientific)和1%glutamax的最低必需培养基(mem)中研磨组织。将解离的细胞以30,000-40,000个细胞/盖玻片的密度,在mem补充培养基(如上所述)中接种至用pdl预处理(如上所述)的12mm直径盖玻片(fisherscientific)上。将神经元保持在37℃下含5%co2的加湿培养箱中。在体外第3天(div),取出一半的mem补充培养基,并补充以含有2%b-27补充物和1%glutamax的neurobasal培养基。在7div,使用lipofectamine3000进行遗传工具的转染。除了在12-15div神经元上进行的电生理学实验外,在13-20div成熟神经元上进行功能成像。
除非另有说明,否则对于hek细胞和海马神经元的加载,将berst1在dmso中稀释至1mm,然后在hbs(单位mm)140nacl,2.5kcl,10hepes,10d-葡萄糖,1.3mgcl2和2cacl2;ph7.3和290mosmol中以1:1000稀释。所有成像实验均在hbs中进行。
dna构建体。本文所述的实验中使用的构建体包括视紫红质通道蛋白-2-yfp(chr2-yfp)、puro-cag-asap1和gcamp6s。chr2-yfp利用突触蛋白启动子驱动视紫红质通道蛋白-2的神经元表达;puro-cag-asap1表达由鸡β-肌动蛋白启动子驱动;并且gcamp6s表达由哺乳动物细胞中的巨细胞病毒启动子驱动。
一般成像参数。在配备spectra-xlightengineled灯(lumencor)的、用slidebook(v6,intelligentimaginginnovations)控制的axioexaminerz-1(zeiss)上进行落射荧光成像。多个led的共射激发由lumencor软件控制,所述lumenor软件通过digidata1332a数字转换器和pclamp10软件(moleculardevices)触发。使用w-plan-apo20x/1.0水物镜(20x;zeiss)或w-plan-apo63x/1.0水物镜(63x:zeiss)采集图像。将图像聚焦至orcaflash4.0scmos相机(scmos;hamamatsu)或evolve128emccd相机(emccd;photometrix)上。
berst1在hek细胞中的多色成像和光稳定性。将hek细胞与含有berst1(1.0μm)、hoechst33342(1.0μm,molecularprobes)和罗丹明123(5.0μm,sigma-aldrich)的hbss溶液(gibco)在37℃下孵育15分钟。用w-plan-apo63x/1.0物镜(zeiss)和oracflash4.0scmos相机(hamamatsu)采集显微图像。对于berst1图像,在631/28(带通)nm从led(67w/cm2;100ms曝光时间)递送激发光,并且在通过四重二向色镜(432/38、509/22、586/40、654nmlp)之后用四重发射滤光片(430/32、508/14、586/30、708/98nm)收集发射。对于hoechst33342图像,在390/22nm从led(33w/cm2;100ms曝光时间)递送激发光,并且在通过二向色镜(510nmlp)之后用发射滤光片(540/50nm)收集发射。对于罗丹明123图像,在475/34nm从led(57w/cm2;100ms曝光时间)递送激发光,并且在通过二向色镜(510nmlp)之后用发射滤光片(540/50nm)收集发射。
将hek细胞分别与berst1(0.20μm)和vf2.1.cl(0.20μm)在hbss中在37℃下孵育15分钟。用w-plan-apo63x/1.0物镜(zeiss)和evolve128emccd相机(photometrics)收集数据。在led(162w/cm2;100ms曝光时间)的持续照射下,每隔20秒拍摄图像(像素尺寸为0.38μm×0.38μm),持续10分钟。对于berst1图像,在631/28nm下递送激发光,并且在通过四重二向色镜(432/38、509/22、586/40、654nmlp)之后用四重发射滤光片(430/32、508/14、586/30、708/98nm)收集发射。对于vf2.1.cl图像,在475/34nm下递送激发光,并且在通过二向色镜(510nmlp)之后用发射滤光片(540/50nm)收集发射。将获得的荧光曲线(减去背景值)以t=0处的荧光强度标准化,并取平均值(每种染料6个不同细胞)。
细胞外刺激实验。通过连接至含有两个铂电极(warner)的记录室的grass刺激器来递送细胞外场刺激,其中通过digidata1332a数字转换器和pclamp10软件(moleculardevices)提供触发。通过在5hz下递送的1ms80v场电位来触发动作电位。为防止复发活性,用突触阻断剂10μm2,3-二氧代-6-硝基-1,2,3,4-四氢苯并[f]喹喔啉-7-磺酰胺(nbqx;santacruzbiotechnology)和25μmdl-2-氨基-5-膦酰基戊酸(apv;sigma-aldrich)补充hbs浴溶液。使用emccd相机和63x物镜进行berst1的功能成像。用强度为127w/cm2的631nm光(led;631nm,28nm带通)来激发berst1。来自berst1的发射用680/10nm带通发射滤光片收集(在通过四重二向色镜(432/38nm、509/22nm、586/40nm、654nmlp)之后),或者对于gcamp6s和asap实验,在通过四重二向色镜之后,用四重滤光片(四重发射滤光片(430/32nm、508/14nm、586/30nm、708/98nm)收集。除了asap1成像(1.25khz)以外,berst1成像的光学采样速率为0.5-0.53khz。使用475nm光(led;475nm,34nm带通)照射绿色光谱遗传工具(gfp、gcamp6s和asap1)。对于功能成像,对于gcamp6s,使用33w/cm2的强度,对于更弱荧光的asap1,使用200w/cm2的强度,这是系统的最大475nmled强度。在通过510nm长通二向色镜之后,用540/50nm带通滤光片收集发射。分别在40hz和1.25khz下进行gcamp6s和asap的功能成像。通过切换至较低放大率20x物镜结合emccd(gcamp6s/asap1)或scmos(gfp)相机来执行显示细胞形态的图像。
hek细胞中的电压敏感性。使用20x物镜,同时以0.5khz的采样速率从emccd相机捕获图像来进行berst1的功能成像。使用强度为6.7w/cm2的633nmled来激发berst1。对于初始电压表征(参见图4),用四重滤光片和二向色镜(见上文)收集发射。为了研究激发串扰期间的电压敏感性(参见图11),通过如上所述的633nmled和强度为3.3w/cm2的390nm光(紫色led,20nm带通)激发berst1,并且用680/10nm带通发射滤光片收集发射。
细胞的成像组。从许多大于5个神经元研究功能响应的成像实验(参见图8和图15)需要较大视场,其使用具有20x物镜的scmos相机获得。使用强度为20w/cm2的633nmled来激发berst1,并使用680/10nm带通发射滤光片收集发射。将图像4×4拼接,以使采样速率为0.5khz。通过475nmled激发gfp,并在通过510nm长通二向色镜之后,用540/50nm带通滤光片收集发射。通过用510nm光(led;510nm,25nm带通)激发的yfp融合来鉴定chr2阳性神经元,并在通过三重二向色镜(475/30nm、540/25nm、642/96nm)之后,通过三重发射滤光片(473/22nm、543/19nm、648/98nm)收集发射。在5hz的频率下,通过80mw/cm2、5ms脉冲的475nmled光来激活chr2。
berst1在膜片钳海马神经元中的成像。使用emccd相机和20x物镜进行膜片神经元的功能成像。该物镜具有较大的工作距离并允许定位膜片电极。使用强度为10w/cm2的633nmled来激发berst1,并使用680/10nm带通发射滤光片收集发射。对于动作电位波形的光学评估(参见图5),采样速率增加至1.8khz。对于所有光电生理学(参见图13和图14),采样速率增加至1khz。如上所述收集yfp图像。在5hz的频率下,通过80mw/cm2、5ms脉冲的475nmled光来刺激chr2。
交叉激发。通过用390nm、475nm和633nmled激发加载(1μm)berst1的海马神经元对串扰进行评估,所述led全部以9.7w/cm2的强度照射。使用680/10nm带通发射滤光片收集发射。
图像分析。使用自定义matlab程序对hek细胞中的电压敏感性进行分析。简言之,基于荧光强度自动选择感兴趣区域(roi),并将其作为掩码应用于所有图像帧。在已知的基线和电压阶跃时期计算荧光强度值。为了分析神经元中的berst1电压响应,在imagej中绘制包含细胞体的感兴趣区域,并且提取每个帧的平均荧光强度。berst1的光稳定性允许通过从所有原始荧光帧减去平均背景值来计算δf/f值,从而避开从每个帧减去背景而产生的噪声放大。未对所有实例迹线进行平均。为了比较以电生理学和光学方式记录的动作电位,使用clampfit10软件(moleculardevices)中的尖峰检测算法来分析成像迹线。对于交叉激发定量,将图像减去背景。通过使阈值达到最大像素强度的25%以去除非染色区域,来确定roi。计算染色神经元的平均强度值。
电生理学。对于电生理学实验,由硼硅酸盐玻璃(sutterinstruments,bf150-86-10)拉制吸管,电阻为5-8mω,并在吸管中填充内部溶液:(单位mm)115葡萄糖酸钾、10bapta四钾盐、10hepes、5nacl、10kcl、2atp二钠盐、0.3gtp三钠盐(ph7.25,275mosm)。在室温下使用axopatch200b放大器(moleculardevices)获得记录。用digidata1332a将信号数字化,在50khz下采样,并在pc上用pclamp10软件(moleculardevices)记录。以细胞上配置(on-cellconfiguration)补偿快电容。对于所有电生理学实验,仅当电压钳中的串联电阻小于30mω时,才进行记录。
对于hek293t细胞中的全细胞电压钳记录,将细胞保持在-60mv,并且20mv的增量从-100mv至+100mv施加100ms的超极化和去极化步骤。
对于海马神经元中的全细胞电流钳记录,在膜破裂之后,评估并记录(在i=0)静息膜电位,并在数据采集期间监测静息膜电位。如果它们在电压钳中显示串联电阻<30mω,则将神经元切换至电流钳模式。通过进行电桥平衡补偿来校正吸管尖端阻力。
为测试将berst1加载至神经元膜上是否对神经元的动作电位放电有影响,以0.05pa的增量将10个500ms的电流阶跃引入神经元中。在clampfit10软件(moleculardevices)中分析每次扫描的第一个动作电位,以给出振幅和动力学数据。在记录期间由clampex软件确定细胞电容。为诱发单个动作电位以进行电生理学和成像比较,应用短(10ms)电流注入,其为诱发单个动作电位所需阈值的2倍。使用clampfit10软件中的尖峰检测算法来进行动作电位分析。
为以电生理学方式记录chr2诱发的动作电位,将神经元保持在细胞吸附模式(封接0.5-1gω),或者在膜破裂后,在i=0处采集数据。
磺化硅罗丹明的设计和合成。描述了跨膜电位berkeleyred传感器1(berst1,“burst”)的研发,其为一种电压敏感的磺化硅-罗丹明(si-罗丹明)荧光团。berst1的特征是在中位芳环上具有磺酸的si-罗丹明核心(称为berkeleyred或“br”)。该磺化的si-罗丹明(参见方案1)由于si取代的氧杂蒽而提供nir激发和发射谱,并且由于阴离子磺酸盐而改进了染料在细胞膜的细胞外表面的保留(见下文)。
方案1.跨膜电位berkeleyred传感器1(berst1)的合成。
br在三个步骤中从中间体1和3合成,它们分别在1和4个步骤中得到。在合成具有伴随磺酸酯的br核心中的关键步骤是在1衍生自锂-卤素交换的有机锂中间体与已用三氟甲磺酸酐活化的氧杂蒽酮3的亲核加成。在三个步骤(方案1)中,用bbr3使异丙基酯脱保护以9%提供br。
2,5-二溴苯磺酸异丙酯(2):在0℃下,将1,4-二氮杂双环[2.2.2]辛烷(0.81g,7.2mmol,1.2当量)缓慢加入在3:2ch2cl2/iproh(v/v)(5.0ml)中的2,5-二溴苯磺酰氯(2.0g,6.0mmol,1.0当量)中。在白色沉淀开始形成后,将反应混合物加热至环境温度,并搅拌30分钟。通过过滤移除沉淀后,将滤液真空浓缩,并通过快速柱色谱(5:1己烷/etoac)进行纯化,得到作为白色固体的产物(1.3g,3.7mmol,62%)。1hnmr(400mhz,cdcl3)δ8.25(d,j=2.3hz,1h),7.63(d,j=8.4hz,1h),7.57(dd,j=8.4,2.3hz,1h),4.86(sep,j=6.3hz,1h),1.38(d,j=6.3,6h);13cnmr(150mhz,cdcl3)δ138.8,137.2,136.8,134.3,121.4,119.5,79.3,22.8;hrms(ei)c9h10br2o3s+[m]+的计算值为355.8712,实测值为355.8717。
5-溴-2-(7-(二甲基氨基)-3-(二甲基亚氨基)-5,5-二甲基-3,5-二氢二苯并[b,e]silin-10-基)苯磺酸酯(即,溴-berkeleyred):将三氟甲磺酸酐(0.10ml,0.59mmol,1.9当量)加入3(0.10g,0.31mmol,1.0当量)在ch2cl2(1.0ml)中的溶液中。然后,将溶液在环境温度下搅拌30分钟(溶液a)。在另一烧瓶中,将2(0.33g,0.93mmol,3.0当量)溶于ch2cl2(2.0ml)中。将溶液冷却至-20℃后,缓慢加入n-buli(1.6m于己烷中,0.58ml,0.93mmol,3.0当量)。10分钟后,向反应混合物中加入溶液a。然后,将混合物搅拌1小时。通过ptlc(5:1:1己烷/etoac/ch2cl2)获得粗异丙基酯保护产物,并用在ch2cl2(2.0ml)中的1.0mbbr3进行处理。将反应混合物在环境温度下搅拌过夜,并通过ptlc(10:1ch2cl2/ch3oh)进行纯化,得到作为深蓝色固体的所需产物(25mg,0.046mmol,15%)。1hnmr(600mhz,cdcl3)δ8.51(d,j=2.0hz,1h),7.53(dd,j=8.1,2.0hz,1h),7.32(d,j=9.5hz,2h),6.99(d,j=2.8hz,2h),6.89(d,j=8.1hz,1h),6.58(dd,j=9.5,2.8hz,2h),3.25(s,12h),0.55(表观s,3h),0.53(表观s,3h);13cnmr(225mhz,cdcl3)δ173.6,153.9,148.3,148.2,143.5,134.3,132.2,131.1,130.2,129.0,122.9,119.4,113.3,40.6,-0.9,-1.2;hrms(esi)c25h27brn2nao3ssi+[m+na]+的计算值为565.0587,实测值为565.0590。
(2-(7-(二甲基氨基)-3-(二甲基亚氨基)-5,5-二甲基-3,5-二氢二苯并[b,e]silin-10-基)苯磺酸酯)(即,berkeleyred):根据与上文所述相同的程序,从3(50mg,0.15mmol,1.0当量)、三氟甲磺酸酐(26μl,0.15mmol,1.0当量)、1(83mg,0.30mmol,1.5当量)和n-buli(1.6m于己烷中,0.19ml,0.30mmol,1.5当量)制备。获得作为深蓝色固体的产物(6.3mg,0.014mmol,9%)。1hnmr(600mhz,cdcl3)δ8.35(dd,j=8.4,1.3hz,1h),7.54(ddd,j=8.4,7.5,1.3hz,1h),7.39(表观td,j=7.5,1.3hz,1h),7.36(d,j=9.6hz,2h),6.99(dd,j=7.5,1.3hz,1h),6.98(d,j=2.9hz,2h),6.56(dd,j=9.6,2.9hz,2h),3.23(s,12h),0.56(表观s,3h),0.53(表观s,3h);13cnmr(150mhz,cdcl3)δ175.8,153.9,148.2,146.8,143.8,135.3,129.4,129.4,128.9,128.6,127.9,119.2,113.3,40.5,-0.9,-1.2;hrms(esi)c25h28n2nao3ssi+[m+na]+的计算值为487.1482,实测值为487.1478。
berkeleyred(br)在水性缓冲液(图1a,50mmtbs,ph7.5,0.1%sds)中显示以658nm为中心的吸光度曲线和150,000m-1cm-1的消光系数。br的特征为在681nm处强烈发射的nir荧光(在tbs/sds缓冲液中,φfl=0.24,而在甲醇中,φfl=0.32)。在电压感测应用中使用br的关键要求是,br不在诸如细胞膜的低介电环境中环化为非荧光状态。尽管这种螺环化对于超分辨率显微术而言是有用的性质,但环化导致更疏水的构象并促进电压传感器通过质膜。内膜和细胞溶质的染色随后使背景荧光急剧增加并限制可从成像实验提取的有用信号。如所预测的,在中位芳环上放置磺酸酯基团防止螺环化,并且在酸性或碱性环境(ph2.5-9)中未观察到吸光度的变化(参见图2c和e)。在从ε=6(10%水/二
berst1的设计和合成。已经证实磺化的si-罗丹明br具有明亮的nir荧光和不随ph或溶剂电介质变化的吸光度,将br用亚苯基亚乙烯基分子线官能化,以产生berst1。通过2的螯合辅助锂化,以15%的产率合成了关键的溴化berkeleyred(溴-br,方案1)。锂化在-20℃下在ch2cl2中进行,其中使用三氟甲磺酸酐来活化3用于加成有机锂物质。涉及溶剂(thf、ch2cl2)、试剂(nbuli、iprmgcl·licl)、添加剂(mgso4)和温度(-78℃、-40℃和22℃)的不同组合的各种其它条件均不反应,产率不足或得到复杂的混合物。
在优化的反应条件下的区域选择性锂化通过用酸淬灭生成的锂物质得到根据1hnmr与邻位-锂化相一致的产物得以证实(参见图26)。以三个步骤实现了溴-br与甲氧基取代的亚苯基亚乙烯基二甲基苯胺分子线4的pd催化的heck偶合,并在硅胶上纯化后以62%的产率获得berst1。berst1表现出与母体br染料相似的光谱性质,激发和发射以658nm和683nm为中心(比较图1a与图2a)。与br相比,berst1的量子产率大幅降低,在水性缓冲液和meoh中分别为0.017和0.022。
(5-((e)-4-((e)-4-(二甲基氨基)-2-甲氧基苯乙烯基)苯乙烯基)-2-(7-(二甲基氨基)-3-(二甲基亚氨基)-5,5-二甲基-3,5-二氢二苯并[b,e]silin-10-基)苯磺酸酯)(berst1)。将溴-berkeleyred(5.0mg,9.2μmol,1.0当量)、4(2.6mg,9.3μmol,1.0当量)、pd(oac)2(1.1mg,4.5μmol,0.50当量)、p(o-tol)3(2.8mg,9.2μmol,1.0当量)和net3(50μl)溶于dmf(0.10ml)中。在75℃下搅拌溶液,并通过tlc监测反应的进展。反应完成后,通过ptlc(10:1ch2cl2/ch3oh)纯化粗混合物,得到作为深绿色固体的产物(4.2mg,5.7μmol,62%)。1hnmr(900mhz,10:1cdcl3/cd3od(v/v))δ8.34(d,j=1.8hz,1h),7.53(dd,j=7.8,1.8hz,1h),7.46(表观s,4h),7.43(d,j=8.5hz,1h),7.39(d,j=16.4hz,1h),7.27-7.21(m,3h),7.14(d,j=16.4hz,1h),6.99-6.94(m,3h),6.91(d,j=16.4hz,1h),6.55(dd,j=9.7,2.8hz,2h),6.31(dd,j=8.5,2.4hz,1h),6.19(d,j=2.4hz,1h),3.85(s,3h),3.21(s,12h),2.95(s,6h),0.50(表观s,3h)0.48(表观s,3h);13cnmr(225mhz,10:1cdcl3/cd3od(v/v))δ173.3,158.0,153.9,151.4,148.1,145.2,143.3,138.7,138.5,134.9,134.4,130.4,129.6,128.8,127.1,126.9,126.2,126.2,126.2,125.9,124.1,123.7,119.3,115.0,113.2,105.2,95.6,55.3,40.3,-1.2,-1.4;hrms(esi)c44h48n3o4ssi+[m+h]+的计算值为742.3129,实测值为742.3118。
berst1的细胞表征。当将浴应用于hek细胞时,berst1定位于细胞膜(参见图1c)。重要的是,在整个成像实验过程中,berst1荧光保持定位于细胞膜。这与独立的br荧光团形成对比,所述荧光团在相同条件下加载之后显示可忽略的细胞荧光,这进一步证实了berst1和br中的磺酸酯防止染料内化的能力(参见图3a与图3c)。
berst1显示优异的光稳定性(参见图1b),在强烈的照射条件(i=162w/cm2,631nmled)下,漂白半衰期大约为5分钟。所述照射条件比与其它光学工具协作用于berst1成像的强度高约一个数量级(参见图8、13和15)。通过比较,在相同的照射强度(i=162w/cm2,475nmled)下,具有相似的电压敏感性,即27%δf/f/100mv的vf2.1.cl具有<60秒的漂白半衰期。由于berst1在入射辐射下具有比vf2.1.cl更大的消光系数(150,000对90,000),所以该比较略微低估了berst1(si-罗丹明)相对于vf2.1.cl(荧光素)的光稳定性。为了确定berst1的电压敏感性,对加载1μmberst1的hek细胞进行全细胞膜片钳电生理学(参见图4a和4b)。具有berst1的电压钳制的hek细胞的去极化导致荧光的迅速增加,而超极化引起荧光降低(参见图4b)。berst1具有大约24%±5%δf/f/100mv的电压敏感性,这与第一代蓝光可激发的voltagefluors相当,并且berst1在跨越±100mv的生理学相关范围内是线性的(参见图4b)。
berst1在神经元中的电压成像。berst1对培养的海马神经元的细胞膜也同样良好地染色(参见图5a和5b)。对加载berst1的培养的神经元进行的全细胞膜片钳电生理学证实berst1可检测单次试验中的动作电位(aps)。在电流钳模式下诱发动作电位,并且所得光学响应精确地匹配所记录的vmem变化(参见图5d)。光学记录的动作电位(1.8khz光学采样)与同时记录的传统电生理学迹线不能区分。当以电生理学方式测量时,动作电位的fwhm持续时间为1.65±0.15ms,而光学动作电位记录给出了1.97±0.14ms的值(每个条件n=7个细胞)。0.32ms的差远小于0.56ms的光学采样间隔,因此在成像设备的测量误差范围内。在这些条件下来自berst1的动作电位的光学响应大约为9.5%δf/f(±1.2%,n=7个细胞)。
在没有成像的情况下使用全细胞膜片钳电生理学,证实了berst1的存在对神经元发射动作电位的能力或动作电位的测量性质没有可识别的影响。当比较在有或没有1μmberst1下神经元对刺激的电生理学响应时(n=12和n=11个无染料和加载染料的神经元,参见图6),在峰值动作电位振幅、持续时间、上升时间、衰减时间或细胞电容方面没有发现差异。在场刺激条件下同样可容易地检测到动作电位,给出17.8%δf/f(±1.6%,n=5个细胞)(参见图5c)。在大多数情况下,在动作电位之后可见复极化,进一步突出了berst1检测和报告全动作电位波形的效用。
使用berst1进行多色成像。电压传感器在nir窗口中的优点之一是,这些新工具可以与多种蓝色、绿色和红色光学工具接口。特别感兴趣的是基于gfp的经遗传编码的光学工具,因为总体而言,这些荧光蛋白比它们的红色荧光对应体更广泛地使用并且表现出更可预测的细胞和光物理行为。首次证实berst1可以与一些常用于细胞器:细胞核和线粒体的分子探针进行多色成像。用berst1(参见图1c)、罗丹明123线粒体染色剂(参见图1d)和hoescht33342细胞核染色剂(参见图1e)进行同时三色活细胞成像。在这些条件下,不同的细胞成分以三种颜色清晰可见,从而证实了berst1用于多色成像的效用(参见图1c-f)。
通常需要来自细胞亚群的功能信息,所述细胞亚群通常通过荧光蛋白的靶向表达来鉴定。下面测定通过将berst1染色与gfp标记配对,berst1是否能够提供多色功能成像。给表达细胞溶质gfp的神经元加载berst1,然后通过场刺激诱发动作电位(参见图7)。在这些条件下,berst1在不表达gfp的细胞中提供大的荧光变化,大约9.2%δf/f/动作电位(±1.6%),snr为62:1。在相同视场中的表达gfp的细胞给出了实质上相同的响应(8.7±0.8%δf/f,snr=63:1,n=5对细胞),证实了berst1的响应不被gfp的存在减弱,也不被gfp的光学渗透(opticalbleedthrough)或交叉激发减弱(参见图7)。因此,该方法可用于标记具有光学正交荧光蛋白(gfp)的感兴趣的细胞或亚细胞区域,然后从由所述荧光蛋白界定的感兴趣区域(roi)记录。尽管细胞外场刺激证实gfp的存在不减弱berst1的光学响应,但它不允许探测来自gfp阳性细胞和gfp阴性细胞的独立信号,因为所有神经元都会对细胞外场刺激作出响应。
为了证明在表达gfp的培养物中个体神经元活动可在空间上分离,在表达gfp并用berst1标记的相同培养物中使自发活动成像。使用gfp来界定感兴趣区域,感兴趣的细胞的活动可以清楚地与周围的细胞区分开来。在图8中,由gfp阳性神经元(#3和#6)界定的roi明显显示与视场中的其它四个细胞显著不同的活动。总而言之,这些实验证明了berst1与gfp复染剂平行地提供神经元活动的多位点光学记录的能力。
然后测定berst1参与双色多功能成像的能力,即将电压成像与ca2+成像、电压成像或通过chr2的光遗传学操纵组合。ca2+传感器的gcamp系列是系统和细胞神经科学中最广泛使用的功能探针之一。然而,由于gcamp的激发和发射光谱正好落在前几代voltagefluors(以及其它功能探针)的范围内,这妨碍了与基于pet的电压敏感染料一起使用gcamp。表达经遗传编码的ca2+传感器,即gcamp6s的神经元用berst1染色(参见图9a和9b),所述gcamp6s响应于上升的细胞内ca2+浓度而提供大的荧光增加。gcamp6s阳性神经元(参见图9b)显示明亮的绿色细胞溶质荧光,而膜明显标记有berst1(参见图9a)。从表达gcamp6s并用berst1染色的单个细胞,通过场刺激诱发动作电位,并首先针对用于gcamp6s的绿色通道,然后在针对berst1的nir通道中获得光学记录(参见图9a和9b)。在顺序光学迹线中,vmem的上升和[ca2+]i的上升都清晰可见(参见图9c)。双重berst1和gcamp6s成像可区分电压和ca2+瞬变,对于单个诱发动作电位,电压瞬变(大约15%δf/f)在测量的gcamp6s信号(大约5%δf/f)之前(参见图9c)。电压成像的优点之一是去卷积快闪的能力,具有较慢的固有信号和缓慢的探针释放动力学的ca2+成像通常不能解决这个问题。当刺激表达gcamp6s并用berst1染色的神经元以在5、10和20hz诱发一系列动作电位时,在所有频率下,在berst1通道中都可见对应于各诱发动作电位的独立vmem响应(参见图9d),而如通过在gcamp6s荧光的上升侧中的小变化所测量,由gcamp6s测量的ca2+响应仅在5hz下可辨别(参见图9e)。这突出了berst1参与其中需要在同一系统中解释多个信号的功能成像实验的能力。
由berst1和基于gfp的荧光团发出的非重叠信号提供了进行双色电压成像的独特机会。经遗传编码的电压传感器asap1在培养的神经元中表达。如前所述,神经元用berst1染色(参见图10a-d)。响应于诱发的一系列动作电位(参见图10e),asap1提供约6%±1.4%(s.e.m.,信噪比snr为8:1,n=4个细胞)的相对荧光的降低,其与报告的值-4.8%δf/f一致。在相同的细胞中,在相同的刺激参数下(参见图10e),berst1引起15%±2.1%的增加(s.e.m.,snr为41:1,n=4个细胞),突出了berst1用于测量快闪事件和用于与基于gfp的互补遗传编码电压传感器进行双色电压成像的效用。
berst1和chr2的光电生理学。将berst1与诸如视紫红质通道蛋白2(chr2)的光遗传学工具接口,以证明在“全光”电生理学方法中使用光同时致动和记录活细胞的vmem的可行性。作为较常使用的光遗传学工具之一,chr2的作用光谱(470nm峰响应)与第一代voltagefluor染料有显著重叠。尽管已经报道了chr的红移变体,但是它们全部都在光谱的蓝色区域中含有显著的响应峰。因此,有利的是将电压成像成分移至光谱的nir区域中,以避免在用于激活和记录的光通道中的串扰。
在进行光诱导的动作电位的光学记录之前,对berst1和chr2之间是否存在任何光学串扰进行了研究。对于berst1发现少量的交叉激发。当在475nm下激发时,berst1染色的细胞显示荧光,其大约为在631nm下激发所得强度的约4%(9.7w/cm2,475nm和631nm,参见图11a-d)。由于相对于用于berst1的典型成像光强度,chr2需要低得多的光强度(对于多细胞成像,80mw/cm2,475nm相对于20w/cm2,631nm),因此估计在实际成像实验中,小于0.1%的berst1信号来自chr2的交叉激发。在体外激发br和berst1衍生物时也观察到交叉激发(参见图12a和12b)。与630nm下的激发相比,在水性缓冲液中用青色光(475nm)激发br或berst1衍生物分别给出总发射的大约1%或7%(参见图12c)。体外紫色光激发(390nm)给出总发射的16%(br)和35%(berst1)(参见图12c),这与细胞膜中berst1的交叉激发一致(大约47%,9.7w/cm2,390nm激发)(参见图11c和d)。当在紫色照射下成像时,用berst1染色的hek细胞是电压敏感的(参见图11e,390nm激发,3.3w/cm2,680nm发射)。
已经确定在实验条件下存在berst1的可忽略的交叉激发(<0.1%),然后证实了berst1和chr2是否可以作为光学正交工具用于探测和扰乱神经元活动。如所预期的,瞬时表达yfp-chr2融合(参见图13a和图14b)并加载berst1的神经元给出明亮的膜染色(参见图13b和图14a)。如通过全细胞(参见图13c和d)或细胞吸附配置(参见图14d)的膜片钳电生理学所测量的,用青色光的短暂脉冲(5ms,475nm,80mw/cm2)刺激chr2导致膜电位的光诱导的尖峰。缺少chr2的细胞的对照实验未显示尖峰。用berst1的光诱导尖峰的光学记录与电生理学记录的活动匹配(参见图13c对d和e对f;以及图14d和e)。值得注意的是在光学记录期间由berst1实现的高snr。尽管berst1的snr与高敏感性的全细胞膜片钳方法相比是低的(参见图13c-f),但berst1的光学敏感性与通过较不敏感的细胞上膜片钳技术获得的记录有利地相当(参见图14d和e)。
作为结合光遗传学工具使用berst1的有效性的最终证明,在培养的海马神经元中探测了网络行为。以细胞分辨率分析完整脑中的神经元连接和功能仍然是一项突出的挑战,这使得培养的海马神经元成为用于研究连接和功能的有吸引力的模型系统。实际上,实验证据表明,培养的神经元产生特定的突触连接,从而反映体内产生的连接。
使大面积的海马神经元(370×62μm,20x放大)成像,所述海马神经元用berst1染色并且仅含有单个表达yfp-chr2的神经元(参见图15a-c和图16)。像之前一样(参见图8),历时数秒的连续光学记录表明,在记录时期期间,大多数神经元保持相对静息。用青色光(475nm,80mw/cm2,5ms,5hz,参见图15e-g,青色棒)激活表达yfp-chr2的神经元导致,像之前一样(参见图13),来自chr2(+)神经元的尖峰脉冲(参见图15,蓝色迹线),其恰好在光学刺激模式之后。与捕获仅chr(+)细胞的光学响应的先前实验(参见图13和图14)不同,较大的记录区域提供关于单个神经元的激活如何影响周围细胞的信息(参见图15)。
在第一光学刺激期间(参见图15e和f,青色棒),神经元1(参见图15c-e,黑色细胞和迹线)——与表达yfp-chr2的神经元2(参见图8c-e,蓝色细胞和迹线)最近邻——响应于神经元2中的第二ap而发射单个ap(参见图15e,第一红色方框和图15g,第一区域)。神经元3(参见图15c-e,紫色细胞和迹线)和神经元5(参见图15c-e,橙色细胞和迹线)仅与神经元2的放电弱关联,并且似乎启动它们自身的双峰尖峰,所述双峰尖峰传播至神经元4(参见图15c-e,绿色细胞和迹线)中并打断神经元2的光诱导的放电模式(参见图15d和e,第一红色方框)。该尖峰双峰间隔大约12ms,并且难以用较慢的ca2+成像分辨。
在光刺激的第二时期,神经元1(参见图15d和15f,黑色细胞和迹线)的响应受到抑制,并且不再显得与来自光学控制的神经元2(参见图15d和f,蓝色细胞和迹线)的信号强关联。神经元3和5的响应更强烈地与神经元2的放电相关联(参见图15f和g,第一红色方框),而神经元4(参见图15d和f,绿色细胞和迹线)保持静息,除了在神经元2的光学激活之前的几个自发脉冲。即使在这种“简单”的培养的海马模型中,也存在通过诸如ca2+成像的方法不能观察到的高度互联性。总而言之,这些实验证实了berst1与经典的光遗传学工具协作以光学探测神经元连接和功能的复杂性的能力。
本文中已经描述了许多个实施方案。然而,应理解,可在不脱离本公开的精神和范围的前提下作出各种修改。因此,其它实施方案也在所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!