用于检测幽门螺杆菌胃炎和具有相关风险的萎缩性胃炎的改进的方法与流程
本发明涉及用于检查具有指示幽门螺杆菌感染和/或具有相关风险的萎缩性胃炎的生物标志物的人的方法。更精确地,本发明涉及用于改进与筛查和检测前述疾病以及胃粘膜的功能有关的分析步骤的方法。
背景技术:
gastropanel®,独特的幽门螺杆菌测试可以检测以下情况:
1)幽门螺杆菌(hp)感染,其是胃癌和消化性溃疡疾病(胃溃疡和十二指肠溃疡)两者的独立风险因素。
2)hp感染引起的萎缩性胃炎(ag)(其在大多数情况下是无症状的),以及ag在胃体中或胃窦中的地形部位。除了hp感染之外,胃体中的ag与其所有临床后遗症一起也可以通过胃粘膜的自身免疫疾病而发展。
2.1)胃体粘膜的ag导致低酸输出或最终无酸的(胃酸缺乏的)胃。这增加了胃癌或食道癌的风险,以及维生素b12、钙、镁和锌的吸收不良。此外,由于无酸的胃而导致损害一些药物,例如,双嘧达莫(dipyridamol)、一些铁制剂和抗真菌药(氟康唑(fluconazol)、伊曲康唑(itraconazol))、甲状腺素和阿扎那韦(atazanovir)的吸收。钙缺乏会导致骨质疏松症,并且维生素b12缺乏会影响阿尔茨海默疾病、痴呆、抑郁症或周围神经病变的发展。胃中减少的酸输出还会增加胃肠道和呼吸道中严重感染的风险,所述严重感染包括贾第虫病(giardiasis)、疟疾、艰难梭菌(clostridiumdifficile)、大肠杆菌ehec和肺炎。
2.2)胃窦的ag增加胃癌的风险。胃体和胃窦的共存ag(全胃炎)是胃癌的单个最重要的风险条件。
3)hp感染也见于具有ag、malt淋巴瘤或消化性溃疡出血的对象,以及服用ppi药物或抗生素的那些对象。在这些情况下,13c尿素呼气测试(ubt)或粪便hp抗原测试经常给出假阴性结果,并且hp感染(及其所有可能的后果)仍然未被发现。ubt可能在具有无酸的胃的对象中给出假阳性结果。此外,ubt和hp抗原或抗体测试检测不到由于hp感染或自身免疫疾病导致的ag(http://www.biohithealthcare.com/limitations-of-helicobacter-pylori-diagnostics)。
4)胃粘膜的高酸输出,其易患食道反流疾病并伴有潜在的并发症。这些是溃疡性食道炎、barrett食道或下食道癌。
有症状幽门螺杆菌(hp)感染、萎缩性胃炎(ag)和高酸输出是胃镜检查的指示。
gastropanel®的创新基于由在芬兰和爱沙尼亚的研究小组进行的对胃炎患者的后续研究以及幽门螺杆菌在胃炎和消化性溃疡疾病的发病机制中的作用的发现(这于2005年获得诺贝尔奖),以及基于biohit的r&d和微孔板免疫分析仪(基于垂直光束测量原理的发明)。
更精确地,biohitgastropanel®是定量elisa测试板,其测量胃粘膜结构和功能的四种生物标志物的血浆浓度:胃蛋白酶原i(pgi)、胃蛋白酶原ii(pgii)、胃泌素-17(g-17)和幽门螺杆菌igg抗体。用于gastropanel®的主要指示是要帮助诊断和筛查无症状和有症状对象,其具有1)幽门螺杆菌感染2)萎缩性胃炎(ag)3)紊乱的胃功能。
gastropanel®是幽门螺杆菌(hp)感染(世界人口的5-80%)的一线诊断测试,其用于检查具有消化不良的所有患者(西方人口的20-40%),以及用于筛查具有相关风险(诸如胃癌和食道癌)的萎缩性胃炎(ag)(1-3)。萎缩性胃炎还会增加维生素b12、铁、镁、锌、钙和一些药物的吸收不良的风险。13c尿素呼气测试(ubt)、粪便抗原测试和hp感染的抗体测试检测不到由hp感染或自身免疫疾病引起的萎缩性胃炎以及酸输出的水平。此外,如果患者具有a)萎缩性胃炎b)malt淋巴瘤c)消化性溃疡出血疾病,或者d)如果患者目前正在接受抗生素或ppi,那么13c尿素呼气测试和粪便抗原测试可能给出假阴性结果。
gastropanel®由关键的胃特定生物标志物组成,所述关键的胃特定生物标志物代表正常胃生理学的关键调节剂。这四种生物标志物包括胃蛋白酶原i(pgi)、胃蛋白酶原ii(pgii)、酰胺化胃泌素-17(g-17)和hp抗体,其被设计以给出有关胃粘膜的结构和功能两者的信息(1-6)。最重要的是,该板分别给出了准确估计胃体和胃窦粘膜分泌胃酸和g-17的能力以及准确估计重要的胃病理(如萎缩性胃炎的分级和地形、炎症)(7-9),其可能代表胃癌及其临床后遗症的增加的风险(1)。
所有四种生物标志物的正常血浆水平指示了胃粘膜具有正常的结构和功能,而异常水平是不健康的胃的迹象,其反映胃体的酸输出、pg和g-17之间的反馈机制中的紊乱。对于g-17评估,存在两种选项:基础g-17(g-17b)值和刺激的g-17(g-17s)值,后者在区分胃窦的功能紊乱(g-17s正常)和胃窦中的ag(g-17s在ag中不增加)中尤其重要(10,11)。
作为第一个针对胃粘膜健康的非侵入性诊断测试,gastropanel®的独特之处还在于,结果由专门为此目的而设计的软件应用程序(gastrosoft)(http://www.gastropanel.com)来解释。gastropanel®结果被分类为五种可能的诊断类别之一:1)正常粘膜、2)浅表(hp)胃炎、3)胃窦中的ag、4)胃体中的ag和5)胃窦和胃体两者中的ag(全胃炎)(l1,12)。因此,gastropanel®被优化以便与用于胃炎的分类的更新的悉尼系统(uss)一起使用,所述更新的悉尼系统(uss)基于相同的这5个诊断类别(13)。
gastropanel®已在基于活组织检查证实的胃镜检查的若干大型试验中被验证(14,15),所有这些都被包括在关于该主题的最近整合分析(meta-analysis)中(14)。已经利用这些研究为板的每个单独生物标志物建立验证的参考(截止)值(使用五个组织学类别作为终点)。这些研究证实了gastropanel在检测最重要的研究终点、中度至重度ag时的高准确性(14-16)。因此,pgi、pgii及它们的比率(pgi/pgii)的正常值排除了具有超过95%的npv的胃体的ag。进而,pgi和pgii的值以及它们的比率(在建立的截止水平以下)预测了中度至重度ag,其中在充分供电和uss验证的系列中,roc曲线(auc)值下的面积高于0.950(1,2,3,16,17)。
简而言之,pgi的水平在胃体的ag中(和泛胃炎中)降低,但在所有其他情况下仍保持在正常范围内。升高的pgii水平反映了粘膜炎症,其中最高值在hp相关联的非ag中被检测到。g-17b值在胃体的ag中最高,这是因为缺失由来自萎缩性胃体的酸输出所进行的负反馈,导致由正常胃窦粘膜不受抑制地分泌g-17b。这同样适用于其中由长期使用ppi药物而抑制酸输出的情形。根据定义,当胃窦粘膜萎缩并且g细胞耗尽时,即使在蛋白质刺激后g-17分泌(g-17s)仍然非常低(17)。
hpigg抗体向三种生物标志物给出显著的附加诊断价值。hp的igg血清学潜在地测量两种不同情况:1)正在进行的hp-感染,或2)先前暴露于hp。虽然gastropanel®不能够对这两者做出区分,但是hp参与的证据给出了显著的附加诊断价值。作为唯一的异常标志物,hp表示hp-相关联的浅表胃炎(不具有ag),而与其他三种标志物中的异常相关联,升高的hp-抗体滴定度证实了hp-相关联(胃窦或胃体)的ag的诊断(1,3,18,19)。
有关gastropanel®结果解释的更多详细信息,请参阅http://www.gastropanel.com。
而且,wo2009/053537描述了与gastropanel创新有关的原理方法和概念。
此外,syrjänen(2016)对诊断萎缩性胃炎中的gastropanel®的所有相关研究提供了系统评论和整合分析,并确证了国际专家的陈述,从而倡导诊断和筛查ag中的gastropanel®。由于其对胃窦的ag和胃体的ag两者的高度特定性,gastropanel®确实是对胃健康的测试。
在gastropanel®测试中,从血液样本中确定四种生物标志物的浓度。测量这些生物标志物:由胃粘膜中的细胞分泌的胃蛋白酶原i(pgi)、胃蛋白酶原ii(pgii)和胃泌素-17(g17)。另外,测量幽门螺杆菌抗体。相较于通过分离地使用单独的生物标志物可以实现的,所有四种生物标志物结果的总体解释提供了对胃粘膜的结构和功能的更可靠和全面的理解。然而,应尽快确定这些生物标志物的浓度,或在分析前注意血液样本应当被正确地存储和处置。建议在从采集样本后30分钟内应当将血液样本离心。应在分离的血浆试管中添加特定的稳定剂物质,以防止任何分析物的降解。稳定剂能够使得样本在室温(20-25°c)下存储达三天,或者在冰箱(2-8°c)中存储长达七天。万一在分析前延迟更长,样本在-20°c下容许存储长达2周。对于任何更长的存储时间,样本应被保持在-70°c。然而,如果不可能离心样本,则不可能使用稳定剂,这是因为红血球变得被溶血。因此,在全血样本的存储和运输期间的温度和时间的影响是高度感兴趣的。
技术实现要素:
本发明由独立权利要求的特征所限定。在从属权利要求中限定了一些特定实施例。
根据本发明的第一方面,提供了一种用于基于获得全血样本、记录样本采集时间或样本存储温度或两者的组合、测量感兴趣的生物标志物浓度、以及基于这样的信息确定胃粘膜的初始生物标志物浓度和状态,来筛查具有幽门螺杆菌感染、具有相关风险的萎缩性胃炎和/或紊乱的胃功能的无症状和有症状对象的方法。
根据本发明的第二方面,提供了一种设备或程序,其基于血浆或血清生物标志物浓度的测量、全血样本采集与血浆或血清样本分析之间的时间以及全血样本的存储温度来确定初始生物标志物浓度。
根据本发明的第三方面,通过这种手段所确定的生物标志物(诸如胃泌素-17)的初始浓度用于非侵入性测试中,所述非侵入性测试用于筛查具有幽门螺杆菌感染、具有相关风险的萎缩性胃炎和/或紊乱的胃功能的无症状和有症状对象。
本发明基于以下发现:例如胃泌素-17的生物标志物的浓度相对于时间和温度单调下降。如果浓度高于定量限制,并且已知存储温度和样本采集的时间的信息,则初始胃泌素-17浓度可以可靠地被估计并被用于解释胃粘膜健康的结果。
如下文所述和要求保护的,由本发明实现了这些和其他方面以及其优于已知解决方案的优点。
更精确地,本发明的方法由权利要求1、2和3中所述的内容表征。
根据本发明的设备或程序由权利要求7中所述的内容来表征,以及根据本发明的使用由权利要求9中所述的内容来表征。
借助于本发明获得了相当可观的优点。例如,血液样本不需要立即离心来分离血浆或血清以用于进一步分析。替代地,样本可以作为全血样本而被采集、存储和发送以用于进一步分析,而无需首先处理它们。在其中然后测量生物标志物的分析步骤中,使用样本采集的时间和存储温度来解释和校正所获得的结果,其可能已经受到例如蛋白质降解的影响。这使得实际的临床工作成为更少时间相关的和耗时的,并且还节省了成本。例如,不需要在取得血液样本的现场进行每个样本的分析,而只是需要采集要被处理并在以后被分析的样本。因此,研究单位的内部后勤也得到了改善。另外,血液样本不需要为了存储目的的稳定剂,而是替代地可以在进一步分析使用之前作为全血样本在例如室温下被存储。
接下来,将参考某些实施例更加仔细地描述本技术。
具体实施方式
本技术涉及当检查具有或假设具有gp生物标志物(指示幽门螺杆菌感染和/或具有相关风险的萎缩性胃炎)的人时在全血样本的存储和运输期间的温度和时间的影响。
已经示出了与胃泌素-17不同,对于在正常室温下的几天的存储,胃蛋白酶原i、胃蛋白酶原ii和幽门螺杆菌保持良好而没有显著的降解,如图1中所图示的。在该上下文中,如氧化、光降解、二硫化物扰乱、脱酰胺、聚集、沉淀、解离、碎裂等的不同的蛋白质降解事件不是感兴趣的,而仅有存储时间和温度的影响是感兴趣的。
图1是示出当在分析前样本随着不同的时段在21℃下作为全血被存储时胃蛋白酶原和胃泌素-17相对浓度改变的图。
图2至图4图示了在4℃、21℃的室温和30℃下存储样本达12、24、36和48小时之后胃泌素-17浓度。在4℃、21℃和30℃下24小时内浓度的相对下降分别为约20%、40%和80%。
更精确地,图2a是示出在分析前随着不同的时段在4℃下作为全血被存储的样本的胃泌素-17浓度的图。
图2b是示出在分析前随着不同的时段在4℃下作为全血的样本的胃泌素-17相对浓度改变的图。
图3a是示出在分析前随着不同的时段在21℃下作为全血的样本的胃泌素-17浓度的图。
图3b是示出在分析前随着不同的时段在21℃下作为全血的样本的胃泌素-17相对浓度改变的图。
图4a是示出在分析前随着不同的时段在30℃下作为全血的样本的胃泌素-17浓度的图。
图4b是示出在分析前随着不同的时段在30℃下作为全血的样本的胃泌素-17相对浓度改变的图。
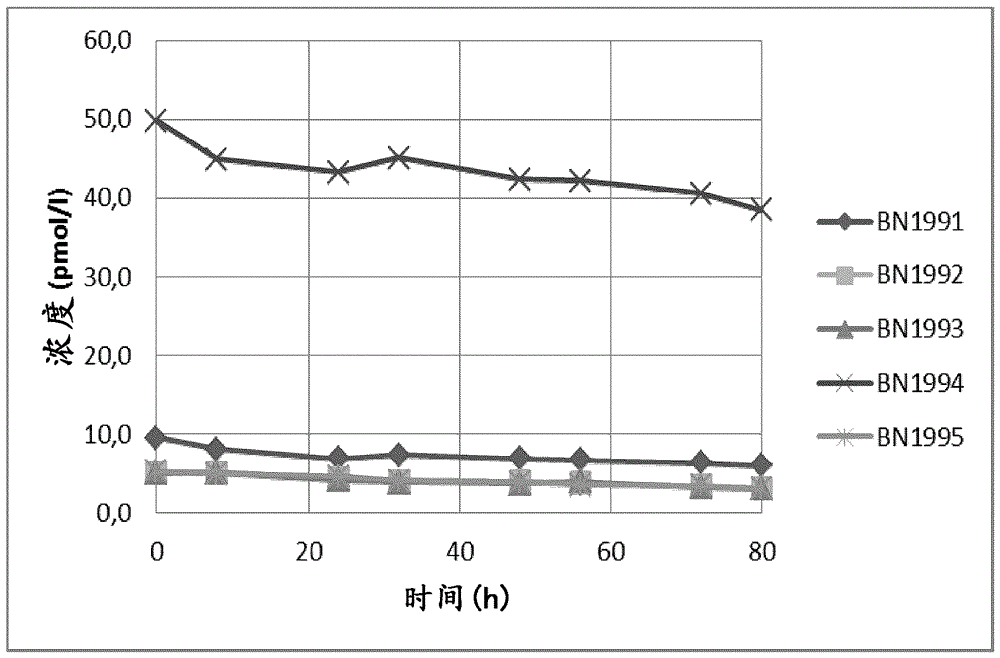
存储/运输温度对胃泌素-17降解速率具有显著影响,如图5中所示。因此,图5是示出对于两个不同样本在不同温度中的全血的一天(24h)存储的图。
图6是示出在分析前随着不同的时段在30℃下作为全血被存储的样本的胃泌素-17浓度的图。虚线表示7pmol/l的胃泌素-17高参考(高参考的示例;任何更高浓度指示低酸度)。
本发明的一个实施例是用于筛查具有幽门螺杆菌感染、具有相关风险的萎缩性胃炎和/或紊乱的胃功能的无症状和有症状对象的方法,所述方法包括以下步骤:
a)从对象获得全血样本,
b)记录全血样本采集的时间,
c)定量测量从全血样本中分离的血浆或血清样本的胃泌素-17浓度,
d)通过比较从步骤b)和c)中获得的值与参考值来确定初始胃泌素-17浓度,以及
e)基于所述比较来解释胃粘膜的结构和/或功能。
本发明的另一个实施例是用于筛查具有幽门螺杆菌感染、具有相关风险的萎缩性胃炎和/或紊乱的胃功能的无症状和有症状对象的方法,所述方法包括以下步骤:
a)从对象获得全血样本,
b)记录全血样本采集的存储温度,
c)定量测量从全血样本中分离的血浆或血清样本的胃泌素-17浓度,
d)通过比较从步骤b)和c)中获得的值与参考值来确定初始胃泌素-17浓度,以及
e)基于所述比较来解释胃粘膜的结构和/或功能。
本发明的又一个实施例是用于筛查具有幽门螺杆菌感染、具有相关风险的萎缩性胃炎和/或紊乱的胃功能的无症状和有症状对象的方法,所述方法包括以下步骤:
a)从对象获得全血样本,
b)记录全血样本采集的时间,
c)记录全血样本采集的存储温度,
d)定量测量从全血样本中分离的血浆或血清样本的胃泌素-17浓度,
e)通过比较从步骤b)、c)和d)中获得的值与参考值来确定初始胃泌素-17浓度,以及
f)基于所述比较来解释胃粘膜的结构和/或功能。
一种方法属于本发明的范围,其中除了胃泌素-17浓度外,还从血浆或血清样本中确定胃蛋白酶原i、胃蛋白酶原ii和幽门螺杆菌igg抗体的浓度。
用于估计样本的初始浓度的一种合适但不限于的分析功能如下。如果假设浓度降低与分子的数量成比例
n是分子的数量,k指示速率,以该速率将降低发生,以及t是时间。
1阶微分方程的解可以表示如下:
其中
n0是分子的初始数量,即分析物的初始浓度,并且n(t)是如果分子(≈浓度)的测量的数量。由于测量的浓度受存储温度的影响,因此功能可以通过以下一般形式表示:
t是样本的存储温度。
浓度一半的时间t1/2可以通过以下公式求解:
可以从测量的数据来估计一半时间
随着浓度随时间和温度单调下降,以及如果浓度高于定量限制(loq),并且已知存储温度和样本采集时间的信息,则可能估计初始浓度并当解释结果时使用该信息。
根据本发明的一个实施例,高(相对于参考范围)胃泌素-17浓度指示无酸的胃。如果在测量前已经存储达一段时间的样本仍然给出高浓度值,那么初始浓度也必须已经是高的。由图5中的样本bn1999图示了这种情形,假设从样本采集的下一天(24小时)已经实行了测量。对存储的样本结果的解释好像在采集后将已经立即分析了样本是一样有效的。
此外,如果确定温度链没有超过某个温度,则它可以预测浓度对参考范围,并在解释结果时能够使用那些内容。例如,当在测量前在室温(21°c)下已经存储图5中的样本bn1998,并且测量的值为5pmol/1时,可以假设一半时间小于24小时,以及因此确信初始值已经高于7pmol/1的示例高参考。因此,这种情况也指示胃中缺少酸,以及例如具有低胃蛋白酶原水平将增加萎缩性胃炎诊断的特定性。
此外,如果假设在测量前已经存储样本达24小时,并且该值约为2pmol/l,则它指示胃的酸含量是正常的,小于参考范围的上限。
然而,如果测量的浓度低于loq,则不可能预测初始浓度。在这种情况下,胃泌素-17结果不能用于解释。然后必须基于其他生物标志物值进行gastropanel®解释。
根据一个实施例,全血样本被采集并在没有稳定剂的情况下被存储。
根据一个实施例,全血样本采集和由血浆或血清样本的进一步分析之间的时间段在0至120小时之间,更优选地在0至72小时之间,以及最合适地在0至48小时之间。
根据一个实施例,在分离血浆和/或血清并分析生物标志物浓度之前,全血样本被采集并在0至30℃之间的温度下被存储,例如在4℃、21℃或30℃的温度下被存储。
基于血浆或血清生物标志物浓度的测量、全血样本采集与血浆和/或血清样本分析之间的时间以及全血样本的存储温度来确定初始生物标志物浓度的设备或程序属于本发明的范围。
优选地,血浆或血清生物标志物浓度高于定量限制,全血样本采集与血浆和/或样本分析之间的时间在0至48小时之间,并且全血样本的存储温度在0℃至30℃之间。
因此,这种设备或程序可以是例如gastrosoft程序,其被设计用于解释gastropanel结果,其已被修改以考虑本发明的上述基本参数。
本发明的一个另外的实施例是使用如在非侵入性测试中公开的方法,所述非侵入性测试用于筛查具有幽门螺杆菌感染、具有相关风险的萎缩性胃炎和/或紊乱的胃功能的无症状和有症状对象。
要理解的是,所公开的本发明的实施例不限于本文中公开的特定结构、处理步骤或材料,而是扩展到如由相关领域的普通技术人员将认识到的其等同物。还应该理解的是,本文中采用的术语仅用于描述特定实施例的目的,而不是旨在是限制的。
贯穿本说明书对一个实施例或实施例的引用意味着结合该实施例描述的特定特征、结构或特性被包括在本发明的至少一个实施例中。因此,贯穿本说明书在各处出现的短语“在一个实施例中”或“在实施例中”不必都指代相同的实施例。在使用诸如例如约或基本上的术语对数值进行参考的情况下,还公开了确切的数值。
如本文中所使用的,为方便起见,可以在共同列表中呈现多个项目、结构元素、组成元素和/或材料。然而,这些列表应该被解释为好像列表中的每个成员都被单独标识为分离且独特的成员。因此,在没有相反指示的情况下,仅基于成员在共同组中的呈现,没有此类列表的单独成员应被解释为同一列表的任何其他成员的事实上的等同物。另外,在本文中本发明的各种实施例和示例可以连同其各种组分的替代方案而一起被提及。理解的是,这些实施例、示例和替代方案不要被解释为彼此的事实上的等同物,而要被视为本发明的分离的和自主的表示。
此外,所描述的特征、结构或特性可以在一个或多个实施例中以任何合适的方式组合。在以下描述中,提供了许多具体细节以提供对本发明的实施例的透彻理解。然而,相关领域的技术人员将认识到,可以在没有一个或多个具体细节的情况下或者在利用其他方法、组分、材料等来实践本发明。在其他情况下,未详细示出或描述公知的结构、材料或操作以避免模糊本发明的方面。
虽然前述示例在一个或多个特定应用中说明了本发明的原理,但是对于本领域普通技术人员来说将会是显而易见的是,可以在不运用创造的才能的情况下并且在不脱离本发明的原理和概念的情况下对形式、使用和实现的细节进行多种修改。因此,不意图使本发明受到除了下面阐述的权利要求之外的内容的限制。
动词“要包括”和“要包含”在本文档中用作开放限制,其既不排除也不要求还存在未记载的特征。除非另有明确说明,否则从属权利要求中记载的特征是相互自由地可组合的。此外,要理解的是,在整个该文档中使用“一”或“一个”(即单数形式)并不排除多个。
工业适用性
本发明的至少一些实施例得到了工业应用,例如在筛查和检查具有消化不良的患者中,以及用于筛查和检测具有相关风险(诸如胃癌和食道癌)的萎缩性胃炎(ag)。
引用列表
专利文献:
1.wo2009/053537
非专利文献:
1.agréusl,kuipersej,kupcinskasl,malfertheinerp,dimariof,lejam,mahachaiv,yaronn,vanoijenm,perezperezg,ruggem,ronkainenj,salaspurom,sipponenp,suganokandsungj:rationaleindiagnosisandscreeningofatrophicgastritiswithstomach-specificplasmabiomarkers.scandjgastroenterol2012;47:136-147.
2.storskrubbt,arop,ronkainenj,sipponenp,nyhlinhandtalleynj:serumbiomarkersprovideanaccuratemethodfordiagnosisofatrophicgastritisinageneralpopulation:thekalixandastudy.scandjgastroenterol2008;43:448-1455.
3.wikströmm:assessmentofstomachhealthby“chemicalgastroscopy”.eurgastroenterolrev2012;1-6.
4.lomba-vianar,dinis-ribeirom,fonsecaf,vieiraas,bentomjandlomba-vianah:serumpepsinogentestforearlydetectionofgastriccancerinaeuropeancountry.eurjgastroenterolhepatol2012;24:37-41.
5.mikik:gastriccancerscreeningusingtheserumpepsinogentestmethod.gastriccancer2006;9:245-253.
6.bornscheinj,selgradm,wext,kuesterdandmalfertheinerp:serologicalassessmentofgastricmucosalatrophyingastriccancer.bmcgastroenterol201212:10.doi:10.1186/1471-230x-12-10.
7.germanáb,dimariof,cavallarolg,moussaam,lecisp,liatoupolous,comparatog,carlonic,bertiatog,battiestelm,papan,aragonag,cavestrogm,ioriv,merlir,bertolinis,caruanapandfranzéa:clinicalusefulnessofserumpepsinogensiandii,gastrin-17andanti-helicobacterpyloriantibodiesinthemanagementofdyspepticpatientsinprimarycare.digliverdis2005;37:501-508.
8.mikik,ichinosem,shimizua,huangsc,okah,furihatac,matsushimatandtakahashik:serumpepsinogensasascreeningtestofextensivechronicgastritis.gastroenteroljpn1987;22:133-141.
9.samloffim,varisk,ihamakit,siuralamandrotterji:relationshipsamongserumpepsinogeni,serumpepsinogenii,andgastricmucosalhistology.astudyinrelativesofpatientswithperniciousanemia.gastroenterol1982:83:204-209.
10.korstanjea,denhartogg,biemondiandlamerscb:theserologicalgastricbiopsy:anon-endoscopicaldiagnosticapproachinmanagementofthedyspepticpatient:significanceforprimarycarebasedonasurveyoftheliterature.scandjgastroenterol2002236(suppl):22–26.
11.oksanena,sipponenp,miettinena,sarnasandrautelinh:evaluationofboodteststonormalgastricmucosa.scandjgastroenterol2000;35:791–795.
12.varisk,sipponenp,laxenf,samloffim,huttunenjk,taylorpr,andthehelsinkigastritisstudygroup:implicationsofserumpepsinogeniinearlyendoscopicdiagnosisofgastriccanceranddysplasia.scandjgastroenterol2000:35:950–956.
13.dixonmf,gentarm,yardleyjhandcorreap:classificationandgradingofgastritis.theupdatedsydneysystem.internationalworkshoponthehistopathologyofgastritis,houston1994.amjsurgpathol1996;20:1161-1181.
14väänänenh,vauhkonenm,helsket,etal.non-endoscopicdiagnosisofatrophicgastritiswithabloodtest.correlationbetweengastrichistologyandserumlevelsofgastrin-17andpepsinogeni:amulticenterstudy.eurjgastroenterolhepatol2003:15:885–891.
15.telaranta-keeriea,karar,paloheimol,härkönenmandsipponenp:prevalenceofundiagnosedadvancedatrophiccorpusgastritisinfinland:anobservationalstudyamong4,256volunteerswithoutspecificcomplaints.scandjgastroenterol2010;45:1036-1041.
16.dinis-ribeirom,yamakig,mikik,costa-pereiraa,matsukawamandkuriharam:meta-analysisonthevalidityofpepsinogentestforgastriccarcinoma,dysplasiaorchronicatrophicgastritisscreening.jmedscreen2004;11:141–147.
17.sipponenp,rantap,helsket,kääriäineni,mäkitandlinnalaa.serumlevelsofamidatedgastrin-17andpepsinogeniinatrophicgastritis:anobservationalcase-controlstudy.scandjgastroenterol2002;37:785–791.
18.benberinv,bektayevar,karabayevarym.prevalenceofh.pyloriinfectionandatrophicgastritisamongymptomaticanddyspepticadultsinkazakhstan.ahospital-basedscreeningwithapanelofserumbiomarkers.anticancerres2013;33:4595-4602.
19.syrjänenkj,sipponenp,härkönenm,peetsalua,korpelas.accuracyofgastropaneltestingindetectionofatrophicgastritis.eurjgastroenterolhepatol2015;27:102-104.
20.misiewiczjj.thesydneysystem:anewclassificationofgastritis.introduction.jgastroenterolhepatol.1991;6:207–208.
21.sipponenp,priceab.thesydneysystemforclassificationofgastritis20yearsago.jgastroenterolhepatol.2011;26:suppl1:31-34.
22.malfertheinerp,megraudf,o'morainca,athertonj,axonat,bazzolif,gensinigf,gisbertjp,grahamdy,rokkast,el-omarem,kuipersej.europeanhelicobacterstudygroup.managementofhelicobacterpyloriinfection-themaastrichtiv/florenceconsensusreport.gut2012;61:646-664.
23.syrjänenk.apanelofserumbiomarkers(gastropanel®)innon-invasivediagnosisofatrophicgastritis.systematicreviewandmeta-analysis.anticancerresearch36:5133-5144(2016).
- 还没有人留言评论。精彩留言会获得点赞!