一种基于光学原子磁力仪的原位力谱方法与流程
本发明涉及一种基于光学原子磁力仪的原位力谱方法,属于生物力谱技术领域。
背景技术:
蛋白质、DNA等生物大分子之间的相互作用在生物体中处处存在,这种相互作用对维持所有细胞的生存和正常活动必不可少。研究蛋白质-DNA相互作用的分子机制,对人们了解DNA转录调控和基因表达机制、揭示各种生命活动现象具有极其重要的指导作用。伴随纳米科技的进步,人们已经发展了多种单分子力谱方法来直接检测生物大分子之间的相互作用,其中的超低场力谱技术是在超低场磁成像基础上发展起来的全新形态,利用磁标记法来探测分子间相互作用力。作为分子探针的磁性粒子会产生一个强磁场信号,进而粒子的磁场强度被高灵敏度的磁力仪所探测。在有足够强的外界微扰力借助磁性粒子作用于非共价键合分子对时,物理吸附或者结合力较弱的分子首先发生解离,并随之进行布朗运动,扰乱了粒子的磁偶极。最终导致这些解离分子将不会产生信号,仅有与目标分子特异性结合的较强分子对才能被探测。相比于目前已经发展成熟的多种力谱方法,超低场力谱技术能够将大量的单分子事件同时测量,克服了单一事件的随机性;同时计算作用力所需的参数都能精确得到,而无须额外的校准;采用分子间特异的相互作用力来探测识别多种不同的生物分子和细胞,因此也不需要繁琐的物理分离,广泛应用于分子间(抗体-抗原、受体-配体、DNA、蛋白质)的相互作用力测量。然而,目前超低场生物力谱技术采用离心力方法来施加外界微扰力,很难实现施力过程和测量过程的一体化,样品需要在离心机和原子磁力仪两个独立装置间反复转移,才能获得力-磁场强度曲线。这就使得整个力谱检测过程费时费力,效率不高,并且还会增加测量的误差。鉴于此,建立一种原位超低场力谱方法,实现与磁力仪的一体化,将提高超低场力谱的测量效率和精准性,具有更大的应用价值。
技术实现要素:
本发明的目的是提供一种基于光学原子磁力仪的原位力谱方法,本发明原子力谱方法解决了现有技术的超低场力谱方法不能与磁力仪一体化而费时费力、测量效率低,且样品反复转移容易增加实验误差的问题,为一种新型的超低场原位力谱技术。
本发明首先提供一种适用于原位力谱检测的系统,它包括光学原子磁力仪、线性扫描装置和微流控芯片;
所述线性扫描装置安装于所述光学原子磁力仪的样品通道中;
所述线性扫描装置的样品台固定于其扫描通道的进出口轴线上;
所述微流控芯片设于所述样品台上,并随所述样品台沿所述扫描通道移动;
所述微流控芯片的微流体通道用于固定待测分子,所述微流体通道内的流体循环流动以对待测分子施加流体曳力。
所述的系统中,所述线性扫描装置还包括线性马达和原子气池传感器,所述线性马达驱动所述样品台沿所述扫描通道运动,所述原子气池传感器设于所述样品通道的一侧,当所述磁探针最接近所述原子气池传感器的时候,所述原子气池传感器测量的磁信号达到最强点,在样品的磁场曲线(扫描距离—磁场强度)上,谱峰的高度对应于样品的磁场强度。
所述的系统中,所述通过在所述微流体通道的两端连接一回路实现对所述微流体通道内流体的循环流动,在所述回路上设置阀门,通过控制阀门的开度大小实现对流体流速的控制。
所述的系统中,所述微流控芯片包括PDMS薄片和贴附于其上表面和下表面的所述基底,所述PDMS薄片内设有所述微流体通道;
所述基底上修饰有能与所述分子对连接的官能团;
所述微流控芯片采用无磁材料,所述基底采用玻璃或者石英片。
所述的系统中,所述官能团可为-OH、-NH2、-SH或-COOH。
所述的系统中,利用Labview软件控制所述微流控芯片内流体流速(控制回路上的阀门)和所述光学原子磁力仪的磁力仪检测系统,,可实现微扰力的原位施加和磁信号的原位检测,有利于提高力谱测量的精准性和工作效率。
本发明进一步提供利用所述系统进行原位力谱检测的方法,包括如下步骤:
(1)将磁探针标记的分子对固定于所述微流控芯片的微流体通道内,并连接于所述微流控芯片的基底上,所述磁探针经磁铁磁化;
(2)将经步骤(1)处理的所述微流控芯片安装于所述样品台上,启动所述线性扫描装置进行扫描,即得到所述磁探针标记的所述分子对的磁场强度;
(3)启动所述光学原子磁力仪,控制所述微流控芯片内流体流速和所述光学原子磁力仪的磁力仪检测系统,得到不同流体流速时的磁场强度变化量,根据流体力学即得到力与磁场强度变化量之间的变化曲线,进而实现所述分子对的分子间非共价相互作用力的检测。
上述的方法中,所述线性扫描装置的扫描速度为0.1~10mm/s,扫描长度为0~300mm。
上述的方法中,所述磁探针的尺寸(即半径)为10nm~10μm;
所述分子对可为蛋白质、双链DNA、抗体-抗原或受体-配体;
可采用stop-flow微流控控制的方法固定所述分子对。
上述的方法中,步骤(2)中,扫描过程中,当所述磁探针与所述线性扫描装置的原子气池传感器之间的距离最短时,此时测量得到的磁信号即为所述磁探针标记的所述分子对的磁场强度。
上述的方法中,步骤(3)中,所述微流控芯片内的流体流速为0~1000rpm。
上述的方法中,步骤(3)中,根据式(1)所示微流体曳力公式得到不同流体流速下所对应的外力:
F=-6πηrv (1)
式(1)中,η表示流体的粘滞系数,r表示所述磁探针的半径,v表示流体的运动速度;
根据不同流速下测量得到的磁场强度变化量,得到流速-磁场强度变化量之间的变化曲线,当磁场强度变化量最大时所对应的力即为分子对发生解离所需作用力,根据流速和公式(1)即可获得该作用力的大小。
与现有技术相比,本发明具有的优点和积极效果是:
本发明的目的是测得分子对间的非共价相互作用力的大小,是通过力与磁场强度变化量之间的关系得到,当磁场强度变化量最大时对应的力即为分子对间的相互作用力;磁场强度变化量为光学原子磁力仪的测定值与分子对的磁场强度的差值,分子对的磁场强度由线性扫描装置测定得到。
待研究的分子对直接固定于微流控芯片上,并内置于超低场磁力仪的检测区。通过Labview软件控制可以同时实现微流控芯片内微扰力的施加和磁力仪内样品信号的检测,提供一种新型的超低场原位力谱。这样完全避免了样品在施力过程和测量过程的反复转移,减少了相应的实验误差,提高了力谱测量的工作效率。原位力谱技术可以直接反映微流控芯片内生物大分子间相互作用的动态过程。
附图说明
图1为本发明适用于原位力谱检测的系统的结构示意图。
图2为本发明安装线性扫描装置的超低场原子磁力仪的灵敏度。
图3为微流控芯片内作为分子探针的磁性颗粒物的磁场曲线。
图4为利用本发明原位力谱方法测量得到的双链DNA(15bp)的力-磁场强度曲线。
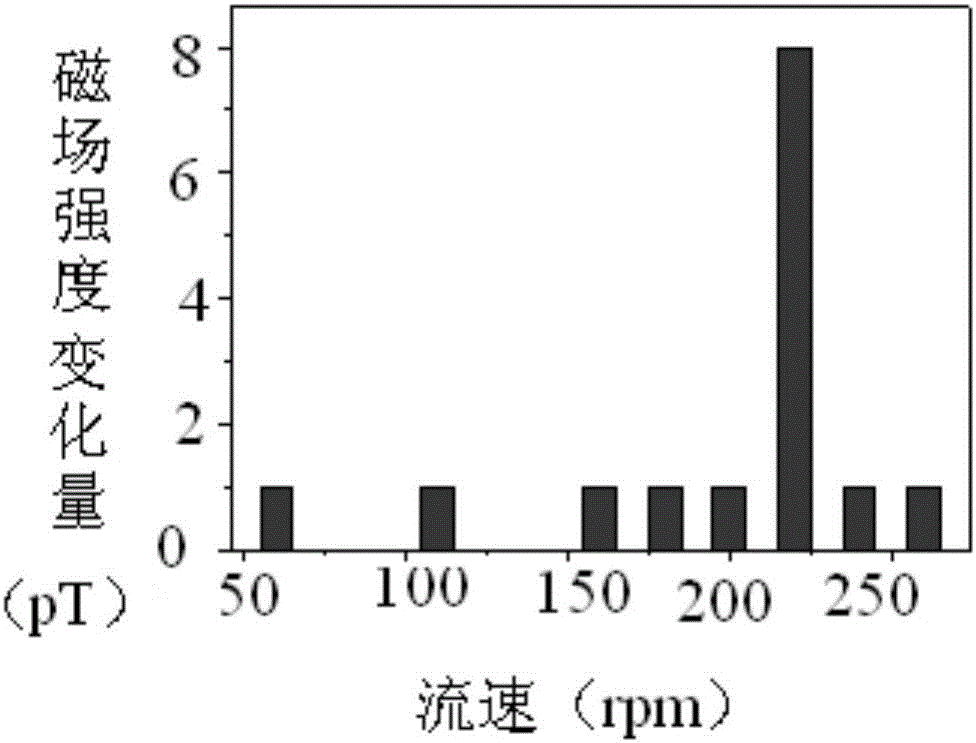
图5为利用本发明原位力谱方法测量得到的双链DNA(16bp)的力-磁场强度曲线。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
如图1所示,本发明适用于原位力谱检测的系统的示意图,其组装和使用过程如下:
步骤一、首先,在光学原子磁力仪的样品通道中安装线性扫描装置,样品台可以稳定固定在扫描通道的进出口轴线上。样品台采用无磁材料,包括塑料、玻璃、硅片等,扫描速度0.1~10mm/s,扫描长度0~300mm。
其中,线性扫描装置还包括线性马达和原子气池传感器(图中(B(b)所示)),该线性马达驱动样品台沿扫描通道运动,原子气池传感器设于样品通道的一侧。
步骤二、加工制作微流控芯片。在官能团(-OH、-NH2、-SH、-COOH等官能团)修饰的微流控芯片基底上固定有微流体通道的聚二甲基硅氧烷(PDMS)薄片,然后在上面再固定基底盖片。在PDMS薄片两端的流体通道进出口上封装聚四氟乙烯的流体管道,构成简单的微流控芯片(封装后芯片总尺寸为长<100mm,高<5mm,宽<10mm)。
步骤三、利用微流控装置,在芯片基底上固定待研究的磁探针标记的分子对,采用的磁探针尺寸为10nm~10μm,分子对可为双链DNA、抗体-抗原、受体-配体等,分子对的修饰固定过程可通过stop-flow微流控控制。
微流控芯片内的被测物包括生物大分子及多种细胞,例如肿瘤细胞、免疫细胞、细菌、衣原体、支原体。
步骤四、先用磁铁对探针进行磁化,然后将含有待测分子对的微流控芯片安装在线性扫描样品台上,利用扫描磁成像的方式,获得样品的磁场曲线,测量磁场强度。在样品扫描过程中,当磁探针处于最接近原子气池传感器的时候,测量的磁信号达到最强点。在样品的磁场曲线(扫描距离—磁场强度)上,谱峰的高度对应于样品的磁场强度。
步骤五、在原子磁力仪上,利用Labview软件控制微流控装置和磁力仪检测系统,逐步改变微流控芯片内的流速,利用流体力学得到力-磁场强度曲线,从而确定磁标记分子间非共价的相互作用力。
微流控芯片内的流速控制0~1000rpm,利用微流体曳力公式F=-6πηrv(其中,η是溶液的粘滞系数,r是颗粒物(磁探针)的半径,v是流体的运动速度)可以确定施加作用力大小;根据不同流速下测量得到的磁场强度变化量,得到力-磁场强度曲线,进而获得分子对发生解离所需作用力大小的信息。
利用Labview软件同时控制微流控装置和磁力仪检测系统,可实现微扰力的原位施加和磁信号的原位检测,有利于提高力谱测量的精准性和工作效率。
实施例1、安装线性扫描装置对超低场原子磁力仪的影响
在光学原子磁力仪的样品通道中安装线性扫描装置,组成部分包括X-Y-Z三维位移马达、样品杆、旋转固定台。其中,样品杆采用2mm直径的石英棒,可以稳定固定在扫描通道的进出口轴线上。通过优化电动马达的扫描速度,调节样品杆运动方向,将线性扫描装置对超低场原子磁力仪的影响降至最低。
如图2所示,在安装线性扫描装置后,采用1000pT的方波磁场检测超低场原子磁力仪的灵敏度。利用Labview软件调节磁力仪各参数,可将磁场强度的背景噪音降至1pT,检测灵敏度达到150fT·Hz-1/2。
实施例2、在原子磁力仪内的线性扫描平台上检测微流控芯片修饰的磁探针
在氨基修饰的玻璃基底上对中心区域进行局部醛基化修饰。将0.6ml 8.4mg/ml NaHCO3水溶液,150mg mPEG-SVA,4mg Ald-PEG-SVA混合均匀后取上层清液1-2ul滴加至玻璃基底中心位点,加盖上4mm小玻片,室温反应3h,然后用大量水清洗,得到局部醛基化基底。再将0.6ml 8.4mg/ml NaHCO3水溶液,150mg mPEG-SVA混合均匀取上层清液20ul滴加至整个局部醛基化基底,反盖上另一片局部醛基化基底,室温反应3h,然后用大量水清洗吹干。
然后在上述修饰好的玻璃基底上,用环氧树脂胶固定含有微流体通道的聚二甲基硅氧烷(PDMS)薄片,在其上面再固定基底盖片,形成玻片-PDMS-玻片的夹层。然后在PDMS薄片两端的流体通道进出口上封装聚四氟乙烯的流体管道,构成简单的微流控芯片,最后用环氧树脂胶对整个芯片进行封装加固。
利用微流控装置,在芯片内部基底上固定待研究的磁探针标记的双链DNA分子对。双链DNA分子一端氨基修饰,可与醛基化修饰的芯片基底连接;另一端生物素修饰,可与亲和素修饰的磁探针M280连接。
在磁铁磁化后,将含有磁标记DNA分子对的微流控芯片安装到线性扫描样品台上,利用扫描磁成像的方式,扫描速度1mm/s,扫描长度220mm,获得样品的磁场曲线。在样品扫描过程中,当磁探针处于最接近原子气池传感器的时候,测量的磁信号达到最强点。在如图3所示的磁场曲线上,谱峰的高度对应于样品的磁场强度,测量得到的磁场强度为25pT。
实施例3、利用本发明的原位力谱方法测量双链DNA(15bp)的力-磁场强度曲线
在实施例2中,采用15bp的双链DNA分子,利用Labview软件同时控制微流控装置和磁力仪检测系统,可实现微扰力的原位施加和磁信号的原位检测。控制微流控芯片内的流速0~500rpm,每个流速位点作用3分钟。根据不同流速下测量得到的磁场强度变化量,得到力-磁场强度变化量曲线,进而获得分子对发生解离所需作用力大小的信息。如图4所示,15bp的双链DNA分子在180rpm流速作用下发生解离。利用微流体曳力公式F=-6πηrv(其中,η是流体的粘滞系数,r是颗粒物(磁探针)的半径,v是流体的运动速度)可以得出15bp的双链DNA分子间非共价相互作用力大小。
实施例4、利用本发明的原位力谱方法测量双链DNA(16bp)的力-磁场强度曲线
在实施例2中,采用16bp的双链DNA分子,利用Labview软件同时控制微流控装置和磁力仪检测系统,可实现微扰力的原位施加和磁信号的原位检测。控制微流控芯片内的流速0~500rpm,每个流速位点作用3分钟。根据不同流速下测量得到的磁场强度变化量,得到力-磁场强度变化量曲线,进而获得分子对发生解离所需作用力大小的信息。如图5所示,16bp的双链DNA分子在220rpm流速作用下发生解离。利用微流体曳力公式F=-6πηrv(其中,η是流体的粘滞系数,r是颗粒物(磁探针)的半径,v是流体的运动速度)可以得到16bp的双链DNA分子间非共价相互作用力大小。并且对比实施例3的测量结果,表明本发明的原位力谱方法具有了区分单碱基对的力谱分辨能力。
- 还没有人留言评论。精彩留言会获得点赞!