一种治疗性抗体的放行检测方法与流程
本发明总体上涉及生命科学领域,具体涉及抗体生产工艺中质量控制和放行标准方法的建立。
背景技术:
pd-1(programmeddeath1)程序性死亡受体1,是一种重要的免疫抑制分子。以pd-1为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及器官移植存活等均有重要的意义。其配体pd-l1也可作为靶点,相应的抗体也可以起到相同的作用。因此临床中可采用治疗性抗体抑制pd-1或pd-l1免疫调节从而抑制疾病。
pd-1和pd-l1的结合的一个特点是它们既可以快速结合也可以在洗脱时快速解离,所以使两者的结合发生在没有洗脱的“均质化(homogenous)”状态方能更准确模拟体内情形(biomimic)。以前的方法,比如流式细胞检测(facs)或表面等离子体共振(spr)的细胞结合测定都不是均质化实验,不能满足这样的要求。并且由于这些方法的灵敏度和特异性不足,并不适用于治疗性抗体生产工艺中制定治疗性抗体放行标准,因此亟需进一步优化检测方法以期获得高灵敏度读数的检测方法。
电化学发光(ecl)是一种在电极表面由电化学引发的特异性化学发光反应。新一代的标记免疫测定技术,既兼有发光分析的高灵敏度和抗原抗体反应的高度特异性,因此,具有广泛的应用价值。本发明利用电化学发光技术建立了抗体生产工艺中放行方法及其放行标准,该方法不同于常规的基于facs的细胞结合测定,其步骤更简洁、数据更稳定准确,有利于治疗性抗体生产工艺中的质量控制。
技术实现要素:
本发明的一个方面,提供了一种抗体放行的方法,所述方法利用电化学发光法检测供试品抗体的细胞结合活性;通过对所述供试品抗体浓度和电化学发光强度进行四参数拟合,计算生物学活性,获得放行标准。该方法通过方法学确认能用于抗体的生物学活性放行检测。
在本发明的一个实施例中,所述抗体包括抗体类药物,优选包括治疗性抗体药物。
如前所述的供试品抗体包括抗pd-1抗体或抗pd-l1抗体,优选包括抗pd-1治疗性抗体或抗pd-l1治疗性抗体。
在本发明的一个实施例中,所述抗pd-1抗体的放行方法的步骤包括:
a)将细胞表面表达pd-1的细胞铺于细胞板中,之后不需要洗涤;
b)加入pd-l1重组蛋白、检测抗体、和所述pd-1抗体,孵育,之后不需要洗涤;其中所述pd-1抗体优选为pd-1治疗性抗体;
c)加入无表面活性剂的读数缓冲液;所述读数缓冲液优选为msdread缓冲液;
d)使用设备读板,得到电化学发光强度。
在本发明的一个实施例中,所述抗pd-l1抗体的放行方法的步骤包括:
a)将细胞表面表达pd-l1的细胞铺于细胞板中,之后不需要洗涤;
b)加入pd-1重组蛋白、检测抗体、和所述抗pd-l1抗体,孵育,之后不需要洗涤;其中所述pd-l1抗体优选为pd-l1治疗性抗体;
c)加入无表面活性剂的读数缓冲液;所述读数缓冲液优选为msdread缓冲液;
d)使用设备读板,得到电化学发光强度。
在本发明的另一方面,还提供了一种电化学发光检测pd-1抗体活性的方法,所述方法的步骤包括:
a)将细胞表面表达pd-1的细胞铺于细胞板中,之后不用缓冲液洗涤;
b)加入pd-l1重组蛋白、检测抗体、和所述pd-1抗体,孵育,之后不用缓冲液洗涤;其中所述pd-1抗体优选为pd-1治疗性抗体;
c)加入无表面活性剂的读数缓冲液,之后不用缓冲液洗涤;所述读数缓冲液优先为msdread缓冲液;
d)使用设备读板,得到电化学发光强度。
在本发明的另一方面,还提供了一种电化学发光技术检测pd-l1抗体活性的方法,所述方法的步骤包括:
a)将细胞表面表达pd-l1的细胞铺于细胞板中,之后不用缓冲液洗涤;
b)加入pd-1重组蛋白、检测抗体、和所述pd-l1治疗性抗体,孵育,之后不用缓冲液洗涤;其中所述pd-l1抗体优选为pd-l1治疗性抗体。
c)加入无表面活性剂的读数缓冲液,之后不用缓冲液洗涤;所述读数缓冲液优先为msdread缓冲液;
d)使用设备读板,得到电化学发光强度。
在本发明的一个实施例中,前述pd-1抗体的放行方法或活性检测方法的步骤或pd-l1抗体的放行方法或活性检测的步骤或还可以包括:
a')在步骤a)之前,在细胞板中加入封闭液,孵育约1至3小时,之后用洗涤缓冲液洗涤细胞板。
如前所述任一方法,其中,对所述供试品抗体浓度和电化学发光强度利用公式(1)进行四参数拟合,根据参考品、质控品及供试品四参数拟合计算得到c值,即ic50值,利用公式(2)计算得到供试品相对活性:
其中,x表示自变量,a表示左平台,b表示曲率参数,c表示半数抑制量,单位为ng/ml,d表示右平台。
在本发明的一个实施例中,供试品放行可接受标准为以下中的一种或以上:
1)a参数/d参数≥2;
2)平行性分析:曲线的斜率比值在0.7至1.4之间;高平台比值在0.8至1.25之间;
4)所有线形段复孔的cv≤30%;
5)质控品的生物学活性在75%至125%之间
6)四参数拟合s型曲线的r2≥0.95。
在本发明的一个实施例中,所述封闭液为含体积浓度为1%至5%的牛血清白蛋白的缓冲液或10%至30%胎牛血清的缓冲液,优选为15%至30%胎牛血清的缓冲液或含体积浓度为1%至3%牛血清白蛋白的缓冲液。
在本发明的一个实施例中,所述洗涤缓冲液为pbs缓冲液。
在本发明的一个实施例中,所述细胞板为msd96孔板,更优选为msd高结合的96孔板。
在本发明的一个实施例中,所述细胞为表达pd-1或pdl1的cho细胞。
在本发明的一个实施例中,细胞板中的细胞密度为2.5e4/孔至20e4/孔,优选为3.5e4/孔至7.5e4/孔,更优选为3.5e4/孔至5e4/孔。
在本发明的一个实施例中,所述pd-1重组蛋白或pd-l1重组蛋白的浓度为50ng/ml至200ng/ml,优选为80ng/ml至160ng/ml。
在本发明的一个实施例中,所述检测二抗的浓度为500ng/ml至1000ng/ml,优选为1000ng/ml。
在本发明的一个实施例中,所述步骤b)中的孵育时间为60分钟至90分钟,优选为90分钟。
在本发明的一个实施例中,所述重组蛋白为融合了标签的蛋白质,其中所述标签优选为鼠源fc。
在本发明的一个实施例中,所述检测抗体为钌结合的抗小鼠igg。
附图说明
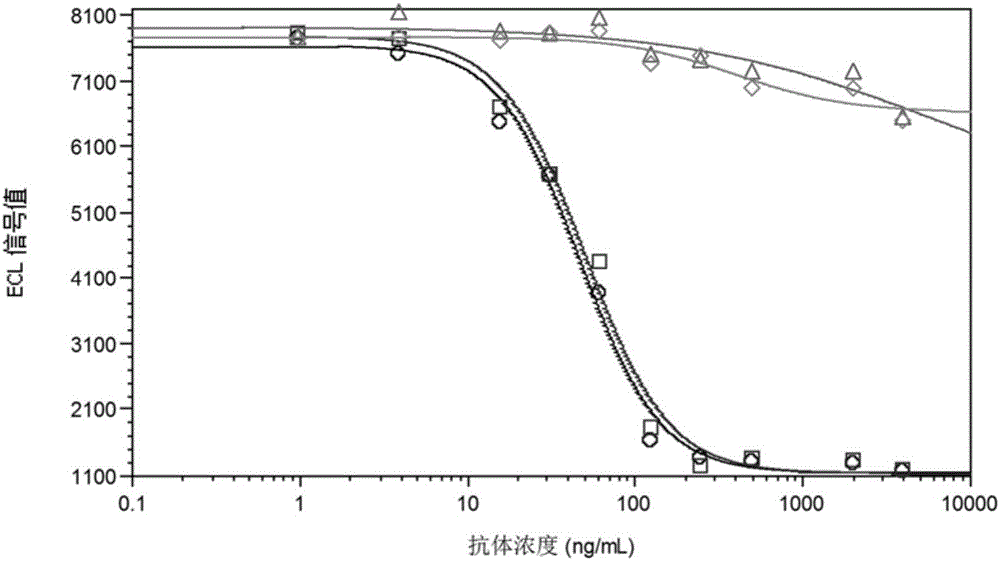
图1示出抗pd-1治疗性抗体的生物学活性放行方法的专属性。其中横坐标为产品和对照品的浓度,纵坐标为ecl信号值,蓝色圆圈标记为参考品,红色方框标记为质控品,橘色菱形标记为对照品rituximab,绿色三角形标记为对照品xolair。
图2示出抗pd-1治疗性抗体的生物学活性放行方法的线性拟合图。
图3示出细胞铺板浓度与ecl信号值之间的柱状图。
图4示出pd-l1浓度与ecl信号值之间剂量依赖柱状图。
图5示出不同条件处理下的应激样品的活性结果图。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
在详细描述本发明之前,应当理解,本发明不限于特定的生物系统或细胞类型。还应当理解,本文使用的术语仅用于描述特定实施例的目的,而不是限制性的。如本说明书和所附权利要求中所使用的,单数形式“一个”,“一”和“该”除非另有明确规定,包括复数指示物。因此,例如,提及“细胞”包括两个或多个细胞或细胞的整个培养物的组合;对于“多核苷酸”的提及实际上包括该多核苷酸的许多拷贝。除非在本说明书的提醒中另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。
在本文中所用的术语“供试品”是指待鉴别、待测定的供测试样品。在本发明中,供试品抗体包括在工业生产中被生产出的待检测生物学活性的抗体样本,具体包括pd-1抗体或pd-l1抗体。
本文所用的术语“抗体”包括全抗体和任何抗原结合片段(即“抗原结合部分”)或其单链。“抗体”包含至少两个重(h)链和两条通过二硫键相互连接的轻链(l)链或其抗原结合部分的蛋白质。每个重链由重链可变区(本文缩写为vh)和重链恒定区组成。重链恒定区由三个结构域ch1,ch2和ch3组成。每个轻链由轻链可变区(本文缩写为vl)和轻链恒定区组成。轻链恒定区由一个结构域cl组成。vh和vl区域可以进一步细分为高变区域,称为互补决定区(cdr),散布于更保守的区域,称为框架区(fr)。每个vh和vl由以下顺序从氨基末端到羧基末端排列的三个cdr和四个fr组成:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。其中术语“抗体”是指免疫球蛋白或其片段或衍生物,并且包括包含抗原结合位点的任何多肽,不管其是否在体外或体内产生。该术语包括但不限于多克隆、单克隆、单特异性、多特异性、非特异性、人源化、单链、嵌合、合成、重组、杂交、突变和接枝抗体。术语“抗体”还包括保留抗原结合功能的抗体片段,例如fab、f(ab')2、fv、scfv、fd、dab和其他抗体片段,例如特异性结合pd-1或pd-l1的能力。通常,这样的片段将包含抗原结合片段。
如本文中所使用,术语“治疗类抗体”、“治疗性抗体”可互换使用,包括但不限于已经用于临床或临床研究的抗体,还包括正在研发的具有临床使用价值的潜在抗体,所述抗体可被施用于受试者,治疗某种疾病;术语“治疗类抗体”或“治疗性抗体”还包括可用于体外诊断、体外研究、体外研发的检测性抗体,所述抗体可用于细胞学水平或免疫检测。
如本文中所使用,术语“程序性死亡1”、“程序性细胞死亡1”、“蛋白pd-1”、“pd-1”、“pd1”、“pdcd1”、“hpd-1”和“hpd-f”可互换使用,并且包括变体、同种型、人pd-1的物种同源物和具有pd-1的至少一个共同表位的类似物。
如本文中所使用,术语“程序性死亡配体1”、“pd-配体1”、“pd-l1”、“pdl1”、“b7同源物1”、“b7-h1”、“cd274”可互换使用,包括变体、同种型、人pd-l1的物种同源物和具有pd-l1的至少一个共同表位的类似物。
如本文中所使用,术语“cv”是指变异系数,是反映数据离散程度的绝对值。其数据大小不仅受变量值离散程度的影响,而且还受变量值平均水平大小的影响。标准差与平均数的比值称为变异系数。变异系数可以消除单位和(或)平均数不同对两个或多个资料变异程度比较的影响。变异系数的计算公式为:变异系数cv=(标准偏差sd/平均值mean)×100%。
如本文中所使用,术语“重组蛋白”是指应用基因重组技术,获得连接有可以翻译成目的蛋白的基因片段的重组载体,之后将其转入可以表达目的蛋白的宿主细胞从而表达特定的重组蛋白分子。
如本文中所使用,术语“读数缓冲液”是指用于读数的缓冲液,包括但不限于msdread缓冲液。
如本文中所使用,术语“放行”、“实时放行”、“放行检测”、“实施放行检测、“rtr”、“rtrt”可互换使用,是指根据工艺数据,评估和保证中间品和/或成品达到可接受质量的能力;其通常将被测量物料属性和工艺控制等的数据进行有效结合,据此评估和保证中间产品或最终成品质量的能力。
实施例
通过以下实施例进一步说明本发明。提供实施例仅用于说明目的,并且不应被解释为以任何方式限制本发明的范围或内容。
实施例1:参考品、质控品和供试品制备(关于抗pd-1抗体)
根据蛋白标示量,用分析培养基将参考品、质控品和供试品通过梯度稀释或者靶向稀释成10个或11个浓度点,作为标准曲线上的10个或11个点。其中质控品与参考品是同一种,但是与参考品独立稀释。
实施例2:pd-1/cho-s细胞株的准备
连续培养的细胞或新复苏的冻存细胞都适用于该方法。
1、连续培养的细胞:将细胞离心后弃上清。
2、冻存细胞:从液氮罐中拿出pd-1/cho-s细胞,并快速放入37℃水浴锅中解冻。将冻存管中的细胞悬液加入到含约n×9ml(n表示细胞支数)cho培养基中,轻柔地吹打混匀。离心弃去上清。
3、用冷的dpbs将细胞洗涤一次。离心后弃上清。根据所需要的细胞悬液体积,加入分析培养基重悬细胞。取细胞悬液进行细胞计数,确定细胞密度及细胞活率。用分析培养基调整细胞密度至16.7e5/ml,将调整浓度的细胞悬液混匀。
实施例3:测试方法
1、封闭:将150μl封闭液(10%fbs/pbs或3%bsa/pbs)加入到msd高结合96孔中。msd板置于振荡器上以150~220转/分钟的转速振荡,室温孵育2±1小时(如果不需要封闭,此步可以省略)。
2、按照实施例1中所述的方法制备参考品、质控品及供试品溶液。将pd-l1-mfc存储液稀释至终浓度为800ng/ml,涡旋混匀。将检测二抗(msdsulfo-taggoatanti-mouseantibody)存储液稀释至终浓度为2.857μg/ml,涡旋混匀。pd-1/cho-s细胞株的准备参见实施例2。
3、将稀释好的参考品及供试品,稀释好的800ng/mlpd-l1-mfc和稀释好的2.857μg/ml检测抗体以1:1:2(v:v:v)的比例(例如45μl:45μl:90μl)转移至u形底96孔板中(转移板)的第二列至第十二列中,混匀。在第一列中加入以1:1(v:v)混合(例如90μl:90μl)的分析培养基和检测抗体,作为背景。2至8℃冰箱避光保存。
4、用dpbs或1×pbs将msd高结合96孔板洗3遍(如果不需要封闭msd板,则此步省略)。
5、pd-1/cho-s细胞铺板:以30μl/孔加入到msd高结合板中。将参考品及供试品抗体、pd-l1-mfc和检测抗体的混合物以70μl/孔加入到含有pd-1/cho-s细胞的msd高结合板中,每孔的总体积为100μl。
6、将msd板置于室温或22~28℃恒温培养箱中避光孵育60至90分钟。
7、向msd板的每孔中加入100μl的2×不含表面活性剂的readbuffer。
8、用msdmesotmsectors600或同等设备读板。
9、数据分析:
虽然每次实验同时操作多块板,但是每块板独立计算。
用四参数对抗体浓度和电化学发光强度进行拟合
其中,x=自变量
a=左平台
b=曲率参数
c=半数抑制量(ng/ml)
d=右平台
平行性分析:根据参考品及供试品四参数拟合计算得到b值,即四参数拟合曲线的斜率,利用下列公式计算得到供试品或质控品的曲线斜率的比值(sloperatio):
质控品与样品的相对活性计算如下:根据参考品、质控品及供试品四参数拟合计算得到c值,即ic50值,利用下列公式计算得到供试品生物学活性。
10、在一个具体实施例中,系统适用性
只有当质控品满足以下所有标准,实验才有效,
a)a参数/d参数≥2;
b)平行性分析:曲线的斜率比在0.7至1.4之间;高平台比在0.8至1.25之间;
c)双复孔都包括在线形段的复孔cv≤30%;
d)质控品的生物学活性在75%至125%之间;
e)四参数拟合s型曲线的r2≥0.95;
如果质控品的结果不满足以上的标准,实验被认为是无效的。
参考品可接受标准
a参数/d参数≥2
所有线性段复孔cv≤30%.
四参数拟合s型曲线的r2≥0.95
供试品可接受标准
a参数/d参数≥2
平行性:曲线的斜率比在0.7~1.4之间;高平台比在0.8至1.25之间
供试品的所有线性段复孔的cv≤30%.
四参数拟合s型曲线的r2≥0.95
实施例4:方法确认
1、专属性
不相关的isotype匹配抗体不能抑制pd-l1与表达pd-1的cho细胞株的结合,对照样品无特异性的生物学活性(图1)。该方法对考察抗pd-1产品的生物学活性具有良好的特异性。
2、准确度
50%、71%、100%、141%以及200%目标浓度样品的平均回收率介于80%至120%之间(表1)。
3、精密度
50%、71%、100%、141%以及200%目标浓度样品,分别独立8次;中间精密度检测结果每个样品rsd均小于25%(表1)。
表1.准确度和精确度结果列表
4、线性
使用回收率研究的数据,预期相对活性与实测相对活性线性拟合情况较好,pearson相关系数≥0.95(图2)。
5、试验有效范围
试验结果在50%至200%目标浓度范围内回收率显示了良好的线性,而且结果的准确性与精密度都符合可接受标准。因此,该试验有效范围为50%至200%目标浓度范围。
6、耐用性
pd-l1浓度、试验孵育时间、细胞密度、检测抗体浓度和细胞代次等参数在研究范围内,qc回收率均满足80%≤回收率≤120%
7、应激样品
热处理、酸处理(大约ph3)和碱处理(大约ph11)的应激样品的活性相对于未处理的对照明显下降(图5)。
8、长期的质量控制
在至少6个月的时间内,由至少两名实验人员进行检测,在此过程中,质控品的回收率均在80%至120%之间,符合放行的要求,证明本放行方法满足长期质量控制的考察。
9、结论
实验结果,包括专属性、准确度、精密度、试验有效范围以及线性、耐用性和应激样品分析,证明该方法适用于抗pd1抗体的实验室各阶段的生物活性方法,包括药物原液,成品,稳定性样品及中间体的生物学活性检测。
实施例5:方法参数的优化
1、细胞密度
细胞类型:分别表达pd-1或pd-l1的cho细胞,探索细胞密度范围:6.25e3/孔~20e4/孔。结果参见图3,2.5e4/孔~20e4/孔的细胞均适用于实验。
2、pd-l1/pd-1浓度
探索浓度范围:4至2000ng/ml。结果参见图4,100±50ng/ml的pd-l1均适用于实验。
3、其他参数
3.1、检测二抗浓度
探索浓度范围:100ng/ml至2000ng/ml。750±250ng/ml的检测二抗浓度均适用于实验。
3.2、试验孵育时间
探索范围:60至90分钟,孵育时间均适用于实验。
3.3、封闭液
探索条件:1%bsa至3%bsa、15%至30%的fbs/培养基、无封闭。三者均适用于该实验。
3.4、分析缓冲液
探索条件:1%bsa、10%至30%fbs/培养基、10%至30%fbs/pbs。三者均适用于该实验。
3.5、冻存细胞和连续培养细胞的比较
结果:均适合于实验。
通过引用并入
本文引用的每个专利文献和科学文献的全部公开内容通过引用并入本文用于所有目的。
等效
本发明可以在不脱离其基本特征的情况下以其他具体形式实施。因此,前述实施例被认为是说明性的,而不是对本文所述的本发明的限制。本发明的范围由所附权利要求书而不是由前述说明书表示,并且意在将落入权利要求书的等同物的含义和范围内的所有改变包括在其中。
- 还没有人留言评论。精彩留言会获得点赞!