一种细胞培养收获液中病毒颗粒的电镜定量检测方法与流程
本发明属于生物技术领域,具体的,本发明涉及一种细胞培养收获液中病毒颗粒的电镜定量检测方法。
背景技术:
一、细胞培养的外源因子污染
生物制品是采用生物技术制备而成的具有生物活性的药品、疫苗、抗体、生化产品等的总称,其生产工艺复杂且受多种因素影响,生产过程中使用的各种材料来源复杂,可能污染细菌、真菌、支原体和病毒等外源因子,引起产品安全性问题。其中生物制品生产用细胞是生物制品生产的一个关键要素,目前国内外许多生物制品均是以细胞基质材科为基础生产生物制品。同时,使用细胞基质生产生物制品过程及其复杂,加之周期长、易污染等客观因素,导至外源因子污染成为影响生物制品生物安全性的一个极其重要的因素。因此,对生物制品生产用细胞基质及过程进行严格的质量控制,排除外源因子污染,是生物制品生产的重要环节。
鉴于生物制品的应用对象是人体免疫或疾病治疗。因此,生物制品终产品的质量与生物安全性密切相关,是各国药品管理机构最为关注的问题,各国药典中最严格控制的指标之一。生物制品生产用细胞基质需建立各级细胞库,细胞库质量是产品质量的上游保证,《中华人民共和国药典,三部,2015版》及《生物制品通则》规定各级细胞库及终产品均需要进行外源因子污染检定,检测结果应无外源因子污染。
目前,中国药典规定对于细胞外源因子污染的检测以培养法为主,细菌、真菌、支原体因其生物学持性所至,用多种培养方法联合检测基本能检测出所有的污染物。而对于细胞内、外源病毒污染的检测,目前采用的体外培养观察加红细胞吸附法、动物体内及鸡胚接种法等均为间接的检测方法,不仅检测周期长,操作复杂且易受干扰,同时覆盖的范围窄,对某些特定病毒,且病毒密度比较低的样品检测技术更为复杂多样。因此,急需一种能够快速、直观观察污染的病毒颗粒形态,且又能同时对低密度病毒进行精确定量的方法,解诀细胞内、外源病毒污染的精确定量检测问题。
二、负染色电镜技术与病毒学研究
电子显微镜技术在自然科学各个领域中都发挥了重要的作用,尤其是生物学、材料科学、医药卫生等相关学科,更是不可缺少的工具。负染色电子显微镜技术在病毒学研究中常规使用,尤其对病毒形态观察、病毒分类和病毒诊断领域起非常重要的作用。对于特征性病毒,可直观地立刻做出判定,对于特征不太强的病毒,可结合其它指标综合判定。
负染色电子显微镜定量实验(quantitationofviralcontaminantsbynegativestainelectronmicroscopy)是一项运用负染色电子显微镜观察待检测样品中是否含有病毒颗粒,同时通过直接计数病毒颗粒,对样品中的病毒浓度进行定量的技术。上世纪70~80年代该技术已被gelderblometal(1978)和hammondetal(1981)用于病毒的定量检测,基本流程是纯化后的病毒与电镜铜网直接超速离心,电子显微镜视野下拍照并直接对病毒颗粒计数。由于当时的实验条件所限,加之电子显微镜技术参数设置差强人意,至使病毒定量误差较大,难于推广应用。近年来,也有少数新技术、新方法问世,但仅限于对高密度(106-7)以上的病毒进行定量,对低密度(103-5)的病毒定量仍无能为力。而对低密度(103-5)的病毒定量,正是细胞培养中内、外源病毒污染定量检测期待的关键技术。
纳米颗粒是一种人工制造的、大小不超过100纳米的微型颗粒。它的形态可以是乳胶体、聚合物、陶瓷颗粒、金属颗粒和碳颗粒。近年来,纳米颗粒越来越多地应用于生物医学、药物载体及生物活性大分子吸附中。直接用于人体的纳米颗粒依其形状、大小、原始材料、表面大小、带电荷以及用量、作用时间等方面所表现出的生物毒性差异显著,需经严格的毒理试验评估后方可使用。而用于离体试验的标准参照物,更多关注纳米颗粒的大小形状,表面结构及带电荷状态,相溶牲等,对纳米颗粒的选择余地会更大。纳米颗粒根据表面基团功能的不同,可分为特异性吸附型和非特异性吸附型,前者为特异性稳定吸附,是一种典型的生物学效应,后者是一种不稳定的吸附聚集现象,产生的是物理吸附作用,结合力不够牢固,随着时间推移,条件的改变,吸附的物体会缓慢脱落,形成分散状态。
技术实现要素:
针对上述问题,本发明提供了一种细胞培养收获液中病毒颗粒的电镜定量检测方法,由于引入纳米颗粒作为负染色电子显微镜定量观察中的标准参照物,显著提升病毒定量的灵敏度、精确度,可对待检细胞培养收获液中低密度(103-5)的病毒进行精确定量,其定量精确度甚至与标准的生物学测定法(病毒滴度测定法)相当。
为了达到上述目的,本发明采取以下技术措施:
一种细胞培养收获液中病毒颗粒的电镜定量检测方法,包括下述步骤:
1)预处理:按照常规离心方式去除待测样品中的细胞碎片和杂质,经超速离心浓缩后的病毒,用mem或pbs溶解;
2)上样检测:将经过步骤1)预处理的待测样品与纳米颗粒混合,将铜网置于该混合物中后超速离心;将铜网取出,清洗后的铜网磷钨酸负染,电镜观察;
3)计数:若发现病毒样颗粒,则对不同网格中的纳米颗粒或病毒样颗粒进行计数,每个网格至少观察5个视野,结果中会给出网格中纳米颗粒和病毒样颗粒各自的数目,并根据两者的比例关系计算出检测样品中病毒样颗粒的浓度。
以上所述的方法中,优选的,步骤1)的步骤包括:
1、先取待检测样品5~10ml,转入15ml离心管中,于4℃,3000g离心10分钟。
2、将离心好的上清转入新的15ml离心管中,于4℃,6000g离心20分钟。
3、将离心好的上清转入新的15ml离心管中,于4℃,10000g离心30分钟,上清备用。
4、取3~5ml备用上清置于超速离心管中,补满离心管总体积6ml。在thermowx100(t8100转子)冷冻超速离心机中4℃,72000g离心2~4小时。
5、弃上清,每管加入500~1000ul无血清mem培养基或pbs重悬,于冰上溶解4小时或过夜,收集样品于1.5mlep管中,冻于-80℃冰箱备用。
以上所述的方法中,优选的,所述的纳米颗粒的直径为100nm;
以上所述的方法中,优选的,步骤2)中超速离心的速度为100,000×g~120,000×g,离心时间为5~10min;
以上所述的方法中,优选的,所述的磷钨酸的浓度为3%(w/v)
以上所述的方法中,优选的,所述的铜网为200目;
以上所述的方法中,优选的,步骤2)中,待测样品与纳米颗粒混合时,待测样品中的病毒数与纳米颗粒的比值范围是1:1~1:9;
以上所述的方法中,优选的,所述的纳米颗粒的材质为合成乳胶。
与现有技术相比,本发明具有以下优点:
1、检测周期短,成本低廉:对比常规方法(体外体内培养法)长达2~4周的检测周期,负染色电子显微镜定量法仅需三个工作日就能完成样品处理、上样检测及结果分析的完整周期,大大节约了时间成本和人力成本,能够高效、快速的完成样品的病毒污染检测工作,同时,所用试剂(纳米颗粒标准品,染色液等)性状稳定,检测成本低。
2、直观化、可视化、精确定量:对比传统的间接培养检测法,负染色电镜检测法能够直观的在电镜下观察到各种特异的病毒样颗粒形态,实现可视化操作;同时引入已知浓度的非吸附型纳米颗粒标准物作为参照,在可视化的基础上实现对细胞培养收获液中病毒样颗粒的直接计数,通过计算获得样品中病毒的定量,即每ml样品中的病毒数量。
3、灵敏度高,稳定性强:对比国外实验室上世纪70~80年代建立的方法,本发明建立的负染色电镜检测方法,由于加入了非吸附型纳米颗粒,在超速离心过程中可通过其表面非特异性吸附的形式吸附低密度病毒颗粒,使得病毒颗粒更多地聚集到铜网上,检测下限由原先的1×106-7个/ml提高至2×103-5个/ml,综合提高了10-1000倍的检测灵敏度。
4、检测幅度宽,应用范围广:与现有的负染色电镜检测方法比,由于加入已知浓度的纳米颗粒标准物作为参照,使病毒定量幅度加宽,不仅对颗粒较大(大小约为180×80nm)的水泡性口炎病毒,颗粒中等(大小约为60~80nm)的逆转录病毒样颗粒能进行定量,就是颗粒非常小(大小约为20~30nm)的口蹄疫病毒也能进行定量,定量精确度甚至与标准的生物学测定法(病毒滴度测定法)相当,这一发明让负染色电子显微镜病毒定量法的广泛应用得以实现。
附图说明
图1为为细胞培养收获液的负染色电镜图片;
放大倍数4,0000×,标尺为200nm。
具体实施方式
本发明所述技术方案,如未特别说明,均为本领域的常规技术,所述试剂或材料,如未特别说明,均来源于商业渠道。
实施例1:
一种细胞培养收获液中病毒颗粒的电镜定量检测方法,包括下述步骤:
本发明实施例是以人的293t细胞制备的重组腺病毒上清和生物制品生产cho细胞的培养收获液为待测样品,感染水泡口炎病毒(vsv)和口蹄疫病毒(fmdv)的细胞收获液作阳性对照为例进行说明。本发明实施例所述的纳米颗粒为的材质为合成乳胶。
1)样品的预处理
(1)先取待检测样品10ml,转入15ml离心管中,于4℃,3000g离心10min。
(2)将离心好的上清转入新的15ml离心管中,于4℃,6000g离心20min。
(3)将离心好的上清转入新的15ml离心管中,于4℃,10000g离心30min,取上清备用。
(4)取5ml备用上清置于超速离心管中,补满离心管总体积6ml。在thermowx100(t8100转子)冷冻超速离心机中4℃,72000g离心4小时。
(5)弃上清,每管加入1000ulpbs重悬,于冰上溶解4h,收集样品于1.5mlep管中,冻于-80℃冰箱备用。
2)上样检测
(1)取200ul待检测样品于离心管中,加入1.22×109个/ml浓度的纳米颗粒200ul,纳米颗粒为直径100nm的标准品,混匀。将200目的铜网(200meshgrid)放入离心管中,在thermowx100(t8100转子)离心机上120,000×g超速离心10min,样品中的病毒颗粒被纳米颗粒非特异性吸附后直接聚集在铜网上。
(2)将铜网取出,用蒸馏水洗三次,然后用吸水纸吸干,室温放置两小时。用3%的磷钨酸(phosphotungsticacid,pta)进行负染,吸水纸吸干。在jeol(型号jem-1400plus)透射电镜下以合适的放大倍数(40,000×)观察样品,拍照。
(3)若发现病毒样颗粒,则对两个不同网格中的1000个纳米颗粒和病毒样颗粒进行计数,每个网格至少观察5个视野。结果中会给出两个网格中纳米颗粒和病毒样颗粒各自的数目,并根据两者的比例关系计算出检测样品中病毒样颗粒的浓度。该测试的检测限约1×103-5个颗粒/ml,一些情况下可能以低于检测限的浓度检测病毒颗粒。如果使用测试样品的稀释度来评价样品,则必须调整检测限度。
3)检测体系
依据检测的要求,每次细胞培养收获液样品的检测都必须设立阴性对照和阳性对照。
(1)阴性对照为纳米颗粒加pbs溶液,其电镜结果如图1中a所示,箭头标注的灰黑色小球(也可能染成灰白色)为100nm的纳米颗粒;
(2)阳性对照1为纳米颗粒加纯化的指示病毒(水泡性口炎病毒,vsv),电镜结果如图1中b,箭头标注的病毒样颗粒为弹状vsv,大小约为180×80nm;阳性对照2为纳米颗粒加纯化的指示病毒(口蹄疫病毒,fmdv),电镜结果如图1中c,箭头标注的病毒样颗粒为球状fmdv,大小约为20~30nm;
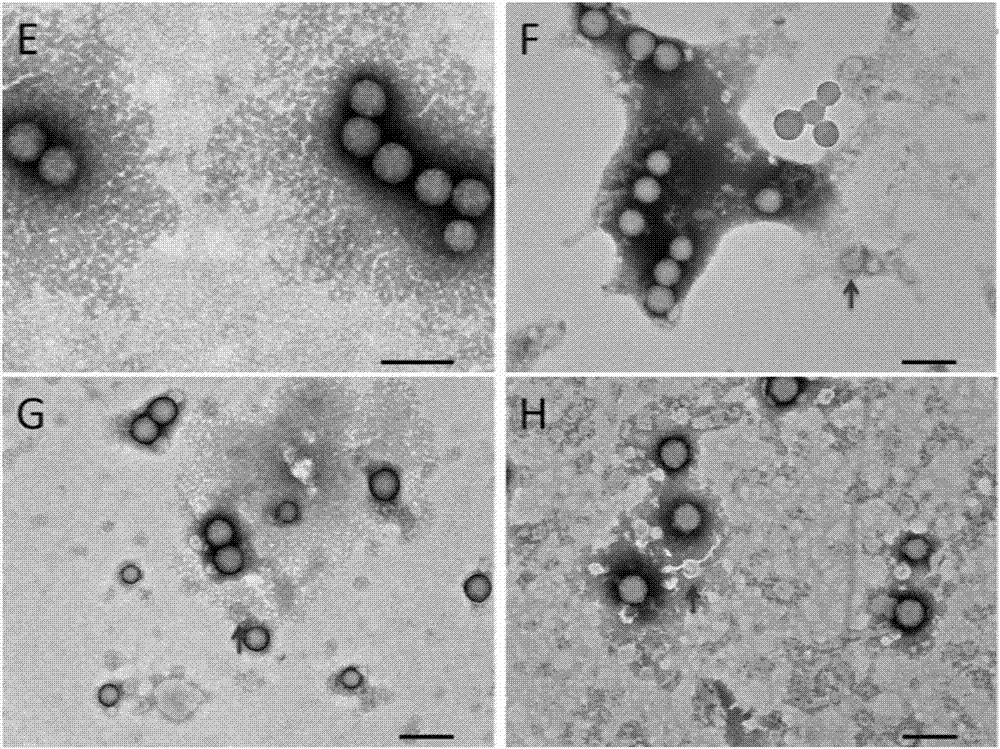
(3)图1中d所示为细胞培养收获液加纳米颗粒,样品中没有发现其他病毒样颗粒;图1中e所示为细胞收获液上清加纳米颗粒,样品中没有发现其他病毒样颗粒;图1中f~h则为人293t细胞生产重组腺病毒的细胞收获液,箭头为样品中发现的逆转录病毒样颗粒,为散状分布的球形,边沿有囊膜被染成白色,内部被染成灰白色,大小约为60~80nm,纳米颗粒则边沿被染成黑色,内部染成灰白色,大小约100nm。
4)检测结果
病毒定量:图1中d发现病毒样颗粒,则对两个不同网格中的1000个纳米颗粒和病毒样颗粒进行计数。结果中给出两个网格中纳米颗粒和病毒样颗粒各自的数目,并根据两者的比例关系计算出检测样品中病毒样颗粒的浓度。
本发明对阳性对照和样品进行颗粒计数并定量得到vsv及样品逆转录病毒样颗粒浓度,为了进一步验证该实验的可靠性和准确性,同时运用标准的生物学测定法(病毒滴度测定--tcid50法)检测vsv病毒的滴度,结果如表1所示,负染色电镜检测法测得vsv阳性对照的颗粒浓度达1.47×107个/ml,该数值与tcid50法测出的滴度10-7.6/ml较为接近,说明该方法得到的数据真实可靠,而逆转录病毒收获液在预处理时经过了12倍的浓缩,换算后得到其初始浓度约为4~5×105个/ml。
针对一些可能存在低密度病毒的收获液样品,可以采取两种方式进一步降低检测限,10倍稀释纳米颗粒标准品至1.22×108个/ml,或预处理时对细胞收获液样品进行50倍的浓缩,从而检测并计算得到细胞收获液1中病毒颗粒浓度为3.05×104个/ml,细胞收获液2中病毒颗粒浓度为4.14×103个/ml,进一步提高了检测灵敏度。
表1.样品病毒颗粒定量结果
电镜检测的特异性主要通过观察病毒本身的形态学特征体现。我们知道,大多数病毒都是有其独特的形态学特征的:如vsv为子弹状,大小约为180×80nm;fmdv为球状,大小约为20~30nm;逆转录病毒样颗粒,为散状分布的球形,边沿有囊膜,大小约为60~80nm等。因此可以根据细胞培养样品的性质和特征,分析其可能存在的病毒污染物,再根据该病毒的特异性形态特征去定向检测。
- 还没有人留言评论。精彩留言会获得点赞!