一种骨髓染色体G带的制作方法与流程
本发明涉及生物医学检验技术领域,具体涉及一种骨髓染色体G带的制作方法。
背景技术:
随着分子生物学与细胞遗传学的发展,骨髓染色图核型分析在血液系统疾病的诊断、治疗和预后中发挥了越来越重要的作用。在对染色体的研究过程中,研究者们期望通过实验技术导致染色体内部结构的分化染色,以获得更多的具有鉴别特征的信息,即所谓染色体的“解剖学”特征。通过采用不同的方法以及不同的染料处理染色体标本后,使每条染色体上出现明暗相间或深浅不同的带纹,这种分化染色技术即为染色体显带技术。G带是目前被广泛应用的一种带型,它主要是被姬姆萨(Giemsa)染料染色后而显带,故称之为G显带技术,其所显示的带纹分布在整个中期细胞的染色体上。
骨髓染色体的制作主要包括:细胞收获、低渗、固定、制片和染色等步骤,每个步骤都可能会影响骨髓染色体的制备成功。由于骨髓染色体的制作过程复杂,影响因素众多,常常出现可分析分裂象小,染色体粗短,且分散不良等现象,大大降低了染色体核型分析的成功率,降低了其临床实用性。
技术实现要素:
针对上述现有技术的不足,本发明的目的是提供一种骨髓染色体G带的制作方法。采用本发明的方法制作的骨髓染色体呈长棒状,分散良好无交叉,显带清晰。
为实现上述目的,本发明采用如下技术方案:
一种骨髓染色体G带的制作方法,包括以下步骤:
(1)进行骨髓白细胞计数,根据白细胞计数结果确定骨髓血的接种量和培养时间;
(2)将骨髓血接种到骨髓细胞培养基中进行培养;
(3)向骨髓细胞培养基中加入秋水仙素,终止培养;
(4)收取骨髓细胞培养物,将其配制成细胞悬液,调节细胞悬液的浊度为2-3个麦氏浊度;
(5)将细胞悬液滴于玻片上,然后将玻片过火,过火时间为10-15s,过火后再进行烘烤;
(6)将烘烤后的玻片采用胰蛋白酶进行处理,然后采用姬姆萨染料染色,即获得具有G显带的染色体标本。
优选的,步骤(1)中,骨髓白细胞的计数方法为:用白细胞稀释液先破坏红细胞,然后用血细胞计数板进行计数四角大方格,得出平均数N。
优选的,步骤(1)中,骨髓血接种量的确定方法为:
当N≤20,每5ml骨髓细胞培养基内骨髓血的接种量为2.5ml;
当20<N≤200,每5ml骨髓细胞培养基内骨髓血的接种量为50/N ml;
当N>200,将骨髓血稀释至N’=80-120,再按每5ml骨髓细胞培养基内骨髓血的接种量为50/N’ml进行接种。
优选的,步骤(1)中,培养时间的确定方法为:
当N≤40时,培养3天;
当N>40时,培养2天。
优选的,步骤(2)中,所述骨髓细胞培养基为RPMI-1640培养基。
优选的,步骤(2)中,培养温度为37℃。
优选的,步骤(3)中,每5ml骨髓细胞培养基中加入0.1ml 20μg/ml的秋水仙素。
优选的,步骤(4)中,收取骨髓细胞培养物的方法为:将终止培养后的骨髓细胞培养液离心,弃去上清液;加入预温至37℃的低渗液,混匀,37℃,35-45min;加入固定液,混匀,离心,进行预固定;离心后弃去上清液,再加入固定液,-20℃固定至少45min或4℃放置过夜,进行第一次固定;再次离心,弃去上清液,加入固定液,混匀,进行第二次固定;第二次固定后再离心,弃去上清液,即得到骨髓细胞培养物。
进一步的,所述固定液为甲醇和冰醋酸按体积比1:3混合而成。
优选的,步骤(5)中,将细胞悬液于5-10cm高度处滴于玻片上。
优选的,步骤(5)中,将玻片放在酒精灯外延火焰处进行过火,过程中左右移动玻片,使玻片从头到尾得到充分过火。
优选的,步骤(6)中,胰蛋白酶的处理浓度为0.025%,处理时间为15-25s。
本发明的有益效果:
采用本发明方法制备的骨髓染色体标本,与常规骨髓染色体标本相比,其分裂相更多,分裂相中染色体的长度更长,带纹更加清晰,分散度更加良好,便于分析;异常染色体检出率更高,诊断结果更加可靠;采用本发明的骨髓染色体G带用于骨髓染色体核型分析时,成功率显著提高,制片失败率从10%降为5%,还降低了制作成本,具有广泛的应用前景。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
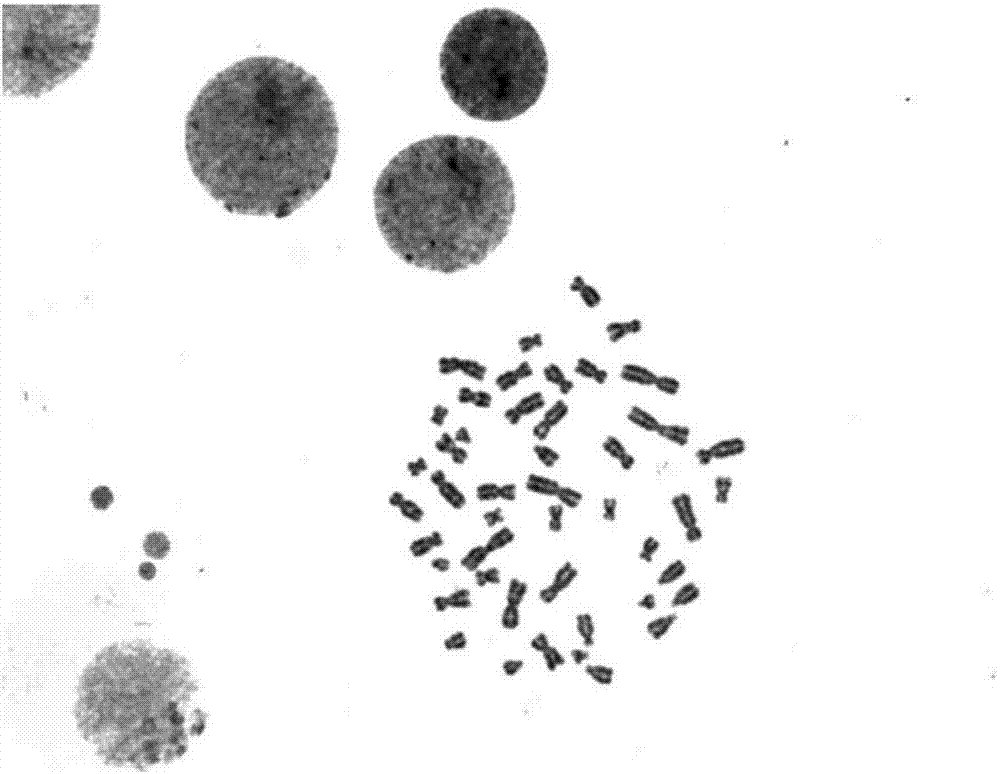
图1:实施例1制备的骨髓染色体在低倍镜下的分裂相;
图2:实施例1制备的骨髓染色体在高倍镜下的分裂相;
图3:对比例1制备的骨髓染色体在低倍镜下的分裂相;
图4:对比例1制备的骨髓染色体在高倍镜下的分裂相。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,由于骨髓染色体的制作过程复杂,影响因素众多,经常会出现染色后细胞小而皱缩,染色体比较少,短小、分散不好且有部分染色体交叉,显带也不理想等情况,从而导致制片失败率居高不下。基于此,本发明提出了一种新的骨髓染色体G带的制作方法,通过对接种量、培养时间进行优化改进,增加了染色体数量;通过对收获方式、滴片方式进行改进,使染色后细胞大而圆润,染色体呈长棒状,分散良好无交叉,显带清晰。
本发明的骨髓染色体G带制作方法的各个步骤相辅相成,缺一不可,是一个有机的整体。其中:
骨髓血的接种量是染色体标本制备过程中的重要影响因素,本发明通过白细胞计数来确定骨髓血的接种量,这样可以使得培养的细胞浓度处在最适生长浓度范围内,使细胞生长处于最佳状态,分裂指数最高;本发明同时结合对培养时间的优化,使得采用本发明的接种量和培养时间进行培养,与其他培养方法相比,收获的染色体数目多,分裂相最多,染色体形态良好。
由于骨髓中含有大量的脂肪颗粒,且各种细胞系的细胞周期不固定,使制备出的染色体G带往往出现染色体分裂指数低、染色体短粗、分散度差等缺点。有研究通过在传统的骨髓培养基中加入人类淋巴瘤细胞培养物,为骨髓细胞提供了更多的营养物,制取出的G带背景更加清晰,骨髓染色体分裂相多,形态及分散度更加良好,但是,由于在培养基中增加了人类淋巴瘤细胞培养物,增加了生产成本。本发明的改进思路不同于该研究,本发明仍采用传统的骨髓细胞培养基,重点在于骨髓染色体制作方法的改进,这样不仅可以获得背景清晰的G带,分裂相多、形态及分散度优异的骨髓染色体,同时还降低了生产成本。
应用秋水仙素终止细胞培养,使其停留在中期分裂相,是目前普遍采用的一种方法。但秋水仙素的处理浓度一直是争论的焦点,不同报道的秋水仙素处理浓度相差很大,至今仍无一致的观点。秋水仙素能阻留中期分裂相,同时也会使染色体浓缩,若秋水仙素的处理浓度过高,虽然分裂相会有所增加,但染色体长度反而会缩短,导致带纹减少;若处理浓度过低,则会导致染色体分裂相减少。本发明通过对秋水仙素的处理浓度进行考察,结果发现,采用20μg/ml的秋水仙素终止细胞培养,取得了优异的效果,染色体长度适中,结构紧密,分裂相多,显带成功率明显提高。
采用秋水仙素终止细胞培养后,应用低渗液处理细胞,可使染色体分散。低渗时间是影响染色体分散效果的影响因素,低渗时间过长,会导致染色体丢失,使染色体过分肿胀,造成形态结构模糊影响显带;低渗时间过短,则会导致染色体分散不佳;本发明通过对低渗时间的优化,结果发现,低渗35-45min,染色体的分散效果最佳。
低渗后再采用固定液固定细胞,可以使带型清晰,若细胞固定不充分,会影响染色体的显带质量。本发明通过一次预固定和两次固定,细胞得到了充分固定,更加有利于后续的染色操作。
更为关键的是,对于固定细胞后得到的细胞悬液,本发明对细胞悬液的浊度进行了优化控制,将细胞悬液的浊度控制在相当于麦氏管2-3个麦氏的浊度。本发明研究发现,细胞悬液的浊度与制备的骨髓染色体的标本质量密切相关,若细胞悬液的浊度低于2个麦氏,则分裂相容易散大;若细胞悬液的浊度高于3个麦氏,则容易产生过火不够的现象。控制细胞悬液的浊度在2-3个麦氏,其制备的骨髓染色体的标本质量最佳。
要使调整浊度后的细胞悬液中的细胞和染色体均匀的分散在玻片上,滴片操作是关键,滴片时要有一定的高度,若滴片高度过低,会导致细胞堆积,分散不均匀,染色体相互重叠;若滴片高度过高,会使细胞和染色体丢失。本发明将滴片高度控制在5-10cm,可以获得分散比较均匀的细胞和染色体,同时不会造成细胞和染色体的丢失。
将滴片后的玻片进行过火处理,可以促使细胞破膜和染色体分散,过火处理的时间是影响过火处理效果的关键因素,对于如何选择过火时间,现有技术中并未记载。本发明首次对过火处理的时间进行了优化考察,结果发现,过火时间为10-15s效果最好,短于10s,则细胞破膜和染色体分散不充分;长于15s,则会导致染色体皱缩、分散过度。
胰酶处理是获得染色体G显带的关键,不同胰蛋白酶处理浓度及处理时间,G带显示效果有较大差异,它们之间并不呈一种简单的随浓度或时间递增或递减的线性关系,变化比较复杂。若胰蛋白酶处理时间过长,则会导致染色体边缘发毛;若胰蛋白酶处理时间过短,则会导致染色体不出现带纹。本发明对胰蛋白酶的处理时间进行了优化,结果发现,胰蛋白酶的处理时间为15-25秒时,染色体G显带的效果最优。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例和对比例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
实施例1:骨髓染色体G带的制作
具体制作方法包括如下步骤:
(1)准备培养基:将RPMI1640培养基从冷冻冰箱取出,放37℃水浴箱温育,备用。
(2)接种:首先进行骨髓细胞计数:用白细胞稀释液先破坏红细胞,用血细胞技术板进行细胞计数四角大方格,得出平均数N,根据平均数N确定培养基内骨髓血的加入量;
当N≤20,每5ml骨髓细胞培养基内骨髓血的接种量为2.5ml;
当20<N≤200,每5ml骨髓细胞培养基内骨髓血的接种量为50/N ml;
当N>200,将骨髓血稀释至N’=80-120,再按每5ml骨髓细胞培养基内骨髓血的接种量为50/N’ml进行接种。
(3)培养:在37℃的培养箱内进行培养,平均数N大于40培养2天,平均数N小于或等于40培养3天。
(4)终止培养:收获前每瓶(含5ml骨髓瘤细胞培养基)加入0.1ml 20μg/ml秋水仙素,再放入37℃温箱,终止细胞分裂,使其停留在细胞中期,1小时后收获。
(5)收取骨髓细胞培养物:
A.离心:2100rpm/min,10分,弃上清液;
B.低渗:加入预温至37℃的0.075M KCL低渗液8ml左右,轻轻混匀,置37℃35-45分;
C.预固定:加入1-2ml固定液轻轻混匀,2100rpm/min×10分。(可提前将一天所需固定液配好,固定液配置比例:甲醇和冰醋酸按1:3体积混匀配成,放-20℃冰箱中预冷);
D.第一次固定:离心后弃上清液,加入固定液约8ml,-20℃冰箱固定至少45分钟或4℃冰箱放置过夜。
E.第二次固定:2100rpm/min×10分,离心后弃上清液,在其中一管加入固定液约8ml,混匀,此步骤时两管合成一管;
F.离心2100rpm/min×10分,弃上清液,加适量固定液配成细胞悬液,悬液浊度相当于麦氏管2-3个麦氏的浊度,配好待用。
(6)染色体标本制片:
1)滴片:
a.取出在4℃冰水中预冷的清洁玻片,对玻片进行标识,每标记完一块滴片板上的玻片,就回顾一下是否编号准确,每块滴片板上只能放置12张玻片,检查板上玻片的实验号和玻片放置的顺序。
b.用吸管吸取细胞悬液在5-10cm的高度滴于预冷的清洁玻片上,玻片的头体尾各一滴。每张片子放在酒精灯外延火焰出进行过火,过程中左右移动手中玻片,使玻片从头到尾得到充分过火,一般来回走动6-8下,时间控制在10-15秒,置于75℃的烤箱中烘烤3小时。
2)染片:
A将3个分别标示胰酶、生理盐水、染液的染缸先置于37℃水浴箱中预热20分钟。
B试剂准备
a.0.025%胰酶配制,取0.5%的胰酶一管2ml,加入50ml的PBS缓冲液中,充分混匀后,置于水浴箱里标示胰酶的染缸中待用。
b.生理盐水准备,取生理盐水70-100ml置于水浴箱里标示生理盐水的染缸中待用。
c.姬姆萨染液配制,取5-7ml姬姆萨母液,加入35ml的PBS缓冲液中,充分混匀后,置于水浴箱里标示染液的染缸中待用。
C胰酶消化及染色:
a.将玻片放入标示胰酶的染缸中消化15-25s,然后用生理盐水漂洗,立刻放入姬姆萨染液中染色2-2.5分钟。
b.用流水冲洗、风干或电吹风吹干。
(7)扫片:
每批标本显带、染色完成后,镜下观察显带和染色效果,结果见图1和图2。由图可以看出,染色体的长度较长,形态清晰,带纹清晰可辨,分散度较好。
对比例1:骨髓染色体G带的制作
(1)准备培养基:将RPMI1640培养基从冷冻冰箱取出,放37℃水浴箱温育,备用。
(2)接种:每5ml骨髓细胞培养基内骨髓血的接种量为2.5ml。
(3)培养:在37℃的培养箱内进行培养3天。
(4)终止培养:收获前每瓶(含5ml骨髓瘤细胞培养基)加入0.1ml 20μg/ml秋水仙素,再放入37℃温箱,终止细胞分裂,使其停留在细胞中期,1小时后收获。
(5)收取骨髓细胞培养物:
A.离心:2100rpm/min,10分,弃上清液;
B.低渗:加入预温至37℃的0.075M KCL低渗液8ml左右,轻轻混匀,置37℃35-45分;
C.预固定:加入1-2ml固定液轻轻混匀,2100rpm/min×10分。(可提前将一天所需固定液配好,放-20℃冰箱中预冷);
D.第一次固定:离心后弃上清液,加入固定液约8ml,-20℃冰箱固定至少45分钟或4℃冰箱放置过夜。
E.第二次固定:2100rpm/min×10分,离心后弃上清液,在其中一管加入固定液约8ml,混匀,此步骤时两管合成一管;
F.离心2100rpm/min×10分,弃上清液,加适量固定液配成细胞悬液,悬液浊度相当于麦氏管4个麦氏的浊度,配好待用。
(6)染色体标本制片:
1)滴片:
a.取出在4℃冰水中预冷的清洁玻片,对玻片进行标识,每标记完一块滴片板上的玻片,就回顾一下是否编号准确,每块滴片板上只能放置12张玻片,检查板上玻片的实验号和玻片放置的顺序。
b.用吸管吸取细胞悬液在30cm的高度滴于预冷的清洁玻片上,玻片的头体尾各一滴。每张片子置于75℃的烤箱中烘烤3小时。
2)染片:操作同实施例1。
(7)扫片:
每批标本显带、染色完成后,镜下观察显带和染色效果,结果见图3和图4。由图可以看出,染色体短小,边缘毛糙,分散度较差,带纹较模糊。
由实施例1和对比例1可以看出,骨髓细胞的接种量、培养时间、用于滴片的骨髓细胞麦氏浊度以及滴片后的过火操作,会直接影响制备的骨髓染色体标本的质量。利用本发明的方法(实施例1),能增加骨髓染色体分裂相数目,染色体长度增加,形态更加良好,带纹更加清晰可辨,制取的G带稳定性更好,能更好的检出异常染色体(检出率达95%以上),诊断结果更加可靠。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!