一种含抗CD45单抗的组合物及其使用方法与流程
本发明属分子生物学领域,涉及基于两种及两种以上高亲和力抗cd45兔单抗用于富集和鉴定循环肿瘤细胞的方法及其应用。
背景技术:
循环肿瘤细胞(circulatingtumorcells,ctcs)是指在肿瘤生长过程中从肿瘤原发灶脱落并进入外周血循环系统的实体瘤上皮细胞。ctcs作为原发灶和转移灶的链接会通过血液循环系统依附到远端组织上生长形成新的肿瘤组织,即转移灶。大量临床数据表明肿瘤转移是直接导致肿瘤患者死亡的直接原因,因而ctcs数目检测能实现对肿瘤发展的实时监测,对ctcs数目的实时监测不仅能判断机体免疫力的状态还对辅助诊断疾病、预后、指导临床治疗、治疗效果评估、耐药性和转移复发等有着很重要的临床研究价值。现有数据表明,ctcs早在肿瘤初期就可以在外周血中被检测到,而研究发现在肿瘤早期就被发现的癌症患者治愈率可高达90%,越晚期的肿瘤患者的生存率则越低。另外世界卫生组织也指出,癌症的预防治疗应秉持早发现、早诊断、早治疗的原则,因此ctcs数目检测对肿瘤的早筛也具有很重要的临床价值意义。
但如何从外周血中有效、准确的分离出ctcs是非常关键的,同时也是非常复杂的,因为血液中存在着大量的血液细胞,其中红细胞含量约为5x1012个/l、白细胞含量约为9x109个/l、血小板含量约为3x1011个/l。在如此多的血液细胞中,ctcs的含量及其稀少,肿瘤患者血液中每106~107(一百万~一千万)个白细胞中才会发现一个ctc。
随着检测技术的不断进步,捕获ctcs的方法有很多,主要分为以下三大类:利用ctcs与血液细胞的体积大小差异进行过滤捕获,利用ctcs表面标记物直接进行捕获,和利用针对血液中的各种细胞抗体磁珠的组合进行捕获。
利用ctcs与血液细胞体积大小差异进行过滤捕获的方法的基本原理来自于ctcs与肿瘤细胞的大小相似这一假设。此方法利用细胞筛过滤掉体积较小的白细胞从而留下体积较大的ctcs从而达到捕获ctcs的目的。此方法优点在于可以方便并迅速地将ctcs与血细胞分离开,但是越来越多的研究发现,有部分ctcs与白细胞大小类似,甚至小于白细胞,这是因为肿瘤细胞在上皮细胞间质转型(epithelial-mesenchymaltransition,emt)转化过程中由于细胞骨架的重建从而导致了ctcs的体积变小。小细胞ctcs在临床上的意义也得到了越来越多的关注,因此过滤捕获的方法会导致大量的小细胞ctcs丢失。另外,因为捕获到的ctcs是在滤膜上面,对于后期的ctcs培养和下游的技术研究也会造成很大的困难。
利用ctcs表面标记物直接进行捕获的方法又称正相富集,此方法是目前应用最为广泛的正相富集方法,最典型的代表就是cellsearch系统。因ctcs属于非血源性上皮细胞,部分ctcs会表达上皮细胞的特有蛋白——上皮细胞粘附分子(epithelialcelladhesionmolecule,epcam),所以此方法主要利用上皮细胞的表面标记物epcam抗体并偶联在载体上,如磁珠,从而直接从血液样本中捕获epcam阳性的ctcs。然而研究数据表明,不是所有实体肿瘤都会有epcam阳性表达,如epcam在膀胱癌和恶行黑色素肿瘤细胞上就表现为低表达或阴性。而且通常认为,肿瘤在前转移阶段,原发肿瘤组织中的肿瘤细胞失去其本具有的极性上皮细胞特性(粘附性强、片状结构),转化为具有迁移侵袭能力的间质细胞特性(无细胞极性、失去细胞与细胞之间的紧密连接)。这些肿瘤细胞在emt转化过程中,发生了明显的细胞骨架重建,改变多种与emt相关的转录因子、细胞表面受体的表达。因而使用epcam的直接捕获方法特异性不高,不能有效捕获多种肿瘤的ctcs,捕获效率和回收率较低。另外,细胞表面的epcam蛋白抗原是极为活跃的信号传导诱发因子,所以使用epcam抗体偶联磁珠来捕获ctcs很有可能会触发和激活一系列的细胞内信号传导通路的发生。因此,使用此方法捕获到的ctcs很大一部分程度上可能已经不是自然状态下的ctcs并且捕获的ctcs细胞活性较低,无法进行后期的细胞培养,同时也不利于进行细胞分离,用于下游技术的研究。
利用针对血液中各种细胞抗体磁珠组合进行负向富集的方法先根据细胞的不同密度,利用密度梯度离心来分选多种细胞从而有效地分离去除红细胞和血浆,再利用多种针对白细胞的抗体组合偶联磁珠抓取白细胞从而富集出ctcs。se-ifish(赛特生物;美国专利号us8,969,021)所使用subtractionenrichment就是这样一种方法。这种从血液中一个个剔除血源性细胞从而留下ctcs的方法被称为负向富集方法。此方法对ctcs的细胞损伤极小,所用的抗体为针对血源性细胞,因此不会触发细胞内的信号通路机制。使用密度梯度离心替代红细胞裂解液来剔除红细胞,极大的减少了对ctcs的损伤,很好的保留了ctcs细胞的特性和特征。虽然此方法具有很高的灵敏度,能有效的分离出自然状态下的ctcs,但是残余的白细胞数量过多。se-ifish(赛特生物)的方法是在用密度梯度离心去除红细胞和血浆后,加入偶联了各种白细胞亚类抗体的免疫磁珠孵育来结合白细胞,并通过磁力来起到去除白细胞的效果。但使用这种方法来去除白细胞最后的白细胞剩余量通常仍高达5x103-1.5x104个/ml。另外,鉴定ctcs的一个主要标准为八号染色体多倍体,而白细胞中的巨噬细胞也为八号染色体多倍体,在如此高的白细胞残余量中很可能会有多倍体巨噬细胞的存在,这样就会容易导致假阳性的ctcs出现;而过多的白细胞残余,在显微镜自动化扫描过滤有cd45阳性表达的白细胞的时候,如果在白细胞团聚处有ctc,容易被扫描系统自动判定成假阴性从而过滤掉此细胞。另外,残余的白细胞数量过高会给下游的ctcs细胞测序和ctcs培养等操作带来较大的困难和背景过高的影响。
mindec方法是另一种负向富集方法。与se-ifish(赛特生物)的方法相比,采用mindec的方法最终所残余的白细胞数量明显更少。此方法首先利用密度梯度离心来剔除红细胞和血浆,之后也是利用针对不同白细胞亚类的抗体组合来抓取白细胞从而富集ctcs。与se-ifish(赛特生物)方法不同的是,此方法先用生物素标记过的抗体加入去除掉红细胞和血浆之后的单核细胞悬液中进行孵育,之后再加入用链霉亲和素标记的磁珠让其与抗体结合。mindec方法的磁珠去除次数相比se-ifish(赛特生物)的方法要多,起到了更好的去除磁珠和白细胞的效果,并且同时避免了ctcs被磁珠包裹去除的风险,增加了ctcs的回收率。应用mindec方法白细胞去除效率更高,最后的白细胞残余细胞数量在437±350个/ml,有效的降低了检测结果的假阳性和假阴性出现的可能性。然而因为使用不同针对白细胞亚类的抗体组合,所需要用到的抗体量较多,成本也会较高。mindec所使用的抗体为鼠单克隆抗体,从鼠类身上提取的抗体对人类的白细胞亲和力不高,因此在mindec方法中鼠单抗的需求量很大。
此外,在ctc鉴定过程中,我们发现有部分染色体正常,但不表达cd45的疑似细胞存在,可能的原因是这类白细胞表面的cd45分子没有与使用的cd45抗体结合。因此需要更好的ctc鉴定抗体组合及其方法。
技术实现要素:
本发明第一方面提供一种含有抗体的组合物,所述抗体包括两种或两种以上抗cd45兔单抗。
在一个或多个实施方案中,所述两种或两种以上抗cd45单抗所识别cd45抗原分子上的抗原决定簇各不相同。
在一个或多个实施方案中,所述抗cd45单抗为兔抗人单克隆抗体。
在一个或多个实施方案中,所述抗cd45单抗的亲和力系数≤1.0×10-10m。
在一个或多个实施方案中,所述抗cd45单抗中至少一个单抗的亲和力≤4.0×10-11m。
在一个或多个实施方案中,所述抗体结合了亲和标记;所述亲和标记优选为生物素。
在一个或多个实施方案中,所述组合物的抗cd45单抗中,最高亲和力抗cd45兔单抗的含量与所有其它抗cd45兔单抗的总含量之间的质量比为1-10:1;优选为5:1。
在一个或多个实施方案中,所述含有抗体的组合物与抗cd16单抗、抗cd19单抗和抗cd235a单抗一起使用,用于循环肿瘤细胞的富集。
在一个或多个实施方案中,所述含有抗体的组合物含有抗cd16单抗、抗cd19单抗、抗cd235a单抗和两种或两种以上抗cd45单抗,其中,所述两种或两种以上抗cd45单抗所识别cd45抗原分子上的抗原决定簇各不相同;优选地,所述单抗均偶联有亲和标记;优选地,所述亲和标记为生物素分子。
在一个或多个实施方案中,所述两种或两种以上抗cd45单抗的亲和力系数均低于1.0×10-10m;优选地,所述两种或两种以上抗cd45单抗中的至少一种的亲和力系数低于4.0×10-11m。
在一个或多个实施方案中,组合物中的单抗的物种来源为相同的或不同的物种来源;优选地,所述两种或两种以上抗cd45单抗中的一种的物种来源为兔源,其它抗cd45单抗的物种来源为鼠源;更优选地,所述两种或两种以上抗cd45单抗的物种来源均为兔源。
在一个或多个实施方案中,所述抗cd16单抗、抗cd19单抗和抗cd235a单抗各自独立为兔抗人单克隆抗体或鼠抗人单克隆抗体。
在一个或多个实施方案中,所述两种或两种以上抗cd45单抗均为兔抗人cd45单克隆抗体,所述抗cd16单抗为鼠抗人cd16单克隆抗体、所述抗cd19单抗为鼠抗人cd19单克隆抗体和所述抗cd235a单抗为鼠抗人cd235a单克隆抗体。
在一个或多个实施方案中,所述组合物中所述两种或两种以上抗cd45单抗、抗cd16单抗、抗cd19单抗和抗cd235a单抗之间的质量比为1:1~5:1~5:1~5;优选为1:2~4:2~4:2~4;更优选为1:3:3:3。
另一方面,本发明提供一种试剂盒,所述试剂盒含有本文所述的含抗体的组合物。
在一个或多个实施方案中,所述试剂盒还含有磁珠,所述磁珠偶联了能够与前述实施方案中所述亲和标记相结合的配体;优选地,所述配体为链霉亲和素。
在一个或多个实施方案中,试剂盒中,所述含抗体的组合物和磁珠分别置于不同的容器中。
再一方面,本发明提供抗两种或两种以上的cd45单抗组合与抗cd16单抗、抗cd19单抗和抗cd235a单抗一起在分离血液中的白细胞或在富集外周血循环肿瘤细胞中的应用,或在制备用于分离血液中的白细胞或用于富集外周血循环肿瘤细胞的试剂或试剂盒中的应用。
在一个或多个实施方案中,所述两种或两种以上的抗cd45单抗组合包括靶向cd45分子不同的抗原决定簇的两种以上抗cd45单抗,其中所有的抗cd45单抗均为兔源。
在一个或多个实施方案中,所述抗cd45单抗组合物包括靶向cd45分子不同的抗原决定簇的两种以上抗cd45单抗,其中的一种抗cd45单抗为兔源,其他的为鼠源。
在一个或多个实施方案中,所述抗cd45单抗组合物中最高亲和力的抗cd45兔单抗的质量与其他抗cd45兔单抗质量之和的比例为1-10:1;优选为5:1。
再一方面,本发明还提供一种分离血液中白细胞的方法,所述方法包括使血液与本文所述的组合物接触的步骤。
在一个或多个实施方案中,所述血液是除去了红细胞和血浆的血液。
再一方面,本发明提供一种富集循环肿瘤细胞的方法,所述方法包括:
(1)离心,除去血浆;
(2)离心,除去红细胞;
(3)洗涤步骤(2)获得的液体;
(4)在步骤(3)获得的液体中加入本文所述的含抗体的组合物,孵育,离心清洗;
(5)在步骤(4)获得的细胞中加入偶联了链霉亲和素的磁珠,孵育;和
(6)孵育结束后,除去磁珠,从而富集循环肿瘤细胞。
在一个或多个实施方案中,所述步骤(4)包括,将步骤(3)获得的液体与所述含抗体的组合物混合,孵育10~30分钟后,离心清洗。
在一个或多个实施方案中,所述步骤(5)包括,加入链霉亲和素偶联的磁珠,孵育10~20分钟。
在一个或多个实施方案中,所述步骤(6)包括,孵育结束后,将含所述液体和磁珠的容器置于磁力架上,静置,使磁珠吸附在磁铁上,吸取未含有磁珠部分的液体。
附图说明
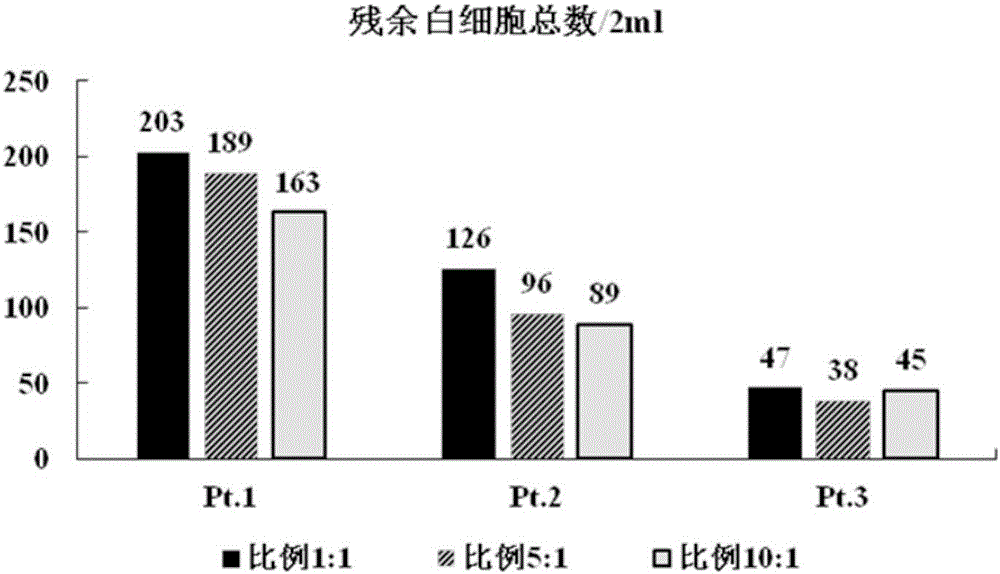
图1:使用质量比为1:1、5:1、10:1的高亲和力和低亲和力cd45抗体处理后的残余白细胞总数。
图2:使用质量比为1:1、5:1、10:1的高亲和力和低亲和力cd45抗体处理后的ctcs检出总数。
图3:本发明方法与对照方法的ctcs检出率。
图4:本发明方法与对照方法的残余白细胞总数。
图5:本发明方法与对照方法的ctcs鉴定过程中疑似细胞总数。
图1-5中的pt.1(patient1)表示患者1,依次类推。
具体实施方式
应理解,在本发明范围中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成优选的技术方案。
本发明旨在解决现有循环肿瘤细胞分离方法存在的因白细胞残余量过多而导致的循环肿瘤细胞回收率不高、白细胞鉴定不完全以及不能准确获得有活性的循环肿瘤细胞的问题。
为了高效的去除各种不同类型的白细胞,本发明提供了一种含抗体的组合物(也称为“抗体组合物”),该含抗体组合物中的抗体包括两种及两种以上抗cd45单抗,与抗cd16单抗、抗cd19单抗和抗cd235a单抗共同用于ctcs的富集和鉴定。
适用于本文的抗cd45单抗、抗cd16单抗、抗cd19单抗和抗cd235a单抗可以是本领域周知的各种抗cd45单抗、抗cd16单抗、抗cd19单抗和抗cd235a单抗。例如,可使用市售的抗cd45单抗、抗cd16单抗、抗cd19单抗和抗cd235a单抗来实施本发明,如可从abcam、赛默飞世尔购得这类单抗。或者,也可采用本领域公知技术,如杂交瘤技术,自行制备这些单抗。
在优选的实施方案中,该含抗体的组合物中,两种或两种以上抗cd45单抗是兔抗人cd45单抗。优选的是,所述两种或两种以上抗cd45单抗的亲和力系数≤1.0×10-10m。更优选地,所述两种或两种以上抗cd45单抗中至少有一种的亲和力系数≤4.0×10-11m,优选≤2.0×10-11m,更优选≤1.0×10-11m。优选地,所述两种或两种以上抗cd45单抗的亲和力系数都≤3.0×10-11m。
在某些实施方案中,所述两种或两种以上抗cd45单抗所识别的cd45抗原分子上的抗原决定簇各不相同。优选地,所述两种或两种以上抗cd45单抗是亲和力不同的兔抗人cd45单抗,优选它们的亲和力系数都≤4.0×10-11m。
组合物中,亲和力最高的抗cd45单抗的质量与其它抗cd45单抗的质量之和之比可在1~10:1的范围内,优选在3~7:1的范围内。在某些实施方案中,该比例为5:1。本文中,抗体的用量可以微克计。
本文中,抗cd16单抗、抗cd19单抗和抗cd235a单抗可以是兔抗人单抗,也可以是鼠抗人单抗。优选的是,适用于本文的兔抗人单抗的亲和力系数≤4.0×10-11m,优选≤2.0×10-11m,更优选≤1.0×10-11m。
在某些实施方案中,本文所述的含抗体的组合物中,抗体可以是两种或两种以上兔抗人cd45单抗,鼠抗人cd16单抗,鼠抗人cd19单抗和鼠抗人cd235a单抗。
组合物中两种或两种以上抗cd45单抗、抗cd16单抗、抗cd19单抗和抗cd235a单抗的质量比可以在1:1~5:1~5:1~5的范围内,优选在1:2~4:2~4:2~4的范围内。在某些实施方案中,两种或两种以上抗cd45单抗、抗cd16单抗、抗cd19单抗和抗cd235a单抗的质量比为1:3:3:3。
在某些实施方案中,本文所述的含抗体的组合物中,抗体是两种或两种以上兔抗人cd45单抗,鼠抗人cd16单抗、鼠抗人cd19单抗和鼠抗人cd235a单抗,其质量比在1:1~5:1~5:1~5的范围内,优选在1:2~4:2~4:2~4的范围内,更优选为1:3:3:3。
通常,组合物中抗体偶联有生物素,以使其可与磁珠上偶联的链霉亲和素结合。
组合物中可含有合适的溶剂,包括但不限于pbs、edta和bsa。
本文还提供一种试剂盒,该试剂盒含有本文所述的组合物。在某些实施方案中,试剂盒中还可含有磁珠。通常,组合物和磁珠分装在不同的容器中。磁珠可以是本领域已知的各种用于细胞分离的磁珠,包括具有任何合适大小和材质的磁珠。通常,磁珠上偶联有链霉亲和素或其它合适的分子,以与偶联了生物素或相应分子的抗体结合,从而将被抗体分子俘获的白细胞分离出来。
如前文所述,本文的抗体组合物可用于分离血液中的白细胞或富集循环肿瘤细胞。因此,本文提供一种分离血液中的白细胞的方法,包括使本文所述的抗体组合物与该血液接触的步骤。可按本领域常规的技术手段进行所述接触,然后加入偶联了相应结合分子的磁珠,将被抗体分子俘获的白细胞吸附到磁珠上,并通过分离出这类磁珠而从血液中分离出白细胞。本文中,除非另有说明,否则血液通常指人的外周血。在分离血液中的白细胞之前,可先采用本领域常规的技术手段除去血液中的血浆和红细胞。例如,可通过常规的离心而除去血浆,可采用密度梯度离心除去红细胞。
在某些方面,本文提供一种富集循环肿瘤细胞的方法,所述方法包括:
(1)离心,除去血浆;
(2)采用密度梯度离心除去红细胞;
(3)洗涤步骤(2)获得的液体;
(4)在步骤(3)获得的液体中加入本文所述的含抗体的组合物,孵育,离心清洗;
(5)在步骤(4)获得的细胞沉淀物中加入偶联了链霉亲和素的磁珠,孵育;和
(6)孵育结束后,除去磁珠,从而富集循环肿瘤细胞。
除去血清时,可将血液混匀后离心,洗去上清即血浆。可将除去血浆后获得的沉淀与清洗缓冲液和密度梯度分离液混合,进行密度梯度离心。离心后混合物通常分层三层,红色沉淀层为红细胞,中间为白膜层。通常,先去除中间的白膜层,然后吸取余下的液体。对该液体进行洗涤数次,离心以除去溶液中的蛋白和血小板等杂质。这些步骤可采用本领域常规的技术完成。例如,对于离心的时间、转速等,均可采取常规的条件实施。例如,除去血浆的离心条件可以是150~300g,10~20分钟;除去红细胞的离心条件可以是300~500g,20~30分钟;除去蛋白和血小板等杂质的离心条件可以是500~700g,3~8分钟。
之后加入本文抗体组合物,孵育一段时间后再加入偶联了相应分子的磁珠,再孵育一段时间,利用磁力分离出结合了白细胞的磁珠,从而实现循环肿瘤细胞的富集。抗体组合物的加入量以及磁珠的加入量可根据实际情况加以确定。
本文中,与抗体组合物混合后的孵育时间通常在10~30分钟的范围内,孵育温度可在2~8℃的范围内。孵育结束后,可加入分离清洗液,混匀后离心,以除去未结合血细胞的抗体。可在200~400g的条件下离心5~15分钟。与磁珠的孵育时间通常在10~20分钟的范围内,孵育温度通常在2~8℃。孵育结束后,可加入分离清洗液重悬磁珠结合的细胞,用枪头轻轻吹打混匀,然后放置在磁力架上进行磁力分离,吸取上清。可在2~8℃对上清进行离心处理,离心条件可为200~400g,5~15分钟。应理解的是,在分离白细胞的整个过程中,通常在2~8℃的温度条件下进行。
本发明的有益效果在于:本发明基于两种及两种以上高亲和力抗cd45单抗(对人类白细胞的亲和力比常用的鼠单抗要高很多,最高达到3.6×10-11m),当与单细胞悬液进行孵育时,能够更加有效地结合在白细胞上,因此本发明的方法所需的抗cd45单抗相比mindec的鼠单抗用量至少能减少一半。此后再结合磁珠能够更加有效地去除掉悬液中的白细胞,同等抗体用量下,本发明方法能把最后的白细胞残余数量控制在200±50个/6.0ml,进一步增加了ctcs的回收率,降低疑似细胞的出现,降低ctcs鉴定的难度。
本发明的方法与传统循环肿瘤细胞阴性富集方法相比较,因抗体组合的高亲和力,能更好的标记各种白细胞亚类,从而能够更好的去除白细胞,更高效地富集ctcs,同时不会损伤ctc细胞,使得ctc细胞维持良好的自然状态和细胞形态,可对后续的单(多)个循环肿瘤细胞进行基因组、转录组和蛋白组分析或对富集后的循环肿瘤细胞进行培养。本发明的循环肿瘤细胞的回收率高达95%以上;本发明还具有高灵敏度的优点,可以在血量极少的样品中稳定检出循环肿瘤细胞。
因此,本文也提供本文所述的两种或两种以上的高亲和力抗cd45单抗的组合在与抗cd16单抗、抗cd19单抗和抗cd235a单抗一同分离血液中的白细胞或在富集外周血循环肿瘤细胞中的应用,或在制备用于分离血液中的白细胞或用于富集外周血循环肿瘤细胞的试剂或试剂盒中的应用。
下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并非限制本发明的范围。实施例中所用到的方法和材料,除非另有说明,否则为本领域常规的方法和材料。
本发明涉及的缩略语和关键术语定义:
ctcs:循环肿瘤细胞;
cd45:白细胞表面共同抗原;
dapi:4',6-二脒基-2-苯基吲哚;
cd16:nk细胞和中性粒细胞抗原;
cd19:b细胞抗原;
cd235a:血型糖蛋白a。
实施例
材料与方法
兔抗人cd45单抗:abcam(高、低亲和力:3.6x10-11m、1.0x10-10m);
鼠抗人cd45单抗:赛默飞世尔;
鼠抗人cd16单抗:赛默飞世尔;
鼠抗人cd19单抗:赛默飞世尔;
鼠抗人cd235a单抗:赛默飞世尔;
磁珠:dynabeadsmyone1μm,链霉亲和素包被,赛默飞世尔。
实施例中涉及到的试剂为:
dapi:4',6-二脒基-2-苯基吲哚;
细胞清洗液:pbs+2mmedta+0.5%bsa;
分离清洗液:pbs+2mmedta+0.1%bsa;
fcr阻断液:militenyibiotec公司;
2xssc/0.1%np-40:abbott公司。
按以下步骤分离ctcs并鉴定ctcs。
1、准备磁珠
步骤1:从标记好链霉亲和素的磁珠混合液中吸取相应分量的磁珠混合液到2mlep管中,并将该ep管放置在磁力架上静置3分钟,磁珠的配置量为100μl每1x107个细胞;
步骤2:待磁珠都吸附在磁力架后,使用真空泵吸弃磁珠保存液,加入至少1ml的分离清洗液缓慢吹打混匀,放置在磁力架上静置3分钟,使用真空泵吸弃清洗液;
步骤3:加入与最开始吸取的磁珠混合液等体积的分离清洗液,缓慢吹打混匀,静置在室温等待后续操作。
2、红细胞,血浆分离
步骤1:采集6.0ml外周血,将采血管轻柔头尾颠倒混匀并离心,离心条件为200g,15分钟;将离心结束后的上清(血浆)使用真空泵吸弃;
步骤2:加入与采血管中沉淀的血细胞等体积的细胞清洗液,轻柔头尾颠倒混匀;
步骤3:在标记好的15ml离心管a中加入3ml密度梯度分离液ficoll-pague(1.086g/ml);
步骤4:缓慢将上述血细胞混合液加叠至离心管a中分离液的上方,放入离心机内离心,离心条件为室温400g,20-30分钟;
步骤5:离心结束后,离心管中的液体分成三层,先吸取中间的白膜层后,再吸取红细胞沉淀上方的所有液体,并一同加入到50ml离心管b中;
步骤6:加入5倍于上述液体体积的细胞清洗液至离心管b中,离心清洗细胞,离心条件为室温600g,5分钟,弃上清至100μl,吹打混匀重悬细胞。
3、白细胞去除
步骤1:在上述步骤得到的100μl细胞悬液转移至新的15ml离心管c中,并加入生物素标记的高亲和力抗体混合液(兔抗人cd45单抗、鼠抗人cd16单抗、鼠抗人cd19单抗、鼠抗人cd235a单抗,抗体用量比例为1:3:3:3;添加量分别为1μl、3μl、3μl、3μl)至离心管c中;
步骤2:轻柔吹打混匀,4℃孵育20分钟,每10分钟混匀一次;
步骤3:孵育结束后,加入分离清洗液来去除掉未结合血细胞的抗体,头尾颠倒混匀数次,离心弃上清至100μl,离心条件为300g,10分钟(2℃-8℃);
步骤4:加入3ml分离清洗液吹打混匀重悬细胞;
步骤5:加入上述步骤配置好的磁珠悬液,持续一边摇晃离心管c一边滴加磁珠悬液,混匀并放置在混匀器上孵育15分钟(2℃-8℃);
步骤6:孵育结束后加入3ml分离清洗液到离心管c中;重悬磁珠结合的细胞,用枪头轻轻吹打混匀,切记勿产生气泡;然后放置在磁力架上静置3分钟;
步骤7:小心避开磁珠转移上清至新的15ml离心管d中;
步骤8:加入4ml分离清洗液至装有磁珠的离心管c中;轻柔吹打混匀,切记勿产生气泡,并放置在磁力架上静置3分钟;
步骤9:小心避开磁珠转移上清至15ml离心管d中;
步骤10:吹打混匀离心管d中的液体并放置离心管d在磁力架上静置3分钟;
步骤11:转移离心管d中的所有液体到标记好的15ml离心管e中;离心弃上清至50μl,离心条件为300g,10分钟(4℃)。
4、ctcs鉴定
步骤1:加入25μlfcr阻断液到实施例3步骤得到的50μl细胞悬液中,使用振荡混合仪轻柔振荡混匀沉淀细胞,室温静置10分钟;
步骤2:各加入1μl荧光抗体(cd45-af594,瘤标荧光抗体),室温避光孵育20分钟,每10分钟使用震荡混合仪轻柔混匀一次;
步骤3:补加细胞清洗液至14ml,配平,颠倒混匀,室温离心,离心条件为950g,4分钟,弃上清至100μl;
步骤4:加入100μl4%多聚甲醛于以上100μl细胞悬液中,并使用加样器枪头轻柔吹打混匀;
步骤5:将离心管e中的所有标本液体滴加涂于载玻片标本框内;
步骤6:将标本放置30-32℃干燥箱过夜,第二天关闭干燥箱温度后将标本继续静置于干燥箱中30分钟凉至室温,立即进行后续检测;
步骤7:加入200μl新鲜配置的固定液(甲醇:冰乙酸=3:1)于玻片上避免气泡,室温静置10分钟;
步骤8:沿标本框内侧边角轻柔滴加200μl1xpbs后,立即吸弃,共重复2次;
步骤9:沿标本框内侧边角轻柔滴加200μl1xpbs,静置2分钟,吸弃,共重复两次;
步骤10:沿标本框内侧边角轻柔滴加200μl无水乙醇后,立即吸弃,共重复2次;
步骤11:将玻片插入装有无水乙醇的染色缸中静置2分钟,取出玻片,竖立在滤纸上完全吸干玻片流下残留液,并使用微型吹风机将玻片轻柔吹至完全干燥后;
步骤12:以下操作均须避光,将载玻片吹干后立即滴加10μl八号染色体fish探针于标本框中央,后立即使用镊子将盖玻片盖放在探针液上,使液体向四周蔓延至整个标本框;如果需要,例如标本框内有气泡,需使用镊子轻压盖玻片以使探针液覆盖整个标本框并把气泡排出;
步骤13:封片:剪去1ml加样器尖头,每张玻片使用250μl封片胶封住盖玻片四边边缘后,直接放入杂交仪;
步骤14:杂交:变性76℃,10分钟;杂交37℃,4小时;
步骤15:杂交完毕,取出玻片;用手轻按盖玻片一角,使用镊子撕去封片胶,将玻片置于预热至室温的染色缸中,静置1分钟后轻柔晃动染色缸,直至盖玻片脱落。盖玻片脱落后,将玻片继续在缸中室温静置1分钟后取出,使用滤纸吸干玻片流下的残留液,并擦干标本框外围液体;
步骤16:沿标本框内侧边角轻柔滴加200μl2xssc/0.1%np-40后,立即吸弃溶液,共重复2次;
步骤17:沿标本框内侧边角轻柔滴加200μl2xssc/0.1%np-40,室温静置2分钟,吸弃溶液;
步骤18:取10μl荧光保存液滴加于标本框中央,置放盖玻片后,一手固定盖玻片防止其滑动,另一手用真空泵吸头或滤纸轻柔挤压并吸干溢出的多余液体,封干标本;
步骤19:立即在荧光扫描显微镜下观察或于4℃避光保存。为避免fish信号及抗体染色荧光减弱,标本应在一周内完成检测。在荧光显微镜上反复观察标本会使荧光淬灭。
实施例1
对3位患者血液分别分成3管,每管2ml,分别采用高亲和力、低亲和力两种cd45抗体质量比为1:1、5:1、10:1的量进行残余白细胞总数、ctc检出数目进行比较。
结果如图1所示。结果显示,高亲和力、低亲和力两种cd45抗体质量量比为1:1、5:1、10:1时,残余白细胞总数依次减少,说明去除白细胞的能力逐渐递增。
对每个样品的ctc的检出总数进行统计,结果如图2所示。结果显示质量比为5:1的效果优于1:1和10:1。可能的原因是,1:1的用量中高亲和力抗体的量太低,白细胞剩余太多,导致ctc细胞被漏检;而10:1的用量比例中,高亲和力抗体的量太高,使ctc细胞被白细胞团聚去除掉,导致漏检。
实施例2
对同一肿瘤患者采取两管等量外周血,重复三次实验操作,即共采取15位不同肿瘤患者的各两管外周血。分别按照对照(赛特生物;美国专利号:us8,969,021)所述的方法和本文“材料与方法”部分所述的方法进行ctc检测,对最终检出率进行评价。两种cd45抗体质量比为5:1。两种检测方法对ctc检出数量如图3所示。
对每个样本的总细胞数进行扫描计数,结果如图4所示。结果显示,本发明残留的血源性白细胞总数低于对照,表明本发明具有高效富集ctcs的能力。
对每个样品的疑似细胞总数进行统计和比较,结果如下图5所示。结果显示,本发明疑似细胞总数低于对照,表明本发明具有更高效鉴定ctcs的能力。
- 还没有人留言评论。精彩留言会获得点赞!