用于流动中的自动单细胞细胞学分类的系统和方法与流程
本申请一般涉及流动中的细胞的成像,更具体地涉及流动中的自动高通量(throughput)单细胞细胞学分类。
背景技术:
细胞的物理和形态特性长期以来被用于研究细胞类型和细胞状态以及诊断疾病。细胞形状是细胞周期的标志之一。真核细胞显示出会依赖于细胞周期的形状的物理变化,诸如经历出芽或裂变的酵母细胞。形状也是细胞状态的指示物,并且可以成为用于临床诊断的指示。由于许多临床条件、疾病和药物,血细胞形状可能会改变,诸如由寄生虫感染引起的红细胞形态的变化。其他参数如细胞膜特征、核-细胞质比、核膜形态和染色质结构也可用于识别细胞类型和疾病状态。例如,在血液中,不同的细胞类型通过诸如细胞大小和核形状之类的因素来进行区分。
生物学家和细胞病理学家通常使用细胞大小和形态来识别细胞类型和诊断疾病。这主要通过某种显微成像和图像的手动分析来完成。结果,现有方法耗时、主观、定性且容易出错。例如,细胞病理学家使用光学显微镜检查从不同组织制备的载玻片,并寻找类似于疾病特性的特征。这个过程是不及时的,结果是主观的,并受到染色细胞的取向、如何制备载玻片以及细胞病理学家的专业知识的影响。尽管最近已经进行了细胞学涂片分析自动化的努力,但仍然存在挑战。涂片分析的主要问题之一是存在难以避免的污染细胞,并且使得难以检测稀有细胞或疾病的特定特征特性。其他问题有染色或涂抹的细胞的角度,其可能模糊用于识别细胞类型或状态的重要信息。
技术实现要素:
示出了根据本发明各种实施例的用于流动中的自动单细胞细胞学分类的系统和方法。一个实施例包括细胞学分类系统,所述细胞学分类系统包括:成像系统;流动池,所述流动池包括:入口、出口和微流体通道,所述微流体通道包括成像区域,其中所述微流体通道经由所述入口接收流体并且具有通道壁,所述通道壁被形成为:将来自样品的细胞聚焦成单个流线,使单个流线内的细胞间隔开,以及使单个流线内的细胞旋转;和灌注系统,被配置为经由所述入口将样品注入流动池。
在另一实施例中,注入所述流动池的样品包括1×105个细胞/ml和5×105个细胞/ml范围内的细胞浓度。
在又一实施例中,注入所述流动池的样品包括来自如下的组的细胞,所述组包括固定细胞和用有色染料染色的细胞。
在又一实施例中,所述流动池被实现为微流体装置。
在又一实施例中,所述成像系统包括光源,所述光源被配置成照明所述微流体通道的成像区域。
在还有的实施例中,所述成像系统还包括物镜系统,所述物镜系统被配置为放大通过所述微流体通道的成像区域的细胞。
在还有的实施例中,所述成像系统还包括高速相机系统,所述高速相机系统被配置为以100,000和500,000帧/秒之间捕获图像。
在另一实施例中,所述微流体通道被形成为使得所述成像系统捕获所述微流体通道的成像区域内的旋转细胞的图像序列以提供所述细胞的完整360°视图。
在还有的实施例中,所述成像系统捕获所述微流体通道的成像区域内的细胞的至少10个图像。
在另一实施例中,所述成像系统以至少1000个细胞/秒捕获图像,并且计算系统以至少1000个细胞/秒进行分类。
在还有的实施例中,所述微流体通道还包括过滤区域。
在还有的实施例中,所述通道壁的子部分包括聚焦区域,所述聚焦区域被形成为使用惯性升力将细胞从样品聚焦成细胞的单个流线中。
在还有的实施例中,所述惯性升力作用于处于发生层流的雷诺数的细胞。
在还有的实施例中,所述聚焦区域包括收缩和扩展部分。
在还有的实施例中,所述收缩和扩展部分具有不对称的周期性结构。
在还有的实施例中,所述通道壁的子部分包括排序区域,所述排序区域被形成为使用惯性升力和对所述细胞施加拖曳力的二次流使单个流线内的细胞间隔开。
在还有的实施例中,所述排序区域形成至少一个夹持区域。
在还有的实施例中,所述排序区域形成一系列弯曲通道和夹持区域。
在还有的实施例中,所述通道壁的子部分包括细胞旋转区域,所述细胞旋转区域被形成为通过向细胞的单个流线内的细胞施加速度梯度来使细胞旋转。
在还有的实施例中,所述细胞旋转区域使用共流向细胞施加速度梯度。
在还有的实施例中,所述细胞旋转区域通过增加所述通道的至少一个维度来向细胞施加速度梯度。
在另一附加实施例中,细胞学分类系统,包括:双层流动池,包括:入口;出口;和微流体通道,包括:聚焦区域,用于将来自样品的细胞聚焦成单个流线;排序区域,用于使单个流线内的细胞间隔开;细胞旋转区域,用于使单个流线内的细胞旋转;以及成像区域,提供旋转细胞的视野;灌注系统,配置为经由所述入口将样品注入到所述流动池中;成像系统,包括:相机,被配置为收集成像区域的图像;光源,用于照明成像区域;以及物镜系统,被配置为提供成像区域的放大;以及计算系统,被配置为从成像系统接收图像并分析所接收的图像。
另外的实施例和特征部分地在下面的描述中阐述,并且部分地对于本领域技术人员在阅读说明书后将变得清楚,或者可以通过本发明的实践来学习。
通过参考说明书的其余部分和附图可以实现对本发明的本质和优点的进一步理解,附图形成本公开的一部分。
附图说明
参考以下附图和数据图将更全面地理解描述和权利要求,这些附图和数据图被呈现为本发明的示例性实施例,并且不应被解释为本发明的范围的完整记载。
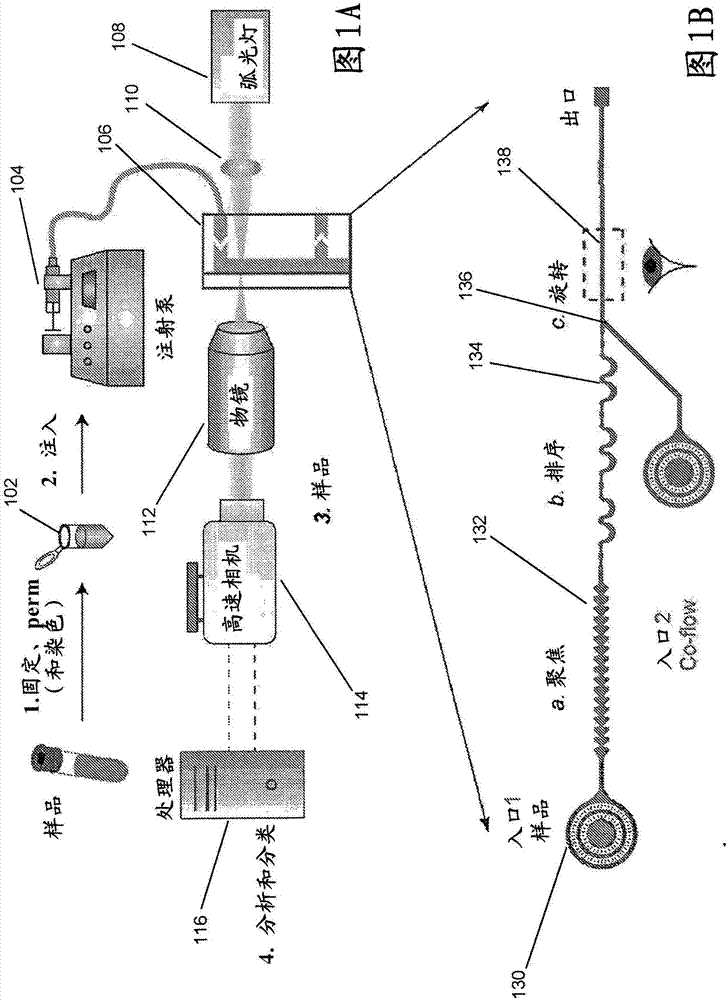
图1a概念性地示出了根据本发明实施例的细胞学分类系统。
图1b概念性地示出了根据本发明实施例的流动池的微流体设计。
图2概念性地示出了根据本发明实施例的流动池的过滤区域。
图3a概念性地示出了根据本发明实施例的流动池的聚焦区域。
图3b-图3d概念性地示出了根据本发明实施例的流动池的聚焦区域的上游部分、收缩和扩展部分以及下游部分。
图4a概念性地示出了根据本发明实施例的流动池的排序区域。
图4b概念性地示出了根据本发明实施例的流动池的排序区域的通道截面内的流体动力学。
图5a和图5b概念性地示出了根据本发明实施例的利用共流的流动池的细胞旋转区域。
图5c概念性地示出了根据本发明实施例的利用通道尺寸变化的流动池的细胞旋转区域。
图5d是根据本发明实施例的流动池的细胞旋转区域中的旋转颗粒的视频的叠加图像。
具体实施方式
根据本发明各种实施例的系统和方法能够基于细胞形态学特性对细胞样品进行快速分析和分类。在若干实施例中,悬浮在流体介质中的细胞通过微流体通道,在微流体通道中细胞聚焦成单个流线并被连续成像。在许多实施例中,微流体通道建立流动,流动使得各个细胞能够在短时间内以多个角度成像。图案识别系统可以分析从流经该系统的细胞的高速图像捕获的数据并对目标细胞进行分类。通过这种方式,自动平台为广泛的研究和临床应用(诸如(但不限于)护理点服务)创造了新的可能性。
根据本发明多个实施例的系统和方法利用小型化流体装置中的惯性升力来定位流动中的细胞并将细胞传送到单个横向位置。然后可以对细胞进行排序以防止在成像期间多个细胞到达单个帧中。以这种方式,可以避免对图像分割的需要。在许多实施例中,使细胞在成像时旋转,从而以多个角度捕获各个细胞的图像。
在许多实施例中,细胞学分类系统可以在细胞通过微流体系统时检测和跟踪细胞,以不同角度捕获每个细胞的多个图像。在若干实施例中,该系统可以容易地与其他小型化平台集成以使染色自动化并完全消除手动样品制备。在某些实施例中,细胞学分类系统允许通过将细胞彼此以所需距离排序来单独对细胞进行分类。当以这种方式对细胞进行成像时,细胞学分类系统可以从成像细胞的不同角度的图像重建三维图像。此外,可以基于成像细胞的特性进行分析,成像细胞的特性包括(但不限于)细胞质和核膜的形态。
下面进一步讨论根据本发明各种实施例的用于在流动中执行细胞学分类的细胞学分类系统和方法。
细胞学分类系统
图1a中示出了根据本发明实施例的细胞学分类系统,图1b中进一步详细示出了微流体设计。在操作中,制备样品102并通过注射泵104将其注射到流动池106或流通装置中。在许多实施例中,流动池106是微流体装置。虽然图1a示出了利用注射泵的细胞学分类系统,但是可以使用多种灌注系统中的任何一种,诸如(但不限于)重力供给、蠕动或多种压力系统中的任何一种。在许多实施例中,通过固定和染色来制备样品。可以容易地理解,制备样品的具体方式很大程度上取决于具体应用的要求。
在若干实施例中,以1×105-5×105个细胞/ml的浓度范围制备细胞悬浮液样品。在给定的细胞学分类系统中使用的具体浓度通常取决于系统的能力。可以固定细胞并用有色染料进行染色(例如,papanicolaou和wrightgiemsa方法)。根据本发明各种实施例的细胞学分类系统可以对活的、固定的和/或wrightgiemsa染色的细胞进行操作。染色可以帮助增加核细胞器的对比度并提高分类准确性。在制备之后,可以使用导管(诸如(但不限于)管道)和灌注系统(诸如(但不限于)注射泵)将细胞悬浮液样品注射到微流体装置中。在许多实施例中,注射泵以~100pl/min注射样品。可以容易地理解,可以使用适合于给定细胞学分类系统的任何灌注系统,诸如(但不限于)蠕动系统和重力供给。
如上所述,流动池106可以被实现为流体装置,其将来自样品的细胞聚焦成连续成像的单个流线。在所示实施例中,细胞线由光源108和光学系统110照明,光学系统110将光引导到流动池106的成像区域138上。物镜系统112通过将光导向高速相机系统114的传感器来放大细胞。在某些实施例中,使用40x、60x或100x物镜来放大细胞。如本领域普通技术人员可以容易地理解的,所使用的具体放大率可以变化很大并且很大程度上取决于给定成像系统和感兴趣的细胞类型的要求。
在许多实施例中,使用高速相机以100,000至500,000帧/秒的速率记录来自细胞的图像序列,所述高速相机可以是彩色的、单色的和/或使用各种成像模式中的任何一种进行成像的,所述各种成像模式包括(但不限于)近红外光谱。在所示实施例中,用曝光时间<1μs的高功率led照明成像区域,以帮助防止细胞的运动模糊。可以容易地理解,曝光时间可以在不同系统之间不同,并且可以在很大程度上取决于给定应用的要求或给定系统的限制,诸如但不限于流速。获取图像并且可以使用图像分析算法来分析图像。在许多实施例中,在捕获后获取并分析图像。在其他实施例中,连续地实时采集和分析图像。使用对象跟踪软件,可以在相机的视野中检测和跟踪单个细胞。然后可以执行背景减法。在许多实施例中,流动池106使得细胞在成像时旋转,并且每个细胞的多个图像被提供给计算系统116以用于分析。可以确定流速和通道尺寸以获得同一细胞的多个图像和细胞的完整360°视图(例如,其中细胞在连续帧之间旋转90°的4个图像)。可以通过叠加单个细胞的多个图像来生成细胞的二维“全息图”。可以分析“全息图”以基于包括(但不限于)细胞的形态特征在内的特征对细胞的特性进行自动分类。在许多实施例中,为每个细胞捕获10个或更多个图像。可以容易地理解,捕获的图像的数量取决于给定应用的要求。
在若干实施例中,流动池具有不同的区域以聚焦、排序和旋转细胞。虽然聚焦区域、排序区域和细胞旋转区域被讨论为以特定顺序影响样本,但是本领域普通技术人员将理解,可以不同地布置各种区域,其中可以以任何顺序执行样品中细胞的聚焦、排序和旋转。根据本发明实施例实现的微流体装置内的区域在图1b中示出。流动池106包括过滤区域130,以防止通道由聚集体/碎屑或灰尘颗粒堵塞。细胞通过聚焦区域132,聚焦区域132利用“惯性聚焦”以形成细胞的单个流线,细胞的单个流线然后由排序区域134隔开。在成像之前,可以通过旋转区域136对细胞施加旋转。然后,旋转的细胞可以通过成像区域138,在成像区域138中,在离开流动池之前照明细胞以用于成像。下面更详细地描述和讨论这些各种区域。
由于根据本发明各种实施例的细胞学分类系统递送单个细胞以用于成像,因此该系统消除了依赖于操作者的专业知识的手动制备载玻片所涉及的可变性。此外,可以避免图像分割。由于细胞学分类系统依赖于惯性效应,因此可以实现相对高的流速和高通量(例如,分析>1000个细胞/秒)。在许多实施例中,细胞学分类系统包括可以以至少1000个细胞/秒捕获图像的成像系统和可以以至少1000个细胞/秒进行分类的计算系统。成像系统尤其可以包括照相机、物镜系统和光源。在许多实施例中,可以使用标准2d微流体制造技术制造与上述流动池类似的流动池,这需要最少的制造时间和成本。
尽管上文参照图1a和图1b描述了特定的细胞学分类系统、流动池和微流体装置,但是细胞学分类系统可以以适合于根据本发明各种实施例的具体应用的要求的各种方式中的任何一种来实现。下面进一步讨论根据本发明许多实施例的可用于细胞学分类系统的微流体装置的具体要素。
微流体装置制造
可以使用各种方法制造根据本发明若干实施例的微流体装置。在许多实施例中,使用光刻和模铸的组合来制造微流体装置。传统的光刻通常涉及使用光致抗蚀剂和图案化的光来产生模具,该模具在基板(通常是硅晶片)的顶部上包含所需微流体图案的正浮雕。光致抗蚀剂是可光固化的材料,其可用于光刻以产生特征尺寸为微米级的结构。在制造期间,可以将光致抗蚀剂沉积到基板上。可以旋转基板以产生具有目标所需高度的光致抗蚀剂层。然后可以通过图案化掩模将光致抗蚀剂层暴露于光,通常是uv光(取决于光致抗蚀剂的类型),以产生光致抗蚀剂的固化图案。剩余的未固化部分可以被显影掉,留下可以用于制造微流体装置的正浮雕模具。
从模具中,可以浇铸材料以形成包含负浮雕图案的层。入口和出口孔可以在适当的区域形成,然后该装置可以粘合到背衬上,以产生具有微流体通道的流通装置或流通池。在利用旋转部分的许多实施例中,可以使用双层制造工艺来定向旋转部分,使得当细胞旋转时细胞的成像将提供不同角度的细胞图像,其具有更准确的细胞特征表示。可以容易地理解,微流体装置可以使用适合于给定应用的要求的各种材料来制造。在成像应用中,微流体装置通常由光学透明材料制成,诸如(但不限于)聚二甲基硅氧烷(“pdms”)。
尽管讨论了微流体装置制造的具体方法,但是根据给定应用的要求,可以实现多种方法中的任何一种来制造根据本发明各种实施例中使用的微流体装置。
微流体过滤器
根据本发明若干实施例的微流体装置可以在微流体装置的入口处或更下方包括一个或多个微流体过滤器,以防止通道堵塞。在其他实施例中,过滤可以在装置外进行。图2中示出了根据本发明实施例的微流体过滤系统,该微流体过滤系统包括位于微流体装置入口处的两层微流体过滤器,以防止通道被聚集体/碎屑或灰尘颗粒堵塞。在所示实施例中,微流体过滤器被实施为展开具有特定尺寸间隙的结构环,以过滤掉超过特定尺寸的颗粒。虽然示出了过滤器和微流体通道的具体尺寸和图案,但是过滤器和微流体通道的具体尺寸和图案可以变化,并且很大程度上取决于感兴趣细胞的大小和给定应用的要求。
尽管图2中示出了特定微流体过滤系统,但是根据给定流动应用的要求,可以在根据本发明各种实施例使用的微流体装置上实现各种微流体过滤系统中的任何一种。
聚焦区域
微流体装置上的聚焦区域可以捕获无序的细胞流并利用惯性升力(壁效应和剪切梯度力)将流体内的细胞聚焦成细胞的单线。图3a示出了根据本发明实施例的微流体通道的聚焦区域300。上游部分302、收缩304和扩展306部分以及下游部分308在图3b-图3d中另外详细示出。
聚焦区域300经由上游部分302接收随机排列的细胞流。细胞流入收缩304和扩展306部分区域,在收缩304和扩展306部分中,随机排列的细胞聚焦成细胞的单个流线。聚焦由在雷诺数>1时作用于细胞的惯性升力(壁效应和剪切梯度力)的作用驱动,其中通道雷诺数定义如下:rec=ρumw/μ,其中um是最大流体速度,ρ是流体密度,μ是流体粘度,w是通道尺寸。在一些实施例中,可以使用约20-30的雷诺数来聚焦颗粒~10-20pm。在许多实施例中,雷诺数使得在微流体通道内发生层流。可以容易地理解,特定通道雷诺数可以变化,并且很大程度上取决于设计微流体装置所针对的细胞的特性、微流体通道的尺寸以及灌注系统控制的流速。
在许多实施例中,聚焦区域形成有曲线壁,该曲线壁形成周期性图案。在一些实施例中,图案形成一系列方形扩展和收缩。在其他实施例中,图案是正弦的。在进一步的实施例中,正弦图案倾斜以形成不对称图案。图3a-图3d中所示的聚焦区域可以在宽的流速范围内聚焦细胞。在所示实施例中,使用不对称的正弦曲线状结构,而不是方形扩展和收缩。这有助于防止在颗粒流动流后面形成二次涡流和二次流动。以这种方式,所示结构允许更快和更准确地将细胞聚焦到单个横向平衡位置。螺旋和弯曲通道也可用于惯性区域。但是,这些可能会使与其他模块的集成变得复杂。最后,通道宽度大于通道高度的直通道也可用于将细胞聚焦到单个横向位置上。然而,在这种情况下,由于在z平面中将存在多于一个平衡位置,因此成像可能成为问题,因为成像焦平面优选地是固定的。如可以容易地理解的,可以根据具体应用的要求使用如下各种结构中的任何结构,该结构提供沿微流体通道的长度扩展和收缩的截面或能够聚焦细胞。
虽然以上参照图3a-图3d描述了微流体通道内的聚焦区域的具体实现,但是根据本发明的各种实施例,可以根据特定应用的要求适当地利用将细胞聚焦成单个流线的各种通道配置中的任何一种。
排序区域
根据本发明若干实施例,可以设计微流体通道以对由聚焦区域形成的细胞单流线施加排序。根据本发明许多实施例的微流体通道包括具有夹持区域和弯曲通道的排序区域。排序区域对细胞进行排序并使单个细胞彼此拉开距离以便于成像。在许多实施例中,通过形成微流体通道以在细胞上施加惯性升力和dean拖曳力来实现排序。dean流是由流体惯性引起的旋转流。可形成微流体通道以产生二次流,二次流施加与二次流的速度成比例的dean拖曳力。dean拖曳力与~ρum2αdh2/r成比例,其中ρ是流体密度,um是最大流体速度,dh=2wh/(w+h)是通道水力直径,α是颗粒尺寸,并且r是曲率半径。惯性升力和dean拖曳力之间的力平衡决定了颗粒平衡位置。
图4a和图4b示出了根据本发明实施例的微流体通道的排序区域400,其具有一系列弯曲通道402和夹持区域404。取决于颗粒尺寸,可确定通道的相对内部和外部曲率半径(r1in,out)和微流体通道的通道高度(hc)以在期望位置达到平衡。弯曲402和夹持区域404的不同组合(及其参数)可用于实现颗粒之间的所需距离。可以调节夹持区域中的通道宽度,使得细胞不会被挤压通过通道,导致对细胞膜的可能损坏(然而,细胞可以在穿过夹持区域时在不接触通道壁的情况下稍微变形)。另外,挤压可能导致通道壁上留下的细胞膜碎片/残留物,这将改变通道的性质。夹持区域中的排序由细胞/颗粒到达时通道流体阻力的瞬时变化驱动。由于该区域中的通道宽度接近于细胞/颗粒尺寸,因此当细胞到达夹持区域时,通道阻力增加。由于整个系统是压力调节的(恒定压力),这可以导致流速的瞬时降低并因此导致细胞的间隔。可以调节夹持区域的长度和宽度以达到细胞之间的期望间隔。弯曲的通道结构还可以帮助将细胞聚焦到单个z位置,从而便于成像。在图4b中概念性地示出了通道内的dean流和惯性升力的影响。
尽管在图4a和图4b中示出了排序和控制细胞之间间隔的弯曲通道和颗粒夹持区域的特定组合,但是可以使用不同的几何形状、顺序和/或组合。在其他实施例中,可以在不使用弯曲通道的情况下将夹持区域放置在聚焦通道的下游。添加弯曲通道有助于更快速和受控的排序,以及增加颗粒在向下游迁移时遵循单个横向位置的可能性。可以容易地理解,排序区域的具体配置很大程度上基于给定应用的要求来确定。
细胞旋转区域
根据本发明许多实施例,微流体通道可以被配置为对排序细胞施加旋转。根据本发明许多实施例的微流体通道的细胞旋转区域使用无颗粒缓冲液的共流来通过使用共流在细胞上施加差异速度梯度来诱导细胞旋转。在若干实施例中,使用双层制造工艺制造微流体通道的细胞旋转区域,使得旋转轴垂直于细胞下游迁移的轴并平行于细胞横向迁移。细胞在该区域成像,同时在向下游迁移时翻滚和旋转。这允许以不同角度对细胞进行成像,这提供了比在单个图像或者在没有任何显著程度旋转的细胞的图像序列中捕获的关于细胞特征的更准确的信息。这还允许使用可用软件对细胞进行3d重建,因为跨越图像的旋转角度是已知的。在许多实施例中,通过提供通道高度的变化(即,微流体通道的截面的两个尺寸中的较小尺寸和垂直于成像平面的尺寸)来实现跨细胞的速度梯度的类似变化。通道高度的这种增加应该使得通道的宽度继续大于高度。同样在增加通道高度的情况下,可以在高度尺寸中使细胞聚焦位置偏移,这应当在成像焦平面的成像和调整期间考虑。
在图5a和图5b中示出了根据本发明实施例的在成像区域之前结合注入的共流的微流体通道的细胞旋转区域。在所示实施例中,在z平面(垂直于成像平面)中引入共流以使细胞旋转。由于成像是在x-y平面中进行的,因此细胞围绕平行于y轴的轴的旋转通过将在先前图像中可能已被遮挡的细胞部分旋转到每个后续图像中的视图中而提供了附加信息。由于通道尺寸的变化,在点xo处,在细胞上施加速度梯度,这可以使细胞旋转。细胞的角速度取决于通道和细胞尺寸以及q1(主通道流速)和q2(共流流速)之间的比率,并且可以根据给定应用的要求进行配置。在许多实施例中,细胞旋转区域包括微流体通道的在一个尺寸的增加,以引发跨细胞的速度梯度的变化以将旋转施加到细胞上。图5c中示出了根据本发明实施例的结合了成像区域之前的微流体通道的截面的z轴尺寸的增加的微流体通道的细胞旋转区域。通道高度的变化可以引起细胞在微流体通道的z轴上的速度梯度的变化,这可以使细胞旋转,如同使用图5a和图5b中的共流那样。图5d中示出了来自微流体通道的成像区域内捕获的旋转棒状颗粒的视频的叠加图像,其中所述微流体通道结合了与图5c中所示的细胞旋转区域类似的细胞旋转区域。
尽管上面参考图5a-5d描述了用于对细胞施加速度梯度的特定技术。但是根据本发明各种实施例,可以根据特定应用的要求利用各种技术中的任何一种来对细胞的单个流线施加旋转。
成像和分类
根据本发明各种实施例,可以利用各种技术对细胞学分类系统捕获的细胞图像进行分类。在许多实施例中,以每秒帧数为100,000数量级的非常高的帧速率捕获图像,并且实时进行分类。由于血液中的细胞具有不同的形态学特性,因此根据本发明各种实施例的使用细胞学分类系统从不同角度对单个细胞进行成像的能力意味着可以开发多种分类器以识别血液中的不同细胞类型和/或其他应用。使用图像分析软件,可以对不同的细胞类型进行分类。
尽管已经在某些特定方面描述了本发明,但是对于本领域技术人员来说许多其他修改和变化是清楚的。因此,应该理解,在不脱离本发明的范围和精神的情况下,可以以不同于具体描述的方式实施本发明。因此,本发明的实施例应该在所有方面都被认为是说明性的而非限制性的。因此,本发明的范围不应由所示实施例确定,而应由所附权利要求及其等同物确定。
- 还没有人留言评论。精彩留言会获得点赞!