克罗恩病相关的尿液蛋白质标记物的筛选及其用途的制作方法
本发明涉及临床医学领域;具体而言本发明涉及人克罗恩病相关的尿液蛋白质标记物。具体而言,本发明涉及利用克罗恩病的大鼠模型和质谱分析尿液蛋白质组学技术获得与人克罗恩病相关的尿液蛋白质标记物,以及所述尿液蛋白质标记物的用途。
背景技术:
炎症性肠病是一种病因不明的慢性非特异性肠道炎症性疾病,临床表现有腹痛、血便和消化不良等。炎症性肠病主要包括克罗恩病和溃疡性结肠炎。流行病学资料显示,炎症性肠病在欧洲、北美地区发病率较高,但近几年来在中国的发病率呈逐年升高趋势,参见ngsc,shihy,hamidin,等人worldwideincidenceandprevalenceofinflammatoryboweldiseaseinthe21stcentury:asystematicreviewofpopulation-basedstudies.thelancet,2017;和kaplangg,ngsc.globalisationofinflammatoryboweldisease:perspectivesfromtheevolutionofinflammatoryboweldiseaseintheukandchina.thelancetgastroenterology&hepatology,2016,1:307-316。
目前炎症性肠病的诊断主要依据临床表现、肠道内窥镜、影像学和病理组织活检进行判定,在排除感染等其他病因的前提下诊断。克罗恩病和溃疡性结肠炎临床表现相似,但在组织学和内镜检查方面存在很大差异,因此内镜检查联合病理活检是现阶段鉴别诊断,以及评估肠道炎症程度及活动性的重要依据,参见tontinige,vecchim,pastorellil,等人differentialdiagnosisininflammatoryboweldiseasecolitis:stateoftheartandfutureperspectives.worldjournalofgastroenterology,2015,21:21-46;gomollonf,dignassa,annesev,等人,第三版europeanevidence-basedconsensusonthediagnosisandmanagementofcrohn'sdisease2016:part1:diagnosisandmedicalmanagement.journalofcrohn's&colitis,2017,11:3-25;和dignassa,eliakimr,magrof,等人secondeuropeanevidence-basedconsensusonthediagnosisandmanagementofulcerativecolitispart1:definitionsanddiagnosis.journalofcrohn's&colitis,2012,6:965-990。但仍有5%-15%的患者病变仅累及结肠鉴别诊断不明确,其中的80%最终发展为克罗恩病或溃疡性结肠炎,参见nuijvj,zelinkovaz,rijkmc,等人phenotypeofinflammatoryboweldiseaseatdiagnosisinthenetherlands:apopulation-basedinceptioncohortstudy(thedeltacohort).inflammatoryboweldiseases,2013,19:2215-2222;burischj,pedersenn,cukovic-cavkas,等人east-westgradientintheincidenceofinflammatoryboweldiseaseineurope:theecco-epicominceptioncohort.gut,2014,63:588-597;和ngsc,tangw,chingjy,等人incidenceandphenotypeofinflammatoryboweldiseasebasedonresultsfromtheasia-pacificcrohn'sandcolitisepidemiologystudy.gastroenterology,2013,145:158-165e152。并且内镜检查及病理活检具有侵入性、费时、费力、不可多次重复操作等缺点。所以亟需找到一种无创、简单、高敏感性、高特异性的生物学标记物。
尿液是机体代谢产生的排泄废物,不受内环境稳态机制的严格调控,所以尿液可以灵敏、早期地反应疾病期机体的变化,即尿液是比血液更好的寻找疾病标志物的重要来源,参见gaoy.urine-anuntappedgoldmineforbiomarkerdiscovery?scichinalifesci,2013,56:1145-1146;和wuj,gaoy.physiologicalconditionscanbereflectedinhumanurineproteomeandmetabolome.expertreviewofproteomics,2015,12:623-636;和lim,zhaom,gaoy.changesofproteinsinducedbyanticoagulantscanbemoresensitivelydetectedinurinethaninplasma.scichinalifesci,2014,57:649-654。此外尿液还具有可大量、连续性、无创性收集的优点。据urinaryproteinbiomarkerdatabase(6/29/2017更新),有924个尿液候选蛋白质标记物被报道与159种疾病相关。除泌尿系疾病,尿液还可以反映全身各系统疾病状态,例如,脑部疾病、心脏疾病、代谢性疾病。尿液中包涵丰富的信息,对泌尿系统,乃至整个机体系统疾病标记物的研究都具有重要的指导意义。
化学试剂诱导的炎症性肠病动物模型广泛应用于实验室研究。其中2,4,6-三硝基苯磺酸钠(tnbs)是一种半抗原诱导的肠炎动物模型,主要激活th1型免疫反应,导致炎性细胞浸润和炎症反应,参见wirtzs,poppv,kindermannm,等人chemicallyinducedmousemodelsofacuteandchronicintestinalinflammation.natureprotocols,2017,12:1295-1309;elsonco1,beagleykw,sharmanovat,等人hapten-inducedmodelofmurineinflammatoryboweldisease:mucosaimmuneresponsesandprotectionbytolerance.jimmunol,1996,157(5):2174-2185。从免疫学和组织病理学方面比较,tnbs诱导的肠炎动物模型与人类克罗恩病非常相似,参见kieslerp,fussij,stroberw.experimentalmodelsofinflammatoryboweldiseases.cellularandmoleculargastroenterologyandhepatology,2015,1:154-170。
技术实现要素:
在本实验中应用蛋白质组技术对tnbs诱导的肠炎动物模型的尿液蛋白质组进行高通量的深度鉴定,在尿液里挖掘疾病特异的生物标记物。
一方面,本发明提供了一种建立用于筛选与克罗恩病相关的尿液蛋白质标记物的动物模型的方法,所述方法包括以下步骤:
i)通过灌肠注入tnbs乙醇溶液或通过灌肠注入生理盐水分别获得患有克罗恩病的大鼠模型和对照大鼠模型;
ii)收集步骤i)中获得的患有克罗恩病的大鼠模型和对照大鼠模型的尿液;和
iii)通过质谱分析鉴定步骤ii)中收集的患有克罗恩病的大鼠模型和对照大鼠模型尿液中的蛋白质谱。
进一步地,根据本发明所述的方法,其中在步骤ii)中收集灌肠注入tnbs乙醇溶液或通过灌肠注入生理盐水之后第2或7天的大鼠尿液。
进一步地,根据本发明所述的方法,其进一步包括步骤iv)比较步骤iii)中获得的患有克罗恩病的大鼠模型和对照大鼠模型尿液中的蛋白质谱,获得差异表达的蛋白质。
另一方面,本发明提供了一种通过灌肠注入tnbs乙醇溶液获得的患有克罗恩病的大鼠模型在制备用于筛选与克罗恩病相关的尿液蛋白质标记物的动物模型中的用途。
根据本发明所述的用途,其中通过鉴定患有克罗恩病的大鼠模型尿液中的蛋白质谱获得与克罗恩病相关的尿液蛋白质标记物。
另一方面,本发明提供了用于检测一种或多种根据本发明的方法获得的尿液蛋白质标记物的试剂在制备用于诊断受试者中克罗恩病的试剂盒中的用途。
根据本发明所述的用途,其中所述一种或多种根据本发明所述的方法获得的尿液蛋白质标记物选自核糖核酸酶胰腺γ型(rns1g)、中性粒细胞明胶酶相关脂质运载蛋白(ngal)、基质金属蛋白酶8(mmp8)、二-n-乙酰胆碱酯酶(diac)、果糖二磷酸醛缩酶b(aldob)、甘油醛-3-磷酸脱氢酶(g3p)、中性和碱性氨基酸转运蛋白rbat(slc31)、钠依赖性中性氨基酸转运蛋白b(s6a18)、二氢硫辛酸脱氢酶,线粒体(dldh)、溶酶体相关膜糖蛋白1(lamp1)、β-甘露糖苷酶(manba)、神经胶质原(nptn)、谷氨酸-半胱氨酸连接酶调节亚基(gsh0)、γ-谷氨酰转肽酶1(ggt1)、腺苷酸激酶同工酶1(kad1)、酯水解酶c11或f54同系物(ck054)、collectrin(tmm27)和碳酸酐酶1(cah1)。
根据本发明所述的用途,其中所述试剂用于检测受试者的尿液蛋白质谱,所述尿液蛋白质谱由核糖核酸酶胰腺γ型(rns1g)、中性粒细胞明胶酶相关脂质运载蛋白(ngal)、基质金属蛋白酶8(mmp8)、二-n-乙酰胆碱酯酶(diac)、果糖二磷酸醛缩酶b(aldob)、甘油醛-3-磷酸脱氢酶(g3p)、中性和碱性氨基酸转运蛋白rbat(slc31)、钠依赖性中性氨基酸转运蛋白b(s6a18)、线粒体二氢硫辛酸脱氢酶(dldh)、溶酶体相关膜糖蛋白1(lamp1)、β-甘露糖苷酶(manba)、神经胶质原(nptn)、谷氨酸-半胱氨酸连接酶调节亚基(gsh0)、γ-谷氨酰转肽酶1(ggt1)、腺苷酸激酶同工酶1(kad1)、酯水解酶c11或f54同系物(ck054)、collectrin(tmm27)和碳酸酐酶1(cah1)组成。
根据本发明所述的用途,其中在所述尿液蛋白质谱中,与对照组相比,核糖核酸酶胰腺γ型(rns1g)、中性粒细胞明胶酶相关脂质运载蛋白(ngal)、基质金属蛋白酶8(mmp8)、二-n-乙酰胆碱酯酶(diac)、线粒体二氢硫辛酸脱氢酶(dldh)、溶酶体相关膜糖蛋白1(lamp1)、β-甘露糖苷酶(manba)和神经胶质原(nptn)上调;以及果糖二磷酸醛缩酶b(aldob)、甘油醛-3-磷酸脱氢酶(g3p)、中性和碱性氨基酸转运蛋白rbat(slc31)、钠依赖性中性氨基酸转运蛋白b(s6a18)、谷氨酸-半胱氨酸连接酶调节亚基(gsh0)、γ-谷氨酰转肽酶1(ggt1)、腺苷酸激酶同工酶1(kad1)、酯水解酶c11或f54同系物(ck054)、collectrin(tmm27)和碳酸酐酶1(cah1)下调。
根据本发明所述的用途,其中所述受试者是人。
附图说明
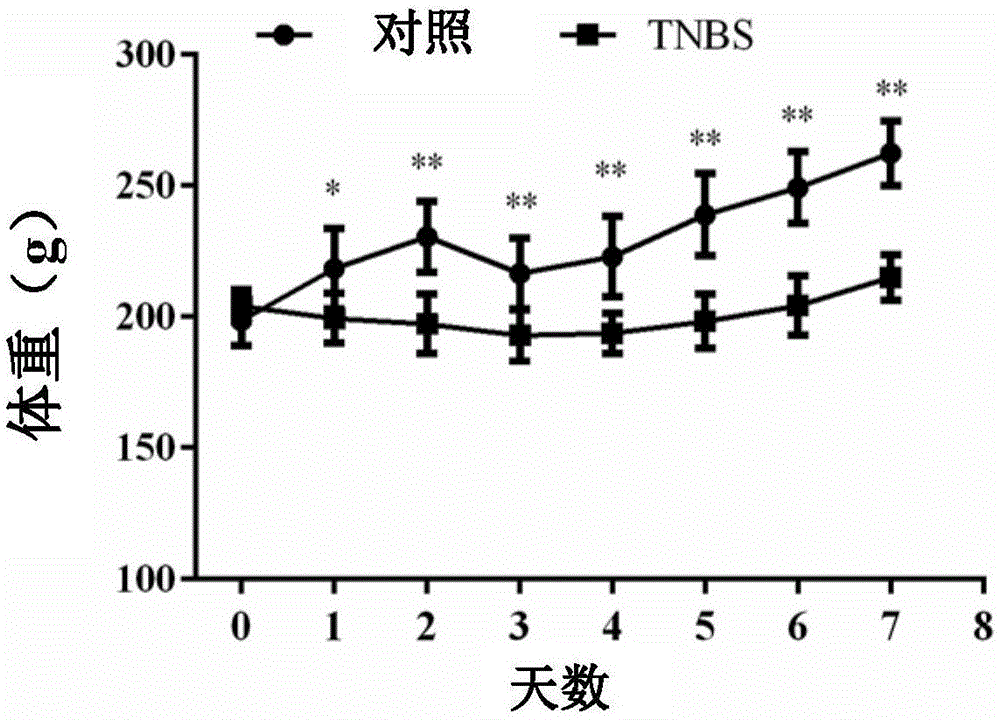
图1显示对照大鼠与tnbs诱导的大鼠的体重变化。其中,*p<0.05,**p<0.01。
图2a-图2b显示大鼠结肠病理改变。图2a:大体观;图2b:he染色(con:对照组,tnbs:实验组)。
具体实施方式
在以下实验中应用蛋白质组技术高通量筛选tnbs诱导的克罗恩病肠炎动物模型中的尿液蛋白质组,寻找克罗恩病特异的尿液蛋白质标记物。
1.材料与试剂
1)仪器:
orbitrapfusionlumostribird质谱仪购自thermoscientific公司;大鼠代谢笼:购自北京佳源兴业科技有限公司。
2)主要试剂:
色谱质谱级水、乙腈、甲酸和甲醇从fisher公司购买;碘乙酰铵(iaa)、碳酸氢铵、尿素、二硫苏糖醇(dtt)、2,4,6-三硝基苯磺酸(tnbs)从sigma公司购买;黄金胰酶从promega公司购买;tmt(tandemmasstags)同位素标记试剂盒从thermopierce公司购买。
3)动物:
雄性wistar大鼠(体重180-200g)购自维通利华公司,在标准饲养环境中饲养(室温22±1℃,湿度65-70%)。
2.实验方法
1)动物模型的建立和尿液样本收集
实验前对wistar大鼠进行称重,将24只大鼠随机分为两组。实验组(n=14):大鼠禁食24小时后乙醚麻醉,用聚乙烯导管(长约15cm,直径2mm)由肛门轻缓插入8cm处的肠腔内,快速(5s内)注入100mg/kg的50%tnbs乙醇溶液150μl。注入后捏紧肛门,提取大鼠尾巴倒置3分钟,使药液与结肠充分接触。对照组(n=10):与实验组类似地处理,肠道内灌注150μl生理盐水,而不是tnbs。每天测量造模后的实验组大鼠和对照组大鼠的体重。
尿液样本收集:造模后,第2、7天将实验组与对照组大鼠置于大鼠固定器中收集尿液。并分别处死3只大鼠,取结肠部位福尔马林固定,石蜡包埋后做he染色病理分析。
2)丙酮沉淀法提取尿液中蛋白质
丙酮沉淀尿蛋白质方法参照thongboonkerd等方法,参见thongboonkerdv,mcleishkr,arthurjm,等人proteomicanalysisofnormalhumanurinaryproteinsisolatedbyacetoneprecipitationorultracentrifugation.kidneyint,2002,62:9。8ml尿液离心:3500g/min、4℃、30min,取上清,12000g/min、4℃离心30min。取上清5ml,加入20ml预冷的丙酮,4℃沉淀过夜。12000g/min、4℃离心30min,留沉淀室温风干。加入裂解液约500μl吹打溶解沉淀,超声3min。12000g/min、4℃离心30min,留取上清,bradford法测蛋白质浓度-80℃保存备用。
3)尿蛋白质胰酶酶解
每个样本取200μg尿蛋白质,按wisniewski等方法酶解,参见wisniewskijr,zoμgmana,nagarajn,等人universalsamplepreparationmethodforproteomeanalysis.natmethods,2009,6:359-363。加入dtt终浓度4.5mm、37℃、60min还原;加入iaa终浓度10mm、室温避光、30min烷基化;按照质量比例(尿液蛋白质:胰酶=50:1)加入胰酶,37℃、水浴、16小时。酶解后回收肽段用oasishlb小柱除盐,并冻干成粉末,于-20℃存储备用。
4)tmt(tandemmasstags)同位素标记肽段和离线高ph值反相色谱预分离多肽
将tmt标记试剂(共9个:126,127,127n,128,128n,129,129n,130,131)分别加入41μl乙腈,涡旋震荡5min,放置10min备用。将酶解冻干后的9个肽段样品(对照组n=3(1-3),第二天组n=3(4-6),第七天组n=3(7-9)),分别溶于100mm三乙胺碳酸盐(teab)溶液,涡旋震荡5min。每个样品取70μg肽段,分别加到tmt试剂中(将126标记试剂加入样品1,127加入样品2,依次类推),涡旋震荡3min,室温反映1h。抽干样品。
利用高ph值反相色谱分离tmt标记后的混合多肽400μg。a相(ph10)1mm氨水,b相(ph10)90%乙腈、2mm氨水。60min分离梯度,0.7ml/min流速。每分钟收集1份组分,共收集60份。梯度如下表:
将所有组分样品离心冻干后,用0.1%甲酸水溶液溶解样品,按照第1、21和41份混合成第一个样品,第2、22和42混合成第二个样品,以此规则将60个组分样品混合成20个样品。待后续质谱分析。
5)高效液相串联质谱法(lc-ms/ms)分析
a)非标记定量:将第3步所的肽段溶于0.1%甲酸,每个样品取500ng肽段进行色谱分离(thermoeasy-nlc1200):洗脱时间60min,色谱柱流速0.3μl/min,洗脱梯度为4%-28%流动相b(0.1%甲酸+79.9%乙腈+20%水)。反相柱(c18,长15cm,内径50um)洗脱下的多肽用orbitrapfusionlumos质谱仪进行鉴定。喷雾电压2.1kv,离子传输管温度300℃。一级全扫描:350-1550m/z,120000分辨率。二级扫描为数据依赖采集模式,循环时间3s,最高速度模式。其它参数:hcd碎裂方式,30%碎裂能量,30000分辨率,扫描起始110m/z。每个样品进行3次技术重复鉴定。
b)tmt标记定量:将第4步经高ph值反相色谱预分离后的20份多肽样品溶于0.1%甲酸。每个样品大约500ng肽段进行色谱分离(thermoeasy-nlc1200):洗脱时间60min,色谱柱流速0.3μl/min,洗脱梯度为4%-35%流动相b(0.1%甲酸+79.9%乙腈+20%水)。反相柱(c18,长15cm,内径50um)洗脱下的多肽用orbitrapfusionlumos质谱仪进行鉴定。喷雾电压2.1kv,离子传输管温度300℃。一级全扫描:350-1550m/z,60000分辨率;二级扫描:hcd碎裂,40%碎裂能量,60000分辨率,扫描起始110m/z。每个样品进行2次技术重复鉴定。
c)prm(parallelreactionmonitoring)靶向定量:
建立谱图库数据采集:将待验证尿液样本酶解后多肽样品(对照组n=8,实验组第2天n=11,实验组第7天n=11),每组随机挑选4个样本,每个样本取1μg肽段组合一个混合样本。取750ng混合肽段进行色谱分离(thermoeasy-nlc1200):洗脱时间90min,色谱柱流速0.3μl/min,洗脱梯度为4%-28%流动相b(0.1%甲酸+79.9%乙腈+20%水)。反相柱(c18,长25cm,内径50um)洗脱下的多肽用orbitrapfusionlumos质谱仪进行鉴定。喷雾电压2.1kv,离子传输管温度300℃。一级全扫描:350-1550m/z,60000分辨率。二级扫描为数据依赖采集模式,循环时间3s,最高速度模式。其它参数:hcd碎裂,30%碎裂能量,30000分辨率,扫描起始110m/z。进行6次技术重复鉴定。
prm靶向数据采集:将待验证尿液样本酶解后多肽样品(对照组n=8,实验组第2天n=11,实验组第7天n=11),每个样本取750ng肽段分别进行色谱分离(thermoeasy-nlc1200):洗脱时间90min,色谱柱流速0.3μl/min,洗脱梯度为4%-28%流动相b(0.1%甲酸+79.9%乙腈+20%水)。反相柱(c18,长25cm,内径50um)洗脱下的多肽用orbitrapfusionlumos质谱仪进行鉴定。喷雾电压2.1kv,离子传输管温度300℃。一级全扫描:350-1550m/z,60000分辨率;二级扫描:隔离窗口宽度2m/z,hcd碎裂,30%碎裂能量,30000分辨率。二级靶向定量的肽段保留时间窗口为4min,详细信息如表1。
6)数据分析
a)非标记定量:将orbitrapfusionlumos采集的数据(raw格式文件)直接导入用progenesislc-ms软件(版本:4.1)。软件自动选择最合适的数据作为参照,对其它质谱数据进行保留时间的校正。选择带2+,3+,4+电荷数的母离子进行后续定量。将所有普峰数据导出mgf格式文件,用mascot软件(版本2.4.0)进行搜库。所用数据库为swissprotdatabase(数据截止至2013年5月3日)。搜库条件:酶切方式为胰酶酶切,允许2个误切位点;固定修饰为半胱氨酸的修饰,蛋白n端乙酰化修饰;母离子质量偏差为0.02da,子离子质量偏差10ppm。检索完成后,将p值设为0.01,mascot打分设为30,导出xml格式文件,并导入progenesis。以鉴定到多肽的峰强度为基础进行定量分析。
b)tmt标记定量:将orbitrapfusionlumos采集的数据(raw格式文件)直接导入用proteomediscoverer(版本2.1)进行数据检索和定量分析(qexactive系列仪器中tmt定量工作流程的仪器参数优化和proteomediscoverer2.1软件数据处理方法)。所用数据库为swissprotdatabase(数据截止至2013年5月3日)。sequest检索条件:胰酶酶切;允许最多2个漏切位点;固定修饰为半胱氨酸的脲基甲基化、肽段氮末端与赖氨酸残基上的229.163da质量增加;母离子质量偏差为10ppm,子离子质量偏差0.05da。定量方法选择tmt报告离子定量方法,导出原始报告离子的强度。
c)prm靶向定量:
prm的数据处理采用skyline软件,参见macleanb,tomazeladm,shulmann,等人skyline:anopensourcedocumenteditorforcreatingandanalyzingtargetedproteomicsexperiments.bioinformatics,2010,26:966-968。建立谱图库:将6个建库质谱原始数据合并用pd2.1软件搜库:胰酶酶切;允许最多2个漏切位点;固定修饰为半胱氨酸的脲基甲基化,蛋白质氮末端乙酰化修饰和蛋氨酸氧化修饰为可变修饰;母离子质量偏差为10ppm,子离子质量偏差0.02da。将pdresult与原始文件一起导入skyline,蛋白质fdr设为1%。筛选定量肽段:将感兴趣发现阶段筛选出来的77个差异表达的蛋白质序列fasta文件导入skyline与普图库,11个在普图库中未鉴定到的蛋白质删除。保留每个蛋白质特异性肽段至少2条,肽段长度为8-18个氨基酸,保留半胱氨酸发生脲基甲基化修饰的肽段,去掉信号肽。肽段保留时间窗口设为4min,将65个蛋白质对应的320条肽段的m/z和保留时间窗口导出,为表1。
将采集到的prm原始数据导入skyline。筛选定量子离子:母离子价态+2/+3,子离子价态+1,子离子为b,y,p类型,碎片离子从第三个离子至倒数第二个离子,碎片离子质量偏差0.02da。手动提取每一条肽二级碎片离子的峰面积,并导出。用progenesisqi软件提取一级普图中+2-+5离子峰面积,校正prm靶向定量的所有蛋白质。
实验结果
1.大鼠临床表现与体重变化
正常对照组大鼠活跃,毛发光泽,大小便正常。tnbs诱导肠炎组大鼠于建模第2天出现活动减少、肛周污秽,粪便质地为黏液便、稀便,并持续加重至脓血便。tnbs诱导肠炎组大鼠体重,从第2天开始明显低于对照组(图1)。
2.结肠病理分析结果
在第7天分别处死实验组3只大鼠,对照组3只大鼠。取结肠进行福尔马林固定、石蜡包埋、he染色病理分析。对照组大体观:肠壁厚度正常,皱襞文理清洗,黏膜光滑(图2a)。组织病理学(he染色):肠上皮完整、结果清晰、固有曾杯状细胞丰富、腺体排列规则,无充血、水水肿,无溃疡(图2b)。实验组第7天大体观:结肠局部肠壁增厚,局部充血,可见明显溃疡(图2a)。组织病理学(he染色):结肠全层普遍增厚,粘膜层缺失,杯状细胞丢失,腺体破坏,有大量中心粒细胞、淋巴细胞、嗜酸性细胞浸润,可见组织增生(图2b)。
3.尿液差异表达蛋白质筛选(非靶向定量分析)
来源于大鼠3个时期(对照组n=3(该对照组是指处理7天后的对照组大鼠,即生理盐水灌肠7天后的大鼠),实验组第2天n=3、第7天n=3)的9个尿液样本。首先,经过非标记定量蛋白质组学分析鉴定。筛选蛋白质条件为fdr小于1%的水平,并且每个蛋白质至少有1条特异的肽段,共鉴定到599个蛋白质。差异表达的蛋白质筛选标准:蛋白质丰度变化倍数在2倍以上,p值小于0.05。其次,该9个样本经过tmt标记定量蛋白质组学分析鉴定。筛选蛋白质条件为fdr小于1%的水平,并且每个蛋白质至少有1条特异的肽段,共鉴定到1543个蛋白质。差异表达的蛋白质筛选标准:蛋白质丰度变化倍数在1.2倍以上,包含至少2条特异性肽段,p值小于0.05。同时使用uniprot数据库将大鼠蛋白转化为相应的人同源蛋白。
第2天实验组与对照组相比,非标记定量与标记定量两种方法一共鉴定到33个差异表达的蛋白质,有16个蛋白质表达上调,17个蛋白质表达下调。第7天实验组与对照组相比,非标记定量与标记定量两种方法一共鉴定到48个差异表达的蛋白质,有20个蛋白质表达上调,28个蛋白质表达下调。实验组第2天、第7天尿液中一共有77个蛋白质表达出现变化,采用prm靶向定量分析技术对其在更多的尿液样本中进行验证。
4.尿液差异蛋白质验证(prm靶向定量分析)
应用prm靶向定量分析技术,对77个差异表达的尿液蛋白质在30个尿液样本(对照组n=8,实验组第2天n=11、第7天n=11)中进行验证,63个蛋白质可以被准确定量。其中,蛋白质丰度变化大于1.5倍,p<0.05的蛋白质共有30个。与对照组相比,实验组第7天发生变化的蛋白质有18个,其中8个蛋白质表达上调,10个蛋白质表达下调,如表1。这18个差异表达的尿液蛋白质可以作为诊断克罗恩病的尿液蛋白质标记物。
表1.克罗恩病尿液蛋白质标记物
- 还没有人留言评论。精彩留言会获得点赞!