一种基于回音壁模式的单细胞内物质检测方法与流程
本发明涉及到细胞激光器,一种利用回音壁模式微腔对细胞内的物质进行检测技术,属于激光技术与生物光子学领域。
背景技术
作为一种特殊的光学谐振腔,回音壁模式光学微腔通过边界连续的全反射,将光子长时间的局域在微腔内形成回音壁模式的介质谐振腔。由于其特有的回音壁模式,使其具有超高q值、极小的模式体积、超高的能量密度和极窄的线宽等优越特性,从而成为一类最典型的光子器件。
光学微腔在很多领域得到广泛的应用,尤为引人注目的是用于生物传感和检测。当光在微腔表面发生全反射时,在表面形成消逝波(约在~200nm范围内),任何待分析物质,只要和微腔表面结合,就会导致微腔周围有效折射率的变化,实验中可以通过测量波谱的位移来达到检测的目的。目前基于回音壁模式的生物检测局限于体外检测。2015年7月,美国哈佛大学光物理学家seokhyunyun和matjahumar利用细胞内的油滴构成的回音壁微腔实现了激光输出。他们将混有荧光染料的油滴注入单个细胞,在短脉冲激光泵浦下,成功地将一个活细胞变为微型激光器。因为油滴的折射率高于细胞内环境的折射率,光照在油滴上满足全反射条件,因此油滴便成了一个回音壁模式的微型谐振腔。因为油滴内掺杂了荧光染料,在泵浦光的作用下,光子长时间局域在很小的空间内,从而相干叠加形成谐振模式使能量发生显著的累积效应,增强了光和染料的相互作用,实现了染料的激光输出。
本发明是基于此背景产生的。
技术实现要素:
本发明是一种基于回音壁模式微腔对细胞内物质进行检测的方法。这种检测方法包括以下几点:(1)回音壁模式微腔的选取(2)微腔与细胞的处理(3)待测生物物质探测的具体实施方法(4)此探测方法的探测范围涉及到核酸、蛋白质、细胞、生物分子等众多特定生物物质。
具体包括以下步骤:
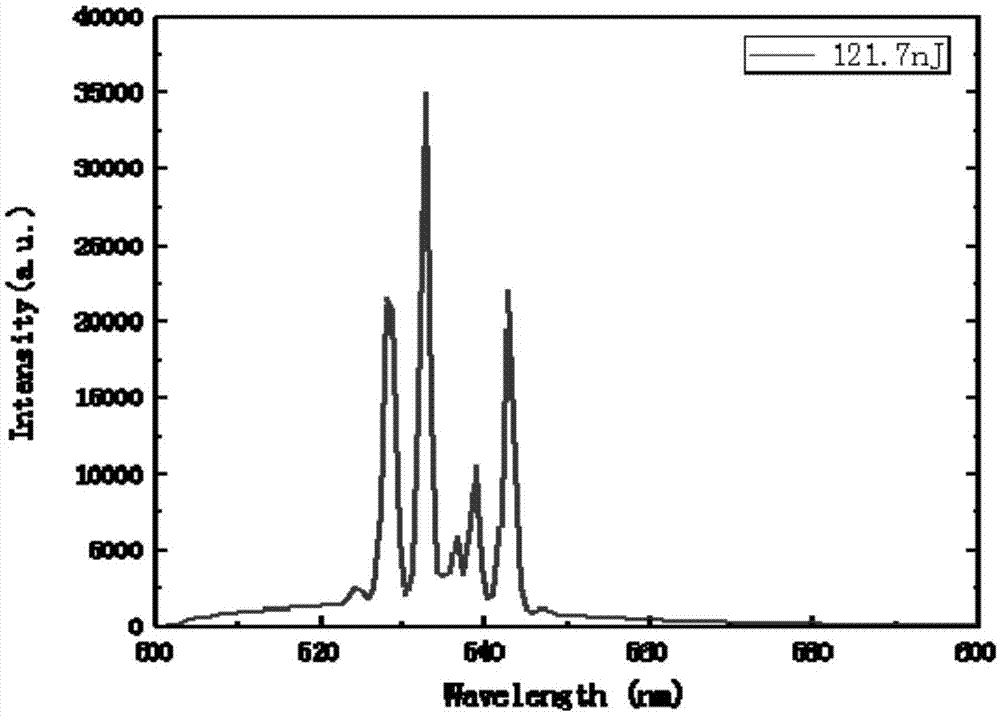
步骤1:本实验所用的材料为具有回音壁模式的球形或者其他规则形状能够形成回音壁微腔的物质,例如,硅基氧化物,高折射率无机盐,蛋白质,纤维素,果胶,等等,通过熔融或其他方式制作而成,尺寸大约在几微米左右。制作回音壁模式的材料掺杂荧光物质(例如染料,量子点,荧光蛋白等),荧光物质的浓度与它本身的发光效率有一定关系。符合条件波长的光在内部形成谐振,达到阈值(也就是当光的增益大于损耗时)发出激光。例如:在这个实验中可以用dragongreen微球,这种微球有很好的生物相容性、折射率高(n=1.56)、小的模式体积和高q值,激发的荧光效率会特别好,因此会出现窄的谱线。其在空气中的wgm信号如图1所示。
步骤2:将荧光掺杂的回音壁微腔表面进行功能化处理(对于某些待测物质也可以不进行表面功能化处理),使微腔能够特异性识别待检测物质。功能化的种类包括特异性抗体修饰,适体修饰,等等。
步骤3:将回音壁微腔与细胞一起孵育。经过2-4小时,由于细胞的吞噬作用,微球将会进入到细胞内部,因为回音壁微腔具有良好的生物相容性,所以对细胞的影响很小,其分裂、生长都正常进行。外部信号刺激细胞,使待测物质浓度升高。用激光器照射细胞,调节光束使其聚焦在微球上激发荧光,荧光偶合进微球内,产生回音壁模式,发出激光。外部连接一台光谱仪和一个ccd装置,分别用于接受光谱信号和细胞成像,实验装置结构示意图见图2。本实验需要用未加信号刺激的细胞作为对照。
对于微腔内的光学模式,主要能量束缚在介质腔内,还有一部分能量在微腔外部的环境中(空气或液体等),这就是模式的倏逝场,这部分能量分布在微腔外表面达几百纳米,当外部环境中的生物分子黏附到微球表面时,就会发生扰动,从而引起该共振模式的频率漂移,因为微球的高q值,其谱线线宽非常的窄,谱线很微小的漂移也很容易被观测到。谱线的位置移动通过光谱仪实现观察。
用此方法可以用来检测细胞内的成分,在微球上分别固定相应的识别物质,用激光泵浦,发出的荧光在微球内形成回音壁模式,产生激光,当识别物质与相应分子结合时,通过观察谐振波长的变化达到检测的目的。谐振波长变化越大,说明被检测分子浓度越高;同时,不同的谐振波长对应于不同的检测物质。
与现有技术相比,本发明具有如下优势:
1.检测灵敏度高。例如本实验用的dragongreen微球,直径为15±0.5μm,比这直径更小的微腔效果更好。模式体积小,同时折射率高,品质因子高,所形成的回音壁模式谱线质量好,有着尖锐的峰值,谱线线宽窄。因此,微球周围环境有很小的变动就会出现谱线的漂移,随即被观测到,灵敏度很高。
2.可在细胞内实现检测。微球在细胞内作为一个谐振腔,由回音壁模式产生激光输出,充当一个细胞器的作用,可跟踪细胞的运动,在不同的位置实现检测,而且对细胞影响很小,其实用性更强。
3.回音壁模式产生光放大的作用。如果只激发荧光物质,很难实现对细胞内物质的检测,因为荧光本身具有自吸收作用和漂白作用,一段时间后,荧光信号会大大减弱,并慢慢消失,检测灵敏度就会降低。而回音壁模式会使荧光在腔内形成谐振,产生激光,信号大大增强并延长了跟踪检测的时间。
附图说明:
图1dragongreen在空气中的输出光谱图
图2本发明实验装置结构示意图。
图3dragongreen微球的吸收和发射波长
具体实施方式
下面结合实施案例对本发明做进一步说明,但本发明并不限于以下实施案例。
实施案例1
本实验所用的激光光源是473nm,或者其他波段的脉冲激光器(激光器的波长由所使用荧光物质的激发波长决定),检测的物质为蛋白质,糖类,氨基酸,生物酶,dna等分子。dragongreen微球的吸收和发射波长范围如图3所示。首先要进行的是对溶液中的蛋白质分子的检测,在培养液中加入1μl浓度为10mg/ml的dragongreen微球,再加入10μl浓度为1mg/ml的蛋白质分子,其中dragongreen微球要先经过表面的敏化处理,如对于dragongreen,将微球悬浮于mes缓冲液中,加入1-乙基-3-(二甲胺丙基)碳二亚胺(edac),使微球上的羧基活化可以更容易让蛋白质分子黏附在微球表面。然后用移液枪全部取出滴在盖玻片上,因为重力的作用,需要将样品平放在三维调整架上,调节位置使激光光斑聚焦在单独的一个小球上,连接一个ccd相机可以准确的看到微球的位置和光斑是否聚焦在微球的中心。信号光由光谱仪光纤连接头收集,可以看到波长在520nm左右,会有峰值,调节到最佳位置(峰值达到最高)并增大激光功率,在520nm左右会有尖锐的峰值出现。之后微球周围会黏附蛋白质分子,峰值波长会发生红移,通过测量红移的大小,可以去计算蛋白质浓度。
本实验仅仅是对蛋白质的测量,还可以对其它分子进行检测,高灵敏度可以实现更低浓度的检测,因此有很好的实用性。然后进行下一步,实现在细胞内的检测。在培养液中加入细胞,通过吞噬作用,微球进入细胞,具体操作和上面一样,要注意激光功率不要太高,以免损坏细胞。当细胞内的分子黏附在微球表面时,或者是细胞外的分子附着在细胞上时,导致细胞变形或者是周围的折射率发生变化,都会影响微球的谐振波长,使其峰值发生变化。
实施案例2
检测钙离子浓度,研究钙离子浓度变化和激光信号的关系,实现钙离子浓度的实时动态检测。
细胞内外离子的动态平衡是细胞赖以生存的基础。钙离子作为人体代谢的信使,几乎所有的生理活动都受ca2+的调控。它参与了神经传导、肌肉收缩、心脏收缩、大脑功能、酶功能以及内分泌腺的激素分泌等各种生理机能。钙离子选择性微电极法、放射示踪法、核磁共振法(nmr)及酶法分析适合于血液、血清、血浆及体液中游离钙的检测。而细胞中钙离子的检测多用基于荧光标记的流式细胞法及荧光成像法等。这些方法不能实时,动态地反应细胞内钙离子浓度地真实信息。本发明的研究内容拟对细胞内钙离子浓度进行定量测定。
具体实验步骤如下:
(1)测量钙离子浓度为零时的激光谱。在载玻片上培养细胞,将健康生长的细胞与5mm的乙二醇双(2-氨基乙基醚)四乙酸(egta)一起培育,egta时很强的钙离子螯合剂,会进入细胞并与细胞中的钙离子螯合,使游离钙离子浓度降到最低。使细胞内吞荧光微球,利用图2装置对细胞进行泵浦,测量激光输出,记录激光谱,作为参考以计算后续实验的频移值。
(2)绘制频移-浓度标准曲线。配制一系列浓度钙离子。培养细胞,在细胞培养液中加入0.1%tritonx-100(是指细胞培养液中加入tritonx-100后的tritonx-100质量百分比浓度)和不同浓度的钙离子。tritonx-100使细胞膜具有通透性,使细胞内外钙离子的浓度达到平衡。加入荧光微球,使微球内化于细胞中,利用装置图2,用473nm激光泵浦细胞,测量不同钙离子浓度下的激光谱,与步骤(1)中的谱图对照,测出谱线的频移,绘制频移-浓度标准曲线。
(3)测定钙离子浓度。培养细胞,用外部信号刺激细胞,使胞内释放钙离子,加入荧光微球与细胞共培养并使其内化,利用装置图2在473nm激光泵浦下,记录激光发射谱,与参考谱对比测量频移,利用标注曲线,计算钙离子的浓度。
(4)同时与常规钙离子浓度测定法的结果比较。
实施案例3
对细胞内蛋白质分子的动态磷酸化修饰进行无标记检测。
人体是由几万亿个细胞组成的复杂系统,基因组控制着遗传信息,但决定细胞的状态和命运的执行者大多是蛋白质分子;而作为组成生命体主要成分的蛋白质分子的动态化学修饰对生物个体发育、细胞命运调控和疾病的形成均起着决定性作用。蛋白质磷酸化修饰是调节和控制蛋白质活性和功能的最基本、最普遍、也是最重要的机制。研究生物体内蛋白质大分子化学修饰的动态过程和机制,有助于对其进行化学干预和调控,对探索新的生命过程和发现新的疾病诊疗手段,均具有重要的科学意义和应用价值。现有的磷酸化修饰研究技术只能发现或分析那些结构性磷酸化位点,而蛋白质功能的变化往往要借助于瞬时的磷酸化变化。因此,瞬时磷酸化修饰研究技术的突破将是磷酸化蛋白研究的新方向。
具体实验步骤如下:
(1)首先制备抗体修饰的荧光微球。
a)计算修饰直径10μm的微球所需抗体的浓度。单层抗体修饰所需要的量取决于抗体的分子量大小以及抗体和微球的亲和力。可用公式s=(6/ρsd)·c粗咯计算。s是单层修饰需要的抗体的量(mg抗体/g微球),ρs是微球的密度(g/cm3),d是微球的直径,c是微球表面的容量。对于bsa,c~3mg/m2,因此,单层覆盖直径为10μm的微球所需bsa的量可以计算出大约为180mg/g微球。所需抗体的量可以通过比较其分子量和bsa的分子量计算得知。根据所需量配制抗体溶液。
b)活化微球上的羧基。将微球悬浮于mes缓冲液中,加入1-乙基-3-(二甲胺丙基)碳二亚胺(edac),20min后,微球上的羧基活化。
c)根据计算所需的蛋白质的量,将抗体稀释于pbs缓冲液中。为了防止非特异性结合,最好在缓冲液中加入适量浓度为0.05%-0.1%的载体蛋白(是指缓冲液中加入载体蛋白后的载体蛋白质量百分比浓度),比如bsa或胎牛血清,可以阻断非特异性的位点,减少误差。
d)将活化的微球与特异性磷酸化蛋白抗体混合,并孵育2-4h,清洗。制得抗体修饰的微球。
(2)准备细胞(nih3t3)。培养细胞,为了消除细胞内在的磷酸化分子的干扰,首先将细胞用磷酸化抑制剂wortmannin处理30min;处理后的细胞内磷酸化蛋白akt(pakt)水平很低,作为对照。
(3)将抗体修饰的微球悬浮液和(2)处理后的细胞一起培育,细胞会将微球内化。在473nm激光泵浦下,记录激光谱,作为时间点t0。然后用血小板生长因子(pdgf)处理细胞,刺激细胞内的蛋白akt磷酸化,产生的pakt与微球上的抗体结合。分别在不同时间点用473nm的激光泵浦,记录每个时间点的光谱,分别与t0时的光谱对比,用谱带的频移观察磷酸化的过程。
实施案例4
无标记检测肿瘤细胞内的micrornas(以mir-21为例)。
microrna(mirnas)是一类长约22nt的非编码单链rna分子,在转录水平调控基因的表达。mirna能特异性地诱导靶基因的降解或抑制靶基因的翻译,从而调节细胞的增殖分化和凋亡。在人类大多数的肿瘤细胞中发现mirna异常表达,起到癌基因或抑癌基因的作用。这使其成为很好的肿瘤标记物,可以用于多种肿瘤的诊断及预后评估。mir-21是较早发现的存在于人类基因组中的一个mirna,现已被证实在许多肿瘤细胞中(胃癌,肠癌,乳腺癌)均被过度激活,起到类癌基因的作用,而且还与肿瘤的侵袭和转移有关。因此mir-21被认为是癌症诊断和治疗的靶分子。尽管mirnas如此重要,但是却缺乏灵敏有效的检测手段。荧光定量pcr是分析核酸常用的方法,但是由于mirnas分子太小,常常不能有效地复制,而且分析过程冗长,需要昂贵的仪器。因此本发明是基于回音壁模式细胞激光器,以mir-21为例,设计了细胞中mirnas无标记实时动态检测方案。这一方案的成功实施,将为当个细胞中mirnas的实时动态分析提供有力的工具。
具体实验步骤如下:
(1)首先制备pna-21功能化的荧光微球。
a)合成特异性识别mir-21的pna序列pna-21。
b)活化微球上的羧基。将微球悬浮于mes缓冲液中,加入1-乙基-3-(二甲胺丙基)碳二亚胺(edac),20min后,微球上的羧基活化。
c)用pna-21修饰荧光微球。将pna-21稀释于te缓冲液中。将活化的微球与特异性pna-21混合并孵育2-4h,清洗。制得pna-21修饰的荧光微球。
(2)准备细胞。培养乳腺癌细胞mda-mb-231,并将细胞平行分成两组:第一组细胞预先用mir-21抑制剂处理,抑制细胞中mir-21表达。这组细胞为阴性对照组;第二组细胞未作任何处理。
(3)将pna-21修饰的荧光微球悬浮液分别和两组细胞一起培养,细胞会将微球内化。
(4)用波长为473nm的激光源分别泵浦两组细胞。用光谱仪测量激光发射谱,并与阴性对照组相比。癌细胞中mir-21与微球上的pna-21结合,必然导致其激光谱的频移,利用这一现象可以检测细胞中mir-21的存在。
(5)结果论证。我们的结果将与常规检测方法(比如荧光定量pcr)取得的结果进行对比,以确定结果的可靠性,其优势在于实现体内检测,速度更快,效果更好
本发明在技术上要求很高,其核心部分在于激光激发回音壁模式,实现细胞内的激光输出,并且当有物质附着到微腔表面时,发生光谱频率的偏移。
- 还没有人留言评论。精彩留言会获得点赞!