一种基于金属离子标记的电化学检测方法与流程
本发明属于医学检验领域,尤其是涉及一种基于金属离子标记的电化学检测方法。
背景技术:
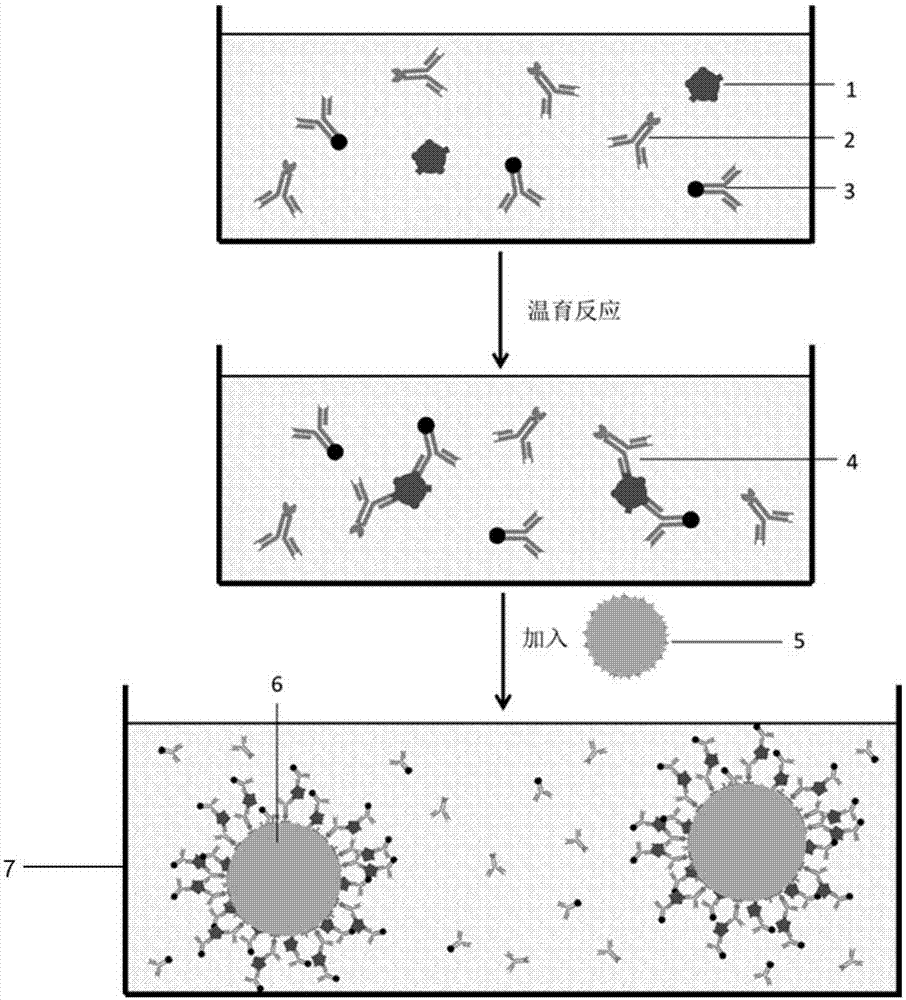
:电化学检测技术是近年来新兴的灵敏分析检测技术,是一种以不同方式的电信号作为激发与检测信号的分析检测技术。电化学检测技术由于其操作简单、灵敏度高和检测速度快等优势而备受青睐,已经在生命科学、生物科学、临床分析、环境监测以及表面科学等领域得到了广泛的研究与应用。电化学传感器可实现经济、高效、实用、快速、灵敏、精确的检测与分析,是一种将电化学分析与传感技术结合所产生的一种传感器件,其检测原理是基于被测物质影响电极体系的电化学信号,从而实现对被测物质的定量分析。目前的研究中金属离子作为标记物进行免疫检测通常采用质谱免疫分析法,采用电化学方法非常少。技术实现要素:本发明要解决的问题是提供一种提高检测灵敏度,方法稳定性高、重复性好、结果快速准确可靠的基于金属离子标记的电化学检测方法。为解决上述技术问题,本发明采用的技术方案是:包括三种同类方法,方法一、一种基于金属离子标记的电化学检测方法,包括以下过程:(1)金属离子材料标记待测物的一株抗体;(2)具有特异亲和性一对物质中的一个标记待测物的另一株抗体;(3)具有特异亲和性一对物质中的另一个标记纳米微球;(4)检测过程①将含有待测物的样本、金属离子材料标记的待测物的一株抗体和具有特异亲和性的一对物质中的一个标记待测物的另一株抗体加入到反应池中,经过3~90min的温育反应,形成一端标记有金属离子材料另一端标记有具有特异性亲和性的一对物质中的一个的免疫复合物;②然后向步骤①反应后的混合物中加入表面标记有具有特异亲和性的一对物质中的另一个的纳米微球,步骤①中免疫复合物一端的具有特异亲和性的一对物质中的一个与标记在纳米微球表面的具有特异性亲和性一对物质中的另一个进行特异性结合,形成表面结合了步骤①中的免疫复合物的纳米微球;③采用分离的方式将步骤②中表面结合了步骤①中的免疫复合物的纳米微球固定到工作电极表面,然后移除反应池中的剩余液体,加注电解液;④采用三电极体系或二电极体系进行测定,将电极正确的连接在电化学工作站上,利用电化学检测方法测定纳米微球表面的免疫复合物上金属离子的伏安曲线图,然后在测得的伏安曲线图中金属离子理论特征峰的±100mv范围内寻找实际特征峰,计算半峰面积,用半峰面积与待测物浓度之间用log-log回归方程进行拟合制备标准曲线,通过标准曲线计算待测物的含量。方法二、一种基于金属离子标记的电化学检测方法,包括以下过程:(1)金属离子材料标记待测物的一株抗体;(2)具有特异亲和性一对物质中的一个标记待测物的完全抗原;(3)具有特异亲和性一对物质中的另一个标记纳米微球;(4)检测过程①将含有待测物的样本、金属离子材料标记的待测物的一株抗体和具有特异亲和性的一对物质中的一个标记的待测物的完全抗原加入到反应池中,待测物和具有特异亲和性的一对物质中的一个标记的待测物完全抗原竞争与金属离子材料标记的待测物的一株抗体发生免疫反应,经过3~90min的温育反应,形成一端标记金属离子材料另一端标记有具有特异性亲和性的一对物质中的一个的第一免疫复合物和一端标记有金属离子材料的第二免疫复合物;②然后向步骤①反应后的混合物中加入表面标记的具有特异亲和性的一对物质中的另一个的纳米微球,步骤①中第一免疫复合物一端的具有特异亲和性的一对物质中的一个与纳米微球表面标记的具有特异亲和性的一对物质中的另一个进行特异性结合,形成表面结合了第一免疫复合物的纳米微球,第二免疫复合物不参加反应;③采用分离的方式将步骤②中表面结合了第一免疫复合物的纳米微球固定到工作电极表面,然后移除反应池中的剩余液体,加注电解液;④采用三电极体系或二电极体系进行测定,将电极正确的连接在电化学工作站上,利用电化学检测方法测定纳米微球表面的免疫复合物上的金属离子的伏安曲线图,然后在测得的伏安曲线图中金属离子理论特征峰的±100mv范围内寻找实际特征峰,计算半峰面积,用半峰面积与待测物浓度之间用logit-log回归方程进行拟合制备标准曲线,通过标准曲线计算待测物的含量。方法三、一种基于金属离子标记的电化学检测方法,包括以下过程:(1)金属离子材料标记待测物的完全抗原;(2)具有特异亲和性一对物质中的一个标记待测物的一株抗体;(3)具有特异亲和性一对物质中的另一个标记纳米微球;(4)检测过程①将含有待测物的样本、金属离子材料标记的待测物的一株完全抗原和具有特异亲和性的一对物质中的一个标记的待测物的一株抗体加入到反应池中,待测物和金属离子材料标记的待测物完全抗原竞争与具有特异亲和性的一对物质中的一个标记的待测物的一株抗体发生免疫反应,经过3~90min的温育反应,形成一端标记有金属离子材料另一端标记有具有特异性亲和性的一对物质中的一个的第一免疫复合物和一端标记有具有特异性亲和性的一对物质中的一个的第二免疫复合物;②然后向步骤①反应后的混合物中加入表面标记的具有特异亲和性的一对物质中的另一个的纳米微球,步骤①中第一免疫复合物和第二免疫复合物一端的具有特异亲和性的一对物质中的一个分别与纳米微球表面标记的具有特异亲和性的一对物质中的另一个进行特异性结合,形成表面结合了第一免疫复合物和第二免疫复合物的纳米微球;③采用分离的方式将步骤②中表面结合了第一免疫复合物和第二免疫复合物的纳米微球固定到工作电极表面,然后移除反应池中的剩余液体,加注电解液;④采用三电极体系或二电极体系进行测定,将电极正确的连接在电化学工作站上,利用电化学检测方法测定纳米微球表面的免疫复合物上的金属离子的伏安曲线图,然后在测得的伏安曲线图中金属离子理论特征峰的±100mv范围内寻找实际特征峰,计算半峰面积,用半峰面积与待测物浓度之间用logit-log回归方程进行拟合制备标准曲线,通过标准曲线计算待测物的含量。所述金属离子材料为表面或内部含有金属的微球;所述金属离子为cd2+、cu2+、zn2+、mn2+、pb2+、ag+、li+、hg2+、co2+、cr3+、ni2+、au3+、ba2+等离子中的一种;所述微球材质为聚苯乙烯、聚四氟乙烯微球、二氧化钛、二氧化锰、二氧化锆、有机硅、聚酰胺、聚丙烯酸、壳聚糖、聚苯胺、聚氯乙烯、钴、镍、铂、金、银、钯、二氧化硅等。所述纳米微球的材质为聚苯乙烯微球、聚四氟乙烯微球、二氧化硅微球、二氧化钛微球、有机硅、聚酰胺、聚丙烯酸、壳聚糖、聚苯胺、聚氯乙烯、磁性微球。所述分离方式为离心分离、电场或毛细管作用;或者当纳米微球的材质为磁性微球时,则所述分离方式采用磁分离的方式;所述磁性微球为磁性的fe3o4、γ-fe2o3、pt、ni或co微球,或者为磁性的fe3o4、γ-fe2o3、pt、ni或co与无机物或有机物形成的核/壳结构或掺杂结构的微球。所述金属离子材料的粒径为1~500nm,纳米微球的粒径为50nm~5μm。所述具有特异亲和性的一对物质为生物素和链酶亲和素、生物素和亲和素、荧光素和抗荧光素、抗体和特异性结合此抗体的二抗。在步骤③中,移除反应池中的剩余液体后可采用pb缓冲液洗涤2~3遍,再加注电解液。所述的三电极体系包括工作电极、对电极和参比电极;所述二电极体系包括工作电极和对电极;所述工作电极为铜电极、碳电极、玻碳电极、金微电极等,或者在上述电极里掺杂石墨烯的电极,或者在上述电极表面涂覆石墨烯的电极;所述对电极为铂丝电极等;所述参比电极为甘汞电极、ag/agcl电极等。所述电解液为0.01m~0.6m、ph=7.4的磷酸缓冲溶液;0.01m~0.6m、ph=3~7的柠檬酸缓冲溶液;0.01m~0.6m、ph=2~7的醋酸缓冲溶液;由0.1mm~1m的k3[fe(cn)6]/k4[fe(cn)6]和0.1mm~1m的kcl组成的铁氰化钾电解液。所述电化学检测方法为循环伏安法、微分伏安法、差分脉冲伏安法、交流阻抗谱图法、阳极溶出伏安法或者微分脉冲阳极溶出伏安法等。由于采用上述技术方案,采用金属离子作为标记材料,利用金属离子的电化学特性以及电化学法对重金属离子检测的高度灵敏性,可以大大提高检测灵敏度,该方法稳定性高、重复性好、结果准确可靠,实现了快速、灵敏检测的目的,拓展了基于金属离子标记的电化学检测方法在体外诊断领域中的应用。与传统电化学检测中直接将待测物抗体或抗原包被于电极表面相比,本发明中采用纳米微球收集免疫复合物,然后通过分离将带有免疫复合物的纳米微球富集于电极表面,有利于减小实验误差,提高检测灵敏度。附图说明下面通过参考附图并结合实例具体地描述本发明,本发明的优点和实现方式将会更加明显,其中附图所示内容仅用于对本发明的解释说明,而不构成对本发明的任何意义上的限制,在附图中:图1为本发明方法一检测过程中步骤①和步骤②反应过程示意图图2为本发明方法一检测过程中步骤③和步骤④检测示意图图3为本发明方法二检测过程中步骤①和步骤②反应过程示意图图4为本发明方法二检测过程中步骤③和步骤④检测示意图图5为本发明方法三检测过程中步骤①和步骤②反应过程示意图图6为本发明方法三检测过程中步骤③和步骤④检测示意图图7为本发明实施例二中检测不同浓度ft3的校准品后测得的cd2+的伏安曲线图,a-0pg/ml,b-1.8pg/ml,c-4.5pg/ml,d-7.5pg/ml,e-12pg/ml,f-40pg/ml图8为本发明实施例方法一中afp的标准曲线图图9为本发明实施例方法二中ft3的标准曲线图图10为本发明实施例方法三中ft3的标准曲线图图1和图2中:1-待测物2-具有特异亲和性一对物质中的一个标记待测物的一株抗体3-金属离子材料标记待测物的另一株抗体4-一端标记有金属离子材料、另一端标记有具有亲和性一对物质中的一个的免疫复合物5-具有特异亲和性一对物质中的另一个标记的纳米微球6-表面结合了步骤①中的免疫复合物的纳米微球7-反应池8-工作电极,9-表面结合了步骤中①免疫复合物的纳米微球10-电解液11-对电极图3和图4中:1-待测物2-金属离子材料标记待测物的一株抗体3-具有特异亲和性一对物质中的一个标记待测物的完全抗原4-第二免疫复合物5-第一免疫复合物6-具有特异亲和性一对物质中的另一个标记的纳米微球7-外表面结合了第一免疫复合物的纳米微球8-反应池9-工作电极10-外表面结合了第一免疫复合物的纳米微球11-电解液,12-对电极图5和图6中:1-待测物2-金属离子材料标记待测物的一株完全抗原3-具有特异亲和性的一对物质中的一个标记待测物的一株抗体4-第一免疫复合物5-第二免疫复合物6-表面标记具有特异亲和性一对物质中的另一个的纳米微球7-表面结合了第一免疫复合物和第二免疫复合物的纳米微球8-反应池9-工作电极10-表面结合了第一免疫复合物和第二免疫复合物的纳米微球11-电解液12-对电极具体实施方式方法一:如图1和图2所示,实施例:以检测甲胎蛋白(afp)为例1.包埋铜离子的聚苯乙烯微球的制备:将10g苯乙烯单体、1g十二烷基硫酸钠、100ml纯化水,1g氯化铜粉末搅拌混匀,放置于75℃温育箱中,通入氮气持续鼓气混匀;随后将1g过硫酸钾溶解于5ml纯化水中,以0.1ml/分钟的速度添加到反应液中,在氮气保护下反应50min;反应结束后,加入100ml冰水混合液,将反应液温度迅速降低到40℃以下;将反应液10000r/min离心3次,每次30分钟,用95%乙醇复溶并洗涤。最后用100ml纯化水复溶;将复溶后的材料置于50℃水浴中高速搅拌,加入硫酸和硝酸的混合酸(v/v=3:2)反应2h,将反应物10000r/min离心,去除上清液,用纯化水洗涤并复溶至100毫升,重复该步骤3次。最后将复溶后的材料转移至75℃恒温箱中加入2gnaoh和2gna2s2o4,搅拌反应4h后10000r/min离心去除上清液,用纯化水洗涤并复溶至100毫升,重复该步骤3次,,记作铜离子材料。2.铜离子材料标记一株鼠抗人afp单克隆抗体:先用碳酸钠缓冲液将一株鼠抗人afp单克隆抗体稀释成1mg/ml,并用碳酸钠缓冲液室温(25℃±5℃)避光搅拌4小时后透析;在5ml制备的铜离子材料中加入1ml一株鼠抗人afp单克隆抗体溶液,在25℃±5℃下避光磁力搅拌30min,然后混合溶液转入透析袋,用磷酸缓冲液4℃透析过夜。最后取出加等量甘油-20℃保存即可。3.生物素标记另一株鼠抗人afp单克隆抗体:先用碳酸钠缓冲液将另一株鼠抗人afp单克隆抗体稀释成1mg/ml,并用碳酸钠缓冲液室温(25℃±5℃)避光搅拌4小时后透析;随后用n,n-二甲基酰胺(dmf)将6–氨基己酸-n羟基琥珀酰亚胺-生物素(bcnhs)配置成1mg/ml;在1ml的另一株鼠抗人afp单克隆抗体溶液中加入上述dmf溶液80μl,玻璃瓶中混合,室温(25℃±5℃)避光搅拌2小时;加入1mol/l氯化铵溶液9.6μl,室温(25℃±5℃)避光搅拌10分钟;然后混合溶液转入透析袋,用磷酸缓冲液4℃透析过夜。最后取出加等量甘油-20℃保存即可。4.链酶亲和素标记的磁性微球:取0.5ml,2.5mg/ml磁性微球(粒径为800nm,购自天津赛尔群科技有限公司)用磷酸缓冲溶液(ph=7.4)洗涤2次后重悬于10ml的磷酸缓冲溶液中,继续加入4ml的戊二醛室温震荡反应10h,反应结束后用大量的纯化水进行洗涤,将磁性微球重悬于10ml的磷酸缓冲溶液中;将0.5mg的链酶亲和素溶于1ml的磷酸缓冲溶液中,然后加入磁性微球的磷酸缓冲溶液中,室温震荡8h,用磷酸缓冲溶液洗涤后分散在10ml的磷酸缓冲溶液中备用。5.检测过程:(1)将10μl含有afp的待测样本、10μl的铜离子材料标记的一株鼠抗人afp单克隆抗体和10μl生物素标记另一株鼠抗人afp单克隆抗体加入到反应池中,经过30min的温育反应,形成一端标记有铜离子材料、另一端标记有生物素的afp免疫复合物;(2)然后向步骤(1)反应后的混合物中加入10μl表面标记有链酶亲和素的磁性微球,标记在afp免疫复合物一端的生物素与标记在磁性微球表面的链酶亲和素进行特异性结合,表面结合了afp免疫复合物的磁性微球;(3)采用磁分离的方式将步骤②中表面结合了afp免疫复合物的纳米微球固定到工作电极(石墨烯电极)表面,然后移除反应池中的剩余液体,采用pb缓冲液洗涤3遍,并加注50μl醋酸电解液;(4)采用三电极体系进行测定,将工作电极(石墨烯电极)、对电极(铂电极)和参比电极(甘汞电极)正确的连接在电化学工作站上,利用溶出伏安法测定磁性微球表面的免疫复合物上的铜离子的伏安曲线图,然后在测得的伏安曲线图中铜金属离子理论特征峰的±100mv范围内寻找实际特征峰,计算半峰面积,用半峰面积与afp浓度之间用log-log回归方程进行拟合制备afp标准曲线,通过标准曲线计算afp的含量。6.标准曲线的建立:配置浓度为0、5、15、50、150、600ng/ml的的afp校准品用于建立afp标准曲线,检测灵敏度为5ng/ml,检测范围为5~600ng/ml,检测数据如表1所示,标准曲线如图8所示。表1检测数据标准浓度(ng/ml)积分面积010256751518255071361502127060081493方法二:如图3和图4所示,实施例:以检测游离三碘甲状腺原氨酸(ft3)为例1.包埋镉离子的聚苯乙烯微球的制备:将10g苯乙烯单体、1g十二烷基硫酸钠、100ml纯化水,1g氯化镉粉末搅拌混匀,放置于75℃温育箱中,通入氮气持续鼓气混匀;随后将1g过硫酸钾溶解于5ml纯化水中,以0.1ml/分钟的速度添加到反应液中,在氮气保护下反应50min;反应结束后,加入100ml冰水混合液,将反应液温度迅速降低到40℃以下;将反应液10000r/min离心3次,每次30分钟,用95%乙醇复溶并洗涤。最后用100ml纯化水复溶;将复溶后的材料置于50℃水浴中高速搅拌,加入硫酸和硝酸的混合酸(v/v=3:2)反应2h,将反应物10000r/min离心,去除上清液,用纯化水洗涤并复溶至100毫升,重复该步骤3次。最后将复溶后的材料转移至75℃恒温箱中加入2gnaoh和2gna2s2o4,搅拌反应4h后10000r/min离心去除上清液,用纯化水洗涤并复溶至100毫升,重复该步骤3次,形成内部和表面含有cd2+的聚苯乙烯微球,记作镉离子材料。2.镉离子材料标记一株鼠抗人ft3单克隆抗体:先用碳酸钠缓冲液将一株鼠抗人ft3单克隆抗体稀释成1mg/ml,并用碳酸钠缓冲液室温(25℃±5℃)避光搅拌4小时后透析;在5ml制备的镉离子材料中加入1ml一株鼠抗人ft3单克隆抗体溶液,在25℃±5℃下避光磁力搅拌30min,然后混合溶液转入透析袋,用磷酸缓冲液4℃透析过夜。最后取出加等量甘油-20℃保存即可。3.生物素标记一株ft3完全抗原:先用碳酸钠缓冲液将一株ft3完全抗原稀释成1mg/ml,并用碳酸钠缓冲液室温(25℃±5℃)避光搅拌4小时后透析;随后用n,n-二甲基酰胺(dmf)将6–氨基己酸-n羟基琥珀酰亚胺-生物素(bcnhs)配置成1mg/ml;在1ml一株ft3完全抗原溶液中加入上述dmf溶液80μl,玻璃瓶中混合,室温(25℃±5℃)避光搅拌2小时;加入1mol/l氯化铵溶液9.6μl,室温(25℃±5℃)避光搅拌10分钟;然后混合溶液转入透析袋,用磷酸缓冲液4℃透析过夜。最后取出加等量甘油-20℃保存即可。4.链酶亲和素标记的磁性纳米微球:取0.5ml,2.5mg/ml磁性微球(粒径为800nm,购自天津赛尔群科技有限公司)用磷酸缓冲溶液(ph=7.4)洗涤2次后重悬于10ml的磷酸缓冲溶液中,继续加入4ml的戊二醛室温震荡反应10h,反应结束后用大量的纯化水进行洗涤,将磁性微球重悬于10ml的磷酸缓冲溶液中;将0.5mg的链酶亲和素溶于1ml的磷酸缓冲溶液中,然后加入磁性微球的磷酸缓冲溶液中,室温震荡8h,用磷酸缓冲溶液洗涤后分散在10ml的磷酸缓冲溶液中备用。5.检测过程:(1)将10μl含有ft3的待测样本、20μl的镉离子材料标记一株鼠抗人ft3单克隆抗体和10μl生物素标记的一株ft3完全抗原加入到反应池中,样本中的ft3和生物素标记的一株ft3完全抗原竞争与镉离子标记一株鼠抗人ft3单克隆抗体发生免疫反应,经过30min的温育反应,形成一端标记有镉离子、另一端标记有生物素的第一ft3免疫复合物和一端标记有镉离子的第二ft3免疫复合物;(2)然后向步骤(1)反应后的混合物中加入10μl表面标记有链酶亲和素的磁性纳米微球,标记在第一ft3免疫复合物一端的生物素与标记在磁性纳米微球表面的链酶亲和素进行特异性结合,形成磁性微球表面结合了第一ft3免疫复合物;(3)采用磁分离的方式将步骤(2)中表面结合了第一ft3免疫复合物的磁性微球固定到工作电极(石墨烯电极)表面,然后移除反应池中的剩余液体,采用pb缓冲液洗涤3遍,并加注50μl醋酸电解液;(4)采用三电极体系进行测定,将工作电极(石墨烯电极)、对电极(铂电极)和参比电极(甘汞电极)正确的连接在电化学工作站上,利用溶出伏安法测定磁性微球表面的第一ft3免疫复合物上的镉离子的伏安曲线图,然后在测得的伏安曲线图中镉离子理论特征峰的±100mv范围内寻找实际特征峰,计算半峰面积,用半峰面积与ft3浓度之间用logit-log回归方程进行拟合制备ft3标准曲线,通过标准曲线计算ft3的含量。5.标准曲线的建立配置浓度为0、1.8、4.5、7.5、12、40pg/ml的ft3校准品用于建立ft3标准曲线,检测灵敏度为1.8pg/ml,检测范围为1.8~40pg/ml,检测数据如表2所示,标准曲线如图9所示。表2检测数据标准浓度(pg/ml)积分面积065491.862314.543267.5254512119740245方法三:如图5和图6所示,实施例:以检测游离三碘甲状腺原氨酸(ft3)为例1.包埋镉离子的聚苯乙烯微球的制备:将10g苯乙烯单体、1g十二烷基硫酸钠、100ml纯化水,1g氯化铜粉末搅拌混匀,放置于75℃温育箱中,通入氮气持续鼓气混匀;随后将1g过硫酸钾溶解于5ml纯化水中,以0.1ml/分钟的速度添加到反应液中,在氮气保护下反应50min;反应结束后,加入100ml冰水混合液,将反应液温度迅速降低到40℃以下;将反应液10000r/min离心3次,每次30分钟,用95%乙醇复溶并洗涤。最后用100ml纯化水复溶;将复溶后的材料置于50℃水浴中高速搅拌,加入硫酸和硝酸的混合酸(v/v=3:2)反应2h,将反应物10000r/min离心,去除上清液,用纯化水洗涤并复溶至100毫升,重复该步骤3次。最后将复溶后的材料转移至75℃恒温箱中加入2gnaoh和2gna2s2o4,搅拌反应4h后10000r/min离心去除上清液,用纯化水洗涤并复溶至100毫升,重复该步骤3次,,记作铜离子材料。2.镉离子材料标记一株ft3完全抗原:先用碳酸钠缓冲液将一株ft3完全抗原稀释成1mg/ml,并用碳酸钠缓冲液室温(25℃±5℃)避光搅拌4小时后透析;在5ml制备的镉离子材料中加入1ml一株ft3完全抗原溶液,在25℃±5℃下避光磁力搅拌30min,然后混合溶液转入透析袋,用磷酸缓冲液4℃透析过夜。最后取出加等量甘油-20℃保存即可。3.生物素标记一株鼠抗人ft3单克隆抗体先用碳酸钠缓冲液将一株鼠抗人ft3单克隆抗体稀释成1mg/ml,并用碳酸钠缓冲液室温(25℃±5℃)避光搅拌4小时后透析;随后用n,n-二甲基酰胺(dmf)将6–氨基己酸-n羟基琥珀酰亚胺-生物素(bcnhs)配置成1mg/ml;在1ml一株鼠抗人ft3单克隆抗体溶液中加入上述dmf溶液80μl,玻璃瓶中混合,室温(25℃±5℃)避光搅拌2小时;加入1mol/l氯化铵溶液9.6μl,室温(25℃±5℃)避光搅拌10分钟;然后混合溶液转入透析袋,用磷酸缓冲液4℃透析过夜。最后取出加等量甘油-20℃保存即可。4.链酶亲和素标记的磁性微球纳米微球:取0.5ml,2.5mg/ml磁性微球(粒径为800nm,购自天津赛尔群科技有限公司)用磷酸缓冲溶液(ph=7.4)洗涤2次后重悬于10ml的磷酸缓冲溶液中,继续加入4ml的戊二醛室温震荡反应10h,反应结束后用大量的纯化水进行洗涤,将磁性微球重悬于10ml的磷酸缓冲溶液中;将0.5mg的链酶亲和素溶于1ml的磷酸缓冲溶液中,然后加入磁性微球的磷酸缓冲溶液中,室温震荡8h,用磷酸缓冲溶液洗涤后分散在10ml的磷酸缓冲溶液中备用。5.检测过程:(1)将10μl含有ft3的待测物样本、20μl的镉离子材料标记的一株ft3完全抗原和10μl生物素标记的一株鼠抗人ft3单克隆抗体加入到反应池中,样本中的ft3和cdse标记的ft3完全抗原竞争与生物素标记的一株鼠抗人ft3单克隆抗体发生反应,经过3~90min的温育反应,形成一端标记有镉离子材料、另一端标记有生物素的第一ft3免疫复合物和一端标记有生物素的第二ft3免疫复合物;(2)然后向步骤(1)反应后的混合物中加入10μl表面标记有链酶亲和素的磁性微球纳米微球,标记在第一ft3免疫复合物和第二ft3免疫复合物一端的生物素分别与标记在磁性纳米微球表面的链酶亲和素发生特异性结合,形成磁性微球表面结合了第一ft3免疫复合物和第二ft3免疫复合物。(3)采用磁分离的方式将步骤(2)中表面结合了第一ft3免疫复合物和第二ft3免疫复合物的磁性微球固定到工作电极(石墨烯电极)表面,然后移除反应池中的剩余液体,用pb缓冲溶液洗涤三次,并加注50μl醋酸电解液。(4)采用三电极体系进行测定,将工作电极(石墨烯电极)、对电极(铂电极)和参比电极(甘汞电极)正确的连接在电化学工作站上,利用溶出伏安法测定磁性微球表面的第一ft3免疫复合物上镉离子的伏安曲线图,然后在测得的伏安曲线图中镉离子理论特征峰的±100mv范围内寻找实际特征峰,计算半峰面积,用半峰面积与ft3浓度之间用logit-log回归方程进行拟合制备ft3标准曲线,通过标准曲线计算ft3的含量。5.标准曲线的建立配置浓度为0、1.8、4.5、7.5、12、40pg/ml的ft3校准品校准品用于建立ft3标准曲线,检测灵敏度为1.8pg/ml,检测范围为1.8~40pg/ml,检测数据如表3所示,标准曲线如图10所示。表3检测数据此外,以上三个实施例中所需溶液配制为(1)pb缓冲溶液纯化水定容至1000ml;(2)碳酸钠缓冲溶液碳酸钠0.99g碳酸氢钠2.96g纯化水定容至1000ml;(3)磷酸缓冲溶液碳酸钠0.99g碳酸氢钠5.16g纯化水定容至1000ml。以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明范围所作的均等变化与改进等,均应仍归属于本专利涵盖范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1