用于分析白细胞的试剂、体系及方法与流程
交叉引用
本申请要求2013年3月12日提交的美国临时专利申请第61/777,966号的权益,该申请通过引用整体并入本文。
背景
使用自动血液分析仪精确计数并分类全血样品中的白细胞(wbc)是一个重要的诊断过程。通常,通过同时裂解全血样品中的红细胞(rbc,红血球(erythrocyte))并保存全血样品中的wbc来实现wbc分析。现代血液分析仪中通常需要一种或多种wbc试剂来进行这些功能并有助于wbc的分析。
wbc计数和差异化的质量高度依赖于用来进行该分析的方法和相关试剂。配制稳健的wbc分析试剂仍是血液学行业的最大挑战之一。原则上,稳健的wbc试剂导致准确的wbc分析。理想地,精心配制的wbc试剂应有助于(1)在标准条件下彻底裂解红细胞(rbc),通常在约30秒或更少的时间框架中;(2)将大的红细胞片段破坏或溶解成较小的块;和(3)保护来自rbc裂解工艺的wbc,使得wbc能够被精确地计数并适当地分类。
如果血样不能充分裂解,那么未裂解的rbc(即使是非常小的百分比或浓度)或较大的rbc片段能够干扰wbc分析,因为使用传统的wbc分析技术难以从淋巴细胞(最小的wbc)中分离或区分rbc或较大的rbc。如果血液样本被过裂解,那么通过过度损坏wbc的细胞膜会大大影响wbc的分类。因此,需要能够实现这些目标的改善的wbc的分析试剂、体系和方法。
发明概述
本公开的各方面包括可以用于分析全血样品以鉴定、分类和/或定量样品中的白血球(wbc)和wbc亚群的wbc分析试剂、体系和方法。本发明的wbc分析试剂通常包括至少一种膜可渗透的荧光染料、wbc保护剂和表面活性剂。在一些实施方案中,所述wbc试剂包括适量的渗透压调节组分来调节所述wbc试剂的渗透压至所需的范围之内。
在一些实施方案中,本公开提供了使用自动血液分析仪进行白血细胞(wbc)分析的方法,所述方法包括:(a)用wbc分析试剂稀释全血样品,其中所述wbc分析试剂包含:标记样品中的多个含核细胞的膜可渗透的荧光染料;和当使用血液分析仪分析时将多个wbc亚群彼此分离的渗透压调节组分;(b)在范围为约30℃至约50℃的温度下孵育步骤(a)的稀释血样小于约25秒的孵育时间;(c)将来自步骤(b)的经孵育的样品递送至血液分析仪的流动池;(d)当来自步骤(c)的经孵育的样品穿过流动池时,使用激发源将所述样品激发;(e)收集来自被激发的样品的多个光散射信号和至少一个荧光发射信号;和(f)进行基于在步骤(e)中收集的所有信号的wbc差异分析,同时基于所述至少一个荧光发射信号排除对所述稀释血样内的不满足荧光阈值的任何颗粒的考虑。
在一些实施方案中,所述激发源具有约350nm至约700nm的波长。在一些实施方案中,所述荧光发射信号通过带通滤光器或长通滤光器在约360nm至约750nm的波长下收集。在一些实施方案中,所述试剂中的膜可渗透的荧光染料为吖啶橙、碘化己锭、sytornaselect、syto12或syto14。在一些实施方案中,所述试剂中的膜可渗透的荧光染料的浓度范围为约0.0001%至约0.0005%。在一些实施方案中,所述试剂中的膜可渗透的荧光染料的浓度为约0.01μm至约15μm。在一些实施方案中,所述渗透压调节组分为氯化铵或氯化钠。在一些实施方案中,所述渗透压调节组分的浓度范围为约0.1%至约0.5%。在一些实施方案中,所述试剂还包含wbc保护剂。在一些实施方案中,所述wbc保护剂为甲醛、戊二醛、丁氧基乙醇、苯氧基乙醇或异丙醇。在一些实施方案中,所述wbc保护剂的浓度范围为约0.1%至约1.0%。在一些实施方案中,所述wbc分析试剂还包含表面活性剂。在一些实施方案中,所述表面活性剂为皂角苷。在一些实施方案中,所述表面活性剂的浓度范围为约0.01%至约0.05%。在一些实施方案中,所述试剂还包括ph缓冲组分。在一些实施方案中,所述ph缓冲组分为醋酸钠或碳酸氢钠。在一些实施方案中,所述ph缓冲组分的浓度范围为约0.01%至约0.5%。在一些实施方案中,所述试剂还包含抗微生物剂。在一些实施方案中,所述抗微生物剂为proclin。在一些实施方案中,所述抗微生物剂的浓度范围为约0.01%至约0.1%。在一些实施方案中,所述wbc分析试剂的ph范围为约2.5至约12.5ph单位。在一些实施方案中,所述wbc分析试剂的渗透压范围为约25至约350mosm。
在一些实施方案中,本公开提供了用于对全血样品进行白血细胞(wbc)差异分析的体系,所述体系包括:(a)血液分析仪,所述血液分析仪包括:被布置成激发血样中颗粒的激发源;多个检测器,包括(1)被布置成测量来自被激发的血样的轴向光损失的轴向光损失检测器、(2)被布置成测量来自被激发的血样的中等角度散射的中等角度散射检测器、(3)被布置成测量来自被激发的血样的大角度偏振侧向散射的偏振侧向散射检测器、(4)被布置成测量来自被激发的血样的大角度消偏振侧向散射的消偏振侧向散射检测器和(5)被布置成测量自被激发的血样发射的荧光的荧光检测器;和处理器,其被配置成:(i)从多个检测器接收(1)轴向光损失、(2)中等角度散射、(3)大角度偏振侧向散射、(4)大角度消偏振侧向散射和(5)荧光的测量结果,以及(ii)基于所有五个测量,针对发射高于荧光阈值的荧光的颗粒进行血样的wbc差异分析;和(b)用于分析所述样品中wbc的试剂,所述试剂包含:膜可渗透的荧光染料;和渗透压调节组分;其中所述膜可渗透的荧光染料的浓度足以有助于使用所述血液分析仪鉴定含有细胞核的样品中的一种或多种细胞;并且其中所述渗透压调节组分的浓度足以有助于使用所述血液分析仪鉴定样品中的多个wbc亚群。
在一些实施方案中,所述膜可渗透的荧光染料为吖啶橙、碘化己锭、sytornaselect、syto12或syto14。在一些实施方案中,所述试剂中膜可渗透的荧光染料的浓度范围为约0.0001%至约0.0005%。在一些实施方案中,所述试剂中的膜可渗透的荧光染料的浓度范围为约0.01μm至约15μm。在一些实施方案中,所述渗透压调节组分为氯化铵或氯化钠。在一些实施方案中,所述渗透压调节组分的浓度范围为约0.1%至约0.5%。在一些实施方案中,所述试剂还包含wbc保护剂。在一些实施方案中,所述wbc保护剂为甲醛、戊二醛、丁氧基乙醇、苯氧基乙醇或异丙醇。在一些实施方案中,所述wbc保护剂的浓度范围为约0.1%至约1.0%。在一些实施方案中,所述wbc分析试剂还包含表面活性剂。在一些实施方案中,所述表面活性剂为皂角苷。在一些实施方案中,所述表面活性剂的浓度范围为约0.01%至约0.05%。在一些实施方案中,所述试剂还包括ph缓冲组分。在一些实施方案中,所述ph缓冲组分为醋酸钠或碳酸氢钠。在一些实施方案中,所述ph缓冲组分的浓度范围为约0.01%至约0.5%。在一些实施方案中,所述试剂还包含抗微生物剂。在一些实施方案中,所述抗微生物剂为proclin。在一些实施方案中,所述抗微生物剂的浓度范围为约0.01%至约0.1%。在一些实施方案中,所述试剂的ph范围为约2.5至约12.5ph单位。在一些实施方案中,所述试剂的渗透压范围为约25至约350mosm。
在一些实施方案中,所述处理器被进一步配置成预筛选所接收的测量结果以排除对不满足荧光阈值的颗粒的考虑。在一些实施方案中,轴向光损失检测器测量在0°散射处的轴向光损失。在一些实施方案中,中等角度散射检测器测量在约3°至约15°处的光角散射。在一些实施方案中,所述多个检测器包括一个或多个光电倍增管。在一些实施方案中,激发源是激光器。在一些实施方案中,激光器在对应于荧光染料的波长下发射光。在一些实施方案中,选择荧光染料以与激发源相对应。
在一些实施方案中,所述体系还包括用于用所述试剂稀释血样的孵育子体系(subsystem)。在一些实施方案中,所述孵育子体系被配置成用所述试剂孵育血样少于约25秒的时间段。在一些实施方案中,所述孵育子体系被配置成用所述试剂孵育血样少于约17秒的时间段。在一些实施方案中,所述孵育子体系被配置成用所述试剂孵育血样少于约9秒的时间段。在一些实施方案中,所述孵育子体系被配置成在范围为约30℃至约50℃的温度下用所述试剂孵育血样。在一些实施方案中,所述孵育子体系被配置成在约40℃的温度下用所述试剂孵育血样。
在一些实施方案中,本公开提供了用于使用血液分析仪分析全血样品中的白血细胞(wbc)的试剂,所述试剂包含:足以有助于使用所述血液分析仪鉴定含有细胞核的样品中多个细胞的浓度的膜可渗透的荧光染料;和足以有助于使用所述血液分析仪鉴定样品中的多个wbc亚群的浓度的渗透压调节组分。
在一些实施方案中,所述膜可渗透的荧光染料为吖啶橙、碘化己锭、sytornaselect、syto12或syto14。在一些实施方案中,所述试剂中的膜可渗透的荧光染料的浓度范围为约0.0001%至约0.0005%。在一些实施方案中,所述试剂中的膜可渗透的荧光染料的浓度范围为约0.01μm至约15μm。在一些实施方案中,所述渗透压调节组分为氯化铵或氯化钠。在一些实施方案中,所述渗透压调节组分的浓度范围为约0.1%至约0.5%。在一些实施方案中,所述试剂还包含wbc保护剂。在一些实施方案中,所述wbc保护剂为甲醛、戊二醛、丁氧基乙醇、苯氧基乙醇或异丙醇。在一些实施方案中,所述wbc保护剂的浓度范围为约0.1%至约1.0%。在一些实施方案中,所述wbc分析试剂还包含表面活性剂。在一些实施方案中,所述表面活性剂为皂角苷。在一些实施方案中,所述表面活性剂的浓度范围为约0.01%至约0.05%。
在一些实施方案中,所述试剂还包括ph缓冲组分。在一些实施方案中,所述ph缓冲组分为醋酸钠或碳酸氢钠。在一些实施方案中,所述ph缓冲组分的浓度范围为约0.01%至约0.5%。在一些实施方案中,所述试剂还包含抗微生物剂。在一些实施方案中,所述抗微生物剂为proclin。在一些实施方案中,所述抗微生物剂的浓度范围为约0.01%至约0.1%。在一些实施方案中,所述wbc分析试剂的ph范围为约2.5至约12.5ph单位。在一些实施方案中,所述wbc分析试剂试剂的渗透压范围为约25至约350mosm。
附图说明
并入本文的附图形成了说明书的部分。结合此书面说明书,附图还起到解释本文所述的试剂、体系和方法的原理,并使本领域技术人员能够配制并使用本文所述的试剂、体系和方法。附图中,相似的附图标记表示相同或功能相似的元素。
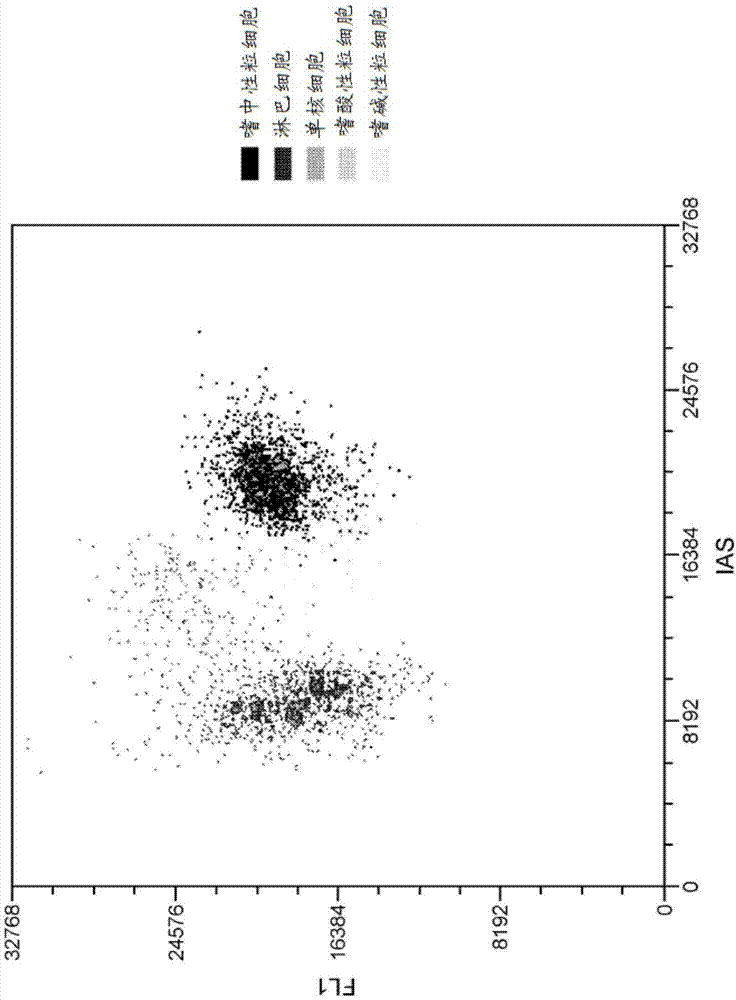
图1示出了使用含有3.8μm吖啶橙作为荧光染料的wbc分析试剂得到的wbc散点图(fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图2示出了使用含有1.3μm碘化己锭作为荧光染料的wbc分析试剂得到的wbc散点图(fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图3示出了使用含有1.3μmsytornaselect作为荧光染料的wbc分析试剂得到的wbc散点图(fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图4示出了使用含有1.3μmsyto12作为荧光染料的wbc分析试剂得到的wbc散点图(fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图5示出了使用含有1.3μmsyto14作为荧光染料的wbc分析试剂得到的wbc散点图(fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图6a示出了使用含有11.3μm(1x)的浓度的吖啶橙作为荧光染料的wbc分析试剂得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图6b示出了使用含有1.13μm(0.1x)的浓度的吖啶橙作为荧光染料的wbc分析试剂得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图6c示出了使用含有0.11μm(0.01x)的浓度的吖啶橙作为荧光染料的wbc分析试剂得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图6d示出了使用含有0.022μm(0.002x)的浓度的吖啶橙作为荧光染料的wbc分析试剂得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图7a示出了使用含有0.22%甲醛的wbc分析试剂(与实施例wbc分析试剂#1相同的配制物)得到的两幅wbc散点图(all对ias和fl1对all)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图7b示出了使用含有0.22%甲醛的wbc分析试剂(与实施例wbc分析试剂#1相同的配制物)得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图7c示出了使用含有0.22%甲醛的wbc分析试剂(与实施例wbc分析试剂#1相同的配制物)得到的两幅wbc散点图(pss对ias和fl1对pss)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图8a示出了使用含有0.2%戊二醛的wbc分析试剂(与实施例wbc分析试剂#6相同的配制物)得到的两幅wbc散点图(all对ias和fl1对all)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图8b示出了使用含有0.2%戊二醛的wbc分析试剂(与实施例wbc分析试剂#6相同的配制物)得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图8c示出了使用含有0.2%戊二醛的wbc分析试剂(与实施例wbc分析试剂#6相同的配制物)得到的两幅wbc散点图(pss对ias和fl1对pss)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图9a示出了使用含有0.5%丁氧基乙醇的wbc分析试剂(与实施例wbc分析试剂#7相同的配制物)得到的两幅wbc散点图(all对ias和fl1对all)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图9b示出了使用含有0.5%丁氧基乙醇的wbc分析试剂(与实施例wbc分析试剂#7相同的配制物)得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图9c示出了使用含有0.5%丁氧基乙醇的wbc分析试剂(与实施例wbc分析试剂#7相同的配制物)得到的两幅wbc散点图(pss对ias和fl1对pss)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图10a示出了使用含有0.5%苯氧基乙醇的wbc分析试剂(与实施例wbc分析试剂#8相同的配制物)得到的两幅wbc散点图(all对ias和fl1对all)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图10b示出了使用含有0.5%苯氧基乙醇的wbc分析试剂(与实施例wbc分析试剂#8相同的配制物)得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图10c示出了使用含有0.5%苯氧基乙醇的wbc分析试剂(与实施例wbc分析试剂#8相同的配制物)得到的两幅wbc散点图(pss对ias和fl1对pss)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图11a示出了使用含有0.5%异丙醇的wbc分析试剂(与实施例wbc分析试剂#9相同的配制物)得到的两幅wbc散点图(all对ias和fl1对all)。嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞示于散点图中。
图11b示出了使用含有0.5%异丙醇的wbc分析试剂(与实施例wbc分析试剂#9相同的配制物)得到的两幅wbc散点图(pss对all和fl1对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图11c示出了使用含有0.5%异丙醇的wbc分析试剂(与实施例wbc分析试剂#9相同的配制物)得到的两幅wbc散点图(pss对ias和fl1对pss)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图12a示出了使用含有0.5%氯化铵作为渗透压调节组分的wbc分析试剂得到的三幅wbc散点图(all对ias、pss对all和pss对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图12b示出了使用含有0.375%氯化铵作为渗透压调节组分的wbc分析试剂得到的三幅wbc散点图(all对ias、pss对all和pss对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图12c示出了使用含有0.25%氯化铵作为渗透压调节组分的wbc分析试剂得到的三幅wbc散点图(all对ias、pss对all和pss对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图12d示出了使用含有0.125%氯化铵作为渗透压调节组分的wbc分析试剂得到的三幅wbc散点图(all对ias、pss对all和pss对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。图12a-12d之间的比较示出了由散点图上wbc亚群的位置偏移得到的wbc分析试剂中氯化铵的浓度变化。
图13,小图a-e示出了使用含有不同浓度的氯化钠的wbc试剂得到的wbc散点图(all对ias)。小图a:不添加nacl;小图b:+0.033%nacl;小图c:+0.066%nacl;小图d:+0.100%nacl;小图e:+0.133%nacl。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。
图14为图示出适用于血液学分析的设备(包括流式细胞仪)的照明和检测光学器件的示意图。
详述
本发明的各方面包括可以用于分析全血样品以鉴定、分类和/或定量样品中的白血球(wbc)和wbc亚群的wbc分析试剂、体系和方法。本公开的wbc分析试剂通常包括至少一种膜可渗透的荧光染料、wbc保护剂和表面活性剂。在一些实施方案中,所述wbc试剂包括适量的渗透压调节组分来调节所述wbc试剂的渗透压至所需的范围之内。
在一些方面中,本文所公开的试剂、体系和方法被用来使用荧光染色和荧光触发策略筛选wbc。通过使用这种方法,来自未裂解的rbc(例如抗裂解的rbc,或“rstrbc”)和rbc片段的干扰被基本上或完全消除,因此,确保wbc和wbc亚群的精确计数和分类。本公开还提供了使用例如被配置成进行荧光触发方法的自动血液学分析仪有助于增强对wbc的分析的wbc分析试剂。本公开的wbc分析试剂也适用于分析含脆性淋巴细胞(或其它脆性wbc)的样品(包括老化的样品)。
在一些实施方案中,例如,本文所公开的方法涉及:将血样与包括至少一种膜可渗透的荧光染料、wbc保护剂、表面活性剂和足以分离由血液分析仪生成的散点图上的wbc亚群的浓度的渗透压调节组分的wbc分析试剂接触;在升高的温度下孵育具有wbc分析试剂的血样;用荧光染料将血样染色;在血液分析仪上使用荧光触发器(fluorescencetrigger)来筛选血样中的wbc;并且使用(1)轴向光损失、(2)中等角度散射、(3)大角度偏振侧向散射、(4)大角度消偏振侧向散射和(5)荧光发射的测量的组合来进行样品中wbc的差异分析(例如计数存在于样品中的多个wbc亚型或亚群中每一个的数目)。
结合本文所述的荧光触发器分析方法使用本文所述的荧光染料通过筛选出未被wbc试剂裂解的rbc提供了wbc分析中的异常灵敏度。这反过来又有助于使用更温和的wbc分析试剂(例如,在裂解样品中的rbc的过程中不裂解或损坏wbc的分析试剂),其可被精确调节以有助于使用例如渗透压调整组分进一步彼此分离多个wbc亚群(如由血液分析仪产生的一幅或多幅散点图上所观察)。
如本文中所使用,术语“荧光信息”表示自血液分析仪的荧光通道收集的数据。如本文中所使用,术语“荧光通道”表示用于测量自样品发射的荧光量的设置在适当的波长带处的检测装置,例如光电倍增管。
wbc分析试剂
本发明的各方面包括可以被用来增强使用自动血液分析仪分析血样中wbc和wbc亚群的wbc分析试剂。根据本发明的实施方案的wbc分析试剂通常被用来裂解血样中的rbc,同时保存血样中的wbc用于分析。当在由血液分析仪生成的差别散点图上观察时,根据本发明的实施方案的wbc分析试剂还通常提供将wbc亚群增强地、无干扰地彼此分离。这种增强的分离有助于更精确地分析存在于血样中的多个wbc亚群。
根据本发明的实施方案的wbc分析试剂可以通常包括至少一种膜可渗透的荧光染料、wbc保护剂、表面活性剂、渗透压调节组分及几种附加组分。下面更详细地描述这些组分中的每一种。
膜可渗透的荧光染料
膜可渗透的荧光染料可以被用来区分两类血细胞;即含有dna的血细胞和不含dna的血细胞。由于wbc在它们的核中含有大量的dna,而rbc不含,所以包括与dna相互作用的膜可渗透的荧光染料有助于区分rbc与wbc。染料的目的是通过细胞膜,以足够的亲和力结合至一个或多个核酸,并且当染料被适当的光源激发时,发射具有充足stokes位移的荧光信号。为了适当地激发染料和达到最佳的结果,染料在可见光带中的峰吸收基本上匹配光源的波长(在光源的50nm的波长内,更优选在光源的25nm的波长内)。
膜可渗透的荧光染料优选:1)能够结合至核酸(例如,dna),2)能够穿透wbc的细胞膜,3)当经受光源照射时可在选择的波长处激发,4)在被光源激发时发射荧光,以及5)是生物稳定的并可溶于液体(例如水溶液)中。合适的膜可渗透的荧光染料的实例包括但不限于:吖啶橙、碘化己锭、syto12、syto14、sytornaselect或它们的任意等同物。
基于配置在血液分析仪中的荧光触发器,荧光染料通常被用来活化wbc并筛选出未裂解的rbc和rbc片段。在一些实施方案中,染料以约1pm至约1mm的浓度存在,这取决于结合亲和力、膜渗透特性和/或染料发射荧光的强度。在一些实施方案中,染料以约1pg/l至约1mg/l的浓度存在,这取决于结合亲和力、膜渗透特性和/或染料发射荧光的强度。尽管各种染料是可用的,但所选择的染料一般与血液分析仪的激发源配对,使得一种单一染料被用来在预期被鉴定、定量和/或分析的所有wbc亚群中染色并激发发射荧光。这样,在一些实施方案中,单一(即排他的)染料可以被用来鉴定、定量和分析同时存在于样品中的所有不同的wbc亚群。在一些实施方案中,一种以上的荧光染料可被包括于wbc分析试剂中。
在一些实施方案中,荧光染料以约1.0μm、至约1.3μm、至约1.5μm、至约1.8μm或至约2.0μm或更高的浓度存在于wbc分析试剂中。在一些实施方案中,荧光染料以约0.0001%、至约0.0002%、至约0.0003%、至约0.0004%或至约0.0005%或更高的浓度存在于wbc分析试剂中。在某些实施方案中,荧光染料以约0.01μm、至约0.022μm、至约0.05μm、至约0.1μm、至约0.11μm、至约0.5μm、至约1.0μm、至约1.13μm、至约5.0μm、至约10μm、至约11.3μm、至约15μm或更高的浓度存在于wbc分析试剂中。
wbc保护剂
根据本发明的一些实施方案的wbc分析试剂可以包括在rbc裂解期间避免过度损伤wbc的wbc保护剂。wbc保护剂的实例包括但不限于甲醛、戊二醛、丁氧基乙醇、苯氧基乙醇、异丙醇或它们的组合。在一些实施方案中,wbc保护剂以约0.1%、至约0.2%、至约0.3%、至约0.4%、至约0.5%、至约0.6%、至约0.7%、至约0.8%、至约0.9%或至约1%的浓度存在于wbc分析试剂中。
渗透压调节组分
根据本发明的一些实施方案的wbc分析试剂可以包括渗透压调节组分。渗透压调节组分通常是将wbc分析试剂的渗透压改变至所需程度的试剂。渗透压调节组分的实例包括但不限于:含阳离子的盐,例如含诸如na+、k+、nh4+、ca2+和mg2+的盐;含阴离子的盐,例如含诸如cl-、br-、no3-、co32-、hco3-、so42-、hso4-、po43-、hpo42-、h2po4-、cooh-和ch3coo-的盐;有机化合物,例如诸如糖(例如,葡萄糖和蔗糖)和醇(例如,乙醇和甲醇);或它们的等同物。
在一些实施方案中,渗透压调节组分以约0.1%或更高、至约0.125%或更高、至约0.25%或更高、至约0.5%或更高的浓度存在于wbc分析试剂中。
附加组分
除上文所述的组分之外,根据本发明的一些实施方案的wbc分析试剂也可以包括多种添加剂。例如,在一些实施方案中,wbc分析试剂可以包括用来调节和/或保持溶液的ph并达到试剂的最佳渗透压的缓冲剂或盐。缓冲剂或盐的实例包括但不限于醋酸钠、碳酸氢钠或它们的组合。一些实施方案中,缓冲剂或盐以约0.01%、至约0.02%、至约0.03%、至约0.04%、至约0.05%、至约0.06%、至约0.07%、至约0.08%、至约0.09%、至约0.1%、至约0.15%、至约0.2%、至约0.25%、至约0.3%、至约0.35%、至约0.4%、至约0.45%、至约0.5%或更高的浓度存在于wbc分析试剂中。
在一些实施方案中,wbc分析试剂可以具有从约2.5ph单位、至约3.0ph单位、至约3.5ph单位、至约4.0ph单位、至约4.5ph单位、至约5.0ph单位、至约5.5ph单位、至约6.0ph单位、至约6.5ph单位、至约7.0ph单位、至约7.5ph单位、至约8.0ph单位、至约8.5ph单位、至约9.0ph单位、至约9.5ph单位、至约10ph单位、至约10.5ph单位、至约11ph单位、至约11.5ph单位、至约12ph单位、至约12.5ph单位变化的ph。
在某些实施方案中,wbc分析试剂也可以包括用来防止wbc分析试剂中微生物生长的抗微生物剂。抗微生物剂的实例包括但不限于proclins,例如proclin300或它的等同物。抗微生物剂的浓度通常足以使wbc分析试剂保持所需的保质期。在一些实施方案中,抗微生物剂可以以约0.01%、至约0.02%、至约0.03%、至约0.04%、至约0.05%、至约0.06%、至约0.07%、至约0.08%、至约0.09%或至约0.1%或更高的浓度存在于wbc分析试剂中。
在一些实施方案中,wbc分析试剂可以包括用来最小化rbc片段的蓄积并防止rbc片段干扰样品中wbc的分析的表面活性剂。表面活性剂的实例包括但不限于皂角苷或它的等同物。在一些实施方案中,表面活性剂可以以约0.01%、至约0.015%、至约0.02%、至约0.025%、至约0.03%、至约0.035%、至约0.04%、至约0.045%、至约0.05%或更高的浓度存在于wbc分析试剂中。
在一些实施方案中,wbc分析试剂可以包括rbc裂解组分。rbc裂解组分通常可以帮助裂解血样中的rbc,同时也促成wbc分析试剂的渗透压调节以有助于存在于样品中的不同类别的wbc的分离和/或分析。rbc裂解组分的实例包括但不限于:铵盐,例如诸如氯化铵;叔铵盐;季铵盐或它们的等同物。
wbc分析试剂的制备方法
在一些实施方案中,使用两阶段制备方法制备wbc分析试剂以溶解膜可渗透的荧光染料。在第一步骤中,将荧光染料溶解于合适的有机溶剂(例如,dmso)中以产生含有合适的第一浓度的荧光染料的溶液。在第二步骤中,将于有机溶剂中含有荧光染料的溶液与水溶剂混合以产生含有所需最终浓度的荧光染料的水性wbc分析试剂。在一些实施方案中,所述水溶剂可以含有wbc分析试剂的附加组分。
裂解血样中的rbc的方法
根据本发明的实施方案的wbc分析试剂可以通常被用来裂解全血样品中的rbc。可以在高于室温的温度(例如约30℃至约50℃之间,例如约40℃)下进行血样中rbc的裂解,历时范围为约5秒至约1分钟的时间段。在一些实施方案中,可以在相对短的量的时间(例如,小于约25秒、小于约17秒或甚至小于约9秒)进行rbc的裂解,接着将wbc分析试剂与血样混合。血样的体积与wbc分析试剂的体积的稀释比(表示为“血样的体积:wbc分析试剂的体积”)可以变化很大。在一些实施方案中,血样的体积与wbc分析试剂的体积比的范围为约1:10、至约1:20、至约1:30、至约1:40、至约1:50、至约1:60、至约1:70、至约1:80、至约1:90、至约1:100或更高。
涉及荧光触发器的分析方法
在光源激发荧光染料时血细胞发射不同幅度的荧光信号。荧光信号的幅度的差异部分由细胞中的核酸(即dna)的量造成。dna的量越大,更高的荧光信号的可能性越大。荧光幅度的差异也由例如荧光染料穿透细胞膜的能力、荧光染料分子的尺寸、荧光染料和结合的核酸之间的结合动力学、荧光染料和核酸之间的结合亲和力及其它此类因素造成。
成熟的rbc发射最小的荧光信号,因为在成熟的rbc中没有dna。有核的红血球(nrbc)发射很强的荧光信号,因为不仅dna存在于nrbc的核内,染色也更容易发生,因为在裂解方法期间nrbc的膜被破坏。未裂解的rbc或rbc片段不发射荧光,但是在某些情况下,它们可以发射非常弱的自发荧光。
这样,本文中所提出的体系和方法使用荧光触发器和wbc分析试剂的组合来分析样品内的wbc。例如,荧光触发器(通常设在来自rbc的信号和来自wbc的信号之间)可以被用来分别收集来自wbc的信号以用于进一步分析。换言之,使用荧光触发器允许将来自rbc的信号分离出,或从分析中移除,这通过消除来自rbc信号的干扰而有助于更精确地测量及分析样品中的wbc和wbc亚群。使用fl1或荧光触发器的实例示于图1-5中。图1是fl1对ias的散点图,其示出使用荧光触发器用于消除rbc的任意片段(无核颗粒)以及用于仅收集含核事件(例如wbc和/或nrbc)。在图1中,wbc分析试剂中的荧光染料为吖啶橙,荧光染料的浓度为3.8μm。使用含有吖啶橙作为荧光染料的wbc分析试剂(甚至具有非常不同的染料浓度,即11.3μm至0.022μm,如图6中所示)并且适当设定的fl1触发器有助于通过在fl1上建立阈值水平来鉴定含核事件。因此,只有在fl1触发器上方的事件(例如,wbc和/或nrbc,如果存在的话)被捕获用于进一步分析。
光学和荧光通道用于分析的用途
本发明的各方面涉及光学和荧光通道用于分析血样中的wbc的用途。例如,在一些实施方案中,通过多角度偏振散射分离技术(mapss)的方式在荧光信息增强的情况下进行wbc差异分析需要至少一个光电二极管、或至少一个光电倍增管、或至少一个光电二极管和至少一个光电倍增管二者来检测由每个血细胞散射的通过流动池的光。两个或更多个光电二极管被用于测量all信号(测量约0°散射)和ias信号(测量低角度(例如约3°至约15°)散射)。两个或更多个光电倍增管(或雪崩光电二极管)被用于测量大角度(例如,90°)pss信号和大角度(例如,90°)dss信号。需要附加的光电倍增管用于在适当的波长范围内的fl1测量,这取决于光源波长的选择。因此,在体系上捕获的每个事件展示出多种信息维度,例如all、ias(一个或更多通道)、pss、dss和荧光(一个或更多通道)。来自这些检测通道的信息被用于进一步分析血细胞。
图14为图示出适用于血液学分析的设备(包括流式细胞仪)的照明和检测光学器件的示意图。现在参考图14,设备10包括光源12、前镜14和后镜16用于光束弯曲、含有第一圆柱形透镜20和第二圆柱形透镜22的扩束模块18、聚焦透镜24、精细光束调节器26、流动池28、前向散射透镜30、靶心检测器32、第一光电倍增管34、第二光电倍增管36和第三光电倍增管38。靶心检测器32具有用于0°光散射的内检测器32a和用于7°光散射的外检测器32b。图14中描述的设备仅是可以用来进行本文所述方法的设备的一个实例。
在下面的讨论中,光源优选为激光器。但是,也可以使用其它光源,例如灯(例如汞、氙)。光源可以是垂直偏振的风冷coherentcube激光器,商业可购买自coherent,inc.,santaclara,ca。在一些实施方案中,可以使用具有范围为350nm至700nm的波长的激光。激光器的运行条件和现在与“cell-dyn”自动血液分析仪使用的激光器基本上相似。
可以在例如通过引用整体并入本文的美国专利第5,631,165号中,尤其是在第41栏第32行至第43栏第11行中找到涉及合适的自动血液分析仪的流动池、透镜、聚焦透镜、细光束调节机制和激光聚焦透镜的额外细节。图14中所示的前向光路体系包括球形平凸透镜30和位于透镜的后焦面内的双元件光电二极管检测器32。在这样的构造中,双元件光电二极管检测器32中的每个点映射至来自移动通过流动池28的细胞的光的特定收集角。检测器32可以是能够检测轴向光损失(all)和中等角度前向散射(ias)的靶心检测器。美国专利第5,631,165号在第43栏第12-52行描述了此检测器的多种替代方式。
第一光电倍增管34(pmt1)测量消偏振的侧向散射(dss)。第二光电倍增管36(pmt2)测量消偏振的侧向散射(pss),第三光电倍增管38(pmt3)测量440nm至680nm放出的荧光,取决于所选择的荧光染料和所使用的光源。光电倍增管在宽波长范围内收集荧光信号以增加信号的强度。侧向散射和荧光发射通过二色光束分离器40和42被引导至这些光电倍增管,其在所需波长下有效地传输和反射以使得有效检测。美国专利第5,631,165号在第43栏第53行至第44栏第4行描述了涉及光电倍增管的多种其它细节。
当通过使用浸渍收集体系测量荧光时,在光电倍增管34、36和38处的灵敏度得以增强。浸渍收集体系借助于折射指数匹配层将第一透镜30光学地耦合至流动池28,使得在宽角上收集光。美国专利第5,631,165号在第44栏第5-31行描述了这种光学体系的多种其它细节。
冷凝器44是用于高分辨率显微镜中的具有足够用于受衍射限制的成像的像差校正的光学透镜体系。美国专利第5,631,165号在第44栏第32-60行描述了这种光学体系的多种其它细节。
图14中所示的其它组件(即狭缝46、场透镜48和第二狭缝50)的功能描述于美国专利第5,631,165号的第44栏第63行至第45栏第26行中。被插入到光电倍增管的光路中来改变所检测光的波长或偏振化或波长和偏振化两者的光学滤光器52或56和偏振器52或56也描述于美国专利第5,631,165号的第44栏第63行至第45栏第26行中。适用于本文的光学滤光器包括带通滤光器和长通滤光器。
光电倍增管34、36和38检测侧向散射(在轴线大致垂直于入射激光束的锥体中散射的光)或荧光(在入射激光束的波长不同的波长下从细胞发射的光)。
尽管上文引用了美国专利第5,631,165号的选择部分,但美国专利第5,631,165号通过引用整体并入本文。
除了从四个传统mapss通道(all、ias、pss、dss)收集的信息,所述fl1通道进一步将细胞亚群彼此区分。来自所有的光学维度和荧光维度的结合的定量信息提供了增强的且更可靠的用于含有wbc的样品的差异分析。
本文所述的方法增强了用于血液学分析仪的wbc分析,并提供了更精确的wbc计数和更准确的wbc亚群的分类,因为基本上消除了来自未裂解的rbc和rbc片段的干扰。使用荧光提供了进一步的信息来改善wbc的差异分析。本文所述的方法在分析具有rstrbc的样品和具有脆性wbc的样品时表现出相比于传统方法的优势。
实施例wbc分析试剂配制物:
下文提供wbc分析试剂配制物的各种实施例。下文提供的配制物仅用作实例,并且决不限制。本文所述组分的任意多种组合都可以被用于根据本发明的实施方案的wbc分析试剂中。
实施例配制物1:
实施例配制物2:
实施例配制物3:
实施例配制物4:
实施例配制物5:
实施例配制物6:
实施例配制物7:
实施例配制物8:
实施例配制物9:
实施例配制物10:
实施例配制物11:
实施例:
图1-5示出了分别使用上文实施例配制物1-5中所述的wbc分析试剂和体系进行分析的正常全血样本的wbc差异散点图(fl1对ias)。如图1-5中可见,wbc分析试剂能够充分地区分并区别样品中的wbc。
图6a-6d示出了四种不同的wbc分析试剂配制物的wbc差异散点图(pss对all和fl1对ias)。结果表明,即使当wbc分析试剂中的膜可渗透荧光染料的浓度显著变化时,也会获得相似的wbc差异。所测试的四种配制物与实施例配制物1中的那些相似,除了吖啶橙的浓度以11.3μm(1x)、1.13μm(0.1x)、0.11μm(0.01x)和0.022μm(0.002x)制备,其中fl1pmt的电压分别设定在375v、420v、475v和520v。
图7a-7c示出了使用含有0.22%甲醛作为wbc保护剂的wbc分析试剂(与实施例配制物1相同的配制物)进行分析的正常全血样本的多种wbc差异散点图。
图8a-8c示出了使用含有0.2%戊二醛作为wbc保护剂的wbc分析试剂(与实施例配制物6相同的配制物)进行分析的正常全血样本的各个wbc差异散点图。
图9a-9c示出了使用含有0.5%丁氧基乙醇作为wbc保护剂的wbc分析试剂(与实施例配制物7相同的配制物)进行分析的正常全血样本的各个wbc差异散点图。
图10a-10c示出了使用含有0.5%苯氧基乙醇作为wbc保护剂的wbc分析试剂(与实施例配制物8相同的配制物)进行分析的正常全血样本的各个wbc差异散点图。
图11a-11c示出了使用含有0.5%异丙醇作为wbc保护剂的wbc分析试剂(与实施例配制物9相同的配制物)进行分析的正常全血样本的各个wbc差异散点图。
图12a-12d示出了使用含有指定含量的氯化铵作为渗透压调节组分的wbc分析试剂得到的各个wbc差异散点图(all对ias、pss对all和pss对ias)。嗜中性粒细胞/嗜酸性粒细胞、淋巴细胞、单核细胞和嗜碱性粒细胞示于散点图中。wbc分析试剂具有与实施例配制物10中使用的相同的配制物,除了按指示调节氯化铵的浓度。wbc分析试剂中氯化铵的浓度的变化导致散点图上wbc亚群的位置的偏移。例如,氯化铵的浓度在wbc试剂中从0.125%至0.5%变化。由各种氯化铵浓度变化导致的渗透压变化影响all对ias散点图中嗜中性粒细胞、淋巴细胞和单核细胞的相对位置。较低浓度的氯化铵和较低的渗透压在散点图上表现出“提升”嗜中性粒细胞群并为嗜碱性粒细胞创造空间。对于含有0.5%、0.375%、0.25%和0.125%氯化铵的wbc试剂,测量的渗透压分别在263、224、181和146mosm。可以通过比较散点图看出嗜中性粒细胞/嗜酸性粒细胞群的位置偏移。
图13示出了由不同浓度的nacl(见实施例配制物11)导致的渗透压变化而造成的wbc群体的相对位移。在此实验中,渗透压的范围为149至181mosm。
本发明还涉及以下实施方案:
1.一种使用自动血液分析仪进行白血细胞(wbc)分析的方法,所述方法包括:
(a)用wbc分析试剂稀释全血样品,其中所述wbc分析试剂包含:
膜可渗透的荧光染料,其标记所述样品中的多个含核细胞;和
渗透压调节组分,其当使用所述血液分析仪分析时将多个wbc亚群彼此分离;
(b)在范围为约30℃至约50℃的温度下孵育步骤(a)的所述稀释血样小于约25秒的孵育时间;
(c)将来自步骤(b)的经孵育的样品递送至所述血液分析仪的流动池;
(d)当来自步骤(c)的经孵育的样品穿过所述流动池时,使用激发源将所述样品激发;
(e)收集来自所述被激发的样品的多个光散射信号和至少一个荧光发射信号;和
(f)基于在步骤(e)中收集的所有所述信号进行wbc差异分析,同时基于所述至少一个荧光发射信号排除对所述稀释血样内的不满足荧光阈值的任何颗粒的考虑。
2.根据实施方案1所述的方法,其中所述激发源具有约350nm至约700nm的波长。
3.根据前述实施方案中的任一项所述的方法,其中所述荧光发射信号通过带通滤光器或长通滤光器在约360nm至约750nm的波长下收集。
4.根据前述实施方案中的任一项所述的方法,其中所述膜可渗透的荧光染料为吖啶橙、碘化己锭、sytornaselect、syto12或syto14。
5.根据前述实施方案中的任一项所述的方法,其中所述试剂中的膜可渗透的荧光染料的浓度范围为约0.0001%至约0.0005%。
6.根据前述实施方案中的任一项所述的方法,其中所述试剂中的膜可渗透的荧光染料的浓度为约0.01μm至约15μm。
7.根据前述实施方案中的任一项所述的方法,其中所述渗透压调节组分为氯化铵或氯化钠。
8.根据前述实施方案中的任一项所述的方法,其中所述渗透压调节组分的浓度范围为约0.1%至约0.5%。
9.根据前述实施方案中的任一项所述的方法,其中所述试剂还包含wbc保护剂。
10.根据实施方案9所述的方法,其中所述wbc保护剂为甲醛、戊二醛、丁氧基乙醇、苯氧基乙醇或异丙醇。
11.根据实施方案9或10所述的方法,其中所述wbc保护剂的浓度范围为约0.1%至约1.0%。
12.根据前述实施方案中的任一项所述的方法,其中所述wbc分析试剂还包含表面活性剂。
13.根据实施方案12所述的方法,其中所述表面活性剂为皂角苷。
14.根据实施方案12或13所述的方法,其中所述表面活性剂的浓度范围为约0.01%至约0.05%。
15.根据前述实施方案中的任一项所述的方法,其中所述试剂还包含ph缓冲组分。
16.根据实施方案15所述的方法,其中所述ph缓冲组分为醋酸钠或碳酸氢钠。
17.根据实施方案15或16所述的方法,其中所述ph缓冲组分的浓度范围为约0.01%至约0.5%。
18.根据前述实施方案中的任一项所述的方法,其中所述试剂还包含抗微生物剂。
19.根据实施方案18所述的方法,其中所述抗微生物剂的浓度范围为约0.01%至约0.1%。
20.根据前述实施方案中的任一项所述的方法,其中所述wbc分析试剂的ph范围为约2.5至约12.5ph单位。
21.根据前述实施方案中的任一项所述的方法,其中所述wbc分析试剂的渗透压范围为约25至约350mosm。
22.一种用于对全血样品进行白血细胞(wbc)差异分析的体系,所述体系包括:
(a)血液分析仪,所述血液分析仪包括:
激发源,其被布置成激发所述血样中的颗粒;
多个检测器,其包括(1)被布置成测量来自所述被激发的血样的轴向光损失的轴向光损失检测器、(2)被布置成测量来自所述被激发的血样的中等角度散射的中等角度散射检测器、(3)被布置成测量来自所述被激发的血样的大角度偏振侧向散射的偏振侧向散射检测器、(4)被布置成测量来自所述被激发的血样的大角度消偏振侧向散射的消偏振侧向散射检测器、和(5)被布置成测量来自所述被激发的血样发射的荧光的荧光检测器;和
处理器,其被配置成:
(i)从所述多个检测器接收(1)轴向光损失、(2)中等角度散射、(3)大角度偏振侧向散射、(4)大角度消偏振侧向散射和(5)荧光的测量结果,和
(ii)基于所有五个测量结果,针对发射高于荧光阈值的荧光的颗粒进行所述血样的wbc差异分析;和
(b)用于分析所述样品中wbc的试剂,所述试剂包含:
膜可渗透的荧光染料;和
渗透压调节组分;
其中所述膜可渗透的荧光染料的浓度足以有助于使用所述血液分析仪鉴定含有细胞核的样品中的一种或多种细胞;并且
其中所述渗透压调节组分的浓度足以有助于使用所述血液分析仪鉴定所述样品中的多个wbc亚群。
23.根据实施方案22所述的体系,其中所述膜可渗透的荧光染料为吖啶橙、碘化己锭、sytornaselect、syto12或syto14。
24.根据实施方案22或23所述的体系,其中所述试剂中膜可渗透的荧光染料的浓度范围为约0.0001%至约0.0005%。
25.根据实施方案22-24中的任一项所述的体系,其中所述试剂中的膜可渗透的荧光染料的浓度范围为约0.01μm至约15μm。
26.根据实施方案22-25中的任一项所述的体系,其中所述渗透压调节组分为氯化铵或氯化钠。
27.根据实施方案22-26中的任一项所述的体系,其中所述渗透压调节组分的浓度范围为约0.1%至约0.5%。
28.根据实施方案22-27中的任一项所述的体系,其中所述试剂还包含wbc保护剂。
29.根据实施方案28所述的体系,其中所述wbc保护剂为甲醛、戊二醛、丁氧基乙醇、苯氧基乙醇或异丙醇。
30.根据实施方案28或29所述的体系,其中所述wbc保护剂的浓度范围为约0.1%至约1.0%。
31.根据实施方案22-30中的任一项所述的体系,其中所述试剂还包含表面活性剂。
32.根据实施方案31所述的体系,其中所述表面活性剂为皂角苷。
33.根据实施方案31或32所述的体系,其中所述表面活性剂的浓度范围为约0.01%至约0.05%。
34.根据实施方案22-33中的任一项所述的体系,其中所述试剂还包括ph缓冲组分。
35.根据实施方案34所述的体系,其中所述ph缓冲组分为醋酸钠或碳酸氢钠。
36.根据实施方案34或35所述的体系,其中所述ph缓冲组分的浓度范围为约0.01%至约0.5%。
37.根据实施方案22-36中的任一项所述的体系,其中所述试剂还包含抗微生物剂。
38.根据实施方案37所述的体系,其中所述抗微生物剂的浓度范围为约0.01%至约0.1%。
39.根据实施方案22-38中的任一项所述的体系,其中所述试剂的ph范围为约2.5至约12.5ph单位。
40.根据实施方案22-39中的任一项所述的体系,其中所述试剂的渗透压范围为约25至约350mosm。
41.根据实施方案22-40中的任一项所述的体系,其中所述处理器被进一步配置成预筛选所接收的测量结果以排除对不满足所述荧光阈值的颗粒的考虑。
42.根据实施方案22-41中的任一项所述的体系,其中所述轴向光损失检测器测量在0°散射处的轴向光损失。
43.根据实施方案22-42中的任一项所述的体系,其中所述中等角度散射检测器测量在约3°至约15°处的光角散射。
44.根据实施方案22-43中的任一项所述的体系,其中所述多个检测器包括一个或多个光电倍增管。
45.根据实施方案22-44中的任一项所述的体系,其中所述激发源是激光器。
46.根据实施方案45所述的体系,其中所述激光器在对应于所述荧光染料的波长下发射光。
47.根据实施方案22-46中的任一项所述的体系,其中选择所述荧光染料以与所述激发源相对应。
48.根据实施方案22-47中的任一项所述的体系,其还包括用于用所述试剂稀释所述血样的孵育子体系。
49.根据实施方案48所述的体系,其中所述孵育子体系被配置成用所述试剂孵育所述血样少于约25秒的时间段。
50.根据实施方案48或49所述的体系,其中所述孵育子体系被配置成用所述试剂孵育所述血样少于约17秒的时间段。
51.根据实施方案48-50中的任一项所述的体系,其中所述孵育子体系被配置成用所述试剂孵育所述血样少于约9秒的时间段。
52.根据实施方案48-51中的任一项所述的体系,其中所述孵育子体系被配置成在范围为约30℃至约50℃的温度下用所述试剂孵育所述血样。
53.根据实施方案48-52中的任一项所述的体系,其中所述孵育子体系被配置成在约40℃的温度下用所述试剂孵育所述血样。
54.一种使用血液分析仪分析全血样品中的白血细胞(wbc)的试剂,所述试剂包含:
足以有助于使用所述血液分析仪鉴定所述含有细胞核的样品中多个细胞的浓度的膜可渗透的荧光染料;和
足以有助于使用所述血液分析仪鉴定所述样品中的多个wbc亚群的浓度的渗透压调节组分。
55.根据实施方案54所述的试剂,其中所述膜可渗透的荧光染料为吖啶橙、碘化己锭、sytornaselect、syto12或syto14。
56.根据实施方案54或55所述的试剂,其中所述试剂中的膜可渗透的荧光染料的浓度范围为约0.0001%至约0.0005%。
57.根据实施方案54-56中的任一项所述的试剂,其中所述试剂中的膜可渗透的荧光染料的浓度范围为约0.01μm至约15μm。
58.根据实施方案54-57中的任一项所述的试剂,其中所述渗透压调节组分为氯化铵或氯化钠。
59.根据实施方案54-58中的任一项所述的试剂,其中所述渗透压调节组分的浓度范围为约0.1%至约0.5%。
60.根据实施方案54-59中的任一项所述的试剂,其中所述试剂还包含wbc保护剂。
61.根据实施方案60所述的试剂,其中所述wbc保护剂为甲醛、戊二醛、丁氧基乙醇、苯氧基乙醇或异丙醇。
62.根据实施方案60或61所述的试剂,其中所述wbc保护剂的浓度范围为约0.1%至约1.0%。
63.根据实施方案54-62中的任一项所述的试剂,其中所述wbc分析试剂还包含表面活性剂。
64.根据实施方案63所述的试剂,其中所述表面活性剂为皂角苷。
65.根据实施方案63或64所述的试剂,其中所述表面活性剂的浓度范围为约0.01%至约0.05%。
66.根据实施方案54-65中的任一项所述的试剂,其中所述试剂还包括ph缓冲组分。
67.根据实施方案66所述的试剂,其中所述ph缓冲组分为醋酸钠或碳酸氢钠。
68.根据实施方案66或67所述的试剂,其中所述ph缓冲组分的浓度范围为约0.01%至约0.5%。
69.根据实施方案54-68中的任一项所述的试剂,其中所述试剂还包含抗微生物剂。
70.根据实施方案69所述的试剂,其中所述抗微生物剂的浓度范围为约0.01%至约0.1%。
71.根据实施方案54-70中的任一项所述的试剂,其中所述wbc分析试剂的ph范围为约2.5至约12.5ph单位。
72.根据实施方案54-71中的任一项所述的试剂,其中所述wbc分析试剂的渗透压范围为约25至约350mosm。
为了说明和描述的目的,已经呈示本发明的前面描述。不旨在穷举或将本发明限制至公开的精确形式。按照上述教导可以进行其它的修改和变化。为了最好地解释本发明的原理及它的实际应用且从而使本领域其它技术人员能够在适合于预期的特定用途的多种实施方案和多种变化中最好地利用本发明,对实施方案进行选择并描述。随附的权利要求意在被解释为包括本发明的其它替代实施方案;包括等效的结构、组分、方法和装置。
上文的详述是指图示出一种或多种示例性实施方案的所附附图。其它实施方案也是可以的。可以对所描述的实施方案做出修改而不偏离本发明的精神和范围。因此,详述不意指是限制性的。另外,概述和摘要部分可以阐明发明人所设想的一个或多个但不是全部的本发明的示例性实施方案,因此,绝非意在限制本发明及随附的权利要求。
- 还没有人留言评论。精彩留言会获得点赞!