研究离子结晶反应成核速率时反应液稀释倍数的测算方法与流程
本发明属于化学反应动力学技术领域,涉及研究离子结晶反应成核速率时反应液稀释倍数的测算方法。
背景技术:
对于离子型沉淀反应maa++nbb-->ambn,分别含两种沉淀离子aa+和bb-的两种反应液混合后,在过饱和度作用下反应混合液中瞬间生成沉淀颗粒ambn。反应混合液中单位体积、单位时间内生成的沉淀颗粒ambn的总个数即为离子结晶反应的成核速率,单位为个/m3·s。
离子结晶反应的成核速率的大小与aa+和bb-混合时各自的浓度有关。当采用nielsen型成核测量装置测量离子结晶反应的成核速率时,体积相同的两股反应溶液被分别加入至带有恒温功能的两个加料器中,在一定推力的作用下,两个加料器中的两股反应溶液被快速、同时压入至成核管中。在成核管中,两股反应溶液混合,并在高过饱和度下诱发成核生成晶核。在成核管的出口,反应混合液在一个容器中经适当体积的稀释液稀释使得aa+和bb-的浓度大大降低,使得成核反应停止,之后已经形成的晶核借助稀释液中的微量aa+和bb-离子浓度继续生长。而在离子结晶反应成核速率测定时,可等晶核在反应混合液和稀释液混合并长到可测量的尺寸后,通过用颗粒计数器测量成核过程中生成的晶粒个数进行离子结晶反应成核速率的计算。
但是,上述离子结晶反应成核速率测定时,稀释液对反应混合液的稀释倍数必须适当。因为稀释倍数偏小,则成核后的反应混合液经稀释液稀释后过饱和度依然较大,会继续长出新的晶核;稀释倍数偏大,则成核后的反应混合液经稀释液稀释后过饱和度偏小,已经形成的晶核会发生部分溶解。而无论发生哪种情况,都会影响离子结晶反应成核速率测定的准确性。
现有技术虽然给出了在发生离子结晶反应时反应混合液和稀释液混合后的过饱和度,但并未给出稀释倍数的计算方法或获得途径。
技术实现要素:
本发明的目的是提供研究离子结晶反应成核速率时反应液稀释倍数的测算方法,以能够在进行离子结晶反应的成核速率测定时,针对不同反应物的浓度,都能够测算得到适宜的反应混合液的稀释倍数,从而使离子结晶反应的成核速率测定结果更加准确。
为实现此目的,在基础的实施方案中,本发明提供研究离子结晶反应成核速率时反应液稀释倍数的测算方法,其针对aa+离子不过量的离子型沉淀反应maa++nbb-->ambn;所述的稀释倍数是在一定的恒定的温度下,在当其中aa+离子的浓度为caa+的第一反应液与其中bb-离子的浓度为cbb-的第二反应液在以等体积瞬间混合形成晶核后用稀释液进行稀释时,既没有新的晶核形成,也没有已形成晶核的溶解的稀释液对反应混合液的稀释倍数;所述的稀释液的组成、浓度与所述的第一反应液、第二反应液充分等体积混合反应去沉淀后,除去aa+离子的母液的组成、浓度一致;
其中所述的测算方法包括如下步骤:
(1)在一定的恒定的温度下,将所述的第一反应液与所述的第二反应液等体积混合后至达到溶解沉淀平衡时,测量反应混合液中aa+离子和bb-离子的浓度caa+equ和cbb-equ;
(2)利用如下式1的公式计算所述的稀释倍数n.
其中s为设定值在1.3-2.1之间的数。
在一种优选的实施方案中,本发明提供研究离子结晶反应成核速率时反应液稀释倍数的测算方法,其中所述的一定的恒定的温度为5-90℃。
在一种优选的实施方案中,本发明提供研究离子结晶反应成核速率时反应液稀释倍数的测算方法,其中所述的caa+为0.01-2mol/l,所述的cbb-为0.01-4mol/l。
在一种优选的实施方案中,本发明提供研究离子结晶反应成核速率时反应液稀释倍数的测算方法,其中所述的第一反应液与所述的第二反应液为等温混合。
在一种优选的实施方案中,本发明提供研究离子结晶反应成核速率时反应液稀释倍数的测算方法,其中所述的瞬间混合的时间为1-100毫秒。
本发明的有益效果在于,利用本发明的研究离子结晶反应成核速率时反应液稀释倍数的测算方法,能够在进行离子结晶反应的成核速率测定时,针对不同反应物的浓度,都能够测算得到适宜的反应混合液的稀释倍数,从而使离子结晶反应的成核速率测定结果更加准确。
本发明的有益效果具体体现在:
(1)本发明将反应混合液的稀释倍数与两种反应液中反应离子的初始反应浓度相关联,从而可计算得出不同初始反应物浓度所对应的适宜的稀释倍数;
(2)本发明可在减少实验次数、减少工作量、节省时间的情况下获得更为准确的成核速率的测定结果;
(3)本发明尤其适用于放射性元素的离子沉淀反应,可以减少实验人员所受放射性物质的照射剂量;
(4)本发明的稀释倍数的计算公式简单、实用。
附图说明
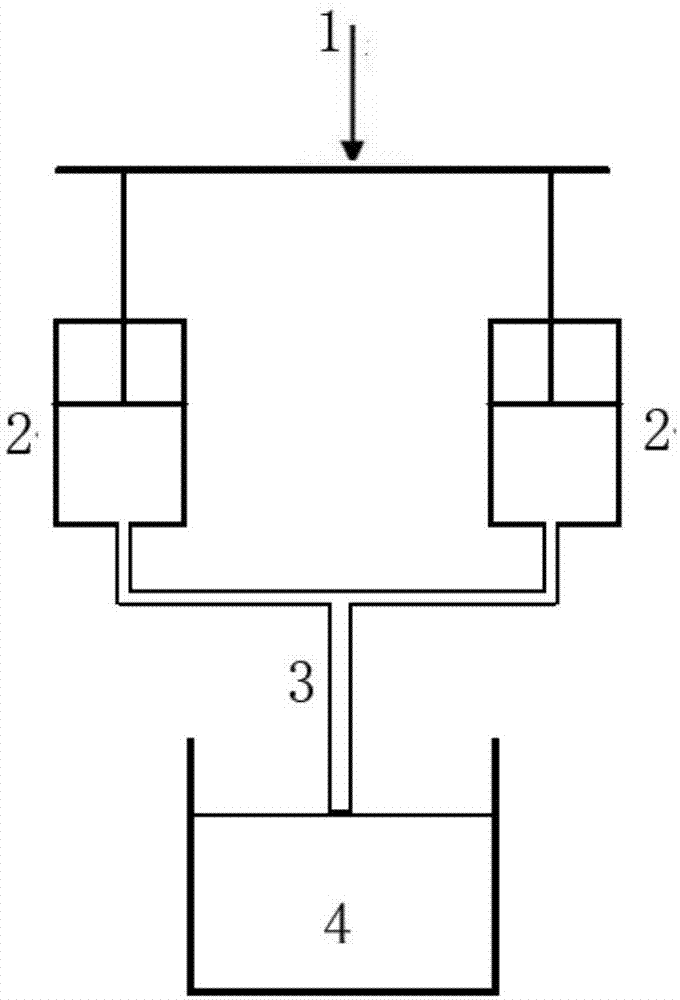
图1为实施例1所使用的nielsen型成核测量装置的测量原理图。
具体实施方式
以下结合实施例和附图对本发明的具体实施方式作出进一步的说明。
实施例1:
1)配制一定体积的0.1mol/l硝酸肼+0.05、0.07、0.09、0.15、0.20、0.30mol/lh2so4+0.1mol/l草酸作为稀释液。
2)在25℃下,分别将15.0ml的第一反应液(0.05、0.07、0.09、0.15、0.20、0.30mol/l硫酸亚铁+0.1mol/l硝酸肼溶液)和15.0ml的第二反应液(对应0.25、0.27、0.29、0.35、0.40、0.50mol/l草酸+0.1mol/l硝酸肼溶液)加入到图1所示的两个加料器2中。
3)在测算相关浓度值的基础上(caa+为第一反应液中硫酸亚铁的浓度,cbb-为第二反应液中草酸的浓度;在25℃恒温下,在烧杯中将第一反应液与第二反应液等体积混合后至达到溶解沉淀平衡时,测量反应混合液中亚铁离子,即aa+离子和草酸根离子,bb-离子的浓度caa+equ和cbb-equ),通过如下式1计算稀释液对反应混合液的适宜的稀释倍数n,以使反应混合液和稀释液混合后,既没有新的晶核形成,也没有已形成晶核的溶解,其中s为1.3,
4)如图1所示,在方形池4中加入一定体积的稀释液,并预热恒温至25℃。方形池4带有磁子搅拌,设定搅拌速率为4000r/min。在0.52mpa的推力下,通过注射系统1将第一反应液和第二反应液压入至成核管3中混合并瞬间反应生成晶核(实验测得形成晶核时间为17毫秒)。然后将反应混合液在0.5-0.8mpa的压力下迅速压入至高速搅拌的方形池4中,以使稀释液对反应混合液的稀释倍数n为上述步骤3)的测算值,并在5秒后立即将磁子搅拌转速降低至200r/min,在25℃水浴下保温10min以让晶核继续生长。用颗粒计数器测量沉淀颗粒总个数n,结合成核时间测得在此反应物浓度条件下的草酸亚铁结晶的反应成核速率g(个/m3·s)。
5)改变第一反应液和第二反应液的浓度值,重复步骤1)至步骤4),测定不同反应物浓度条件下的适宜的稀释倍数n和草酸亚铁结晶的反应成核速率g,由此可测得25℃下草酸亚铁的反应结晶成核动力学方程为g=3.3×1013m-3s-1exp[-3.6/(lnd)2],其中d为第一、第二反应液瞬间混匀时的溶液过饱和度。
上述示例性的方法中,草酸与亚铁离子反应的方程式为:fe2++c2o42-+7h2o->fec2o4·7h2o(s),即m=n=1。将亚铁浓度0.05-0.30mol/l、草酸浓度0.25-0.50mol/l、草酸亚铁溶解度1.61×10-3mol/l、草酸过量浓度0.1mol/l、s值1.3、m=n=1带入式1所得稀释倍数n值如表1所示。
表1草酸亚铁结晶反应成核速率测定时不同浓度反应物的稀释倍数n
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若对本发明的这些修改和变型属于本发明权利要求及其同等技术的范围之内,则本发明也意图包含这些改动和变型在内。上述实施例或实施方式只是对本发明的举例说明,本发明也可以以其它的特定方式或其它的特定形式实施,而不偏离本发明的要旨或本质特征。因此,描述的实施方式从任何方面来看均应视为说明性而非限定性的。本发明的范围应由附加的权利要求说明,任何与权利要求的意图和范围等效的变化也应包含在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!