一种完整蛋白质组高pH反相色谱高通量预分离方法与流程
本发明涉及蛋白质预分离研究领域,尤其是涉及一种完整蛋白质组高ph反相色谱高通量预分离方法。
背景技术
蛋白质的预分离技术,在蛋白质组学的研究中具有重要的意义。在蛋白质组学中利用正交分离的方法可以提高蛋白质分析的动态范围和蛋白质鉴定的覆盖率。yangf等人(yangf,sheny,campdg,etal.high-phreversed-phasechromatographywithfractionconcatenationfor2dproteomicanalysis[j].expertreviewofproteomics,2012,9(2):129-34.)建立了以高ph反相色谱预分离,以低ph反相色谱作为最后一维对蛋白样品进行了分离研究,并将这种分离模式与离子交换-反相色谱分离模式进行了对比;结果发现,高-低ph反相色谱分离模式的分离效果优于离子交换-反相色谱分离模,高ph条件下的反相色谱预分离可以有效地代替离子交换色谱预分离。wangz等人(wangz,mah,smithk,etal.two-dimensionalseparationusinghighphandlowphreversedphaseliquidchromatographyfortop-downproteomics[j].internationaljournalofmassspectrometry,2017,427.)利用规格为(
上述的研究表明高ph和低ph分离联用的二维分离方法具有良好的正交性。两种分离方法的联用能显著的提高蛋白质的鉴定数量。目前,对于高ph条件下整体蛋白的反相色谱分离有了一定的研究;但是大多都是基于商业色谱柱或自制的毛细管色谱柱等在线或离线的分离方法;这些分离方法处理样品的通量低,分离速度相对较慢,当面对大量的样品时比较耗时。为此,蛋白质的预分离需要一种高通量快速的方法,来增加蛋白质预分离的通量和分离速度。
专利cn105890960a使用尺寸排阻色谱填料、反相色谱填料或离子交换色谱填料作为固定相填料,将固定相填料与蛋白质混合物混合后,加入不同强度的洗脱缓冲夜,充分混合并离心处理,收集洗脱缓冲液。基于蛋白质混合物中不同性质的蛋白质被分别收集到不同强度的洗脱缓冲液中,实现完整蛋白质混合物的预分离。该方法的速度较快,但是该方法分离方法中,得到的部分蛋白质馏份中含有盐,需要离线除盐,除盐过程中会造成大量蛋白质的损失,同时需要离心等复杂的操作,由于馏份和填料都在同一个离心管中,这使得部分馏份残留或吸取馏份时容易吸到填料,而残留的馏份会混入到下一个馏份的组分里,会导致预分离效果变差,而吸出的填料会增加馏份预处理的难度。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种完整蛋白质组的高通量预分离方法。
本发明的目的可以通过以下技术方案来实现:
一种完整蛋白质组高ph反相色谱高通量预分离方法,加入蛋白质混合物于spe柱,所述蛋白质混合物与spe柱中的反相色谱填料混合,spe柱中依次加入不同极性的洗脱液,利用注射器将不同极性的洗脱液排出spe柱得到溶解了不同蛋白的馏分,离心管接收馏分。
在本发明的一个具体实施方式中,所述完整蛋白质组高ph反相色谱高通量预分离方法具体包括以下步骤:
(1)将蛋白质混合物加入spe柱中,使蛋白样品缓慢地经过色谱填料而被吸附,spe柱的下端用离心管承接流出的液体;
(2)在上述步骤(1)处理后的反相色谱填料中加入8种不同极性的流动相,缓慢推注射器依次洗脱,加入的流动相的极性由小到大,spe柱的下端用离心管承接流出的馏份;
(3)每个馏份用真空浓缩仪进行浓缩干燥。
在本发明的一个具体实施方式中,所述步骤(2)的流动相的ph大于8。
在本发明的一个具体实施方式中,所述步骤(1)中将spe柱的下端流出的液体重新加入spe柱中,重复操作4-6次。
在本发明的一个具体实施方式中,所述注射器的出口通过转接头与spe柱连接,所述注射器的使用方式:断开spe柱和转接头之间的联接,注射器向后拉,在spe柱加入蛋白混合液或洗脱液后,联接spe柱和转接头,缓慢地推注射器,使spe柱中的液体流出。
在本发明的一个具体实施方式中,所述不同极性的流动相分别由不同体积的缓冲液a和缓冲液b配制而成,极性由小到大的流动相的乙腈浓度分别为5.0%、20.0%、35%、40%、48%、55%、75%、90%,所述乙腈浓度用体积比表示。
在本发明的一个具体实施方式中,所述的缓冲液a为10mm的甲酸铵水溶液;所述的缓冲液b的组成体积比为90%乙腈和10%10mm的甲酸铵水溶液。
在本发明的一个具体实施方式中,所述spe柱中放置两片筛板,所述反相色谱填料装在两片筛板中间。
在本发明的一个具体实施方式中,所述反相色谱填料包括c4反相色谱填料。
本发明的一个具体实施方式如下:
(1)配制流动相a(10mm的甲酸铵水溶液);配制流动相b(90%乙腈/10%甲酸铵水溶液)。
(2)设计8个由不同比例的流动相a和流动相b组成的流动相c,每个不同的流动相c的体积均为300μl,每个流动相都用独立的离心管进行保存。
(3)先断开spe柱和转接头之间的联接,在spe柱内加入c4反相色谱填料。
(4)利用流动相a(10mm的甲酸铵水溶液)对色谱填料进行平衡,从spe柱下端流出的液,用高速离心机离心5分钟,以检查填料是否漏出,确定填料不会漏出后在进行其他的分离步骤。
(5)完成步骤4之后,将整体大肠杆菌蛋白质混合液加入spe柱中,注射器后拉,再把spe柱和转接头相连在一起,spe柱的下端用离心管承接流出的液体,慢慢的推注射器,使蛋白质混合液缓慢的经过色谱填料而被吸附。
(6)流出的液体用移液枪取出再次加入spe柱中,重复步骤5共6次。
(7)利用8个不同比例的流动相a(10mm的甲酸铵水溶液)和流动相b(90%乙腈/10%甲酸铵水溶液)组成的流动相c,对大肠杆菌样品进行洗脱,每个不同比例的流动相洗脱的蛋白质样品即为一个馏份,洗脱的操作为:断开spe柱和转接头之间的联接,注射器向后拉,用移液枪取300μl的流动相a和流动相b的混合液,加入spe柱中,联接spe柱和转接头,缓慢的推注射器,使流动相流出,不同流动相比例下流出的馏份用不同编号的离心管接收。重复8次洗脱操作,一共可收集到8个不同的馏份。
(8)得到的8个馏份用真空浓缩仪进行浓缩干燥,用纯净水或用液相色谱的上样缓冲液进行溶解,即得预分离后的8馏份样品。
(9)用sds-page凝胶电泳的方法,对8个不同的馏份样品进行分离效果验证。
与现有技术相比,本发明采用高ph的洗脱液,用注射器加压分离的方式操作简单快速,通量高,可以彻底的压出每一个馏份,使馏份之间不会相互干扰,由于利用的的是挥发性碱和盐,通过离心浓缩可除去挥发性的碱,另外馏份可实现在线除盐;只要增加色谱填料的用量,就可以增加分离的通量。
附图说明
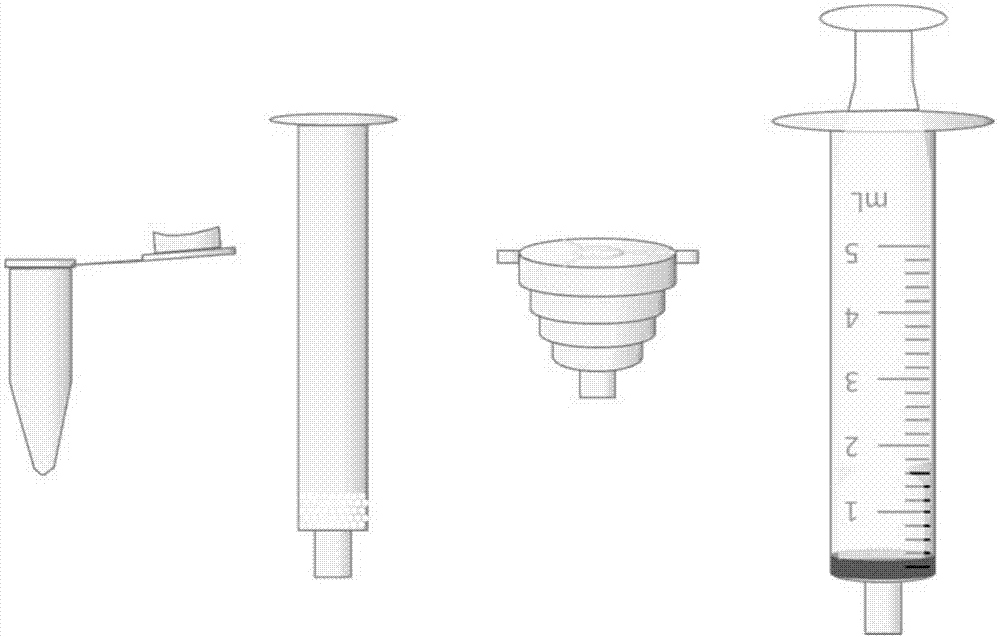
图1:本发明所使用的预分离装置的组成部分;
图2:本发明所使用的预分离装置结构示意图;
图3:e.coli样品经高ph预分离馏份的凝胶电泳图。
条带1为marker,条带2到9分别为馏份1到馏份8,条带10为e.coli蛋白质混合液。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例1
1、配制流动相a和b
配制流动相a(10mm的甲酸铵水溶液):(1)称取0.0859g的甲酸铵,放置于15ml的离心管中,加10.00ml的超纯水,充分溶解,测定其体积为10.1ml,得到浓度为0.135m的甲酸铵溶液;(2)取1.1111ml0.135m的甲酸铵溶液,于15ml离心管中,加18.8889ml的超纯水,充分混匀,得到流动相a;(3)取50μl的浓氨水于步骤(2)的溶液中,每加一次测定一次ph,到5次时减少到20μl以下每次,最后用ph计测定ph值,共消耗335μl氨水,得到ph为10甲酸铵-氨缓冲溶液,此溶液即为流动相a(10mm甲酸铵水溶液)。
配制流动相b(90%乙腈/10%甲酸铵水溶液):称取0.0095g的甲酸铵,加1.5ml的超纯水溶解,然后加13.5ml的乙腈,得到10mm的甲酸铵溶液,加335μl的氨水,此溶液为流动相b(90%乙腈/10%甲酸铵水溶液)。
2、设计8种由不同比例的流动相a和流动相b组成的流动相c:
编号为1到8的流动相c对应的乙腈的浓度分别为:5.0%、20.0%、35%、40%、48%、55%、75%、90%,每个不同的流动相c的体积均为300μl,每个流动相都用独立的离心管进行保存,具体配制比例见表1。
表1流动相c的组成
3、利用图2装置,先断开spe柱和转接头之间的联接,用电子分析天平称取50mg的c4反相色谱填料,加入spe柱中。
4、用移液枪取500μl的流动相a,加入spe柱中,注射器后拉,联接好转接头和spe柱,spe柱的下端放置一个离心管,缓慢推注射器,从spe柱下端流出的溶液,用高速离心机于12000rpm下离心5分钟,检查填料是否漏出,确定填料不会漏出后在进行其他的分离步骤。
5、完成步骤4之后,取500μl2.06μg/μl(1030μg)的无盐e.coli破碎的蛋白质混合液,加入spe柱中,注射器后拉,再把spe柱和转接头相连在一起,spe柱的下端用离心管承接流出的溶液,慢慢的推注射器,使蛋白质混合液缓慢的经过色谱填料而被吸附。
6、流出的液体用移液枪取出再次加入spe柱中,重复步骤4和步骤5共6次,多次上样,提高吸附比例。
7、按表1配制的8个不同的流动相c对大肠杆菌蛋白样品进行洗脱,按流动相c中乙腈浓度从小到大的顺序。每个不同流动相c洗脱的蛋白质样品即为一个馏份,洗脱的操作为:断开spe柱和转接头之间的联接,注射器向后拉,用移液枪取300μl的流动相c,加入spe柱中,联接spe柱和转接头,缓慢推注射器,使流动相流出,不同流动相比例下流出的馏份用不同编号的500μl离心管接收。重复8次洗脱操作,一共可收集到如表1的8个不同的馏份。
8、得到的8个馏份用真空浓缩仪进行浓缩干燥,用50μl的纯净水进行溶解,即得预分离后的8馏份。
9、用sds-page凝胶电泳的方法,对8个不同的馏份样品进行分离效果验证:具体操作为:
(1)按表2配制15%的分离胶的配制及灌胶:
表2分离胶的配制方法
将6.5ml的分离胶加入凝胶槽中,用水密封,静置30分钟。
(2)按表3配制5%的浓缩胶及灌胶
表3浓缩胶的配制方法
将凝胶槽中的密封水倒去,用无尘纸吸干水;加入配制好的浓缩胶至满,插入10孔的梳子,静置30分钟,取下梳。
(3)于8个离心管中,分别加入15μl的2×电泳缓冲液和15μl的1到8号馏份溶液,各馏份的上样量为15μl;e.coli原始蛋白样品上样量为12μl。
(4)恒压120v,电泳80分钟,电泳完成后按考马斯亮蓝染色试剂盒的说明书,利用考马斯亮蓝染色试剂盒对凝胶进行染色和脱色。实验结果见图3,e.coli得原始蛋白样品被分离在馏分1到8中。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!