单抗N糖糖型的快速分析方法与流程
本发明涉及化学分析检测技术领域,尤其是涉及单抗n糖糖型的快速分析方法。
背景技术:
在制药工业中,生物医药技术受到越来越多的关注。单抗药物的使用已经有一百多年的历史,由于其低毒副作用、高特异性疗效、较长的半衰期和容易规模化生产等特点,使单抗药物在生物药物领域成为一种非常成熟的产品,也是众多药企争相涉足的领域。当前,多数单抗产品都是由哺乳动物细胞表达的,很大一部分原因是哺乳动物细胞可以实现对单抗蛋白分子复杂的糖基化修饰,而糖基化修饰可以增加蛋白的稳定性及溶解度,以达到较长的半衰期,同时使抗体分子具备生物活性。最常见的单抗表达系统为cho细胞系,因其产生的单抗分子的糖基化修饰的种类与比例最接近人的igg糖基化修饰。
作为单抗药物开发的源头,细胞株克隆的筛选是非常关键的,不同细胞株克隆不仅抗体产量有差异,而且糖基化修饰的种类与比例也有差异,这就需要进行对细胞株克隆所产生的抗体分子糖基化修饰的种类与比例进行表征。
传统的糖基化表征是通过n-糖苷酶切下多糖后,使用衍生试剂2-aa或2-ab进行标记,再通过高效液相色谱法进行分析。这种方法存在以下问题:
①对样品的纯度要求高,细胞培养物需要经过proteina色谱柱纯化后才能用于后续的切糖和标记;
②切糖和衍生试剂标记的过程费时费力;
③使用高效液相色谱仪分析时还需要加入价格不菲的n糖标准品作为参照。
因此,使用传统的2-aa或2-ab标记法,单个样品分析测试占用时间长,导致单位时间内检测分析样品量少,效率低下,检测通量与自动化程度低。从拿到样品到获得结果需要3天左右的时间,对单克隆抗体细胞株的筛选造成极大的时间浪费。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种单抗n糖糖型的快速分析方法,该分析方法相比传统的多糖标记法具有快速、高效、灵敏的优点,为生物制药行业的细胞株开发提供有力支持,将极大地加快细胞株筛选的开发进度。
为了实现以上目的,本发明提供了以下技术方案:
单抗n糖糖型的快速分析方法,包括下列步骤:
步骤a:将待测细胞培养物离心后,取上清液,稀释至预定的抗体浓度,得到供试品;
步骤b:向所述供试品中加入ides酶和还原剂进行酶解反应和还原反应,之后离心,取上清液,得到抗体酶切与还原亚单位溶液;
步骤c:通过毛细管电泳-质谱联用法检测所述抗体酶切与还原亚单位溶液,得到离子流色谱图,获取所述抗体酶切与还原亚单位溶液中不同糖型分子ai的强度和分子量;
步骤d:对照含有各种糖型分子的分子量的数据库,确定所述不同糖型分子ai的分子量所对应的糖型,并以每个糖型分子ai的强度占该糖型分子ai所属的亚单位的总强度的比例作为该糖型分子ai的糖型比例。
毛细管电泳-质谱联用是一种新兴的质谱技术,毛细管电泳仪根据分析物带电荷情况和分子大小,对分析物进行分离和离子化,由于上样量达到纳升级别,可以极大提高质谱的灵敏度和检测限,另外分析速度极快,数分钟之内可以完成样品检测,从而实现高通量检测。
本发明利用毛细管电泳-质谱联用技术检测单抗糖型的原理是:
由于单抗蛋白经过ides酶切和还原剂处理后,可以获得fd、lc、fc三个亚单位,其中fc亚单位上保留有完整的n糖修饰类型和比例信息。在另外一种处理方法中,单抗蛋白经过还原剂还原,破坏了链间与链内二硫键,可以获得hc与lc两个亚单位,其中hc亚单位上同样保留有完整的n糖修饰类型和比例信息。利用质谱技术,特别是zipchip毛细管电泳-质谱联用技术,可以将fd、lc、fc三个亚单位或者hc与lc两个亚单位很好地分开,再加上该技术上样量低至nl级别,提高了质谱检测的灵敏度,有助于提高对于低丰度n糖的抗体片段的检测,再加上样品前处理方法简化及zipchip毛细管电泳-质谱联用技术对分析物能够在数分钟内完成分析,从拿到样品到获得结果需要5~8个小时左右的时间,从而极大地提高单克隆抗体细胞株的筛选效率。
在本发明中,酶和还原剂的选用是结果准确性的关键点。只有经过适当的酶解和还原后,才能保留完整的n糖修饰类型和比例信息,且保证不同亚单元能够充分分离。
在本发明中,确定所述不同糖型分子ai的分子量所对应的糖型时,可以参照数据库人工确证,或者利用智能软件自动给出,例如biopharm软件intactmass分析模块。
在实际检测过程中,为了验证以上分析方法的准确性,还可将只经过还原处理的培养物溶液作为对照,该对照除了没有经过酶反应处理外,其余处理条件及检测条件同上述方法。
本发明中,糖型比例的计算方法是:
以分离出的某一糖型分子ai为例,若其属于fc亚单元,则将ai的强度除以谱图中所有属于fc亚单元的糖型分子的强度总和,即得该糖型分子ai的糖型比例。
在此基础上,各检测条件还可以进一步优化,具体如下。
优选地,向所述供试品中加入ides酶和还原剂进行酶解反应和还原反应的过程为:
先加入ides酶,混匀后在35~40℃下孵育0.5~8h;然后加入还原剂,混匀后在35~40℃下孵育0.5h~2h。
优选地,所述ides酶和所述还原剂均以溶液的形式加入所述供试品中。
优选地,所述ides酶的加入量为:每20~40mg抗体加入2.5×104~25×104酶活单位。
优选地,所述还原剂为二硫苏糖醇、三(2-羧乙基)膦、β-巯基乙醇和巯基乙胺中的一种或多种,优选为二硫苏糖醇。
优选地,所述还原剂的加入量为:每20~40mg抗体加入终浓度为50~200mmol/l的还原剂。此处的“终浓度”指还原剂加完后在溶液中的浓度。
优选地,所述预定的抗体浓度为0.5~3mg/ml,优选0.5~1mg/ml。样品中抗体浓度不宜过高,以避免酶切不彻底,或者电泳无法分离。
优选地,向所述供试品中加入的ides酶浓度为45~55酶活单位/μl。
优选地,向所述供试品中加入的还原剂浓度为0.7mol/l~1.2mol/ml,优选1.0mol/l~1.2mol/ml。
优选地,步骤b中,在完成所述酶解反应和还原反应之后和离心之前还进行:
加入甲酸溶液,静置反应。
加入甲酸可以溶解部分沉淀的蛋白,提高结果准确性。
优选地,所述稀释时所用的稀释剂为:
乙腈:水:甲酸:1mol/l乙酸铵溶液的混合物,其体积比为45~50:45~50:0.5~5:0.5~5。
优选地,毛细管电泳检测时所用的电泳缓冲液为乙腈:水:甲酸的混合物,其体积比为45~50:45~50:0.5~5,优选45~50:45~50:2~5。
稀释剂以及电泳缓冲液均是电泳分离的关键技术参数,是决定亚单位是否能够分离的关键点,直接影响结果准确性。
优选地,步骤b中还将所述抗体酶切与还原亚单位溶液稀释至抗体浓度为0.5~3mg/ml,所用的稀释剂与所述步骤a稀释用的稀释剂相同。
优选地,所述毛细管电泳-质谱联用法中,毛细管电泳仪参数如下:进样量为1.0~7.0nl,辅助加压开始时间为0.5~3.0min,检测时间为3.0~8.0min,hr或hrx芯片。
优选地,所述毛细管电泳-质谱联用法中,质谱参数如下:扫描范围m/z800-3000,鞘气流速1.5~2.5l/min,离子传输管温度180~220℃,正离子模式。
优选地,每个步骤中的离心速度为10000~15000rpm,优选13000~15000rpm。
本发明的快速分析方法可用于抗体开发时常规细胞株的筛选,尤其是cho细胞株筛选。
综上,与现有技术相比,本发明达到了以下技术效果:
(1)毛细管电泳-质谱联用技术,样品上样量仅为纳升级别,可以将复杂培养物基质干扰降到很低水平,极大增强了方法灵敏度;
(2)简化了样品前处理的要求,只要将细胞培养物样品经过离心,加入ides酶进行酶切,然后还原,再加入甲酸溶解沉淀,最后再使用样品稀释剂进行稀释处理即可,整个样品制备过程数小时内可以完成,极大提高了分析通量和分析的自动化程度,避免了繁杂的衍生化操作,避免了潜在的人为误差或者差错;
(3)单个抗体亚单位样品的检测时间仅为3~8min,从样品前处理到上质谱操作只要5~8个小时即可报告结果,而传统的高效液相色谱法需要至少3天的时间,极大利用了质谱高灵敏度性能和质谱的利用效率,对细胞株筛选开发的提速提供巨大支持;
(4)采用biopharm软件intactmass分析模块可以让软件自动给出的主要糖型修饰类型,并根据其强度所占比例得出不同糖型分子所占比例,所给的结果精度高,重复性好,完全可以媲美传统的2-aa或2-ab标记法高效液相色谱技术。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
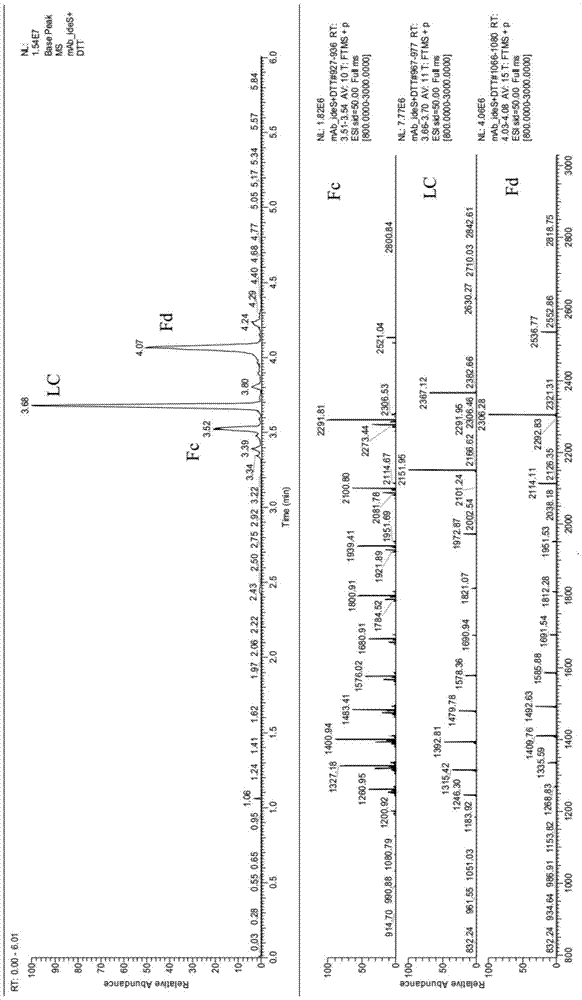
图1是单抗酶切与还原亚单位的基峰离子流图及其fc亚单位、lc亚单位与fd亚单位质谱图;
图2是单抗还原亚单位的基峰离子流图及其hc亚单位与lc亚单位质谱图;
图3是根据单抗酶切与还原亚单位全卷积得到的各类糖型的fc亚单位分子量分析结果;
图4是根据单抗酶切与还原亚单位全卷积得到的各类糖型的hc亚单位分子量分析结果。
具体实施方式
下面将结合附图和具体实施方式对本发明的技术方案进行清楚、完整地描述,但是本领域技术人员将会理解,下列所描述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
一种单抗n糖糖型快速分析的毛细管电泳-质谱联用技术检测方法
一、溶液配制
1mol/l乙酸铵溶液配制:取一支15ml离心管,准确称量0.77g乙酸铵,加入10ml水,涡旋30s,充分混匀。
还原剂溶液:取一支15ml离心管,准确称量二硫苏糖醇1.54g,加入10ml水,涡旋30s,充分混匀。
样品稀释剂配制:取一支15ml离心管,分别加入4.9ml乙腈,4.9ml水,0.2ml甲酸、0.1ml1mol/l乙酸铵溶液,涡旋30s,充分混匀。
电泳缓冲液的配制:取一支100ml干净试剂瓶,分别加入49ml质谱级乙腈,49ml质谱级水,2ml质谱级甲酸,充分摇匀。
所述的乙腈、水、乙酸铵均为质谱级。
ides酶液的配制:取一支promega公司产的ides酶冻干粉,规格为5000酶活单位/支,加入100μl水,配制得到50酶活单位/μl的ides酶液。
所述的酶活单位是这样定义的:在30min内,将1μg的重组单克隆igg的95%及以上切开的酶量为1个酶活单位。
二.具体检测步骤
①抗体酶切与还原亚单位溶液制备:使用nanodrop微量紫外可见分光光度计测定培养物中抗体的浓度;使用离心机将待测培养物样品以13000rpm转速离心15min,弃沉淀,用水将培养物样品稀释成抗体浓度为0.5mg/ml的培养物稀释溶液。向50μl培养物稀释溶液中加入1μlides酶液,涡旋10s混合均匀,置于水浴锅中37℃孵育4h。酶切结束后,加入8.8μl还原剂溶液,置于水浴锅中37℃孵育0.5h。还原处理时间到后,加入1μl甲酸,室温静置10min,再使用离心机以13000rpm的转速离心15min,取出上清液。向30μl上清液中加入30μl的样品稀释液后制备得到抗体酶切与还原亚单位溶液。
②抗体还原亚单位溶液制备:使用nanodrop微量紫外可见分光光度计测定培养物中抗体的浓度;使用离心机将培养物样品以13000rpm转速离心15min,弃沉淀,用水将培养物样品稀释至抗体浓度为0.5mg/ml。加入8.8μl还原剂溶液,置于水浴锅中37℃孵育0.5h。还原处理时间到后,加入1μl甲酸,室温静置5~30min,再使用离心机以13000rpm的转速离心15min,取出上清液。向30μl上清液中加入30μl样品稀释液后制备得到抗体还原亚单位溶液。
③分别取抗体酶切与还原亚单位溶液及抗体还原亚单位溶液各1.0nl,使用毛细管电泳-质谱联用仪进行分析。质谱采用一级扫描方式采集数据,检测条件如表1和2。
毛细管电泳仪为美国908devices公司的zipchip,需在zipchip上使用hs芯片和电泳缓冲液对分析物进行毛细管电泳分离和蛋白分子离子化,然后使用质谱进行分析。毛细管电泳-质谱联用仪条件如下。
表1.zipchip毛细管电泳仪参数
所述的质谱仪为thermoscientificqe质谱,所述的质谱一级扫描相关参数设置如下。
表2.质谱参数设置
④数据处理:采用biopharm软件的intactmass模块处理数据,根据biopharm软件给出的各种糖型修饰的抗体分子的分子量判断出现的主要n糖糖型修饰类型,根据其强度所占比例得出不同糖型分子所占比例。不同fc亚单位的含量同其峰强度成正比,通过fc亚单位峰强度所占比重(基准为所有fc亚单位强度总和)计算得到不同fc亚单位的含量比例,也就是完整单抗不同糖型的比例。同理,不同hc亚单位的含量同其峰强度成正比,通过hc亚单位峰强度所占比重(基准为所有hc亚单位强度总和)计算得到不同hc亚单位的含量比例,也就是完整单抗不同糖型的比例。
经过抗体酶切与还原形成的亚单位水平更能准确反映出低丰度修饰糖型的比例,最终的报告结果以抗体酶切与还原亚单位溶液的检测结果为准,抗体酶还原亚单位的检测结果作为佐证和参考。
三、zipchip毛细管电泳-质谱联用技术和2-ab标记法高效液相色谱法技术检测结果的比对
分别使用毛细管电泳-质谱联用技术和高效液相色谱法技术分析同一份单克隆细胞培养物中主要n糖糖型及其比例,不同样品得到谱图如图1至4,计算得到糖型比例如表3和表4,两种方法检测结果相对偏差可以接受。
所述的2-ab标记使用的是waters公司2-ab标记试剂盒。
表3.zipchip毛细管电泳-质谱联用技术和2-ab标记法高效液相色谱法技术(酶切与还原亚单位)检测单克隆细胞株培养物中主要n糖糖型及其
比例的结果比对
所述的表3中毛细管电泳-质谱联用技术检测结果为使用毛细管电泳-质谱联用技术检测单抗酶切与还原亚单位溶液的三次重复实验的结果,以平均值±标准差报告最终结果。
所述的表3中2-ab标记法结果为单次实验的结果。
所述的表3中两种方法偏差为毛细管电泳-质谱联用技术检测结果相对2-ab标记法高效液相色谱结果的偏差。
表4.zipchip毛细管电泳-质谱联用技术和2-ab标记法高效液相色谱法技术(还原亚单位)检测单克隆细胞株培养物中主要n糖糖型及其比例的
结果比对
所述的表4中毛细管电泳-质谱联用技术检测结果为使用毛细管电泳-质谱联用技术检测单抗还原亚单位溶液的三次重复实验的结果,以平均值±标准差报告最终结果。
所述的表4中2-ab标记法结果为单次实验的结果。
所述的表4中两种方法偏差为毛细管电泳-质谱联用技术检测结果相对2-ab标记法高效液相色谱结果的偏差。
本发明一次测定准确给出单克隆细胞株培养物中主要n糖糖型及其比例的结果,除了g1f-gn糖型比例检测偏差过大外,其余的检测结果与2-ab标记法高效液相色谱结果相一致。毛细管电泳-质谱联用技术检测结果最终以酶切与还原亚单位溶液的三次重复实验的结果为准,还原亚单位溶液的三次重复实验的结果仅作为参考与佐证。
本发明已用于生物制药工艺单克隆抗体细胞株开发的培养物样本的n糖糖型及其比例分析,结果表明该方法准确性能够满足细胞株筛选工艺的检测需要。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!