多肽合成芯片以及包括其的多肽阵列检测系统的制作方法
本实用新型涉及生物医学技术领域,尤其是涉及一种多肽合成芯片以及包括其的多肽阵列检测系统。
背景技术:
后基因组时代,科学家们已将研究的重点由基因组学研究转向功能性蛋白质组学研究。蛋白质组学以研究细胞中蛋白质的组成和结构,蛋白与蛋白相互之间的作用以及各种功能性蛋白与疾病发病机理之间的关系为主。而蛋白质与其他大分子如其他蛋白质、核酸以及多糖之间的相互作用研究则是蛋白质组学研究的关键部分。
目前,许多技术以开发用于这一相互作用的研究,多肽合成芯片技术就是其中关键的技术之一,被广泛用于药物的筛选、靶标确认、表位定位、疫苗开发以及蛋白质结构功能的研究。同时,出于对多肽药物不断增加的兴趣,多肽合成芯片技术也能满足大量的制药企业不断增长的对多肽药物研发的需求。
但是,现有多肽合成芯片中多肽的合成通常为基于树脂的手动、半自动、全自动的常规合成及微波多肽合成以及基于纤维膜的原位合成,不但氨基酸检测的通量较低,而且消耗物质的量也较大,已不能满足多肽合成和蛋白检测日益提高的检测通量要求。
因此,研究开发一种可以在芯片载体上直立进行多肽合成的多肽合成芯片,进而以层为单位合成多肽,有效缓解现有的平铺式多肽合成方式检测通量和检测密度较低的问题,变得十分必要与紧迫。
有鉴于此,特提出本实用新型。
技术实现要素:
本实用新型的第一目的在于提供一种多肽合成芯片,所述多肽合成芯片包括固相载体以及包被于固相载体上能与氨基酸的羧基端进行反应而使后续合成的多肽固定于芯片上的3D聚合物包衣层,该多肽合成芯片可以在芯片载体上直立进行多肽合成,进而以层为单位合成多肽,有效缓解现有的平铺式多肽合成方式检测通量和检测密度较低的问题,具有检测通量和密度高、操作简易快速,结果精确直观,易分析的优点。
本实用新型的第二目的在于提供一种多肽阵列检测系统,该多肽阵列检测系统包括上述多肽合成芯片,上述多肽阵列检测系统可广泛应用于肿瘤抗体表位筛查,抗原表位寻找,蛋白质模拟表位选优等工作。
本实用新型提供的一种多肽合成芯片,所述多肽合成芯片包括固相载体以及包被于固相载体上能与氨基酸的羧基端进行反应而使后续合成的多肽固定于芯片上的3D聚合物包衣层。
进一步的,所述固相载体为有机玻璃薄片。
更进一步的,所述有机玻璃薄片的长度为8~25cm,宽度为1.5~6cm。
更进一步的,所述有机玻璃薄片的维氏硬度为150~600HV,冲击强度为5~30J/m。
进一步的,所述有机玻璃薄片的厚度为1.5~2.5mm。
进一步的,所述3D聚合物包衣层的包被厚度为0.2~0.5mm。
进一步的,所述3D聚合物包衣层的表面裸露设置有连接氨基酸羧基端的官能团。
更进一步的,所述官能团为NHS、氨基、羟基或氯离子
更进一步的,所述3D聚合物包衣层主要由聚丙烯酸树脂组成。
本实用新型提供的一种多肽阵列检测系统,所述多肽阵列检测系统包括上述多肽合成芯片。
与现有技术相比,本实用新型的有益效果为:
本实用新型提供的多肽合成芯片,所述多肽合成芯片包括固相载体以及包被于固相载体上能与氨基酸的羧基端进行反应而使后续合成的多肽固定于芯片上的3D聚合物包衣层。本实用新型多肽合成芯片3D聚合物包衣层采用包被的方法设置于固相载体上。在多肽的合成过程中,3D聚合物包衣层与氨基酸的羧基端进行反应使氨基酸固定于合成芯片上,随后采用重复添加氨基酸的方法使多肽链直立于芯片上完成多肽的合成,进而以层为单位合成多肽,有效缓解现有的平铺式多肽合成方式检测通量和检测密度较低的问题,具有检测通量和密度高、操作简易快速,结果精确直观,易分析的优点。
本实用新型提供的多肽阵列检测系统,该多肽阵列检测系统包括上述多肽合成芯片,可广泛应用于肿瘤抗体表位筛查,抗原表位寻找,蛋白质模拟表位选优等工作。
附图说明
为了更清楚地说明本实用新型具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本实用新型的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
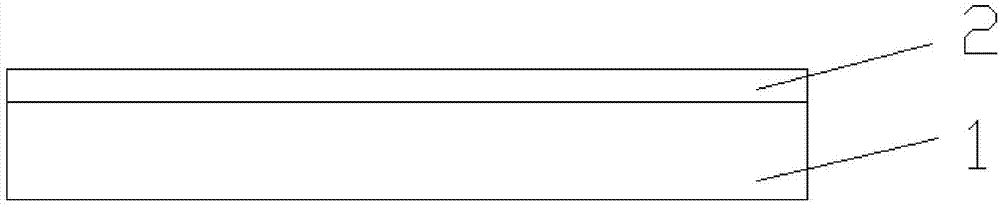
图1为本实用新型实施例1提供的多肽合成芯片的侧面剖视结构示意图;
图2为本实用新型实施例1提供的多肽合成芯片的俯视结构示意图;
图3为本实用新型实施例1提供的多肽合成芯片官能团为氨基的侧面剖视结构示意图;
图4为本实用新型实施例2提供的多肽合成示意图。
图标:1-固相载体;2-3D聚合物包衣层;3-官能团。
具体实施方式
下面将结合附图对本实用新型的技术方案进行清楚、完整地描述,显然,所描述的实施例是本实用新型一部分实施例,而不是全部的实施例。基于本实用新型中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本实用新型保护的范围。为了有助于更清楚的理解本实用新型,现通过具体的实施例对本实用新型进行详细的介绍。
在本实用新型的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本实用新型和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本实用新型的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。
在本实用新型的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本实用新型中的具体含义。
以下结合附图对本实用新型的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本实用新型,并不用于限制本实用新型。
根据本实用新型的一个方面,一种多肽合成芯片,所述多肽合成芯片包括固相载体1以及包被于固相载体1上能与氨基酸的羧基端进行反应而使后续合成的多肽固定于芯片上的3D聚合物包衣层2。
本实用新型提供的多肽合成芯片,所述多肽合成芯片包括固相载体1以及包被于固相载体1上能与氨基酸的羧基端进行反应而使后续合成的多肽固定于芯片上的3D聚合物包衣层2。本实用新型多肽合成芯片3D聚合物包衣层2采用包被的方法设置于固相载体1上。在多肽的合成过程中,3D聚合物包衣层2与氨基酸的羧基端进行反应使氨基酸固定于合成芯片上,随后采用重复添加氨基酸的方法使多肽链直立于芯片上完成多肽的合成,进而以层为单位合成多肽,有效缓解现有的平铺式多肽合成方式检测通量和检测密度较低的问题,具有检测通量和密度高、操作简易快速,结果精确直观,易分析的优点。
在本实用新型的一种优选实施方式中,所述固相载体1为有机玻璃薄片。
作为一种优选的实施方式,上述固相载体1为有机玻璃薄片,有机玻璃薄片具有分辨率高,相互干扰小,信号明显等优点。
在上述优选实施方式中,所述有机玻璃薄片的长度为8~25cm,宽度为1.5~6cm。
本实用新型中,上述有机玻璃薄片的长度典型但非限定性的为8cm、10cm、15cm、18cm、20cm、22cm和25cm。
本实用新型中,上述有机玻璃薄片的宽度典型但非限定性的为1.5cm、3cm、4cm、5cm和6cm。
在上述优选实施方式中,所述有机玻璃薄片的维氏硬度为150~600HV,冲击强度为5~30J/m。
本实用新型中,上述有机玻璃薄片的维氏硬度典型但非限定性的为150HV、200HV、300HV、400HV、500HV和600HV。
本实用新型中,上述有机玻璃薄片的冲击强度典型但非限定性的为5J/m、10J/m、15J/m、20J/m、25J/m和30J/m。
在本实用新型的一种优选实施方式中,所述有机玻璃薄片的厚度为1.5~2.5mm,所述3D聚合物包衣层2的包被厚度为0.2~0.5mm。
本实用新型中,上述有机玻璃薄片的厚度典型但非限定性的为1.5mm、1.8mm、2.0mm、2.2mm和2.5mm。
在本实用新型的一种优选实施方式中,所述3D聚合物包衣层2的包被厚度为0.2~0.5mm。
本实用新型中,上述3D聚合物包衣层2的包被厚度典型但非限定性的为0.2mm、0.3mm、0.4mm和0.5mm。
在本实用新型的一种优选实施方式中,所述3D聚合物包衣层2的表面裸露设置有连接氨基酸羧基端的官能团3。
作为一种优选的实施方式,上述3D聚合物包衣层2的表面裸露设置有连接氨基酸羧基端的官能团3,在多肽合成的开始阶段,上述官能团3可以与氨基酸的羧基端进行连接,进而使多肽固定于本实用新型多肽芯片的表面。
在上述优选实施方式中,所述官能团3为NHS、氨基、羟基或氯离子。
所述NHS为N-羟基琥珀酰亚胺,N-羟基琥珀酰亚胺与氨基酸的羧基端进行反应使氨基酸固定于合成芯片上,随后采用重复添加氨基酸的方法使多肽链直立于芯片上完成多肽的合成,进而以层为单位合成多肽。
优选的,所述官能团3还可以为能够与氨基酸的羧基端连接的其他碱性基团。
在本实用新型的一种优选实施方式中,所述3D聚合物包衣层2主要由聚丙烯酸树脂组成。
根据本实用新型的一个方面,一种多肽阵列检测系统,所述多肽阵列检测系统包括上述多肽合成芯片。
本实用新型提供的多肽阵列检测系统,该多肽阵列检测系统包括上述多肽合成芯片,可广泛应用于肿瘤抗体表位筛查,抗原表位寻找,蛋白质模拟表位选优等工作。
实施例1
如图1所示,一种多肽合成芯片,所述多肽合成芯片包括固相载体1以及包被于固相载体1上能与氨基酸的羧基端进行反应而使后续合成的多肽固定于芯片上的3D聚合物包衣层2。
本实用新型提供的多肽合成芯片,所述多肽合成芯片包括固相载体1以及包被于固相载体1上能与氨基酸的羧基端进行反应而使后续合成的多肽固定于芯片上的3D聚合物包衣层2。本实用新型多肽合成芯片3D聚合物包衣层2采用包被的方法设置于固相载体1上。在多肽的合成过程中,3D聚合物包衣层2与氨基酸的羧基端进行反应使氨基酸固定于合成芯片上,随后采用重复添加氨基酸的方法使多肽链直立于芯片上完成多肽的合成,进而以层为单位合成多肽,有效缓解现有的平铺式多肽合成方式检测通量和检测密度较低的问题,具有检测通量和密度高、操作简易快速,结果精确直观,易分析的优点。
在本实用新型的一种优选实施方式中,所述固相载体1为有机玻璃薄片。
作为一种优选的实施方式,上述固相载体1为有机玻璃薄片,有机玻璃薄片具有分辨率高,相互干扰小,信号明显等优点。
在上述优选实施方式中,所述有机玻璃薄片的长度为8~25cm,宽度为1.5~6cm。
优选的,所述有机玻璃薄片的长度为12cm,宽度为3cm。
在本实用新型的一种优选实施方式中,所述有机玻璃薄片的维氏硬度为150~600HV,冲击强度为5~30J/m。
优选的,所述有机玻璃薄片的维氏硬度为400HV,冲击强度为20J/m。
在本实用新型的一种优选实施方式中,所述有机玻璃薄片的厚度为1.5~2.5mm。
优选的,所述有机玻璃薄片的厚度为2.0mm。
在本实用新型的一种优选实施方式中,所述3D聚合物包衣层2的包被厚度为0.2~0.5mm。
优选的,所述3D聚合物包衣层2的包被厚度为0.2mm。
如图2所示,在本实用新型的一种优选实施方式中,所述3D聚合物包衣层2的表面裸露设置有连接氨基酸羧基端的官能团3。
作为一种优选的实施方式,上述3D聚合物包衣层2的表面裸露设置有连接氨基酸羧基端的官能团3,在多肽合成的开始阶段,上述官能团3可以与氨基酸的羧基端进行连接,进而使多肽固定于本实用新型多肽芯片的表面。
在本实用新型的一种实施方式中,所述官能团3为NHS、氨基、羟基或氯离子。
如图3所示,在上述优选实施方式中,所述官能团3为氨基。
在本实用新型的一种优选实施方式中,所述3D聚合物包衣层2主要由聚丙烯酸树脂组成。
实施例2
一种多肽阵列检测系统,所述多肽阵列检测系统包括上述多肽合成芯片。上述多肽阵列检测系统可以广泛应用于肿瘤抗体表位筛查,抗原表位寻找,蛋白质模拟表位选优等工作。
如图4所示,使用原位合成法对多肽进行合成,在多肽的合成过程中,多肽合成芯片上的3D聚合物包衣层2与氨基酸的羧基端进行反应使氨基酸固定于合成芯片上,随后采用重复添加氨基酸的方法使多肽链直立于芯片上完成多肽的合成,进而以层为单位合成多肽。
上述多肽阵列检测系统可以广泛应用于肿瘤抗体表位筛查,抗原表位寻找,蛋白质模拟表位选优等工作。例如,抗原表位的检测,首先根据已知的蛋白序列,在多肽芯片上合成连续的仅有1或2个氨基酸位移的短多肽片段,随后与样本(如血清、尿液以及任何特殊蛋白)中的目标蛋白进行孵化反应,洗涤后再用荧光二抗孵化,然后再用能观测芯片的设备观察,有荧光点的就是要找的抗原表位。
综上所述,本实用新型提供的多肽合成芯片,所述多肽合成芯片包括固相载体1以及包被于固相载体1上能与氨基酸的羧基端进行反应而使后续合成的多肽固定于芯片上的3D聚合物包衣层2。本实用新型多肽合成芯片3D聚合物包衣层2采用包被的方法设置于固相载体1上。在多肽的合成过程中,3D聚合物包衣层2与氨基酸的羧基端进行反应使氨基酸固定于合成芯片上,随后采用重复添加氨基酸的方法使多肽链直立于芯片上完成多肽的合成,进而以层为单位合成多肽,有效缓解现有的平铺式多肽合成方式检测通量和检测密度较低的问题,具有检测通量和密度高、操作简易快速,结果精确直观,易分析的优点。
最后应说明的是:以上各实施例仅用以说明本实用新型的技术方案,而非对其限制;尽管参照前述各实施例对本实用新型进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本实用新型各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!