使用数字全息显微术的特异性疟疾检测的制作方法
本发明涉及一种使用数字光学显微镜(dhm)检测患者体内可能的疟疾感染的方法。
背景技术:
疟疾检测遭受一般的测量问题,因为其(1)需要快速检测(分子诊断测试不够快并且通常需要3个小时),(2)需要优良的灵敏性(寄生虫血症<0.1‰;金标准厚膜诊断),(3)必须具有特异性(目前只能通过薄膜显微术定量地实现),并且(4)尤其应该只需要低成本(基于侧向流分析的初步定性快速测试;1usd/测试)。奇怪的是,尤其是在非洲国家,疟疾快速测试导致显微术使用减少,这导致诊断信息的丢失。另一方面,通常只能通过血液分析仪,利用与正常血液相比白细胞(wbc)或血小板的设备特异性偏差来间接确定疟疾感染。
迄今为止,与临床相关的是薄(特异性)和厚(灵敏性)膜的手动显微镜检查,用于治疗中的初步诊断和鉴别诊断。在资源薄弱的地区,优选使用快速测试进行初步诊断。通常,通过厚膜的裂解和染色来检测寄生虫血症,并通过显微镜观察干燥和染色的红血球来检测特异性。
但是,上述方法存在上述问题,并且不能满足所有上述标准。
因此,仍然需要一种可靠、快速且相对便宜并且能够获得定量结果的用于检测患者体内可能的疟疾感染的改进方法。
技术实现要素:
发明人开发了一种用于确定使用数字全息显微术(dhm)进行疟疾检测的工作流的特定顺序的方法步骤,尤其是使用简单的微流体流方案,其允许以临床相关性进行所有上述方面(1)至(4)的测量,特别是几乎不需要样品制备。该测量可以整合到成像流式细胞仪中,这在将来会对血液学常规诊断发挥重要作用。
本发明涉及一种检测患者体内可能的疟疾感染的方法,包括:
-提供数字光学显微镜(dhm),
-获得或提供来自所述患者的包含疑似受疟疾侵染(affect)的至少一个红细胞的样品,
-将包含至少一个红细胞的样品与缓冲溶液混合,从而将所述至少一个红细胞形成为球形,以形成球形红细胞,并且将包含至少一个球形红细胞的缓冲溶液导入到微流体装置中,其中所述微流体装置的通道的至少一部分包括在dhm的聚焦区域(focalarea)中,和/或
将包含至少一个红细胞的样品导入到微流体装置中,并且将包含至少一个红细胞的样品与缓冲溶液混合以将所述至少一个红细胞形成为球形,从而形成球形红细胞,其中所述微流体装置的通道的至少一部分包括在dhm的聚焦区域中,
-将所述至少一个球形红细胞引导到dhm的聚焦区域中,
-使用dhm检测所述至少一个球形红细胞,和
-确定所述至少一个红细胞是否受疟疾侵染,从而确定患者是否感染疟疾。
本发明的其他方面和实施方式在从属权利要求中公开,并且可以从以下描述、附图和实施例中获得,但不限于此。
附图说明
附图应说明本发明的实施方式并传达对其的进一步理解。结合说明书,它们用作本发明的构思和原理的解释。可以参照附图得出其他实施方式和许多所述的优点。附图的元件未必彼此成比例。除非另有说明,否则在附图中以相同的附图标记标识相同的、功能等效且作用相同的特征和组件。
图1示意性地显示了如何可能用dhm区分不同的疟疾物种。
在图2中,示意性地描绘了红细胞的球形化。
在图3中,示出了物种区分的示意图。
具体实施方式
定义
除非另有定义,否则本文使用的技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同的含义。
在本发明的上下文中,“样品”是要分析的可能感染疟疾的样品,其包含至少一个红细胞/红血球,例如1、2、3、4、5、6、7、10、100、1000、10000、100000或更多个红细胞。红细胞的形式以及其中的样品状态没有特别限制,并且它可以是例如在世界任何地方的温度下获得或给出的样品,例如范围也可以是从-20℃至低于50℃或更高,例如-10℃至45℃,或0℃至40℃,或10℃至35℃,但也可以在20-25℃的室温下。
样品没有特别限制并且可以是天然或合成来源的,并且可以例如包含来自简单或复杂基质的样品,只要其包含至少一个红细胞即可,例如其可以来自受试者,例如脊椎动物,例如人类或动物。它也可以是先前已经富集、提取、过滤或以任何其他方式处理过的样品,从而富集红细胞或从原始样品中分离出红细胞。样品也可以是无水或贫水的。样品甚至可以是基本上仅含有红细胞的样品,例如将原始样品离心后的样品,或为仅含有血细胞的样品等。根据某些实施方式,所述至少一个红细胞是从患者的原始样品(优选血液样品)中分离的,从而提供了优选主要包含所述至少一个红细胞的样品或优选主要包含大量(amultitudeof)红细胞的样品。
根据某些实施方式,样品是水性样品,即含有水的样品。例如,样品可以是受试者的体液。因此,体液是源自受试者体内,尤其是活体受试者体内的液体。它们包括可以从体内排泄或分泌和/或在体内循环的流体,以及体内水分。它们可以是液体、乳液或悬浮液状态。本发明中的体液的实例特别是血液和源自血液的样品(如果它们至少包含至少一个红细胞)。根据某些实施方式,样品是患者样品(临床分离物)。示例性样品是患者的全血。
根据某些实施方式,从样品中提取物质、富集样品中的物质和/或检测样品中的物质的本发明方法中的受试者可以是脊椎动物,优选为人类或动物,更优选为哺乳动物且最优选为人类,分别为人类患者。
本发明中的脊椎动物是指具有脊椎的动物,包括哺乳动物-包括人类、鸟类、爬行动物、两栖动物和鱼类。因此,本发明不仅适用于人类和人类医学领域,而且还适用于兽医学。这意味着还可以检测动物可能的疟疾感染,例如家养动物在乘坐飞机、轮船等的旅程之后(例如从容易爆发疟疾疫情的地区)的可能疟疾感染。
在本发明中,微流体装置是包含至少一个微通道(即至少宽度和/或深度为1至<1000μm的通道)的任何装置,在所述微通道中可以使有待分析的流体(例如在根据本发明的方法中通过与缓冲溶液混合来处理的样品)流动。其可以包含至少一个用于流动的入口和出口,用于处理和/或操纵物体(对象、目标)的其他通道和/或结构化区域等。
dhm的聚焦区域是dhm焦点周围的区域,其中可以检测到dhm检测光束照射的光的至少50%,优选至少80%,进一步优选至少90%,例如至少95%、98%、99%或甚至高达100%。
在本说明书中,与量有关的所有数值应理解为以wt.%给出,除非另外给出或者从上下文中清楚看出其有其他意指。
在示例性详细描述本发明之前,应理解的是,本发明不限于本文描述方法的工艺步骤的特定组成部分,因为这类方法可以变化。还应理解的是,本文使用的术语仅出于描述特定实施方式的目的,而不旨在进行限制。必须注意的是,在说明书和所附权利要求书中使用的单数形式“一个(a)”、“一种(an)”和“该/所述(the)”包括单数和/或复数指代,除非上下文中另有明确规定。例如,本文使用的术语“一个”可以理解为一个单一实体或“一个或多个”实体的含义。还应理解的是,除非上下文另外明确指出,否则复数形式包括单数和/或复数指代。此外应理解的是,在给出由数值限定的参数范围的情况下,该范围被认为包括这些限制值。
本发明涉及一种检测患者体内可能的疟疾感染的方法,包括:
-提供数字光学显微镜(dhm),
-获得或提供来自患者的包含疑似受疟疾侵染的至少一个红细胞的样品,
-将包含至少一个红细胞的样品与缓冲溶液混合,以将所述至少一个红细胞形成为球形,从而形成球形红细胞,并且将包含至少一个球形红细胞的缓冲溶液导入到微流体装置中,其中所述微流体装置的通道的至少一部分包括在dhm的聚焦区域中,和/或
将包含至少一个红细胞的样品导入到微流体装置中,并且将包含至少一个红细胞的样品与缓冲溶液混合以将所述至少一个红细胞形成为球形,从而形成球形红细胞,其中所述微流体装置的通道的至少一部分包括在dhm的聚焦区域中,
-将所述至少一个球形红细胞引导到dhm的聚焦区域中,
-使用dhm检测所述至少一个球形红细胞,和
-确定所述至少一个红细胞是否受疟疾侵染,从而确定患者是否感染疟疾。
在本方法中,dhm的提供和数字全息显微镜本身不受特别限制,并且可以采用任何形式。使用相干光源和至少一个分束器,可以使用数字全息显微镜来构建样品的全息图像,并且其设置没有特别限制。数字全息显微镜使用参考光束(referencebeam)和检测光束(detectionbeam)进行工作,这些光束能够以不同的光束设置进行适当地设置,例如同轴(onaxis)、离轴、垂直等。作为必要的物镜,可以存在其他分束器、聚光镜等。
使用dhm的数字全息显微术可以例如在透射或可选反射模式下执行,并且可以使用通用光束设置(commonbeamsetup)参考执行。对比度(反差、衬度,contrast)是介质与细胞之间以及在亚细胞成分之间的细微折射率变化的散射效应的结果。亚细胞成分的定量和积分相位(积分相)信息与米氏散射(miescatter)有关。
优选进行离轴测量,从而可以实现更简单且更稳健的干扰设置,并且测量距离短,从而将噪声降至最低。因此,根据某些实施方式,数字全息显微装置的参考光束和检测光束是离轴的。另外,优选在透射模式下进行测量。
景深(depthoffield)优选为5.7μm或更小,更优选为4.7μm或更小,例如3μm或2μm或更小,特别优选为1.5μm或更小。在减小景深的情况下,也可以实现良好的横向分辨率,从而促进细胞鉴别。在低景深下,可以容易地观察和鉴别细胞中进一步的细胞区室,如白细胞中的颗粒,从而使得可以改善细胞的鉴别度(分辨率)。此外,使用减小的景深可以更好地获得诸如相位信息等其他信息。
使用微流体装置/系统可以实现对要检测的红细胞的聚焦,从而即使在流动条件下,也可以容易地引导它们通过减小的景深,并因此优选甚至可以对其进行定量。
此外,所应用的微流体装置可以实现不同细胞数的可扩展(规模可改变的,scalable)记录,例如1*103至>1*106个细胞,例如最多达1*107个细胞。根据某些实施方式,检测1*104至1*106个红细胞。这样也可以检测到ppb范围内的很小的寄生虫血症。因此,与以前的检测方法(例如快速测试或pcr)相比,该分析可单独适应于进行预期的诊断或治疗而无需额外的努力。特别地,还可以解决在感染之后由于同步化引起的当前循环阶段(循环期)在不同时间的数量波动(见njwhiteetal.,1992,"theeffectsofmultiplicationandsynchronityonthevasculardistributionofparasitesinfalciparummalaria",transrsoctropmedhyg,86(6),pp.590.7)。
根据某些实施方式,在使包含所述至少一个红细胞的缓冲溶液流动通过所述微流体装置时,进行所述至少一个球形红细胞(例如多于一个红细胞)的检测。所述流动没有特别限制,只要所述至少一个红细胞流过数字全息显微镜/显微装置的速度允许拍摄其图像(该图像不是模糊不清的)以获得具有足够对比度的图像即可,这例如取决于照明时间等。另外,优选应避免过慢的流动以实现足够的通量(吞吐量)。可以根据数字全息显微镜以及微流体装置的参数(例如(一个或多个)微流体通道的尺寸、其表面条件等)来适当地设定流动。
根据某些实施方式,微流体装置中的流动至少在获得所述至少一个细胞的图像的区域中是层流的。通过层流,可以将细胞设置为优选的取向(定向),以便可以容易地检测到它们。可以根据例如微流体装置内的尺寸适当地设定层流流动。
根据某些实施方式,所述微流体装置在检测所述至少一个红细胞的区域中包含微通道,优选其中通过至少一个鞘流产生层流。微通道的尺寸和形状没有特别限制。根据某些实施方式,微通道的剖面为矩形或正方形,特别是至少在由dhm检测所述至少一个红细胞的区域中如此。
通过微通道,可以容易地设置和确定该流动,从而简化定量。而且,在微通道中可以容易地实施鞘流。优选地,在微通道中对至少两个相对位置实施鞘流以实现要检测的红细胞的聚焦。进一步优选地,在微通道中,特别是在矩形或正方形微通道中,从两个方向,特别是四个方向,优选垂直方向(例如在顶部、底部、左侧和右侧)实施鞘流,以实现合适的聚焦和细胞取向。鞘流可通过例如来自与主通道不同的入口的其他微流体流的流动来实现。
根据某些实施方式,在检测所述至少一个红细胞(例如获得所述至少一个红细胞的图像)的区域中,数字全息显微装置的视场为微通道宽度的至多1.0倍。
根据某些实施方式,所述微通道包括至少一个表面,优选至少两个表面,所述表面垂直于数字全息显微镜的参考光束和/或检测光束的波前。
根据某些实施方式,垂直于数字全息显微装置的参考光束和/或检测光束的波前的微通道表面基本上是平面的。这可以避免参考光束和/或检测光束的波前的干扰和/或反射,有利于信号分析和图像重建,并且获得诸如相位信息的其他信息,基本上无需因这种干扰、反射等而进行计算中的调整。
另外,对于获得或提供来自患者的包含疑似受疟疾侵染的至少一个红细胞的样品,没有特别限制。根据某些实施方式,其例如可以在体外获得或提供。如上所述,不排除所述样品是在样品获得或提供之前经过处理的样品。
在本发明中,可以在所述微流体装置的外部和/或在所述微流体装置的内部进行包含至少一个红细胞的样品与缓冲溶液的混合。因此,所述混合没有特别限制,并且可以在微流体装置外部,例如通过振动器、搅拌器等来进行,或者可以在微流体装置内部通过混合结构等来进行。
对于所述混合,对缓冲溶液没有特别限制,只要其使得能够产生球形红细胞即可。其可以是通常用于例如在血液分析仪中对红细胞(rbc)进行分析的缓冲溶液。例如,样品中的红血球可以用标准缓冲溶液来球形化,所述标准缓冲溶液除了含有合适的缓冲物质和任选的螯合剂(这二者均不受限制)之外,还包含例如约0.01至约0.5vol.%(例如约0.1vol.%)的戊二醛和/或另一种固定剂,以及约0.02至0.05mmol/l的sds(十二烷基硫酸钠)和/或另一种表面活性剂。对于缓冲溶液,溶剂没有特别限制,并且可以例如包含水或者为水。
示例性含水缓冲溶液如下(相对于缓冲溶液给出量):
-sds(十二烷基硫酸钠),0.035mmol/l,其影响细胞膜
-缓冲剂(ph7.4),例如基于磷酸氢盐/磷酸二氢盐
-氯化钠(109.3mmol/l)
-戊二醛(0.11vol.%)
-na2edta(4.03mmol/l)
-na4edta(3.36mmol/l)
使用缓冲溶液,可以稀释包含红细胞的样品,以便通过dhm更容易观察到红细胞。红细胞在缓冲溶液中的稀释(可能包括样品的其余部分)可以例如为1:10至1:2000,优选1:20至1:2000,进一步优选1:25至1:700,例如1:28至1:600,例如1:29至1:200,例如1:30至1:70,例如1:30至1:50。
对于将包含rbc的缓冲溶液或者包含rbc的样品与缓冲溶液向微流体装置中的导入,没有特别限制,并且可以例如通过泵和管、毛细管、注射器或其他任何适用于微流体装置的导入装置(手段,means)来进行。
对于将所述至少一个球形红细胞引导到dhm的聚焦区域中,也没有特别限制,并且可以例如如上所述通过在微流体装置中设置适合的流动来进行。在这方面要注意的是,替代地或附加地,也可以引导物镜使其聚焦区域至微流体流中,因此也不排除这种情况。
此外,如上所述,对于使用dhm检测所述至少一个球形红细胞,也没有特别限制。
可以使用不同的标准来确定所述至少一个红细胞是否受疟疾侵染,进而确定患者是否感染疟疾,例如也如以下关于本发明某些实施方式所描述的那样。为了确定所述至少一个红细胞是否受疟疾侵染,例如,可以考虑对于疟疾感染和/或寄生虫血症具有特异性的细胞阶段的存在,以在第一阶段确定是否可能存在疟疾感染。
根据某些实施方式,使用dhm检测所述至少一个球形红细胞涉及重建dhm获得的相位和幅度图像。如下面将更详细描述的,除了可以确定允许检测疟疾特异性细胞阶段(例如也在下文更详细描述的环状体(ring)阶段或其他阶段)的存在的细胞形状之外,这种方式还可以确定针对疟疾感染特定的不同的其他特异性参数。
为了改善疟疾诊断,间日疟(malariatertiana)、热带疟(malariatropica)和三日疟(malariaquartana)之间的明确区分是有利的。因此,根据某些实施方式,使用dhm测量来区分间日疟、热带疟和三日疟。进一步地,根据某些实施方式,在本方法中确定感染细胞(寄生虫血症)的百分比。
为了区分不同的疟疾物种,可以应用以下标准:
1.使用dhm的相位图像,可以确定球形化的感染红血球的直径并由此确定它们的体积(球体的体积:v=4/3*π*r3)。使用确定的体积,可以进行第一分类:间日疟寄生虫(间日疟原虫(p.vivax)或卵形疟原虫(p.ovale))仅感染大小为8至10μm的网织红细胞和年轻红血球(双凹形式)。热带疟寄生虫(恶性疟原虫(p.falciparum))仅感染大小为7至8μm的正常红细胞(双凹形式)。三日疟寄生虫(三日疟原虫(p.malariae))仅感染大小<7μm的小红细胞(双凹形式)。
因此,根据某些实施方式,使用dhm确定所述至少一个球形红细胞的细胞体积和/或细胞直径,以识别疟原虫的发育阶段和物种。根据某些实施方式,使用dhm检测所述至少一个球形红细胞的体积的至少2/3。当球形化rbc和/或网织红细胞的体积的>2/3处于物镜的聚焦区域内时,dhm测量特别灵敏。通常,球形化rbc和网织红细胞的直径>4μm。需要注意的是,本发明的疟疾诊断方法独立于细胞的粘弹性性质、细胞中的血红蛋白浓度以及样品(例如悬浮液)中rbc的取向。特别地,这最后一方面使得能够进行简单的高通量分析,如以类似方式应用于使用流式细胞术进行的rbc血液学检查中。
然而,由于网织红细胞、正常红细胞和小红细胞之间的过渡流畅,仅基于感染红血球的尺寸的明确区分可能会导致误诊。为了排除错误的诊断,可以从dhm结果中使用进一步的区分特征。
2.外周血中不同疟疾阶段的存在也可以区分不同的疟疾物种。对于间日疟和三日疟,寄生虫发育的各个阶段以循环状态和隔离状态存在于外周血中。只有当疾病变得自限时,才会发生急剧的同步化。对于热带疟,在循环中可以看到环状体阶段和可能的滋养体阶段。此外,具有环状体阶段的多重感染也是典型的。对于极高的寄生虫血症,也可(很少)发现隔离阶段。为了避免错误的诊断,可以使用第三种区分标准。
因此,根据某些实施方式,使用dhm检测大量红细胞(amultitudeofredbloodcells),其中针对大量红细胞确定疟疾物种的不同阶段。
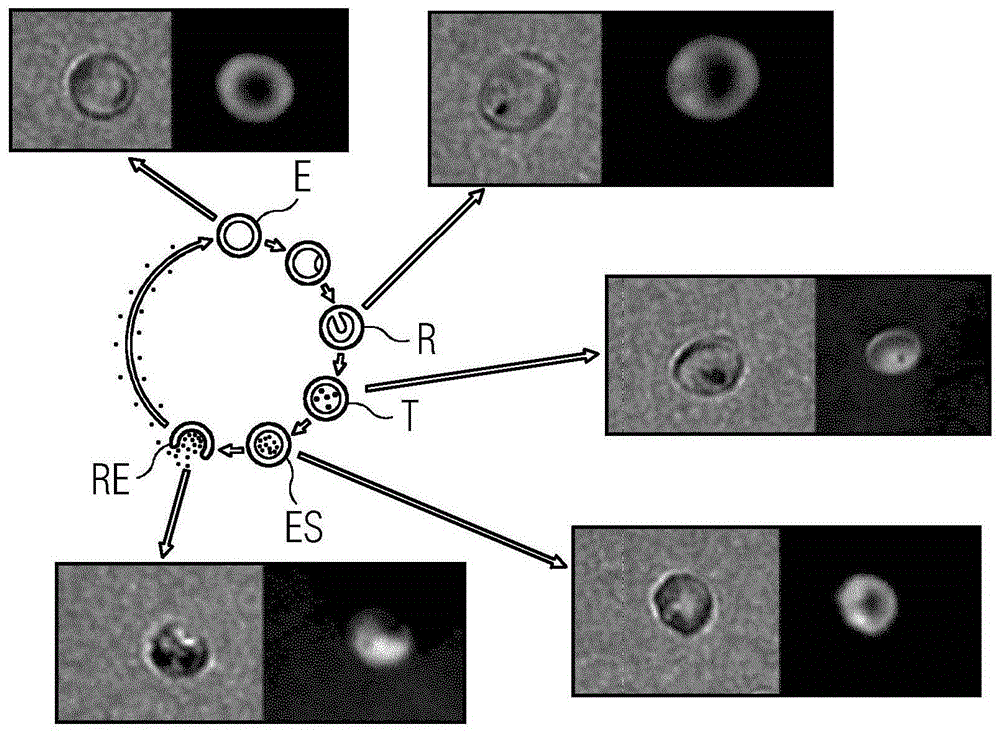
图1显示,在无dhm标签的情况下,可检测出完整的疟疾生命周期,包括环状体阶段,这是疟原虫感染的最早可检测的生长阶段。使用本发明的方法,可以在临床相关的生长阶段提供特定的疟疾信息。
图1示出了以由普通光学显微镜(左;放大40x的入射光显微术;na=0.55)和dhm(右;透射光;放大40x;na=0.55)获得的图像进行的不同疟疾阶段的对比。其示出了在红血球(e)、环状体(r)、滋养体(t)、红细胞裂殖体(es)和破裂红血球(re)阶段观察到的细胞差异。很明显,除光学显微镜之外,dhm也可以区分不同的细胞阶段。
3.寄生虫血症是用于区分不同疟疾类型的另一个特征。对于间日疟,寄生虫血症从来不会增加超过2%,因为感染限于网织红细胞,网织红细胞通常最多占红血球的2%。对于三日疟,寄生虫血症也从来不会增加超过2%,因为仅感染小红血球。相反,对于热带疟,可发生显著更高的寄生虫血症,在极端情况下显著高于10%,由此代表了用于区分的重要特征。
因此,根据某些实施方式,确定大量红细胞的寄生虫血症,涉及确定感染细胞数与总细胞数之比。可以通过感染细胞的数量相对于检测的细胞总数来确定寄生虫血症。
可以按任意顺序应用所有三个区分标准,但所有三个标准的结合对于明确诊断是有利的。稍后将更详细描述的图3显示了如何可能用dhm区分不同的疟疾物种。
根据某些实施方式,疟疾类型的确定可以借助机器学习程序来完成,该程序没有特别限制,其中例如可以使用感染不同疟疾物种的多种参考细胞类型的多个图像来训练所述程序。
特别地,为了进行用于疟疾区分的图像分析,可以使用基于机器学习的技术,其不受特别限制。在这类技术中,分析通常以两个主要阶段进行:训练阶段和测试阶段。这些阶段可以在例如dhm测量的图像分析中照常进行。
如果适当,上述实施方式可以任意组合。本发明的其他可能的实施方式和实施还包含在前文中或在下文中关于本发明的实施例而未明确提及的特征的组合。特别地,本领域技术人员还将增加各个方面作为对本发明的各个基本形式的改进或补充。
实施例
现在将参考本发明的多个实施例详细描述本发明。但是,这些实施例是说明性的,并不限制本发明的范围。
实施例1:
在第一实施例中,首先使用如下的水性标准缓冲溶液,单独地将感染间日疟(卵形疟原虫和间日疟原虫)、热带疟(恶性疟原虫)和三日疟(三日疟原虫)的红血球球形化:
-sds(十二烷基硫酸钠),0.035mmol/l,其影响细胞膜
-缓冲剂(ph7.4),例如基于磷酸氢盐/磷酸二氢盐
-氯化钠(109.3mmol/l)
-戊二醛(0.11vol.%)
-na2edta(4.03mmol/l)
-na4edta(3.36mmol/l)
拍摄非球形化rbc和球形化rbc的图像进行比较并且示于图2中(放大40x的入射光显微术;na=0.55),右侧显示的是球形化rbc。
利用独立感染的rbc,随后可以使用dhm检测(透射光;放大40x;na=0.55)来进行不同疟疾物种之间的区分。
调整缓冲溶液中rbc的稀释度至约1:600,以获得实施例中球形化的rbc的清晰照片,但在现场分析环境中针对高通量的最终稀释因子(稀释倍数)旨在为1:20至1:200,例如1:30至1:50。
作为微流体装置,采用具有一个入口和出口的简单矩形微通道(宽500μm,高50μm),其中将微通道的一部分置于dhm的聚焦区域中。
在所述微通道中,通过微流体引导将球形化rbc引导至dhm物镜的聚焦区域(放大40x;na=0.55)并且记录全息图像。
在全息图像的图像重建之后,可以从相位和幅度图像以及细胞内对比度来区分疟疾感染的不同阶段。这种令人惊讶的结果是出乎意料的,因为以前并不知道可以单独使用成像方法基于球形化细胞进行疟疾诊断。
另外,尤其借助于机器算法,使用高对比度和红血球的体积测定,基于dhm的疟疾诊断可以识别发育阶段和病原体物种,因为如上所述及下文更详细显示的,不同的疟疾病原体表现出特定的红血球感染模式。
在这方面,应该注意的是,代替使用机器算法,还可以仅通过评估物理参数来识别寄生虫物种的发育阶段。
下文尤其还参考图3给出了通过物理参数对不同疟疾物种进行区分的详细描述,提供图3以便更好地理解。图3中示出了物种区分的示意图。
如i所示,dhm测量可以区分直径为8-10μm的网织红细胞(rc)、直径为7-8μm的正常红细胞(nc)和直径小于7μm的小红细胞(mc)。
另外,如ii所示,对于三种不同的rbc,可以观察到不同疟疾阶段,所有三种(rc、nc和mc)均观察到了环状体阶段(r)和滋养体阶段(t),而仅rc和mc观察到了裂殖体阶段(es)和分裂体(破裂体,segmenter)阶段(s)。
此外,如标准iii所示,通过对寄生虫血症p进行定量,观察到了进一步的差异,rc和mc显示寄生虫血症<2%,而nc显示寄生虫血症>2%和多重感染(multipleinfections)。
因此,具有所有四个阶段且p<2%的rbc主要感染可归因于间日疟,仅具有阶段r和t且p>2%的nc主要感染可归因于热带疟,而具有所有四个阶段且p<2%的mc极罕见感染可归因于三日疟。对于参考测量,通过在显微镜下计数细胞数来量化感染细胞。
实施例2:
在本方法中,还可将机器算法应用于自动评价。
在示例性实施方式中,在实施例1的装置中,使用处于限定细胞阶段的感染恶性疟原虫的细胞进行算法的训练。从参考实验室的同步培养物中手动选择感染疟疾的细胞,并如实施例1中那样进行球形化和检测。使用神经网络对不同疟疾阶段进行归类。每种细胞类型使用100个细胞进行训练。之后,使用200个随机选择的细胞对神经网络进行测试。为了获得混淆矩阵,相对彼此考虑并评估了所有状态。训练的结果示于下表1中。
表1:来自训练(i)的混淆矩阵
在进一步的实验中,如上相对于表1的结果,进行相同的常规训练和测试,不同之处在于仅考虑健康细胞和处于环状体状态的细胞。结果示于表2。
表2:来自训练(ii)的混淆矩阵
从表2可以看出,可以以95.2%的概率将健康细胞与环状体状态区分开,由此其可以构成疟疾感染常规检测的基础。
仅通过红血球/红细胞(rbc)的简单固定和球形化,在存在疟原虫的情况下,使用数字全息显微术,通过光学厚度的改变,在最早的环状体阶段就已经能够检测出疟疾感染。与微流体装置相结合,可以高通量实现与厚膜检查所能实现的灵敏度相当的灵敏度。另外,可以通过相位衬度的改变来确定寄生虫的细胞周期。此外,数字全息显微术还可以确定红血球的细胞体积,从而获得关于疟原虫物种的进一步特异性。
本发明方法可以容易地应用在需要快速确定可能的疟疾感染的情形中,例如,在机场用于发烧患者(例如使用红外热像仪等检测到的),在疫区,或者在对可能感染疟疾的患者样本进行测试的实验室中。从获取患者的血液样品到获得结果,确定感染可能仅需要约半小时的短时间,其中本发明方法的测量本身可以快至在3分钟内完成。
- 还没有人留言评论。精彩留言会获得点赞!