用于标记、透明化和成像大型组织的方法与流程
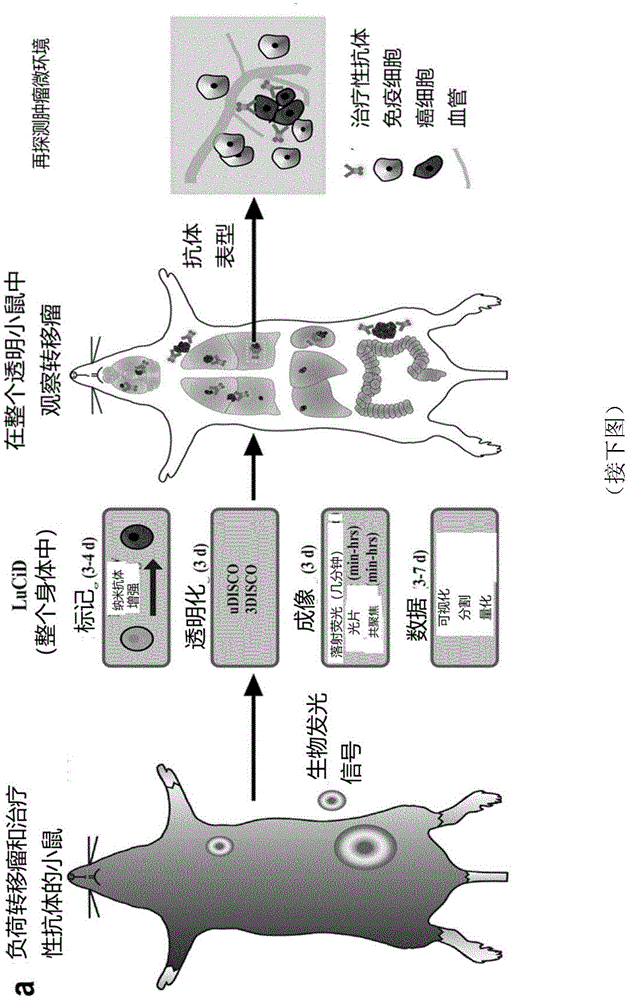
本发明涉及制备用于荧光显微术的动物组织的方法,根据所述方法获得的动物组织,分析所述动物组织的方法,以及检测转移瘤、分析生物制药药物的生物分布和分析纳米颗粒的生物分布的方法。根据本发明制备动物组织的方法包括全身标记、透明化和成像方法。本发明的方法是有利的,因其允许例如在哺乳动物组织(包括猪和人脑)内的单细胞、单细胞水平上的转移瘤和在整个小鼠内单细胞水平上的生物制药药物分布(例如在整个动物,如整个小鼠中的癌症靶向治疗抗体的分布)的可视化。
背景技术:
了解肿瘤侵入和转移时的细胞的详情在癌症研究中至关重要,因为大多数癌症患者死于远离原发肿瘤部位的转移瘤。转移瘤是影响不同器官的复杂过程(lambertetal.,2017;massagueandobenauf,2016),因此在全身范围内对单个转移瘤进行全面的追踪和可视化至今仍是一项重大挑战。目前可用的方法提供的转移负荷的图像片面且不完整(例如,通过检查组织切片或预选器官中的表面可检测的转移性结节),或者空间分辨率非常差,三维信息很少,并且在身体较深处的穿透有限(例如,基于生物发光的成像)(dejongetal.,2014)。
哺乳动物的组织天生是不透明的,阻碍了任何深度超过几百微米的组织的高分辨率成像(tuchinandtuchin,2007)。最近开发的组织透明化方法为研究整个器官铺平了道路(belleetal.,2014;chungetal.,2013;erturketal.,2012;erturketal.,2011;hamaetal.,2011;keetal.,2013;murrayetal.,2015;renieretal.,2014;susakietal.,2014;yangetal.,2014),例如整个小鼠大脑中的神经元投射(renieretal.,2016;yeetal.,2016)和肠道炎症过程(gabanyietal.,2016)。一些研究甚至提供了透明的人类胚胎(belleetal.,2017)和整个成年鼠体(panetal.,2016;tainakaetal.,2014;yangetal.,2014)。特别是,发明人先前开发的ultimatedisco(udisco)透明化方法,可以通过将组织缩小到其原始大小的三分之一来透明化和成像整个啮齿动物体(panetal.,2016年)。这种方法首次允许通过使用光片显微术对整个成年小鼠的身体进行3d成像和重建。
然而迄今为止,还没有一种方法能够在不预先解剖小鼠的情况下以单细胞分辨率在整个鼠体内可视化目标分子(例如癌细胞中存在的蛋白质)。例如yangetal.,2014和tainakaetal.,2014的已知方法声称其实现了小鼠的全身透明化。然而,这些方法实际上并没有通过荧光显微镜术分析整个身体,只是分析了身体的一些解剖部分。因此,在先前的这些出版物中,没有将全部的整个成年小鼠以单细胞分辨率成像的实证/证据。
此外,到目前为止,还没有技术可以让像猪脑一样大的组织变得透明。这对于使用整体方法研究哺乳动物大脑中的疾病和治疗方案至关重要,这种方法能够以不偏不倚的方式展示整个病理学。
因此需要用于制备和分析包括整个动物和大型哺乳动物大脑在内的组织的改进方法。
技术实现要素:
发明人推断,对包括小鼠在内的光学透明组织成像可用作强有力的临床前方法,例如以细胞分辨率在整个身体中检测荧光标记的癌细胞和/或治疗性抗体。
典型地,癌细胞的体外或体内荧光标记是通过荧光蛋白如绿色荧光蛋白、yfp和mcherry的内源性表达来实现的,它们发射可见光谱的光。然而,身体中的许多组织在这个范围内也显示出高自发荧光(tuchin,2016;zipfeletal.,2003),这可能妨碍在厘米厚的整个鼠体中可靠地检测单个癌细胞。根据本发明的优选实施方案,使用荧光染料标记的抗体在发射峰,特别是在远红外范围内标记例如癌细胞的细胞,对于通过提供更高的信号-背景比来克服这种自发荧光信号十分有利,可以可靠地检测单细胞。
为此,发明人开发了一种制备用于荧光显微术的动物组织的方法。优选地,所述方法使用基于抗体片段(例如纳米抗体)的全身标记(例如免疫标记)技术,以用荧光染料(例如alexa和atto染料),优选在远红光谱中,特别地标记内源表达的普通荧光蛋白(例如egfp、mcherry)或内源细胞蛋白。发明人随后在本发明的方法中使用了基于有机溶剂的透明化方法,例如ultimatedisco透明化方法(参见panetal.,2016,其全部内容通过引用结合于此,以用于所有目的)。本发明的方法是有利的,其允许在整个可透视小鼠中甚至在具有高自体荧光的组织中可视化例如癌细胞的细胞。
根据本发明的这种新流程被命名为lucid(全身标记、u/3disco透明化、成像、数据可视化)。本发明的方法可以用于例如评估肿瘤的转移以及癌细胞靶向抗体的生物分布,例如,在小鼠中。本发明人举例说明了这一发现,例如,通过使用移植了人乳腺癌细胞并注射了针对碳酸酐酶xii(ca12)的治疗性单克隆抗体6a10的小鼠(参见battkebattkeetal.,2011;andgondietal.,2013,作为对所述抗体的参考,其通过引用整体并入本文,以用于所有目的)。本发明的方法提供了优于其他成像方法的各种关键优势,包括但不限于在整个小鼠的单细胞水平上检测自发转移瘤和监测肿瘤药物-靶的相互作用,以及通过透明化组织的再水合和随后的抗体标记进一步对特定的肿瘤微环境进行表型。
在单个细胞水平上公正地检测癌症转移和肿瘤靶向治疗的生物分布一直是临床前研究中的长期挑战。
在此,发明人使用了基于有机溶剂的全身透明化方法,并开发了可用于在细胞分辨率下分析微转移和治疗性抗肿瘤抗体在组织中,例如整个鼠体中的分布的方法。本发明的方法是公正的,因为其允许以单细胞分辨率标记和检测动物组织(例如,整个小鼠)中的目标分子,而无需在分析动物组织之前解剖动物组织。有利的是,根据本发明的动物组织无需预先解剖就可以以单细胞分辨率制备和分析,比先前已知的方法较大。因此,通过本发明的方法,由组织解剖(以及随后对所述动物组织的不同解剖部分的单独分析)引入的偏差被最小化。例如,本发明的方法可以最小化由仅分析所选器官或这些器官的一部分而引入的偏差。在非限制性实施方案中,根据本发明的方法使用的有机溶剂有助于这些有利的效果,因其允许将动物组织收缩到更小的尺寸,并且使得动物组织在显微镜物镜最大工作距离处更容易被荧光显微镜观察到。
与以前的方法相比,本发明的方法也是有利的,因其可以透明化包括皮肤在内的组织,例如包括皮肤在内的整个成年小鼠。
本发明的方法也是有利的,同样因其可以容易地应用于不同的实验室,而不需要高度专用的设备,因为即使使用常用的落射荧光显微镜成像,也能够比通过生物发光成像更详细地检测整个透视小鼠。
例如,本发明的方法还可以减少在细胞水平上对整个鼠体进行肿瘤微转移的研究所需的时间和成本。此外,因为研究人员可以容易地评估整个鼠体而不是选定的组织/器官,并且由于本方法的高灵敏度(能够识别和量化整个身体中的单细胞),所以使用本发明的方法也可以显著减少用于研究的小鼠数量。
因此,本文提出的本发明的方法可以比传统方法更有效地促进新疗法向临床的转化。
此外,不同于已知的透明化组织方法,例如会使组织易碎的cubic和pact方法,根据本发明的制备用于荧光显微术的动物组织的方法使动物组织更坚硬。因此有利的是,通过本发明的方法获得的动物组织适于解剖成不同的部分,并在解剖后通过荧光显微镜进一步分析这些部分。应当理解的是,根据本发明,通过本发明的方法可获得的动物组织通常不需要解剖,因为根据本发明可以以单细胞分辨率制备和分析而无需预先解剖的动物组织相对于先前已知的方法更大。然而,如果需要解剖,可以有利地使用根据本发明的方法获得的动物组织。这对于进一步表征通过本发明方法鉴定的微转移及其分离后的微环境十分有用。
组织标记,例如使用纳米抗体的全身免疫染色
对厚生物组织中的内源性蛋白质如内源性荧光蛋白质成像展现出了主要的挑战,包括蓝绿色光谱中的自体荧光和长时间成像和储存期间的漂白。在本发明的示例性实施方案中,为了在整个成年小鼠中实现单个肿瘤细胞检测的最高信号质量,用稳定的远红色荧光染料如atto或alexa染料标记(例如免疫标记)内源性荧光蛋白,例如癌细胞内的内源性荧光蛋白是有利的。这种方法的优势在于它将信号与背景的比率提高了20倍,并且允许组织中的单细胞可视化,特别是在厘米厚的小鼠体内。根据本发明应当理解的是,更进一步在更长的波长光谱中使用荧光染料,例如近红外荧光物,可以用于进一步提高成像质量,并且有潜力地允许研究整个小鼠体内的亚细胞结构/分子(参见hongetal.,其通过引用整体并入本文,以用于所有目的,例如合适的荧光染料)。
本发明的方法使用分子量等于或小于100kda的含荧光物的标记剂(例如与荧光染料缀合的抗体片段)进行标记。虽然目前可作为这种标记剂的可商购的例子的纳米抗体数量有限,但可用于本发明方法的纳米增强剂(chromotek)可对21种不同荧光蛋白,例如egfp、yfp、venus、mcherry和mrfp广泛地选择进行染色。或者,本发明的方法也可以使用其他纳米抗体或常规抗体的小片段(例如,单链抗体)(参见例如,holligerandhudson,2005,其全部内容通过引用结合于此,以用于所有目的,作为这种标记剂的例子)。或者,可以为本发明的方法生成新的纳米抗体来研究影响全身的病理。例如,可用作炎症或感染标记物的标记剂(例如纳米抗体)将有助于收集影响全身的炎症性疾病(如多发性硬化或类风湿性关节炎)或感染性疾病的整个小鼠的无偏读数。此外,本发明的实施方案证明,根据本发明的lucid方法成像的动物组织可以随后再水合,并使用标准方案的常规抗体染色,从而允许肿瘤/转移瘤及其微环境的完全表型表征。
根据本发明的微转移检测
以细胞分辨率在例如整个啮齿动物体内,对肿瘤微转移进行无偏高通量作图,可以成为揭示肿瘤细胞传播背后的生物学的一个有价值的工具。在示例性实施方案中,本发明包括lucid方法,所述方法可用于整个小鼠体内肿瘤微转移的体积成像。虽然使用单平面激光扫描光片显微镜例如检测透视小鼠中的癌细胞,是根据本发明的分析方法的最优选的实施方案,但是使用标准荧光显微镜也可以提供新的见解。例如,发明人使用落射荧光显微镜检测直径小到20μm的微转移。此外,落射荧光成像有助于在用光片显微术收集大型数据集之前,在几分钟内对透明化的鼠体进行直接扫描,以确定需要的区域。随后的光片显微术可以根据落射荧光数据只聚焦于需要的器官/区域。这种方法将显著加快所进行的研究,并减少要分析的数据量。在如下所示的本发明的说明性例子中,光片显微术中单个小鼠体产生约4tb的数据,而单个器官,如肺产生约100gb的数据。在这些说明性的例子中,发明人使用了vision4d软件(arivis)来拼接由超微显微镜收集的3d成像叠层,其能够以细胞分辨率拼接和分割来自整个小鼠的tb大小的数据。根据本发明,也可以使用其他用于显微镜图像分析的已知计算机程序。
发明人在此证明了有利的是,本发明的方法适用于在细胞水平上检测和定位整个小鼠体内的癌症转移,允许识别单个传播的癌细胞的精确位置。重要的是,发明人还展示了本发明的方法允许使用常规抗体以及基因表达谱通过例如rna序列和蛋白质组(质谱)对已识别的转移组织进行再探测。
因此根据本发明的用于制备本发明的荧光显微术的动物组织的方法是有利的,因其保存了蛋白质(功能表位)和dna/rna。
因此,本发明的方法能够进一步实现表征和分子筛选微转移以及远端器官中鉴定的单个肿瘤细胞。根据本发明,对肿瘤细胞的特定亚型(例如肿瘤干细胞)或肿瘤微环境中的炎性细胞和细胞外基质组分(例如肿瘤相关成纤维细胞、t细胞和巨噬细胞)的分子标记的应用将有助于确定它们在转移期间在组织(例如整个啮齿动物体)中的精确时空分布。
根据本发明的生物制药药物的生物分布分析
虽然生物制药药物(例如抗体药物)生物分布的精确评定对于评估其在治疗,如肿瘤治疗中的特异性和实用性至关重要,但仍未有方法能够在整个生物体的细胞水平上提供这种信息。这里,发明人将本发明的方法(在示例性实施方案中也称为“lucid”方法)作为一种新的工具,不仅可以用于研究单个肿瘤细胞的分布,还可以用于研究基于抗体的治疗。本发明的说明性实施方案表明,本发明的方法能够识别抗体靶向的肿瘤细胞,特别是在不同器官,包括肺、肾、脑和肝的转移瘤中。例如,发明人惊奇地观察到,虽然肺中的大多数微转移均被抗ca12治疗抗体6a10靶向,但是分布在整个肺和肝中的一些微转移却没有被抗体靶向。最后,本发明的分析方法是有利的,也因其可用于检测生物制药药物(例如治疗性抗体)与非靶组织(例如癌症治疗性抗体情况下的非癌组织)的结合,以指示潜在的非靶效应。这在下文中的小鼠全身的非限制性实施方案中举例说明,还展示出了在器官中的量化。
根据本发明的纳米颗粒的生物分布分析
在用于分析纳米颗粒生物分布的示例性方法中,纳米颗粒(dna折纸或碳纳米管)与诸如peg的聚合物偶联,以增加循环时间和稳定性。其也可用小分子,如抗体、肽、适体靶向标记。例如,cpg肽可被用于靶向免疫细胞。最后,其也可与荧光物(例如alexa或atto染料)缀合,从而根据本发明的方法使用。缀合纳米颗粒可以以200nm-2μm的浓度溶解在pbs中。然后以100-200μl将这种溶液对小鼠进行静脉或腹腔注射。随后,将小鼠灌注至少3小时(或更长时间)。使用本发明的方法评定纳米颗粒的生物分布。
因此,本发明提供了有利的标记和分析流程。例如,这个流程允许在整个小鼠体内以单细胞分辨率可视化和分析肿瘤的微转移和基于抗体的治疗。因为本发明的方法是时间和成本高效的,因此其可被用于研究各种生物医学问题,例如与影响整个生物体的各种病理或发育过程相关的生物医学问题。
因此,本发明包括以下优选实施方案:
1.一种用于制备荧光显微术的动物组织的方法,所述方法包括以下步骤:
a)任选地将固定的动物组织用脱钙溶液脱钙;
b)任选地将固定的动物组织用用于去除亚铁血红素的溶液脱色;
c)将所述固定的动物组织中的目标分子用标记溶液标记,以获得用所述含荧光物的标记剂标记的固定的动物组织,其中所述标记溶液包含能够结合所述目标分子的含荧光物的标记剂,所述标记剂的分子量等于或小于100kda;
其中在步骤c)中所述的标记目标分子之前,用透化溶液处理所述固定的动物组织,并且其中透化溶液和标记溶液是不同的溶液;
或者其中在步骤c)中所述的目标分子的所述标记过程中,用透化溶液处理固定的动物组织,并且其中透化溶液和标记溶液是相同的溶液,并且
d)用包含有机溶剂的透明化溶液将含有荧光物的标记剂标记的固定的动物组织透明化,以获得用于荧光显微术的所述动物组织。
2.根据第1项所述的方法,其中所述方法包括步骤a)。
3.根据第1项或2的方法,其中在步骤a)中,所述脱钙溶液选自:包含edta和nahco3的溶液、包含甲酸的溶液、包含硝酸的溶液或包含盐酸的溶液。
4.根据前述任一项所述的方法,其中所述固定的动物组织可用包含4wt%的多聚甲醛和任选肝素的固定溶液固定后获得。
5.根据前述任一项所述的方法,其中所述方法包括步骤b)。
6.根据前述任一项所述的方法,其中步骤b)为用所述用于去除亚铁血红素的溶液灌注所述固定的动物组织。
7.根据前述任一项所述的方法,其中所述用于去除亚铁血红素的溶液是血红素螯合溶液。
8.根据前述任一项所述的方法,其中在步骤b)中,所述用于去除亚铁血红素的溶液包含适于去除亚铁血红素的氨基醇和任选的洗涤剂。
9.根据第8项所述的方法,其中所述用于去除亚铁血红素的溶液包括洗涤剂,并且其中所述洗涤剂是离子洗涤剂、非离子洗涤剂、两性离子洗涤剂、离液洗涤剂或其组合。
10.根据第9项所述的方法,其中所述洗涤剂是离子洗涤剂,为十二烷基硫酸钠或脱氧胆酸钠。
11.根据第9项所述的方法,其中所述洗涤剂是非离子洗涤剂,其为4-(1,1,3,3-四甲基丁基)苯基-聚乙二醇、叔辛基苯氧基聚乙氧基乙醇、聚乙二醇叔辛基苯基醚或聚氧乙烯(20)脱水山梨醇单月桂酸酯。
12.根据第9项所述的方法,其中所述洗涤剂是两性离子洗涤剂,为3-[(3-胆酰胺丙基)二甲基氨基]-1-丙磺酸水合物。
13.根据第9项所述的方法,其中所述洗涤剂是离液洗涤剂,即尿素。
14.根据第8-13项中任一项所述的方法,其中所述氨基醇是n,n,n,n-四(2-羟丙基)乙二胺、n-丁基二乙醇胺、n-甲基二乙醇胺、2-吗啉乙醇、n-乙基二乙醇胺、n,n-二异丙基乙醇胺、n-甲基吗啉-n-氧化物或1-(2-羟乙基)哌啶。
15.根据第8-14项中任一项所述的方法,其中所述氨基醇是n,n,n,n-四(2-羟丙基)乙二胺。
16.根据第15项所述的方法,其中用于去除亚铁血红素的溶液是下列试剂的1∶2或1∶3稀释,优选在0.1mpbs中:25wt%尿素,25wt%n,n,n,n-四(2-羟丙基)乙二胺,15wt%tritonx-100,0.1mpbs。
17.根据前述任一项所述的方法,其中在步骤b)中,所述用于去除亚铁血红素的溶液包括用于氧化亚铁血红素的氧化剂。
18.根据第17项所述的方法,其中用于氧化亚铁血红素的氧化剂是过氧化苄基、3-氯过氧苯甲酸或六水合单过氧邻苯二甲酸镁。
19.根据第17项所述的方法,其中用于氧化亚铁血红素的氧化剂是过氧化苄基。
20.根据前述任一项所述的方法,其中所述含荧光物的标记剂的分子量等于或小于60kda。
21.根据前述任一项所述的方法,其中所述含荧光物的标记剂的分子量等于或小于50kda。
22.根据前述任一项所述的方法,其中所述含荧光物的标记剂的分子量等于或小于40kda。
23.根据前述任一项所述的方法,其中所述含荧光物的标记剂的分子量等于或小于30kda。
24.根据前述任一项所述的方法,其中含所述荧光物的标记剂的分子量等于或小于20kda。
25.根据前述任一项所述的方法,其中所述荧光物能够发射红外或红色荧光。
26.根据前述任一项所述的方法,其中所述荧光物能够发射近红外或远红落射荧光。
27.根据第1至26项中任一项所述的方法,其中所述荧光物的最大发射波长高于480nm。
28.根据第1至26项中任一项所述的方法,其中所述荧光物的最大发射波长高于500nm。
29.根据第1至26项中任一项所述的方法,其中所述荧光物的最大发射波长高于550nm。
30.根据第1至26项中任一项所述的方法,其中所述荧光物的最大发射波长高于590nm。
31.根据第1至26项中任一项所述的方法,其中所述荧光物的最大发射波长高于600nm。
32.根据第1至26项中任一项所述的方法,其中所述荧光物的最大发射波长高于640nm。
33.根据第1至26项中任一项所述的方法,其中所述荧光物的最大发射波长高于700nm。
34.根据第1至26项中任一项所述的方法,其中所述荧光物的发射最大值在640nm至700nm的波长范围内。
35.根据第1至33项中任一项所述的方法,其中所述荧光物的最大发射波长低于1000nm或低于900nm。
36.根据第1至33项中任一项所述的方法,其中所述荧光物的最大发射波长低于800nm。
37.根据前述任一项所述的方法,其中含荧光物的标记剂是与所述荧光物缀合的抗体片段,所述抗体片段能够结合所述目标分子。
38.根据前述任一项所述的方法,其中含荧光物的标记剂是与所述荧光物缀合的纳米抗体,所述纳米抗体能够结合所述目标分子。
39.根据前述任一项所述的方法,其中步骤c)中,使用包含含有荧光物的标记剂的标记溶液来灌注固定的动物组织。
40.根据前述任一项所述的方法,其中含荧光物的标记剂是荧光染料,所述荧光染料能够结合所述目标分子。
41.根据前述任一项所述的方法,其中含有荧光物的标记剂是荧光染料,所述荧光染料是nissl、碘化丙锭、甲氧基-x04、乙酸甲酚紫、吡喃宁y、噻嗪红、凝集素、dii、atto染料和to-pro3。
42.根据前述任一项所述的方法,其中所述有机溶剂的折射率与所述动物组织的折射率相差不超过5%。
43.根据前述任一项所述的方法,其中所述包含有机溶剂的透明化溶液的折射率与所述动物组织的折射率相差不超过2%。
44.根据前述任一项所述的方法,其中所述包含有机溶剂的透明化溶液的折射率在1.500和1.600之间。
45.根据前述任一项所述的方法,其中所述包含有机溶剂的透明化溶液的折射率在1.520和1.580之间。
46.根据前述任一项所述的方法,其中所述有机溶剂包括苯甲醇、苯甲酸苄酯、二苄基醚、3-苯基-2-丙烯酸乙酯、3-苯基丙烯酸烯丙酯、聚乙二醇(锰=200-1000)、聚乙二醇二丁醚(锰=200-1000)、聚乙二醇甲醚(锰=200-1000)、1-苯基萘和/或二苯醚。
47.根据前述任一项所述的方法,其中所述包含有机溶剂的透明化溶液进一步包含抗氧化剂。
48.根据前述任一项所述的方法,其中所述包含有机溶剂的透明化溶液由体积比为4∶8∶3至10∶20∶3的苯甲醇、苯甲酸苄酯和二苯醚以及所述抗氧化剂组成。
49.根据项目47或48的方法,其中所述抗氧化剂是dl-α-生育酚。
50.根据第47或48或49项所述的方法,其中所述抗氧化剂在所述透明化溶液中以0.4vol%的量存在。
51.根据前述任一项所述的方法,其中步骤d)为使用所述含有机溶剂的透明化溶液灌注所述的使用含荧光物的标记剂标记的所述固定的动物组织。
52.根据第51项所述的方法,其中使用所述含荧光物的标记剂标记的所述固定的动物组织被所述含有机溶剂的透明化溶液灌注至少6小时。
53.根据第51或52项所述的方法,其中步骤d)进一步包括在用所述透明化溶液灌注之前,用梯度增加的脱水溶液灌注,所述脱水溶液包含0vol%至100vol%的另一种有机溶剂。
54.根据第53项所述的方法,其特征在于,在使用含有0vol%至100vol%的有机溶剂的梯度增加的脱水溶液灌注之后使用含有另一种有机溶剂的脱脂溶液。
55.根据第54项所述的方法,其中所述另外的有机溶剂是叔丁醇、四氢呋喃(thf)、甲醇、乙醇或1,4-二恶烷,并且其中所述梯度增加的脱水溶液灌注在高于所述另外的有机溶剂的熔点的温度下进行。
56.根据项目54或55的方法,其中所述另一种有机溶剂是二氯甲烷、氯仿、甲醇、己烷、丁醇、乙酸乙酯、叔丁基甲基醚,并且其中所述使用另一种有机溶剂的灌注在高于所述另一种有机溶剂的熔化温度的温度下进行。
57.根据前述任一项所述的方法,其中所述标记溶液、所述透化溶液和所述透明化溶液通过施加压力主动递送,优选通过用泵施加压力。
58.根据前述任一项所述的方法,其中所述用标记溶液标记目标分子和所述用透化溶液的处理是通过在高于80mmhg,优选高于150mmhg的压力下灌注来进行的。
59.根据前述任一项所述的方法,其中所述用标记溶液标记目标分子和所述用透化溶液处理是通过在220至240mmhg的压力下,优选在230mmhg的压力下灌注来进行的。
60.根据前述任一项所述的方法,其中在步骤c)中所述标记目标分子之前,用透化溶液处理固定和脱色的动物组织,并且其中透化溶液和标记溶液是不同的溶液。
61.根据项目60的方法,其中所述透化溶液是如项目54或55中任一项所定义的脱水溶液。
62.根据第60项所述的方法,其中所述透化溶液是如第54或56项中任一项所定义的脱灰溶液。
63.根据项目60的方法,其中所述透化溶液包含乙酸。
64.根据项目60的方法,其中所述渗透溶液包括盐酸胍和/或乙酸钠。
65.根据第1至59项中任一项所述的方法,其中在步骤c)中所述标记目标分子的同时,用透化溶液处理固定的动物组织,并且其中透化溶液和标记溶液是相同的溶液。
66.根据前述任一项所述的方法,其中步骤b)为在高于80mmhg,优选高于150mmhg的压力下用所述用于去除亚铁血红素的溶液灌注所述固定的动物组织。
67.根据前述任一项所述的方法,其中步骤b)为在220至240mmhg的压力下,优选在230mmhg的压力下,用所述去除亚铁血红素的溶液灌注固定的动物组织。
68.根据项目51至67中任一项所述的方法,其中步骤d)中的灌注在高于80mmhg、优选高于150mmhg的压力下进行。
69.根据项目51至67中任一项所述的方法,其中步骤d)中的灌注在220至240mmhg的压力下进行,优选在230mmhg的压力下进行。
70.根据前述任一项所述的方法,其中所述动物组织来自哺乳动物。
71.根据前述任一项所述的方法,其中所述动物组织来自非人哺乳动物或人。
72.根据前述任一项所述的方法,其中所述动物组织来自啮齿动物。
73.根据前述任一项所述的方法,其中所述动物组织来自小鼠。
74.根据前述任一项所述的方法,其中所述动物组织是整个小鼠。
75.根据第1-71项中任一项所述的方法,其中所述动物组织是猪脑。
76.根据第1至58项中任一项所述的方法,其中所述动物组织是整个器官或其一部分。
77.根据前述任一项所述的方法,其中在步骤c)中由所述标记剂标记的所述目标分子存在于所述固定的动物组织细胞中的结构,优选蛋白质、脂质、dna或rna,更优选存在于所述固定的动物组织细胞中的蛋白质。
78.根据前述任一项所述的方法,其中在步骤c)中由所述标记剂标记的所述目标分子存在于所述癌症的细胞中的结构,优选蛋白质、脂质、dna或rna,更优选存在于所述癌症的细胞中的蛋白质。
79.根据前述任一项所述的方法,其中所述动物组织包含癌症转移,其中在步骤c)中由所述标记剂标记的所述目标分子存在于所述癌症的细胞中的结构,优选蛋白质、脂质、dna或rna,更优选存在于所述癌症的细胞中的蛋白质。
80.根据前述任一项所述的方法,其中所述动物已用生物制药药物治疗,其中所述动物组织包含所述生物制药药物,并且其中所述生物制药药物是在步骤c)中由所述标记剂标记的所述目标分子,或者其中所述生物制药药物已经在体外用另外的荧光染料标记,或者其中所述生物制药药物本身是荧光的。
81.根据项目80的方法,其中所述生物制药药物是小分子。
82.根据项目80的方法,其中所述生物制药药物是治疗蛋白。
83.根据项目80的方法,其中所述生物制药药物是治疗性抗体。
84.根据前述任一项所述的方法,其中所述方法不是通过手术或治疗来治疗人体或动物体的方法,也不是在人体或动物体上实施的诊断方法。
85.根据前述任一项所述的方法,其中所述方法是离体方法。
86.根据前述任一项所述的方法,其中在步骤d)中获得的用于荧光显微术的动物组织的体积小于在步骤b)中使用的所述固定的动物组织的体积。
87.根据第86项所述的方法,其中步骤d)中获得的用于荧光显微术的动物组织的体积比步骤b)中使用的所述固定的动物组织小40%至75%。
88.可以通过根据第1-87项中任一项的用于荧光显微术的动物组织的制备方法获得的动物组织,其中所述动物组织包含由所述含荧光物的标记剂标记的所述目标分子。
89.项目88的动物组织,其中所述动物组织是整个啮齿动物,优选整个小鼠。
90.项目88的动物组织,其中所述动物组织是整个器官或其一部分。
91.项目90的动物组织,其中所述动物组织是整个哺乳动物器官。
92.项目88的动物组织,其中所述动物组织是大小为2×2×2厘米的组织块。
93.根据前述任一项所述的动物组织,其中在所述动物组织中,所述目标分子由所述含荧光物的标记剂标记,并且其中,当通过光片荧光显微术分析时,不论其位于动物组织中的哪里,所有目标分子都可以单细胞分辨率检测。
94.根据项目88至93中任一项的用于分析动物组织的方法,所述方法包括步骤i)通过荧光显微术分析所述组织,以便检测所述动物组织中的所述荧光物的荧光。
95.根据第94项所述的分析方法,其中所述方法还包括步骤ii)可视化所述荧光物的检测荧光,以获得所述动物组织的图像,优选为三维图像。
96.根据项目95的分析方法,其中所述图像是整个所述动物组织的具有单细胞分辨率的图像。
97.根据前述任一项的分析方法,其中所述动物组织不厚于20厘米,优选不厚于10厘米,更优选不厚于5厘米。
98.根据前述任一项所述的用于分析的方法,其中所述动物组织的厚度不超过2cm,并且优选在1.5至2cm之间。
99.根据前述项中任一项的分析方法,其中所述分析方法在步骤i)之前还包括根据项1-87中任一项所述的方法。
100.根据前述任一项所述的分析方法,其中所述荧光显微术选自光片荧光显微术、落射荧光显微术、多光子显微术和共焦荧光显微术。
101.根据前述任一项所述的分析方法,其中所述荧光显微术是光片荧光显微术。
102.根据前述任一项所述的用于分析的方法,其中所述方法在步骤i)之后还包括步骤iii)解剖目标组织区域;iv)对解剖的目标组织区域进行再水合;和v)进一步分析解剖的目标组织区域。
103.根据第102项所述的分析方法,其中在步骤v)中,使用基于抗体的免疫染色,或通过基因分析(优选通过rnaseq进行基因分析),或通过蛋白质组学(优选通过质谱进行蛋白质组学)进一步分析所解剖的目标组织区域。
104.根据第102或103项中任一项所述的分析方法,其中所述解剖目标组织区域包括转移瘤,优选具有小于200个肿瘤细胞大小的转移瘤,更优选具有小于100个肿瘤细胞大小的转移瘤,还更优选具有小于75个肿瘤细胞大小的转移瘤,还更优选具有小于50个肿瘤细胞大小的转移瘤,并且还更优选具有小于25个肿瘤细胞大小的转移瘤。
105.一种用于检测转移瘤的方法,其中所述方法包括根据前述任一项分析动物组织的方法。
106.根据第105项所述的用于检测转移瘤的方法,其是用于在所述动物组织中以单细胞分辨率检测转移瘤的方法。
107.根据前述任一项的用于检测转移瘤的方法,其中所述动物组织包含癌症转移,并且其中由所述标记剂标记的目标分子是存在于所述癌症细胞中的结构,优选为蛋白质。
108.一种用于分析生物制药药物的生物分布的方法,其中所述方法包括根据前述项目中任一项的用于分析动物组织的方法,其中所述动物经项目80中所述的生物制药药物治疗,其中所述动物组织包含所述生物制药药物,并且其中所述生物制药药物是由所述标记剂标记的所述目标分子。
109.根据第1项08的方法,其中所述生物制药药物是治疗蛋白。
110.根据第1项08的方法,其中所述生物制药药物是治疗性抗体。
111.根据第1项08的方法,其中所述生物制药药物是纳米颗粒。
112.一种用于分析纳米颗粒生物分布的方法,其中所述方法包括根据前述任一项的用于分析动物组织的方法,其中所述动物已经用纳米颗粒处理,其中所述动物组织包含所述纳米颗粒,并且其中所述纳米颗粒是由所述标记剂标记的所述目标分子和/或选自荧光物缀合纳米颗粒或自身荧光的纳米颗粒。
113.根据第112项所述的用于分析纳米颗粒的生物分布的方法,其中所述纳米颗粒携带药物或者为药物。
114.一种研究神经退化的方法,其中所述方法包括根据前述任一项分析动物组织的方法,并且其中所述动物组织包含神经元。
115.根据第114项所述的研究神经退化的方法,其中所述动物组织中的神经元被荧光标记,优选通过荧光蛋白的表达。
116.根据前述任一项所述的用于研究神经退化的方法,其中所述神经退化的研究包括对神经元轴突起泡的分析。
117.一种用于研究神经炎症的方法,其中所述方法包括根据前述任一项分析动物组织的方法,并且其中所述动物组织包含神经元。
118.根据第117项所述的用于研究神经炎症的方法,其中所述动物组织中的免疫细胞经荧光标记,优选通过荧光蛋白的表达。
119.根据前述任一项的用于研究神经炎症的方法,包括通过分析荧光标记免疫细胞的信号强度和/或细胞数量来研究免疫细胞的激活。
120.一种用于研究脑膜淋巴管的方法,其中所述方法包括根据前述任一项分析动物组织的方法,并且其中所述动物组织优选包括整个小鼠头部。
121.根据第120项所述的用于研究脑膜淋巴管的方法,其中所述脑膜淋巴管被荧光标记,优选被标记蛋白或示踪剂如卵清蛋白标记,
122.根据前述任一项的研究脑膜淋巴管的方法,其中所述脑膜淋巴管包含所述目标分子。
附图说明
图1:lucid流程和纳米推进技术在深层组织荧光成像中的优点
(a)成年小鼠体内的lucid流程的步骤。包含目标癌细胞的特定区域可以被解剖、再水合,进一步通过抗体标记来表征。(b)不同成像波长的光穿透组织的展示:使用光片显微镜,用绿色(例如:470nm(左),红色(例如:561nm(中间)和远红色通道(例如:640)(右)成像的透明化老鼠的相同肝脏区域(没有任何标记)。(c)在(b)中虚线所示区域用最大强度归一化的荧光信号强度分布图。(d-f)在未标记的透明化小鼠肺中转移瘤表达mcherry的具有代表性的光片图像(d),用结合atto594(e)的抗mcherry纳米抗体或结合atto647n(f)的抗mcherry纳米抗体促进的转移。(g)沿面板中虚线绘制的信号强度分布图(每个通道中,每只小鼠n=3转移)。(h)在(g)中的数据根据背景归一化的荧光信号强度分布图。(i)使用lucid后的透视小鼠远红外光谱大脑肿瘤转移的深层组织成像实例。肿瘤微转移(三角)可见于脑组织的几毫米深处。
图2:高肿瘤负荷整个小鼠体内转移瘤的可视化
(a,b)在lucid处理之前的具有高肿瘤负荷的小鼠的正常和高曝光生物发光图像。(c-h)同一只小鼠经过lucid处理后的落射荧光图像显示了与生物发光相比更多的肿瘤转移的细节(虚线矩形),包括在肺(f)(三角)和腿(h)中容易检测到的小的微转移,以及作为大规模信号在生物发光(d和e)中可见的原发肿瘤(g)和主要转移瘤。(i,j)从对应于(a-c)中指示的虚线角区域的光片成像数据获得的3d分割的正视图和侧视图。为简单起见,只分割了几个器官:心脏和肺;肿瘤以黑色显示。(k-n)原始的光片显微术数据(500μm投影)显示(j)中所示矢状面的肿瘤。(o-q)高分辨率的光片显微术图像(单平面)展示了由lucid检测到的单个肿瘤细胞(o中的盒状区域)和细胞核(p中用碘化丙锭(pi)标记)。另见图7-9。
图3:低肿瘤负荷的整个小鼠体内转移瘤的可视化和量化
(a,b)低肿瘤负荷小鼠lucid处理前的正常和高暴露生物发光图像。原发性肿瘤和腋窝淋巴结(a.l.n)转移瘤使用(a)中的箭头标记。(c-f)同一只小鼠经过lucid处理后的落射荧光图像显示了与生物发光相比更多的肿瘤转移的细节,包括许多生物发光(e)检测不到的肺微转移,甚至小于20mm(e中的三角)。(g,h)分别为在腹侧和侧视进行光片显微成像后,整个小鼠的3d重建。小鼠体内的所有肿瘤/转移瘤都被分割(有些用箭头标记)。(i)基于其大小(细胞数量)和数量对整个小鼠的所有转移瘤进行量化。(j)整个小鼠体内肿瘤转移的2d分布图。斑点的大小代表肿瘤转移的体积。标记区域的相对深度显示在右侧。(k)在肺中检测到的肿瘤转移的3d分割,显示肿瘤细胞(白点)的自发荧光背景。(l)如(k)所示的肺中所有转移瘤的3d散点图,表示了其大小和位置。
图4:转移瘤和治疗性抗体在整个小鼠体内的可视化
(a,b)在lucid之前的注射了与alexa568缀合的治疗性抗体6a10的低肿瘤负荷小鼠的正常和高暴露生物发光图像。需要注意的是,只有带有荧光物酶信号的肿瘤(而不是治疗性抗体)可见。(c-g)lucid处理的小鼠的落射荧光图像,显示了肿瘤转移和抗体6a10分布的细节。虽然大多数微转移似乎为抗体的目标(e,箭头),但也有一些并非是(f,箭头)。(h,i)分别为腹侧和侧视中进行光片显微成像后,整个小鼠的3d重建。小鼠体内的所有肿瘤均被分割并用抗体覆盖(合并显示为白色信号)。(j)为(h)中方框区域的高放大图,显示了肿瘤微转移的更多细节。(k-m)在(j)中针对盒装区域的抗体靶向的细节:(k)肿瘤通道,(l)抗体通道,和(m)是二者合并。另请参见图10和11。
图5:负荷有转移瘤的单个器官的高分辨率光片成像
(a)肺、肝、肾和脑的三维可视化。以三角(黑色)表示分割的肿瘤,以箭头(白色)表示治疗抗体(与alexa568缀合)靶向的肿瘤。(b)相关器官单个转移瘤的原始高分辨率光片显微图像,显示了肺、肾和脑中肿瘤细胞和治疗性抗体(白色)的重叠。不同器官中的靶向和非靶向微转移的(c)2d分布图和(d)治疗性抗体的量化。(e)器官中抗体生物分布的量化:与肿瘤和非肿瘤宿主小鼠组织结合的治疗性抗体。数值是平均值±s.e.m;n=3只小鼠。
图6:肿瘤脉管系统的可视化和肿瘤微环境的再探测
为了研究血管肿瘤微环境和治疗性抗体分布的细节,通过外源凝集素灌注标记低肿瘤负荷小鼠的血管。(a,b)用光片显微镜扫描小鼠躯干,显示出了一小群在生物发光中不可见的肿瘤(虚线矩形)。(c-f)图(b)所示区域的高放大倍数光片显微图像。外源凝集素标记的血管显示在(c)中,肿瘤显示在(d)中,治疗性抗体6a10(透明化之前2天注射)显示在(e)中。(f)为(c-e)中所示的3个通道的3d合并图层。需要注意的是,在这个高度血管化的肿瘤微环境中,大多数肿瘤都被治疗抗体靶向。(g-n)用lucid对肿瘤细胞进行全身标记、透明化和成像后的肺转移组织的共聚焦显微图像。将识别的转移性肺组织再水合,并使用肿瘤相关纤维原细胞(a-平滑肌肌动蛋白;asma)(g-j)与血管内皮细胞(meca-32)标记来进行肿瘤微环境的免疫标记分析(k-n)。
图7:肿瘤移植、抗体标记的特异性和肿瘤形态学特征的实验设计
(a)肿瘤移植实验工作流程的说明。(b)lucid流程后的小鼠全身。(c-e)肺肿瘤(c)内源性mcherry信号的共焦图像,其用与atto647n(d)缀合的抗mcherry纳米增强剂标记。合并图层显示了在e中。(f-h)为使用与atto647n(f,三角)和碘化丙锭(pi)(g,三角)缀合的抗mcherry纳米增强剂标记的动物的肺转移瘤的共聚焦图像中。两个通道的合并图层如(h,三角)所示。
图8:表达mcherry的肿瘤小鼠的纳米增强剂着色特异性确认
(a)高肿瘤负荷(表达mcherry)动物和c57bl/6n对照动物之间的比较,这两种动物都经与atto647n(白色)缀合的抗mcherry纳米抗体增强,c57bl/6n对照的器官中显示出缺乏非特异性的信号。bl6对照器官中指示区域的光片显微镜图像,显示出缺乏特定信号。需要注意的是,背景(灰色)被增强以显示高放大倍数图像中缺乏的信号。(b)在透明化的组织再水合后,用抗萤火虫荧光物酶抗体免疫标记肺组织中的647增强的肿瘤小转移的共聚焦图像,并用hoechst标记细胞核。
图9:低和高肿瘤负荷小鼠经生物发光和落射荧光成像的比较
(a-d)发现了正常暴露的生物发光成像对检测低肿瘤负荷小鼠的所有转移瘤均不敏感。例如,a、b和c、d中的小鼠在正常暴露下具有非常相似的生物发光图像。将lucid应用于这些小鼠,发明人发现在一个案例(a,b)中没有肿瘤转移,同时在腋窝淋巴结(c,d,盒装区域1)发现了大量转移(三角)。尽管来自原发肿瘤的信号在正常和高暴露生物发光图像(c,d,方框区域3)中都很强,但肺转移(箭头)(c,d,方框区域2))是不可见的。在落射荧光图像中,肿瘤(a647标记)显示为白色。(e-h)在高肿瘤负荷的小鼠中,生物发光成像提供了转移分布的整体热图。相反,即使使用立体荧光显微镜,lucid也能分辨出整个小鼠体内的单一微转移。特别是在肺部,即使直径小于20米的微转移也可以在整个小鼠体内解析。
图10:用改良的3disco方案:脱色步骤+免疫染色+3disco透明化的组合在肿瘤中进行内源性表达的mcherry信号的消除
(a)在改良的3disco透明化前后,通过荧光立体显微镜对肺中的肿瘤转移进行成像,显示出内源表达的mcherry信号被消除。(b)原发性肿瘤的光片显微图像,背景以绿色成像(例如:470nm)(左),红色mcherry信号成像(例如:561nm(中间)和增强信号(atto647nnm)成像于远红外通道(例如:640)(右)。(c)沿b组的白线绘制的信号强度分布图(n=3只小鼠)。(d)c中数据的背景归一化荧光信号分布图,显示出在改良后的3disco透明化后,内源性mcherry信号被耗尽到与背景相似的水平。
图11:共聚焦显微镜显示的抗体6a10信号与纳米抗体信号共定位
(a-i)动物的肺(a-c)、肾(d-f)和肝(g-i)转移瘤的共聚焦图像,所述动物用与atto647(a,d,g)缀合的抗mcherry纳米抗体标记,并用与alexa568(b,e,h)缀合的治疗性抗体6a10治疗。显示出了转移瘤与抗体6a10的共定位(c,f,i,三角)。(j-n)用与atto594(k)缀合的抗mcherry纳米抗体标记并用与alexa647(l)缀合的治疗性抗体6a10治疗的动物肺中单个癌细胞的共焦图像。hoechst核染色如(j)所示。显示出了核染色(m)的肿瘤和抗体6a10(n)的共定位。这些方框为高放大倍数图像或与虚线框指示的相应区域。
图12:肿瘤切除模型中肺转移的分析
将mda-231细胞移植到乳腺脂肪垫中8周后,切除体积<1.5cm3的原发肿瘤,5周后灌注小鼠进行lucid工作流程。(a-d)在全身透明化之前和之后的裸鼠外观。需要注意的是,肺部(c)和皮肤(d)在透明化后变得完全透明。(e)对小鼠切除肿瘤后的肺中的肿瘤转移进行3d分割。(f)对(e)中显示的所有肺转移瘤进行量化,表明其大小分布。
图13:lucid用于研究成年小鼠cns的神经再生
(a)对一只gfp-m的小鼠的cns(tbi后2个月)进行了透明化和成像。锥体轴突的退化在整个cns(b-d)中是明显的。需要注意的是,营养不良神经元的详细形态在每个区域都是可见的(b-d,三角)。(e)年龄匹配的gfp-m小鼠对照的未切除脊髓视图。需要注意的是,出现了整个轴突的递减(方框)。
图14:全身用lucid标记抗gfp纳米抗体后,cx3cr1-gfp小鼠(tbi后4个月)激活的小胶质细胞/巨噬细胞。
在整个cns(a)和单细胞放大图(b-d)中,免疫细胞的慢性激活沿着锥体轴突轨迹是明显的。需要注意的是,使用lucid(c,三角)进行纳米增强后,详细的细胞形态可见。(e)年龄匹配的cx3cr1-gfp小鼠对照的未切除脊髓视图。需要注意的是,小胶质细胞的均匀分布,并且中间没有积聚。
图15:lucid用于研究整个小鼠体内的脑淋巴管
(a-e)在全身透明化和成像后,同时使用内皮细胞标记(lectin-fitc)的bl6小鼠(a,b)或3-yfp转基因小鼠(c-e)中,整个小鼠头部(连同颅骨)使用ovalbumin(ov)-alexa647标记的淋巴管在血管周的分布。需要注意的是,vegfr3信号(d)和卵清蛋白示踪剂(e)的共定位,两者都标记脑淋巴管(c-e)。cx3cr1-gfp小鼠整个头部脑膜血管中的免疫细胞成像(f,三角)和cx3cr1-gfp+ccr2-rfp双转基因小鼠中的免疫细胞成像(g,虚线之间的三角)。需要注意的是,从大脑中排除了rfp+(虚线之间的三角)巨噬细胞/单核细胞(虚线右侧大脑区域用三角标记的小胶质细胞),其浸润将在损伤后追踪。m.v:脑膜血管。
图16:使用小鼠血液和脾脏筛选用于脱色的氨基醇
将11种不同的氨基醇与pfa固定小鼠血液混合并离心。(a)无色颗粒表明红色血红素已脱色。(b)进一步测试了8种良好候选物使用小鼠脾脏的脱色效果。所有老鼠的脾脏均褪色。分别在0小时和24h用指定的氨基醇孵育后显示的图像。图中所示的氨基醇如下:1.四乙酸,2.n-丁基二乙醇胺,3.n-甲基二乙醇胺,4.n,n-n-甲基二乙醇胺,5.1,3-二(二甲氨基)-2-丙醇,6.2-吗啉乙醇,7.n-叔丁基二乙醇胺,8.n-乙基二乙醇胺,9.n,n-二异丙基乙醇胺,10.n-甲基吗啉-n-氧化物和11.2-n-二丁氨基乙醇。
图17:猪脑的透明化
(a)解剖新鲜猪脑。(b)用n,n-二异丙基乙醇胺孵育24小时后脱色猪脑。(c)透明化后的猪脑的透明度。
图18:大型人脑样本的透明化和标记
(a)透明化后人脑的透明度,大小为3厘米×3厘米×1厘米。(b)荧光共聚焦图像显示出透明化的人脑中的斑块和细胞。(箭头:甲氧基-x04;星形:碘化丙锭;三角:nissl)
发明详述
定义和一般技术
除非下面另有定义,本发明中使用的术语应根据本领域技术人员已知的它们的共同含义来理解。
本文引用的所有出版物、专利和专利申请在此全部引入作为参考。本文提及的这些出版物、专利和专利申请通过其第一作者的姓名和出版年份来标识。对于以这种方式标识的每个参考文献,相应的参考文献包括出版物的具体来源(例如科学期刊的名称和卷等)可以在“参考资料”的部分中找到。
除非另有说明,这些材料、方法和实例均仅为说明,而非限制性的。
在此使用的术语“荧光物”没有特别限制。例如,荧光物可以是荧光蛋白或合成化合物,例如合成有机化合物。优选地,根据本发明使用的荧光物能够在红色或红外范围内发射荧光,更优选在远红外或近红外范围内发射荧光。根据本发明使用的荧光物发射最大值的优选波长如本发明的优选实施方案所示。能够发射远红外或近红外范围的荧光并且可以根据本发明使用的荧光物的非限制性实例为本领域中已知,并且修订在了例如hongetal(2017),near-infraredfluorophoresforbiomedicalimaging中。naturebiomedicalengineering1,0010在此通过引用整体并入本文。能够发射远红外或近红外范围荧光的荧光物,并且可以根据本发明使用,为市售可得的,并且优选包括例如atto染料,如attorho13、atto594、atto610、atto620、attorho14、atto633、atto647、atto647n、atto655、attooxa12、atto665、atto680、atto700、atto725和atto740,以及alexa
可用于本发明方法的动物组织没有特别限制。其可来自任何动物物种。在本发明的优选实施方案中,动物组织可以是非人类哺乳动物或人类的组织。优选地,非人哺乳动物的动物组织来自啮齿动物,更优选来自小鼠。更优选地,动物组织是整个小鼠。在根据本发明的优选实施方案中,动物组织可以是整个器官或其一部分,优选人类器官或其一部分。在根据本发明所有其他实施方案的优选实施方案中,动物组织可以包含重组表达的荧光蛋白(例如gfp、yfp和mcherry),均可用作目标分子。例如,在根据本发明的优选实施方案中,获得动物组织的动物可以是已经移植了表达这种重组荧光蛋白的癌细胞的动物(例如小鼠)。
本发明制备方法的脱色步骤使用固定的动物组织。在根据本发明的优选实施方案中,本发明的制备方法从脱色步骤开始,不包括动物组织的固定。因此,在优选实施方案中,本发明的所有方法均优选地不为通过手术或治疗来治疗人体或动物体的方法,也不是在人体或动物体上实施的诊断方法。在根据本发明所有其他实施方案的相关优选实施方案中,本发明的方法是离体方法。因此,本发明的方法可以优选地在活体动物外部进行。
适用于本发明方法的固定的动物组织可以被本领域技术人员容易地识别。例如,对于pfa固定,可以使用咪达唑仑、美托咪啶和芬太尼(mmf)的组合对小鼠进行深度麻醉(例如,小鼠体重为1毫升/100克;心内灌注前用肝素化的0.1mpbs(10u/毫升肝素,比率药物;100-125mmhg压力,使用leicaperfusionone系统),在室温下持续5-10分钟,直到血液被冲洗掉。该程序之后可进行固定,例如用4%多聚甲醛(pfa),例如在0.1mpbs(ph7.4)(morphisto,11762.01000)中固定10-20分钟。如果需要血管染色,在进行pfa固定之前,可以在动物组织如小鼠(如全小鼠)的心脏内灌注20毫升含有0.5毫克fitc缀合的凝集素(eylaboratories,f-2101-5)的pbs(无肝素)。或者,对于paxgene固定,可以使用咪达唑仑、美托咪定和芬太尼(mmf)的组合对小鼠进行深度麻醉(例如,小鼠体重为1毫升/100克;心内灌注前用肝素化的0.1mpbs(10u/毫升肝素,比率药物;100-125mmhg压力,使用leicaperfusionone系统),在室温下持续5-10分钟,直到血液被冲洗掉。该程序之后可以通过注射40-50毫升paxgene固定溶液进行固定。如果在进一步加工前需要储存paxgene固定的动物,组织将被保存在paxgene稳定溶液中。如果需要血管染色,在进行pfa固定之前,可以在动物组织如小鼠(如整个小鼠)的心脏内灌注20毫升含有0.5毫克fitc结合凝集素(eylaboratories,f-2101-5)的pbs(无肝素)。随后,如果动物是裸的(没有毛皮),可以小心地去除皮肤或保持皮肤完整,并且可以将尸体在4℃下在4%pfa中固定1天,并转移到0.1mpbs中。本发明的方法可以立即开始,也可以储存整个小鼠体之后开始,优选在4℃的pbs中储存长达4周,或者在含有0.05%叠氮化钠(sigma,71290)的pbs中储存长达6个月。
如本文所用,术语如“用于荧光显微术的动物组织”是指相应的动物组织适用于荧光显微术。
类似地,与溶液相关的术语“用于去除亚铁血红素”是指适于去除亚铁血红素的任何溶液。根据本发明,亚铁血红素的去除不限于特定的机制,只要其从组织中去除亚铁血红素和/或使亚铁血红素脱色即可。例如,可以使用适合于除去亚铁血红素的氨基醇,例如n,n,n,n-四(2-羟丙基)乙二胺,如优选实施方案中所示。这种氨基醇与亚铁血红蛋白竞争亚铁血红素结合,因此可用于从组织中的亚铁血红蛋白和组织中去除亚铁血红素。或者,可以使用过氧化苄基。
根据本发明使用的术语“含荧光物的标记剂”没有特别限制,只要其为适合于标记脱色的固定的动物组织中的目标分子,能够结合到所述目标分子,并且分子量等于或小于100kda。在优选实施方案中,含荧光物的标记剂是与所述荧光物缀合的抗体片段,更优选与所述荧光染料缀合的纳米抗体(也称为单结构域抗体)。可根据本发明使用的除单结构域抗体之外的抗体片段在本领域中也是已知的,包括例如fab、f(ab’)、单特异性fab2、双特异性fab2、scfv、双特异性双抗体和三特异性三抗体、scfv-fc、微型抗体和hcigg分子。
如本文所用,术语“目标分子”指组织中的任何目标分子。应当理解,对于本发明方法的给定应用,例如生物医学应用,可以选择合适的目标分子。例如,这些目标分子可以是动物的内源性分子(例如,疾病如癌症的标记蛋白)或重组分子如重组蛋白。例如,在根据本发明的优选实施方案中,如果获得动物组织的动物是已经移植了表达这种重组荧光蛋白的癌细胞的动物(例如小鼠),则这种荧光蛋白可以是目标分子。
还应当理解,本文使用的术语“标记目标分子”包括通过本发明的方法可以标记一个以上目标分子的可能性。因此,在根据本发明的优选实施方案中,不止一个目标分子被标记,例如两个或三个目标分子。例如,在根据本发明的优选实施方案中,如果获得动物组织的动物是已经移植了表达这种重组荧光蛋白的癌细胞的动物(例如小鼠),那么这种荧光蛋白可为第一目标分子,而已经给予所述动物的抗癌生物制药药物(例如抗癌治疗抗体)可为第二目标分子。因此,在诸如本实施方案的优选实施方案中,根据本发明的用于检测转移的方法和用于分析生物制药药物的生物分布的方法可以一起执行。
如本文所用,术语“在压力下的灌注”是指在组织入口点可测量的压力。可以通过本领域已知的任何方法测量压力。优选地,使用压力计测量压力,更优选地,使用kkmoondigitalmanometerpressuregaugemanometer(ht-1891)。当使用kkmoondigitalmanometerpressuregaugemanometer(ht-1891)时,可以将一个双头连接器(b.braundiscofixcdreiwegehahn,16494c)插入泵送通道并连接至压力计。泵送通道可以使用常规灌注针(leica,39471024)设置,并且可以在用于该方法的泵送速度下测量压力(当读数稳定时)。
本文所指的“透化溶液”是指适于动物组织透化的溶液。这种溶液是本领域已知的,本领域技术人员可以容易地选择,并且包括例如适合透化的洗涤剂,例如tritonx-100。优选地,根据本发明使用的透化溶液进一步包含适于从生物膜中提取胆固醇的试剂。这种适于从生物膜中提取胆固醇的试剂包括例如甲基-β-环糊精。优选地,根据本发明使用的透化溶液进一步包含疏松胶原网络的试剂,例如反式-1-乙酰基-4-羟基-1-脯氨酸。应当理解,如果在本发明方法的特定步骤中使用透化溶液,这并不排除其它溶液,例如在该方法的先前步骤中使用的溶液也可以有助于透化和改善透化。例如,去除亚铁血红素的溶液可以是有助于透化的溶液。
根据本发明的组织体积的测量可以通过本领域已知的任何合适的方法进行。优选地,这种体积通过测量组织在液体中的排水量(例如在合适的圆柱体中)来测量。
本文所指的“透明化溶液”是指适于透明化动物组织的溶液。这些溶液没有特别限制,只要它们含有有机溶剂。应当理解,技术人员可以容易地选择这样的有机溶剂,使得它们与本发明的方法相容,例如基于它们的电磁吸收/发射光谱(特别是其在可见光、红光和近红外范围内没有荧光发射)。优选地,包含有机溶剂的透明化溶液具有与所述动物的组织(例如骨骼)相似的折射率,如同优选实施方案中所反映的。这种透明化溶液对于透明化组织特别有利。可用于本发明这种透明化溶液的优选有机溶剂的实例例如,包含苯甲醇、苯甲酸苄酯和二苯醚的溶剂、包含肉桂酸乙酯的溶剂和包含肉桂酸烯丙酯的溶剂。
测量折射率的方法在本领域是众所周知的。此处所指的折射率值是在室温(即25℃)和正常大气压(即760mmhg)下测量的值。
结合本发明提及的“另一种有机溶剂”没有特别限制。应当理解,技术人员选择的溶剂应当适于干燥。这种溶剂的实例如thf、二氯甲烷和1,4-二恶烷。例如,根据本发明,另一种使用0vol%至100vol%的递增梯度的有机溶剂的灌注可以是梯度为0vol%至100vol%的thf灌注,然后用二氯甲烷孵育。或者,在根据本发明的所有实施方案中,二氯甲烷可以被1,4-二恶烷代替。
根据本发明所有其他实施方案的附加改进可以通过添加脱钙步骤来实现。这一步将进一步改善骨骼的透明化。脱钙化学品是已知的,包括例如包含乙二胺四乙酸的溶液,优选进一步包含nahco3。这种脱钙步骤在脱色步骤之前进行,或者如果没有脱色步骤,则在标记步骤之前进行。
本文结合结构使用的术语通过连接结构“存在于细胞中”是指存在于所述细胞中的结构。该术语并不意味着该结构必须存在于细胞,而是还包括该结构存在于所述细胞表面的可能性。
这里使用的术语“治疗性抗体”是指本领域已知的任何治疗性抗体和治疗性抗体片段此外,该术语不限于治疗性抗体和治疗性抗体片段本身,还包括偶联物,例如抗体药物偶联物。
如本文所述,术语“小分子”具有本领域已知的含义。典型地,根据本发明使用的小分子具有<900道尔顿的分子量。
根据本发明,术语“包括”的每次出现可以任选地用术语“由...组成”代替。
本发明通过以下非限制性实例来说明:
实例
除非另有说明,实例中使用了以下方法:
小鼠、异种移植实验和治疗性抗体注射
雌性nsg(nod/scid/il2受体gamma链被敲除)小鼠获自jacksonlaboratory,并被安置在亥姆霍兹慕尼黑中心的动物设施中。所有动物实验均根据慕尼黑大学和亥姆霍兹慕尼黑中心的机构指南进行,并获得上巴伐利亚州政府伦理审查委员会(regierungvonoberbayern,munich,germany)的批准。所有数据都根据arrive标准进行报告。计数用表达mcherry的慢病毒转导的mda-mb-231乳腺癌细胞和增强的萤火虫荧光素酶(vicketal.,2015),通过100μm过滤器过滤并重新悬浮在rpmi1640培养基中。将每只小鼠2×106个细胞以50μl的体积经皮注射到第4个左侧乳腺脂肪垫中。肿瘤生长通过使用如上所述的ivisluminaii成像系统(caliperlifesciences)(gondietal.,2013)的全身生物发光测量(光子/秒)来监测。简言之,用异氟醚麻醉小鼠,将其固定在成像室中,并在荧光素注射后15分钟成像(150mg/kg;i.p.)。使用活体图像软件4.2(caliper)量化生物发光信号。肿瘤细胞注射后9周,将发光测量显示低、中或高转移信号的小鼠(图9)分配到不同的实验程序,包括注射人碳酸酐酶(ca)xii特异性抗体(6a10)(battkeetal.,2011)、血管染色、增强内源性mcherry荧光、免疫标记和透明化,如下所述。灌注前48小时,将20μg的与alexa-568或alexa-647缀合的6a10抗体注射到尾静脉。
切除模型
nmrinu/nu小鼠获得自janvier,动物实验根据机构指南进行,并获得德国达姆施塔特地区委员会兽医部门的批准。在注射肿瘤细胞之前,用100mg/kg氯胺酮和10mg/kg甲苯噻嗪在0.2ml的0.9%氯化钠溶液中麻醉动物。对于乳房脂肪垫移植,麻醉小鼠背部朝下放置,在无菌条件下,在腹部右下象限的皮肤上做一个小的(~1cm长)切口以暴露乳房脂肪垫。接下来,在乳房脂肪垫中给每只动物注射50μl含有4×106的mda-231-br细胞的肿瘤细胞悬液(yonedaetal.,2001),并使用米歇尔夹闭合伤口。使用卡尺测量肿瘤体积,并根据以下公式计算体积:vt=(axb2)/2,其中a代表肿瘤的长度(最长的测量值),b代表肿瘤的宽度,垂直于a测量。在实验结束时(或者当肿瘤体积达到2cm3时,或者当观察到其他需要终止的症状时,例如恶病质、溃疡形成等),使用深度麻醉处死动物,并用4%pfa灌注。对于肿瘤切除实验,如上所述地麻醉动物,并在无菌条件下在离肿瘤约2-3mm的皮肤上切开。为了更好地暴露肿瘤,覆盖肿瘤的皮肤被轻轻地拨开。接下来,使用烧灼器通过热凝术识别并闭合主要肿瘤供应动脉。为了实现肿瘤的完全切除,在距离肿瘤至少2mm将周围的乳房脂肪垫切离。肿瘤切除术中观察到的任何小出血都通过热凝术停止。随后,应用米歇尔夹闭合皮肤伤口。在术后阶段,动物在术后一周内使用镇痛药物(rimady),并在接下来的几周内进行观察。实验结束时,通过深度麻醉处死动物,并用4%pfa灌注。
灌注和组织处理
在使用肝素化的0.1mpbs(10u/ml肝素,ratiopharm;100-125mmhg压力,使用leicaperfusionone系统)心内灌注前,使用咪达唑仑、美托咪啶和芬太尼(mmf)的组合对小鼠进行深度麻醉(1ml/100g小鼠体重;i.p),心内灌注在室温下持续5-10分钟,直到血液被洗掉,导致小鼠死亡,随后在溶于0.1mpbs(ph7.4)的4%pfa(morphisto,11762.01000)中灌注10-20分钟。对于脉管系统染色,在进行pfa固定之前,用20毫升含有0.5毫克fitc结合凝集素(ey实验室,f-2101-5)的pbs(无肝素)对小鼠进行心内灌注。对于ngs小鼠,小心地除去皮肤,将身体在4℃下在4%pfa中固定1天,并转移到0.1mpbs中。nmrinu/nu小鼠以相同的方式进行后固定,而不去除皮肤。立即启动lucid流程,或将整个小鼠体在4℃的pbs中储存长达4周,或在含有0.05%叠氮化钠(sigma,71290)的pbs中储存长达6个月。
udisco全身透明化
在参考文献(panet.al.,2016年)中已经详细描述了udisco透明化小鼠全身的方案。简而言之,构建了包括蠕动泵的经心循环系统(ismatec,reglo,digitalms-4/8ism834;参考管,sc0266)。泵的两个通道设置用于通过心脏进入脉管系统的循环:第一通道将透明化溶液泵入小鼠体内,第二通道收集离开小鼠体内的溶液,并将溶液再循环回到原始瓶中。对于将溶液注射到心脏中的第一通道的流出管,使用注射器的尖端(从1ml的syringe-braun中切下,9166017v)将灌注针(leica,39471024)连接到管上。同时,将再循环透明化溶液的第二通道的流入管固定至包含鼠体的玻璃室。循环溶液的量取决于透明化玻璃室的容量。例如,如果玻璃室的最大体积是400毫升,则使用300毫升的溶液进行循环。
所有透明化步骤都在通风橱中进行。首先,将鼠体放入玻璃室中,并将灌注针通过用于pfa灌注的同一孔插入心脏。然后,在用铝箔覆盖室后,以230mmhg的压力(ismatec泵60转/分)开始经心循环。用下列梯度的叔丁醇灌注小鼠体6小时:30vol%、50vol%、70vol%、90vol%(蒸馏水中)、100vol%两次,最后用折射率匹配溶液babb-d4,含有4份babb(苯甲醇+苯甲酸苄酯1∶2、sigma、24122和w213802)、1份二苯醚(dpe)(alfaaesar,a15791)和0.4%vol维生素e(dl-alpha-生育酚,alfaaesar,a17039),持续至少6小时,直到身体透明。由于叔丁醇的熔点在23-26℃之间,所以在两轮100%叔丁醇循环中使用设定在35-40℃的加热垫来防止溶液凝固。
脱色和全身免疫染色
以下纳米抗体和染料用于全身免疫染色:atto647n缀合抗rfp/mcherry纳米增强剂(chromotek,rba647n-100),atto594缀合抗rfp/mcherry纳米增强剂(chromotek,rba594-100),hoechst33342(thermofisherscientific,21492h),碘化丙啶(pi,sigma,p4864)和fitc缀合外源凝集素(eylaboratories,f-2101-5)。
为了在pfa灌注后除去剩余的血液和亚铁血红素,在免疫染色前用脱色溶液对动物进行一轮灌注。脱色溶液用cubic试剂1(susakietal.,2014)在0.1mpbs中以1∶3稀释制成。制备cubic试剂1,在0.1mpbs中混合25wt%尿素(roth,3941.3)、25wt%的n,n,n’,n’-四(2-羟丙基)乙二胺(sigma,122262)、15%tritonx-100(applichem,a4975,1000)。除了将0.20μm的注射器过滤器(sartorius16532)连接到管道上,搭建了与udisco使用的相同的包括蠕动泵的经心循环系统,以在脱色和免疫染色步骤灌注小鼠,这有效地防止了染料聚集体积聚到样品中,并且泵送的高压保持在约230mmhg。固定后和用pbs洗涤后,小鼠在室温下用0.1mpbs灌注过夜,然后将动物在室温下用脱色溶液灌注2天,每12小时换一次新鲜溶液。随后,动物在室温下用300毫升免疫检测溶液灌注2天,该溶液含有1.5%山羊血清(gibco,16210072)、0.5%tritonx-100、0.5mm的甲基-beta-环糊精(sigma,332615)、0.2%反式-1-乙酰基-4-羟基-l-脯氨酸(sigma,441562)、0.05%叠氮化钠(sigma,71290)、25μl纳米增强剂(储备浓度0.5-1mg/ml),1mg的外源凝集素-fitc,10μg/ml的hoechst和/或0.1mpbs中的350μl的碘化丙啶(贮存浓度1mg/ml)。然后在室温下用洗涤液(在0.1mpbs中的1.5%山羊血清,0.5%tritonx-100,0.05%叠氮化钠)灌注小鼠12小时两次,最后在室温下用0.1mpbs灌注12小时两次。
3disco全身透明化
对于使用3disco的全身被动透明化,将小鼠在室温下在玻璃室内的脱水和透明化溶液中孵育,保持在通风橱内摇动摇杆(ika,2d数字)顶部的轻微旋转,这足以使组织透明。为了脱水,将鼠体在蒸馏水中的下列梯度的300毫升的四氢呋喃thf(sigma,186562)中孵育(每个步骤6-12小时):50vol%thf,70vol%thf,80vol%thf,100vol%thf和100vol%thf;然后将小鼠在二氯甲烷(sigma,270997)中孵育1小时,最后在babb孵育。在所有孵育步骤中,玻璃室用石蜡膜密封,并用铝箔覆盖。
使用lucid后透明化的转移组织的再水化和免疫染色
以下抗体用于再水合组织:抗萤火虫荧光素酶(稀释1:2000,abcam,ab21176),抗panendothelial抗原细胞meca-32(稀释1:25,bdbiosciences,550563),抗α-平滑肌肌动蛋白(αsma)(稀释1:500,sigmac6198),alexafluorplus568山羊抗大鼠igg(h+l)(稀释1:400,lifetechnologies,a11077),alexafluorplus647山羊抗大鼠igg(h+l)(稀释1:400,lifetechnologies,a21245),alexafluorplus555山羊抗大鼠igg(h+l)(稀释1:400,lifetechnologies,a32732),alexafluorplus488山羊抗大鼠igg(h+l)(稀释1:400,lifetechnologies,a11034)。
在鉴定了经lucid处理的小鼠肺中的转移瘤后,通过应用用于udisco透明化的叔丁醇的反向梯度来解剖肺组织并再水合,如下所示(在37℃下温和摇动各6小时):室温下,100vol%两次、90vol%、70vol%、50vol%、30vol%和两次0.1mpbs。将再水合的样品在含有0.2%明胶、0.5%tritonx-100、0.05%叠氮化钠和5%正常山羊血清的0.1mpbs中于37℃孵育1天(belleetal.,2014)。然后将1毫米切片与稀释在同一溶液中的第一抗体在37℃孵育过夜,在pbs中洗涤两次,并与第二抗体一同在37℃孵育4小时
落射荧光立体显微镜成像
被透明化的整个小鼠体被固定在原始的透明化室中,并使用1×长工作距离空气物镜(平面z1×,0.25na,工作距离(wd)=56毫米)使用蔡司axiozoomems3/sycop3荧光立体显微镜成像。放大倍数设置为7倍,手动选择成像区域以覆盖整个鼠体。这些图像是用gfp、rfp和cy5滤镜拍摄的,文件被导出为rgb图像,并使用adobephotoshopcs6进一步拼接。对于高放大倍数的放大图像,扫描是由同一台显微镜拍摄的,最高可达112×。
光片显微成像
使用ultramicroscopeii(lavisionbiotec)采集单平面照明(光片)图像叠层,其轴向分辨率为4μm。对于肿瘤和抗体信号的低放大率全身筛查,使用与olympusmvx10变焦体耦合的1×olympus空气物镜,其提供从0.63倍到6.3倍的放大和缩小范围。使用1×物镜,对2×2.5厘米的视场进行成像,覆盖鼠体的整个宽度。从深度达13毫米的腹侧和背侧表面获得沿鼠体纵向y轴60%重叠的切片扫描,使用10μm的z-step覆盖身体的整个体积曝光时间为150毫秒,激光功率为3至4mw(70%至95%的功率水平),并且光片宽度保持在最大值。样品在整个视野内平铺成像后,使用薄电动牙科刀片(0.2毫米)(dremel,8200)切割扫描区域,以便进一步成像。在对整个身体进行低放大率成像之后,使用高放大率物镜(olympus4×/0.28纳[wd=10毫米)和与保持在1×的olympus旋转变焦体单元(u-tvcac)耦合的zeiss20×/0.1na[wd4=mm)将单个器官(包括肺、肝、肾、脑、脾、肠和骨)分别解剖和成像。使用20%的重叠获得高放大倍数的瓦片扫描(4×4),并且减小光片宽度以在视场中获得最大照明,保持相同的na。
共聚焦显微成像
将诸如解剖组织、器官碎片或整个器官的透明化标本放置在35毫米玻璃底培养皿(mattek,p35g-0-14-c)上,然后用一两滴折射率匹配溶液(例如babb或babb-d14)覆盖样品。没有必要密封该安装室。样品用倒置激光扫描共聚焦显微镜系统(zeiss,lsm880)成像,使用40×的油浸透镜(zeiss,ecplan-neofluar40×/1.30oildicm27)和25×水浸长工作距离物镜(leica,na0.95,wd=2.5mm毫米),后者安装在定制安装螺纹上。z-step的尺寸为1-2.50μm。
小鼠全身扫描的重建
落射荧光(整只老鼠的2d拼接):
收集的落射荧光图像使用了adobephotoshop照片合并功能(文件\自动\照片合并)半自动拼接的。不同的通道被分别使用adobephotoshop合并,以生成合成图像。
光片显微镜(整只老鼠的3d拼接):
使用imspector(lavisionbiotecgmbh)的光片显微镜堆叠被分别采集为各个通道的16位灰度tiff图像。堆叠首先被对齐并使用vision4d(arivisag)融合在一起。进一步的图像处理主要使用fiji(图像j2)完成:首先,均衡鼠体的总体轮廓的自体荧光通道(在488激发下成像)。通过定义目的区域来手动分割器官。数据可视化是通过amira(feivisualizationsciencesgroup)、imaris(bitplaneag)、vision4d用最大体积和强度的投影颜色映射绘制的。
量化
荧光和归一化荧光信号分布图:
用荧光信号分布图在最大峰值上的计算来更好地比较在远红外通道和红色通道上的深层组织的光学成像,特别是绿色通道,由于远红外通道中的光的散射、自发荧光和吸收较少。在用光片显微镜在肝脏样品的三个不同通道(激发470nm、561nm和647nm)中获得相同的z叠层后,在fiji软件中打开来自不同通道的相同z平面。在不同的通道中在器官上画出从一侧至另一侧的相同的直线,并测量由该直线明限定的信号强度分布。然后,将所有曲线图的值归一化为曲线最大峰值的百分比,并显示在代表性折线图中(图1d)。
为了比较在成像通道移动到远红或近远红时,背景信号的减小和信号相对于背景的增强(sbr),用激发545/561nm对表达mcherry的肺转移瘤进行成像,然后在激发590nm将与atto594缀合的抗mcherry纳米抗体标记过的肺转移瘤进行成像,以及在激发640nm将与atto647n缀合的抗mcherry纳米抗体标记过的肺转移瘤成像(每个实验组n=9个肿瘤,每个实验组由3只动物组成)首先,计算所有这些转移瘤的荧光信号分布图:使用光片显微镜获得肿瘤z平面图像,用fiji打开,并且在肿瘤上画出大约300-350像素的直线,包括作为背景的肿瘤周围的组织区域。从限定的直线测量信号的轮廓,每个实验组的代表性动物的所有绘图值都显示在代表性折线图中(图1g)。最后,通过归一化如上所述的相应环境背景的平均信号强度上的肺转移瘤图像,来计算由图表图1h表示的归一化图像。
为了比较图10c-d中的信号-背景比,样品使用了与atto647n缀合的抗mcherry纳米抗体标记,分别使用470nm、561nm和640nm激发原发肿瘤成像。用与上述相同的方案绘制每个通道的荧光信号强度图和归一化背景图。
肿瘤大小和治疗性抗体结合:
为了量化大数据集中的肿瘤大小和数量,发明人用python开发了一个定制脚本,该脚本将数据分成小的3d立方体(块),并分别处理它们。然后使用fiji对每个单独的块进行量化。由于数据大小和处理速度之间的非线性关系(增加数据大小将大幅度地降低处理速度),较小的数据集将得到更快的处理速度,此外,不同的数据包可以分散在多个在并行管理的处理器上,以进一步加速整个过程。并行处理器的输出使用python脚本进行合并。其中,最终结果包括肿瘤的体积、表面、半径和坐标的测量。为了量化每个肿瘤中的细胞数量,测量几个分离的单细胞(约1700μm3)的大小,并基于体积插值估测转移瘤的总数。估测值的准确性由微转移实例内的细胞核数量(pi或hoechst标记)证实。肿瘤的直方图由python(matplotlib)生成,代表了具有相同数量的癌细胞的转移频率。为了分析治疗性抗体的生物分布,首先,将分割的肿瘤通道作为掩模应用于抗体通道,并分割特定信号。这使我们能够快速确定治疗抗体靶向和非靶向的微转移比例。为了确定没有靶向肿瘤的抗体,只分割了出现在抗体通道的信号,而不分割是肿瘤通道的信号。
实例1:成年小鼠全身免疫标记
发明人着手开发了一种免疫染色方法,用于使用荧光蛋白标记在整个成年小鼠体内表达的癌细胞。发明人推断纳米抗体最适合于实现整个成年小鼠的免疫标记,因为其体积小(12-15kda,而常规抗体约为150kda)(muyldermans,2013;yangetal.,2014)。为了将与亮色atto染料缀合的纳米抗体(称为纳米增强剂)递送到全身,发明人开发了一种透化溶液,该溶液含有tritonx-100、甲基-β-环糊精(用于从生物膜中提取胆固醇)和反式-1-乙酰基-4-羟基-l-脯氨酸(用于疏松胶原网络)(hamaetal.,2015)。发明人通过高压蠕动泵(230mmhg,而标准小鼠心脏灌注为80-150mmhg)在小鼠体内循环这种透化溶液(gageetal.,2012;ghanavatietal.,2014),这有助于通过心血管系统向组织深处输送纳米增强剂。为了进一步降低血液密集器官(如肝脏)的背景,在全身免疫标记步骤之前,用氨基醇处理小鼠全身(tainakaetal.,2014年)。在使小鼠透明后,通过标准的落射荧光和光片显微镜对整个身体成像。拼接收集到的图像,用于整个透明小鼠的目标细胞的无偏差可视化(图1a)。
发明人选择使用与远红外染料缀合的纳米抗体来增强来自癌细胞的信号,因为穿过生物组织的光在这些光谱中散射较少(hongetal.,2017年),并且它可以到达大型器官的内核,例如肝脏,而不会在表面被阻挡(图1b,c)。为了在肿瘤转移中利用lucid,将人乳腺癌细胞(表达mcherry和萤火虫荧光素酶的mda-mb-231细胞)移植到nodscidgamma(nsg)雌性小鼠的乳腺脂肪垫中,并使肿瘤生长和转移超过6-10周(图7a)(gondietal.,2013年;iornsetal.,2012年)。然后在应用lucid方案之前,使用标准pfa固定对动物进行经心灌注。首先,在使用与atto-594或atto-647n染料缀合的抗mcherry纳米抗体增强肿瘤细胞中的内源性mcherry信号之后,评估透明小鼠中的荧光信号。发明人发现纳米增强剂特异地性地标记了肿瘤细胞,并且与内源性mcherry信号相比,增强了高达20倍的信号背景比(图1d-h和图7b-g)。由于信号强度的显著增强以及在远红色范围成像的优点,在远红色范围中,光穿透深层组织而散射很小,因此即使在深层组织区域,例如大脑中部,也容易检测到肿瘤微转移(图1i,箭头)。为了进一步确认lucid全身免疫标记的特异性,进行了以下对照:1)对照小鼠在没有肿瘤移植的情况下被染色,因此缺乏mcherry表达,并且在任何分析的器官中没有发现标记(图8a);2)将来自原发性肿瘤和肺转移瘤的透明组织再次水合,并使用特异性抗荧光素酶抗体再次染色,这证实了内源性mcherry荧光与纳米增强剂和荧光素酶信号共定位(图7b-d和8b)。
实例2:透明小鼠单细胞水平的肿瘤转移的检测
许多关于癌症转移的临床前研究会采用小鼠模型,其中使用磁共振成像(mri)、计算机断层扫描(ct)、正电子发射断层扫描(pet)、单光子发射计算机断层扫描(spect)或超声和生物发光成像(condeelisandweissleder,2010;massoudandgambhir,2003,2007;ntziachristos,2010;pichleretal.,2008;timpsonetal.,2011)等方法观察癌细胞在原发部位和身体远端区域的生长。虽然这些方法提供了关于原发性肿瘤和大型转移瘤大小的重要纵向信息,但是其通常只能分辨大于50μm(约75个细胞)的结构,因此其不具有检测由较少细胞组成的较小的微转移的分辨率。由于检测可能代表休眠癌细胞或早期转移结节的较小尺寸的肿瘤细胞簇至关重要,发明人使用lucid来研究整个小鼠体内的癌症转移。为了将lucid与常规成像方法进行比较,采集了移植有人乳腺癌细胞的小鼠的生物发光图像,以确定lucid之前可检测的肿瘤转移水平。基于生物发光成像对具有低和高肿瘤负荷的小鼠进行如下分析:没有转移(图9a)或仅局限于单个身体区域的转移的小鼠代表低肿瘤负荷类别(图9c),而转移到多于一个身体区域的小鼠代表高肿瘤负荷类别(图2a,b和图9e,g)。根据以前的发现,使用类似的模型将mda-mb-231细胞注入乳腺脂肪垫,发明人总是通过生物发光检测腋窝淋巴结最早的大量转移(图9)(iornsetal.,2012)。评测了生物发光后,应用lucid如下:使用与atto-647n缀合的抗mcherry纳米增强剂对整个小鼠体进行pfa固定、脱色、免疫标记,并使用disco全身方法进行透明化(panetal.,2016)。首先,使用标准落射荧光立体显微镜观察来自高肿瘤负荷小鼠的整个透明小鼠体(图2c-h)。正如预期的,可以很容易地看到原发性肿瘤(图2g)和腋窝淋巴结的主要转移瘤(图2e),也可以通过生物发光成像(图2a,b)检测,尽管其作为一个大块信号而缺乏关于其真实大小和形状的信息。相比之下,lucid还允许用常规的荧光成像观察肺部的几个微转移,这在生物发光中是不可见的(比较图2f,红色箭头和图2a,b中由紫色矩形标记的区域)。因此,与生物发光成像相比,可以在几分钟内完成检测的落射荧光成像已经提供了更多的细节和灵敏度(图9)。
接下来,使用单平面激光扫描光片显微镜(panetal.,2016)对整个小鼠收集高分辨率的3d图像,以检测高肿瘤负荷小鼠体内的微转移。拼接扫描的切片,分割肿瘤。在胸部区域,不仅可以看到肺(图2i,j中的分割区域)和淋巴结的各种转移瘤,还可以看到颈部底部和周围组织的转移瘤(图2i-n)。重要的是,光片显微镜扫描使我们能够观察到至单细胞水平的整个小鼠体内的微转移(图2o-q)。接下来,使用lucid对低肿瘤负荷小鼠成像。同样,与生物发光成像(图3a、3b)相比,落射荧光成像已经显示了肿瘤转移的更多细节(图3c-f)。在低肿瘤负荷小鼠中,使用光片显微镜检测腋窝淋巴结中的大分子团,并在全身特别是在肺中(图3g-j)检测到数百个不同大小的微转移。放大整个小鼠的肺,发明者可以在细胞水平上对转移瘤进行成像,并提取其大小和空间位置的信息(图3k,左)。例如如图3i-l所示,在的肺中检测到了约1490个微转移,其中62.2%小于75个细胞,这些细胞不能通过包括生物发光在内的标准方法成像。有趣的是,微转移无论其大小随机分布在肺部,这表明在多个部位有独立的定殖。为了证明lucid流程在不同肿瘤模型中的适用性,在原发性乳腺脂肪垫肿瘤的体积达到<1.5cm3后将其切除,并观察小鼠约8周。这种切除模型更接近临床环境,不受原发肿瘤生长的限制,为转移瘤的扩散和生长提供了额外的时间。事实上,与未切除的动物相比,该模型中转移瘤的数量增加了4倍(图12,图3i)。有趣的是,发明人发现88.5%的肺中的微转移小于75个细胞(图12),这表明可能通过循环肿瘤细胞而存在不断重新接种新的微转移。因此,lucid揭示了整个小鼠体内的肿瘤转移的细胞细节。
实例3:使用lucid评定治疗性抗体
靶向关键肿瘤细胞抗原的单克隆抗体是过去二十年中出现的最有希望的肿瘤治疗方法之一。许多肿瘤靶向单克隆抗体已成为各种实体和血液恶性肿瘤的标准治疗方法的一部分,还有许多处于临床发展的早期或晚期阶段(pandey和mahadevan,2014)。通常,针对癌细胞过度表达的肿瘤相关抗原产生治疗性抗体。一旦注射这些抗体,其会在全身分布以靶向癌细胞。然而,到目前为止,还没有以细胞分辨率确定在全身的治疗性抗体的分布的方法。在此,发明人使用lucid来评估针对人ca12的治疗性单克隆抗体6a10的生物分布(battkeetal.,2011)。ca12在各种类型的癌症中过表达,使用抗体6a10阻断其活性可减少肿瘤生长(gondietal.,2013)。在移植mda-mb-231细胞后9周静脉注射20μg与alexa-568缀合的6a10(具有atto-647n增强的肿瘤信号)或与atto-647n缀合的6a10(具有atto-594增强的肿瘤信号),并在抗体注射后2天灌注小鼠用于lucid分析。由于alexa-568激发/发射光谱与癌细胞的内源性mcherry信号重叠,发明人使用了一种改进的3disco方案——脱色步骤+免疫染色+3disco透明化的组合——来完全淬灭注射了与alexa-568缀合的6a10抗体的小鼠的内源性mcherry信号(图10)(panetal.,2016)。同样,小鼠的生物发光成像的终端表现出仅在低肿瘤负荷小鼠的原发肿瘤和腋窝淋巴结中可检测到的信号(图4a,b)。为了评估lucid是否能够同时对肿瘤细胞和治疗性抗体6a10的生物分布进行成像,发明人首先使用落射荧光显微镜观察抗体6a10在原发性肿瘤(图4c,g)的累积和腋窝淋巴结的转移(图4c,d)。聚焦肺部,可以看到抗体6a10靶向的微转移(图4e,白色箭头)而其他中则不能(图4f,箭头)。接下来获得了整个透明小鼠全身中的肿瘤转移和缀合的抗体6a10的高分辨率光片显微图像,以评估目标肿瘤的完整分布(图4h-m)。发明人发现在肾和脑中,所有肿瘤微转移都被6a10靶向,而在肝和肺中,分别只有75%和81%被靶向(图5a-d,图12)。此外,肾中5%的抗体结合位点、肝中27%的抗体结合位点以及肺和脑中约40%的抗体结合位点是非特异性的(非肿瘤宿主组织)(图5e)。总的来说,该分析表明,本发明的方法提供了一个强大的用于追踪治疗性抗体的生物分布以及整个小鼠体内的微转移的平台。
实例4:肿瘤脉管系统的三维可视化和肿瘤微环境的表型
原发性肿瘤和转移瘤都依赖血管提供氧气和代谢物。此外,肿瘤脉管系统为肿瘤细胞向远处扩散、免疫细胞流入肿瘤以及治疗药物的递送提供了管道(weltietal.,2013)。此外,血管来源的血管分泌信号特异性地形成专门的血管龛,调节肿瘤的生物学的不同方面,包括增殖、侵袭、自我更新或治疗抗性(butleretal.,2010)。发明人使用lucid通过整个小鼠的肿瘤细胞、治疗性抗体和血管的伴随可视化,对整个小鼠中的转移血管瘤进行表征。通过光片显微镜对低肿瘤负荷小鼠进行全身成像,确定了远离原发肿瘤和主要转移部位的微转移(图6a,b)。接下来,发明人从整个小鼠身上收集了高分辨率的光片显微图像,以观察转移区域的血管结构(图6c-f)。发明人还发现治疗性抗体在这个富含血管的区域达到了大多数肿瘤的微转移(图6d-f)。
为了能够进一步表征全身检测到的微转移,在lucid流程之后对目标区域进行免疫标记至关重要。为此,通过逆转udisco方案,使lucid成像的转移性肺组织再水合。随后,使用癌症相关的成纤维细胞标记物alpha平滑肌肌动蛋白(αsma)(图6g-j)和血管内皮细胞标记物meca-32(图6k-n)对其进行免疫染色。这些结果表明,lucid能够通过抗体标记对所选组织进行进一步的表型分析。
实例5:本发明的方法可用于评估小鼠整个cns神经变性的细节。
为了研究小鼠整个cns的慢性神经变性,发明人对thy-1gfp-m小鼠系进行了创伤性脑损伤(tbi),其中一部分神经元表达gfp。发明人对小鼠体使用了一个闭头(整个颅骨)tbi模型,因为与开放颅骨模型相比,其能更好地模拟人类受伤的情况。小鼠躯体感觉的运动皮质上的tbi由tbi的受控皮层冲击(cci)模型(“impactone”device,leica)诱导,如发明人最近所述(erturketal.,2016),该模型允许诱导高度可再现的轻度和中度tbi。使用了以下参数:信号枪速6.5m/s,撞击持续时间350毫秒,影响深度为2.0mm。这个tbi使头骨破裂,并在2-3周内诱导出一个mri可见的洞。在tbi灌注小鼠两个月后,发明人使用lucid流程以增强gfp信号,在整个小鼠使用与atto647n缀合的抗gfp纳米抗体。随后,使用光片显微镜对小鼠整个cns成像。发明人发现了从大脑到脊髓的下降锥体运动轴突的退化(图13)。与未受伤小鼠的脊髓相比,轴突的退化通过盒装区域(图13b-d)的断裂(起泡)而证明(图13e)。需要注意,也可以通过可视化不增强的gfp蛋白的类似的实验来完成(panetal.,2016),然而,增强的gfp的提供了1)与内源性gfp相比更多的细节,因为染料更亮,2)其稳定了gfp信号(没有漂白超时),可以通过长时间的高放大扫描收集详细的高分辨率图像,以及3)使用标记有a647n的抗gfp纳米抗体在远红外增强有助于在远红外通道中成像样本,与绿色通道(488nm)相比,这里的自发荧光少的多。
实例6:本发明的方法可用于分析整个小鼠的cns中存在的慢性神经炎症。
炎症被认为具有包括修复性和破坏性的多个方面,这取决于损伤后的时间、涉及的免疫细胞类型和组织位置。除了要知道哪些类型的炎症细胞必须被靶向,以及何时(急性、慢性或两者兼有)被靶向之外,还需要知道其应当靶向的确切位置。后一个问题在很大程度上仍不清楚。
我们使用lucid的数据表明,神经炎症不仅发生在大脑中,还遍及整个脊髓(图14)。在此,发明人在cx3cr1-gfp小鼠中诱导了如上所述的闭头tbi(图13),其中巨噬细胞/小胶质细胞和一些单核细胞用gfp标记。在进行了tbi4个月后,将这些动物进行lucid,使用抗gfp纳米抗体标记以增强gfp信号。需要注意,沿着下行运动轴突的免疫细胞的激活是明显的,表现为信号强度和退化运动轨迹上的细胞数量的增加(图13)。还值得一提的是,可以使用针对免疫细胞的内源性蛋白质的纳米抗体对免疫细胞进行标记。这一观察结果表明,tbi诱发了广泛的慢性炎症反应,这种反应似乎不仅围绕着受伤的大脑区域,还围绕着脊髓,甚至可能是周围器官。研究表明,浸润性血液免疫细胞会加剧疾病的发展(wilsonetal.,2010)。我们的数据显示,即使在损伤数月之后(erturketal.,2016),在受伤的小鼠大脑中仍长期存在有淋巴细胞。经过这么长时间后,它们是如何进入大脑(或在大脑中生存)的仍然是个谜。
实例7:本发明的方法可用于研究完全透明小鼠的脑膜淋巴管。
连接体内各种淋巴器官的淋巴系统对免疫反应至关重要(janewayetal.,1997)。其使淋巴细胞和其他白细胞在全身循环。直到最近,大脑还被认为是全无任何淋巴连接的(ransohoffandengelhardt,2012)。最近,发现了覆盖小鼠颅骨和大脑之间硬脑膜窦的脑膜淋巴管(louveauetal.,2015)。这些脑膜血管携带有免疫细胞(louveauetal.,2015),有潜能可以入侵大脑。然而,大脑的这些脑膜淋巴管在病例学对tbi(或其他疾病)的影响尚不清楚。由于脑淋巴管直接位于颅骨和大脑之间,当采集大脑进行标准组织学研究时,它们会被破坏。因此,其只能在完整的大脑中研究,例如使用lucid技术。使用各种标记方法,发明人证明了lucid允许对整个小鼠头部的脑膜淋巴管成像(图14)。人们可以通过以下方式标记脑膜淋巴管:1)示踪剂,例如将卵清蛋白-alexa647注射入小脑延髓池或鼻内(然后排入淋巴管,导致淋巴管的特异性标记)(图14a),2)使用转基因报告小鼠,例如vegfr3-yfp小鼠(calvoetal.,2011)(图14b-e),以及3)使用特异性标记,例如lyve-1(louveauetal.,2015),对整个小鼠头部进行抗体标记。随后,可以对整个小鼠头部中的目标细胞/分子进行成像。例如,发明人成功地对cx3cr1-egfp小鼠(图14f)和cx3cr1-egfp×ccr2-rfp(图14g)双转基因小鼠中的免疫细胞群进行了成像。
实例8:使用小鼠血液和脾脏筛选用于脱色的氨基醇
为了确定脱色的附加溶液,首先研究氨基醇是否能直接脱色血液。将11种不同的氨基醇与pfa固定小鼠血液混合并离心。无色颗粒表明红色血红素已脱色(图16,平台(a))。因此,进一步测试了8种小鼠脾脏的脱色效果。如图16,平台(b)所示,小鼠脾脏全部脱色。分别在0小时和24h用指定的氨基醇孵育后显示的图像。图中所示的氨基醇如下:1.四乙酸,2.n-丁基二乙醇胺,3.n-甲基二乙醇胺,4.n,n-二甲基氯烯亚胺,5.1,3-二(二甲基胺基)-2-丙醇,6.2-吗啉乙醇,7.叔丁基二乙醇胺,8.n-乙基二乙醇胺,9.n,n-二异丙基乙醇胺,10.n-甲基吗啉-n-氧化物和11.2-n-二丁氨基乙醇。
实例9:猪脑的透明化和大型人脑样本的透明化和标记
本发明的方法也适用于包括猪和人在内的大型动物的整个器官。
特别地,根据本发明的方法用于猪脑的脱色和透明化。图17(a)显示解剖的新鲜猪脑,图17(b)显示用n,n-二异丙基乙醇胺孵育24小时后脱色的猪脑。最后,图17(c)显示了透明化后猪脑的透明度。这些结果表明,本发明方法的脱色和透明化步骤可以应用于包括猪在内的大型动物。
接下来,根据本发明的方法也被用于大型人脑样本的透明化和标记。特别是,图18(a)显示了透明化后的大小为3厘米×3厘米×1厘米的人脑的透明度。图18(b)显示了荧光共焦图像,显示了透明化的人脑中的斑块和细胞。这些结果表明,根据本发明的方法的透明化和标记可以应用于大型人脑样品,并且这些透明化和标记的样品可以通过荧光显微镜进行分析。发明人还通过实验发现,整个人脑可以被脱色和透明化。此外,预期荧光成像可以应用于根据本发明制备的整个人脑的成像。
工业适用性
本发明的方法和产品在工业上是可应用的,并且可以用于例如测试生物制药药物,例如治疗性抗体。
参考文献
battke,c.,kremmer,e.,mysliwietz,j.,gondi,g.,dumitru,c.,brandau,s.,lang,s.,vullo,d.,supuran,c.,andzeidler,r.(2011).generationandcharacterizationofthefirstinhibitoryantibodytargetingtumour-associatedcarbonicanhydrasexii.cancerimmunolimmunother60,649-658.
belle,m.,godefroy,d.,couly,g.,malone,s.a.,collier,f.,giacobini,p.,andchedotal,a.(2017).tridimensionalvisualizationandanalysisofearlyhumandevelopment.cell169,161-173e112.
belle,m.,godefroy,d.,dominici,c.,heitz-marchaland,c.,zelina,p.,hellal,f.,bradke,f.,andchedotal,a.(2014).asimplemethodfor3danalysisofimmunolabeledaxonaltractsinatransparentnervoussystem.cellrep9,1191-1201.
butler,j.m.,kobayashi,h.,andrafii,s.(2010).instructiveroleofthevascularnicheinpromotingtumourgrowthandtissuerepairbyangiocrinefactors.natrevcancer10,138-146.
calvo,c.f.,fontaine,r.h.,soueid,j.,tammela,t.,makinen,t.,alfaro-cervello,c.,bonnaud,f.,miguez,a.,benhaim,l.,xu,y.,etal.(2011).vascularendothelialgrowthfactorreceptor3directlyregulatesmurineneurogenesis.genesdev25,831-844.
chung,k.,wallace,j.,kim,s.y.,kalyanasundaram,s.,andalman,a.s.,davidson,t.j.,mirzabekov,j.j.,zalocusky,k.a.,mattis,j.,denisin,a.k.,etal.(2013).structuralandmolecularinterrogationofintactbiologicalsystems.nature497,332-337.
condeelis,j.,andweissleder,r.(2010).invivoimagingincancer.coldspringharbperspectbiol2,a003848.dejong,m.,essers,j.,andvanweerden,w.m.(2014).imagingpreclinicaltumourmodels:improvingtranslationalpower.natrevcancer14,481-493.
erturk,a.,mentz,s.,stout,e.e.,hedehus,m.,dominguez,s.l.,neumaier,l.,krammer,f.,llovera,g.,srinivasan,k.,hansen,d.v.,etal.(2016).interferingwiththechronicimmuneresponserescueschronicdegenerationaftertraumaticbraininjury.jneurosci36,9962-9975.
erturk,a.,becker,k.,jahrling,n.,mauch,c.p.,hojer,c.d.,egen,j.g.,hellal,f.,bradke,f.,sheng,m.,anddodt,h.u.(2012).three-dimensionalimagingofsolvent-clearedorgansusing3disco.natprotoc7,1983-1995.erturk,a.,mauch,c.p.,hellal,f.,forstner,f.,keck,t.,becker,k.,jahrling,n.,steffens,h.,richter,m.,hubener,m.,etal.(2011).three-dimensionalimagingoftheunsectionedadultspinalcordtoassessaxonregenerationandglialresponsesafterinjury.natmed18,166-171.
gabanyi,i.,muller,p.a.,feighery,l.,oliveira,t.y.,costa-pinto,f.a.,andmucida,d.(2016).neuro-immuneinteractionsdrivetissueprogramminginintestinalmacrophages.cell164,378-391.
gage,g.j.,kipke,d.r.,andshain,w.(2012).wholeanimalperfusionfixationforrodents.jvisexp.
ghanavati,s.,yu,l.x.,lerch,j.p.,andsled,j.g.(2014).aperfusionprocedureforimagingofthemousecerebralvasculaturebyx-raymicro-ct.jneuroscimethods221,70-77.
gondi,g.,mysliwietz,j.,hulikova,a.,jen,j.p.,swietach,p.,kremmer,e.,andzeidler,r.(2013).antitumorefficacyofamonoclonalantibodythatinhibitstheactivityofcancer-associatedcarbonicanhydrasexii.cancerres73,6494-6503.
hama,h.,hioki,h.,namiki,k.,hoshida,t.,kurokawa,h.,ishidate,f.,kaneko,t.,akagi,t.,saito,t.,saido,t.,etal.(2015).scales:anopticalclearingpaletteforbiologicalimaging.natneurosci18,1518-1529.
hama,h.,kurokawa,h.,kawano,h.,ando,r.,shimogori,t.,noda,h.,fukami,k.,sakaue-sawano,a.,andmiyawaki,a.(2011).scale:achemicalapproachforfluorescenceimagingandreconstructionoftransparentmousebrain.natneurosci14,1481-1488.
holliger,p.,andhudson,p.j.(2005).engineeredantibodyfragmentsandtheriseofsingledomains.natbiotechnol23,1126-1136.
hong,g.,antaris,a.l.,anddai,h.(2017).near-infraredfluorophoresforbiomedicalimaging.naturebiomedicalengineering1,0010.
iorns,e.,drews-elger,k.,ward,t.m.,dean,s.,clarke,j.,berry,d.,elashry,d.,andlippman,m.(2012).anewmousemodelforthestudyofhumanbreastcancermetastasis.plosone7,e47995.
janeway,c.a.,travers,p.,walport,m.,andshlomchik,m.j.(1997).immunobiology:theimmunesysteminhealthanddisease,vol1(currentbiology).
ke,m.t.,fujimoto,s.,andimai,t.(2013).seedb:asimpleandmorphology-preservingopticalclearingagentforneuronalcircuitreconstruction.natneurosci16,1154-1161.
lambert,a.w.,pattabiraman,d.r.,andweinberg,r.a.(2017).emergingbiologicalprinciplesofmetastasis.cell168,670-691.
louveau,a.,smirnov,i.,keyes,t.j.,eccles,j.d.,rouhani,s.j.,peske,j.d.,derecki,n.c.,castle,d.,mandell,j.w.,lee,k.s.,etal.(2015).structuralandfunctionalfeaturesofcentralnervoussystemlymphaticvessels.nature523,337-341.
massague,j.,andobenauf,a.c.(2016).metastaticcolonizationbycirculatingtumourcells.nature529,298-306.massoud,t.f.,andgambhir,s.s.(2003).molecularimaginginlivingsubjects:seeingfundamentalbiologicalprocessesinanewlight.genesdev17,545-580.
massoud,t.f.,andgambhir,s.s.(2007).integratingnoninvasivemolecularimagingintomolecularmedicine:anevolvingparadigm.trendsmolmed13,183-191.
murray,e.,cho,j.h.,goodwin,d.,ku,t.,swaney,j.,kim,s.y.,choi,h.,park,y.g.,park,j.y.,hubbert,a.,etal.(2015).simple,scalableproteomicimagingforhigh-dimensionalprofilingofintactsystems.cell163,1500-1514.muyldermans,s.(2013).nanobodies:naturalsingle-domainantibodies.annurevbiochem82,775-797.ntziachristos,v.(2010).goingdeeperthanmicroscopy:theopticalimagingfrontierinbiology.natmethods7,603-614.
pan,c.,cai,r.,quacquarelli,f.p.,ghasemigharagoz,a.,lourbopoulos,a.,matryba,p.,plesnila,n.,dichgans,m.,hellal,f.,anderturk,a.(2016).shrinkage-mediatedimagingofentireorgansandorganismsusingudisco.natmethods.
pandey,m.,andmahadevan,d.(2014).monoclonalantibodiesastherapeuticsinhumanmalignancies.futureoncol10,609-636.
pichler,b.j.,wehrl,h.f.,andjudenhofer,m.s.(2008).latestadvancesinmolecularimaginginstrumentation.jnuclmed49suppl2,5s-23s.
ransohoff,r.m.,andengelhardt,b.(2012).theanatomicalandcellularbasisofimmunesurveillanceinthecentralnervoussystem.natrevimmunol12,623-635.
renier,n.,adams,e.l.,kirst,c.,wu,z.,azevedo,r.,kohl,j.,autry,a.e.,kadiri,l.,umadevivenkataraju,k.,zhou,y.,etal.(2016).mappingofbrainactivitybyautomatedvolumeanalysisofimmediateearlygenes.cell165,1789-1802.
renier,n.,wu,z.,simon,d.j.,yang,j.,ariel,p.,andtessier-lavigne,m.(2014).idisco:asimple,rapidmethodtoimmunolabellargetissuesamplesforvolumeimaging.cell159,896-910.
susaki,e.a.,tainaka,k.,perrin,d.,kishino,f.,tawara,t.,watanabe,t.m.,yokoyama,c.,onoe,h.,eguchi,m.,yamaguchi,s.,etal.(2014).whole-brainimagingwithsingle-cellresolutionusingchemicalcocktailsandcomputationalanalysis.cell157,726-739.
tainaka,k.,kubota,s.i.,suyama,t.q.,susaki,e.a.,perrin,d.,ukai-tadenuma,m.,ukai,h.,andueda,h.r.(2014).whole-bodyimagingwithsingle-cellresolutionbytissuedecolorization.cell159,911-924.
timpson,p.,mcghee,e.j.,andanderson,k.i.(2011).imagingmoleculardynamicsinvivo--fromcellbiologytoanimalmodels.jcellsci124,2877-2890.
tuchin,v.v.(2016).editor’sintroduction:opticalmethodsforbiomedicaldiagnosis.
tuchin,v.v.,andtuchin,v.(2007).tissueoptics:lightscatteringmethodsandinstrumentsformedicaldiagnosis,vol642(spiepressbellingham).
vick,b.,rothenberg,m.,sandhofer,n.,carlet,m.,finkenzeller,c.,krupka,c.,grunert,m.,trumpp,a.,corbacioglu,s.,ebinger,m.,etal.(2015).anadvancedpreclinicalmousemodelforacutemyeloidleukemiausingpatients'cellsofvariousgeneticsubgroupsandinvivobioluminescenceimaging.plosone10,e0120925.welti,j.,loges,s.,dimmeler,s.,andcarmeliet,p.(2013).recentmoleculardiscoveriesinangiogenesisandantiangiogenictherapiesincancer.jclininvest123,3190-3200.
wilson,e.h.,weninger,w.,andhunter,c.a.(2010).traffickingofimmunecellsinthecentralnervoussystem.jclininvest120,1368-1379.
yang,b.,treweek,j.b.,kulkarni,r.p.,deverman,b.e.,chen,c.k.,lubeck,e.,shah,s.,cai,l.,andgradinaru,v.(2014).single-cellphenotypingwithintransparentintacttissuethroughwhole-bodyclearing.cell158,945-958.ye,l.,allen,w.e.,thompson,k.r.,tian,q.,hsueh,b.,ramakrishnan,c.,wang,a.c.,jennings,j.h.,adhikari,a.,halpern,c.h.,etal.(2016).wiringandmolecularfeaturesofprefrontalensemblesrepresentingdistinctexperiences.cell165,1776-1788.
yoneda,t.,williams,p.j.,hiraga,t.,niewolna,m.&nishimura,r.abone-seekingcloneexhibitsdifferentbiologicalpropertiesfromthemda-mb-231parentalhumanbreastcancercellsandabrain-seekingcloneinvivoandinvitro.jboneminerres16,1486-1495,doi:10.1359/jbmr.2001.16.8.1486(2001).
zipfel,w.r.,williams,r.m.,christie,r.,nikitin,a.y.,hyman,b.t.,andwebb,w.w.(2003).livetissueintrinsicemissionmicroscopyusingmultiphoton-excitednativefluorescenceandsecondharmonicgeneration.procnatlacadsciusa100,7075-7080.
- 还没有人留言评论。精彩留言会获得点赞!