检测和表征癌症的生物标志物的制作方法
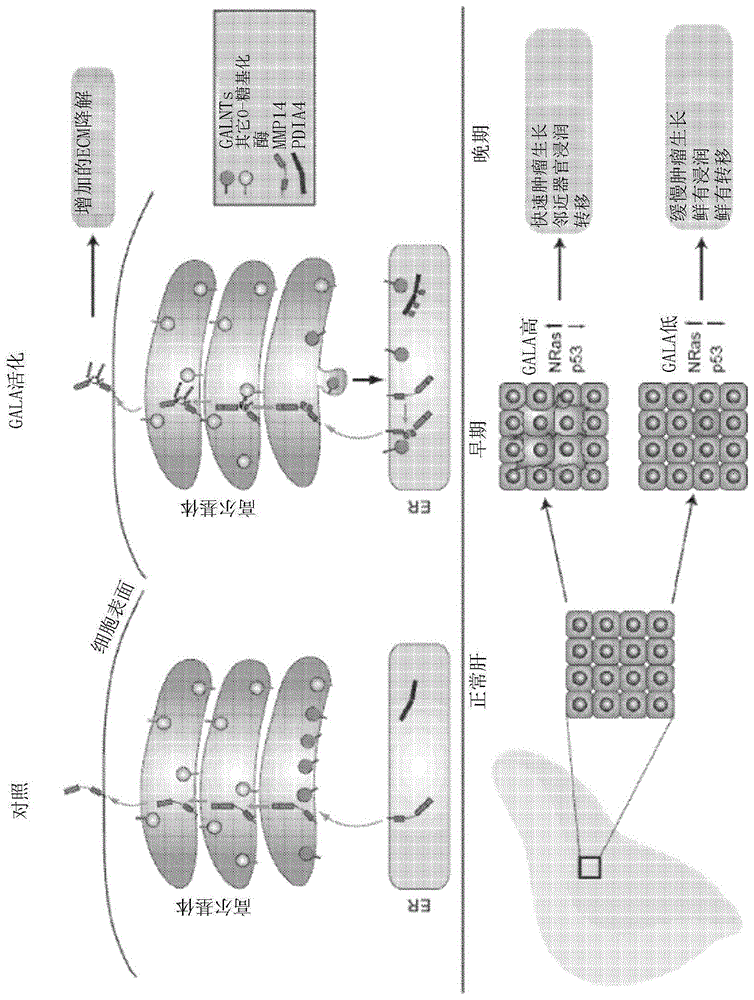
相关申请的交叉引用本申请要求2017年10月4日提交的第10201708183v号新加坡临时申请的优先权的益处,该临时申请的内容通过引用以其整体并入本文中,用于所有目的。本发明总体上涉及分子生物学领域。特别地,本发明涉及用于检测和表征癌症的生物标志物的用途。
背景技术:
:浸润性肿瘤表型驱使肿瘤更快地生长,并且通常与转移的形成和不良预后相关联。对于大多数癌症患者而言,转移最终会引起死亡。癌症早期的检测是困难的,因为现有的方法缺乏灵敏度并且缺乏可用于这种检测的靶标。大多数癌症只能在后期,有时甚至在疾病无法治愈或症状无法治疗的时候才能被检测到。因此,对于允许癌症早期检测和表征的方法的需求未得到满足。技术实现要素:在一个方面中,本发明涉及一种检测癌症存在或不存在的方法,其中该方法包括以下步骤:(i)从受试者获得样品;(ii)检测得自步骤(ii)中的样品中的一种或多种内质网(er)驻留蛋白的o-糖基化水平;(iii)将步骤(ii)中的一种或多种内质网(er)驻留蛋白的o-糖基化水平与对照组中的一种或多种内质网(er)驻留蛋白的o-糖基化水平进行比较;其中,该样品中存在的一种或多种内质网(er)驻留蛋白的o-糖基化水平与该对照组相比增加,表明存在癌症。在另一个方面中,本发明涉及一种确定受试者罹患癌症的风险的方法,其中该方法包括以下步骤:(i)从受试者获得样品;(ii)检测该样品中的一种或多种内质网(er)驻留蛋白的o-糖基化水平;(iii)将步骤(ii)中的一种或多种内质网(er)驻留蛋白的o-糖基化水平与对照组中的一种或多种内质网(er)驻留蛋白的o-糖基化水平进行比较;其中,该样品中存在的一种或多种内质网(er)驻留蛋白的o-糖基化水平与该对照组相比增加到至少4倍,表明该受试者患有癌症。在又一个方面中,本发明涉及一种确定癌症的恶性度(malignancy)、等级或分期的方法,该方法包括以下步骤:(i)从受试者获得样品;(ii)检测该样品中的一种或多种内质网(er)驻留蛋白的o-糖基化水平;(iii)将步骤(ii)中的一种或多种内质网(er)驻留蛋白的o-糖基化水平与针对每一癌症等级定义的组中的一种或多种内质网(er)驻留蛋白的o-糖基化水平进行比较。在再一个方面中,本发明涉及一种试剂盒,该试剂盒包括能够与一种或多种o-糖基化内质网(er)驻留蛋白结合的单糖结合蛋白;能够与该单糖结合蛋白和/或该一种或多种o-糖基化内质网(er)驻留蛋白结合的检测剂;以及一种或多种标准品,其中每种标准品均包括本文所公开的该o-糖基化内质网(er)驻留蛋白中的任何一种。附图说明当结合非限制性实例和附图考虑时,通过参考具体实施方式,本发明将被更好地理解,在所述附图中:图1是示出n-乙酰基半乳糖胺(galnac)-t活化途径(gala)活化的示意图。在gala活化过程中,多肽n-乙酰氨基半乳糖转移酶(galnt)从高尔基体(golgi)重新定位到内质网(er),进而使er中蛋白质的o-糖基化增加,所述蛋白质包括基质金属蛋白酶-14(mmp14)和蛋白质二硫键异构酶a4(proteindisulfideisomerasefamilyamember4,pdia4)。o-糖基化基质金属蛋白酶-14(mmp14)致使细胞外基质(ecm)降解增加。早期癌症期间具有高gala活化的细胞会导致肿瘤快速生长,在晚期癌症期间会导致邻近器官浸润和转移。相反,早期癌症期间具有低gala活化的细胞会导致肿瘤缓慢生长,在晚期癌症期间会很少会导致浸润和转移。图2提供的数据显示,恶性肝肿瘤显示高tn染色和er驻留蛋白pdia4的糖基化。(a)是垂直散点图,其示出利用长柔毛野豌豆(viciavillosa)凝集素(vvl)抗体染色水平的强度对人肝肿瘤进展过程的tn抗原的定量。分析了人肝活组织检查的组织微阵列(tma)lv8011和bc03002,其包括正常、良性、恶性(不同等级)和转移性肝肿瘤。水平线表示每组的平均值。(b)示出四个图像,这些图像是组织微阵列(tma)bc03002中被长柔毛野豌豆凝集素(vvl)抗体染色的代表性核心的特写图。比例尺,100μm。(c)示出两个图像,这两个图像是利用盖罩大蜗牛(helixpomatia)凝集素(hpl)抗体对鼠肝细胞癌(hcc)染色的tn的免疫组织荧光分析。比例尺,100μm。星号标记的是红细胞的背景染色。(d)示出六个图像,这些图像示出鼠肝细胞癌(hcc)和正常组织中长柔毛野豌豆凝集素(vvl)和er标志物钙联结蛋白的共染色。比例尺,10μm。细胞核用hoechst染色。(e)是蛋白质印迹(westernblot)的图像,其示出对两个正常小鼠肝脏和处于早期(注射后6周;6wpi)的三个注射nras-g12v/shp53的小鼠肿瘤样品以及处于晚期(注射后24周;24wpi)的四个肿瘤样品中tn修饰的er-驻留pdia4水平的免疫印迹分析。细胞裂解物用长柔毛野豌豆凝集素(vvl)进行免疫沉淀,并探测pdia4。数字表示来自不同小鼠的肝样品。(f)是两个蛋白质印迹的图像,代表2小时、4小时和6小时内,被生长因子表皮生长因子(egf)和血小板源生长因子(pdgf)刺激的hek细胞中tn修饰的er驻留pdia4的水平的免疫印迹分析。(g)是蛋白质印迹的图像,其示出来自20个随机肝细胞癌(hcc)患者的20对人肝细胞癌(hcc)肿瘤(t)中相对于与患者匹配的正常肝组织(nt)中tn修饰的pdia4的水平的免疫印迹分析。(h)是散点图,其示出图1g中所示的蛋白质印迹中的人肝细胞癌(hcc)肿瘤中通过总pdia4归一化的tn修饰的pdia4的水平的定量。给出了相对于对应的正常肝脏的倍数变化。(i)示出热图,其示出与肝肿瘤发展相关的19个多肽n-乙酰氨基半乳糖转移酶(galnt)族成员的定量逆转录聚合酶链反应(qrt-pcr)评估结果。以热图表示的聚类分析示出22例患者的肝肿瘤与相邻非癌组织之间的表达差异。图3中示出的数据显示,er靶向多肽n-乙酰氨基半乳糖转移酶1(galnt1)的表达驱使肿瘤快速发展。(a)是与在pgk启动子控制下的以下三种质粒一起使用的“睡美人”(sleepingbeauty,sb)转座子系统的示意图:一种质粒编码“睡美人”(sb)转座酶,第二种质粒携带mcherry-nras,而第三种质粒表达shp53以及与egfp融合的目的基因(goi)。反向重复(ir)序列位于最后两种质粒的侧翼,允许基因组插入。(b)是线形图,表示在注射(a)编码gfp或者gfp-标记形式的野生型galnt1(高尔基体-g1)、er-定位的galnt1(er-g1)或er-g1催化失活(er-g1δcat)的质粒后小鼠的卡普兰-迈耶存活曲线(kaplan–meiersurvivalcurve)。统计显著性用相对于gfp的对数秩计算。(c)是柱状图,代表注射后6周(wpi)时每只小鼠的平均总结节数和大小,每组n=9。误差条表示标准偏差(sd)。*p<0.005(t检验)。(d)示出的图像显示gfp、高尔基体-g1和er-g1组中的肝脏在注射后6周(wpi)时的组织病理学和免疫组织化学(ihc)分析。gfp、高尔基体-g1和er-g1组的总肝脏(grossliver)的代表性图像在左图上。黑色箭头表示肿瘤结节(左图,每组n=4;比例尺,1cm)。gfp、高尔基体-g1和er-g1组中的肝脏在注射后6周(wpi)时的长柔毛野豌豆凝集素(vvl)、gfp和mcherry(右图;比例尺,100μm)的组织病理学苏木精和伊红(h&e)染色以及免疫组织化学(ihc)分析的代表性图像。h:肝增生,ha:肝细胞腺瘤,hcc:肝细胞癌。肝脏病变用虚线绘出。图4提供的数据显示er-g1如何在早期促进肿瘤生长。(a)示出注射后3天(dpi)的nras-g12v/shp53-egfp小鼠的肝脏切片的免疫组织化学(ihc)染色的图像,n=3。比例尺,100μm。(b)示出注射后3天(dpi)的nras-g12v/shp53-egfp-高尔基体-g1小鼠的肝脏切片的免疫组织化学(ihc)染色的图像,n=3。比例尺,100μm。(c)示出注射后3天(dpi)的nras-g12v/shp53-egfp-er-g1小鼠的肝脏切片的免疫组织化学(ihc)染色的图像,n=3。比例尺,100μm。(d)是柱状图,示出每个肝脏切片上每视野(10x)阳性细胞的定量分析结果,每组三只小鼠:表达mcherry和gfp的细胞。学生t检验是相对于gfp计算的,误差条表示标准偏差(sd)。ns:不显著。(e)是柱状图,示出具有表达长柔毛野豌豆凝集素(vvl)的细胞的三只小鼠的每个肝脏切片上每视野(10x)阳性细胞的定量分析结果。学生t检验是相对于gfp计算的,误差条表示标准偏差(sd)。(f)示出在注射后7天(dpi)对小鼠肝脏中表达nras-g12v/shp53-egfp-、高尔基体-g1-或er-g1的细胞进行mcherry免疫组织化学(ihc)染色的图像。比例尺,100μm。(g)是垂直箱线图,示出在注射后3天(dpi),来自三个不同小鼠肝脏的表达mcherry的细胞的面积的定量,每组n=9。所显示的p值是相对于对照gfp注射小鼠的(t检验)。线表示每组的平均值。(h)是垂直箱线图,表示在注射后7天(dpi),来自三个不同小鼠肝脏的表达mcherry的细胞的面积的定量,每组n=9。所显示的p值是相对于对照gfp注射小鼠的(t检验)。线表示每组的平均值。(i)是表示hepg2gfp、高尔基体-g1和er-g1细胞系相对于时间的生长速率的图。孔中的汇合百分比每6小时采集一次。学生t检验是相对于hepg2gfp细胞计算的,并且误差条表示三个重复的平均值的标准误差(sem)。ns:不显著。图5提供的数据表明er-g1促进肝肿瘤浸润。(a)是表格,示出死亡时已经显示转移到肺、脾、胰腺、肌肉、肾和胃中的gfp、wt-g1和er-g1组小鼠的数量和百分比。(b)示出使用苏木精和伊红(h&e)、抗长柔毛野豌豆凝集素(vvl)和抗gfp染色的er-g1小鼠肺组织中转移的代表性图像。比例尺,100μm。(c)示出使用苏木精和伊红(h&e)、抗长柔毛野豌豆凝集素(vvl)和抗gfp染色的侵入胰腺(p)的肝肿瘤(t)的代表性图像,右侧为放大图像。浸润性肿瘤结节(t)由虚线绘出。比例尺,100μm。(d)是垂直散点图,示出死亡时gfp+循环肿瘤细胞(ctc)的百分比分析结果(每组n=4)。线表示每组的平均值。学生t检验是相对于所示的gfp小鼠计算的。(e)是线形图,示出小鼠肝脏组织中的体外福斯特共振能量转移基质金属蛋白酶(fret-mmp)底物裂解测定的结果的分析结果。数字表示来自每种状况的不同小鼠的肝样品。图中的值表示来自同一肝样品的三次重复测量的平均值±平均值的标准误差(sem),*p<0.05、**p<0.001且***p<0.0001,相对于正常肝样品(t检验)。(f)是垂直散点图,示出来自(e)的小鼠肝裂解物在140分钟时间点的基质金属蛋白酶(mmp)底物裂解活性的分析结果。线表示每组的平均值。*p<0.05,相对于正常肝脏的裂解物(t检验)。ns:不显著。(g)是线形图,表示基于福斯特共振能量转移基质金属蛋白酶(fret-mmp)底物肽的体外裂解,hepg2gfp、高尔基体-g1和er-g1细胞系的细胞裂解物中基质金属蛋白酶-14(mmp14)活性的定量。图中的值表示来自三次重复测量的平均值±平均值的标准误差(sem),*p<0.05、**p<0.001和***p<0.0001,相对于hepg2gfp细胞系(t检验)。(h)示出在明胶降解测定中,接种在荧光标记明胶片上的hepg2gfp(对照)、高尔基体-g1和er-g1细胞的代表性图像。比例尺,10μm。(i)是柱状图,表示明胶降解面积的定量,***p<0.0001,相对于er-g1(t-检验)。图中的值表示三个重复孔的平均值±平均值的标准误差(sem)。图6示出的数据表示,基质金属蛋白酶-14(mmp14)的o-糖基化是细胞ecm降解所需要的。(a)示出在hepg2er-g1细胞中用两种不同基质金属蛋白酶-14(mmp14)小干扰性核糖核酸(sirna)序列(sigenome[sig]和on-targetplus[ont])和非靶向(nt)小干扰性核糖核酸(sirna)进行小干扰性核糖核酸(sirna)敲低的明胶降解测定的代表性图像。比例尺,20μm。(b)是柱状图,示出在hepg2er-g1细胞中用两种不同基质金属蛋白酶-14(mmp14)小干扰性核糖核酸(sirna)序列(sigenome[sig]和on-targetplus[ont])和非靶向(nt)小干扰性核糖核酸(sirna)进行小干扰性核糖核酸(sirna)敲低的明胶降解测定的定量。值表示两次重复的平均值±标准偏差(sd),*p<0.05,相对于hepg2gfp细胞(t检验)。(c)示出在胶原/明胶层降解测定中接种在荧光标记胶原/明胶基质层上的、表达基质金属蛋白酶-14(mmp14)野生型的hepg2gfp和er-g1细胞的代表性图像。比例尺,10μm。(d)是柱状图,示出表达基质金属蛋白酶-14(mmp14)野生型的hepg2gfp和er-g1细胞的胶原/明胶层降解测定的定量测量结果。值表示来自三个重复的平均值±平均值的标准误差(sem)。***p<0.0001,相对于gfp(t检验)。(e)是基质金属蛋白酶-14(mmp14)上o-糖基化位点的示意图。n-乙酰半乳糖胺(galnac)糖残基由深灰色框指示。(f)是蛋白质印迹图像,示出来自注射nras-g12v/shp53/erg1的多只小鼠肝样品和正常肝样品以及来自注射nras-g12v/shp53-egfp的两只不同小鼠的样品的长柔毛野豌豆凝集素(vvl)免疫沉淀(ip)的基质金属蛋白酶-14(mmp14)水平的免疫印迹分析。还分析了细胞裂解物的长柔毛野豌豆凝集素(vvl)、基质金属蛋白酶-14(mmp14)和肌动蛋白水平,其中肌动蛋白用作上样对照。(g)是蛋白质印迹图像,表示注射nras-g12v/shp53的多个小鼠肿瘤样品在早期(注射后6周(wpi))和晚期(注射后24周(wpi))的基质金属蛋白酶-14(mmp14)与正常小鼠肝脏相比的tn修饰水平。这里所使用的样品与图2e中使用的样品相同。数字表示来自不同小鼠的肝样品。肌动蛋白被用作上样对照。(h)是蛋白质印迹图像,表示在表达高尔基体-g1和er-g1的hepg2cosmc-/-细胞系中转染的野生型(wt)mmp14-mcherry和各种基质金属蛋白酶-14(mmp14)突变体的tn修饰水平的免疫印迹分析。mmp14-t(4)a是指带有四个丙氨酸取代t299a-t300a-s301a-s304a的基质金属蛋白酶-14(mmp14)的突变形式。mmp14-t(5)a是指带有五个丙氨酸取代t291a-t299a-t300a-s301a-s304a的基质金属蛋白酶-14(mmp14)的突变体形式。细胞裂解物使用红色荧光蛋白(rfp)珠进行免疫沉淀以分离mmp14-mcherry;tn修饰(活性和裂解原蛋白)通过长柔毛野豌豆凝集素(vvl)染色进行观测。(i)是蛋白质印迹图像,表示表达gfp对照、高尔基体-g1或er-g1的hepg2细胞中mmp14-v5上扩展的o-聚糖水平的免疫印迹分析。细胞裂解物使用花生凝集素(pna)或曼陀罗(daturastramonium)凝集素(dsl)进行免疫沉淀,并用v5标记抗体探测基质金属蛋白酶-14(mmp14)。(j)示出在胶原/明胶层降解测定中接种在荧光标记胶原/明胶基质层上的、表达基质金属蛋白酶-14(mmp14)野生型(mmp-wt)和各种基质金属蛋白酶-14(mmp14)突变体mmp14-t291a、mmp14-t(4)a、mmp14-t(5)a和mmp14-e240a的hepg2er-g1细胞的代表性图像。比例尺,10μm。(k)是柱状图,表示通过表达各种基质金属蛋白酶-14(mmp14)突变体的hepg2er-g1细胞进行的明胶降解的面积的定量。图中的值表示来自三个重复的平均值±平均值的标准误差(sem),***p<0.05,相对于表达基质金属蛋白酶-14(mmp14)wt的hepg2er-g1细胞(t检验)。ns:不显著。图7示出的数据表明,基质金属蛋白酶-14(mmp14)糖基化是肝癌生长和转移所需要的。(a)是线形图,表示注射含有和不含有shmmp14的nras-g12v/shp53-er-g1的小鼠的卡普兰-迈耶存活曲线,shmmp14是一种针对基质金属蛋白酶-14(mmp14)的短发夹状核糖核酸(shrna)。统计显著性用相对于gfp对照的对数秩计算。(b)是垂直散点图,表示对来自(a)的小鼠血流中的gfp+循环肿瘤细胞(ctc)的百分比的分析(每组n=3)。水平线表示每组的平均值。计算了相对于对照小鼠以及共表达shmmp14的er-g1小鼠的学生t检验。(c)是表格,示出已经显示出浸润和转移到肺、脾、胰腺、皮肤、肾、胃中的、注射(含有和不含有shmmp14的)nras-g12v/shp53-er-g1的小鼠的百分比和数目。(d)示出注射各种睡美人(sb)构建体的小鼠肝脏中基质金属蛋白酶-14(mmp14)和mcherry在注射后7天(dpi)的代表性免疫组织化学(ihc)染色图像。基质金属蛋白酶-14(mmp14)染色的放大图像显示在右图。比例尺,100μm。(e)是垂直散点图,示出在注射后7天(dpi),(d)中所示的各种已注射小鼠肝脏中表达mcherry的细胞所占的面积的定量。水平线表示每组的平均值。计算了相对于er-g1以及共表达基质金属蛋白酶-14(mmp14)的er-g1肝脏的学生t检验。图8示出的数据显示在人和小鼠肝细胞癌(hcc)这两者中高的tn表达。(a)示出覆盖肝脏疾病谱的人组织微阵列bc03002和lv8011的长柔毛野豌豆凝集素(vvl)染色的代表性免疫组织化学(ihc)图像。n:正常;in:炎症或肝炎;h:增生;hca:肝细胞腺瘤;hcc:肝细胞癌,其中数字1、2、3代表不同肿瘤等级;c:肝内胆管癌。(b)是柱状图,表示归一化至正常肝脏后,良性肝细胞腺瘤(hca)和恶性肝细胞癌(hcc)之间的长柔毛野豌豆凝集素(vvl)强度的定量,每组n=4只小鼠。(c)示出正常、肝细胞腺瘤(hca)和肝细胞癌(hcc)2-3级组织的代表性tn染色图像,其中肝细胞癌(hcc)2-3级组织与正常肝脏和肝细胞腺瘤(hca)相比呈现密集的tn染色。组织切片的放大图像显示在每个图像的左上角。比例尺,1mm。(d)示出(a)中所示正常肝脏和肝细胞癌(hcc)2级组织的核心的代表性特写图像,比例尺:50μm。(e)是热图,示出使用12个nras/shp53-sb小鼠肝样品,包括非癌性肝、肝细胞腺瘤(hca)和肝细胞癌(hcc),多肽n-乙酰氨基半乳糖转移酶(galnt)族成员的19个基因的表达式样。(f)是维恩图,示出对人和小鼠这两者中的肝细胞癌(hcc)具备特异性的上调和下调基因,其中与正常组织相比,在人和小鼠肝肿瘤中识别出的显著差异表达基因的倍数变化≥1.5,并且p≤0.05。(g)是示出小鼠中肝细胞腺瘤(hca)和肝细胞癌(hcc)中的上调和下调基因的维恩图。(h)是蛋白质印迹图像,示出来自20个随机肝细胞癌(hcc)患者的20对人肝细胞癌(hcc)肿瘤(t)相对于与患者匹配的正常肝组织(nt)中vvl和tn修饰pdia水平的免疫印迹分析。该20对患者样品用编号f009、f012、f016、f017、f019、f022、f025、f026、f028、f031、f034、f037、f038、f039、f040、f042、f046、f049、f052、f074和f036表示。肌动蛋白被用作上样对照。图9示出对小鼠肝脏样品中外源galnt1表达的评估以及nras和er-g1作为肝肿瘤发生驱动因素的比较。(a)是垂直散点图,示出通过在gfp、高尔基体-g1和er-g1小鼠中使用一组引物(seqidno.1和2)进行定量rt-pcr测定的外源galnt1的相对转录水平。针对内部管家基因(β-肌动蛋白)计算log2倍数变化。(b)示出的图像显示,正常小鼠肝脏以及注射各转座子构建体nras-g12v/shp53-gfp、-高尔基体-g1和erg1后3天的肝脏中,gfp和galnt1-gfp水平的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分析。肌动蛋白被用作上样对照。(c)的示意图示出,imagej上用于对注射后一周小鼠的肝脏中睡美人(sb)转座子转化的细胞的面积进行定量的工作流程。(d)示出的图像是注射后1周(wpi)的睡美人(sb)转座子转化的gfp、高尔基体-g1和er-g1组的肝脏中的细胞的代表性图像。右图示出使用(c)中的工作流程,睡美人(sb)转座子转化的gfp、高尔基体-g1和er-g1组中的遮蔽(masking)(浅灰色)。比例尺,100μm。(e)是线形图,表示注射有表达睡美人转座酶的质粒与nras/shp53或er-g1/shp53质粒的两组小鼠的对数秩存活曲线分析。(f)是表示每只小鼠死亡后平均结节>0.5cm3的肿瘤数目的柱状图。与死亡后显示约有1±3个大于0.5cm3的结节的表达er-g1/shp53的小鼠相比,表达nras/shp53的小鼠中未发现肝肿瘤。(g)示出收集自nras/shp53和er-g1/shp53组的肝脏在注射后40周(wpi)的免疫组织化学分析的代表性图像。左图示出nras/shp53肝脏相对于er-g1/shp53肝脏中使用长柔毛野豌豆凝集素(vvl)染色的tn水平的代表性图像,黑框体现三个右图中所示的不同染色的放大图像。来自er-g1/shp53的肝脏切片的放大图像示出苏木精和伊红(h&e)、长柔毛野豌豆凝集素(vvl)和egfp染色。来自nras/shp53的肝脏切片的放大图像示出苏木精和伊红(h&e)、长柔毛野豌豆凝集素(vvl)和mcherry染色。比例尺,100μm。图10提供的数据代表表达各种构建体的稳定hepg2细胞系的建立。(a)示出hepg2er-g1细胞系中er驻留蛋白钙联结蛋白和er-g1的代表性免疫荧光染色图像。比例尺,20μm。(b)示出hepg2-gfp、高尔基体-g1和er-g1细胞系的gfp和盖罩大蜗牛凝集素(hpl)染色的代表性图像。比例尺,30μm。(c)是表示hepg2-gfp、高尔基体-g1和er-g1细胞系的盖罩大蜗牛凝集素(hpl)染色的定量的柱状图。图上的值表示平均值±平均值的标准误差(sem)。**p<0.001并且***p<0.0001,相对于hepg2-gfp细胞。(d)的图像示出,hepg2-gfp、高尔基体-g1和er-g1细胞系中每个构建体的蛋白质表达水平的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分析。上方条带指示高尔基体-g1和er-g1构建体,而30kda的下方条带指示对照gfp蛋白。肌动蛋白水平被用作上样对照。图11示出er-g1如何增强肝肿瘤向各个器官中的浸润和转移的代表性图像。(a)示出侵入到针对苏木精和伊红(h&e)染色的隔膜中的er-g1肝肿瘤的连续切片的代表性图像,黑框体现放大的图像。放大图像示出苏木精和伊红(h&e)、长柔毛野豌豆凝集素(vvl)或egfp染色。(b)示出侵入到针对苏木精和伊红(h&e)染色的脾脏中的er-g1肝肿瘤的连续切片的代表性图像,黑框体现放大的图像。放大图像示出苏木精和伊红(h&e)、长柔毛野豌豆凝集素(vvl)或egfp染色。(c)示出表示附着并侵入肾脏的er-g1肿瘤的苏木精和伊红(h&e)染色,黑框体现放大的图像。放大图像示出苏木精和伊红(h&e)染色。白色箭头表示肾小囊。(d)示出苏木精和伊红(h&e)染色的er-g1肿瘤,黑框体现放大的图像。放大图像示出苏木精和伊红(h&e)染色并且白色箭头表示浆膜表面,其中er-g1肿瘤已通过浆膜表面侵入胃中。(e)中的上图示出苏木精和伊红(h&e)染色的浸润性er-g1肿瘤,黑框体现放大的图像。下图示出通过基底层侵入皮肤的er-g1肿瘤的放大图像。比例尺,100μm。图12呈现的数据显示,er-g1通过基质金属蛋白酶-14(mmp14)糖基化增强hepg2细胞中的基质降解。(a)的图像表示经过nt5、mmp14-sig和mmp14-ont处理的hepg2-gfp、高尔基体-g1和er-g1细胞中基质金属蛋白酶-14(mmp14)水平的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分析。mmp14-sig和mmp14-ont是基质金属蛋白酶-14(mmp14)小干扰性核糖核酸(sirna)。肌动蛋白水平被用作上样对照。(b)的图像表示mmp14-v5转染的细胞系hepg2-gfp、高尔基体-g1和er-g1在代谢掺入人造糖galnaz72小时后的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分析,其中galnaz是可以通过点击化学进行修饰、并在掺入到糖蛋白中时与flag肽缀合的具有n-乙酰半乳糖胺(galnac)的叠氮化物修饰类似物的o-聚糖。裂解物用flag抗体进行免疫沉淀以分离所有o-galnaz修饰的蛋白,并用v5抗体探测基质金属蛋白酶-14(mmp14)。flag、长柔毛野豌豆凝集素(vvl)、v5和肌动蛋白抗体被用于分析相同mmp14-v5转染细胞系hepg2-gfp、高尔基体-g1和er-g1的细胞裂解物中相应的o-galnaz修饰蛋白、o-糖基化蛋白、基质金属蛋白酶-14(mmp14)和肌动蛋白的水平。(c)是柱状图,示出使用来自(b)的flag抗体进行免疫沉淀方法,galnaz修饰的基质金属蛋白酶-14(mmp14)的水平。图中的值表示两个重复的平均值±标准偏差(sd),*p<0.05。(d)是高尔基体和er中o-聚糖结构的示意图,其中该o-聚糖结构被各种凝集素识别,所述凝集素例如曼陀罗凝集素(dsl)、花生凝集素(pna)和盖罩大蜗牛凝集素(hpl)。(e)的图像表示使用mmp14、长柔毛野豌豆凝集素(vvl)和肌动蛋白抗体,hepg2-gfp、-高尔基体-g1和-er-g1细胞系中内源性基质金属蛋白酶-14(mmp14)、tn和肌动蛋白水平的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分析。该内源性基质金属蛋白酶-14(mmp14)由两个条带表示,其中上方条带表示基质金属蛋白酶-14(mmp14)原蛋白,下方条带表示活性基质金属蛋白酶-14(mmp14)。(f)是表示mmp14-v5构建体mmp14-wt、mmp14-t291a、mmp14-t(4)a、mmp14-t(5)a和mmp14-e240a的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分析的图像,其中所述构建体是瞬时转染hepg2-er-g1细胞。分别使用v5和肌动蛋白抗体来分析基质金属蛋白酶-14(mmp14)和肌动蛋白。(g)示出hepg2-gfp和-er-g1细胞中细胞表面基质金属蛋白酶-14(mmp14)和盖罩大蜗牛凝集素(hpl)的代表性免疫荧光染色图像。比例尺,10μm。(h)是柱状图,示出gfp、高尔基体-g1、er-g1、经nt5小干扰性核糖核酸(sirna)处理的er-g1、经mmp14-sig处理的er-g1,以及经mmp14-ont处理的er-g1的细胞表面基质金属蛋白酶-14(mmp14)水平的定量免疫荧光染色。图中的值表示来自三个重复的平均值±标准偏差(sd),*p<0.05并且**p<0.001。(i)示出hepg2gfp和er-g1细胞系中mmp14-mcherry、盖罩大蜗牛凝集素(hpl)和gfp染色的代表性图像。比例尺,10μm。图13呈现的数据显示,er-g1引起的基质金属蛋白酶-14(mmp14)的糖基化增加其底物裂解活性。(a)是线形图,示出表达gfp的hepg2细胞(浅灰色实线)以及具有野生型mmp14(黑色实线)和突变体mmp14-t291a(深灰色虚线)和–t(5)a(黑色虚线)的er-g1的裂解物中的体外福斯特共振能量转移基质金属蛋白酶(fret-mmp)底物裂解测定的数据。裂解缓冲液(深灰色实线)被用作对照。***p<0.0001,相对于与野生型mmp14共表达的erg1。(b)是蛋白质印迹图像,示出正常小鼠肝脏和注射n-ras/p53(n=3)、er-g1(n=2)以及具有shmmp14的er-g1(n=3)1周后的小鼠肝脏中,内源性基质金属蛋白酶-14(mmp14)的表达水平,shmmp14是针对基质金属蛋白酶-14(mmp14)的短发夹状核糖核酸(shrna)。肌动蛋白被用作上样对照。(c)示出在注射gfp+mmp14、er-g1+mmp14和er-g1+mmp14-t(5)a后1周时小鼠肝脏的基质金属蛋白酶-14(mmp14)的免疫组织化学(ihc)染色的代表性图像。比例尺,50μm。图14呈现的数据显示,小鼠肝癌模型中er驻留蛋白的糖基化。(a)是蛋白质印迹图像,示出在注射后6周(6wpi)和注射后24周(24wpi)正常肝脏样品和肿瘤样品中er驻留蛋白pdia4、pdia3、canx、hspa5、erlec1糖基化的免疫印迹分析。(b)是垂直散点图,示出相对于正常肝脏(1)的糖基化er驻留蛋白的水平的定量,如图(a)所示。注射后6周(6wpi)对应于早期肿瘤,而注射后24周(24wpi)对应于晚期肿瘤。(c)是示出er-galnt1可诱导细胞中vvl和canx的表达的蛋白质印迹图像。使用稳定表达强力霉素(dox)可诱导形式的er靶向galnt1的人肝hepg2细胞,其中未诱导细胞表示gala阴性细胞,并且强力霉素(dox)诱导的细胞表示gala阳性细胞,其中er-galnt1的表达模拟gala活化。强力霉素(dox)诱导的细胞显示糖基化er驻留蛋白canx的水平增加到6.5倍。图15呈现的数据表明,20对人肝肿瘤中er驻留蛋白的糖基化。(a)是蛋白质印迹图像,示出来自20个随机肝细胞癌(hcc)患者的20对人肝细胞癌(hcc)肿瘤(t)相对于与患者匹配的正常肝组织(nt)中er驻留蛋白pdia4和canx的糖基化的免疫印迹分析。该20对患者样品用编号f009、f012、f016、f017、f019、f022、f025、f026、f028、f031、f034、f037、f038、f039、f040、f042、f046、f049、f052、f074和f036表示。(b)是示出肿瘤中相对于埃德蒙森等级(edmondsongrade)的糖基化pdia4的水平的垂直散点图。每个点上的值表示相对于来自单个患者的对应正常组织,肿瘤中tn修饰pdia4的比率。(c)是示出肿瘤中相对于埃德蒙森等级的糖基化canx的水平的垂直散点图。将每个点上的值归一化为对应的正常组织。具体实施方式许多癌症与浸润性表型相关,通常会导致致命后果。一般而言,病症的阶段越晚,症状越严重。尽管某些病症可以在早期被检测到,但由于现有方法缺乏灵敏度以及缺乏可用于进行此类检测的靶标或生物标志物,因此难以在早期检测病症。大多数病症只能在晚期被检测到,有时在症状无法治疗或疾病无法治愈时才被检测到。糖基化在癌症中经常被改变。蛋白糖基化在癌症中被严重修饰,其中细胞表面糖基化蛋白决定癌细胞如何与周围组织相互作用及增殖。浸润性还与被扰动的o-糖基化,即细胞表面蛋白的共价修饰,相关。例如但不受理论的束缚,认为浸润性肿瘤表型会驱使肿瘤更快生长,并且通常与转移的形成和不良预后相关。例如,癌症可能是具有高死亡率的毁灭性疾病,尤其是在晚期。对于大多数癌症患者而言,转移最终会引起死亡。导致癌症在组织内生长的分子机制仍不清楚。浸润性肿瘤表型驱使肿瘤更快地生长,并且通常与转移的形成和不良预后相关联。一个此类实例是肝癌,其中浸润性表型与肝内转移相关,其通常是致命的结果。肝癌的发病率正在上升,目前是全世界与癌症相关死亡的第六最常见和第二主要原因。这种高死亡率的出现是由于肝癌的早期诊断存在困难,再加上缺乏有效的化学治疗方法,以及肿瘤局部转移和向其它器官转移的趋势,导致通过手术使其衰退没有效果。尽管目前存在可用于诊断癌症的方法,但是这些方法的准确性和功效仍有待证明。另外,缺乏在早期阶段有效检测癌症的方法。因此,在一个方面中,公开了一种检测癌症存在或不存在的方法。本文还公开了确定受试者罹患癌症的风险的方法,以及确定病症(例如癌症)的恶性程度的方法。本文公开的方法是基于使用本文公开的生物标志物来确定本文所述疾病的存在或不存在。在一个实例中,确定病症的存在或不存在包括检测获自受试者的样品中一种或多种内质网(er)驻留蛋白的o-糖基化水平。在另一个实例中,将检测到的水平与对照组中相同靶标的水平进行比较。在又一个实例中,一种或多种内质网(er)驻留蛋白的o-糖基化水平的增加指示病症的存在。在又一个实例中,一种或多种内质网(er)驻留蛋白的o-糖基化水平的降低指示病症的不存在。本文所用的术语“病症”和“疾病”可以互换使用,其是指不期望的病状或综合征,其中临床医生已经识别出或多或少的特定症状的集合。本文公开的方法可以用于检测本文公开的一种或多种疾病。在一个实例中,该病症是癌症。例如,癌症是但不限于肝癌、乳腺癌、肺癌、肝细胞癌(hcc)、肝细胞腺瘤(hca)、纤维板层型肝细胞癌(fhcc)、肝母细胞瘤、局灶性结节性增生(fnh)、结节再生性增生、导管原位癌(dcis)、乳腺佩吉特病、粉刺性癌、浸润性导管癌(idc)、导管内乳头状瘤、小叶原位癌(lcis)、浸润性小叶癌(ilc)、髓样癌、炎性乳腺癌症、非小细胞肺癌(nsclc)和小细胞肺癌(sclc)。在另一个实例中,该病症是肝癌。在又一个实例中,该病症是肝细胞癌(hcc)或肝细胞腺瘤(hca)。因此,在实例中,本发明公开了一种基于本文公开的主题对所鉴定的病症进行分期或表征的方法。在一个实例中,确定癌症的恶性度、等级或分期的方法包括:从受试者获得样品;检测该样品中一种或多种内质网(er)驻留蛋白的o-糖基化水平;将一种或多种内质网(er)驻留蛋白的o-糖基化水平与针对每一癌症等级定义的组中的一种或多种内质网(er)驻留蛋白的o-糖基化水平进行比较。在另一个实例中,该癌症是良性或恶性的。在另一个实例中,该癌症可以以分期来表征,例如,0期、1期、2期、3期或4期。在另一个实例中,根据埃德蒙森等级对癌症进行分期。本文所用的术语“埃德蒙森等级”,也称为埃德蒙森和斯坦纳分级系统(edmondsonandsteinergradingsystem,esgs),是指基于获自受试者的样品的组织病理学的肿瘤分级系统。根据埃德蒙森等级的分级定义如下:i级由排列在骨小梁中的小肿瘤细胞组成,具有丰富的细胞质和与正常肝组织几乎没有区别的最小的核不规则性。ii级肿瘤具有显著核仁,色素过多,并且具有一定程度的核不规则性。iii级肿瘤呈现出比ii级肿瘤更多的多型性,并具有成角的核。ⅳ级具有显著多型性,常为间变性巨细胞(anaplasticgiantcell)。下面提供了基于埃德蒙森和斯坦纳分级系统的组织学特征表。另外,可以使用并且需要分期来确定癌症在患者体内如何进展。当前用于癌症分期的一种方法包括使用tnm分期系统,其中t描述原发肿瘤的大小以及原发肿瘤是否已转移到附近组织;n描述淋巴结是否含有癌细胞;m是指是否存在转移到身体远端部分中的情况。但是,这种癌症分期的方法有点效率低下,因为它是由临床医师或病理学家通过临床或病理学观察来完成的,其中这种观察取决于活组织检查期间获得的样品的质量。如果活组织检查样品的质量差,或者疾病的病理分期之间的预后差异不足,会导致模糊性,致使分期不准确,进而导致治疗不足。对本文公开的疾病的检测和表征是在样品上进行的。本文所用的术语“样品”是指从受试者获取、获得或衍生的样本。在一个实例中,样品获自受试者。在另一个实例中,样品是生物样品。例如,该样品是但不限于组织、细胞或组件部分的子集,或其一份或一部分的活组织检查;全血或其组分(例如血浆、血清);尿、唾液淋巴液、胆汁、痰、泪、脑脊液、支气管肺泡灌洗液、滑液、精液、腹水肿瘤液、母乳、脓液、羊水、颊部涂片、培养细胞、收集自培养细胞的培养基、细胞团块、裂解物、从整个机体或其组织、细胞或组件部分的子集或者其一份或一部分制备的匀浆或提取物。在一个实例中,该样品可以是从机体器官分离的细胞,其中该器官可以是但不限于肝、脑、心、脾、肾、骨、淋巴结、肌肉、血管、骨髓、胰腺、肠、膀胱或皮肤。在另一个实例中,该样品可以是从机体关节分离的细胞,其中该细胞可以来自但不限于软骨、骨、肌肉、韧带、腱、结缔组织或其任何组合。本文所用的术语“受试者”是作为施用、治疗、观察或实验的对象的动物,优选地是哺乳动物。哺乳动物包括但不限于人以及家畜(诸如实验动物)和家庭宠物(例如但不限于猫、狗、猪、牛、绵羊、山羊、马、兔)以及非家畜(例如但不限于野生动物、禽类、鸟类)等。在一个实例中,该哺乳动物是啮齿动物,例如但不限于小鼠和大鼠。在另一个实例中,该哺乳动物是人。本文公开的方法基于已经被确定在病症(例如但不限于癌症)中被活化的所谓的n-乙酰半乳糖胺(galnac)-t活化(gala)途径。本文所用的术语“gala”、“galnac-t活化途径”或“gala途径”在全文中可互换使用,其是指多肽n-乙酰氨基半乳糖转移酶(galnt)从高尔基体向内质网的迁移过程。这会致使内质网中o-糖基化和tn抗原水平增加,以及蛋白质糖基化整体增加。本文所用的术语“o-糖基化”是指将单糖或多糖分子或聚糖附着到蛋白质中的氨基酸残基的翻译后修饰过程。这种附着在待被聚糖附着的氨基酸中存在的氧原子处进行。在一个实例中,o-联聚糖可以附着到例如丝氨酸、苏氨酸、酪氨酸、羟基赖氨酸或羟脯氨酸侧链的羟基氧上,或者附着到脂质(诸如但不限于通过磷酸丝氨酸的磷酸酯连接的神经酰胺磷酸聚糖)的氧原子上。该糖基化过程通常发生在真核生物的高尔基体中,并且可以影响细胞信号传导途径,从而导致生物学过程的改变和细胞的功能改变。因此,在一个实例中,本文公开的方法依赖于蛋白质的o-糖基化来确定疾病的存在或不存在。糖基化过程中所涉及的酶通常称为糖基转移酶,其是建立糖苷键的酶。换言之,糖基转移酶将糖分子(也称为“糖基供体”)附着到(亲核)糖基受体分子,该(亲核)糖基受体分子通常是氧基、碳基、氮基或硫基分子。本文所用的术语“聚糖”是指由通过糖苷连接的大量单糖组成的化合物。也就是说,单糖连接在一种糖的半缩醛或半缩酮基与另一种化合物的羟基之间。本文所用的术语“聚糖”与术语多糖同义使用。聚糖可以是单糖残基的均聚物或杂聚物,并且可以是直链或支链的。通常,在细胞的外表面上发现聚糖,因此o-联聚糖和n-联聚糖在真核生物中是非常普遍的。例如,聚糖可以仅包括单糖的o-糖苷键。在另一个实例中,聚糖是但不限于n-乙酰半乳糖胺(galnac)、n-乙酰基葡糖胺、岩藻糖、葡萄糖、木糖、半乳糖、甘露糖或其任何组合。在一个实例中,聚糖是o-联聚糖。在糖基供体是n-乙酰基-半乳糖胺的一个实例中,催化n-乙酰基-半乳糖胺与糖基受体分子连接的酶是多肽n-乙酰氨基半乳糖转移酶。在另一个实例中,当n-乙酰半乳糖胺(galnac)在被galnt催化的反应中结合到蛋白质中丝氨酸或苏氨酸的羟基上时,会形成o-聚糖o-galnac。本文所用的术语“o-联聚糖”和“o-聚糖”在全文中可互换使用,并且是指通过丝氨酸或苏氨酸残基连接到蛋白质的聚糖。在另一个实例中,o-聚糖是连接到蛋白质中的丝氨酸或苏氨酸的o-n-乙酰半乳糖胺(o-galnac)。在另一个实例中,o-聚糖是tn。本文所用的术语“tn抗原”或“tn”在全文中可互换使用,并且是指o-galnac。本文所用的术语“n-乙酰半乳糖胺”或“galnac”在全文中可互换使用,是指参与o-糖基化过程的单糖。如上所述,例如,galnac在o-糖基化过程中通过例如galnt连接到蛋白质中氨基酸丝氨酸或苏氨酸的羟基,从而形成o-联n-乙酰半乳糖胺(o-galnac)。本文所用的术语“多肽n-乙酰氨基半乳糖转移酶”或“galnt”在全文中可互换使用,并且是指在o-糖基化期间催化n-乙酰半乳糖胺转移到蛋白质中氨基酸丝氨酸或苏氨酸的羟基上的糖基转移酶。在一实例中,多肽n-乙酰氨基半乳糖转移酶(galnt)可以是但不限于多肽n-乙酰氨基半乳糖转移酶1(galnt1)、多肽n-乙酰氨基半乳糖转移酶2(galnt2)、多肽n-乙酰氨基半乳糖转移酶3(galnt3)、多肽n-乙酰氨基半乳糖转移酶4(galnt4)、多肽n-乙酰氨基半乳糖转移酶5(galnt5)、多肽n-乙酰氨基半乳糖转移酶6(galnt6)、多肽n-乙酰氨基半乳糖转移酶7(galnt7)、多肽n-乙酰氨基半乳糖转移酶8(galnt8)、多肽n-乙酰氨基半乳糖转移酶9(galnt9)、多肽n-乙酰氨基半乳糖转移酶10(galnt10)、多肽n-乙酰氨基半乳糖转移酶11(galnt11)、多肽n-乙酰氨基半乳糖转移酶12(galnt12)、多肽n-乙酰氨基半乳糖转移酶13(galnt13)、多肽n-乙酰氨基半乳糖转移酶14(galnt14)、多肽n-乙酰氨基半乳糖转移酶15(galnt15)、多肽n-乙酰氨基半乳糖转移酶16(galnt16)、多肽n-乙酰氨基半乳糖转移酶17(galnt17)、多肽n-乙酰氨基半乳糖转移酶18(galnt18)、多肽n-乙酰氨基半乳糖转移酶样(like)5(galntl5)、多肽n-乙酰氨基半乳糖转移酶样6(galntl6)或其任何组合。本文所用的术语“蛋白质”、“肽”和“多肽”在全文中可互换使用,并且是指包括通过肽键彼此连接的两个或更多个氨基酸残基的分子。蛋白质也可以仅仅是天然存在的蛋白质或肽的片段。蛋白质可以是野生型、突变的、重组的、天然存在的或合成的,并且可以构成天然存在或非天然存在多肽的全部或部分。蛋白质或肽必须包含至少两个氨基酸,对构成蛋白质或肽序列的最大氨基酸数没有限制。在一个实例中,蛋白质可以是酶。本文所用的术语“酶”是可以催化生化反应的蛋白质。该反应可以是天然发生的或非天然发生的。在另一个实例中,蛋白质可以通过翻译后修饰来修饰。本文所用的术语“翻译后修饰”是指蛋白质的化学修饰,其中该化学修饰可以被酶催化。例如,翻译后修饰可以是但不限于o-糖基化、n-糖基化、乙酰化、甲基化、磷酸化、泛素化、硫酸化、羟基化、酰胺化或其任何组合。在另一个实例中,蛋白质可以存在于一个或多个细胞区室中,例如但不限于内质网(er)、高尔基体、池、细胞核、细胞质、线粒体或其任何组合。在另一个实例中,蛋白质可以存在于内质网中。这类蛋白质也称为内质网(er)驻留蛋白质。本文所用的术语“内质网(er)驻留蛋白”是指蛋白质折叠后保留在内质网中并且仅存在于内质网中的蛋白质。本文公开的内质网(er)驻留蛋白可以存在于光面内质网和/或粗面内质网中。在一个实例中,一种或多种内质网(er)驻留蛋白位于内质网的腔和/或膜中。为了防止蛋白质被分泌到细胞核中,已证明存在于例如内质网中的蛋白质包括特定的n端或c端信号序列,从而能够将具有此信号序列的蛋白质保留在内质网中。在一个实例中,内质网(er)驻留蛋白包括kdel和/或kkxx肽序列。在另一个实例中,可以在蛋白质的n端或c端发现kdel和/或kkxx肽序列。在另一个实例中,可以使用诸如免疫荧光显微镜检查的成像方法来观察蛋白质的亚细胞分布,从而能够确定蛋白质是否是内质网(er)驻留蛋白。根据本文公开的方法,内质网驻留蛋白使用所属领域中已知的方法来识别。在另一个实例中,内质网(er)驻留蛋白可以是但不限于udp-葡萄糖神经酰胺葡糖基转移酶样1(uggt1)、染色体2开放阅读框30(erlec1)、糖基转移酶25结构域1(glycosyltransferase25domaincontaining1,colgalt1/glt25d1)、af216292支持的假设基因;nm_005347;70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip)、低密度脂蛋白受体相关蛋白关联蛋白1(lrpap1)、骨肉瘤放大基因9内质网关联蛋白(os9)、脯氨酰4-羟化酶α多肽i(p4ha1)、脯氨酰4-羟化酶β多肽(p4hb)、蛋白质二硫键异构酶a3(pdia3)、蛋白质二硫键异构酶a4(pdia4)、基质细胞衍生因子2样1(sdf2l1)、硫酸酯酶修饰因子2(sumf2)、含硫氧还蛋白结构域蛋白5(内质网);muted同系物(小鼠)(txndc5)、天冬酰胺-联糖基化9,α-1,2-甘露糖转移酶同系物(酿酒酵母(s.cerevisiae))(alg9)、天冬氨酸β-羟化酶(asph)、钙联结蛋白(canx)、钙同线蛋白1(clstn1)、细胞骨架关联蛋白4(ckap4)、依莫帕米结合蛋白(固醇异构酶)(ebp)、γ-谷氨酰羧化酶(ggcx)、1,4,5-三磷酸肌醇受体2型(itpr2)、甘露糖结合凝集素1(lectin,mannose-binding,1,lman1/ergic53)、皮屑蛋白样1(p3h2/leprel1)、富含亮氨酸脯氨酸的蛋白聚糖(皮屑蛋白)1(p3h1/lepre1)、甘露糖苷酶α,1b类成员1(man1b1)、黑素瘤抑制活性家族成员3(mia3)、中胚层发育候选物2(mesdc2)、多种凝固因子缺乏蛋白2(mcfd2)、核连蛋白2(nucb2)、跨膜脯氨酰4-羟化酶(内质网)(p4htm)、前列腺素f2受体负调节蛋白(ptgfrn)、蛋白激酶c底物80k-h(prkcsh)、核糖体结合糖蛋白i(rpn1)、lin-12-样蛋白的sel-1抑制剂(秀丽隐杆线虫(c.elegans))(sel1l)、信号识别颗粒受体b亚基(srprb)、含硫氧还蛋白结构域蛋白11(txndc11)、酪蛋白磺基转移酶2(tpst2)和木糖基转移酶ii(xylt2)。在一个实例中,该一种或多种内质网(er)驻留蛋白是但不限于蛋白质二硫键异构酶a4(pdia4)、钙联结蛋白(canx)、蛋白质二硫键异构酶a3(pdia3)、内质网凝集素1(erlec1)、70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip)或其组合。在另一个实例中,内质网(er)驻留蛋白是蛋白质二硫键异构酶a4(pdia4)。在另一个实例中,内质网(er)驻留蛋白是钙联结蛋白(canx)。在又一个实例中,内质网(er)驻留蛋白是蛋白质二硫键异构酶a3(pdia3)。在另一个实例中,内质网(er)驻留蛋白是内质网凝集素1(erlec1)。在一个实例中,内质网(er)驻留蛋白是70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip)。在一个实例中,内质网(er)驻留蛋白是以下组合中的任一者:蛋白质二硫键异构酶a4(pdia4)和钙联结蛋白(canx);蛋白质二硫键异构酶a4(pdia4)和蛋白质二硫键异构酶a3(pdia3);蛋白质二硫键异构酶a4(pdia4)和内质网凝集素1(erlec1);蛋白质二硫键异构酶a4(pdia4)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);钙联结蛋白(canx)和蛋白质二硫键异构酶a3(pdia3);钙联结蛋白(canx)和内质网凝集素1(erlec1);钙联结蛋白(canx)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);蛋白质二硫键异构酶a3(pdia3)和内质网凝集素1(erlec1);蛋白质二硫键异构酶a3(pdia3)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);或者内质网凝集素1(erlec1)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip)。在另一个实例中,内质网(er)驻留蛋白是以下组合中的任一种:蛋白质二硫键异构酶a4(pdia4)、钙联结蛋白(canx)和蛋白质二硫键异构酶a3(pdia3);蛋白质二硫键异构酶a4(pdia4)、钙联结蛋白(canx)和内质网凝集素1(erlec1);蛋白质二硫键异构酶a4(pdia4)、钙联结蛋白(canx)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);蛋白质二硫键异构酶a4(pdia4)、蛋白质二硫键异构酶a3(pdia3)和内质网凝集素1(erlec1);蛋白质二硫键异构酶a4(pdia4)、蛋白质二硫键异构酶a3(pdia3)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);蛋白质二硫键异构酶a4(pdia4)、蛋白质二硫键异构酶a3(pdia3)和内质网凝集素1(erlec1);蛋白质二硫键异构酶a4(pdia4)、蛋白质二硫键异构酶a3(pdia3)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);蛋白质二硫键异构酶a4(pdia4)、内质网凝集素1(erlec1)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);钙联结蛋白(canx)、蛋白质二硫键异构酶a3(pdia3)和内质网凝集素1(erlec1);钙联结蛋白(canx)、内质网凝集素1(erlec1)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);钙联结蛋白(canx)、蛋白质二硫键异构酶a3(pdia3)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);或者蛋白质二硫键异构酶a3(pdia3)、内质网凝集素1(erlec1)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip)。在另一个实例中,内质网(er)驻留蛋白是任何以下组合:蛋白质二硫键异构酶a4(pdia4)、钙联结蛋白(canx)、蛋白质二硫键异构酶a3(pdia3)和内质网凝集素1(erlec1);钙联结蛋白(canx)、蛋白质二硫键异构酶a3(pdia3)、内质网凝集素1(erlec1)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);蛋白质二硫键异构酶a4(pdia4)、蛋白质二硫键异构酶a3(pdia3)、内质网凝集素1(erlec1)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);蛋白质二硫键异构酶a4(pdia4)、钙联结蛋白(canx)、内质网凝集素1(erlec1)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip);或者蛋白质二硫键异构酶a4(pdia4)、钙联结蛋白(canx)、蛋白质二硫键异构酶a3(pdia3)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip)。本文所用的术语“生物标志物”是指可用于确定特定疾病或病状的存在或不存在和/或严重性的特定生物学性质、生化特征或方面的分子指示剂。在本公开中,术语“生物标志物”是指与病症相关的蛋白质、该蛋白质的片段或变体。在一个实例中,该生物标志物可以是参与gala途径的基因。在另一个实例中,该生物标志物是o-糖基化蛋白质。在另一个实例中,该生物标志物是本文所公开的o-糖基化er驻留蛋白质。在一个实例中,设想本文所公开的生物标志物能够检测或诊断或预测患者或受试者患有疾病的可能性。因此,本文公开的生物标志物可以掺入入检测方法、风险确定方法、分期预后方法、确定患者或受试者患有疾病的可能性的诊断试剂盒或者确定患者或受试者的病症分期的预后试剂盒中。在一个实例中,本发明公开了一种检测病症存在或不存在的方法。在一个实例中,用于检测病症的存在或不存在的方法包括以下步骤:a.从受试者获得样品;b.检测得自步骤a.中的样品中一种或多种生物标志物的水平;c.将步骤b.中一种或多种生物标志物的水平与对照组中一种或多种生物标志物的水平进行比较。本公开的方法包括以下步骤:a.从受试者获得样品;b.检测得自步骤a.中的样品中的一种或多种内质网(er)驻留蛋白的o-糖基化水平;以及c.将步骤b.中的一种或多种内质网(er)驻留蛋白的o-糖基化水平与对照组中一种或多种内质网(er)驻留蛋白的o-糖基化水平进行比较。在另一个实例中,本发明公开了一种确定受试者罹患病症的风险的方法。在另一个实例中,该方法包括以下步骤:从受试者获得样品;检测该样品中的一种或多种生物标志物的水平;以及将一种或多种生物标志物的水平与对照组中相同生物标志物的水平进行比较。在一个实例中,确定受试者罹患病症的风险的方法包括以下步骤:a.从受试者获得样品;b.检测得自步骤a.中的该样品中的一种或多种内质网(er)驻留蛋白的o-糖基化水平;c.将步骤b.中的一种或多种内质网(er)驻留蛋白的o-糖基化水平与对照组中一种或多种内质网(er)驻留蛋白的o-糖基化水平进行比较。为了检测样品中一种或多种生物标志物的水平,可以采用常规方法,包括但不限于用于捕获和/或检测样品中一种或多种生物标志物的方法。例如,捕获样品中的一种或多种生物标志物的方法包括但不限于已经用于沉淀蛋白质和蛋白质复合物的亲和纯化、免疫沉淀、免疫共沉淀、染色质免疫沉淀、核糖核蛋白免疫沉淀或其任何组合。检测样品中的一种或多种生物标志物的方法可以包括但不限于免疫组织化学法(ihc)、免疫检测测定、荧光测定、免疫染色法、比色蛋白测定或其任何组合。在另一个实例中,样品中的一种或多种生物标志物水平的检测任选地包括使样品与单糖结合蛋白接触的步骤。在另一个实例中,检测一种或多种内质网(er)驻留蛋白的o-糖基化水平任选地包括使样品与单糖结合蛋白接触的步骤。在一个实例中,单糖结合蛋白可以是自由浮动(free-floating)的或可以固定在固体表面上。在另一个实例中,单糖结合蛋白可以是但不限于n-乙酰半乳糖胺结合蛋白、甘露糖结合蛋白、半乳糖结合蛋白、n-乙酰基葡糖胺结合蛋白、n-乙酰基神经氨酸结合蛋白或岩藻糖结合蛋白。在另一个实例中,单糖结合蛋白是外源凝集素。在另一个实例中,单糖结合蛋白是n-乙酰半乳糖胺结合蛋白。n-乙酰半乳糖胺结合蛋白的实例包括但不限于长柔毛野豌豆凝集素(vvl)、盖罩大蜗牛凝集素a(hpl)、曼陀罗凝集素(dsl)、蓖麻毒蛋白(rca)、花生凝集素(pna)和木菠萝素(jacalin,ail)。在另一个实例中,n-乙酰半乳糖胺结合蛋白是长柔毛野豌豆凝集素(vvl)或盖罩大蜗牛凝集素a(hpl)。基于从受试者获得的样品中生物标志物的水平和对照组中相同生物标志物的水平之间的差异,进行患病与无病样品之间的比较。基于此比较,可以基于生物标志物的存在或不存在来确定疾病的存在或不存在。在一个实例中,生物标志物的存在指示疾病的存在。在另一个实例中,生物标志物的不存在指示疾病。基于生物标志物的差别表达,还可以在从受试者获得的样品中生物标志物的水平与对照组中相同生物标志物的水平之间进行另一比较。在一个实例中,该生物标志物的上调指示疾病的存在。在另一个实例中,下调指示疾病的存在。在再一个实例中,该生物标志物的上调指示疾病的不存在。在又一个实例中,该生物标志物的下调指示疾病的不存在。在另一个实例中,该生物标志物水平的降低指示疾病的存在。还应理解,在gala途径的活化过程中,可以看到多肽n-乙酰氨基半乳糖转移酶(galnt)迁移到内质网(er)中。不受理论的束缚,认为galnt酶的这种亚细胞迁移致使内质网(er)中的蛋白质(例如但不限于内质网(er)驻留蛋白)的o-糖基化水平提高。因此,在另一个实例中,一种或多种内质网(er)驻留蛋白的o-糖基化水平的增加指示病症的存在。使用样品中生物标志物水平在与对照组中生物标志物的水平相比时的倍数变化的定量比较,可用于确定受试者罹患病症的风险并指示此受试者患有病症。在一个实例中,样品中生物标志物水平的倍数变化增加表明此受试者患有病症。在一个实例中,该增加可以是但不限于约1.5倍、约2倍、约2.5倍、约3倍、约3.5倍、约4倍、约4.5倍、约5倍、约5.5倍、约6倍、约6.5倍、约7倍、约7.5倍、约8倍、约8.5倍、约9倍、约9.5倍、约10倍、约10.5倍、约11倍、约11.5倍、约12倍、约12.5倍、约13倍、约13.5倍、约14倍、约14.5倍、约15倍、约15.5倍、约16倍、约16.5倍、约17倍、约17.5倍、约18倍、约18.5倍、约19倍、约19.5倍或约20倍,其将指示受试者患有病症。在另一个实例中,该增加可以是约1.5倍到约20倍。在另一个实例中,该增加可以是但不限于约1.5倍到约2.3倍、约2.0倍到约2.8倍、约2.5倍到约3.3倍、约3.0倍到约3.8倍、约3.5倍到约4.3倍、约4.0倍到约4.8倍、约4.5倍到约5.3倍、约5.0倍到约5.8倍、约5.5倍到约6.3倍、约6.0倍到约6.8倍、约6.5倍到约7.3倍、约7.0倍到约7.8倍、约7.5倍到约8.3倍、约8.0倍到约8.8倍、约8.5倍到约9.3倍、约9.0倍到约9.8倍、约9.5倍到约10.3倍、约10.0倍到约10.8倍、约10.5倍到约11.3倍、约11.0倍到约11.8倍、约11.5倍到约12.3倍、约12.0倍到约12.8倍、约12.5倍到约13.3倍、约13.0倍到约13.8倍、约13.5倍到约14.3倍、约14.0倍到约14.8倍、约14.5倍到约15.3倍、约15.0倍到约15.8倍、约15.5倍到约16.3倍、约16.0倍到约16.8倍、约16.5倍到约17.3倍、约17.0倍到约17.8倍、约17.5倍到约18.3倍、约18.0倍到约18.8倍,约18.5倍到约19.3倍、约19.0倍到约19.8倍、约19.5倍到约20倍,其将指示受试者患有病症。在另一个实例中,该增加可以是但不限于至少约1.5倍、至少约2倍、至少约2.5倍、至少约3倍、至少约3.5倍、至少约4倍、至少约4.5倍、至少约5倍、至少约5.5倍、至少约6倍、至少约6.5倍、至少约7倍、至少约7.5倍、至少约8倍、至少约8.5倍、至少约9倍、至少约9.5倍、至少约10倍、至少约10.5倍、至少约11倍、至少约11.5倍、至少约12倍、至少约12.5倍、至少约13倍、至少约13.5倍、至少约14倍、至少约14.5倍、至少约15倍、至少约15.5倍、至少约16倍、至少约16.5倍、至少约17倍、至少约17.5倍、至少约18倍、至少约18.5倍、至少约19倍、至少约19.5倍,或至少约20倍,其将指示受试者患有病症。在另一个实例中,存在于样品中的一种或多种内质网(er)驻留蛋白的o-糖基化水平的增加介于2倍到20倍之间。在又一个实例中,存在于样品中的一种或多种内质网(er)驻留蛋白的o-糖基化水平的增加是至少4倍,其将指示受试者患有病症。在一个实例中,样品中生物标志物水平的倍数变化减少表明此受试者患有病症。在一个实例中,该减少可以是但不限于约1.5倍、约2倍、约2.5倍、约3倍、约3.5倍、约4倍、约4.5倍、5倍、约5.5倍、约6倍、约6.5倍、约7倍、约7.5倍、约8倍、约8.5倍、约9倍、约9.5倍、约10倍、约10.5倍、约11倍、约11.5倍、约12倍、约12.5倍、约13倍、约13.5倍、约14倍、约14.5倍、约15倍、约15.5倍、约16倍、约16.5倍、约17倍、约17.5倍、约18倍、约18.5倍、约19倍、约19.5倍或约20倍,其将指示受试者患有病症。在另一个实例中,该减少可以是约1.5倍到约20倍。在另一个实例中,该减少可以是但不限于约1.5倍到约2.3倍、约2.0倍到约2.8倍、约2.5倍到约3.3倍、约3.0倍到约3.8倍、约3.5倍到约4.3倍、约4.0倍到约4.8倍、约4.5倍到约5.3倍、约5.0倍到约5.8倍、约5.5倍到约6.3倍、约6.0倍到约6.8倍、约6.5倍到约7.3倍、约7.0倍到约7.8倍、约7.5倍到约8.3倍、约8.0倍到约8.8倍、约8.5倍到约9.3倍、约9.0倍到约9.8倍、约9.5倍到约10.3倍、约10.0倍到约10.8倍、约10.5倍到约11.3倍、约11.0倍到约11.8倍、约11.5倍到约12.3倍、约12.0倍到约12.8倍、约12.5倍到约13.3倍、约13.0倍到约13.8倍、约13.5倍到约14.3倍、约14.0倍到约14.8倍、约14.5倍到约15.3倍、约15.0倍到约15.8倍、约15.5倍到约16.3倍、约16.0倍到约16.8倍、约16.5倍到约17.3倍、约17.0倍到约17.8倍、约17.5倍到约18.3倍、约18.0倍到约18.8倍,约18.5倍到约19.3倍、约19.0倍到约19.8倍、约19.5倍到约20倍,其将指示受试者患有病症。在另一个实例中,该减少可以是但不限于至少约1.5倍、至少约2倍、至少约2.5倍、至少约3倍、至少约3.5倍、至少约4倍、至少约4.5倍、至少约5倍、至少约5.5倍、至少约6倍、至少约6.5倍、至少约7倍、至少约7.5倍、至少约8倍、至少约8.5倍、至少约9倍、至少约9.5倍、至少约10倍、至少约10.5倍、至少约11倍、至少约11.5倍、至少约12倍、至少约12.5倍、至少约13倍、至少约13.5倍、至少约14倍、至少约14.5倍、至少约15倍、至少约15.5倍、至少约16倍、至少约16.5倍、至少约17倍、至少约17.5倍、至少约18倍、至少约18.5倍、至少约19倍、至少约19.5倍,或至少约20倍,其将指示受试者患有病症。本文所用的术语“对照组”是指不患有病症的样品。在一个实例中,该对照组可以是得自健康志愿者或无病受试者的样品。本文所用的术语“无疾病”是指没有不期望的病状或综合症,其中受试者和/或样品可被称为无疾病。因此,在一个实例中,将样品中标志物的水平与对照组中相同标志物的水平进行比较。在另一个实例中,该对照组是无疾病组。在另一个实例中,该对照组可以是得自无癌症受试者的样品。在另一个实例中,在另一个实例中,该对照组可以是得自受试者的样品,该受试者不患有,包括但不限于,肝癌、乳腺癌、肺癌、肝细胞癌(hcc)、肝细胞腺瘤(hca)、纤维板层型肝细胞癌(fhcc)、肝母细胞瘤、局灶性结节性增生(fnh)、结节再生性增生、导管原位癌(dcis)、乳腺佩吉特病、粉刺性癌、浸润性导管癌(idc)、导管内乳头状瘤、小叶原位癌(lcis)、浸润性小叶癌(ilc)、髓样癌、炎性乳腺癌症、非小细胞肺癌(nsclc)和小细胞肺癌(sclc)。在又一个实例中,无疾病样品可以是得自患有病症的受试者的非肿瘤相配物(match)。本文所用的术语“非肿瘤”和“非肿瘤相配物”是指不含得自患有病症的受试者的所述病症的样品。例如,非肿瘤相配物可以是但不限于在同一器官内的癌细胞周围或附近发现的正常组织或细胞。在又一个实例中,该对照组可以是得自患有癌症的受试者的非肿瘤相配物。在又一个实例中,该对照组可以是得自受试者的非肿瘤相配物,所述受试者患有,包括但不限于,肝癌、乳腺癌、肺癌、肝细胞癌(hcc)、肝细胞腺瘤(hca)、纤维板层型肝细胞癌(fhcc)、肝母细胞瘤、局灶性结节性增生(fnh)、结节再生性增生、导管原位癌(dcis)、乳腺佩吉特病、粉刺性癌、浸润性导管癌(idc)、导管内乳头状瘤、小叶原位癌(lcis)、浸润性小叶癌(ilc)、髓样癌、炎性乳腺癌症、非小细胞肺癌(nsclc)和小细胞肺癌(sclc)。在一个实例中,可以使用一种或多种生物标志物进行检测和/或比较。在另一个实例中,可以使用,但不限于,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37或38种生物标志物进行检测和/或比较。在一个实例中,可以使用,但不限于,样品中1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37或38种o-糖基化内质网(er)驻留蛋白的o-糖基化水平进行检测和/或比较。在一个实例中,可以使用,但不限于,样品中多肽n-乙酰氨基半乳糖转移酶(galnt)中的1、2、3、4、5、6或7种的水平进行检测和/或比较。本文还公开了一种试剂盒,该试剂盒包括执行本文所述方法所需的生物标志物和组分。在一个实例中,该试剂盒包括能够结合一种或多种生物标志物的单糖结合蛋白。在一个实例中,该试剂盒包括能够结合一种或多种生物标志物的结合蛋白,其中该结合蛋白是自由浮动的或固定在固体表面上。在一个实例中,该结合蛋白是抗体或偶联抗体。在另一个实例中,该结合蛋白包含位于该蛋白的5'或3'端的一个或多个标记。这类标记可以用于例如检测或分离和纯化所附着的分子。因此,所属领域中的技术人员将了解并且能够使用类似的标记来获得以上提供的结果。该标记可以是但不限于生物素、链霉亲和素、磷酸盐、组氨酸flag、三重flag标记(3xflag)、ha、myc和荧光标记,例如绿色荧光蛋白,以及它们中的多种(multiples)或组合。在另一个实例中,该试剂盒包括检测剂。在一个实例中,该检测剂能够结合一种或多种生物标志物。在一个实例中,该检测剂能够结合单糖结合蛋白和/或一种或多种o-糖基化内质网(er)驻留蛋白。在一个实例中,该检测剂可以是但不限于可以产生和/或增强反应的酶偶联抗体、酶或抗体。在一个实例中,该酶可以是辣根过氧化物酶(hrp)。在另一个实例中,该试剂盒包括一种或多种标准品。在一个实例中,该试剂盒包括但不限于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37或38种标准品。本文所用的术语“标准品”是指被认为具有已知值的参照或样品。换言之,实验中的标准品是在比较评估中用作度量、规范或模型的东西。例如,阳性对照可以被认为是标准品。在另一个实例中,该标准品可以是靶标(例如,蛋白质、核酸分子等)的未突变或野生型形式。在其它实例中,术语“标准品”也可以用于指在凝胶电泳中用于定义底物分子量的蛋白梯或分子量参照。在又一个实例中,基因表达的上下文中的术语标准品是指靶基因在其未修饰环境中的表达。此未修饰环境可以指但不限于靶基因在无疾病受试者中的表达。该标准品也可以是得自对照组的特定基因的基因表达的代表值。在一个实例中,本文公开的试剂盒中的标准品是本文公开的生物标志物。在一个实例中,该标准品是o-糖基化内质网(er)驻留蛋白。在一个实例中,该试剂盒中的标准品包括本文所公开的o-糖基化内质网(er)驻留蛋白中的一种或多种。在另一个实例中,该试剂盒中的标准品包括但不限于o-糖基化内质网(er)驻留蛋白中的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37或38种。在另一个实例中,该试剂盒中的标准品包括本文所公开的o-糖基化内质网(er)驻留蛋白中的任一种。在另一个实例中,该试剂盒中的标准品可以是但不限于本文所公开的蛋白质二硫键异构酶a4(pdia4)、钙联结蛋白(canx)、蛋白质二硫键异构酶a3(pdia3)、内质网凝集素1(erlec1)和70kda热休克蛋白5(葡萄糖调节蛋白,78kda)(hspa5/grp78/bip)及其组合。该试剂盒可以用于定性评估或定量测量靶标的存在、量或功能活性。在一个实例中,该试剂盒用于根据本文公开的方法确定样品中一种或多种o-糖基化内质网(er)驻留蛋白的水平;以及/或者将根据本文公开的方法将一种或多种o-糖基化内质网(er)驻留蛋白的水平与标准品所提供的基线水平进行比较。该试剂盒可以是分析工具。在一个实例中,该试剂盒可以是分析生物化学测定。在另一个实例中,该试剂盒是酶联免疫吸附测定(elisa)。在一个实例中,该试剂盒是elisa试剂盒,包括微孔板;样品稀释剂;洗涤缓冲液;可使用检测剂检测的底物溶液;以及可与底物溶液反应并允许可视化的终止溶液。所属领域中的技术人员应当理解,该试剂盒的组分或该试剂盒可以适于根据本文公开的方法使用。该试剂盒的组分或该试剂盒被配置成根据本文公开的方法的需要而被混合。例如,本文公开的组分可以相应地在反应容器中混合,以获得根据本文公开的方法所需的信息。例如,对于elisa试剂盒,所属领域中的技术人员应当理解,elisa试剂盒要求将靶标分析物或生物标志物或标志物结合至反应容器,用所需的底物检测标志物,洗涤反应容器,然后使用检测底物检测标志物的存在、不存在或水平。本文说明性地描述的发明可以在不存在本文未具体公开的任何一个或多个元素、一个或多个限制的情况下适当地实践。因此,例如,术语“包括”、“包含”、“含有”等应被广义地理解而没有限制。另外,本文所采用的术语和表达已被用作描述性而非限制性的术语,并且并不意图使用所述术语和表达来排除所示出和描述的特征或其部分的任何等同形式,但是应认识到,在所要求保护的本发明的范围内可以进行各种修改。因此,应理解,尽管已经通过优选实施方案和任选特征具体公开了本发明,但是所属领域中的技术人员可以对本文所公开、其中所实施的本发明进行修改和改变,并且这些修改和改变被认为在本发明的范围内。本申请中使用的单数形式“一个”、“一种”和“该”包括复数引用,除非上下文另外明确指出。例如,术语“一种遗传标志物”包括多种遗传标志物,包括其混合物和组合。在制剂组分的浓度的上下文中,本文所用的术语“约”通常是指所述值的+/-5%,更通常是所述值的+/-4%,更通常是所述值的+/-3%,更通常为所述值的+/-2%,甚至更通常为所述值的+/-1%,甚至更通常为所述值的+/-0.5%。在整个本公开中,某些实施方案可以以范围格式公开。应理解,范围格式的描述仅是出于方便和简洁目的,而不应被解释为对所公开范围的硬性范围限制。相应地,范围的描述应被认为已经具体公开了所有可能的子范围以及该范围内的各个数值。例如,对范围例如1到6的描述应被视为已明确公开了子范围例如1到3、1到4、1到5、2到4、2到6、3到6等,以及该范围内的各个数字,例如1、2、3、4、5和6。无论范围的广度如何,这都适用。某些实施方案也可以在本文中广泛地和概括地描述。落入一般公开内的每个较窄种类和亚类分组也形成本公开的一部分。这包括对具备去除了此类中的任何主题的附带条件或否定限制的实施方案的一般性描述,无论本文中是否具体叙述了被去除的材料。本文中已经广泛地和概括地描述了本发明。落入一般公开内的每个较窄种类和亚类分组也形成本发明的一部分。这包括对具备去除了此类中的任何主题的附带条件或否定限制的发明的一般性描述,无论本文中是否具体叙述了被去除的材料。其它实施方案在以下权利要求和非限制性实施例内。此外,在根据马库什组描述本发明的特征或方面的情况下,所属领域中的技术人员应当认识到,由此也根据马库什组的任何单个成员或成员子组对本发明进行描述。实验部分实施例1galnt在恶性肝肿瘤中迁移到er为了对人肝癌中的tn水平进行定量,用长柔毛野豌豆凝集素(vvl)对160活组织检查进行染色(图8a)。活组织检查核心来自正常肝脏、肝炎(in)和增生性肝脏、肝细胞癌(hcc)和病理学家定义的1级到3级肝内胆管细胞癌。正常肝样品中的长柔毛野豌豆凝集素(vvl)染色强度低,而2级和3级癌中此长柔毛野豌豆凝集素(vvl)染色强度分别以42/44和11/11被提高(图2a和2b)。3级癌症的中值tn升高到对照组织的约4倍,其中最高达10倍升高。检测不到与肿瘤类型的相关性。接下来,通过流体动力注入编码睡美人转座酶和nras-g12v和抗p53shrna(shp53)的质粒,在小鼠中诱导肝肿瘤(图3a)。注射后20周(wpi),对小鼠实施安乐死并解剖肝脏。约40%的小鼠呈现肝细胞腺瘤(hca),而60%的小鼠呈现肝细胞癌(hcc)。尽管肝细胞腺瘤(hca)中的大多数细胞的tn水平低,但在肝细胞癌(hcc)中,大多数细胞的长柔毛野豌豆凝集素(vvl)染色升高(图8b和8c)。总体而言,小鼠和人肿瘤的模式相似,其中tn强度和频率的增加与肿瘤的严重程度有关。这表明编码睡美人转座酶和nras-g12v和抗p53shrna(shp53)的质粒(图3a)可以诱导肝细胞腺瘤(hca)和肝细胞癌(hcc),这可以通过使用长柔毛野豌豆凝集素(vvl)染色以tn水平来区分。在人和小鼠样品的高放大倍率免疫荧光图像上,观察到染色水平低的细胞在小核周围结构(smallperi-nuclearstructure)中显示阳性tn表达(与高尔基体一致)(图2c和8d),而在高tn水平的细胞中,染色分布在整个细胞内(图8d),具有网状外观(图2c)。实际上,与er标志物钙联结蛋白的共染色表明tn在晚期肿瘤中通过钙联结蛋白而定位(图2d)。已经提出蛋白质二硫键异构酶4a(pdia4)是galnt底物,而且,由于它是er驻留蛋白,因此其糖基化水平在正常条件下预计较低,但在gala后升高。使用n-乙酰半乳糖胺(galnac)修饰的蛋白质的免疫沉淀,观察到pdia4糖基化在正常肝脏样品中非常低,但在早期肿瘤中增加,而在晚期肿瘤中则明显增加(图2e)。为了验证gala在人癌症组织中也被活化,分析了来自最近切除的肝脏的20个成对的非肿瘤和肿瘤组织的样品(表2)。在若干非肿瘤组织中,pdia4糖基化水平非常低,与正常小鼠肝脏相当。通过对比,几乎所有肿瘤组织的pdia4糖基化水平都升高或显著升高(图2g、2h、8h)。一些非肿瘤组织也显示pdia4升高,这可能反映了这些肝脏通常处于患病状态。当成对比较时,约65%的肿瘤组织比非肿瘤组织具有更高的ero-糖基化水平。总之,这些结果确定galnt在肝肿瘤中迁移到er,并且表明gala驱动所观察到的tn水平的升高。实施例2肝肿瘤表达高水平的galnt1为了探讨肝细胞癌(hcc)中涉及哪些galnt,分析了来自22例肝细胞癌(hcc)患者的成对的正常(n)和患病(t)样品中所有家族成员的表达水平(图2i)。用借助于组织病理学评估确定的正常、肝细胞腺瘤(hca)和肝细胞癌(hcc)三个组,平行地分析了12只小鼠样品(图8e)。有趣的是,相对少的galnt被上调:galnt1、-t10和-t11在人和小鼠中均升高,而galnt4和-t6似乎对小鼠和人肿瘤分别具有特异性(图8f和8g)。相反,galnt3、-t13和-t14在两个物种中均被下调(图8f和8g)。这些数据表明,galnt异构体对肿瘤的发展并非都具有相同的作用。此外,异构体在底物特异性上也有差异,其中galnt1是正常肝组织中的主要酶。这些结果证实了galnt1在肝细胞癌(hcc)中的作用。实施例3靶向er的galnt1使肿瘤发展速度加倍为了直接测试galnt1的er重定位的效果,生成了组成型(constitutively)靶向er的嵌合形式的酶。在肿瘤诱导系统中,向小鼠注射编码gfp或gfp标记形式的野生型galnt1(高尔基体-g1)、er定位的galnt1(er-g1)或er-g1催化失活(er-g1δcat)的质粒(图3a)。注射后,监测小鼠的存活率:对照(gfp)小鼠和er-g1δcat小鼠的中位生存期是注射后23周(wpi);er-g1小鼠是注射后10周(wpi)(图3b);而高尔基体-g1(wt)小鼠是注射后17周(wpi)。这表明er定位的galnt1(er-g1)致使死亡率更高。注射后6周(wpi),约40%的er-g1小鼠垂死,而对照中未观察到死亡。在这一阶段,每组处死9只小鼠以进行评估。在肝脏中发现了明显差异,与对照组相比,er-g1组的结节约为5倍多且肿瘤肿更大(图3c)。高尔基体-g1小鼠显示中等丰度的结节形成。检查的所有肿瘤的gfp和mcherry表达均为阳性,表明成功共表达转基因。在对照小鼠中,9/9肿瘤呈现低tn水平,而在er-g1组中,所有肿瘤均呈现高tn水平;高尔基体-g1肿瘤呈现多变的中等水平(图3d)。对照组小鼠的肿瘤边缘清晰,而er-g1小鼠则呈现多灶性肿瘤,肿瘤细胞在正常组织内相互交错(图3d)。实施例4er-g1从早期开始促进肿瘤生长为了探索er-g1如何刺激肿瘤生长,研究了何时可以检测到其作用。观察到转染的肝细胞早在注射后3天(dpi)就可通过gfp和mcherry标记被清楚地检测到,其中小鼠中的转染细胞数在所有情况下均一致(图4a-4d)。证实galnt1构建体的表达水平在转录本和蛋白质水平上相似(图9a和9b)。与其它条件不同,er-g1转染的细胞被长柔毛野豌豆凝集素(vvl)强烈标记,表明构建体的表达重现了在晚期自然肿瘤中观察到的高tn水平(图4c和4e)。注射后3天(dpi),大多数gfp/mcherry阳性细胞表现为单个分离细胞,表明细胞分裂很少。在注射了对照质粒的小鼠中,这种现象在注射后7天(dpi)没有明显改变,表明转化细胞的初始平均倍增时间至少为约6天。通过对比,在表达er-g1的细胞中观察到了转染的细胞簇,表明细胞分裂和小结节形成。这些结节的大小通过测量其平均面积来定量(图4f、4g、4h、9c和9d),而且,早在注射后7天(dpi)就测量到在表达er-g1的条件下其大小增加到4倍(图4f、4g和4h)。表达高尔基体-g1的细胞始终呈现出中间表型(图4f、4g和4h)。实施例5er-g1表达不诱导肿瘤形成,也不促进体外增殖为测试er-g1是否像癌基因样nras-g12v一样发挥作用,向6只小鼠注射er-g1和shp53以及对照组(nras/shp53)。组织学分析证实,在两种条件下均转染了相似比例的细胞。但是,与nras/shp53组的小鼠不同,er-g1/shp53小鼠没有经历任何致死现象(图9e)。注射后40周(wpi),来自er-g1/shp53小鼠的肝脏未呈现任何可见的结节(图9f)。但是,在这些肝脏中检测到大量的tn阳性细胞,表明在没有nras的情况下er-g1的表达无毒,但不诱导细胞生长或增殖(图9g)。为了测试er-g1是否促进体外增殖,衍生了一系列在肝细胞癌(hcc)衍生的hepg2细胞中表达gfp、高尔基体-g1或er-g1的稳定细胞系。验证了构建体的亚细胞定位,特别是er-g1与er标记物钙联结蛋白共定位(图10a)。与gfp和高尔基体-g1细胞相比,er-g1hepg2细胞的tn染色水平提高到50倍,其中高尔基体-g1的过表达没有显著影响(图10b和10c)。但是,这些酶的表达水平是相似的,高尔基体-g1水平甚至稍微更高(图10d)。观察到所有细胞系的平均倍增时间相似,其在24小时左右(图4i)。因此,er-g1不能刺激体外增殖,也不能在体内诱导肿瘤形成,但是从很早阶段就刺激肿瘤的生长。这表明er-g1通过使肿瘤扩大而不是直接刺激细胞生长和分裂来刺激癌细胞增殖。实施例6er-g1促进组织侵入、转移和ecm降解根据肿瘤形态,假设er-g1通过促进组织重塑和浸润来刺激肿瘤生长。一致地,在注射后约16周(wpi)死亡的、注射er-g1的小鼠中,在各个器官中,特别是在肺中观察到了转移(图5a-5c)。对照小鼠未呈现转移,其中在高尔基体-g1小鼠中很少发生(图5a)。循环肿瘤细胞(ctc)揭示癌症逃脱原生环境的强大能力。处死时在3/4er-g1小鼠中发现了显著水平的ctc,但在同一阶段的对照小鼠中未检测到ctc(图5d)。解剖后,观察到肿瘤频频附着于并浸润邻近器官,例如胰腺(图5c)、隔膜、脾、肾、胃、皮肤和腹膜肌肉(图11a-11e)。对照组和高尔基体-g1组中实际上没有这种高度浸润性肿瘤的表型。实施例7er-g1诱导ecm降解就这一点的结果表明,er-g1肿瘤细胞更有效地浸润周围组织并脱离其起源组织,这通常取决于裂解ecm组分并因此表达基质蛋白酶的能力。一致地,5/5er-g1肿瘤裂解物显示的基质金属蛋白酶(mmp)活性水平明显高于正常肝脏,比早期对照肿瘤高4/5(图5e和5f)。一般而言,癌细胞倾向于具有更高的基质金属蛋白酶(mmp)活性,但研究表明,巨噬细胞或与癌症相关的成纤维细胞在基质降解中起关键作用。为了测试er-g1是否可以以细胞自主方式刺激基质降解,在稳定hepg2细胞系中测试了基质金属蛋白酶(mmp)活性。er-g1细胞表现出更高的基质金属蛋白酶(mmp)活性(图5g),并且当将细胞接种在荧光标记明胶纸上时,显示降解增加到6倍(图5h和5i)。实施例8galnt1的er定位诱导基质金属蛋白酶-14(mmp14)高糖基化大量研究指出,膜束缚膜1型(membrane-tetheredmembranetype1)基质金属蛋白酶(mt1-mmp,别名基质金属蛋白酶-14(mmp14))是定位ecm分解的关键酶。为了测试基质金属蛋白酶-14(mmp14)的重要性,针对其耗尽蛋白质的能力,选择了两个不同的小干扰性核糖核酸(sirna)库(图12a)。这些小干扰性核糖核酸(sirna)库消除了由er-g1诱导的明胶降解增加,表明基质金属蛋白酶-14(mmp14)介导er-g1的作用(图6a和6b)。接下来,使基质金属蛋白酶-14(mmp14)在hepg2细胞系中过表达。这些细胞系迅速消化了明胶膜。三螺旋结构形式的天然胶原比明胶中的变性胶原更耐蛋白水解。当在明胶顶部添加一层胶原i时,降解减慢,并且mmp14转染的er-g1细胞(er-g1+mmp14wt)的活性明显高于mmp14转染的对照细胞(gfp+mmp14wt)(图6c和6d)。总体而言,这些数据表明er-g1表达上调了基质金属蛋白酶-14(mmp14)的活性。已知基质金属蛋白酶-14(mmp14)在位于残基t291与s304之间的铰链结构域中的五个残基上被o-糖基化,关于s304的糖基化仍在争论中(图6e)。为了测试er-g1是否刺激基质金属蛋白酶-14(mmp14)的糖基化,使用长柔毛野豌豆凝集素(vvl)下拉(pulldown)tn修饰的蛋白,并在注射后6周(wpi)探查衍生自表达er-g1的肿瘤的肝肿瘤中的基质金属蛋白酶-14(mmp14)(图6f)。注射后6周和24周(wpi),对照肿瘤也采用类似的方法(图6g)。er-g1肿瘤中的基质金属蛋白酶-14(mmp14)蛋白水平升高更多,而tn水平却明显更高。此外,在注射后24周(wpi)的对照肿瘤中还观察到更高水平的糖基化(图6g)。为了验证这些作用是否具有细胞自主性,在hepg2衍生的细胞系中测试了基质金属蛋白酶-14(mmp14)糖基化。但是,内源性基质金属蛋白酶-14(mmp14)水平低,tn信号非常弱。可能的并发症在于,基质金属蛋白酶-14(mmp14)上的o-聚糖在运输蛋白质通过高尔基体之后被修饰。另一种方法通过在hepg2cosmc-/-细胞的背景中重新衍生高尔基体-g1和er-g1细胞系来测试。这些细胞无法通过半乳糖来扩展n-乙酰半乳糖胺(galnac)糖,并且只能用唾液酸封端n-乙酰半乳糖胺(galnac),其可以通过神经氨酸酶处理除去。这些hepg2cosmc-/-细胞被各种mcherry标记的基质金属蛋白酶-14(mmp14)转染,随后对其进行免疫沉淀并探测tn。在这些条件下,与高尔基体-g1相比,表达er-g1的细胞中的基质金属蛋白酶-14(mmp14)显著增加(图6h)。tn信号取决于铰链结构域中的残基簇,因为此簇的突变体呈现出降低的糖基化(图6h)(参见下文对突变体的描述)。评估糖基化水平的另一种方法是使用n-乙酰半乳糖胺(galnac)的叠氮化物修饰的类似物,称为galnaz,对o-聚糖进行代谢标记。一旦掺入糖蛋白后,残基可以通过点击化学修饰并缀合到flag肽。观察到的是,与gfp细胞相比,表达er-g1的hepg2细胞系中galnaz的掺入增加到约3.5倍(图12b和12c)。最后,使用凝集素,例如花生凝集素(pna)和曼陀罗凝集素(dsl)可以部分地检测到扩展的o-聚糖(图12d)。使用两种凝集素,与对照和表达高尔基体-g1的细胞相比,观察到表达er-g1的细胞中的基质金属蛋白酶-14(mmp14)的反应性增加(图6i)。总体而言,这些方法表明galnt1在er中的定位致使基质金属蛋白酶-14(mmp14)的糖基化增加到2.5倍到8倍,这取决于所使用的技术。实施例9基质金属蛋白酶-14(mmp14)糖基化对于ecm降解至关重要为了验证基质金属蛋白酶-14(mmp14)的糖基化增加发生在先前识别的残基上,生成了三种基质金属蛋白酶-14(mmp14)的突变体形式:单点突变体t291a;带有四个丙氨酸取代的突变体t299a-t300a-s301a-s304a(t(4)a);以及带有五个丙氨酸取代的一个突变体t291a-t299a-t300a-s301a-s304a(t(5)a)。这些糖基化突变体呈现出所预期的凝集素结合减少(图6h和6i)。已提出铰链区域中的糖基化影响基质金属蛋白酶-14(mmp14)的成熟和稳定性。但是,突变体未呈现出基质金属蛋白酶-14(mmp14)表达水平上的巨大变化(图6h、6i和12f)。原蛋白形式和活性形式在hepg2细胞系中都相对恒定,表明糖基化不影响这些细胞中基质金属蛋白酶-14(mmp14)的稳定性(图12e和12f)。已知基质金属蛋白酶-14(mmp14)自裂解生成44-kda的形式。与基质金属蛋白酶-14(mmp14)的催化失活形式(mmp14-e240a)相反,糖基化突变体表现出该短的形式,表明其在自蛋白水解中具有活性,与先前的报道一致(图6h、6i和12f)。但是,当在基于细胞的ecm降解测定中进行测试时,mmp14-t(4)a和mmp14-t(5)a突变体的活性完全丧失,与e240a突变体相当(图6j和6k)。因此,基质金属蛋白酶-14(mmp14)糖基化对于ecm降解至关重要。使用未透化的细胞,通过定量免疫荧光法在三个hepg2细胞系中测量了内源性基质金属蛋白酶-14(mmp14)的细胞表面暴露(图12g和12h)。尽管基质金属蛋白酶-14(mmp14)小干扰性核糖核酸(sirna)耗尽明显减少了信号,但对表达er-g1的细胞没有明显作用,这表明运输到细胞表面并不需要进行糖基化(图12g和12h)。对基质金属蛋白酶-14(mmp14)细胞内分布的进一步分析未揭示基质金属蛋白酶-14(mmp14)在细胞内分布的重要变化(图12i)。总之,这些数据表明糖基化不影响基质金属蛋白酶-14(mmp14)的运输或细胞表面稳定性。相比之下,使用荧光底物测定进行的基质金属蛋白酶(mmp)活性测量表明,糖基化对基质金属蛋白酶-14(mmp14)活性有直接影响(图13a)。实际上,与野生型基质金属蛋白酶-14(mmp14)相比,t(5)a突变体呈现出活性显著降低(图13a)。实施例10基质金属蛋白酶-14(mmp14)糖基化从早期开始促进肿瘤生长为了测试基质金属蛋白酶-14(mmp14)在er-g1诱导肿瘤生长中起什么作用,将针对基质金属蛋白酶-14(mmp14)的shrna(shmmp14)与er-g1/nras/shp53共表达。注射后1周(wpi),肝肿瘤中基质金属蛋白酶-14(mmp14)的表达降低了约70%(图13b)。在这些条件下,肿瘤发展的速率降低,其中位生存期是18周,而er-g1/nras/shp53是12周(图7a)。ctc形成减少到与对照小鼠相当的水平(图7b)。在存在shmmp14的情况下形成的晚期肿瘤的浸润性较小、分化程度更高,并且产生的转移要少得多(图7c)。这些数据表明,er-g1诱导的浸润性表型取决于基质金属蛋白酶-14(mmp14)活性。还观察到在注射后1周(wpi)表达er-g1的肿瘤的增殖速率由于基质金属蛋白酶-14(mmp14)的敲低而显著降低,表明该蛋白酶从早期开始起了促进作用。为了进一步验证这一观点,生成了具有表达mmp14/er-g1/nras/shp53(er-g1+mmp14)的肝细胞的小鼠。基质金属蛋白酶-14(mmp14)水平的升高致使注射后7天(dpi)的增殖显著加速(图7d和7e)。这种加速依赖于增强的糖基化,因为在不存在er-g1(gfp+mmp14)的情况下基质金属蛋白酶-14(mmp14)的表达刺激的增殖要少得多。如在er-g1/nras/shp53环境中表达mmp14-t(5)a不刺激生长这一事实所表明的,基质金属蛋白酶-14(mmp14)本身的糖基化是必需的。在表达重组基质金属蛋白酶-14(mmp14)的肿瘤中,大多数蛋白质似乎是细胞质的,其中在细胞表面有一些染色(图13c)。类似于细胞系中的结果,基质金属蛋白酶-14(mmp14)亚细胞分布的任何明显变化都不归因于糖基化状态。总之,这些结果表明,通过er特异性糖基化实现的活化通过促进基质金属蛋白酶-14(mmp14)活性来至少部分地促进肿瘤生长。总之,galnt从高尔基体迁移到er,致使tn水平升高。几乎所有人和小鼠肿瘤中都发现了聚糖增加的胞质(即er样)tn式样。er驻留蛋白pdia4的糖基化是此迁移的另一个标志,并且在4/4晚期和2/3早期小鼠肿瘤中被上调,而且在大多数人肿瘤中均增加。由于galnt迁移是高度受控的事件,因此gala必须赋予肿瘤细胞竞争优势,其中gala从最初的细胞分裂事件开始就加速肿瘤生长。除pdia4外,长柔毛野豌豆凝集素(vvl)免疫印迹和关于galnt底物的现有知识表明,galnt的er定位刺激多种底物的糖基化,从而可能活化多种有利于肿瘤生长的因子。要注意的是,er-g1肿瘤似乎比对照肿瘤积聚明显更多的ecm。这项研究表明,galnt迁移过程的成员和o-糖基化的er定位引发实现了肿瘤生长,并且可用于检测和表征。seqidno说明下表1详细列出了本文引用的seqidno及其相应的序列。还提供了序列的简要说明。表1.seqid的说明前述实例的提出是为了说明本发明,而不应解释为对本发明范围施加任何限制。显然,在不脱离本发明基本精神的前提下,可以对在上文中所述并且在实例中阐述的本发明的具体实施方案进行许多修改和变更。所有这些修改和变更都旨在被本申请所涵盖。材料和方法实验模型和受试者详细信息细胞系hepg2细胞(雄性)获自美国菌种保存中心(americantypeculturecollection,atcc),并保存在含15%胎牛血清(fbs)的dmem中。所有细胞系均在37℃在10%co2培养箱中生长。动物研究从生物资源中心(brc,生物医学科学研究所(biomedicalsciencesinstitute),a*star)获得六到八周龄的c57bl/6j雄性小鼠。为了进行流体动力尾静脉注射,将小鼠保持在尾静脉注射限制器(tailveinerrestrainer)(braintreescientificinc.,us)中,并使用27号针在≤8秒内通过侧尾静脉注射相当于其体重10%的溶液体积。每只动物均接受15μg编码转座酶的质粒(ppgk-sb13)、30μgpt2/pgk/mcherry-nras质粒和15μg具有目的基因(goi)的pt2/shp53/pgk质粒。使用endofreemaxikit(qiagen)制备质粒。dna悬浮在lactatedringer’sinjection(乳酸林格注射液)(baxter)中。每周两次监测小鼠的总体健康状况和肿瘤负荷。当通过触诊估计肿瘤大小为1-2.0cm直径或更大时,对小鼠实施安乐死并进行尸体剖检。将肉眼所见的肝肿瘤保存起来用于组织病理学检查和分子分析。小鼠垂死时以其它方式对其实施安乐死并进行完整尸体剖检。将组织速冻或固定在10%福尔马林溶液(sigmaaldrich)中,并包埋石蜡。对于组织学,对5μm切片进行苏木精和伊红(h&e)染色处理。病理学家根据已公布的组织学标准对肝病变和肝细胞癌(hcc)的组织学分类进行了审查。所有动物实验均按照生物资源中心(brc,生物医学科学研究所,a*star)批准的机构动物护理和使用委员会(institutionalanimalcareandusecommittee)指南进行。人肿瘤微阵列人肿瘤微阵列bc03002和lv8011购自美国biomax,inc.(rockville,md)。tma包括具有明确临床阶段和病理等级的肝脏疾病谱(肝细胞癌进展)。有关图8a所示的肿瘤核心的苏木精和伊红(h&e)染色图像和分类的详细信息,请参见http://www.biomax.us/tissue-arrays/liver/lv8011和http://www.biomax.us/tissue-arrays/liver/bc03002。患者的知情同意和批准从美国biomax,inc获得,依据新加坡humanbiologicalresearchact(人类生物学研究法)的规定被匿名使用样品。用于基因表达分析的人类样品从1991年至2009年在新加坡国家癌症中心(nationalcancercentre,ncc)接受根治性肝细胞癌(hcc)切除术的患者中获得人肝样品。新加坡ncc机构审查委员会(institutionalreviewboard)批准了肿瘤和邻近正常肝组织的收集以及用于研究的用途。获得了所有参与患者的书面知情同意,并且提供给研究人员的所有临床和组织病理学数据均被匿名。在先前的研究中已经报道了患者的人口统计学和临床描述。用于蛋白质分析的人类样品从2014年至2015年在新加坡国家癌症中心从肝细胞癌(hcc)患者获得人肝样品。从接受作为肝细胞癌(hcc)根治疗法的手术切除的患者中获得癌性和相应的远处非癌性肝组织。本研究中使用的所有组织样品均已获得新加坡国家癌症中心组织库(tissuerepository)的批准并由其提供,并根据其伦理委员会的政策进行。获得了所有参与患者的知情同意,并且提供给研究人员的所有临床和组织病理学数据均被匿名。立即将所有组织在液氮中速冻直至使用。有关人肝细胞癌(hcc)患者的信息可见下表2。lcfg患者id性别年龄种族病毒状态f0009m69华人hbvf0012m84华人nilf0016m58华人hbvf0017m78华人nilf0019f56华人hbvf0022m71华人nilf0025m75华人nilf0026f74华人nilf0028m64印第安人nilf0031m57其它hcvf0034m74华人hbvf0036f71华人hbvf0037m74华人nilf0038f47其它hcvf0039f74华人nilf0040m30华人hbvf0042f57华人hbvf0046f78华人hbvf0049m58华人nilf0052m60华人nilf0074f80华人nil表2.有关人肝细胞癌(hcc)患者的信息。方法详细信息载体克隆为了构建睡美人载体,将载体pt2/shp53/gfp4用xhoi消化并且连接到genscriptusainc.的2176-bpxhoi/sali合成片段。该片段包括shp53序列、磷酸甘油酸激酶(pgk)启动子,然后是egfp和多个克隆位点(mcs)以帮助克隆。所得的名为pt2/shp53/pgk-egfp的载体用于插入不同的目的基因(goi)。此研究中使用了小鼠galnt1(nm_013814)。由genscriptusainc.合成galnt1(或高尔基体-g1)、er-g1(与来自人生长激素的er信号序列融合)、具有催化结构域突变d156q、d209n、h211d(以阻断底物和锰结合)的er-g1。然后通过avrii位点将这些goi克隆到载体pt2/shp53/pgk-egfp中,并使其在c端融合到egfp。用ecorv/xhoi切割另一种载体pt/caggs-nrasv12,以除去cagg启动子,并将其连接到1884-bpecorv/sali片段,该片段具有控制与人nrasg12v融合的mcherry的表达的pgk启动子。所得载体命名为pt2/pgk/mcherry-nras。在这项研究中使用了含有某形式(version)的sb10转座酶的ppgk-sb13。通过两个bglii位点将合成的shmmp14编码序列插入pt2/pgk/mcherry-nras中,以获得pt2/shmmp14/pgk/mcherry-nras构建体。为生成pt2/pgk/mcherry-nras-2a-mmp14-wt和pt2/pgk/mcherry-nras-2a-mmp14-t(5)a载体,对含有2a自裂解序列的人mmp14野生型和突变体进行了基因合成(genscript),然后通过两个sacii位点将其克隆到载体pt2/pgk/mcherry-nras中。以下载体已保存在addgene。pt2/pgk/mcherry-nras的id#100974;pt2/shp53/pgk-egfp的id#100975;pt2/shp53/pgk/golgig1的id#100976;pt2/shp53/pgk/er-g1的id#100977和pt2/shp53/pgk/er-g1δcat的id#100978。为了构建plenti6.3载体,对人galnt1(nm_020474)和人mmp14(nm_004995)野生型和突变体进行了基因合成(genscript),并将其克隆到pdonr221入门载体(thermofisherscientific)中。然后使用通路(gateway)lr克隆反应将入门克隆体亚克隆到相应的plenti6.3目的载体中。关于所用质粒的列表,还参见表3。表3.使用的质粒和引物列表。定量rt-pcr(qrt-pcr)按照制造商的说明,使用trizol(invitrogen)提取总rna,并使用superscriptiiicdna合成试剂盒(invitrogen)将其反转录为cdna。使用fluidigmbiomark实时pcr系统和48.48microfluidicdynamicarray(微流体动态阵列)进行qrt-pcr分析。引物序列是通过引物表达软件(primerexpresssoftware)v3设计的,并列于表1和表3中。对于特异性靶标扩增(sta)预扩增反应,将每个cdna样品在5μl反应中用200nm合并的sta引物混合物和tagmanpreampmastermix(appliedbiosystems)进行预扩增,这根据制造商的方案运行14个循环。为了除去未掺入的引物,在37℃孵育30分钟后,将每个样品用核酸外切酶i(thermofisherscientific)进行处理。为了失活,将混合物在第二步中,在80℃孵育15分钟。在核酸外切酶i处理结束时,将反应物在te缓冲液(ph8.0)中以1:5稀释,然后用于qrt-pcr。使用fluidigmbiomarktm实时pcr系统和48.48microfluidicdynamicarray进行高通量qrt-pcr分析。由于每个入口(inlet)的体积为5μl,因此超额制备每入口6μl体积。对于样品,将2.7μl的每个sta和exoi处理的样品与20xdnabindingdyesampleloadingreagent(dna结合染料样品上样试剂)(fluidigm)以及具有低rox的2xssofastevagreensupermix(bio-rad)进行混合。对于基因表达测定,在添加1xte缓冲液至6μl体积后,将0.3μl混合引物对(100um)与2xassayloadingreagent(测定上样试剂)(fluidigm)一起添加。在将样品和测定物加载到入口之前,先使芯片在nanoflex4-ifc控制器中接触抗原(primed)。然后将样品和测定物加载到动态阵列的入口中。在通过ifc控制器将样品和测定物加载并混合到芯片中之后,在以下反应条件下进行pcr:50℃下进行2分钟,95℃下进行10分钟,然后是40个循环(95℃下进行15秒和60℃下进行60秒)。自动为整个芯片计算全局阈值和线性基线校正。atcb、gusb和atcb、gusb分别用作人和小鼠样品中的内部对照基因。使用比较循环阈值ct方法,根据下式计算肝肿瘤与相邻非肿瘤样品之间goi表达的倍数变化:2-δct(肿瘤)/2-δct(非肿瘤)。此计算中所获得的-δct数据用于通过dchip软件(www.dchip.org)生成热图以及样品之间被监督的分级聚类。采用质心连锁方法,将从整体中减去的皮尔逊相关系数用作距离度量,这提供(-2,2)范围内的有界距离。用于功能富集的p值阈值<0.01。与正常组织相比,在人和小鼠肝脏肿瘤中识别出显著差异表达的基因,其倍数变化≥1.5并且p≤0.05(t检验)。免疫组织化学(ihc)使样品在bond脱蜡溶液(bonddewaxsolution)中脱蜡,并通过100%乙醇重新水合到1×bond洗液(leicabiosystems)。使用bond表位修复溶液(bondepitoperetrievalsolution)将样品在100℃下煮沸40分钟以进行抗原修复,然后用3%过氧化氢处理15分钟,再与10%山羊血清块孵育30分钟。随后在室温下用长柔毛野豌豆凝集素(vvl)-生物素(1:1000)染色60分钟。用bond洗液冲洗三次后,将样品与次级链霉亲和素-hrp抗体(1:200)在室温下孵育30分钟。按照制造商的说明,使用bond精制检测试剂盒(bondrefinedetectionkit)(leica)使指示辣根过氧化物酶(hrp-dab)活性的信号可视化。细胞核用苏木精复染5分钟,脱水,然后固定以进行显微镜检查。通过fac分析检测循环肿瘤细胞在注射后3到4个月从对照、高尔基体-g1和er-g1小鼠中收集血液(300μl),并在室温下用10ml氯化铵-钾(ack)裂解缓冲液(thermofisherscientific)进行处理,以裂解红细胞。将细胞团块悬浮在含有2mmedta和2%fbs的pbs中,并通过流式细胞仪(mofloxdp,beckmancoulter)分析egfp+细胞的数量。数据表示为门控细胞(gatedcell)中egfp+细胞的百分比;采集时分析了约100,000个细胞。用生长因子刺激在生长因子刺激之前,先用dulbecco磷酸盐缓冲盐水(d-pbs)将hek293t细胞洗涤两次,然后使血清在无血清dmem中饥饿至少16小时。在裂解之前,添加人重组egf(100ng/ml;sigma-aldrich)或小鼠重组pdgf-bb(50ng/ml;invitrogen),持续各种时间。蛋白质印迹分析称重收获的肝组织,并在冰冷ripa裂解缓冲液(50mmtris[ph8.0,4℃]、200mmnacl、0.5%np-40和完全蛋白酶抑制剂[rocheappliedscience])中均化。在持续搅拌下将样品裂解1小时,然后通过在4℃以13000×g离心分离10分钟进行澄清。为了制备细胞,将细胞系用冰冷d-pbs洗涤两次,在冰冷ripa裂解缓冲液中刮取,并在不断搅拌下裂解30分钟,然后对样品进行澄清。使用bradford试剂(bio-rad)测定澄清的裂解物蛋白浓度,然后将样品标准化以进行免疫沉淀(ip)或在200v使用4-12%bis-trisnupage凝胶进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)电泳,持续60分钟。将电泳后的样品转移到硝酸纤维素膜上,并使用溶于tbst(50mmtris[ph8.0,4℃]、150mmnacl和0.1%tween-20)的3%bsa在室温下封闭1小时。然后将膜与一抗或生物素化长柔毛野豌豆凝集素(vvl)(0.2μg/ml)在4℃孵育过夜。第二天,将膜在tbst中清洗3次,然后添加与辣根过氧化物酶(hrp)或链霉亲和素-hrp偶联的二抗。将膜用tbst进一步洗涤3次,然后进行ecl暴露。凝集素免疫沉淀(ip)将澄清的细胞/组织裂解物与偶联有长柔毛野豌豆凝集素(vvl)的珠在4℃孵育2小时。将珠用ripa裂解缓冲液至少洗涤3次,然后通过在95℃煮沸10分钟将沉淀的蛋白质在含50mmdtt的2xlds样品缓冲液中进行洗脱。对于花生凝集素(pna)和曼陀罗凝集素(dsl)下拉,将细胞裂解物与生物素化的pna或dsl凝集素在补充有2mmcacl2和mgcl2的裂解缓冲液中于4℃孵育过夜。然后将凝集素结合蛋白与链霉亲和素珠在4℃免疫沉淀2小时,然后通过煮沸在含有50mmdtt的2xlds样品缓冲液中洗脱。galnaz代谢标记hepg2细胞系用200μmgalnaz代谢标记72小时。用ripa裂解缓冲液裂解细胞,并在持续搅拌下用250μm的flag-磷化氢将澄清的裂解物标记过夜。将flag-galnaz标记的蛋白与flag抗体(sigmaaldrich)免疫沉淀1小时,然后在4℃与g-琼脂糖孵育2小时。用裂解缓冲液将ip样品洗涤3次,然后在2×lds上样缓冲液中于95℃煮沸10分钟。通过使用4-12%bis-trisnupage凝胶在200v进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)电泳,持续60分钟,来分辨样品,然后将其转移到硝酸纤维素膜上。细胞表面生物素化用基质金属蛋白酶-14(mmp14)突变体转染hepg2细胞系,并使其生长至95%汇合,然后用不可渗透细胞的生物素化试剂sulfo-nhs-ss-biotin在4℃、在不断搅拌的同时进行细胞表面标记,持续30分钟。淬灭生物素化过程,然后收获细胞并裂解细胞。按照制造商的说明,使用pierce细胞表面蛋白分离试剂盒(thermofisherscientific)分离细胞表面蛋白。免疫荧光(if)显微镜检查以每孔20,000个细胞将细胞接种在96孔板(falcon)中,并在37℃与10%co2一起孵育过夜。将细胞用4%多聚甲醛在d-pbs溶液中固定10分钟,用d-pbs洗涤一次,然后再用0.2%tritonx-100再透化10分钟。然后将细胞用盖罩大蜗牛凝集素(hpl)和在2%fbs中稀释的hoechst33342在d-pbs中染色20分钟,然后用d-pbs洗涤3次,持续5分钟,再进行高通量共聚焦成像。在激光扫描共聚焦高通量显微镜(imagexpressultra,moleculardevices)上,使用20×planapo0.75na物镜依次采集每孔四个位点。对于小鼠样品,在与抗体孵育之前,需要对载玻片进行脱蜡、抗原修复和封闭步骤。针对长柔毛野豌豆凝集素(vvl)-生物素(4μg/ml)、钙联结蛋白(1:100,abcam,ab22595)和hoescht(1:10,000)进行过夜染色,并用抗兔alexafluor488(1:1000)或链霉亲和素-alexa594(1:400)二抗进行复染色,持续30分钟。用dapi对载玻片进行复染色,然后固定载玻片(vectashield),再进行共聚焦成像。基质金属蛋白酶(mmp)活性测定在持续搅拌下将hepg2细胞系或收获的肝组织在冰冷裂解缓冲液(50mmtris[ph8.0,4℃]、200mmnacl、0.5%np-40替代品和完全蛋白酶抑制剂[rocheappliedscience])中裂解1小时,然后通过在4℃以13,000×g离心10分钟使样品澄清。使用bradford测定来测量每个样品的总蛋白质水平。将总蛋白裂解物的100μg(hepg2细胞裂解物)和60μg(肝脏组织裂解物)添加到根据制造商方案制备的基质金属蛋白酶(mmp)共振能量转移(fret)肽底物溶液(abcam)中。在酶标仪(激发/发射=540/590nm)上以5分钟的间隔测量样品,以确定肽底物的裂解。对每种条件进行三次重复。基质降解测定将hepg2细胞接种在荧光红色明胶基质或分层的荧光红色明胶/胶原i基质上,持续2天。通过与5-羧基-x-罗丹明琥珀酰亚胺酯(thermofisherscientific)一起孵育,明胶与罗丹明偶联,将其涂在无菌盖玻片上20分钟。然后将盖玻片用0.5%戊二醛固定40分钟(electronmicroscopysciences),并用1×pbs洗涤3次。通过将稀释在d-pbs中的0.5mg/ml胶原i(corning)在37℃于包被的盖玻片上孵育4小时来制备分层红色明胶/胶原i盖玻片。罗丹明和核通道的共焦图像使用具有10×或20×物镜的共聚焦显微镜(zeisslsm700)获得。对于每种条件,至少采集30张图像。使用imagej软件对降解面积进行定量,由此使用阈值线(thresholdbar)手动描绘降解面积。然后将降解面积归一化为每个图像中的核数。细胞增殖测定将hepg2细胞系接种到24孔板中(每孔50,000个细胞),并在37℃孵育过夜,以使其粘附。将该板转移至incucyte系统(essenbioscience)中,以使用相差显微术进行实时成像。每6小时每孔拍摄16幅图像(重复三次),共7天。然后使用incucyte软件通过在每个时间点测量细胞汇合度来确定增殖水平。进行了三次独立的实验重复。定量与统计分析存活分析通过prism4(graphpad)计算卡普兰-迈耶存活曲线。使用对数秩检验比较不同小鼠队列之间死亡率的显著差异。prism4进行了学生t检验,以直接比较gfp(对照)和其它队列。基于多重比较的bonferroni校正,p值≤0.01被认为具有统计显著性。免疫组织化学(ihc)染色的定量使用leicascn400扫描所有免疫组织化学(ihc)载玻片,并通过ariol-slidepathdigitalimaginghub(leicamicrosystems)进行查看。使用该系统捕获的图像用于将人肿瘤核心和小鼠肝肿瘤中的长柔毛野豌豆凝集素(vvl)染色进行定量。免疫组织化学(ihc)图像首先通过ariol系统转换为负像。使用imagej计算和减去整个tma中的非特异性和复染色背景。将校正后的强度测量值除以总核心面积,以生成每个核心每像素的强度。最终归一化为每个阵列中所有正常组织核心的每个核心的每像素的平均强度,以便能够直接比较bc03002和lv8011阵列中的长柔毛野豌豆凝集素(vvl)染色。对于小鼠的肿瘤切片,通过imagej使用恒定图像计算器和减影(subtractbackground)。使用每切片至少三个视野(直径200μm)来测量长柔毛野豌豆凝集素(vvl)染色。然后将每个肿瘤切片的平均值归一化为对照或正常肝切片的平均面积。为了量化注射后1周小鼠肝脏中睡美人(sb)转座子转化细胞的面积,使用imagej分析了mcherry-nras染色的免疫组织化学(ihc)图像。首先将图像转换为8位灰度格式,并设置自动阈值以选择mcherry染色区域。使用“填充孔”工艺覆盖染色细胞内的未染色小区域。测量尺寸大于500像素2的每个对象的面积,并计算每个图像中每个对象的平均面积。对于概括的工作流程,请参照图9c和9d。免疫荧光(if)染色的定量使用metaxpress软件(版本3.1.0.89)进行图像分析。对于每个孔,使用软件中的transfluorht应用程序模块对总盖罩大蜗牛凝集素(hpl)染色强度和核数进行定量。量化每次实验中至少三个孔中的数百个细胞。共进行了三个实验重复。为了量化基质降解测定中的降解,使用imagej软件来量化降解面积。通过调节阈值选择降解区域,并测量图像中的总降解面积。然后将降解面积归一化为每个图像中的核数。从每个实验中,量化每种条件的至少30张图像。进行了三次独立的实验重复。除非另有说明,否则结果以平均值和标准偏差(sd)表示。使用学生t检验假设双尾高斯分布(two-tailedgaussiandistribution),对统计显著性进行测量。图中的星号表示统计显著性(*,p<0.05或p<0.01;**,p<0.001;***,p<0.0001)。蛋白质印迹带的定量使用imagej进行图像分析。为了量化条带的强度,将图像反转为黑色背景,并在目标条带上绘制框。考虑背景的平均强度,测量了框区域内条带的平均强度。序列表<110>新加坡科技研究局法德利克·巴德z·h·j·谢<120>检测和表征癌症的生物标志物<130>9869sg5215<150>10201708183v<151>2017-10-04<160>96<170>patentin版本3.5<210>1<211>18<212>dna<213>人工序列<220><223>与galnt1序列结合的正向引物<400>1cgtcacccttccagaaat18<210>2<211>18<212>dna<213>人工序列<220><223>与gfp序列结合的反向引物<400>2ccactgcaaagcttcttc18<210>3<211>19<212>dna<213>人工序列<220><223>与src序列结合的正向引物<400>3gctttggcgaggtgtggat19<210>4<211>19<212>dna<213>人工序列<220><223>与src序列结合的反向引物<400>4acatcgtgccaggcttcag19<210>5<211>23<212>dna<213>人工序列<220><223>与src序列结合的正向引物<400>5gtgagggagagtgagaccacaaa23<210>6<211>21<212>dna<213>人工序列<220><223>与src序列结合的反向引物<400>6ggcattgtcgaagtcggatac21<210>7<211>20<212>dna<213>人工序列<220><223>与gbf1序列结合的正向引物<400>7gaggcaaggactttgagcaa20<210>8<211>20<212>dna<213>人工序列<220><223>与gbf1序列结合的反向引物<400>8tctgctcctcaggcattaca20<210>9<211>17<212>dna<213>人工序列<220><223>与gbf1序列结合的正向引物<400>9gctgcccaccccaaatg17<210>10<211>20<212>dna<213>人工序列<220><223>与gbf1序列结合的反向引物<400>10tgaagggcacaccaccagta20<210>11<211>20<212>dna<213>人工序列<220><223>与arf1序列结合的正向引物<400>11gcttaagctgggtgagatcg20<210>12<211>20<212>dna<213>人工序列<220><223>与arf1序列结合的反向引物<400>12gtcccacacagtgaagctga20<210>13<211>21<212>dna<213>人工序列<220><223>与arf1序列结合的正向引物<400>13gcgccactacttccagaacac21<210>14<211>24<212>dna<213>人工序列<220><223>与arf1序列结合的反向引物<400>14gctctctgtcattgctgtccacta24<210>15<211>24<212>dna<213>人工序列<220><223>与galnt1序列结合的正向引物<400>15ctgattctcaaattccacgtcact24<210>16<211>24<212>dna<213>人工序列<220><223>与galnt1序列结合的反向引物<400>16gacactgattcgtttccacatttc24<210>17<211>22<212>dna<213>人工序列<220><223>与galnt1序列结合的正向引物<400>17gacttcctgctggtgacgttct22<210>18<211>20<212>dna<213>人工序列<220><223>与galnt1序列结合的反向引物<400>18ccccatttctccaggacctt20<210>19<211>20<212>dna<213>人工序列<220><223>与galnt2序列结合的正向引物<400>19gacgcctgagcagagaaggt20<210>20<211>19<212>dna<213>人工序列<220><223>与galnt2序列结合的反向引物<400>20cagcccaccagcaatcatg19<210>21<211>16<212>dna<213>人工序列<220><223>与galnt2序列结合的正向引物<400>21cgcagcggtgccttct16<210>22<211>22<212>dna<213>人工序列<220><223>与galnt2序列结合的反向引物<400>22gctccagcctgctctgaatatt22<210>23<211>21<212>dna<213>人工序列<220><223>与galnt3序列结合的正向引物<400>23ccacgttgcttagaactgtcc21<210>24<211>21<212>dna<213>人工序列<220><223>与galnt3序列结合的反向引物<400>24ccaaaatgatttccttcagca21<210>25<211>23<212>dna<213>人工序列<220><223>与galnt3序列结合的正向引物<400>25tgaaggagatcattttggtggat23<210>26<211>20<212>dna<213>人工序列<220><223>与galnt3序列结合的反向引物<400>26ttcctccagcttttcatgca20<210>27<211>19<212>dna<213>人工序列<220><223>与galnt4序列结合的正向引物<400>27gtctgattggggccacttt19<210>28<211>20<212>dna<213>人工序列<220><223>与galnt4序列结合的反向引物<400>28cagccaaccggaattacact20<210>29<211>21<212>dna<213>人工序列<220><223>与galnt4序列结合的正向引物<400>29tctttcagggtttggcagtgt21<210>30<211>16<212>dna<213>人工序列<220><223>与galnt4序列结合的反向引物<400>30gcccacgtgcgagcat16<210>31<211>20<212>dna<213>人工序列<220><223>与galnt5序列结合的正向引物<400>31caataacctcccaaccacca20<210>32<211>20<212>dna<213>人工序列<220><223>与galnt5序列结合的反向引物<400>32ggaggagagcgattgatgac20<210>33<211>22<212>dna<213>人工序列<220><223>与galnt5序列结合的正向引物<400>33cagtggacagagccattgaaga22<210>34<211>24<212>dna<213>人工序列<220><223>与galnt5序列结合的反向引物<400>34tgggaggtcattgtgaactagttg24<210>35<211>20<212>dna<213>人工序列<220><223>与galnt6序列结合的正向引物<400>35cgcaaagcagctgtgtctac20<210>36<211>20<212>dna<213>人工序列<220><223>与galnt6序列结合的反向引物<400>36tggctattcttgccagtgaa20<210>37<211>20<212>dna<213>人工序列<220><223>与galnt6序列结合的正向引物<400>37gcagaggtgctcacgttcct20<210>38<211>18<212>dna<213>人工序列<220><223>与galnt6序列结合的反向引物<400>38ctccagccagccgtgaaa18<210>39<211>20<212>dna<213>人工序列<220><223>与galnt7序列结合的正向引物<400>39tgcattgatagcatgggaaa20<210>40<211>20<212>dna<213>人工序列<220><223>与galnt7序列结合的反向引物<400>40gtggcagggtcctagttcaa20<210>41<211>19<212>dna<213>人工序列<220><223>与galnt7序列结合的正向引物<400>41ttggcgcacagaaggctaa19<210>42<211>20<212>dna<213>人工序列<220><223>与galnt7序列结合的反向引物<400>42cacctcacagtgggcatcaa20<210>43<211>20<212>dna<213>人工序列<220><223>与galnt8序列结合的正向引物<400>43tccactcttgaagccactcc20<210>44<211>20<212>dna<213>人工序列<220><223>与galnt8序列结合的反向引物<400>44ccctgatccaagcagacatt20<210>45<211>20<212>dna<213>人工序列<220><223>与galnt8序列结合的正向引物<400>45ccattatacaacgggccatc20<210>46<211>20<212>dna<213>人工序列<220><223>与galnt8序列结合的反向引物<400>46tgagctgaaatcatccacca20<210>47<211>20<212>dna<213>人工序列<220><223>与galnt9序列结合的正向引物<400>47aacgtgtacccggagatgag20<210>48<211>20<212>dna<213>人工序列<220><223>与galnt9序列结合的反向引物<400>48tccctggtccagacagtagg20<210>49<211>22<212>dna<213>人工序列<220><223>与galnt9序列结合的正向引物<400>49agccatcctctacccctgtcat22<210>50<211>21<212>dna<213>人工序列<220><223>与galnt9序列结合的反向引物<400>50caggagaccttcggcactgta21<210>51<211>20<212>dna<213>人工序列<220><223>与galnt10序列结合的正向引物<400>51tggatggatgagtacgcaga20<210>52<211>20<212>dna<213>人工序列<220><223>与galnt10序列结合的反向引物<400>52gctttttctggactgcgaca20<210>53<211>23<212>dna<213>人工序列<220><223>与galnt10序列结合的正向引物<400>53ctggcataacaaggaggctatca23<210>54<211>21<212>dna<213>人工序列<220><223>与galnt10序列结合的反向引物<400>54ggcttcccctgttctccatat21<210>55<211>20<212>dna<213>人工序列<220><223>与galnt11序列结合的正向引物<400>55acccaaagtccttcaacgtg20<210>56<211>20<212>dna<213>人工序列<220><223>与galnt11序列结合的反向引物<400>56gcatttgttggtctggaggt20<210>57<211>19<212>dna<213>人工序列<220><223>与galnt11序列结合的正向引物<400>57agagtcctgcagcgtggaa19<210>58<211>16<212>dna<213>人工序列<220><223>与galnt11序列结合的反向引物<400>58ctgggccaccaggcat16<210>59<211>20<212>dna<213>人工序列<220><223>与galnt12序列结合的正向引物<400>59tgaagcctggtcaactctcc20<210>60<211>20<212>dna<213>人工序列<220><223>与galnt12序列结合的反向引物<400>60gatatccggggatgtctcaa20<210>61<211>21<212>dna<213>人工序列<220><223>与galnt12序列结合的正向引物<400>61gggatgggtcagaaccagttt21<210>62<211>21<212>dna<213>人工序列<220><223>与galnt12序列结合的反向引物<400>62tggcgggtgttatagcgtatt21<210>63<211>21<212>dna<213>人工序列<220><223>与galnt13序列结合的正向引物<400>63gaagcttggagcactctcctt21<210>64<211>21<212>dna<213>人工序列<220><223>与galnt13序列结合的反向引物<400>64tggggaacgatttatcacact21<210>65<211>23<212>dna<213>人工序列<220><223>与galnt13序列结合的正向引物<400>65ggctgtgcttattccaaaagatg23<210>66<211>25<212>dna<213>人工序列<220><223>与galnt13序列结合的反向引物<400>66gccatgaggttaaactgattgattt25<210>67<211>20<212>dna<213>人工序列<220><223>与galnt14序列结合的正向引物<400>67ctaaagttgagcccctgtgc20<210>68<211>20<212>dna<213>人工序列<220><223>与galnt14序列结合的反向引物<400>68ccatacctgggactttgcat20<210>69<211>21<212>dna<213>人工序列<220><223>与galnt14序列结合的正向引物<400>69cagaaagctttgcgcctagac21<210>70<211>19<212>dna<213>人工序列<220><223>与galnt14序列结合的反向引物<400>70ccctccggctatgattgga19<210>71<211>20<212>dna<213>人工序列<220><223>与galntl1序列结合的正向引物<400>71caaccagctggagagtgaca20<210>72<211>20<212>dna<213>人工序列<220><223>与galntl1序列结合的反向引物<400>72ggtccgaggagtaggacaca20<210>73<211>20<212>dna<213>人工序列<220><223>与galntl1序列结合的正向引物<400>73tgtgacaggaacaccctcaa20<210>74<211>20<212>dna<213>人工序列<220><223>与galntl1序列结合的反向引物<400>74gctgacaggtacgccttctc20<210>75<211>20<212>dna<213>人工序列<220><223>与galntl2序列结合的正向引物<400>75cttccaggagaatgggatga20<210>76<211>20<212>dna<213>人工序列<220><223>与galntl2序列结合的反向引物<400>76ttgttttcttgcaccacagc20<210>77<211>20<212>dna<213>人工序列<220><223>与galntl2序列结合的正向引物<400>77tacaagtggcctgcctacag20<210>78<211>20<212>dna<213>人工序列<220><223>与galntl2序列结合的反向引物<400>78gcctcatcatggaagcagag20<210>79<211>20<212>dna<213>人工序列<220><223>与galntl4序列结合的正向引物<400>79cagcgtgtacccagagatga20<210>80<211>20<212>dna<213>人工序列<220><223>与galntl4序列结合的反向引物<400>80cagcactccataggcaatga20<210>81<211>20<212>dna<213>人工序列<220><223>与galntl4序列结合的正向引物<400>81gctggaccacttggagaatg20<210>82<211>20<212>dna<213>人工序列<220><223>与galntl4序列结合的反向引物<400>82gcaggagcctcttggatatg20<210>83<211>20<212>dna<213>人工序列<220><223>与galntl5序列结合的正向引物<400>83tggatttttggggaagagaa20<210>84<211>20<212>dna<213>人工序列<220><223>与galntl5序列结合的反向引物<400>84agagttggcctccacacatc20<210>85<211>20<212>dna<213>人工序列<220><223>与galntl5序列结合的正向引物<400>85ccaaggattgaggcgatatg20<210>86<211>20<212>dna<213>人工序列<220><223>与galntl5序列结合的反向引物<400>86tctctctcgatgcccagtct20<210>87<211>20<212>dna<213>人工序列<220><223>与galntl6序列结合的正向引物<400>87acaacagccccgttacactc20<210>88<211>19<212>dna<213>人工序列<220><223>与galntl6序列结合的反向引物<400>88tgttgctcacaggatggaa19<210>89<211>20<212>dna<213>人工序列<220><223>与galntl6序列结合的正向引物<400>89atggctcggttttccaaagt20<210>90<211>20<212>dna<213>人工序列<220><223>与galntl6序列结合的反向引物<400>90cggatgagaccttccctttt20<210>91<211>25<212>dna<213>人工序列<220><223>与c1galt1c1序列结合的正向引物<400>91ccttgtaaaacccaaagatgtgagt25<210>92<211>23<212>dna<213>人工序列<220><223>与c1galt1c1序列结合的反向引物<400>92tgtcacagtgtttggtccaagtc23<210>93<211>20<212>dna<213>人工序列<220><223>与c1galt1c1序列结合的正向引物<400>93acgccggagtatttgcagaa20<210>94<211>24<212>dna<213>人工序列<220><223>与c1galt1c1序列结合的反向引物<400>94ccaacggatttggtattaaacaca24<210>95<211>18<212>dna<213>人工序列<220><223>与外源galnt1-gfp序列结合的正向引物<400>95cgtcacccttccagaaat18<210>96<211>18<212>dna<213>人工序列<220><223>与外源galnt1-gfp序列结合的反向引物<400>96ccactgcaaagcttcttc18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1