检测非洲猪瘟病毒的分子探针、试剂盒及其应用的制作方法
本发明涉及基因检测技术领域,具体涉及一种检测非洲猪瘟病毒的分子探针、试剂盒及其应用。
背景技术:
非洲猪瘟病毒(asfv)感染家畜或野猪引起非洲猪瘟(asf),可导致高发病率和死亡率,并给养猪业造成巨大的经济损失。asfv于1921年在肯尼亚首次被发现,随后在非洲南部和东部的许多国家均发现asfv的存在。asf传播迅速、发病快,短短几十年就从非洲传至世界各地,几乎席卷全球。2018年8月2日下午17时,经中国动物卫生与流行病学中心诊断,沈阳市沈北新区沈北街道(新城子)五五社区发生疑似非洲猪瘟疫情,并于8月3日上午11时确诊。截至2018年8月3日15时,疫点内913头生猪已经全部扑杀和无害化。接着黑龙江、江苏、安徽等省份相继出现asf疫情。因此,目前当务之急是加强对asf的检疫及防控。
asfv的一些特征类似虹彩病毒和痘病毒,但其为非洲猪瘟病毒属(asfivirus)非洲猪瘟病毒科(asfarviridae)的唯一成员。asfv基因组为双链dna,大小在170至190kb之间。asfv是唯一一种已知的dna虫媒病毒,能够感染猪类,如家猪和野猪、灌木猪、疣猪和巨型森林猪,以及蜱虫类。蜱传播被认为是asfv在非洲地区的主要感染途径。然而,在南欧和拉丁美洲地区asf的爆发与进口感染asfv的肉制品以及随后该病毒感染当地蜱类密切相关。
猪感染asfv的临床特征是高烧、腹泻、出血和皮肤泛红。一些临床症状和尸检结果,如脾肿大、淋巴结和肾脏出血,与猪感染古典猪瘟病毒(csfv)的症状并无区别。因此,asfv的快速、可靠检测至关重要—asfv的快速检测不仅是asf防控所必需的,也是与其临床症状类似的猪疾病进行鉴别诊断所必需的。
目前,国外对非洲猪瘟诊断方法有红细胞吸附试验、直接免疫荧光试验、动物接种试验、elisa、聚合酶链反应等。其中红细胞吸附试验、直接免疫荧光试验的敏感性不高和特异性不强,动物接种试验不安全。实验室诊断asfv的常规方法是在猪骨髓(pbm)细胞培养中进行病毒分离(vi),尽管该方法可靠且敏感,但该检测所需时间过长(6天)。聚合酶链反应(pcr)是一种替代vi的快速检测asfv的方法,特别适用于筛选质量较差或降解的带有不可恢复病毒的样本。pcr技术使asfv的诊断能够在收样后数小时内完成,缩短了诊断时间。pcr检测非洲猪瘟病毒的方法具有特异、敏感、快速的特点,但有费时、易污染、扩增后需电泳检测和每次检测的样品数量少等特点。
因此,亟需研发新的、高效的检测非洲猪瘟病毒方法,以用于检测易感动物及相关动物制品中asfv核酸。
技术实现要素:
本发明要解决的技术问题是提供一种检测非洲猪瘟病毒(asfv)的分子探针、试剂盒及其应用,以解决现有检测技术可靠性和实用性差的技术问题。
为解决上述技术问题,本发明采用如下技术方案:
设计一种检测非洲猪瘟病毒的分子探针,其核苷酸序列为:
5'-x-ccaacccagtggtcatattaacgtatcc-3'-y,所述x为荧光报告基团,y为荧光淬灭基团。
优选的,所述荧光报告基团为fam、hex、tet中的任意一个。
优选的,所述荧光淬灭基团为tam-ra或bhq。
配制一种检测非洲猪瘟病毒的rt-pcr反应液,每22μl所述rt-pcr反应液由5pmol的所述分子探针1μl,50pmol的引物asfv-for1μl,50pmol的引物asfv-back1μl,taqmanreactionmix12.5μl和nuclease-freewater6.5μl组成;
所述引物asfv-for的核苷酸序列如seqidno.3所示;所述引物asfv-back的核苷酸序列如seqidno.4所示。
制备一种检测非洲猪瘟病毒rt-pcr反应液冻干粉,其制备方法为:
(1)配制reactionmixer;
每11.5mlreactionmixer由5pmol的所述分子探针500μl,taqmanreactionmix6250μl,50pmol的引物asfv-for500μl,50pmol的引物asfv-back500μl和nuclease-freewater3750μl组成;
所述引物asfv-for的核苷酸序列如seqidno.3所示;所述引物asfv-back的核苷酸序列如seqidno.4所示;
(2)取所配制的reactionmixer按照每瓶1ml的量分装至容量为10ml的安培瓶中,再避光冻干成粉末;
(3)将所得粉末置于-40~-80℃保存。
制备一种非洲猪瘟病毒检测试剂盒,含有所述分子探针、所述rt-pcr反应液或所述rt-pcr反应液冻干粉。
提供一种非洲猪瘟病毒的定性检测方法,包括以下步骤:
(1)提取待检样品dna;
(2)取所述rt-pcr反应液或将所述rt-pcr反应液冻干粉按照1mlnuclease-freewater每瓶的量稀释,得稀释反应液;
(3)取3μl所述样品dna加入22μl所述反应液或所述稀释反应液中进行rt-pcr反应;
(4)取rt-pcr反应产物进行琼脂糖凝胶电泳;
(5)若rt-pcr检测的ct值>40或电泳无扩增曲线,则待检样品为阴性;若rt-pcr检测的ct值<40且电泳有258bp的扩增曲线,则待检样品为阳性。
优选的,所述rt-pcr反应的反应程序为:1个循环50℃2min,1个循环95℃10min,40个循环95℃15second,58℃1min。
还提供一种非洲猪瘟病毒的定量检测方法,包括以下步骤:
(1)定量用标准品进行倍比稀释;
(2)提取待检样品dna;
(3)取所述rt-pcr反应液或将所述rt-pcr反应液冻干粉按照1mlnuclease-freewater每瓶的量稀释,得稀释反应液;
(4)取3μl所述倍比稀释标准品和所述待检样品dna加入22μl所述反应液或所述稀释反应液中进行rt-pcr反应;
(5)根据已知标准品浓度,计算出各个稀释度对应的核酸拷贝数;
(6)以定量用标准品的核酸拷贝数的对数值为y轴,以rt-pcr检测的ct值为x轴,作标准曲线;
(7)将待检样品的ct值代入标准曲线的线性回归方程中,即计算出其核酸拷贝数,即得其核酸浓度。
优选的,所述rt-pcr反应的反应程序为:1个循环50℃2min,1个循环95℃10min,40个循环95℃15second,58℃1min。
与现有技术相比,本发明的有益技术效果在于:
1.本发明的方法与传统的基于琼脂糖凝胶电泳的pcr方法相比,具有敏度性高、重复性好、特异性强的特点,检测速度快、结果客观、可定量、高通量等优点,有效克服了传统pcr和巢式pcr扩增产物必须电泳检测、耗时长、灵敏度低和无法定量的缺点。
2.本发明利用taqman分子探针的荧光型号可直接检测pcr扩增产物,无需开盖避免了污染,且更加快捷,实现无污染、高通量的检测。
3.本发明的方法可以作出一个定量的、客观的估计,对检测样品能进行准确判定,并明确界定了ct值为40.00是阳性结果和阴性结果的临界值。
4.本发明rt-pcr反应混合液的冻干粉能够长期保存,便于运输和携带。
5.本发明的方法灵敏性高,可准确检测出低含量的asfv病毒的样品、以及隐性感染或者是持续带毒宿主样品。
6.本发明的方法有效提高了pcr技术检测asfv的可靠性和易用性,能用于分离病毒的大批量样品的检测,有利于应用和推广。
附图说明
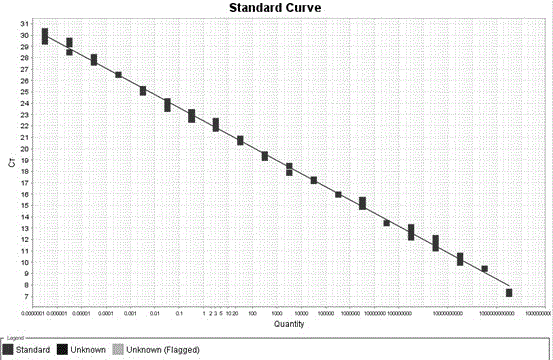
图1为realtime-pcr标准曲线图;
图2为realtime-pcr产物琼脂糖凝胶电泳图;
图中,1为marker2000,2~12为不同拷贝数的asfvvp72扩增,13为阴性对照;
图3为realtime-pcr敏感性评价图;
图4为csfv等病毒基因琼脂糖凝胶电泳图;
图中,1为marker2000,2为csfv,3为pcv2,4为prrsv(mac145),5为prrsv(pam),6为pedv,7为ppv;
图5为realtime-pcr特异性评价图;
图6为冻干反应液realtime-pcr标准曲线图;
图7为现配反应液realtime-pcr标准曲线图;
图8为商品化试剂盒realtime-pcr标准曲线图;
图9为现配反应液realtime-pcr敏感性评价图;
图10为冻干粉反应液realtime-pcr敏感性评价图;
图11为商业化试剂盒反应液realtime-pcr敏感性评价图。
具体实施方式
下面结合附图和实施例来说明本发明的具体实施方式,但以下实施例只是用来详细说明本发明,并不以任何方式限制本发明的范围。
在以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的试剂如无特别说明,均为市售常规试剂;所涉及的试验方法,如无特别说明,均为常规方法。
实施例1:设计一种用于检测asfv的分子探针
根据genebank上54株非洲猪瘟病毒vp72基因,比对筛选出vp72基因3'端核苷酸序列大小为258bp的保守序列,如seqidno.1所示:
cgtatccgatcacattacctattattaaaaacatttccgtaactgctcatggtatcaatcttatcgataaatttccatcaaagttctgcagctcttacatacccttccactacggaggcaatgcgattaaaacccccgatgatccgggtgcgatgatgattacctttgctttgaagccacgggaggaataccaacccagtggtcatattaacgtatccagagcaagagaattttatattagttgggacacggattacg。
以保守序列为靶基因,综合考虑各种因素并结合多年的实践经验,设计出一条分子探针,如seqidno.2所示:
5'-[6-carboxy-fluorescein(fam)]-ccaacccagtggtcatattaacgtatcc-3'-[6-carboxy-tetramethyl-rhodamine(tam-ra)]。
该探针5'端标记的荧光报告基团是6-carboxy-fluorescein(fam),该探针的3'端标记的荧光淬灭基团为6-carboxy-tetramethyl-rhodamine(tam-ra)。
实施例2:设计一种用于检测asfv的特异性引物
以seqidno.1所示的保守序列为靶基因,综合考虑各种因素并结合多年的实践经验,设计出一对特异性引物,如seqidno.3和seqidno.4所示:
asfv-for:5’-cgtatccgatcacattacc-3’
asfv-back:5’-cgtaatccgtgtcccaac-3’
实施例3:提取asfv总dna
(1)试剂配制:
分离缓冲液:10mmol/ltris-clph7.4,10mmol/lnacl,25mmol/ledta;
其他试剂:10%sds,蛋白激酶k(20mg/ml或粉剂),乙醚,酚:氯仿:异戊醇(25:24:1),无水乙醇及70%乙醇,5mol/lnacl,3mol/lnaac,te;
(2)切去组织5g左右,剔除结缔组织,用吸水纸吸干血液,剪碎(越碎越好),放入研钵中;
(3)倒入液氮,磨成粉末,加10ml分离缓冲液;
(4)加10ml10%sds,混匀,此时样品变得很粘稠;
(5)加50μl或1mg蛋白激酶k,37℃保温1~2h,指导组织完全解离;
(6)加1ml5mol/lnacl,混匀,5000rpm离心数秒钟;
(7)取上清液于新离心管,用等体积酚:氯仿:异戊醇(25:24:1)抽提,待分层后,3000rpm离心5min;
(8)取上层水相至干净离心管,加2倍体积乙醚抽提(在通风情况下操作);
(9)移去上层乙醚,保留下层水相;
(10)加1/10体积的3mol/lnaac,及2倍体积无水乙醇颠倒混合dna;室温下静置10~20min,dna沉淀形成白色絮状物;
(11)用玻璃棒勾出dna沉淀,在70%乙醇中漂洗,在吸水纸上吸干,溶解于1mlte中,-20℃保存;
(12)若dna溶液中有不溶解颗粒,可在5000rpm瞬时离心,取上清;若要除去其中的rna,可加5μlrnasea(10μg/μl),37℃保温30min,用酚抽提后,按照步骤(10)(11)重新沉淀dna。
实施例4:配制检测asfv的rt-pcr反应液
每个反应体系25μl,反应液的各组分及含量为:
实施例1的分子探针(5pmol)1μl;实施例2的asfv-for(50pmol)1μl;实施例2的asfv-back(50pmol)1μl;taqmanreactionmix12.5μl;nuclease-freewater6.5μl,配置成反应液。使用时取22μl的混合液加入定量板子的每个孔中,再向每孔加入3μl的模板。
实施例5:制备检测asfv的rt-pcr反应液的冻干粉
检测反应混合液冻干粉的制备方法如下:
配制11.5mlreactionmixer,按照500个反应体系计算:
实施例1的taqmanprobe,5pmol500μl(1×500);
taqmanreactionmix6250μl(12.5×500);
实施例2的asfv-for,50pmol500μl(1×500);
实施例2的asfv-back,50pmol500μl(1×500);
nuclease-freewater3750μl(7.5×500)。
将其分装至10ml安瓿瓶中,每瓶1mlreactionmixer,采用照生有限公司的freezonestopperingtraydryers系统将其冻干成粉末,将粉末置于-80℃冰箱保存,整个过程需要避光操作。
实施例6:设定检测asfv的反应程序
反应程序为:
1个循环50℃2min,1个循环95℃10min,40个循环95℃15second,58℃1min。
实施例7:检测asfv的方法
(1)在1.5ml离心管中,取实施例4配制的rt-pcr反应液,或将实施例5制备的reactionmixer冻干粉用1mlnuclease-freewater稀释液稀释;
(2)将22μl配制的rt-pcr反应液或稀释好的reactionmixer加入microamp®opticalreactionplate孔中;
(3)将3μl的模板加入(2)中的microamp®opticalreactionplate孔中;
(4)将反应板离心1min;
(5)按照实施例6所设置realtime-pcr程序并进行pcr扩增;
(6)配置1.5%的琼脂糖凝胶鉴定pcr扩增产物,根据ct值判读结果,ct值>40或无扩增曲线,为阴性,表示样品中无非洲猪瘟病毒;ct值<40,且出现典型的扩增曲线,为阳性,表示样品中存在非洲猪瘟病毒。
(7)定量判定方法为:
先根据标准品稀释制作标准曲线,对定量用标准品进行倍比稀释后与未知样品同时做rt-pcr检测;然后根据已知标品浓度,计算出各个稀释度对应的核酸拷贝数;以定量用标准品的核酸拷贝数的对数值为y轴,rt-pcr检测的ct值为x轴作散点图,添加趋势线,从而获得标准曲线、线性回归方程及r2;将样品的检测ct值代入标准曲线的线性回归方程中即可计算出未知样品的核酸拷贝数,进而得到核酸浓度。
实施例8:asfvrt-pcr检测方法标准曲线的绘制,及重复性、灵敏性和特异性的评价
(1)材料
rt-pcr模板为asfvvp72,csfv,pcv2,prrsv(mac145),prrsv(pam),pedv,ppv,病料样品,标准品,稀释液。
(2)标准曲线的绘制
将1×1019拷贝/μl的质粒梯度进行10倍倍比稀释稀释到1×100拷贝/μl,每个浓度梯度做3个重复进行荧光定量pcr试验,由abi7500荧光定量pcr仪自动生成标准曲线。并用1.5%agarosegel进行核酸电泳,鉴定扩增片段。rt-pcr反应液为实施例4的反应液,反应程序为实施例6的程序。
结果如图1和图2所示。
以质粒浓度的对数值为横坐标ct值为纵坐标由图1可知曲线的斜率为-1.16,截距22.43,相关系数为0.997,得到标准曲线方程为:y=-1.16x+22.43;用1.5%的琼脂糖凝胶进行核酸电泳后,观察出现一条特异性条带大小约258bp(图2),与预期结果一致。
(3)重复性评价
用1×101~1×1018拷贝/μl的质粒每个浓度梯度做3个重复进行重复性试验并根据所得ct值计算变异系数cv。
重复性试验结果如表1所示:
表1各个浓度梯度ct值的变异系数
表1显示该方法的重复性良好各浓度梯度变异系数cv均小于0.25%,说明该实时荧光定量pcr检测方法具有良好的稳定性。
(3)灵敏性评价
用1×100~1×1020拷贝/μl的质粒每个浓度梯度做3个重复进行敏感性试验确定该方法的最低检测浓度。
结果如图3所示。
用1×1020至1×100拷贝/μl的质粒进行敏感性试验该方法最低可检测到1×101拷贝/μl的质粒,当浓度大于等于10拷贝/μl时均可出现扩增曲线,说明该检测方法具有极高的灵敏度。
(3)特异性评价
以古典猪瘟病毒(csfv)、猪繁殖与呼吸综合征病毒(prrsv)和猪流行性腹泻(pedv)的cdna,猪圆环病毒(pcv2)和猪细小病毒(ppv)的dna及asfvpet28a-vp72为模板进行荧光定量pcr反应观察是否有扩增曲线。
结果如图4和图5所示。
由图4可知:以csfv,pedv,prrsv(mac145)和psrrv(pam)的cdna,pcv2和ppv的dna为模板,用各自相应的引物进行传统pcr均能扩增出相应的特异性条带,说明提取的模板质量良好可用于特异性鉴定。
由图5可知:以csfv,pedv,prrsv(mac145)和psrrv(pam)的cdna,pcv2和ppv的dna及asfv的质粒pet28a-vp72为模板,用扩增asfv的引物进行荧光定量pcr,反应结果只有asfv的pet28a-vp72出现扩增曲线,说明该方法具有良好的特异性。
对比例:检测asfv的试剂盒重复性和敏感度对比
(1)试验设计
对比材料为实施例5的reactionmixer冻干粉、现配制的reactionmixer和thermofisher的vetmax非洲猪瘟(asf)qpcr检测试剂盒;
分别用1×100~1×1010拷贝/μl,1×100~1×109拷贝/μl,1×100~1×1012拷贝/μl的质粒每个浓度梯度做3个重复,进行荧光定量pcr扩增,反应程序为实施例6的程序。
比较三种对比材荧光定量pcr的标准曲线,重复性,灵敏度。
(2)标准曲线绘制
reactionmixer冻干粉的标准曲线如图6所示:
以质粒浓度的对数值为横坐标,ct值为纵坐标,可知曲线的斜率为-1.6695,截距43.18,相关系数为0.9934,得到标准曲线方程为:y=-1.6695x+43.18。
现配的reactionmixer的标准曲线如图7所示:
以质粒浓度的对数值为横坐标,ct值为纵坐标,可知曲线的斜率为-1.5418,截距40.851,相关系数为0.9929,得到标准曲线方程为:y=-1.5418x+40.851。
商品化荧光定量检测试剂盒的标准曲线如图8所示:
以质粒浓度的对数值为横坐标,ct值为纵坐标,可知曲线的斜率为-1.6056,截距38.782,相关系数为0.993,得到标准曲线方程为:y=-1.6056x+38.782。
(3)重复性评价
reactionmixer冻干粉的重复性如表2所示:
表2冻干反应液realtime-pcr
由表2可知:reactionmixer冻干粉的重复性良好,各浓度梯度变异系数cv均小于1.672%。
现配的reactionmixer的重复性如表3所示:
表3现配反应液realtime-pcr
由表3可知:现配的reactionmixer的重复性良好,各浓度梯度变异系数cv均小于1.46%。
商品化荧光定量检测试剂盒的重复性如表4所示:
表4商品化荧光定量试剂盒realtime-pcr
由表4可知:商品化荧光定量检测试剂盒的重复性良好(表4),各浓度梯度变异系数cv均小于1.45%。
以上结果说明:现配reactionmixer与商品化检测试剂盒的稳定性相当,而冻干粉的稳定性略低,可加入保护剂。
(4)敏感度评价
用1×1012至1×100拷贝/μl的质粒进行敏感性试验,reactionmixer冻干粉和现配的reactionmixer方法最低可检测均可达1×101拷贝/μl的质粒,当浓度大于等于10拷贝/μl时均可出现扩增曲线(如图9,图10),而商品化荧光定量试剂盒的最低检测限为1×102拷贝/μl(如图11),说明本发明的realtime-pcr检测方法具有极高的灵敏度,比商品化试剂盒高10倍。
上面结合附图和实施例对本发明作了详细的说明,但是,所属技术领域的技术人员能够理解,在不脱离本发明宗旨的前提下,还可以对上述实施例中的各个具体参数进行变更,形成多个具体的实施例,均为本发明的常见变化范围,在此不再一一详述。
sequencelisting
<110>河南中泽生物工程有限公司,郑州大学
<120>检测非洲猪瘟病毒的分子探针、试剂盒及其应用
<130>2019
<160>4
<170>patentinversion3.2
<210>1
<211>258
<212>dna
<213>asfv
<400>1
cgtatccgatcacattacctattattaaaaacatttccgtaactgctcatggtatcaatc60
ttatcgataaatttccatcaaagttctgcagctcttacatacccttccactacggaggca120
atgcgattaaaacccccgatgatccgggtgcgatgatgattacctttgctttgaagccac180
gggaggaataccaacccagtggtcatattaacgtatccagagcaagagaattttatatta240
gttgggacacggattacg258
<210>2
<211>28
<212>dna
<213>人工合成
<400>2
ccaacccagtggtcatattaacgtatcc28
<210>3
<211>19
<212>dna
<213>人工合成
<400>3
cgtatccgatcacattacc19
<210>4
<211>18
<212>dna
<213>人工合成
<400>4
cgtaatccgtgtcccaac18
- 还没有人留言评论。精彩留言会获得点赞!