一种检测广州管圆线虫的纳米金及其应用的制作方法
本发明涉及广州管圆线虫检测
技术领域:
,具体而言,涉及一种检测广州管圆线虫的纳米金及其应用。
背景技术:
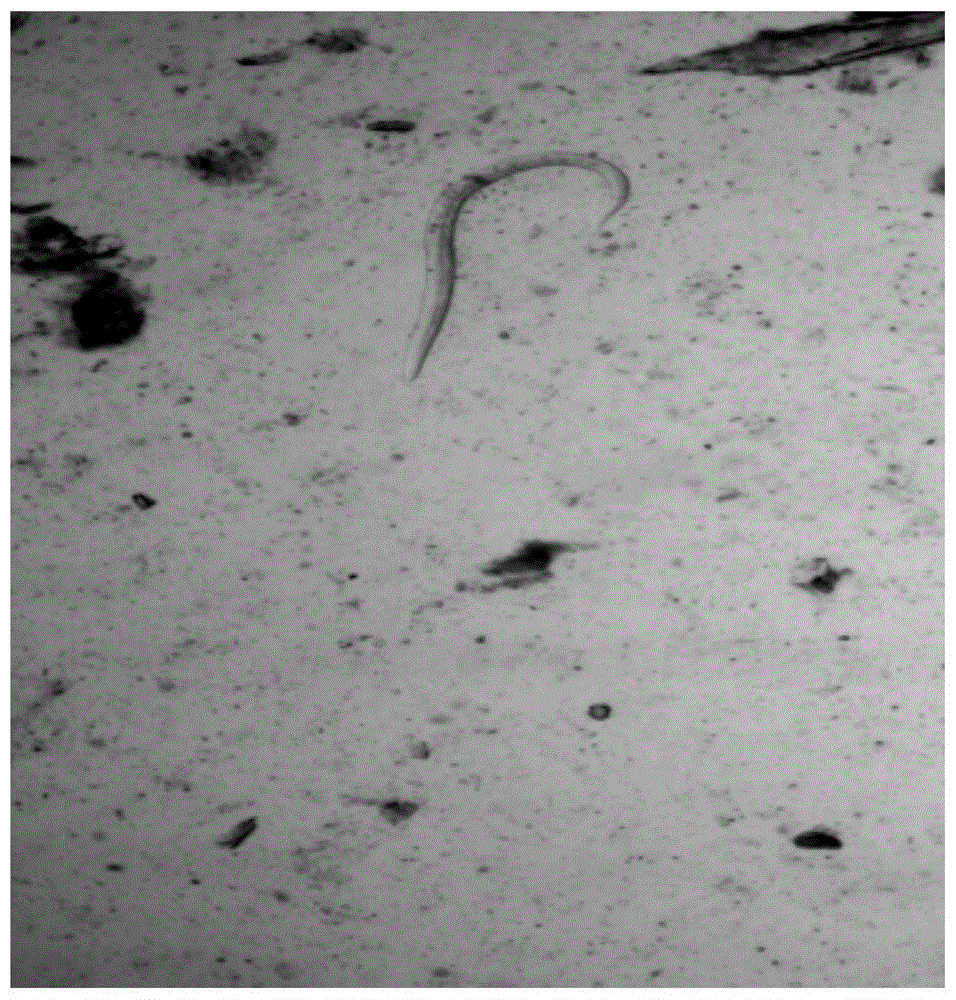
:广州管圆线虫(angiostrongyluscantonensis)是由我国陈新陶教授首次在广州褐家鼠及黑色鼠肺部血管内发现的一种食源性人兽共患寄生虫病,又称嗜酸粒细胞增多性脑膜炎或脑膜脑炎。在分类上属线型动物门、尾感器纲、原线目、管圆科、管圆线虫属。该虫的终宿主是啮齿动物,主要以褐家鼠和黑家鼠为主。从感染广州管圆线虫终宿主的鼠类粪便内分离出一期幼虫,感染中间宿主软体动物,主要以福寿螺、褐云玛瑙螺、蛞蝓、蜗牛为主。经两次蜕皮后发育成感染期幼虫,人类因生食或半生食含感染期幼虫的中间宿主或转续宿主而感染。随着人们饮食习惯的改变及中间宿主褐云玛瑙螺和福寿螺的不断繁殖,使该病的流行趋势逐年上升。1945年在台湾发现第一例人患广州管圆线虫病,1961年第二例患者由horio和alicata报道。之后,在太平洋、印度洋地区的部分岛屿和东南亚各国也相继发现了散在和爆发病例。1984年,在暨南大学医学院收治了一例“酸脑”病例,也是我国大陆首例确诊病例,随后在我国上海、广东、浙江、福建、辽宁、江苏、天津、牡丹江、温州等地有病例报道并有死亡病例出现。2006年在北京因食用半熟的螺肉暴发了160个病例,在云南大理地区一直存在散在病例,2010~2016年共报告63例广州管圆线虫病例,60例为临床诊断病例,据报道2017年在大理古城一游客感染该病,导致流产,这些患者多因半生食凉拌螺肉而感染。迄今为止,全世界患病人数已超过3000例。因此,2004年,国家卫生部将广州管圆线虫病列为一种严重危害人类健康的新发传染病。广州管圆线虫病的主要临床表现为剧烈头疼,伴有撕裂感,疼痛先有间歇性随后发作频繁,最后疼痛加剧且持续时间延长,药物一般仅对45%的患者在短时间内有效,其次还有颈项强直的特征,表现为恶心、呕吐、颈部活动疼痛、低中度发热。一些患者头、躯干或四肢有异常感,比如,针刺感、麻木、烧灼感、疼痛,有时还伴有自主神经功能紊乱,一过性的面部或肢体麻木。个别患者眼内发现虫体寄生,严重者出现视力障碍甚至失明。第ⅴ期幼虫通过脑静脉经右心移行至肺部引起咳嗽、咳痰。当幼虫移行至消化系统时,患者会出现腹痛、腹泻或便秘,部分患者出现肝肿大。感染严重的患者出现昏迷,伴有后遗症,甚至死亡。广州管圆线虫病早期诊断成为预防和治疗的关键,目前,诊断该病的金标准是从患者的脑脊液、眼部、肺部或其他部位找到iv期、v期幼虫或成虫才可确诊。大多数病人经临床治疗愈后良好,很少有神经系统症状和体征异常的表现。导致大部分患者未做腰穿,即便做了脑脊液检查也会忽视对嗜酸性粒细胞的检查,因此漏诊或误诊率极高。免疫学检测对该病的诊断有一定的辅助价值,目前常采用elisa检测患者血清或脊液中的抗体。igm在感染iii期幼虫后1周左右出现,igg出现的稍晚一些,该方法不能做到早期检测。且免疫学检测除不能做到早期检测外,特异性比较低,容易与其他寄生虫感染血清抗体产生交叉反应,因此,如何快速早期诊断该病成为临床急需解决的问题之一。技术实现要素:本发明的第一目的在于提供一种检测广州管圆线虫的纳米金,其由纳米金基质包被广州管圆线虫抗原制成,该纳米金能够检测广州管圆线虫,具有良好的检测早期性和敏感度,且检测效率高,检测结果精准度好。本发明的第二目的在于提供一种检测广州管圆线虫的试剂盒,其包括有上述检测广州管圆线虫的纳米金,具有能够快速准确检测广州管圆线虫的优点。本发明的第三目的在于提供一种制备上述纳米金的方法,该方法能够制备出可以快速精确检测广州管圆线虫的纳米金。本发明的第四目的在于提供一种检测广州管圆线虫的方法,该方法能够快速高效检测广州管圆线虫,具备更好的早期性和敏感度。本发明是这样实现的:一种检测广州管圆线虫的纳米金,其由纳米金基质包被抗原制成,该抗原为广州管圆线虫抗原。进一步地,广州管圆线虫抗原为以下一种或多种抗原的组合:广州管圆线幼虫抗原、广州管圆线成虫抗原以及广州管圆线虫排泄分泌抗原。具体地,上述广州管圆线幼虫抗原为广州管圆线v期幼虫粗抗原或广州管圆线v期幼虫纯化抗原。需要说明的是,在其他实施例中,广州管圆线幼虫抗原也可以是广州管圆线iv期幼虫粗抗原或广州管圆线iv期幼虫纯化抗原。v期幼虫粗抗原为广州管圆线幼虫全虫抗原;广州管圆线v期幼虫纯化抗原选自如下分子量的抗原:34kd、43kd、45kd以及55kd;优选地,广州管圆线幼虫纯化抗原为分子量43kd的抗原。具体地,广州管圆线成虫粗抗原为广州管圆线成虫全虫抗原;广州管圆线成虫纯化抗原选自如下分子量的抗原:36kd、43kd、45kd、90kd以及120kd;优选地,成虫纯化抗原为分子量45kd的抗原。上述广州管圆线排泄分泌抗原为v期幼虫排泄分泌抗原。需要说明的是,在其他实施例中,该广州管圆线排泄分泌抗原为iv期幼虫排泄分泌抗原。经本申请发明人研究,上述抗原均能够作为检测广州管圆线幼虫的抗原包被于纳米金基质上,且该检测相较于传统检测广州管圆线虫的方法具备更好的早期性和敏感度。具体地,纳米金颗粒,其具有良好的生物相容性,其合成方法简单、化学稳定性好易于抗原或抗体等生物大分子结合。纳米金表面易修饰,其含有巯基基团的有机化合物可通过au-s共价键的形式结合到纳米金粒子表面,与药物或生物大分子结合,作为高效载体,例如,纳米金可以与抗原耦合,通过主动和被动的形式与抗体特异性结合。纳米金表面等离子共振效应(surfaceplasmonresonance,spr)是指金的自由电子的振动频率与入射光的波长发生共振耦合时,纳米金颗粒在紫外可见光区域内产生表面等离子共振现象。此外,纳米金颗粒间的相互作用会使spr的波长发生变化,并伴随颜色的改变。kamat等发现当纳米金颗粒聚集时,表面纵向等离子共振带变宽,且大幅度红移,颜色由原来的红色变成蓝色或紫色;分散时,由紫色或蓝色变成红色,常用于生物传感器制备、肿瘤热疗以及影像学研究等。纳米金颗粒表面具有独特的光学性质,导致纳米金颗粒在分散或聚集时出现不同的颜色变化,肉眼可见,受其本身大小、形状、组成以及颗粒间相互作用的影响。纳米金颗粒还具有吸附特性,因其表面具有很多悬空结合位点,易与其他原子结合,大大提高了纳米金表面的活性。可将其负载在其他物质表面以制备高效性能的纳米金催化剂,加速反应过程,缩短检测时间。纳米金标记技术的出现,使其成为继酶免疫标记、放射性同位素免疫标记以及荧光免疫标记物质之后又一标记技术。但在寄生虫病检测方面研究较少,尤其是对于广州管圆线虫并没有相关的研究,特别是组织脏器寄生虫病取材定点困难、有创伤,不易被患者接受,确诊率极低,血清学诊断在感染早期灵敏度不高,导致这类寄生虫病检出率低,影响患者的治愈率。本发明实施例将广州管圆线虫各类型抗原包被纳米金基质,以检测感染广州管圆线虫的血清抗体(待测样品)中是否存在广州管圆线虫。具体地,上述纳米金基质可以为纳米金基质为纳米金棒、纳米金球、纳米金管、纳米金链、纳米金壳、纳米金星等不同形状的纳米金颗粒;优选地,纳米金基质为纳米金棒。在本发明实施例中,广州管圆线虫各类型抗原包括有:广州管圆线幼虫粗抗原、广州管圆线幼虫纯化抗原、排泄分泌抗原、广州管圆线成虫粗抗原以及广州管圆线成虫纯化抗原等。其原理为:纳米金基质表面包覆sh-peg,利用au容易与巯基(-sh)相互作用形成强大的au-s共价键,使纳米金棒作为载体,有效的标记识别大量的生物分子。采用纳米金棒生物分子传感器将单粒纳米金棒包覆在玻璃基底部与抗体结合,当抗原与纳米金棒接触时,抗原与抗体特异性结合,以光学信号被放大的形式传导出来,经之外分光光度计检测,纳米金棒纵向等离子共振(lspr)吸收峰逐渐发生红移,根据红峰移动变化判断纳米金棒包被和检测的功能。本发明实施例还提供一种检测广州管圆线虫的试剂盒,其包括有上述检测广州管圆线虫的纳米金,该纳米金具体如上所述,在此不再重复。本发明实施例还提供一种制备上述纳米金的方法,其包括包被步骤;包被步骤包括将上述抗原加入含纳米金基质的溶液中进行包被。在进行包被的过程中,广州管圆线幼虫抗原在溶液中的浓度为0.5μg/ml、0.6μg/ml、0.7μg/ml、0.8μg/ml、0.9μg/ml、1.0μg/ml、1.1μg/ml、1.2μg/ml、1.3μg/ml、1.4μg/ml、1.5μg/ml、1.6μg/ml、1.7μg/ml、1.8μg/ml、1.9μg/ml或2μg/ml;该幼虫抗原的浓度可以在0.5~2μg/ml的范围内选择,优选为0.90~1.45μg/ml。该浓度范围为幼虫抗原的最佳包被浓度,能够有效提高纳米金检测广州管圆线虫的灵敏度。在进行包被的过程中,排泄分泌抗原在溶液中的浓度为0.5μg/ml、0.6μg/ml、0.7μg/ml、0.8μg/ml、0.9μg/ml、1.0μg/ml、1.1μg/ml、1.2μg/ml、1.3μg/ml、1.4μg/ml、1.5μg/ml、1.6μg/ml、1.7μg/ml、1.8μg/ml、1.9μg/ml或2μg/ml;排泄分泌抗原的浓度可以在0.5~2μg/ml的范围内选择,优选为1.2~1.6μg/ml。该浓度范围为排泄分泌抗原的最佳包被浓度。在进行包被的过程中,成虫抗原在溶液中的浓度为0.3μg/ml、0.4μg/ml、0.5μg/ml、0.6μg/ml、0.7μg/ml、0.8μg/ml、0.9μg/ml、1.0μg/ml、1.1μg/ml、1.2μg/ml、1.3μg/ml、1.4μg/ml、1.5μg/ml、1.6μg/ml、1.7μg/ml、1.8μg/ml、1.9μg/ml、2.0μg/ml、2.1μg/ml以及2.2μg/ml;该成虫抗原的浓度可以在0.3~2.2μg/ml的范围内选择,优选为0.48~1.90μg/ml。该浓度范围为成虫抗原的最佳包被浓度。进一步地,在包被步骤前,制备方法包括纳米金基质的制备步骤;纳米金基质的制备可以采用:晶种生长法、模板法、电化学法以及光化学法等不同方法,优选地,采用晶种生长法进行制备,需要说明的是这些方法均为现有方法,在此不再赘述。进一步地,在包被步骤前,制备步骤后,制备方法包括纳米金基质的提纯步骤;该提纯步骤包括:将纳米金基质第一次离心,弃上清取沉淀重悬得到第一重悬液,然后将第一重悬液进行第二次离心,弃上清后取沉淀加ctab重悬得到第二重悬液,将第二重悬液进行第三次离心,弃上清取沉淀与氯化钠重悬得到。具体地,第一次离心的条件为8000~9000rpm,20~30min;第二次离心的条件为13000~15000rpm,8~12min;第三次离心的条件为13000~15000rpm,8~12min。得到提纯后的纳米金基质后室温放置,已被后续包被步骤使用。该提纯方法有效提高了纳米金棒表面化学修饰的稳定性,使纳米金棒在生物医学领域有更好的发展前景。此外,本发明实施例还提供一种检测广州管圆线虫的方法,其包括将上述纳米金与待测样品混合。需要说明的是,该方法是以检测广州管圆线虫为目的,而非以疾病诊断为目的。本发明具有以下有益效果:本发明实施例提供了一种检测广州管圆线虫的纳米金以及包含该纳米金的试剂盒。该纳米金由纳米金基质包被广州管圆线虫抗原制成,该纳米金能够检测广州管圆线虫,具有良好的检测早期性和敏感度,且检测效率高,检测结果精准度好。本发明实施例还提供了制备上述纳米金的方法和检测广州管圆线虫的方法。具体地,该制备方法能够制备出可以快速精确检测广州管圆线虫的纳米金,该检测方法具有能够早期、快速、高效检测广州管圆线幼虫的优点。附图说明为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。图1为本发明实施例1提供的粪便中分离的i期幼虫;图2为本发明实施例1提供的iii期幼虫;图3为本发明实施例1提供的v期幼虫;图4为本发明实施例1提供的成虫;图5为本发明实施例1提供的v期幼虫排泄分泌抗原制备;图6为本发明实施例1提供的v期幼虫抗原sds-page电泳图;图7为本发明实施例1提供的成虫抗原sds-page电泳图;图8为本发明实施例1提供的bca标准蛋白曲线图;图9为本发明实施例3提供的v期幼虫抗原的uv-vis扫描光谱图扫描光谱图;图10为实施例3提供的v期幼虫抗原的lspr红峰移位;图11为本发明实施例3提供的lesa的uv-vis扫描光谱图;图12为本发明实施例3提供的lesa的lspr红峰移位;图13为本发明实施例3提供的v期幼虫纯化抗原的uv-vis扫描光谱图;图14为本发明实施例3提供的v期幼虫纯化抗原的lspr红峰移位;图15为本发明实施例3提供的成虫抗原的uv-vis扫描光谱图;图16为本发明实施例3提供的成虫抗原的lspr红峰移位;图17为本发明实施例3提供的成虫纯化抗的uv-vis扫描光谱图;图18为本发明实施例3提供的成虫纯化抗的lspr红峰移位;图19为本发明实施例4提供的ⅴ期幼虫抗原标记纳米金棒检测轻度感染的检测结果;图20为本发明实施例4提供的ⅴ期幼虫抗原标记纳米金棒检测中度感染的检测结果;图21为本发明实施例4提供的ⅴ期幼虫抗原标记纳米金棒检测重度感染的检测结果;图22为本发明实施例4提供的ⅴ期幼虫抗原标记纳米金棒检测不同稀释度血清抗体的检测结果;图23为本发明实施例4提供的lesa标记纳米金棒检测轻度感染血清抗体的检测结果;图24为本发明实施例4提供的lesa标记纳米金棒检测中度感染血清抗体的检测结果;图25为本发明实施例4提供的lesa标记纳米金棒检测重度感染血清抗体的检测结果;图26为本发明实施例4提供的lesa标记纳米金棒检测不同稀释度血清抗体的检测结果;图27为本发明实施例4提供的ⅴ期幼虫纯化抗原标记纳米金棒检测轻度感染血清抗体的检测结果;图28为本发明实施例4提供的ⅴ期幼虫纯化抗原标记纳米金棒检测中度感染血清抗体的检测结果;图29为本发明实施例4提供的ⅴ期幼虫纯化抗原标记纳米金棒检测重度感染血清抗体的检测结果;图30为本发明实施例4提供的ⅴ期幼虫纯化抗原标记纳米金棒检测不同稀释度血清抗体的检测结果;图31为本发明实施例4提供的成虫抗原标记纳米金棒检测轻度感染的检测结果;图32为本发明实施例4提供的成虫抗原标记纳米金棒检测中度感染的检测结果;图33为本发明实施例4提供的成虫抗原标记纳米金棒检测重度感染的检测结果;图34为本发明实施例4提供的成虫抗原标记纳米金棒检测不同稀释度血清抗体的检测结果;图35为本发明实施例4提供的成虫纯化抗原标记纳米金棒检测轻度感染的检测结果;图36为本发明实施例4提供的成虫纯化抗原标记纳米金棒检测中度感染的检测结果;图37为本发明实施例4提供的成虫纯化抗原标记纳米金棒检测重度感染的检测结果;图38为本发明实施例4提供的成虫纯化抗原标记纳米金棒检测不同稀释度血清抗体的检测结果;图39为本发明实施例4提供的elisa轻度感染检测结果;图40为本发明实施例4提供的elisa中度感染检测结果;图41为本发明实施例4提供的elisa重度感染检测结果;图42为本发明实施例4提供的elisa检测不同稀释度血清抗体的结果。具体实施方式为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。以下结合实施例对本发明的特征和性能作进一步的详细描述。实施例1广州管圆线抗原的制备。动物模型建立感染中间宿主:将粪便内分离出的i期幼虫喂食给禁食24h的福寿螺连续感染3天,每次喂食11h(10~12h),感染完后12h后进食,具体请参照附图1。iii期幼虫收集:i期幼虫感染福寿螺12h后,采用胃蛋白酶消化法分离收集iii期感染期幼虫,将饲养的福寿螺压碎去壳,采用高速组织搅拌机将其充分搅碎后称重,按照每10g净重螺肉加消化液250ml(胃蛋白酶3g,浓盐酸7ml,加去离子水1l),放于37℃恒温箱中消化10h(8~10h),用200目筛网过滤,将过滤得到的过滤液室温放置15min沉淀,弃去2/3上清后,用0.9%的生理盐水补充至原刻度,反复冲洗2~3次,直至沉淀物清澈,取沉淀物,然后在显微镜下计数,收集iii期幼虫,请参照附图2。感染终宿主:按照50条、100条、200条的感染量灌胃给大鼠,即为轻度感染、中度感染以及重度感染,每组15只。抗原制备v期幼虫收集:于大鼠感染iii期幼虫21天,10%水合氯醛麻醉大鼠,腹主动脉取血,然后取大鼠大脑将其放于盛有ph值为7.4的磷酸缓冲液培养皿中,肉眼可见从脑内钻出的ⅴ期幼虫,用生理盐水反复冲洗干净后放于-20℃保存备用,请参照附图3。成虫收集:大鼠感染iii期幼虫50天后,腹主动脉取血后处死大鼠,从大鼠心脏、肺动脉血管内分离出成虫,用高压灭菌后的生理盐水反复清洗,放于-20℃保存备用,请参照附图4。v期幼虫粗抗原制备:取ⅴ期幼虫2000条加液氮用研钵器研磨10min后,用超声波细胞粉碎仪超声粉碎20min,之后放-80冰箱反复冻融4次(3~5次)后,4℃离心取上清即为v期幼虫抗原,也称幼虫可溶性抗原,采用bca蛋白定量试剂盒测定抗原浓度,-20℃保存备用。lesa(排泄分泌抗原)制备:用0.25%的次氯酸钠溶液清洗活力强ⅴ期幼虫,将ⅴ期幼虫置于含有双抗(青、链霉素混合液各10000u/ml)的waymouth’smb7521/1培养液中培养(37℃,5%co2),每天换液3次,3500rpm离心10min,收集上清,用0.22μm过滤筛过滤至透析袋内,pbs缓冲液4℃透析24h,每4h换液一次,然后用蔗糖浓缩,收集lesa于冷冻干燥机内高度浓缩成lesa冻干粉。(图5)成虫粗抗原制备:将-20℃冻存的成虫加少许的液氮研磨粉末,丙酮脱脂3次,每次10min(5-10min),滴加pbs液,反复研磨20min(15-30min),4℃放置3d,12000r/min4℃离心30min,上清液即为成虫抗原,也称广州管圆线成虫可溶性抗原(a.dultwornlantigen,awa)。纯化抗原制备采用聚丙烯酰胺凝胶电泳(sds-page)纯化抗原。sds-page胶的制备:按照目的蛋白分子量配置10%分离胶和5%浓缩胶,分离胶一般灌注量为4.5ml,然后用200μl移液枪快速用纯水压平胶面,室温放置30min,待胶聚合后,倒掉纯水并用吸水纸吸取多余的水,再加入浓缩胶,即刻插上梳齿,室温下聚合15min后,拔掉梳齿。样品的处理:取“抗原制备”步骤制备的ⅴ期幼虫粗抗原和成虫粗抗原上清,加相应量的5×sds凝胶上样缓冲液,混匀后,100℃煮沸5-10min,待样品冷却后上样,根据表1蛋白浓度表确定蛋白上样量和体积。表1蛋白浓度表标准蛋白(ab)样品(ab)样品浓度(μg/μl)0.1350.38112.60.19390.3392.10.25470.308641.70.34750.278881.40.52780.25681.10.66710.24360.970.83470.23480.881.01350.22560.77电泳:在两玻璃板间加满tris-甘氨酸电泳缓冲液,电泳槽内加至槽外第二刻度处,将两玻璃板间底部的气泡抖散。然后将“样品的处理”步骤处理的样品用微量移液器依次加入,接通电源,调电压至80ⅴ,待染色液进入分离胶时调压至120ⅴ,继续电泳至溴酚蓝恰好跑出分离胶,停止电泳。染色及脱色:用考马斯g-250染色2h后脱色过夜,根据mark记录表达量过多的蛋白分子量,以备纯化蛋白使用。v期幼虫粗抗原sds-page电泳结果请参照附图6,可知v期幼虫粗抗原表达量过多的分子量条带分别为34kd、43kd、45kd以及55kd,即ⅴ期幼虫纯化抗原为:分子量34kd、43kd、45kd和/或55kd的抗原。需要说明的是,在一些实施例中,ⅴ期幼虫纯化抗原选自上述不同分子量抗原的其中一种或几种的组合。成虫粗抗原sds-page电泳结果请参照附图7,可知成虫粗抗原表达量过多的分子量条带分别为36kd、43kd、45kd、90kd以及120kd,即在本实施例中,成虫纯化抗原为分子量36kd、43kd、45kd、90kd和/或120kd的抗原,需要说明的是,在一些实施例中,成虫纯化抗原可以为上述分子量抗原的其中一种或多种的组合。将凝胶取下放入培养皿中,加入naac染液盖过凝胶,置于水平摇床上染色2h。染色结束后,将目的蛋白切下用去离子水脱色至原胶颜色后,室温10000rpm,离心5min,尽量去除上清,保留胶体。水平电泳槽洗脱纯化抗原:将研磨碎的胶碎片放入分子量为mr14000的透析袋内,在透析袋内加入1.5ml的5×tris-甘氨酸电泳缓冲液,用尼龙绳结扎透析袋两端,将其置于水平电泳槽内,并用载玻片压紧,加满5×tris-甘氨酸电泳缓冲液,接通电源,电压设置为120ⅴ,1h,并将电泳槽用冰掩埋,防止蛋白变性,电泳结束后再反向电泳5min,剪开透析袋将液体移入1.5ml离心管内,从离心管内取20μl洗脱液,加5μl5×sds蛋白上样缓冲液,用sds-page电泳检测洗脱效果;将离心管内的洗脱液移入新的透析袋内,放入pbs液内,4℃透析过夜,间隔4h,8h,12h更换新的pbs液,透析至第二天早晨后,将peg-6000撒在透析袋上,直到透析袋内液体减少至原来一半时,停止浓缩,同样取20μl浓缩液加5μl5×sds蛋白上样缓冲液,sds-page电泳检测浓缩效果;ⅴ期幼虫纯化抗原和成虫纯化抗原各取浓缩液1μl,用bca蛋白定量试剂盒测定浓度,bca标准蛋白曲线如图8所示。实施例2制备检测广州管圆线虫的纳米金棒的方法。纳米金棒的制备(晶种法)制备金晶种子液:混合140μlhaucl4(0.1m)和6.86ml纯水制备haucl4(2mm)溶液;新鲜配置nabh4(0.01m)4℃保存8分钟;混合625μlhaucl4(2mm)、1.88mlctab(0.2mm,hexadecyltrimethylammoniumbromide,十六烷基三甲基溴化铵)和1.37ml纯水,混匀搅拌1分钟,然后加入新鲜制备的450μlnabh4得到金晶种子液,剧烈震荡2分钟,金晶种子液颜色由黄色变为浅棕色。放入27℃恒温箱孵育2小时得到金晶种子液。制备增长媒质:混合ctab(0.2m,11.875ml)、7.71ml纯水、haucl4(2m,5ml)充分震荡混匀,然后依次加入agno3(10mm,150μl)、aa(100mm,160μl,抗坏血酸)震荡混匀后得到增长媒质,增长媒质颜色由深黄色转化为无色,放置27℃恒温箱中防止ctab析出。聚合纳米金棒:取108μl的金晶种子液加入到25ml的增长媒质中,混合均匀,27.5℃恒温箱孵育12h。紫外分光光度计(uv-vis)检测纵向等离子共振带吸收峰红峰移位的变化情况。纳米金棒提纯:纳米金棒表面有大量的表面活性剂ctab包覆,ctab的生物毒性会影响纳米金棒在生物医学领域的作用。所以在纳米金棒表面修饰前需要去除部分ctab来降低其生物毒性。有三种方法:(1)高转速离心分别将相应的不同溶液加入到纳米金粒子中;(2)降低温度使ctab析出;(3)聚合物包覆到纳米金棒表面。这三种方法都会引起纳米金粒子的聚集或者出现一些不可控的外在因素。本发明实施例在作出了创造性劳动后发明了纳米金棒提纯方法,以克服上述缺陷,方法如下:纳米金棒8500rpm(离心半径15cm)第一次离心30min,弃去上清取沉淀,在该沉淀中加入12.5ml纯水至原体积的一半,混匀得到第一重悬液后将第一重悬液分装到2ml的ep管内,14000rpm(离心半径15cm)第二次离心10min,弃去上清得到取沉淀,然后在ep管内加入ctab(0.5mm,1ml)至2ml,混匀得到第二重悬液后14000rpm(离心半径15cm)第三次离心10min,弃去上清取沉淀,然后在纳米金棒的ep管内加入氯化钠(5mm,1ml)至2ml,混匀重悬后得到纳米金棒溶液。uv-vis检测并记录纵向等离子共振带红峰移位的吸收峰值及吸光度,放置27℃,以备后续抗原包被的使用。该方法有效提高了纳米金棒表面化学修饰的稳定性,使纳米金棒在生物医学领域有更好的发展前景。抗原硫醇化将“抗原制备”步骤制备的ⅴ期幼虫粗抗原、lesa、成虫粗抗原、ⅴ期幼虫纯化抗原以及成虫纯化抗原分别采用bca蛋白定量试剂盒测定浓度后,将该5种抗原分别稀释成10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml浓度。需要说明的是,纯化抗原是指将蛋白表达量多的抗原分子量,加适当的pbs液稀释,ⅴ期幼虫纯化抗原是指分子量34kd、43kd、45kd和55kd的抗原,成虫纯化抗原是指分子量为36kd、43kd、45kd、90kd和120kd的抗原。分别取上述各浓度抗原0.2ml加入含edta的pbs缓冲液0.8ml充分混匀得到抗原混合物,将traut’s试剂(5mg/ml,10μl)分别加入到该抗原混合物中,27℃放置1h得到抗原样品。抗原样品采用重力型去盐柱脱盐:移去重力型sephadex脱盐柱上下盖,将脱盐柱固定在试管架上,下面放置液体容器培养皿,使脱盐柱内的保护剂流至培养皿内。用6ml的纯水将重力型sephadex脱盐柱洗脱平衡三次,直至柱内的纯水流净。让脱盐柱的流出口申入到2mlep管中,将0.3ml所需脱盐或所需替换的各类抗原样品,用移液枪加至凝胶上方的聚丙烯滤膜中心处。让各类抗原样品进入胶体内,当其全部进入胶体内时,这时脱盐柱流出口再无液体流出,用移液枪再加0.3ml的纯水时,脱盐柱流出口处放置新的ep管,可以收集到与所加纯水等体积的硫醇化抗原溶液。重复步骤5-6次,直到收集到所需的硫醇化抗原为止。脱盐柱的重复使用方法:用10倍体积的tbs冲洗葡聚糖胶,再用5倍体积的含有0.05%sodiumazide双蒸水冲洗葡聚糖胶,再加入适量体积的含有0.05%sodiumazide双蒸水,盖上下盖,使得凝胶上方含有3ml左右的0.05%sodiumazide双蒸水,放置4℃备用。抗原包被纳米金棒:分别取上述硫醇化后的的ⅴ期幼虫粗抗原、lesa以及v期幼虫纯化抗原200μl,浓度为10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml到4ml的“纳米金棒制备”制备的纳米金棒溶液中,充分混匀3min后,逐滴缓慢加入2mlpeg6000,室温放置2h得到包被ⅴ期幼虫抗原、lesa以及v期幼虫纯化抗原的检测广州管圆线虫的纳米金棒;分别取100μl浓度为10μg/ml、20μg/ml、30μg/ml、40μg/ml和50μg/ml的成虫粗抗原和成虫纯化抗原100μl与2ml的“纳米金棒制备”制备的纳米金棒溶液结合3min后,最后加1ml的peg6000,28℃放置2h得包被成虫粗抗原和成虫纯化抗原的检测广州管圆线虫的纳米金棒。实施例3验证实施例2提供的抗原的最佳包被浓度。用紫外分光光度计检测纳米金棒标记抗原前后纵向等离子共振带红峰移位变化,根据红峰移位大小确定抗原的最佳包被浓度。实验结果v期幼虫粗抗原紫外分光光度计(uv-vis)扫描光谱图如附图9所示,纵向等离子共振带包被与检测吸收峰(lspr)的变化情况如附图10所示。由附图10看出,根据红峰移位,v期幼虫抗原的最优稀释浓度为:30μg/ml>50μg/ml>10μg/ml=20μg/ml=40μg/ml>60μg/ml。因此,当v期幼虫粗抗原在包被前后最大红峰移位为35nm对应的稀释浓度为30μg/ml,可知在抗原包被纳米金棒的溶液中,v期幼虫粗抗原的最佳包被浓度为1.43μg/ml。lesauv-vis扫描光谱图如附图11所示,lspr的变化情况如附图12所示。由图11和图12可以看出,根据红峰移位,lesa的最优稀释浓度为:30μg/ml>20μg/ml=40μg/ml=50μg/ml>10μg/ml。因此,当lesa在包被前后最大红峰移位为35nm对应的稀释浓度为30μg/ml,因此,在抗原包被纳米金棒的溶液中,lesa的最佳浓度为1.43μg/ml。广州管圆线v期幼虫纯化抗原广州管圆线v期幼虫纯化抗原uv-vis扫描光谱图如附图13所示,lspr的变化情况如附图14所示。由图13和图14可以看出,根据红峰移位,最优v期幼虫纯化抗原为:43kd>45kd>34kd=55kd。当v期幼虫纯化抗原在包被前后最大红峰移位为25nm对应的稀释浓度为20μg/ml,因此,在抗原包被纳米金棒的溶液中,v期幼虫纯化抗原的最佳浓度为0.95μg/ml。成虫抗原uv-vis扫描光谱图如附图15所示,lspr的变化情况如附图16所示。由附图15~附图16看出,根据红峰移位,成虫抗原的最优稀释浓度为:40μg/ml>50μg/ml>10μg/ml=20μg/ml=30μg/ml。因此,当成虫粗抗原在包被前后最大红峰移位为35nm对应的稀释浓度为40μg/ml,可知在抗原包被纳米金棒的溶液中,成虫粗抗原的最佳包被浓度为1.90μg/ml。广州管圆线成虫纯化抗原广州管圆线成虫纯化抗原uv-vis扫描光谱图如附图17所示,lspr的变化情况如附图18所示。由图17和图18可以看出,根据红峰移位,根据红峰移位,最优成虫纯化抗原为:45kd>120kd=36kd>90kd>34kd。因此,当成虫纯化抗原在包被前后最大红峰移位为40nm对应的稀释浓度为10μg/ml,因此,在抗原包被纳米金棒的溶液中,成虫纯化抗原的最佳浓度为0.48μg/ml。实施例4验证实施2提供的检测广州管圆线虫的纳米金棒的检测效果。实验过程不同感染时间、不同感染度的大鼠血清抗体检测:检测感染广州管圆线虫iii期幼虫50条、100条、200条(即为轻度感染、中度感染、重度感染)第5d、7d、14d、21d的血清样本。分别取40μl的血清抗体分别加入到2ml实施例2提供的包被ⅴ期幼虫粗抗原、lesa、幼虫纯化抗原、成虫粗抗原以及成虫纯化抗原标记纳米金棒中,30℃放置5min,采用紫外分光光度计扫描表面等离子共振吸收峰红峰移位的变化。不同稀释度阳性血清抗体检测:将阳性大鼠血清抗体按照1:5、1:10、1:20、1:40、1:60、1:80、1:100、1:200、1:400、1:600、1:800的比例进行稀释,取40μl的血清抗体分别加入到2ml实施例2提供的包被ⅴ期幼虫抗原、lesa、幼虫纯化抗原、成虫抗原以及成虫纯化抗原标记纳米金棒中,30℃放置5min。实验结果ⅴ期幼虫粗抗原标记纳米金棒轻度感染的检测结果ⅴ期幼虫粗抗原标记纳米金棒检测轻度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图19所示,检测轻度感染不同时间血清抗体红峰移位如表2所示。表2轻度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)55(+)715(+)1410(+)2115(+)由附图19和表2可知,ⅴ期幼虫粗抗原标记纳米金棒检测轻度感染广州管圆线虫第5、7、14、21d的血清抗体,uv-vis扫描lspr吸收峰(紫外分光光度计扫描表面等离子共振吸收峰)都有红峰移位的变化,在感染第7d、21d出现最大红峰移位15nm,第5d、14d有相应红峰移位变化。可知ⅴ期幼虫粗抗原标记纳米金棒能够检测轻度感染5d的血清抗体。中度感染的检测结果ⅴ期幼虫粗抗原标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图20所示,检测中度感染不同时间血清抗体红峰移位如表3所示。表3中度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)55(+)720(+)1415(+)2115(+)由图20和表3可知,ⅴ期幼虫粗抗原标记纳米金棒检测中度感染的第5、7、14、21d的血清抗体,uv-vis扫描lspr吸收峰都有红峰移位的变化,在感染第7d出现最大红峰移位20nm。重度感染的检测结果ⅴ期幼虫粗抗原标记纳米金棒检测重度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图21所示,检测重度感染不同时间血清抗体红峰移位如表4所示。表4重度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)510(+)715(+)1425(+)2140(+)由图21和表4可以看出,ⅴ期幼虫粗抗原标记纳米金棒检测重度感染ac第5、7、14、21d的血清抗体,uv-vis扫描lspr吸收峰的位置均发生了改变。在感染21d紫外分光光度计扫描得到了最大的红峰移位值为40nm,感染第5d相比轻中度多移动了5个nm,说明随着感染量和感染时间的增加血清抗体含量逐渐增加,纳米金棒的敏感性也逐渐增强。检测不同稀释度的阳性血清抗体ⅴ期幼虫粗抗原标记纳米金棒检测不同稀释度的阳性血清抗体的检测结果请参照附图22以及表5。表5不同稀释度的阳性血清抗体的检测结果不同稀释度红峰移位(nm)性质(±)1:525(+)1:1020(+)1:2025(+)1:4025(+)1:6020(+)1:8015(+)1:10010(+)1:2005(+)1:4000(-)1:6000(-)从图22和表5看出,ⅴ期幼虫粗抗原标记纳米金棒检测不同稀释度的血清抗体,通过紫外分光光度计扫描图谱,表面等离子共振红峰移位最大值为25nm,检测的最大稀释度为1:200。,随着血清含量的减少红峰移位逐渐减小,当稀释度达到1:400、1:600时纵向等离子共振吸收峰逐渐发生蓝移,血清抗体性质转阴。lesa标记纳米金棒轻度感染的检测结果lesa标记纳米金棒检测轻度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图23所示,检测轻度感染不同时间血清抗体红峰移位如表6所示。表6轻度感染不同时间血清抗体红峰移位的检测结果由图23和表6知,lesa标记纳米金棒检测轻度感染广州管圆线虫第5、7、14、21d的血清抗体,从uv-vis扫描图谱可以看出表面等离子共振吸收峰均出现不同的红峰移位,且lspr红峰移位在感染第7d出现了最大红峰移位15nm。中度感染的检测结果lesa标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图24所示,检测中度感染不同时间血清抗体红峰移位如表7所示。表7中度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)55(+)715(+)1430(+)2125(+)从图24和表7中可以看出,lesa标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d血清抗体,表面等离子共振吸收峰的红峰移位在感染14d、21d较轻度感染变化明显,在感染第14d出现了最大红峰移位30nm。重度感染的检测结果lesa标记纳米金棒检测重度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图25所示,检测重度感染不同时间血清抗体红峰移位如表8所示。表8重度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)510(+)715(+)1415(+)2145(+)由图25和表8知,lesa标记纳米金棒检测重度感染广州管圆线虫第5、7、14、21血清抗体,在感染第5d的红峰移位较轻中度感染变化明显,随着血清抗体含量的增加表面等离子共振红峰移位的变化幅度增大,在感染第21d红峰移位变化最大为45nm,其他时间的红峰移位峰值均比轻中度大,说明本发明提供的纳米金棒具有较好的敏感性,与抗体含量呈正相关。检测不同稀释度的阳性血清抗体lesa标记纳米金棒检测不同稀释度的阳性血清抗体的检测结果请参照附图26以及表9。表9不同稀释度的阳性血清抗体的检测结果不同稀释度红峰移位(nm)性质(±)1:535(+)1:1035(+)1:2030(+)1:4025(+)1:6015(+)1:8010(+)1:10010(+)1:20010(+)1:4005(+)1:6005(+)1:8000(-)从图26和表9可以看出lesa标记纳米金棒检测不同稀释度的血清抗体通过紫外分光光度计扫描,血清稀释度在1:5、1:10时,出现了较大的红峰移位35nm,检测的最大稀释度为1:600,随着血清含量的减少红峰移位逐渐减小,当稀释度达到1:800时纵向等离子共振吸收峰逐渐发生蓝移,血清抗体性质转阴,在稀释度检测方面,lesa标记纳米金棒比ⅴ期幼虫抗原标记纳米金棒敏感性好,检测的稀释度高。ⅴ期幼虫纯化抗原标记纳米金棒轻度感染的检测结果ⅴ期幼虫纯化抗原(43kd)标记纳米金棒检测轻度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图27所示,检测轻度感染不同时间血清抗体红峰移位如表10所示。表10轻度感染不同时间血清抗体红峰移位的检测结果从图27和表10看出,ⅴ期幼虫纯化抗原标记纳米金棒检测轻度感染广州管圆线虫第5、7、14、21d的血清抗体,紫外分光光度计检测表面等离子共振吸收峰都发生了红移,在感染第7d、14d红峰移位变化均为20nm。中度感染的检测结果ⅴ期幼虫纯化抗原标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图28所示,检测中度感染不同时间血清抗体红峰移位如表11所示。表11中度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)55(+)720(+)1435(+)2115(+)从图28和表11可知,ⅴ期幼虫纯化抗原标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d的血清抗体,在感染第14d时紫外分光光度计扫描表面等离子共振吸收峰的红峰移位最大为35nm,较轻度感染的检测结果占有一定的优势。重度感染的检测结果ⅴ期幼虫纯化抗原标记纳米金棒检测重度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图29所示,检测重度感染不同时间血清抗体红峰移位如表12所示。表12重度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)510(+)725(+)1435(+)2130(+)由图29和表12可以看出,ⅴ期幼虫纯化抗原标记纳米金棒检测重度感染广州管圆线虫第5、7、14、21d的血清抗体,在感染第14d时紫外分光光度计扫描表面等离子共振吸收峰的红峰移位最大为35nm,感染第5d的红峰移位变化相比轻中度感染同一时间的敏感性好。相比ⅴ期幼虫抗原和lesa占有绝对的优势,红峰移位出现了大幅度的变化,这与单一成分抗原结合率高有关系。检测不同稀释度的阳性血清抗体ⅴ期幼虫纯化抗原标记纳米金棒检测不同稀释度的阳性血清抗体的检测结果请参照附图30以及表13。表13不同稀释度的阳性血清抗体的检测结果不同稀释度红峰移位(nm)性质(±)1:540(+)1:1040(+)1:2025(+)1:4015(+)1:6015(+)1:8010(+)1:10010(+)1:20010(+)1:4005(+)1:6000(-)由图30和表13看出,ⅴ期幼虫纯化抗原标记纳米金棒检测不同稀释度的血清抗体,经uv-vis扫描血清稀释比在1:5、1:10时表面等离子共振红峰移位最大值均为40nm,检测最大稀释度为1:400,随着血清含量的减少红峰移位逐渐减小,当稀释度达到1:600时纵向等离子共振吸收峰逐渐发生蓝移,血清抗体性质转阴,在稀释度检测方面,v期幼虫纯化抗原标记纳米金棒比ⅴ期幼虫抗原和lesa标记的纳米金棒灵敏度好。成虫粗抗原标记纳米金棒轻度感染的检测结果成虫粗抗原标记纳米金棒检测轻度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图31所示,检测轻度感染不同时间血清抗体红峰移位如表14所示。表14轻度感染不同时间血清抗体红峰移位的检测结果由图31和表14可以看出,成虫粗抗原标记纳米金棒检测轻度感染ac第5、7、14、21d的大鼠血清抗体,紫外分光光度计检测,lspr均有不同程度的红峰移位变化,且在感染第7d、21d出现最大峰值均为15nm。中度感染的检测结果成虫粗抗原标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图32所示,检测中度感染不同时间血清抗体红峰移位如表15所示。表15中度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)55(+)715(+)1420(+)2120(+)从图32和表15中看出,成虫粗抗原标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d的大鼠血清抗体,紫外分光光度计扫描,纵向等离子共振带吸收峰在感染第14d、21d时出现了最大红峰移位20nm。重度感染的检测结果成虫粗抗原标记纳米金棒检测重度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图33所示,检测重度感染不同时间血清抗体红峰移位如表16所示。表16重度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)510(+)730(+)1415(+)2120(+)由图33和表16得出,成虫粗抗原标记纳米金棒检测重度感染ac第5、7、14、21d的大鼠血清抗体,uv-vis扫描纵向等离子共振带吸收峰在感染第7d出现了最大红移30nm。随着感染度的增加,抗体含量也逐渐增加,紫外分光光度计扫描的表面等离子共振带红峰移位也相应增大,其中感染第5d出现的红峰移位均比轻中度敏感性高。检测不同稀释度的阳性血清抗体成虫粗抗原标记纳米金棒检测不同稀释度的阳性血清抗体的检测结果请参照附图34以及表17。表17不同稀释度的阳性血清抗体的检测结果不同稀释度红峰移位(nm)性质(±)1:530(+)1:1030(+)1:2025(+)1:4020(+)1:6015(+)1:8010(+)1:1005(+)1:2005(+)1:4000(-)1:6000(-)从图34和表17得知,成虫粗抗原标记纳米金棒检测不同浓度梯度的血清抗体,由uv-vis扫描血清稀释比在1:5、1:10时表面等离子共振红峰移位最大值均为30nm,检测最大稀释度为1:200。随着血清抗体含量的减少红峰移位逐渐减小,当稀释度达到1:400、1:600时纵向等离子共振吸收峰逐渐发生蓝移,血清抗体性质转阴。成虫纯化抗原标记纳米金棒轻度感染的检测结果成虫纯化抗原(45kd)标记纳米金棒检测轻度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图35所示,检测轻度感染不同时间血清抗体红峰移位如表18所示。表18轻度感染不同时间血清抗体红峰移位的检测结果由图35和表18可以看出,成虫纯化抗原标记纳米金棒检测轻度感染ac第5、7、14、21d的大鼠血清抗体,紫外分光光度计检测表面等离子共振吸收峰都发生了红移,在感染第14d、21d红峰移位变化均为20nm。中度感染的检测结果成虫纯化抗原标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附图36所示,检测中度感染不同时间血清抗体红峰移位如表19所示。表19中度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)515(+)720(+)1445(+)2125(+)从图36和表19中看出,成虫纯化抗原标记纳米金棒检测中度感染广州管圆线虫第5、7、14、21d的大鼠血清抗体,紫外分光光度计检测表面等离子共振吸收峰都发生了红移,其中在感染第5d时红峰移位相比其他各类抗原功能化纳米金棒检测该时期的红峰移位变化幅度大,并在感染第14d红峰移位变化最大为45nm。重度感染的检测结果成虫抗原标记纳米金棒检测重度感染广州管圆线虫第5、7、14、21d的血清抗体的检测结果如附37所示,检测重度感染不同时间血清抗体红峰移位如表20所示。表20重度感染不同时间血清抗体红峰移位的检测结果感染时间(d)红峰移位(nm)性质(±)510(+)745(+)1445(+)2140(+)由图37和表20得出,成虫纯化抗原标记纳米金棒检测重度感染ac第5、7、14、21d的大鼠血清抗体,紫外分光光度计扫面表面等离子共振吸收峰均有红峰移位的变化,随着感染度的增加,在感染第7d、14d红峰移位变化最大为45nm。成虫纯化抗原每一时段的检测相比上述其他各类抗原红峰移位占有一定的优势,这与感染度和单一组分抗原有关,使得纳米金棒表面结合的有效分子量增加。检测不同稀释度的阳性血清抗体成虫纯化抗原标记纳米金棒检测不同稀释度的阳性血清抗体的检测结果请参照附图38以及表21。表21不同稀释度的阳性血清抗体的检测结果不同稀释度红峰移位(nm)性质(±)1:550(+)1:1045(+)1:2035(+)1:4025(+)1:6025(+)1:8020(+)1:10015(+)1:20010(+)1:40010(+)1:6005(+)1:8000(-)由图38和表21得知,成虫纯化抗原标记纳米金棒检测不同稀释度阳性血清抗体,由uv-vis扫描血清稀释比在1:5时表面等离子共振红峰移位最大值为50nm,检测最大稀释度为1:600。随着血清抗体含量的减少红峰移位逐渐减小,当稀释度达到1:800时纵向等离子共振吸收峰逐渐发生蓝移,血清抗体性质转阴。相比其他各类抗原检测不同稀释度的血清抗体,成虫纯化抗原的表面等离子共振吸收峰红峰移位变化幅度更大,灵敏度更高。实施例5验证实施2提供的纳米金棒的检测早期性和敏感度。采用实施例4提供的实验过程,针对ⅴ期幼虫抗原、lesa和成虫抗原轻、中、重度感染及稀释度lspr红峰移位变化进行比较。v期幼虫抗原的检测结果如表22、表23以及表24所示。表22v期幼虫抗原轻度感染lspr变化表23v期幼虫抗原中度感染lspr变化表24v期幼虫抗原重度感染lspr变化由表22、23、24可知,v期幼虫抗原标记纳米金棒检测不同感染时间、不同感染量的血清抗体比较分析,得出ⅴ期幼虫纯化抗原较lesa以及v期幼虫粗抗原lspr红峰波动范围变化大,lesa的检测效果较v期幼虫粗抗原有一定的优势。成虫抗原的比较结果如表25、表26以及表27所示。表25成虫抗原轻度感染lspr变化感染天数(d)成虫纯化抗原(nm)成虫粗抗原(nm)55572015142010211515表26成虫抗原中度感染lspr变化感染天数(d)成虫纯化抗原(nm)成虫粗抗原(nm)515572015144520212520表27成虫抗原重度感染lspr变化感染天数(d)成虫纯化抗原(nm)成虫粗抗原(nm)5101074530144515214020由表25、26、27成虫抗原标记纳米金棒检测不同感染时间、不同感染度的大鼠血清抗体,从表中得出成虫纯化抗原较成虫粗抗原具有一定的优势。对比分析ⅴ期幼虫纯化抗原和成虫纯化抗原标记纳米金棒检测血清抗体,可以得出成虫纯化抗原在早期检测方面敏感性较ⅴ期幼虫纯化抗原高,也优于其他各类抗原。各类抗原不同稀释度阳性血清抗体lspr变化如表28所示。表28抗体lspr变化备注:表格中(-)代表阴性,(+)代表阳性由表28比较分析得知,成虫纯化抗原的灵敏度优于其他各类抗原,lesa的灵敏度高于除成虫纯化抗原外的其他抗原,ⅴ期幼虫纯化抗原的灵敏度又比成虫粗抗原和v期幼虫粗抗原好,ⅴ期幼虫抗原较成虫粗抗原的灵敏度有相一定的优势。成虫纯化抗原在不同感染度、不同感染时间和不同稀释度方面的检测上较其他各类抗原具有一定的优势,在广州管圆线虫病检测中具有良好的早期性和敏感性。成虫纯化抗原与elisa检测结果比较:elisa检测将elisa试剂盒内的包被板从4℃环境中取出平衡至室温。洗涤液配制:50ml10×洗涤液加450ml纯水充分混匀后即为洗涤液。设置阴阳性对照2孔,空白对照2孔。样品的处理及上样:将放在-80℃的血清放入-20℃内平衡3h(2~3h)后再放入4℃环境中解冻大约1h。用样品稀释液将样品按照1:100稀释,每孔加1μl待测血清加99μl稀释液。空白对照2孔每孔加100μl的样品稀释液,阴性对照2孔分别加入100μl阴性对照品,阳性对照2孔分别加入100μl阳性对照品,盖上封板摸,37℃避光反应30min。洗板:甩去孔内液体,每孔加满工作浓度洗涤液洗涤3次,每次均需停留1min,最后一次甩干,拍干。加酶反应:除空白对照孔外,其余每孔加酶结合物1滴,盖好封板摸,37℃避光反应30min,甩去孔内液体,洗板(同上)。显色反应:加底物和显色液各1滴,混匀,盖好封板摸,37℃避光显色10min。停止反应:加终止液1滴,以空白对照调零,用酶标仪于450nm波长读取od值。结果分析:阴性对照孔od≤0.20,阳性对照od≥0.20,该实验有效。阳性判定:样品od值≥阴性对照孔od值×2.1时,判为广州管圆线虫igg抗体为阳性,反之为阴性。elisa轻度感染检测结果如表29、图39所示。表29elisa轻度感染检测结果感染时间(d)iggod值(均值±标准差)od大于cut-off值为阳性(+)50.0550±0.0023-70.0619±0.0040-140.5544±0.0057+210.5123±0.0011+280.4304±0.0554+350.6054±0.0896+420.6716±0.0412+490.6842±0.1485+560.7711±0.0211+备注:cut-off值(coⅴ)=阴性对照孔od×2.1,本实验所测cut-off值为0.1162。elisa中度感染检测结果如表30以及图40所示。表30elisa中度感染检测结果感染时间(d)iggod值(均值±标准差)od大于cut-off值为阳性(+)50.0560±0.0005-70.4765±0.0158+140.4974±0.0554+210.5465±0.0791+280.5025±0.0153+350.6411±0.0158+420.7735±0.0537+490.92919±0.2111+elisa重度感染检测结果如表31以及图41所示。表31elisa重度感染检测结果感染时间(d)iggod值(均值±标准差)od大于cut-off值为阳性(+)50.0562±0.0027-70.4535±0.0237+140.5020±0.0947+210.5905±0.0072+280.6642±0.0441+350.7510±0.0301+420.8045±0.1131+491.1091±0.0669+由表29和图39知,在感染50条第iii期幼虫的第14天开始igg抗体水平逐渐升高,随着感染时间的延长抗体水平会逐渐升高。从图40和表30中可以看出中度感染的血清igg抗体从第7天起逐渐升高,相较于图39抗体水平升高的幅度更大,抗体水平的变化与虫体的感染量有关。由表29可以得出,广州管圆线虫轻度感染的大鼠血清抗体从第14天开始,elisa检测的血清抗体结果为阳性,而中度、重度感染的大鼠血清均从第7天开始elisa检测结果为阳性。从表31和图41中可以看出随着感染量的增加,抗体igg含量逐渐增加,相比轻中度感染的血清igg抗体变化幅度更大,igg升高有两个阶段,一个从感染后第5天逐渐升高,之后又从28天开始呈大幅度上升趋势。elisa检测不同稀释度的阳性血清抗体采用elisa法检测感染广州管圆线虫不同稀释度的阳性大鼠血清抗体,对elisa法检测的敏感性的评定:将阳性大鼠血清按照一定的比例稀释,请参照表32和图42。表32elisa检测感染不同稀释度结果不同稀释度iggod值(均值±标准差)od大于cut-off值为阳性(+)1:50.7026±0.0382+1:100.6346±0.0982+1:200.6067±0.0000+1:400.5817±0.0484+1:600.5775±0.0227+1:800.5136±0.0064+1:1000.4348±0.0136+1:2000.1598±0.0359+1:4000.0555±0.0017-1:6000.0553±0.0033-1:8000.0482±0.0036-由表32可知,随着稀释度的增加,样品所测得的od值逐渐下降,当阳性血清的稀释度达1:400时检测结果为阴性。由图42也可以看出igg抗体水平逐渐下降。因此,结合表22、23、24、25、26、27与表29、30、31,可知在感染第5d时elisa的检测结果均为阴性,轻度感染是从感染的第14d开始检测到的血清抗体才为阳性;中、重度感染是从感染后第7d开始血清抗体为阳性。本发明实施例2听过的纳米金棒在轻、中、重感染第5d均有红峰移位的变化,表明本发明提供的纳米金棒检出率高。随着感染度的增加和抗原纯度的提高,表面等离子共振吸收峰的红峰移位变化幅度逐渐增大。证实了本发明提供的纳米金棒具有早期识别感染广州管圆线虫的能力。由表28和32,可以看出elisa检测不同稀释度的阳性血清抗体,最大稀释度达1:200,功能化纳米金棒最大稀释度为1:600,表明实施例2提供的纳米金棒比常规的elisa检测法灵敏度高。综上,本发明实施例提供了一种检测广州管圆线虫的纳米金以及包含该纳米金的试剂盒。该纳米金由纳米金基质包被广州管圆线幼虫抗原制成,该纳米金能够检测广州管圆线虫,具有良好的检测早期性和敏感度,且检测效率高,检测结果精准度好。本发明实施例还提供了制备上述纳米金的方法和检测广州管圆线虫的方法。具体地,该制备方法能够制备出可以快速精确检测广州管圆线虫的纳米金,该检测方法具有能够早期、快速、高效检测广州管圆线幼虫的优点。以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1