一种化学发光微阵列芯片的应用的制作方法
本发明属于化学发光分析领域,具体涉及一种化学发光微阵列芯片在制备用于同时检测多个心肌损伤标志物的试剂盒中的应用。
背景技术:
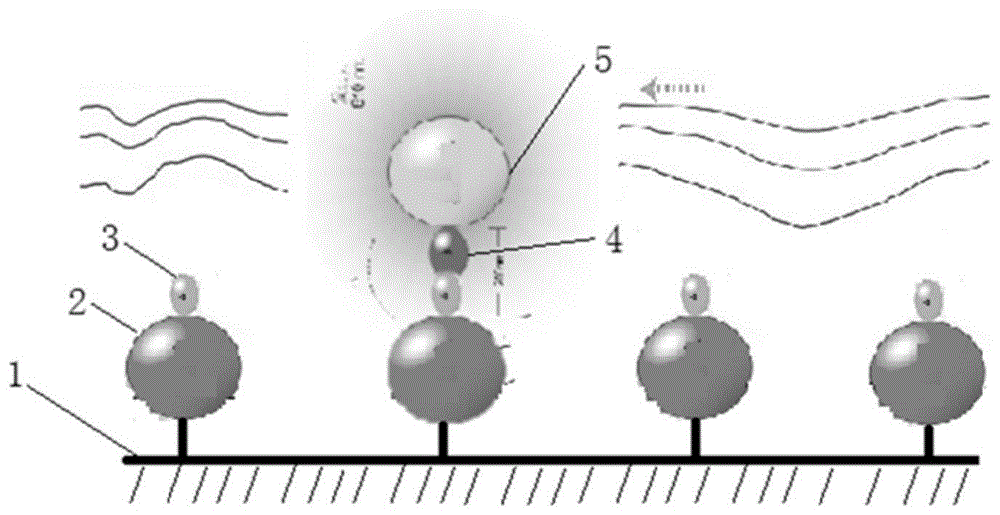
:心血管疾病包括心脏和血管系统疾病。由心血管疾病引起的死亡人数约占世界总死亡人数的1/4,被称为人类健康的“头号杀手”,严重威胁人类的生命和生活质量,造成巨大的人力和经济资源的浪费。目前对心血管疾病的诊断和预测主要是利用化学发光免疫分析对心肌损伤的多个标志物进行检测。化学发光免疫分析(chemiluminescenceimmunoassay,clia)是近十年来在世界范围内发展非常迅速的非放射性免疫分析。根据测定过程中是否要将待测物质与反应体系分离,免疫分析可以分为非均相免疫分析和均相免疫分析;非均相免疫分析,是指在引入探针进行标记的操作过程中,各种相关试剂混合反应后需要进行分离,将待测物与反应体系分离后再进行检测,是现在免疫分析中的主流方向,如:酶促化学发光分析、磁微球化学发光免疫分析。均相免疫分析是指在测定过程中将待测物与反应体系中的相关试剂混合反应后直接测定,例如:光激化学发光分析、电化学发光分析。利用均相免疫分析对心肌损伤标志物的检测虽然省去了分离洗涤步骤,但是血清或血浆中的一些物质却会干扰标记信号检测或干扰化学发光反应。同时,在均相标记免疫分析技术中涉及化学发光的领域,有的涉及氧化还原反应,如血液标本中含有一些氧化-还原药物(如维生素c)同样干扰光信号的产生过程,严重影响检测结果的准确性。另外,目前均相免疫分析的每次反应仅能针对一个指标进行检测,费时费力。技术实现要素:为了解决现有技术的不足,本发明提供了一种均相化学发光免疫检测芯片作为制备用于诊断患者心血管疾病的化学发光免疫检测试剂盒中的用途,利用化学发光阵列微芯片的均相检测方法可同时检测多个心肌损伤标志物,反应速度快、检测时间短,且有效消除均相免疫检测中的基质效应,提高了检测的准确性。为此,本发明第一方面提供了一种均相化学发光免疫检测芯片作为制备用于诊断患者心血管疾病的化学发光免疫检测试剂盒中的用途,所述均相化学发光免疫检测芯片包括表面设置有化学发光配对微球中任一微球的固相支持物;所述化学发光配对微球中的任一微球能够在能量或者活性化合物的激发下生成活性氧,所述活性氧能够与其接触到的所述化学发光配对微球中的另一种微球反应产生化学发光信号;所述设置在固相支持物表面的化学发光配对微球中的任一种微球上连接有抗体,所述抗体包括如下至少一种抗体:抗ctni抗体、抗ctnt抗体、抗il-6抗体、抗ck-mb抗体、抗myo抗体、抗nt-probnp抗体和抗pct抗体。在本发明的一些实施方式中,所述化学发光免疫检测试剂盒通过包含下列步骤的方法来诊断患者的心血管疾病:步骤s1,将包含化学发光配对微球中的第一微球及疑似包含待测目标分子的待测物的液相反应物与固相支持物表面接触反应,其中所述固相支持物表面设置有化学发光配对微球中对应的第二微球;步骤s2,利用能量或活性化合物激发化学发光配对微球中的一种微球生成活性氧,化学发光配对微球中的另一种微球与其接触到的活性氧反应产生化学发光信号;步骤s3,检测步骤s2中所述化学发光信号的强度,分析待测物中是否存在待测目标分子和/或待测目标分子的浓度;所述待测目标分子包括多个心肌损伤标志物。在本发明的一些实施方式中,所述第二微球为供体微球。在本发明的另一些实施方式中,所述第一微球为受体微球。在本发明的一些实施方式中,所述固相支持物选自玻璃芯片、石英芯片、塑料芯片、高分子聚合物芯片、高分子微球、磁性微球、微孔板、nc膜和pdvf膜。在本发明的一些优选的实施方式中,所述第二微球呈阵列式分布于固相支持物表面的不同区域。在本发明的一些具体实施方式中,所述第二微球与磁性微球连接,所述磁性微球通过磁场固定在固相支持物的表面。在本发明的另一些具体实施方式中,所述第二微球通过其表面修饰的分子与固相支持物表面修饰的化学基团的化学键作用固定在固相支持物的表面;优选地,所述化学键选自离子键、共价键、金属键和配位键;进一步优选为共价键。在本发明的一些具体实施方式中,所述第二微球通过其表面修饰的分子与固相支持物表面修饰的分子之间的分子间作用力固定在固相支持物的表面;优选地,所述分子间的作用力选自氢键、范德华力、离子键、疏水作用力、芳环堆积作用和卤键;进一步优选为氢键。在本发明的一些实施方式中,所述固相支持物表面阵列分布4-200个反应孔。在本发明的另一些实施方式中,所述固相支持物表面阵列分布4-200个微孔,每个微孔中设置至少1个反应孔。在本发明的一些实施方式中,所述反应孔的直径小于第二微球的粒径。在本发明的一些具体实施方式中,所述第二微球凹陷在所述反应孔中。在本发明的一些实施方式中,所述第一微球和/或第二微球表面包被有葡聚糖,所述葡聚糖表面修饰有化学基团,所述化学基团选自醛基、羧基、巯基、氨基和羟基。在本发明的另一些实施方式中,所述固相支持物表面还设置有一个定位基准点。在本发明的一些实施方式中,所述第二微球表面直接或间接连接有第一特异结合物,所述第一特异性结合物为能够与待测目标分子特异性结合的抗体ⅰ。在本发明的另一些实施方式中,在步骤s1之前,首先将固相支持物与第一特异结合物接触反应,通过特异性配对物的相互作用将第一特异结合物连接至所述第二微球的表面。在本发明的一些具体实施方式中,所述步骤s1包括以下步骤:步骤s1-101,将疑似包含待测目标分子的待测物的液相反应物与固相支持物接触反应;步骤s1-102,再将第二特异结合物与固相支持物表面接触反应;步骤s1-103,最后将第一微球与固相支持物表面接触反应;其中,所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ,且第二特异结合物能够与第一微球通过特异性配对物连接。在本发明的另一些具体实施方式中,所述步骤s1包括以下步骤:步骤s1-201,将包含第二特异结合物以及疑似含有待测目标分子的待测物的液相反应物与固相支持物表面接触反应;步骤s1-202,再将第一微球与固相支持物表面接触反应;其中,所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ,且第二特异结合物能够与第一微球通过特异性配对物连接。在本发明的一些具体实施方式中,所述步骤s1包括以下步骤:步骤s1-301,将疑似包含待测目标分子的待测物的液相反应物与固相支持物接触反应;步骤s1-302,再将连接有第二特异结合物的第一微球与固相支持物表面接触反应;其中,所述第二特异结合物与第一微球之间通过特异性配对物相连接,且所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ。在本发明的另一些具体实施方式中,所述步骤s1包括以下步骤:步骤s1-401,将疑似包含待测目标分子的待测物的液相反应物与固相支持物接触反应;步骤s1-402,再将第二特异结合物与第一微球的混合物与固相支持物表面接触反应;其中,所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ,且第二特异结合物能够与第一微球通过特异性配对物连接。在本发明的一些具体实施方式中,所述步骤s1包括以下步骤:将疑似包含待测目标分子的待测物的液相反应物、第二特异结合物、第一微球的混合物与固相支持物表面接触反应;其中,所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ,且第二特异结合物能够与第一微球通过特异性配对物连接。在本发明的一些实施方式中,所述疑似包含待测目标分子的待测物的液相反应物流过固相支持物的表面,以流动方式与固相支持物表面的第二微球接触反应。在本发明的一些实施方式中,所述化学发光配对微球中的一种微球为供体微球,其为光活化的或化学活化的敏化剂。在本发明的另一些实施方式中,所述供体微球为填充有光敏剂的高分子微球,其在光激发下能够产生活性氧。在本发明的一些实施方式中,所述光敏剂选自亚甲基蓝、玫瑰红、卟碄和酞菁中的一种。在本发明的另一些实施方式中,所述供体微球的粒径为100-500nm,优选为150-400nm,更优选为200-400nm。在本发明的一些实施方式中,所述化学发光配对微球中的另一种微球为受体微球,其包含化学发光化合物和金属螯合物。在本发明的另一些实施方式中,所述受体微球包含发光组合物和基质,所述发光组合物填充于基质中和/或包被于基质表面。在本发明的一些实施方式中,所述发光组合物能够与活性氧反应产生可检测的化学发光信号,其包含化学发光化合物和金属螯合物。在本发明的另一些实施方式中,所述化学发光化合物选自烯烃化合物,优选选自二甲基噻吩、双丁二酮化合物、二氧杂环己烯、烯醇醚、烯胺、9-亚烷基苍耳烷、9-亚烷基-n-9,10二氢化吖啶、芳基乙醚烯、芳基咪唑和光泽精以及它们的衍生物,更优选选自二甲基噻吩及其衍生物。在本发明的一些实施方式中,所述金属螯合物的金属为稀土金属或viii族金属,优选选自铕、铽、镝、钐、锇和钌,更优选选自铕。在本发明的另一些实施方式中,所述金属螯合物包含选自下列的螯合剂:nha、bhht、bhhct、dpp、tta、nppta、nta、topo、tppo、bfta、2,2-二甲基-4-全氟丁酰-3-丁酮(fod)、2,2’-联吡啶(bpy)、联吡啶基羧酸、氮杂冠醚、氮杂穴状配体和三辛基氧化膦以及它们的衍生物。在本发明的一些具体实施方式中,所述化学发光化合物是二甲基噻吩的衍生物,所述金属螯合物是铕螯合物。在本发明的一些实施方式中,所述基质选自高分子微球,优选为乳胶微球,更优选为聚苯乙烯微球。在本发明的一些实施方式中,所述受体微球的粒径为100-500nm,优选为150-400nm,更优选为200-400nm。在本发明的一些实施方式中,步骤s2中,利用600~700nm的红色激发光照射固相支持物的表面,以激发其表面的受体微球产生活性氧。在本发明的一些实施方式中,步骤s2中所述化学发光信号的检测波长为520-620nm。在本发明的一些实施方式中,所述心肌损伤标志物选自ctni、ctnt、il-6、ck-mb、myo、nt-probnp和pct中的一种以上。本发明的有益效果为:本发明提供了一种均相化学发光免疫检测芯片作为制备用于诊断患者心血管疾病的化学发光免疫检测试剂盒中的用途,利用化学发光阵列微芯片的均相检测方法可有效消除均相检测中的基质效应,提高了检测的灵敏度和准确性,且反应速度快,检测时间短,可应用到多种生物分子的测定,包括酶活性、受体配体反应、低亲和力的反应、第二信使水平、dna、rna、蛋白质、多肽、碳水化合物。同时该方法可同时检测多个待检分子,具有快速、高效、低成本等优点。附图说明下面将结合附图对本发明作进一步说明。图1为本发明实施例3的原理图;图中附图标记的含义如下:1固相支持物;2供体微球;3第一特异性结合物(与待测目标分子结合的抗体ⅰ);4第二特异性结合物(与待测目标分子结合的抗体ⅱ);5受体微球。图2为本发明实施例3的检测结果图。图3为本发明实施例4的原理图;图中附图标记的含义如下:1固相支持物;2供体微球;3第一特异性结合物(与待测目标分子结合的抗体ⅰ);4第二特异性结合物(与待测目标分子结合的抗体ⅱ);5受体微球。具体实施方式为使本发明容易理解,下面将详细说明本发明。但在详细描述本发明前,应当理解本发明不限于描述的具体实施方式。还应当理解,本文中使用的术语仅为了描述具体实施方式,而并不表示限制性的。在提供了数值范围的情况下,应当理解所述范围的上限和下限和所述规定范围中的任何其他规定或居间数值之间的每个居间数值均涵盖在本发明内。这些较小范围的上限和下限可以独立包括在较小的范围中,并且也涵盖在本发明内,服从规定范围中任何明确排除的限度。在规定的范围包含一个或两个限度的情况下,排除那些包括的限度之任一或两者的范围也包含在本发明中。除非另有定义,本文中使用的所有术语与本发明所属领域的普通技术人员的通常理解具有相同的意义。虽然与本文中描述的方法和材料类似或等同的任何方法和材料也可以在本发明的实施或测试中使用,但是现在描述了优选的方法和材料。ⅰ.术语本发明所述用语“均相”所对应的英文定义为“homogeneous”,其是指无须对结合的抗原抗体复合物和剩余的游离抗原或抗体进行分离既可进行检测。本发明所述用语“液相反应物”是指包含能够与固相支持物表面的物质发生相互作用或化学反应的试剂。本发明所述“待测目标分子”可以为dna、rna、蛋白质、多肽、碳水化合物等,优选为蛋白质,更优选为免疫分子,例如抗原或抗体。本发明所述用语“待检物”是指可能含有待测目标分子的的一种混合物。可以被用在本发明公开的方法中的典型待检样本包括体液,如血液、血浆、血清、尿、精液、唾液等。本发明所述用语“特异结合物”是指能够与待测目标分子特异性结合的物质。本发明所述用语“特异配对物”是指能够相互特异性结合的一对物质。本发明所述用语“结合”指由于例如共价、静电、疏水、离子和/或氢键等相互作用,包括但不限于如盐桥和水桥等相互作用引起的两个分子间的直接联合。本发明所述用语“特异性结合”,是指两种物质之间的相互辨别和选择性结合反应,从立体结构角度上说就是相应的反应物之间构象的对应性。本发明所述用语“化学发光配对微球”是由受体微球和供体微球构成的一对物质。当用能量或活化化合物激发供体微球时,供体微球表面的光敏剂分解周围环境中的氧,形成活性氧(单线态氧),活性氧扩散到附近的受体微球,将能量传递给受体微球,从而产生激发光。本发明所述用语“供体微球”是指通过能量或者活性化合物的激活后能够产生与受体微球反应的诸如单线态氧的活性中间体的敏化剂。供体微球可以是光活化的(如染料和芳香化合物)或者化学活化的(如酶、金属盐等)。在本发明一些具体实施例中,所述供体微球为填充有光敏剂的高分子微球,所述光敏剂可以是本领域已知的光敏剂,优选相对光稳定且不与单线态氧有效反应的化合物,其非限定性的例子包括例如美国专利us5709994(该专利文献在此全文引为参考)公开的亚甲基蓝、玫瑰红、卟啉、酞菁和叶绿素等化合物,以及这些化合物的具有1-50个原子取代基的衍生物,所述取代基用于使得这些化合物更具有亲脂性或更具有亲水性、和/或作为连接至特异性结合配对成员的连接基团。本领域技术人员已知的其他光敏剂的例子也可以在本发明中使用,例如美国专利us6406913中记载的内容,该专利文献并入本文以供参考。本发明所述用语“受体微球”是指能够与单线态氧反应可以产生可检测信号的化合物。供体微球被能量或者活性化合物诱导激活并释放高能态的单线态氧,该高能态的单线态氧被近距离的受体微球俘获,从而传递能量以激活所述受体微球。在本发明的一些具体实施方式中,所述受体微球包含发光组合物和基质,所述发光组合物填充于基质中和/或包被于基质表面。本发明所述“基体”是本领域技术人员所公知的微球或微粒,其可以是任何尺寸的,其可以是有机的或是无机的,其可以是可膨胀或不可膨胀的,其可以是多孔的或非多孔的,其具有任何密度,但优选具有和水接近的密度,优选能漂浮于水中,且由透明、部分透明或不透明的材料构成。所述基体可以有或没有电荷,当带有电荷时,优选是负电荷。所述基体可以是乳胶颗粒或是含有有机或无机聚合物的其他颗粒、脂双层如脂质体、磷脂囊泡、小油滴、硅颗粒、金属溶胶、细胞和微晶染料。本发明所述用语“生物素”广泛存在于动植物组织中,其分子上有两个环状结构,分别为咪唑酮环和噻吩环,其中咪唑酮环是与链霉亲和素结合的主要部位。活化的生物素可以在蛋白质交联剂的介导下,与已知的几乎所有生物大分子偶联,包括蛋白质、核酸、多糖和脂类等。“亲和素”分子由4条相同的肽链组成,其中每条肽链都能结合一个生物素。因此每个抗原或抗体可同时偶联多个生物素分子,从而产生“触手效应”提高分析灵敏度。ⅱ.具体实施方案下面将详细说明本发明。本发明第一方面所涉及的均相化学发光免疫检测芯片作为制备用于诊断患者心血管疾病的化学发光免疫检测试剂盒中的用途,所述均相化学发光免疫检测芯片包括表面设置有化学发光配对微球中任一微球的固相支持物;所述化学发光配对微球中的任一微球能够在能量或者活性化合物的激发下生成活性氧,所述活性氧能够与其接触到的所述化学发光配对微球中的另一种微球反应产生化学发光信号;所述设置在固相支持物表面的化学发光配对微球中的任一种微球上连接有抗体,所述抗体包括如下至少一种抗体:抗ctni抗体、抗ctnt抗体、抗il-6抗体、抗ck-mb抗体、抗myo抗体、抗nt-probnp抗体和抗pct抗体。在本发明的一些实施方式中,所述化学发光免疫检测试剂盒通过包含下列步骤的方法来诊断患者的心血管疾病:步骤s1,将包含化学发光配对微球中的第一微球及疑似包含待测目标分子的待测物的液相反应物与固相支持物表面接触反应,其中所述固相支持物表面设置有化学发光配对微球中对应的第二微球;步骤s2,利用能量或活性化合物激发化学发光配对微球中的一种微球生成活性氧,化学发光配对微球中的另一种微球与其接触到的活性氧反应产生化学发光信号;步骤s3,检测步骤s2中所述化学发光信号的强度,分析待测物中是否存在待测目标分子和/或待测目标分子的浓度;所述待测目标分子包括多个心肌损伤标志物。在本发明的一些实施方式中,所述第二微球为供体微球。在本发明的另一些实施方式中,所述第一微球为受体微球。在本发明的一些实施方式中,所述固相支持物选自玻璃芯片、石英芯片、塑料芯片、高分子聚合物芯片、高分子微球、磁性微球、微孔板、nc膜和pdvf膜。在本发明的一些优选的实施方式中,所述第二微球呈阵列式分布于固相支持物表面的不同区域。在本发明的一些具体实施方式中,所述第二微球与磁性微球连接,所述磁性微球通过磁场固定在固相支持物的表面。在本发明的另一些具体实施方式中,所述第二微球通过其表面修饰的分子与固相支持物表面修饰的化学基团的化学键作用固定在固相支持物的表面;优选地,所述化学键选自离子键、共价键、金属键和配位键;进一步优选为共价键。在本发明的一些具体实施方式中,所述第二微球通过其表面修饰的分子与固相支持物表面修饰的分子之间的分子间作用力固定在固相支持物的表面;优选地,所述分子间的作用力选自氢键、范德华力、离子键、疏水作用力、芳环堆积作用和卤键;进一步优选为氢键。在本发明的一些实施方式中,所述固相支持物表面阵列分布4-200个反应孔。在本发明的另一些实施方式中,所述固相支持物表面阵列分布4-200个微孔,每个微孔中设置至少1个反应孔。在本发明的一些实施方式中,所述反应孔的直径小于第二微球的粒径。在本发明的一些具体实施方式中,所述第二微球凹陷在所述反应孔中。在本发明的一些实施方式中,所述第一微球和/或第二微球表面包被有葡聚糖,所述葡聚糖表面修饰有化学基团,所述化学基团选自醛基、羧基、巯基、氨基和羟基。在本发明的另一些实施方式中,所述固相支持物表面还设置有一个定位基准点。在本发明的一些实施方式中,所述第二微球表面直接或间接连接有第一特异结合物,所述第一特异性结合物为能够与待测目标分子特异性结合的抗体ⅰ。在本发明的另一些实施方式中,在步骤s1之前,首先将固相支持物与第一特异结合物接触反应,通过特异性配对物的相互作用将第一特异结合物连接至所述第二微球的表面。在本发明的一些具体实施方式中,所述步骤s1包括以下步骤:步骤s1-101,将疑似包含待测目标分子的待测物的液相反应物与固相支持物接触反应;步骤s1-102,再将第二特异结合物与固相支持物表面接触反应;步骤s1-103,最后将第一微球与固相支持物表面接触反应;其中,所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ,且第二特异结合物能够与第一微球通过特异性配对物连接。在本发明的另一些具体实施方式中,所述步骤s1包括以下步骤:步骤s1-201,将包含第二特异结合物以及疑似含有待测目标分子的待测物的液相反应物与固相支持物表面接触反应;步骤s1-202,再将第一微球与固相支持物表面接触反应;其中,所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ,且第二特异结合物能够与第一微球通过特异性配对物连接。在本发明的一些具体实施方式中,所述步骤s1包括以下步骤:步骤s1-301,将疑似包含待测目标分子的待测物的液相反应物与固相支持物接触反应;步骤s1-302,再将连接有第二特异结合物的第一微球与固相支持物表面接触反应;其中,所述第二特异结合物与第一微球之间通过特异性配对物相连接,且所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ。在本发明的另一些具体实施方式中,所述步骤s1包括以下步骤:步骤s1-401,将疑似包含待测目标分子的待测物的液相反应物与固相支持物接触反应;步骤s1-402,再将第二特异结合物与第一微球的混合物与固相支持物表面接触反应;其中,所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ,且第二特异结合物能够与第一微球通过特异性配对物连接。在本发明的一些具体实施方式中,所述步骤s1包括以下步骤:将疑似包含待测目标分子的待测物的液相反应物、第二特异结合物、第一微球的混合物与固相支持物表面接触反应;其中,所述第二特异结合物为能够与待测目标分子特异性结合的抗体ⅱ,且第二特异结合物能够与第一微球通过特异性配对物连接。在本发明的一些实施方式中,所述疑似包含待测目标分子的待测物的液相反应物流过固相支持物的表面,以流动方式与固相支持物表面的第二微球接触反应。本发明所述方法中,所述接触反应均可以根据需要进行温育。具体地,所述温育的温度可以是35-45℃,时间可以是10-60min;优选地,所述温育的温度可以选自36℃、37℃、38℃、39℃、40℃、41℃、42℃、43℃或44℃;温育的时间可以选自10min、20min、30min、35min、40min、45min、50min、55min或60min。在本发明的一些实施方式中,所述化学发光配对微球中的一种微球为供体微球,其为光活化的或化学活化的敏化剂。在本发明的另一些实施方式中,所述供体微球为填充有光敏剂的高分子微球,其在光激发下能够产生活性氧。在本发明的一些实施方式中,所述光敏剂选自亚甲基蓝、玫瑰红、卟碄和酞菁中的一种。在本发明的另一些实施方式中,所述供体微球的粒径为100-500nm,优选为150-400nm,更优选为200-400nm。本发明的一些具体实施方式中,所述供体微球的粒径可以为100nm、150nm、200nm、250nm、300nm、400nm以及500nm。在本发明的一些实施方式中,所述化学发光配对微球中的另一种微球为受体微球,其包含化学发光化合物和金属螯合物。在本发明的另一些实施方式中,所述受体微球包含发光组合物和基质,所述发光组合物填充于基质中和/或包被于基质表面。在本发明的一些实施方式中,所述发光组合物能够与活性氧反应产生可检测的化学发光信号,其包含化学发光化合物和金属螯合物。在本发明的另一些实施方式中,所述化学发光化合物选自烯烃化合物,优选选自二甲基噻吩、双丁二酮化合物、二氧杂环己烯、烯醇醚、烯胺、9-亚烷基苍耳烷、9-亚烷基-n-9,10二氢化吖啶、芳基乙醚烯、芳基咪唑和光泽精以及它们的衍生物,更优选选自二甲基噻吩及其衍生物。在本发明的一些实施方式中,所述金属螯合物的金属为稀土金属或viii族金属,优选选自铕、铽、镝、钐、锇和钌,更优选选自铕。在本发明的另一些实施方式中,所述金属螯合物包含选自下列的螯合剂:4’-(10-甲基-9-蒽基)-2,2’:6’2”-联三吡啶-6,6”-二甲胺]四乙酸(mtta)、2-(1’,1’,2’,2’,3’,3’-七氟-4’,6’-己二酮-6’-基)-萘(nha)、4,4’-二(2”,3”,3”-七氟-4”,6”-己二酮-6”-基)-邻-三联苯(bhht)、4,4’-二(1”,1”,1”,2”,2”,3”,3”-七氟-4”,6”-己二酮-6”-基)-氯代磺基-邻-三联苯(bhhct)、4,7-联苯-1,10-菲咯啉(dpp)、1,1,1-三氟丙酮(tta)、3-萘酰-1,1,1-三氟丙酮(nppta)、萘基三氟丁二酮(nta)、三辛基氧化膦(topo)、三苯基氧化膦(tppo)、3-苯甲酰-1,1,1-三氟丙酮(bfta)、2,2-二甲基-4-全氟丁酰-3-丁酮(fod)、2,2’-联吡啶(bpy)、联吡啶基羧酸、氮杂冠醚、氮杂穴状配体和三辛基氧化膦以及它们的衍生物。在本发明的一些具体实施方式中,所述化学发光化合物是二甲基噻吩的衍生物,所述金属螯合物是铕螯合物。在本发明的一些实施方式中,所述基质选自高分子微球,优选为乳胶微球,更优选为聚苯乙烯微球。在本发明的一些实施方式中,所述受体微球的粒径为100-500nm,优选为150-400nm,更优选为200-400nm。在本发明的一些具体实施方式中,所述受体微球的粒径可以为100nm、150nm、200nm、250nm、300nm、400nm以及500nm。在本发明的一些实施方式中,步骤s2中,利用600~700nm的红色激发光照射固相支持物的表面,以激发其表面的受体微球产生活性氧。在本发明的一些实施方式中,步骤s2中所述化学发光信号的检测波长为520-620nm。在本发明的一些实施方式中,所述心肌损伤标志物选自ctni、ctnt、il-6、ck-mb、myo、nt-probnp和pct中的一种以上。实施例为使本发明更加容易理解,下面将结合实施例来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径或常规方法制得。实施例1:用于同时检测ctni、ck-mb、myo、nt-probnp的化学发光微阵列芯片的制备。1.固相支持物表面的修饰。在4×4布局的玻璃芯片上,设置有16个反应区,在每个反应区的表面修饰能够与生物素分子连接的基团。(1)用dmso配制20mg/ml的生物素溶液,(2)用0.1mnahco3溶液将生物素溶液稀释至1mg/ml。(3)将修饰后的玻璃芯片浸润于以上生物素溶液中,2-8℃静置反应12-16小时。(4)取出玻璃芯片,用0.1mnahco3溶液清洗,获得表面修饰有生物素的固相支持物(玻璃芯片)。2.包被有亲和素的供体微球的制备1)供体微球的制备(1)准备25ml的圆底烧瓶,加入0.1g酞菁铜(ⅱ)、10mldmf,磁力搅拌,水浴升温至70℃,获得酞菁铜(ⅱ)溶液。(2)准备100ml的三口烧瓶,加入10ml95%乙醇、10ml水和10ml浓度为10%、粒径200nm的包被有醛基葡聚糖水凝胶的聚苯乙烯微球,磁力搅拌,水浴升温至70℃。(3)将步骤1中的酞菁铜(ⅱ)溶液缓慢滴加至步骤2中的三口烧瓶中,70℃反应2小时后停止搅拌,自然冷却,得到乳液。(4)将上述乳液离心1小时,30000g,离心后弃去上清液,用50%乙醇重新悬浮。重复离心清洗3次后用ph值=10的50mmcb缓冲液重新悬浮,使其终浓度为20mg/ml,获得供体微球溶液。2)供体微球包被亲和素(1)将供体微球离心处理去上清后加入0.05mmes缓冲液,微球浓度调节至200mg/ml。(2)用mes缓冲液配制10mg/ml的亲和素溶液,将处理好的供体微球悬浮液、10mg/ml的亲和素溶液以及mes缓冲液按一定体积比进行混合形成反应液。(3)反应:反应液37℃摇动混匀30min,加入25mg/mlnabh3cn溶液,37℃摇动反应48小时。(4)封闭:按照每1mg供体微球加入4ul150mg/ml甘氨酸,37℃,摇动反应16小时。(5)清洗:用pb缓冲液(含0.05%tween-20)进行清洗,调节浓度至10mg/ml,获得包被亲和素的供体微球溶液。3.供体微球在固相支持物表面的固定(1)在绿光灯下,将制备的表面修饰有生物素的玻璃芯片浸润于50ug/ml包被亲和素的供体微球的pb缓冲液(含0.05%tween-20)中,37℃温育2小时。(2)取出玻璃芯片于pb缓冲液(含0.05%tween-20)中清洗,获得表面固定供体微球的固相支持物(玻璃芯片)。4.生物素化的抗体ⅰ的制备(1)抗体处理:将ctni抗体ⅰ透析于0.1mnahco3溶液,测定抗体浓度并调节至1mg/ml。(2)用dmso配制16.17mg/ml的生物素溶液。(3)标记:取处理好的1mg/mlctni抗体ⅰ与配制好的生物素溶液,二者按照10000:54的体积比进行混合,迅速混匀,2-8℃静置反应12-16小时。(4)透析:将反应好的生物素标记抗体ⅰ透析于生物素标记透析缓冲液(ph=8.00)。(5)将透析好的生物素化抗体ⅰ吸出转移至干净离心管中,取样测定抗体浓度。将质检合格的生物素标记抗体ⅰ浓度调节至0.5mg/ml。如上方法,分别制备生物素化的ck-mb抗体ⅰ、myo抗体ⅰ、nt-probnp抗体ⅰ。5.抗体ⅰ在固相支持物(玻璃芯片)表面的固定(1)用生物素试剂缓冲液将生物素化抗体ⅰ稀释到2ug/ml。(2)用机器自动化点样仪,在玻璃芯片的如表1所示位置,分别点涂对应的生物素化抗体ⅰ,37℃温育2小时;(3)用生物素试剂缓冲液中清洗,然后于37℃静置烘干12-16小时,获得表面固定有相应抗体ⅰ的固相支持物(玻璃芯片),即可用于同时检测ctni、ck-mb、myo、nt-probnp的化学发光微阵列芯片。表11234actnictnictnictnibck-mbck-mbck-mbck-mbcmyomyomyomyodnt-probnpnt-probnpnt-probnpnt-probnp实施例2:包被有抗体ⅱ的受体微球的制备1)受体微球的制备(1)准备25ml的圆底烧瓶,加入0.1g铕(ⅲ)配合物,10ml95%乙醇,磁力搅拌,水浴升温至70℃,获得铕(ⅲ)配合物溶液。(2)准备100ml的三口烧瓶,加入10ml95%乙醇、10ml水和10ml浓度为10%、粒径200nm的包被有羧基葡聚糖水凝胶的聚苯乙烯微球,磁力搅拌,水浴升温至70℃。(3)将步骤1中的铕(ⅲ)配合物溶液缓慢滴加至步骤2中的三口烧瓶中,70℃反应2小时后停止搅拌,自然冷却,得到乳液。(4)将上述乳液离心1小时,30000g,离心后弃去上清液,然后用50%乙醇重新悬浮。重复离心清洗3次后用ph值=10的50mmcb缓冲液重新悬浮,使其终浓度为20mg/ml,获得粒受体微球溶液。2)受体微球包被抗体ⅱ(1)0.05mcb缓冲液(ph9.6)透析处理后的ctni抗体ⅱ。(2)将受体微球及ctni抗体ⅱ按一定比例混合后,放入恒温培养箱内的多管可调式旋转混合器上,37℃,25~40rpm,混匀14~18小时,形成反应液。(3)再加入8mg/ml的nabh4溶液,量取nabh4溶液,迅速加入反应液中,多管可调式旋转混合器25~40rpm,2~8℃,反应2小时。(4)清洗后定容,获得包被有ctni抗体ⅱ的受体微球溶液。如上方法,分别制备ck-mb抗体ⅱ、myo抗体ⅱ、nt-probnp抗体ⅱ包被的受体微球溶液。实施例3:利用化学发光微阵列芯片同时检测待测物中的ctni、ck-mb、myo、nt-probnp。(1)将4份样品分别取15ul点样于表1所示的1、2、3、4列。(2)将包被有ctni抗体ⅱ、ck-mb抗体ⅱ、myo抗体ⅱ、nt-probnp抗体ⅱ的受体微球分别用缓冲液稀释到50ug/ml,分别取15ul点样于表1所示的a、b、c、d行,37℃孵育10分钟。(3)利用680nm波长的激发光照射玻璃芯片,供体微球被诱导激活,并释放高能态的活性氧。该高能态的活性氧在近距离被受体微球俘获,从而传递能量以激活受体微球中的发光化合物。数微秒后,受体微球中的发光化合物将释放出612nm的高能级红光,用ccd成像技术显示检测结果。检测原理如图1所示,检测结果如图2所示。进一步利用转换器将光学信号转化为数字化的电信号,以数值大小呈现检测结果,如表2所示。表2信号值1234a32270389129515b345013612411217c52832179169d63951185127其检测信号与样本的浓度成线性关系,4份已知样品中ctni、ck-mb、myo、nt-probnp的浓度值如表3所示。表3已知浓度1234a975.12pg/ml1034.71pg/ml13.29pg/ml<2pg/mlb87.36ng/ml68.21ng/ml2.46ng/ml<0.1ng/mlc6.9ng/ml46.08ng/ml10.45ng/ml19.78ng/mld73.55pg/ml65.19pg/ml9.33pg/ml15.89pg/ml由四例浓度已知浓度临床样本的检测结果可知:(1)检测信号与对照浓度成线性关系,可转换得到准确的浓度。(2)低值样本检测信号很低,此方法灵敏度高。(3)只需要加少量样本和一种试剂,反应10分钟后即得到4个待测目标分子的浓度,检测方法快速简单。实施例4:利用化学发光微阵列芯片同时检测测物中的ctni、ck-mb、myo、nt-probnp。反应原理图如图3所示。首先通过注塑成型工艺,利用金属模具在pdms的表面注塑成型加工一个4×4布局的微流控芯片,在芯片表面设置有16个区域,每个区域内设置有1个反应孔,每个反应孔的粒径为200nm,同时设置一个定位基准点。将含有粒径为400nm的受体微球的试剂以合适的流速流经芯片的表面,严格控制液体的流速,使得受体微球凹陷在pdms芯片表面的反应孔中,受体微球表面连接有亲和素。然后将生物素化的抗体ⅰ(生物素化的ctni抗体ⅰ、ck-mb抗体ⅰ、myo抗体ⅰ、nt-probnp抗体ⅰ)流经pdms芯片表面,在37℃孵育60min,将抗体ⅰ固定在pdms芯片表面的受体微球上。pdms芯片表面的不同生物素化的抗体ⅰ的分布情况如表4所示。表41234actnictnictnictnibck-mbck-mbck-mbck-mbcmyomyomyomyodnt-probnpnt-probnpnt-probnpnt-probnp将4份样本分布流经上述pdms芯片表面的如表4所示的1、2、3、4列,再分别将包被ctni抗体ⅱ、ck-mb抗体ⅱ、myo抗体ⅱ、nt-probnp抗体ⅱ的供体微球的溶液流经pdms芯片表面的如表4所示的a、b、c、d行,供体微球的浓度为50ug/ml,在37℃孵育10min。利用680nm波长的激发光照射pdms芯片,供体微球被诱导激活,并释放高能态的活性氧离子。该高能态的活性氧离子在近距离被受体微球俘获,从而传递能量以激活受体微球中的发光化合物。数微秒后,受体微球中的发光化合物将释放出612nm的高能级红光,用ccd成像技术显示检测结果,再利用转换器将光学信号转化为数字化的电信号,其数值大小如下表5所示:表5信号值1234a23661892842354104b1590210395862677c1732116605681431486d21473159991678352659其检测信号值同样与样本的浓度成线性关系,4份已知样品中ctni、ck-mb、myo、nt-probnp的浓度值如表6所示。表6由表6可知,检测信号与对照浓度成线性关系,可转换得到准确的浓度。且低值样本检测信号很低,此方法灵敏度高,同时反应10分钟后即得到4个待测目标分子的浓度,检测方法快速简单。应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1