一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法与流程
本发明涉及生物检测技术领域,具体来说,涉及一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法。
背景技术:
金属对人体或者环境的利弊不单单取决于金属的种类、理化性质,金属存在于自然界中的浓度,及其化学形态更起着决定性作用,即使是有益的金属元素若含量超过标准值也会引起机体中毒,乃至死亡。重金属离子一旦被人体吸收,就会与体内的蛋白质和酶产生巨大的相互作用。微量的重金属离子不会对人体造成伤害,但是,倘若体内重金属离子浓度过高,则会改变酶的三维结构、活性中心的电荷或者取代酶中的其它必需金属离子,使酶失活,也可在人体内的某些器官中大量聚集,如果超过人体所能够承受的范围,就会对人体产生非常大的毒害作用。其中汞离子就是对人类健康危害最大的重金属离子之一,为世人所知的日本水俣病便是由于患者食用了被甲基汞污染的鱼类和贝类而导致患者中枢神经系统疾病,甲基汞是一种有机汞,其物理形态为白色的粉末,很容易被肠胃所吸收,通过血液循环首先进入到人体的肝和胃,然后转移至人体的大脑或胎儿体内,并且一直积聚于此,给人体健康带来非常严重的影响及损害。
目前检测重金属的技术主要有光谱法如原子吸收、发射光谱、分光光度法、色谱法、质谱法和电化学法如有循环伏安法、极谱法、电位法、安培、电导分析法等。通过电化学阳极溶出伏安法,虽具有灵敏度高,无需高压气体、火焰、原子灯,实验简易,成本低廉等优点,但阳极溶出伏安法操作需要专业的人员操作,但是汞作为电极,给环境带来新的重金属污染。分光光度法等,该方法的检测成本低,但是灵敏度不高,不能满足国家标准的检测要求;而原子吸收光谱法、电感耦合等离子体(ICP)法等检测限低、灵敏度高、选择性好,但价格昂贵,需要专业的技术人员,检测过程相对费力、费时等。实时、在线监测环境中重金属离子污染,提高检测方法的灵敏度、稳定性、简易性及高效性是非常重要的。
近年来,电化学传感器因其简便、快速、灵敏、成本低、易于微型化、可实现在线检测等特点吸引了研究者的广泛关注。其中,电化学生物传感器由于很好地结合了电化学转换装置的高灵敏度以及生物识别体系的高选择性,在重金属离子分析领域有较大的应用可行性及广阔前景。构建用于重金属离子检测的电化学生物传感器时,为了保证传感器的特异性,识别元件的选择至关重要。目前,通过指数富集配体的系统进化技术(SELEX)已从人工构建的随机单链寡核甘酸文库里筛选出了能够特异性识别某些重金属离子的适体(aptamer) 和具有催化活性的脱氧核酶(DNAzyme),用于重金属离子的检测。 2006年,Miyake等人报道了Hg2+可与胸腺嘧啶T碱基特异性地结合形成一种比碱基配对还要稳定的结构T-Hg2+-T复合物,这个发现奠定了利用适体探针检测Hg2+的基础。本专利利用T-Hg2+-T的配位化学,以DNA为传感探针,引入EXOIII辅助的目标物循环放大技术,结合二茂铁与β-环糊精的主客体识别作用,构建电化学生物传感器实现对汞离子的高灵敏检测。
技术实现要素:
针对相关技术中的问题,本发明提出一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法,以克服现有相关技术所存在的上述技术问题。
为此,本发明采用的具体技术方案如下:
一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法。
该方法包括以下步骤:
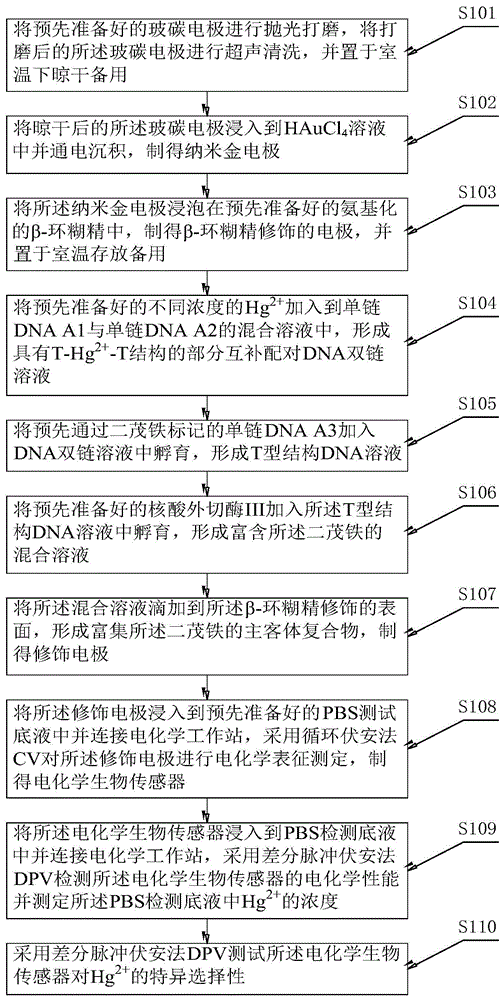
将预先准备好的玻碳电极进行抛光打磨,将打磨后的所述玻碳电极进行超声清洗,并置于室温下晾干备用;
将晾干后的所述玻碳电极浸入到HAuCl4溶液中并通电沉积,制得纳米金电极;
将所述纳米金电极浸泡在预先准备好的氨基化的β-环糊精中,制得β-环糊精修饰的电极,并置于室温存放备用;
将预先准备好的不同浓度的Hg2+加入到单链DNA A1与单链 DNA A2的混合溶液中,形成具有T-Hg2+-T结构的部分互补配对DNA 双链溶液;
将预先通过二茂铁标记的单链DNA A3加入所述DNA双链溶液中孵育,形成T型结构DNA溶液;
将预先准备好的核酸外切酶III加入所述T型结构DNA溶液中孵育,形成富含所述二茂铁的混合溶液;
将所述混合溶液滴加到所述β-环糊精修饰的电极表面,形成富集所述二茂铁的主客体复合物,制得修饰电极;
将所述修饰电极浸入到预先准备好的PBS测试底液中并连接电化学工作站,采用循环伏安法CV对所述修饰电极进行电化学表征测定,制得电化学生物传感器;
将所述电化学生物传感器浸入到PBS检测底液中并连接电化学工作站,采用差分脉冲伏安法DPV检测所述电化学生物传感器的电化学性能并测定所述PBS检测底液中Hg2+的浓度;
采用差分脉冲伏安法DPV测试所述电化学生物传感器对Hg2+的特异选择性。
进一步的,将预先准备好的玻碳电极进行抛光打磨,将打磨后的所述玻碳电极进行超声清洗的步骤包括:
将所述玻碳电极依次用预先准备好的0.3μM和0.05μM的三氧化二铝粉末在麂皮上抛光打磨,并且,抛光时需固定沿顺时针或逆时针方向进行研磨;
将打磨后的所述玻碳电极依次在预先准备好的乙醇和超纯水中进行超声清洗数,清洗时间为3-5分钟。
进一步的,所述HAuCl4溶液的质量分数为1%,所述通电沉积的电位为-0.2V,所述通电沉积的时间为30秒。
进一步的,所述氨基化的β-环糊精的浓度为1mM,将制得所述修饰纳米金电极置于室温存放时间为12小时。
进一步的,所述单链DNA A1的序列为5'-TCTTCTTCTTAACACACGG-3',所述单链DNA A2的序列为 5'-GCTGAGGGCGTTGTTGTTGT-3',所述单链DNA A3的序列为 5'-CCGTGTGTGGCGCCCTCAGC-Fc-3',所述单链DNA A1与所述单链 DNA A2及所述单链DNA A3的体积均为10μL,所述单链DNA A1 与所述单链DNA A2及所述单链DNA A3的浓度均为2μM,所述孵育温度为37℃,所述孵育时间为1小时。
进一步的,所述核酸外切酶III的体积为10μL,所述核酸外切酶III的浓度为0.5U/μL。
进一步的,将所述修饰电极浸入到预先准备好的PBS测试底液中并连接电化学工作站,采用循环伏安法CV对所述修饰电极进行电化学表征测定,制得电化学生物传感器的步骤包括:
将预先准备好的2mL含有0.2mol/LKCl的5mmol/L[Fe(CN)6]3-/4-的所述PBS测试底液通电对所述修饰电极修饰过程中界面电化学性质的变化进行扫描表征;
其中,扫描电位为-0.6V-0.2V,电位扫描速度为100mV/s,所述PBS测试底液的pH=7.0。
进一步的,将所述电化学生物传感器浸入到PBS检测底液中宁连接电化学工作站,采用差分脉冲伏安法DPV检测所述电化学生物传感器的电化学性能并测定所述PBS检测底液中Hg2+的浓度的步骤包括:
将预先准备好的0.1mol/L所述PBS测试底液通电对所述电化学生物传感器进行电极的响应性能的测试;
将测试后的所述电化学生物传感器检测不同浓度的Hg2+并记录其电化学的DPV响应;
其中,所述差分脉冲伏安法DPV的振幅为0.05V,采样宽度为0.0167s,脉冲宽度为0.1s,扫描电位为0.2-0.7V。
进一步的,采用差分脉冲伏安法DPV测试所述电化学生物传感器对Hg2+的特异选择性的步骤包括:
采用差分脉冲伏安法DPV分别对预先准备的100nmol/L的 Mn2+、100nmol/L的Cd2+、100nmol/L的Pb2+、100nmol/L的Cu2+及2nmol/L的Hg2+在同样的实验条件情况下进行检测对比。
进一步的,所述循环伏安法CV与所述差分脉冲伏安法DPV的实验系统均为三电极系统,工作电极为玻碳电极,对电极为铂丝,参比电极为饱和甘汞电极。
本发明的有益效果为:
(1)、信号放大策略的设计及表征以及高灵敏重金属离子电化学生物传感器的构建、响应机制及其应用研究;
(2)、利用纳米金大的比表面积及良好的导电作用来提高β-环糊精的固载率和促进电子传递以达到提高灵敏度的目的;
(3)、联合T-Hg2+-T结构及核酸外切酶Ш对DNA的剪切作用实现目标物的循环利用以放大响应信号;
(4)、通过二茂铁Fc与β-环糊精的主客体识别作用实现目标物定量检测;
(5)、采用电化学技术考察电极组装过程和信号放大机理及核酸相互作用的动力学特征;
(6)、所构建的电化学生物传感器具有高灵敏度、生物识别系统选择性高的特点,而且其也具有构造简单、成本低廉、响应速度快、稳定性高等优点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是根据本发明实施例的一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法的流程图;
图2是根据本发明实施例的一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法的电化学生物传感器的构建原理图;
图3是根据本发明实施例的一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法的电极逐步修饰过程表征的CV响应图;
图4是根据本发明实施例的一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法的孵育时间的优化图;
图5是根据本发明实施例的一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法的不同浓度Hg2+检测的DPV响应图;
图6是根据本发明实施例的一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法的对Hg2+检测的标准曲线图;
图7是根据本发明实施例的一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法的传感器的选择性分析图。
具体实施方式
为进一步说明各实施例,本发明提供有附图,这些附图为本发明揭露内容的一部分,其主要用以说明实施例,并可配合说明书的相关描述来解释实施例的运作原理,配合参考这些内容,本领域普通技术人员应能理解其他可能的实施方式以及本发明的优点,图中的组件并未按比例绘制,而类似的组件符号通常用来表示类似的组件。
根据本发明的实施例,提供了一种基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法。
现结合附图和具体实施方式对本发明进一步说明,如图1所示,根据本发明实施例的基于外切酶Ⅲ辅助目标物循环与主客体识别的汞离子电传感分析检测方法。
该方法包括以下步骤:
步骤S101,将预先准备好的玻碳电极进行抛光打磨,将打磨后的所述玻碳电极进行超声清洗,并置于室温下晾干备用;
步骤S102,将晾干后的所述玻碳电极浸入到HAuCl4溶液中并通电沉积,制得纳米金电极;
步骤S103,将所述纳米金电极浸泡在预先准备好的氨基化的β- 环糊精中,制得β-环糊精修饰的电极,并置于室温存放备用;
步骤S104,将预先准备好的不同浓度的Hg2+加入到单链DNA A1 与单链DNA A2的混合溶液中,形成具有T-Hg2+-T结构的部分互补配对DNA双链溶液;
步骤S105,将预先通过二茂铁标记的单链DNA A3加入所述DNA 双链溶液中孵育,形成T型结构DNA溶液;
步骤S106,将预先准备好的核酸外切酶III加入所述T型结构DNA 溶液中孵育,形成富含所述二茂铁的混合溶液;
步骤S107,将所述混合溶液滴加到所述β-环糊精修饰的电极表面,形成富集所述二茂铁的主客体复合物,制得修饰电极;在具体应用时,被剪切下来的二茂铁Fc能够被集中于所述修饰纳米金电极表面,由此得到一个可测得的电化学信号;
步骤S108,将所述修饰电极浸入到预先准备好的PBS测试底液中并连接电化学工作站,采用循环伏安法CV对所述修饰电极进行电化学表征测定,制得电化学生物传感器;所述电化学生物传感器的构建及原理如图2所示;
步骤S109,将所述电化学生物传感器浸入到PBS检测底液中并连接电化学工作站,采用差分脉冲伏安法DPV检测所述电化学生物传感器的电化学性能并测定所述PBS检测底液中Hg2+的浓度;
步骤S110,采用差分脉冲伏安法DPV测试所述电化学生物传感器对Hg2+的特异选择性。
在一个实施例中,将预先准备好的玻碳电极进行抛光打磨,将打磨后的所述玻碳电极进行超声清洗的步骤包括:
将所述玻碳电极依次用预先准备好的0.3μM和0.05μM的三氧化二铝粉末在麂皮上抛光打磨,并且,抛光时需固定沿顺时针或逆时针方向进行研磨;
将打磨后的所述玻碳电极依次在预先准备好的乙醇和超纯水中进行超声清洗数,清洗时间为3-5分钟。
在一个实施例中,所述HAuCl4溶液的质量分数为1%,所述通电沉积的电位为-0.2V,所述通电沉积的时间为30秒;从而在玻碳电极表面沉积一层纳米金颗粒(AuNPs),进而制得纳米金电极。
在一个实施例中,所述氨基化的β-环糊精的浓度为1mM,将制得所述修饰纳米金电极置于室温存放时间为12小时;从而通过Au-N 键,将氨基化的β-环糊精组装在纳米金颗粒(AuNPs)上,进而制得修饰纳米金电极。
在一个实施例中,所述单链DNA A1的序列为 5'-TCTTCTTCTTAACACACGG-3',所述单链DNA A2的序列为 5'-GCTGAGGGCGTTGTTGTTGT-3',所述单链DNA A3的序列为 5'-CCGTGTGTGGCGCCCTCAGC-Fc-3',所述单链DNA A1与所述单链DNA A2及所述单链DNA A3的体积均为10μL,所述单链DNA A1与所述单链DNA A2及所述单链DNA A3的浓度均为2μM,所述孵育温度为 37℃,所述孵育时间为1小时。
此外,在具体应用时,将预先准备好的不同浓度的Hg2+加入到单链DNA A1与单链DNA A2的混合溶液中,形成具有T-Hg2+-T结构的部分互补配对DNA双链溶液;将预先通过二茂铁标记的单链DNA A3加入所述DNA双链溶液中孵育,形成T型结构DNA溶液的步骤具体为:将不同浓度的Hg2+加入到各10μL 2μM的单链DNA A1与单链DNA A2 的混合溶液中,在Hg2+存在的条件下,单链DNA A1与单链DNA A2 形成T-Hg2+-T结构,从而形成部分互补配对的DNA双链。
在进一步加入10μL 2μM的电化学活性物质二茂铁(Fc)标记的单链DNA A3后于37℃下孵育1小时,此时单链DNA A3与单链DNA A1及单链DNA A2的裸露的粘性末端互补,进而形成T型的DNA结构。
在一个实施例中,所述核酸外切酶III的体积为10μL,所述核酸外切酶III的浓度为0.5U/μL。此外,在具体应用时,在上述混合液中再加入10μL 0.5U/μL的核酸外切酶III(EXO III)于37℃下孵育1小时,此时核酸外切酶III自互补DNA双链的平端,从3'-5'端剪切单链 DNA A3形成DNA双链的部分,将标记在单链DNA A3上的二茂铁Fc 剪切下来,并释放到溶液中;同时单链DNA A1、单链DNA A2和Hg2+形成的DNA双链结构参与下一个互补与剪切的循环,经过多次循环剪切就可以得到大量剪切下来的二茂铁Fc。
在一个实施例中,将所述修饰电极浸入到预先准备好的PBS测试底液中并连接电化学工作站,采用循环伏安法CV对所述修饰电极进行电化学表征测定,制得电化学生物传感器的步骤包括:
将预先准备好的2mL含有0.2mol/LKCl的5mmol/L[Fe(CN)6]3-/4-的所述PBS测试底液通电对所述修饰电极修饰过程中界面电化学性质的变化进行扫描表征;
其中,扫描电位为-0.6V-0.2V,电位扫描速度为100mV/s,所述 PBS测试底液的pH=7.0。
此外,采用循环伏安法CV对所述修饰电极进行电化学表征测定在具体应用时,在5mmol/L[Fe(CN)6]3-/4-的测试底液中记录的不同修饰电极的CV响应,如图3所示,在图中我们可以看出,裸电极所对应的曲线b(GCE)呈现出一对准可逆的[Fe(CN)6]3-/4-的氧化还原峰;在玻碳电极沉积一层纳米金后,由于纳米金能够促进电子传输,其CV 响应电流值有所增加(曲线a,GCE/Au),电极表面孵育β-环糊精后,观察到了进一步降低的响应电流值(曲线c,GCE/Au/β-CD)说明β- 环糊精成功组装在了电极表面;电极不同修饰阶段对应的CV响应的变化,说明了修饰电极是成功制备的。
在一个实施例中,将所述电化学生物传感器浸入到PBS检测底液中宁连接电化学工作站,采用差分脉冲伏安法DPV检测所述电化学生物传感器的电化学性能并测定所述PBS检测底液中Hg2+的浓度的步骤包括:
将预先准备好的0.1mol/L所述PBS测试底液通电对所述电化学生物传感器进行电极的响应性能的测试;
将测试后的所述电化学生物传感器检测不同浓度的Hg2+并记录其电化学的DPV响应;
其中,所述差分脉冲伏安法DPV的振幅为0.05V,采样宽度为0.0167s,脉冲宽度为0.1s,扫描电位为0.2-0.7V。
此外,将预先准备好的0.1mol/L所述PBS测试底液通电对所述电化学生物传感器进行电极的响应性能的测试在具体应用时,为了增加电化学生物传感器的灵敏度和选择性,我们对核酸外切酶III(EXO III) 的孵育时间做了优化,最后仍然使用脉冲差分伏安法DPV检测来研究电化学生物传感器的电化学性能,如图4所示,随着EXO III孵育时间的延长,我们能够明显的观察到电流响应逐渐增加并在50min的时候电流值趋于平稳,因此选用EXO III的孵育时间为50min以确保传感器的最佳性能。
将测试后的所述电化学生物传感器检测不同浓度的Hg2+并记录其电化学的DPV响应在具体应用时,为了评估所构建的电化学生物传感器的灵敏度和定量检测的潜能,在最优实验条件下,我们用构建的电化学生物传感器检测不同浓度的Hg2+并记录其电化学的DPV响应,从图5可以看出电化学生物传感器检测的是0.002到100nmol/L 不同浓度的Hg2+的峰电流值,且还原峰电流值随Hg2+浓度的增加而逐渐增加,这意味着EXO III的作用下,被剪切下来的电活性分子二茂铁 Fc,被修饰在电极表面的β-环糊精成功捕获;Hg2+检测的标准曲线如图6所示,电流响应值在0.002到100nmol/L的浓度范围内与Hg2+的对数值之间呈现出了良好的线性关系;其线性方程式为I=-0.0608 lg c-2.1413,c为Hg2+的浓度,相关性系数为r=0.9971;根据此实验结果表明,本实验所构建的电化学生物传感器能够用于Hg2+的高灵敏性的检测。
在一个实施例中,采用差分脉冲伏安法DPV测试所述电化学生物传感器对Hg2+的特异选择性的步骤包括:
采用差分脉冲伏安法DPV分别对预先准备的100nmol/L的Mn2+、 100nmol/L的Cd2+、100nmol/L的Pb2+、100nmol/L的Cu2+及2nmol/L 的Hg2+在同样的实验条件情况下进行检测对比。
此外,在具体应用时,为了测试本实验构建的电化学生物传感器对Hg2+的特异选择性,我们分别用100nmol/L的Mn2+、100nmol/L 的Cd2+、100nmol/L的Pb2+及100nmol/L的Cu2+四种离子在同样的实验条件情况下与2nmol/L的Hg2+的检测结果做了对比;如图7所示, a为空白值,b为100nmol/L的Mn2+,c为100nmol/L的Cu2+,d为 100nmol/L的Pb2+,e为100nmol/L的Cd2+,f为2nmol/L的Hg2+,此四种离子的电信号都较低且与空白值相当,只有目标物Hg2+产生了非常明显的电化学信号,这说明本实验构建的电化学生物传感器检测方法对Hg2+的检测具有较高的特异性。
在一个实施例中,所述循环伏安法CV与所述差分脉冲伏安法 DPV的实验系统均为三电极系统,工作电极为玻碳电极(GCE,Φ=4 mm),对电极为铂丝,参比电极为饱和甘汞电极(SCE)。
综上所述,本发明的上述技术方案,涉及信号放大策略的设计及表征以及高灵敏重金属离子电化学生物传感器的构建、响应机制及其应用研究;利用纳米金大的比表面积及良好的导电作用来提高β-环糊精的固载率和促进电子传递以达到提高灵敏度的目的;联合T-Hg2+-T 结构及核酸外切酶Ш对DNA的剪切作用实现目标物的循环利用以放大响应信号;通过二茂铁Fc与β-环糊精的主客体识别作用实现目标物定量检测;采用电化学技术考察电极组装过程和信号放大机理及核酸相互作用的动力学特征;进而所构建的电化学生物传感器具有高灵敏度、生物识别系统选择性高的特点,而且其也具有构造简单、成本低廉、响应速度快、稳定性高等优点。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!