一种弯曲毛细管电泳检测多酶的方法与流程
本发明属于纳米生物技术领域,具体涉及一种弯曲毛细管电泳检测多酶的方法。
背景技术:
当前迅速发展并广泛应用的各种酶传感器,将反应与检测两个步骤紧密结合起来,具有快速、方便、灵敏、精确的特点,在酶检测中发挥了巨大的作用,且更进一步推动了酶检测法的发展。通常情况下,使用单一酶底物来检测一种特定的酶,这就造成了检测选择性单一的缺点,而且操作起来较为复杂。
另一方面,毛细管电泳作为一种高分辨率、高灵敏、高通量及低样品小号的微分离技术,在生物分析领域具有广阔的应用前景。同时,通过荧光检测与毛细管电泳相结合,大大提高了检测线,拓展了毛细管的应用。通常采用直的毛细管进行样品的分析与测定。
技术实现要素:
为解决现有技术中尚无快速、高效、便捷地检测多种酶的方法,本发明的目的在于提供一种弯曲毛细管电泳检测多酶的方法,首先,设计含有多个酶切位点的多肽与量子点结合形成多酶探针,利用弯曲毛细管电泳检测不同酶在毛细管内水解多酶探针的情况。利用毛细管弯曲有利于样品在管内充分反应的特点,研究水解酶在毛细管内水解双酶探针的情况。通过毛细管电泳分析检测,并计算荧光染料Cy5的峰面积(S665nm)与QDs的峰面积(S605nm)比值来判断FRET变化情况,从而实现水解酶的检测。
本发明所采用的技术方案为:将量子点与多肽结合形成双酶探针,再将电泳所用的毛细管分别弯曲成不同个数的半圆,固定后,先进样双酶探针,间隔10s后进样水解酶,经荧光光谱仪检测双酶探针的荧光强度;所述的弯曲毛细管为石英毛细管。
所述的水解酶为PreScission蛋白酶和凝血酶。
所述多肽含有(1)双酶切位点;(2)用于和量子点发生FRET的荧光染料Cy5;(3)和量子点结合的6×组氨酸。
所述多肽含有的双酶切位点为LEVLFQGP和LVPRGS。
所述多肽序列为Cy5-D3LEVLFQGPGLVPRGSGP9G2H6(Cy5-LEVLVP-QD)。
所述量子点为含有Zn的量子点,如CdSe/ZnS、CdTe/ZnS、CdSe/ZnSe或CdTe/ZnSe。
所述的双酶探针为1μM量子点与8μM多肽等体积混合孵育10min得到。
所述的弯曲毛细管的内径为75μm,外径为365μm,弯曲的半圆个数为1-4个,弯曲的直径为3cm。
所述的弯曲毛细管为180°等宽圆弧弯曲毛细管。
所述双酶探针的进样时间为15s,所述水解酶的进样时间为15s,所述的水解酶进样间隔为10s。
采用上述技术方案后,本发明所取得的有益效果是:基于CE-FL可以使用一种底物同时检测多种酶,这个设计可以快速筛选来自微生物或其他环境的未知酶。操作简单,可重复性高,进一步拓展了荧光探针在生物分析领域的应用。
附图说明
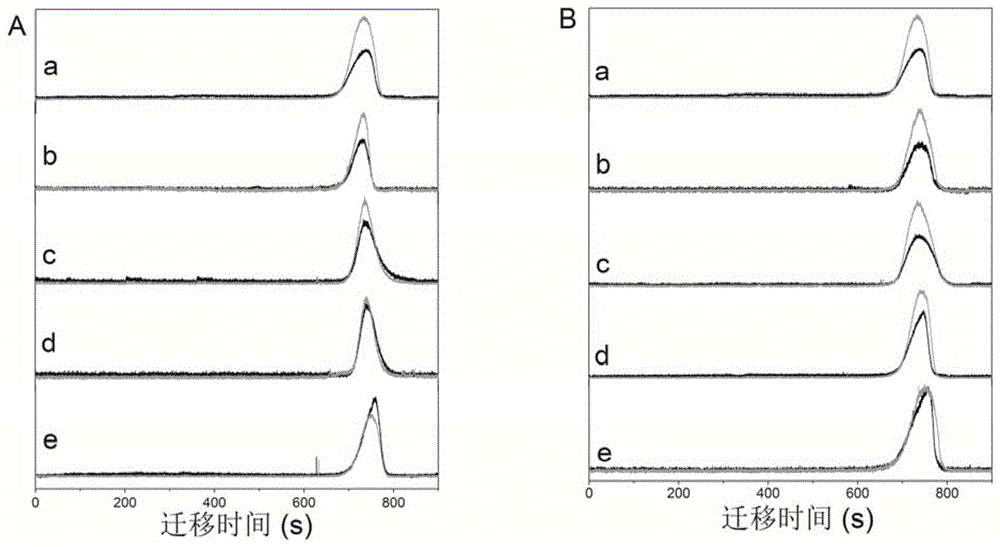
图1:毛细管不同弯曲程度下(A)PSP和(B)凝血酶管内水解复合物。其中(a)仅Cy5-LEVLVP-QD,(b)直毛细管,(c)弯曲1个半圆,(d)弯曲2个半圆,(e)弯曲4个半圆。[His-PSP]=10U/ml,[Thrombin]=10U/ml。(激发光源λex=420nm,黑线,605nm,QDs供体检测通道,灰色,665nm,Cy5受体检测通道)
图2:不同浓度(A)His-PSP与(B)凝血酶的活性检测。(a)0U/ml,(b)5U/ml,(c)10U/ml,(d)20U/ml,(e)40U/ml。
图3:S665nm/S605nm的值随酶浓度变化的趋势图。(a)His-PSP,(b)凝血酶。
图4:毛细管不同弯曲程度下PSP管内水解Cy5-LEV-QD复合物。其中(a)仅Cy5-LEV-QD,(b)直毛细管,(c)弯曲1个半圆,(d)弯曲2个半圆,(e)弯曲4个半圆。[His-PSP]=10U/ml。
具体实施方式
本发明将就以下实施例作进一步说明,但应了解的是,这些实施例仅为例示说明之用,而不应被解释为本发明实施的限制。
实施例1
本发明所述的方法采用常规的固相Fmoc法,即固相树脂上被Fmoc保护的单体氨基酸去保护后露出氨基,通过缩合反应与溶液中氨基酸的羧基形成肽键,从而将氨基酸连接到树脂上,使肽链从C端向N端延伸。
1、基本材料:
(1)树脂与连接分子:固相Fmoc法选择的树脂为Rink Amide-树脂。这种树脂具有非常好的溶胀性,可以使肽链之间更好地进行缩合反应,且有足够的网络空间满足不断增长的肽链。采用HBTU和HOBt作为连接分子,将多肽分子固定到树脂上。
(2)单体:合成所用单体为经化学修饰的α-氨基酸。
2、反应步骤:
第一步,将第一个氨基酸共价连接到树脂上
加入适当的缩合剂如HBTU和HOBt,使被保护氨基酸羧基端与树脂形成共脂以完成氨基酸的固定;
第二步,去保护
采用碱性溶剂20%哌啶去除氨基上的Fmoc,暴露出氨基。
第三步,激活和交联
采用活化剂HBTU和HOBt活化下一个氨基上的羧基,与树脂上的氨基交联,形成肽键。
第四步,重复第二步和第三步,反复循环添加单体氨基酸,按照Cy5-LEVLVP序列的顺序从右到左合成,直到合成完成。
第五步,染料标记
采用碱性溶剂20%哌啶去除氨基上的Fmoc,暴露出氨基。EDC/Cy5/DIEA/HOBT按比例溶于DMF,加入树脂中避光过夜反应。
3、合成后处理:
(1)洗脱和脱保护:用脱保护剂三氟乙酸(TFA)将肽链从树脂上洗脱下来,并脱除保护基。
(2)HPLC分析纯化,冻干保存。
通过上述方法,合成多肽序列Cy5-LEVLVP。
4、脂溶性QDs经GSH转换成水溶性QDs
将60μL GSH溶液(含有18mg GSH和5mg KOH的250μL甲醇溶液)加入到600μL油溶性QDs(20μM)中,剧烈震荡。然后加入600μL NaOH水溶液(1mM),将QDs转移至顶部水层。将得到的QDs离心并分散在600μL硼酸盐缓冲液(pH7.4,10mM)中待用。
5、双酶探针的合成:
将1μM QDs与8μM Cy5-LEVLVP等体积混合孵育10min,形成稳定的复合物Cy5-LEVLVP-QD。
6、水解酶和双酶探针在毛细管内相互作用研究:
将毛细管弯曲成0、1、2或4个半圆(直径为3cm),分别在这4种情况下,首先进样Cy5-LEVLVP-QD 15s,间隔10s后,进样10U/ml的PSP 15s,通过毛细管电泳检测Cy5-LEVLVP-QD的水解情况。当半圆个数为0时,PSP管内水解复合物导致S665nm/S605nm的值为1.44(图1A,曲线b),当半圆个数为4时,PSP的酶切效果最明显,S665nm/S605nm的值降低至0.89(图1A,曲线e)。
测试条件:水解酶与双酶探针的相互作用过程利用荧光毛细管电泳检测,电泳条件:25mM硼酸缓冲液(pH 9.3),电压为20kV。
实施例2
按照实施例1的方法,将10U/ml的凝血酶与双酶探针在毛细管内进行水解反应。
同样,随着半圆个数的增加,凝血酶对复合物的酶切效果越来越明显,S665nm/S605nm的值由1.65(图1B,曲线b)降低到1.10(图1B,曲线e)。
实施例3
将毛细管弯曲成4个直径为3cm的半圆,进样Cy5-LEVLVP-QD 15s,间隔10s后,将不同浓度的PSP(5U/ml、10U/ml、20U/ml或40U/ml)进样15s,通过毛细管电泳检测Cy5-LEVLVP-QD的水解情况。在一定时间范围内,酶浓度的增加使得双酶探针FRET信号强度降低。计算QDs供体检测通道峰面积与Cy5受体通道峰面积比(S665nm/S605nm)进行拟合,得出曲线方程y=1.378*exp(-x/11.307)+0.407。方程式中,y为S665nm/S605nm的值,x为PSP浓度。
其他步骤同实施例1。
实施例4
凝血酶也按照实施例3的方法进行检测。
计算QDs供体检测通道峰面积与Cy5受体通道峰面积比(S665nm/S605nm)进行拟合,得出曲线方程y=1.467*exp(-x/19.063)+0.355,方程式中,y为S665nm/S605nm的值,x为凝血酶浓度。
对比实施例1
按照实施例1的方法合成仅含PSP酶切位点的多肽Cy5-LEV(Cy5-D3LEVLFQGPGP9G2H6),并按照实施例1的方法进行弯曲毛细管内PSP酶切Cy5-LEV-QD复合物研究。检测结果发现,单酶切位点的多肽与QDs形成的复合物在毛细管内的水解也会受到毛细管弯曲程度的影响(图4)。
- 还没有人留言评论。精彩留言会获得点赞!