去除植物叶片中总叶绿素干扰H2S含量测定的方法与流程
本发明属于生物测定技术领域,涉及一种去除植物叶片中总叶绿素干扰h2s含量测定的方法。
背景技术:
植物体内低浓度的h2s是一种信号分子,参与调控植物气孔运动、增强光合作用、延缓衰老、促进植物的生长发育、缓解非生物胁迫等多种生理过程,而高浓度的h2s对植物细胞有毒害作用。植物内源h2s主要由半胱氨酸脱巯基酶催化半胱氨酸分解,以及亚硝酸盐还原酶催化的亚硝酸盐还原过程产生。植物在重金属胁迫、高温胁迫、盐胁迫下形成氧化胁迫,造成活性氧的累积,h2s通过调动抗氧化酶清除活性氧。同时,h2s是半胱氨酸合成的底物,在植物应对非生物胁迫中起着至关重要的作用。谷胱甘肽是以半胱氨酸为前体物合成的,参与活性氧的清除,同时也可以合成植物络合素而参与重金属解毒。
5,5'-二硫代双(2-硝基苯甲酸)比色法(以下简称dtnb比色法)是最常用于测定植物组织(根系或者胚芽鞘)中h2s含量的一种方法。dtnb比色法通常用100mm的磷酸钾缓冲液(ph=7.0,其中含10mmedta)来研磨植物的组织。磷酸钾缓冲液研磨植物根系后,研磨液呈显根系原色;加入5,5'-二硫代双(2-硝基苯甲酸)溶液后,其与根系中的h2s反应生成黄色的硫硝基苯甲酸。由于叶片中叶绿素的存在,如果用该磷酸钾缓冲液研磨植物的叶片,研磨液会呈显绿色,加入5,5'-二硫代双(2-硝基苯甲酸)溶液后仍为绿色,造成吸光值偏大,从而干扰植物叶片中h2s的含量测定。目前,除亚甲蓝法外,dtnb法是测定植物根系中h2s含量的最常用方法,没有发现测定植物叶片中h2s含量的相关文献。
技术实现要素:
为了去除植物叶片中总叶绿素对h2s含量测定的干扰,本发明提供一种去除植物叶片中总叶绿素干扰h2s含量测定的方法,能有效地去除总叶绿素对h2s测定的干扰,采用比色法测定植物叶片中h2s的含量,测定结果准确、可靠,操作简便、实用、快速、可操作性强,解决了现有技术中存在的问题。
本发明所采用的技术方案是,一种去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,将植物叶片在ph=7.0的研磨液中冰浴研磨得到匀浆液;
步骤s2,吸取匀浆液,然后加入等体积的提取液a,涡旋混匀后得到混合液,提取液a为丙酮和正己烷按照体积比1:1混合得到;
步骤s3,将步骤s2得到的混合液在4℃的条件下离心12-15min,离心速度为12000-14000r/min;
步骤s4,吸取上清液,然后加入等体积的提取液b,涡旋混匀后得到混合液,提取液b为三氯甲烷溶液;
步骤s5,将步骤s4得到的混合液在4℃的条件下离心3-4min,离心速度为10000-12000r/min;
步骤s6,吸取上层水相溶液,采用比色法测定上层水相溶液中的h2s含量,即得植物叶片中h2s含量。
进一步的,所述步骤s6,采用比色法测定上层水相溶液中的h2s含量的方法具体为:准确吸取2-3ml水相溶液,向溶液中加入等体积的反应液c,25℃下反应2min,用紫外分光光度计在412nm波长处测定吸光度值,反应液c为0.0317g5,5'-二硫代双(2-硝基苯甲酸)溶于200毫升研磨液中得到;
式中,c:根据标准曲线拟合方程计算出所测样品吸光度值对应的h2s浓度,μmol/l;v1:步骤s1所用的研磨液体积,ml;v2:步骤s2吸取的匀浆液体积,ml;v3:步骤s6吸取的水相溶液体积,ml;fw:步骤s1中植物叶片鲜重,g。
进一步的,所述步骤s1中,研磨液为100mm磷酸钾缓冲液,磷酸钾缓冲液中含10mmedta。
进一步的,所述研磨液的用量为:每0.15-0.20g植物叶片加入3.0-5.0ml研磨液。
进一步的,所述步骤s2中,涡旋混合的混合速度为2800-3000r/min,混合时间为15-18s。
进一步的,所述步骤s3中,离心时间为15min。
进一步的,所述步骤s4中,涡旋混合的混合速度为2800-3000r/min,混合时间为15-18s。
进一步的,所述步骤s5中,离心时间为3min。
本发明的有益效果是,比色法测定植物叶片中h2s的含量易受叶片中总叶绿素的干扰,影响测定的准确性;本发明能有效地去除植物叶片总叶绿素对h2s含量测定的干扰,去除叶绿素干扰的效果好、稳定性强,能够准确测定植物叶片中h2s的含量;与色谱方法比较,本方法从样品提取、制备到测定具有简便、实用、快速、可操作性强等优点。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
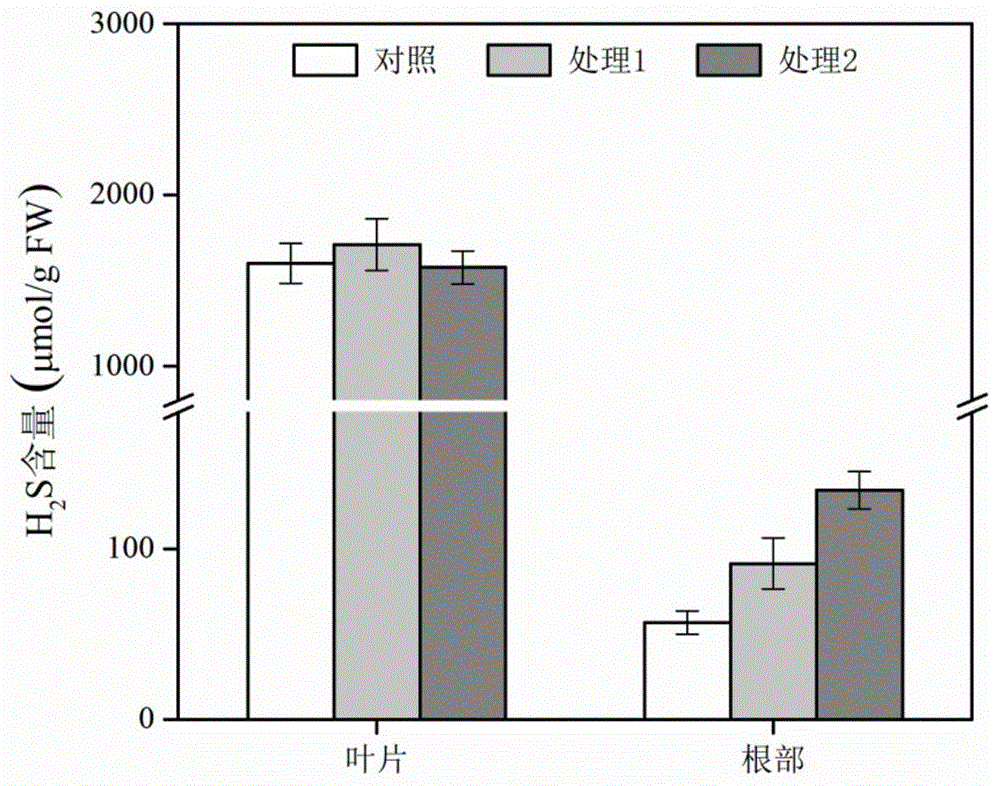
图1是本发明实施案例1的水稻幼苗根部和叶片的h2s含量。
图2是本发明实施案例2、3、4、5的水稻幼苗叶片的h2s含量。
图3是本发明实施案例1、2、3、4、5的对照组水稻幼苗叶片的h2s含量。
具体实施方式
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明以丙酮(助溶剂)、正己烷(非极性提取剂)、三氯甲烷(极性提取剂)混合提取植物叶片中的总叶绿素,以此避免使用dtnb比色法时植物叶片中总叶绿素对h2s含量测定的干扰。
叶绿素属酯类化合物,在有机溶剂中的溶解度远大于水中。根据叶绿素的极性,叶绿素在丙酮中的溶解度最大,其次是氯仿、正己烷、甲醇、乙醇。丙酮是目前最常见的植物叶片中总叶绿素(包括叶绿素a和叶绿素b)的提取剂,但是丙酮具有较强的水溶性,无法达到水相和有机相的分离。本发明的提取液a:丙酮与正己烷以体积比1:1混合,起到协同萃取和助溶的效果,该混合溶剂提取总叶绿素的效果比丙酮、正己烷单独提取效果好。提取液a中的正己烷(非极性提取剂)不溶于水,但叶绿素溶解于正己烷溶液中,加入丙酮起到助溶剂的作用,保证正己烷在水相中获得最大的分散相,以此达到总叶绿素在有机相中的溶解,便于充分萃取研磨液中的总叶绿素。
提取液b:三氯甲烷溶液,为极性提取剂,在本文的作用是利用萃取剂的极性差异,把溶解于正己烷和丙酮混合液中的总叶绿素萃取到极性更大的有机相(三氯甲烷)中,以达到去除水相中总叶绿素的目的。
本发明去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,称取0.15-0.20g(fw,鲜重)水稻幼苗叶片在3.0-5.0ml(v1)、ph=7.0的研磨液中冰浴研磨得到匀浆液,研磨液为100mm磷酸钾缓冲液,磷酸钾缓冲液中含10mmedta;植物叶片用100mm磷酸钾缓冲液研磨,主要是为了保证植物组织中的h2s含量的稳定;100mm磷酸钾缓冲液(含10mmedta),即2.7843gk2hpo4·3h2o、1.0615gkh2po4、0.1461gedta溶于200ml去离子水中;液研磨主要使水稻幼苗叶片研磨成匀浆液,同时维持溶液环境的ph,使h2s更稳定。h2s在酸性溶液中极易挥发,而在碱性条件下能被氧化成硫酸根。植物细胞液呈弱酸性,ph=7.0的磷酸钾缓冲液可以使植物组织研磨成匀浆液后维持中性环境。
步骤s2,准确吸取匀浆液3.0-4.0毫升(v2),然后加入等体积的提取液a,涡旋混匀(2800-3000r/min,混合15-18s)后得到混合液,提取液a与匀浆液的体积比1:1,提取液a为丙酮和正己烷按照体积比1:1混合;
步骤s3,将步骤s2得到的混合液在12000-14000r/min的条件下,4℃离心12-15min,取上清液a备用;离心转速12000-14000r/min的作用是使得水稻幼苗叶片匀浆液中的细胞壁、细胞器等组分沉淀,离心12-15min即可使匀浆液中的细胞壁、细胞器等沉淀,上清液a主要为叶绿素提取液和h2s;
步骤s4,准确吸取3.0-4.0毫升上清液a,然后加入等体积的提取液b,涡旋混匀(2800-3000r/min,混合15-18s)后得到混合液备用,提取液b与上清液a的体积比1:1,提取液b为三氯甲烷溶液;
步骤s5,将步骤s4得到的混合液在10000-12000r/min的条件下,4℃离心3-4min,液体分为上层的水相(h2s提取液)和下层的有机相(含有叶绿素的三氯甲烷提取液);4℃离心是为了避免因温度过高,h2s在提取液中溢出,影响测定结果;
步骤s6,准确吸取上层水相溶液2毫升(v3),向溶液中加入等体积的反应液c,室温(25℃)反应2min,用紫外分光光度计在412nm波长处测定吸光度值,反应液c与水相溶液的体积比1:1,反应液c:称取0.0317g5,5'-二硫代双(2-硝基苯甲酸)溶于200毫升研磨液(100mm磷酸钾缓冲液)中;
式中,c:根据标准曲线拟合方程计算出所测样品吸光度值对应的h2s浓度(μmol/l);v1:步骤s1所用的研磨液体积(ml);v2:步骤s2吸取的匀浆液体积(ml);v3:步骤s6吸取的水相溶液体积(ml);fw:步骤s1的水稻幼苗叶片鲜重(g)。
实施案例1,
去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,对照组:正常生长的水稻幼苗根部和叶片;处理组1:采用100μmolnahs/l对水稻幼苗处理6h。nahs是刺激植物细胞产生h2s的前驱物,以此来增加水稻幼苗体内的h2s含量,使其含量高于对照组,用于验证方法的准确性;处理组2:采用200μmolnahs/l对水稻幼苗处理6h,增加水稻幼苗体内的h2s含量,使h2s含量高于处理组1,用于验证方法的灵敏性;分别取对照组、处理组1、处理组2的水稻幼苗根部和叶片各0.2g在5.0ml、ph=7.0的研磨液中冰浴研磨成匀浆液;研磨液:100mm磷酸钾缓冲液(含10mmedta);
步骤s2,将匀浆液在12000r/min的条件下,4℃离心15min,取2.0ml上清液备用;
步骤s3,取上清液,用dtnb比色法测定水稻根系和叶片中h2s的含量,具体结果见图1。结果可以看出,根系中h2s的含量在对照组与2个处理组之间存在显著性差异,而且处理组2与处理组1之间也存在明显的差异。但是叶片中h2s的含量在对照组与2个处理组之间无显著性差异,2个处理组之间也无明显差异,说明该方法对水稻幼苗叶片中h2s含量的测定结果准确性差。
实施案例2,
去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,分别取实施案例1中对照组、处理组1、处理组2的水稻幼苗叶片各0.2g,在5.0ml、ph=7.0的研磨液中冰浴研磨成匀浆液;研磨液:100mm磷酸钾缓冲液(含10mmedta);
步骤s2,准确吸取3.0ml匀浆液加入3.0ml正己烷,涡旋混匀(3000r/min,混合15s)后备用;
步骤s3,将步骤2中的混合液在12000r/min的条件下,4℃离心3min,液体分为下层水相(h2s提取液)和上层有机相(含有叶绿素的正己烷提取液);
步骤s4,吸取下层的水相溶液2.0ml,用dtnb比色法测定水稻叶片中h2s的含量。
试验中能够用肉眼观察到下层水相溶液颜色为绿色,加入5,5'-二硫代双(2-硝基苯甲酸)溶液后仍为绿色,叶片中h2s的含量与实施案例1的测定结果无显著变化,具体测定结果见图2。从图2可以看出,尽管2个处理组叶片中h2s的含量略高于对照组,但是2个处理组之间不存在显著性差异,2个处理组叶片中h2s的含量无显著差异,说明该方法对水稻幼苗叶片中h2s含量的测定依然不准确。
实施案例3,
去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,分别取实施案例1中对照组、处理组1、处理组2的水稻幼苗叶片各0.2g,在5.0ml、ph=7.0的研磨液中冰浴研磨成匀浆液;研磨液:100mm磷酸钾缓冲液(含10mmedta);
步骤s2,准确吸取3.0ml匀浆液加入3.0ml三氯甲烷,涡旋混匀(3000r/min,混合15s)后备用;
步骤s3,将步骤2得到的混合液在12000r/min的条件下,4℃离心3min,液体分为上层水相(h2s提取液)和下层有机相(含有叶绿素的三氯甲烷提取液);
步骤s4,吸取上层的水相溶液2.0ml,用dtnb比色法测定水稻叶片中h2s的含量。
试验中能够用肉眼观察到上层水相溶液颜色为绿色,加入5,5'-二硫代双(2-硝基苯甲酸)溶液后仍为绿色,叶片中h2s的含量与实施案例1的测定结果无显著变化,具体测定结果见图2。从图2可以看出,尽管2个处理组叶片中h2s的含量略高于对照组,但是2个处理组之间不存在显著性差异,2个处理组叶片中h2s的含量无显著差异,说明该方法对水稻幼苗叶片中h2s含量的测定依然不准确。
实施案例4,
去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,分别取实施案例1中对照组、处理组1、处理组2的水稻幼苗叶片各0.2g,在5.0ml、ph=7.0的研磨液中冰浴研磨成匀浆液;研磨液:100mm磷酸钾缓冲液(含10mmedta);
步骤s2,准确吸取3.0ml匀浆液加入3.0ml丙酮,涡旋混匀(3000r/min,混合15s)后备用;
步骤s3,将步骤2中的混合液在12000r/min的条件下,4℃离心15min,取3.0ml上清液留作备用;
步骤s4,在步骤3中得到的上清液加入3.0ml三氯甲烷,涡旋混匀(3000r/min,混合15s)后备用;
步骤s5,步骤4得到的混合液在12000r/min的条件下,4℃离心3min,液体分为上层的水相(h2s提取液)和下层的有机相(含有叶绿素的三氯甲烷提取液);
步骤s6,吸取上层水相溶液2.0ml,用dtnb比色法测定水稻叶片中h2s的含量。
试验中能够用肉眼观察到上层水相溶液颜色变浅,是因为溶解于丙酮中的总叶绿素部分萃取到了含有三氯甲烷的有机相中,丙酮的水溶性决定了水相的h2s提取液中仍然含有一定比例的总叶绿素残留,加入5,5'-二硫代双(2-硝基苯甲酸)溶液后仍显绿色,叶片中h2s的含量与实施案例1的测定结果无显著变化,具体测定结果见图2。从图2可以看出,尽管2个处理组叶片中h2s的含量略高于对照组,但是2个处理组之间不存在显著性差异,2个处理组叶片中h2s的含量无显著差异,说明该方法对水稻幼苗叶片中h2s含量的测定依然不准确。
实施案例5,
去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,分别取实施案例1中对照组、处理组1、处理组2的水稻幼苗叶片各0.2g,在5.0ml、ph=7.0的研磨液中冰浴研磨成匀浆液,研磨液:100mm磷酸钾缓冲液(含10mmedta);
步骤s2,准确吸取3.0ml步骤s1的匀浆液,然后加入3.0ml提取液a,涡旋混匀(3000r/min,混合15s)后备用,提取液a为丙酮和正己烷按照体积比1:1混合;
步骤s3,将步骤s2中的混合液在12000r/min的条件下,4℃离心15min,吸取3.0ml上清液备用;
步骤s4,在步骤s3中所得到的3.0ml上清液中加入3.0ml提取液b,涡旋混匀(3000r/min,混合15s)后备用;提取液b为三氯甲烷;
步骤s5,将步骤s4所得到的混合液在12000r/min的条件下,4℃离心3min,液体分为上层的水相(h2s提取液)和下层的有机相(含有叶绿素的三氯甲烷提取液);
步骤s6,吸取上层的水相溶液2.0ml用dtnb比色法测定叶片中的h2s含量。
利用本方法获得的水稻叶片h2s粗提液(步骤s5的上清液)几乎没有绿色,加入5,5'-二硫代双(2-硝基苯甲酸)溶液后显色为黄色,叶片中的h2s含量见图2。结果可以看出,不仅2个处理组叶片中h2s的含量明显高于对照组,而且2个处理组叶片中h2s的含量也存在显著性差异,且对照组、处理组1、处理组2的叶片中h2s含量的差异与实施案例1中水稻幼苗根部h2s含量的差异非常接近,说明实施案例5的测定方法去除了叶绿素的干扰,测定结果更接近真实情况。
实施案例6,
去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,取实施案例1中对照组的水稻幼苗叶片0.15g,在4.0ml、ph=7.0的研磨液中冰浴研磨成匀浆液,研磨液:100mm磷酸钾缓冲液(含10mmedta);
步骤s2,准确吸取3.0ml步骤s1的匀浆液,然后加入等体积的提取液a,涡旋混匀(2800r/min,混合18s)后备用,提取液a为丙酮和正己烷按照体积比1:1混合;
步骤s3,将步骤s2中的混合液在14000r/min的条件下,4℃离心12min;
步骤s4,吸取3.0ml上清液,加入等体积提取液b,涡旋混匀(2800r/min,混合18s)后备用;提取液b为三氯甲烷;
步骤s5,将步骤s4所得到的混合液在10000r/min的条件下,4℃离心4min,液体分为上层的水相(h2s提取液)和下层的有机相(含有叶绿素的三氯甲烷提取液);
步骤s6,吸取上层的水相溶液2.0ml用dtnb比色法测定叶片中的h2s含量。
实施案例7,
去除植物叶片中总叶绿素干扰h2s含量测定的方法,具体按照以下步骤进行:
步骤s1,取实施案例1中对照组的水稻幼苗叶片0.2g,在3.0ml、ph=7.0的研磨液中冰浴研磨成匀浆液,研磨液:100mm磷酸钾缓冲液(含10mmedta);
步骤s2,准确吸取3.0ml步骤s1的匀浆液,然后加入等体积的提取液a,涡旋混匀(2900r/min,混合16s)后备用,提取液a为丙酮和正己烷按照体积比1:1混合;
步骤s3,将步骤s2中的混合液在13000r/min的条件下,4℃离心14min;
步骤s4,吸取3.0ml上清液,加入等体积提取液b,涡旋混匀(2900r/min,混合16s)后备用;提取液b为三氯甲烷;
步骤s5,将步骤s4所得到的混合液在11000r/min的条件下,4℃离心4min,液体分为上层的水相(h2s提取液)和下层的有机相(含有叶绿素的三氯甲烷提取液);
步骤s6,吸取上层的水相溶液2.0ml用dtnb比色法测定叶片中的h2s含量。
实施案例8,
提取液a:丙酮和正己烷的体积混合比分别采用40%:60%、60%:40%、30%:70%、70%:30%。在步骤s2分别采用以上四种不同组合的提取液a,其它步骤与实施案例5相同,发现上层水相的颜色均有显示不同程度的淡绿色。
实施案例9,
在实施案例5的步骤s4,将3.0ml提取液b缩减到1.5-2.5ml时,其它步骤与实施案例5相同,得到上层水相的颜色显示淡绿色,说明萃取剂三氯甲烷的加入体积不足。
由实施案例2-4可以看出,由丙酮、正己烷、三氯甲烷单独去除叶绿素,对h2s含量测定效果不明显。
以上所述仅为本发明的较佳实施例而已,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内所作的任何修改、等同替换、改进等,均包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!