免图像采集与处理的单细胞胞浆粘性测量装置和方法与流程
本发明涉及微流控技术领域,尤其涉及一种免图像采集与处理的单细胞胞浆粘性测量装置及方法。
背景技术:
细胞是一切生命活动的基本单元,在生命体的生命活动当中,不断发生着细胞的分裂、分化和凋亡。早在1665年,英国的科学家roberthooker第一次发现了细胞,从那时起,人类就开始了对细胞世界的不断探索。近年来,对于单细胞的的研究吸引了越来越多的科研工作者。现在的科学界普遍认为细胞之间存在着异质性,异质性不仅存在于不同种类的细胞之间,同样也存在于相同细胞之间,这些异质性可能表现在细胞的各种生物物理、生物化学特性上的差异。以往的对于整个细胞团的测量方法常常很难显示出这种差异,因为对于整个细胞团的测量得到的结果往往是其中所有细胞特性的平均结果,一些显著的、存在于单个细胞之间的差异很容易被掩盖。在这样的背景下,单细胞分析技术出现了,它可以实现对于单个细胞的精准的测量与表征,对于各种疾病的诊断、治疗以及人类对于细胞的探索将具有长远的意义。
单细胞分析的一个重要内容是对单个细胞所呈现出来的各种力学特性进行表征。以真核细胞为例,细胞的主要组成部分由细胞膜、细胞质、细胞核等,细胞质当中有着丰富的微丝、微管、中间丝,这些都构成了支撑细胞形态的细胞骨架,决定着细胞对于各种外力的响应。细胞的生命活动往往会伴随着细胞骨架、细胞膜、细胞质等结构的改变,往往也会表现出相应的力学特性的改变。细胞力学特性往往反映了细胞生理学的改变。单细胞胞浆粘性是单细胞的一个重要的力学特性参数,很多研究表明了细胞的胞浆粘性与疾病的关系。例如人感染疟疾虫后,疟疾虫的寄生细胞——红细胞的胞浆粘性会增大。又如镰刀贫血症患者的红细胞的胞浆粘性相比于正常人更高,其红细胞常常呈现镰刀形或新月形。恶性肿瘤细胞在生物体内无限繁殖,其原因是其凋零机制发生异常,而其胞浆粘性也更小。
在表征单细胞的力学特性方面,传统的方法有原子力显微镜(afm)、微吸管技术。原子力显微镜的构成主要有光敏二极管、悬臂梁和微型探针,在实际的测量过程中,微型探针和细胞表面接触后,会引起悬臂梁的形变,悬臂梁后端的光敏二极管会感知到这一形变并将其输出,最终得到细胞的力学特性参数。但是此方法只能测量贴壁的细胞的局部力学特性,无法测量细胞整体的力学特性,且检测结果常常受到细胞基板和探针的影响,再加上其检测通量低,目前由此方法报道的单细胞力学特性的数据量很少。传统的微吸管技术利用负压将细胞吸引进入毛细管口部,细胞在微吸管口部形成微小形变,之后被吐出,通过分析细胞在微吸管的微小形变可以计算得到细胞整体的力学特性参数,但由于此方法无法实现细胞的连续性测量,其检测通量低,难以满足单细胞力学特性表征的实用需求。
微流控技术的特征尺寸与细胞的直径很接近,便于对单细胞进行操纵和分析,且具有对于样本需求量少、反映灵敏的特点。近年来,基于微流控技术的单细胞力学特性检测的方法受到了广泛的关注,代表的有电学拉伸法、流体拉伸法和压缩通道法。prof.sun于2011年提出了一种电学拉伸方法,该方法中使用了两块大小不等的极板发生不均匀的电场,细胞在不均匀电场中向电场强度高的极板运动,当到达此极板时静止,此时,细胞受到静电力的作用而发生拉伸形变,结合相应的力学模型,可以得到细胞的力学特性参数杨氏模量,但是该方法通量低,仅有不到10个细胞的结果被报道。prof.dicarlo于2012年提出了一种流体拉伸的方法,该方法利用流体剪切力使细胞发生形变,将细胞的形变结合相应的力学模型,可以得到细胞的力学特性参数,但细胞在沟道中的受力很大程度上会根据细胞在微流体中的不同位置而呈现出差异,所以这种测量结果并不准确。我课题组的prof.chen于2014年提出了基于压缩通道的单细胞力学特性的方法,该方法利用负压吸引细胞进入压缩通道,细胞在进入压缩通道过程中发生形变,将此形变结合力学模型实现了单细胞杨氏模量的表征。
目前的基于微流控技术的单细胞力学特性检测的方法增加了人类对于单细胞的理解,细胞胞浆粘性作为一种重要的单细胞力学特性参数,也多次被报道与多种疾病相关,但是由于检测通量的限制,大量的单细胞胞浆粘性的数据仍然缺失。这些胞浆粘性的测量方法往往需要经过图像采集与处理过程,因此其检测通量严重受制于图像采集速度、存储空间、图像采集质量、图像数据处理速度等诸多因素,高通量的不需要图像采集与处理过程的单细胞胞浆粘性测量的方法尚未出现。
因此,目前急需要发展一种免图像的高通量单细胞胞浆粘性测量方法和装置。
技术实现要素:
(一)要解决的技术问题
本发明提供了一种免图像采集与处理的单细胞胞浆粘性测量装置及方法,以至少部分解决以上所提出的技术问题。
(二)技术方案
根据本发明的一方面,提供一种免图像采集与处理的单细胞胞浆粘性测量装置,包括:
微流体芯片模块,用于待测量单细胞运动并形成伸入;
压力控制模块,与所述微流体芯片模块连接,用于驱动和控制所述单细胞运动;
电学发生与采集模块,与所述微流体芯片模块连接,用于向所述微流体芯片模块提供电压信号,以及监测所述电压信号并记录发生电压变化的时间;
数据分析与处理模块,与所述电学发生与采集模块连接,用于根据所述发生电压变化的时间得到所述单细胞的伸入速度,从而得到所述单细胞粘性。
在进一步的实施方案中,所述微流体芯片模块包括:
流通通道,用于所述单细胞沿所述流通通道运动;
运动测量通道,与所述流通通道交叉,用于所述单细胞在所述运动测量通道中形成部分伸入以发生第一次电压变化;
运动监视窗口,位于所述运动测量通道上,用于所述单细胞在所述运动监视窗口中形成部分伸入以发生第二次电压变化;
第一电极和第二电极,分别位于所述运动测量通道的两端,用于采集电压信号;
第三电极和第四电极,分别位于所述运动监视窗口的两端,用于采集电压信号。
在进一步的实施方案中,所述微流体芯片模块还包括:
细胞入口,与所述压力控制模块连接;
细胞流入通道,与所述细胞入口和所述流通通道的一端连接;
细胞流出通道,与所述流通通道的另一端连接;
细胞出口,与所述细胞流出通道连接。
在进一步的实施方案中,所述压力控制模块包括:
压力源;
压力控制器,与所述压力源连接,用于输出压力并控制输出的压力大小;
密闭软管和密闭硬管,与所述压力控制器和所述微流体芯片模块连接,用于向所述微流体芯片模块内施加压力。
根据本发明的另一方面,提供一种免图像采集与处理的单细胞胞浆粘性测量方法,包括:
压力控制模块驱动待测单细胞在微流体芯片模块内运动并形成伸入,并使所述微流体芯片模块发生电压变化;
电学发生与采集模块记录所述微流体芯片模块发生两次电压变化的时间;
数据分析与处理模块根据所述电学发生与采集模块记录的所述微流体芯片模块发生所述两次电压变化的时间差得到单细胞的伸入速度,从而得到单细胞粘性。
在进一步的实施方案中,所述待测单细胞在微流体芯片模块内运动并形成伸入之前还包括:
在微流体芯片模块中充满溶液;
将待测量单细胞加入至所述微流体芯片模块,并使单细胞悬浮在所述溶液内。
在进一步的实施方案中,所述压力控制模块驱动待测单细胞在微流体芯片模块内运动并形成伸入,并使所述微流体芯片模块发生电压变化包括:
压力控制模块驱动所述单细胞进入所述微流体芯片模块的流通通道,并沿着所述流通通道继续运动;
所述单细胞运动至细胞运动测量通道并在其内形成部分伸入,形成第一次电压变化;
所述单细胞伸入至运动监视窗口,形成第二次电压变化。
在进一步的实施方案中,所述记录所述微流体芯片模块发生电压变化的时间包括:记录所述第一次述电压变化和第二次电压变化的时间,并得到两次电压变化的时间差。
在进一步的实施方案中,所述根据所述电学发生与采集模块记录的所述微流体芯片模块发生电压变化的时间差得到单细胞粘性包括:
根据所述时间差得到单细胞在所述运动测量通道内的伸入速度;
将所述伸入速度与单细胞粘性特性模型结合得到单细胞粘性。
在进一步的实施方案中,所述伸入速度的计算公式为:
其中,
(三)有益效果
从上述技术方案可以看出,本发明免图像采集与处理的单细胞胞浆粘性测量装置及方法至少具有以下有益效果其中之一:
本发明提供的单细胞胞浆粘性测量装置通过单细胞在微流控芯片模块内运动时使其发生的两次电压变化的时间差得到细胞胞浆粘性,使得该装置无需图像采集装置获得细胞形变相关参数,其检测通量不再受限于图像采集设备的采集速度,有利于检测通量的提升,并且显著降低了装置成本。
本发明提供的单细胞胞浆粘性测量方法无需使用图像采集设备就可以实现细胞胞浆粘性测量,即无需复杂的图像处理过程,其检测过程更简单,降低计算成本。
附图说明
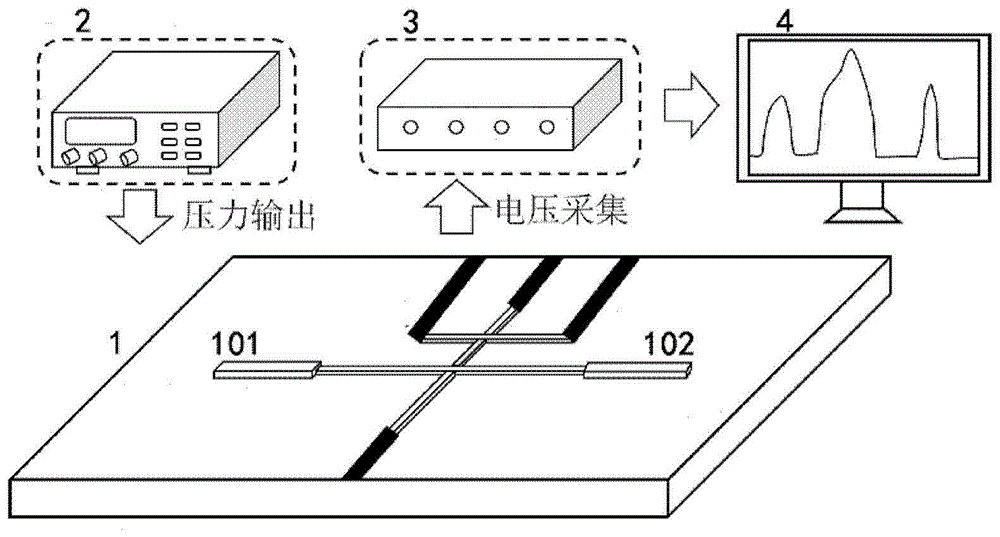
图1是本发明提供的免图像采集与处理的单细胞胞浆粘性测量装置结构示意图;
图2是本发明提供的免图像采集与处理的单细胞胞浆粘性测量装置的微流控芯片模块结构图;
图3是本发明提供的免图像采集与处理的单细胞胞浆粘性测量装置的微流控芯片制作流程图;
图4是本发明提供的免图像采集与处理的单细胞胞浆粘性测量装置的数据分析与处理模块4原理图;
图5是本发明提供的免图像采集与处理的单细胞胞浆粘性测量方法流程图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
本发明提供的单细胞胞浆粘性测量装置和方法,在充满导电介质溶液的微流控芯片模块内,单细胞106在运动过程中产生形变,从而会产生电压变化,通过单细胞106在微流控芯片模块内运动时引起的两次电压变化的时间差得到细胞形变速度,结合模型后可得到单细胞胞浆粘性。该装置无需图像采集装置获得相关参数,可降低设备成本、提高通量、降低计算成本。
需要说明的是,权利要求和说明书中所说的单细胞106的伸入一般是指:在所述单细胞106运动过程中部分细胞被挤入与正在运动的通道存在交叉的其他通道发生形变。
如图1所示,图1是本发明提供的免图像采集与处理的单细胞胞浆粘性测量装置结构示意图,该测量装置包括:
微流体芯片模块1,用于在待测量单细胞106内运动并形成伸入;
压力控制模块2,与所述微流体芯片模块1连接,用于驱动和控制所述单细胞106运动;
电学发生与采集模块3,与所述微流体芯片模块1连接,用于向所述微流体芯片模块1提供电压信号,以及监测所述电压信号并记录发生电压变化的时间;
数据分析与处理模块4,与所述电学发生与采集模块3连接,用于根据所述发生电压变化的时间得到单细胞粘性。在本实施例中,所述压力控制模块2驱动和控制待测量单细胞106在所述微流体芯片模块1中运动,根据所述微流体芯片模块1的设计所述单细胞106在其内运动过程中会使其出现两次或多次的电压变化,所述电学发生与采集模块3记录其中两次电压变化的时间差,数据分析与处理模块4将所述时间差结合其两次形成电压变化的距离得到所述单细胞106的伸入速度,并将所述伸入速度带入单细胞粘性特性模型最终得出单细胞粘性。
其中,所述电压变化的时间为所述电学发生与采集模块3在监测所述微流体芯片模块1电压信号时,电压开始变化的时间。
其中,所述伸入速度的计算公式为:
其中,
如图2所示,图2是本发明提供的免图像采集与处理的单细胞胞浆粘性测量装置的微流控芯片模块结构图,所述微流体芯片模块1包括:
流通通道105,用于所述单细胞106沿所述流通通道105运动;
运动测量通道107,与所述流通通道105交叉,用于所述单细胞106在所述运动测量通道107中形成部分伸入以发生第一次电压变化;
运动监视窗口108,位于所述运动测量通道107上,用于所述单细胞106在所述运动监视窗口108中形成部分伸入以发生第二次电压变化;
第一电极109和第二电极110,分别位于所述运动测量通道107的两端,用于采集电压信号;
第三电极111和第四电极112,分别位于所述运动监视窗口108的两端,用于采集电压信号。
所述微流体芯片模块1包括交叉式压缩通道,在本实施例中,所述交叉式压缩通道由所述流通通道105和所述运动测量通道107形成。其中,所述流通通道105指的是其截面任意维度中的一个或两个维度小于细胞直径的沟道,一般采用的沟道对角线尺寸为5-20微米;所述运动测量通道107指的是其截面任意维度中的一个或两个维度的长度小于细胞直径,且其截面任意维度中的一个或两个维度的长度小于主压缩沟道的截面的任意维度长度,一般采用的沟道对角线尺寸为2-20微米;所述运动监视窗口108指的是其截面任意维度中的一个或两个维度的长度小于细胞直径,且其截面任意维度中的一个或两个维度的长度小于主压缩沟道的截面的任意维度长度,一般采用的沟道对角线尺寸为2-20微米。此外,所述流通通道105与运动测量通道107可以是垂直交叉或其他任意角度交叉,且其交叉位置可位于所述流通通道105的任意位置;所述运动监视窗口108位于所述运动测量通道107的一侧或两侧均可;所述运动测量通道107、所述细胞进入通道、细胞流出通道104和所述运动监视窗口108的横截面可以是但不局限于矩形、圆形或椭圆形,以上设计均可以实现本发明的功能。
在本实施例中,所述单细胞106沿着所述流通通道105运动,当到达细胞运动测量通道107时,开始向运动测量通道107内形成部分伸入,这时,运动测量通道107两端的第一电极109和第二电极110会检测到一个电压的变化,随着细胞沿着细胞流通通道105继续运动,细胞在运动测量通道107内伸入长度会逐渐增加,当其到达运动监视窗口108时,运动监视窗口108两端的第三电极111和第四电极112会检测到另一个电压的变化,之后细胞离开所述细胞流通通道105。其中,第一电极109和第二电极110检测到的一个电压变化时间为t1,第三电极111和第四电极112极检测到的另一个电压变化时间为t2,所述运动监视窗口108到所述流通通道105的距离为形成两次电压变化的距离l,所述单细胞106在所述运动测量通道107的深入速度为所述单细胞106的伸入速度
如图2所示,所述微流体芯片模块1还可包括:
细胞入口101,与所述压力控制模块2连接,用于使所述单细胞106进入所述微流体芯片模块1;
细胞流入通道103,与所述细胞入口101和所述流通通道105的一端连接,用于使所述单细胞106顺利进入所述流通通道105;
细胞流出通道104,与所述流通通道105的另一端连接,用于使所述单细胞106流出所述流通通道105;
细胞出口102,与所述细胞流出通道104连接,用于使所述单细胞106排除所述微流体芯片模块1。
其中,所述细胞流入通道103和细胞流出通道104指的是横截面大于细胞横截面的通道,一般采用对角线尺寸为30-1000微米。
在本实施例中,所述单细胞106从所述细胞入口101加入,之后在所述压力控制模块2的驱动下会进入所述细胞流入通道103,通过所述流通通道105进入所述流通通道105;所述单细胞106完成测量后通过所述细胞流出通道104从所述流通通道105流出,最后通过所述细胞出口102排出所述微流体芯片模块1。
此外,所述微流体芯片模块1还包括:衬底(图中未画出)以及与其紧密结合的承载体,上述的细胞入口101、细胞流入通道103、细胞流通通道105、运动测量通道107、运动监视窗口108、细胞流出通道104和细胞出口102均形成于所述承载体上。本实施例中衬底的材料为玻璃,当然本领域技术人员应当清楚,除了玻璃之外,衬底可以为硅片、聚酸甲酯(polymethylmethacrylate,简称pmma,英文acrylic,又称做压克力、亚克力或有机玻璃)或聚二甲基硅氧烷(polydimethylsiloxane,简称pdms)片等片状材料。本实施例中承载体的材料为pdms,当然除了pdms外,还可以采用玻璃、光刻胶su-8、硅片等材料来形成上述承载体。
如图3所示,图3是本发明提供的免图像采集与处理的单细胞胞浆粘性测量装置的微流控芯片制作流程图,该制备步骤包括:
步骤a:在玻璃片上旋涂光刻胶su8-5,进行第一次对准曝光;
步骤b:在步骤a的光刻胶su8-5上再旋涂一层光刻胶su8-25,进行第二次对准曝光;
步骤c:进行后烘、显影、坚模,形成细胞流入通道103和细胞流出通道104阳模;
步骤d:在步骤c所得模具上浇注pdms与固化剂混合液;
步骤e:固化后脱模得到微流控通道;
步骤f:在玻璃片上溅射一层金属;
步骤g:通过标准的剥离工艺在玻璃片上制备一定形状的片上电极;
步骤h:对步骤e得到的微流控通道打孔并与有片上电极的玻璃片键合。
在本发明中,所述压力控制模块2包括:
压力源,用于提供压力;
压力控制器,与所述压力源连接,用于输出压力并控制输出的压力大小;
密闭软管和密闭硬管,与所述压力控制器和所述微流体芯片模块1连接,用于向所述微流体芯片模块1内施加压力。
在本实施例中,所述压力源作为提供压力来源;所述压力控制器用于输出压力并控制输出的压力大小;所述密闭软管和密闭硬管用于向所述微流控芯片模块内施加压力。一般情况下,所述微流控芯片模块内充满溶液,所述压力控制模块2将压力施加在所述溶液上从而带动待测单细胞106进行运动。所述压力控制模块2为现有技术,在此不再赘述,当然也可以使用其他任何可以实现其相应功能的其他压力控制装置。
如图4所示,图4是本发明提供的免图像采集与处理的单细胞胞浆粘性测量装置的数据分析与处理模块4原理图,所述数据分析与处理模块4根据记录的两次电压变化的结合两次电压变化的距离计算得出所述单细胞106的伸入速度,然后将所述伸入速度带入所述单细胞粘性特性模型得出所述单细胞粘性。
在本实施例中,所述单细胞粘性特性模型为液滴模型,即把细胞视作由一次薄膜包裹的水滴结构,此模型中的关键参数有施加的压强(δp)、所述运动测量通道107的等效半径(rp)、细胞在所述运动测量通道107的深入长度随时间的变化速率
通过将测量得到的参数带入上述公式,可以得到细胞的胞浆粘性(μc)。最终的表征参数可以是细胞胞浆粘性(μc)。
如图5所示,图5是本发明提供的免图像采集与处理的单细胞胞浆粘性测量方法流程图,该测量方法包括:
s1:压力控制模块2驱动待测单细胞106在微流体芯片模块1内运动并形成伸入,并使所述微流体芯片模块1发生电压变化;
s2:电学发生与采集模块3记录所述微流体芯片模块1发生两次电压变化的时间;
s3:数据分析与处理模块4根据所述电学发生与采集模块3记录的所述微流体芯片模块1发生两次电压变化的时间差得到单细胞粘性。
在本实施例中,通过监测并记录两次电压变化的时间,并通过其时间差得到单细胞的伸入速度,再根据所述伸入速度即可经过计算得到单细胞粘性,其过程简便、计算简单,无需图像采集模块通过采集图像再获取相应参数的复杂过程,即可实现低成本且高通量地得到单细胞胞浆粘性。
在本实施例中,所述待测单细胞106在微流体芯片模块1内运动并形成伸入之前还包括:
s01:在微流体芯片模块1中充满溶液;
s02:将待测量单细胞106加入至所述微流体芯片模块1,并使悬浮在所述溶液上。
在步骤s01中,其属于实验准备阶段,即先将微流控器件充入液体,一般情况下采用与细胞等渗透压的细胞培养液,磷酸盐缓冲液(phosphatebufferedsolution,简称pbs)或生理盐水效果更佳。
在步骤s1中,所述压力控制模块2驱动待测单细胞106在微流体芯片模块1内运动并形成伸入,并使所述微流体芯片模块1发生电压变化具体包括:
s101:压力控制模块2驱动所述单细胞106进入所述微流体芯片模块1的流通通道105,并沿着所述流通通道105继续运动;
s102:所述单细胞106运动至细胞运动测量通道107并在其内形成部分伸入,形成第一次电压变化;
s103:所述单细胞106伸入至运动监视窗口108,形成第二次电压变化。
在步骤s2中,所述记录所述微流体芯片模块1发生电压变化的时间包括:记录所述第一次述电压变化和第二次电压变化的时间,并得到两次电压变化的时间差。
在步骤s3中,所述根据所述电学发生与采集模块3记录的所述微流体芯片模块1发生电压变化的时间差得到单细胞粘性包括:
s301:根据所述时间差得到单细胞106在所述运动测量通道107内的伸入速度;
s302:将所述伸入速度与单细胞粘性特性模型结合得到单细胞粘性。
其中,所述单细胞粘性特性模型与上述检测装置中使用的模型相同,在此不再赘述。
至此,已经结合附图对本发明进行了详细描述。依据以上描述,本领域技术人员应当对本发明中提供的单细胞106力学特性检测装置及方法有了清楚的认识。
需要说明的是,数据分析与处理模块4可以包括各种形式的计算设备,例如通用计算机、专用集成电路(asic)、现场可编程门阵列(fpga)等。数据分析与处理模块4可以通过加载存储于存储装置中的程序、代码段等,来按如上所述的各种方法流程工作,以实现图像处理以及细胞胞浆粘性计算等功能。该数据分析与处理模块4还可以包括输入设备,例如鼠标、键盘等,用以输入用户命令、数据等,以及输出设备,例如显示器等,用以输出处理器的处理结果(例如,预测结果等)。输入设备和输出设备可以组合实现为触摸屏。
除非有所知名为相反之意,本说明书及所附权利要求中的数值参数是近似值,能够根据通过本公开的内容所得的所需特性改变。具体而言,所有使用于说明书及权利要求中表示尺寸等等的数字,应理解为在所有情况中是受到“约”的用语所修饰。一般情况下,其表达的含义是指包含由特定数量在一些实施例中±10%的变化、在一些实施例中±5%的变化、在一些实施例中±1%的变化、在一些实施例中±0.5%的变化。
此外,除非特别描述或必须依序发生的步骤,上述步骤的顺序并无限制于以上所列,且可根据所需设计而变化或重新安排。并且上述实施例可基于设计及可靠度的考虑,彼此混合搭配使用或与其他实施例混合搭配使用,即不同实施例中的技术特征可以自由组合形成更多的实施例。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!