一种24,25-双羟基维生素D免疫检测试剂盒及其应用的制作方法
本发明涉及一种24,25-双羟基维生素d免疫检测试剂盒及其应用,属于体外检测技术领域。
背景技术:
维生素d在人体中主要以胆钙化醇(d3)和麦角钙化醇(d2)两种形式存在,其中,胆钙化醇(d3)来源于阳光和肉制品,麦角钙化醇(d2)来源于膳食植物源。维生素d内分泌系统在人体中起着重要的生物学功能,维生素d经血液循环进入肝脏,在25-羟化酶cyp2r1的作用下转化为25-羟基维生素d(25-oh-vitd,包括25-oh-vitd2和25-oh-vitd3),继而在肾脏中被24-羟化酶cyp24a1催化生成24,25-双羟基维生素d(24,25-(oh)2-vitd),25-oh-vitd还可在体内代谢为具有生物学活性的1,25-(oh)2-vitd及3-epi-25oh-vitd。
研究表明,24,25-(oh)2-vitd与25-oh-vitd呈依赖关系,25-oh-vitd与24,25-(oh)2-vitd的浓度比值在血清25-oh-vitd浓度低于20ng/ml时显著增加,而在血清25-oh-vitd浓度高时此比值下降,这可能是由于血液循环中25-oh-vitd下降导致cyp24a1下调,以促进分解代谢产物1,25-(oh)2-vitd的产生;而在25-oh-vitd高浓度个体中,则倾向于产生24,25-(oh)2-vitd以降低1,25-(oh)2-vitd的产量,起到预防毒性的作用。因此,血清24,25-(oh)2-vitd浓度的测定有助于识别cyp24a1功能缺失突变的患者,且血清中25-oh-vitd与24,25-(oh)2-vitd浓度的比值可以作为维生素d分解代谢状态的指标,尤其对于肾钙化或肾结石患者,如果检测到25-oh-vitd与24,25-(oh)2-vitd的浓度比值升高,说明要限制或避免补充维生素d,以防止高钙血症和进一步的结石形成。
目前,对于25-oh-vitd的检测已经应用得比较成熟,常使用的检测方法有竞争法或蛋白结合免疫法及色谱法,其中,液相色谱串联质谱(lc-ms/ms)法为检测的标准方法,然而此方法专业水平要求极高、费时费力,而免疫方法相对简单、通量高,目前国内外各大体外诊断试剂厂家提供各种25-oh-vitd免疫检测试剂,包括从样本准备阶段(如从vdbp中完全连续地释放25-oh-vitd)、结合系统(单抗、多抗还是vdbp)、检测系统(酶、荧光物质、发光物质等)、信号系统(如光吸收、化学发光、放射标记等)等各个阶段所用到的各种试剂,目前国际标准品已建立起来,为消除方法间差异打下基础。然而,对于24,25-(oh)2-vitd的检测,国内外仅有使用lc-ms/ms法测定24,25-(oh)2-vitd的报道,lc-ms/ms操作复杂费时而且需要高端精密的仪器,但是目前尚无免疫学方法可以准确检测24,25-(oh)2-vitd。
技术实现要素:
本发明要解决的技术问题是:为解决现有技术中尚无免疫学方法可以准确检测24,25-(oh)2-vitd的技术问题,提供一种24,25-双羟基维生素d免疫检测试剂盒及其应用。
本发明解决其技术问题所采用的技术方案是:
一种24,25-双羟基维生素d免疫检测试剂盒,包括:全氟辛酸工作液、生物素工作液、抗体工作液、链霉亲和素包被的磁颗粒试剂、24,25-(oh)2-vitd校准品溶液及化学发光底物液,所述抗体工作液包含化学发光标记物标记的抗24,25-(oh)2-vitd免疫单抗、未标记的抗25-oh-vitd免疫单抗、未标记的抗1,25-(oh)2-vitd免疫单抗、未标记的抗3-epi-25oh-vitd免疫单抗。
优选地,所述抗24,25-(oh)2-vitd免疫单抗、抗25-oh-vitd免疫单抗、抗1,25-(oh)2-vitd免疫单抗、抗3-epi-25oh-vitd免疫单抗均为绵羊单抗。
优选地,所述抗体工作液中含有异噬性抗体阻断剂hbr,异噬性抗体阻断剂hbr的浓度优选为0.5-3mg/ml,异噬性抗体阻断剂hbr可以消耗样本中的异噬性抗体,避免异噬性抗体与化学发光标记物标记的抗24,25-(oh)2-vitd免疫单抗反应,以进一步避免假性结果;进一步,所述抗体工作液优选为由pbs或cbs缓冲液配制而成,pbs或cbs缓冲液的浓度优选为0.05-0.15m、ph优选为8.5-10.5。
优选地,所述抗体工作液中含有蛋白、多糖及多元醇;所述蛋白为白蛋白和/或酪蛋白,浓度优选为0.5-2mg/ml;所述多糖为果糖和/或蔗糖,浓度优选为3-5mg/ml;所述多元醇为丙三醇和/或乙二醇,浓度优选为3-5mg/ml;所述多元醇为丙三醇和/或乙二醇,蛋白、多糖和多元醇的加入可以有效防止抗体相互聚集,进一步避免出现假阳性。
优选地,所述化学发光标记物标记的抗24,25-(oh)2-vitd免疫单抗的制备方法为:将抗24,25-(oh)2-vitd免疫单抗与化学发光标记物在pbs或cbs缓冲液中按1:10~20的摩尔比反应0.5-1.5小时,透析去除未交联的小分子,得到化学发光标记物标记的抗24,25-(oh)2-vitd免疫单抗;所述pbs或cbs缓冲液的浓度优选为0.02-0.08m、ph优选为8.5-10.5。
优选地,所述全氟辛酸工作液中含有5-15体积%的乙二醇,全氟辛酸工作液优选为pbs或cbs缓冲液配制而成,pbs或cbs缓冲液的浓度优选为0.05-0.15m、ph优选为8.5-10.5。
优选地,所述24,25-(oh)2-vitd校准品溶液由去类固醇激素血清配制而成,24,25-(oh)2-vitd校准品溶液中优选为含有0.05wt%-0.2wt%的proclin300。
优选地,所述化学发光标记物选自鲁米诺或其衍生物、异鲁米诺或其衍生物、吖啶酯或吖啶磺酰胺。
优选地,所述化学发光底物液包括化学发光激发液1和化学发光激发液2,所述化学发光激发液1含无机酸和过氧化物,所述化学发光激发液2含氢氧化物。
本发明还提供上述24,25-(oh)2-vitd化学发光免疫检测试剂盒的应用,按照以下步骤使用:
将待测样本与全氟辛酸工作液加热反应,之后加入生物素工作液和抗体工作液加热孵育,再加入链霉亲和素包被的磁颗粒试剂加热孵育,形成磁性复合物悬浮液;
将磁性复合物悬浮液置于磁场内,洗涤所述磁性复合物;
向洗涤后的磁性复合物中注入化学发光底物液,检测其化学发光光子强度。
本发明的有益效果是:
本发明首次采用化学发光免疫检测试剂盒对24,25-(oh)2-vitd进行检测,检测方法简单,样本用量较少,较lc-ms/ms适合于临床推广,尤其试剂盒的抗体工作液包含化学发光标记物标记的抗24,25-(oh)2-vitd免疫单抗、未标记的抗25-oh-vitd免疫单抗、未标记的抗1,25-(oh)2-vitd免疫单抗、未标记的抗3-epi-25oh-vitd免疫单抗,能够有效避免24,25-(oh)2-vitd免疫单抗与25-oh-vitd、1,25-(oh)2-vitd、3-epi-25oh-vitd等其他维生素d代谢物发生交叉反应,检测结果准确,有望应用于临床补充维生素d的疗效监测及cyp24a1突变患者的筛查;进一步,所述抗体工作液中加入的异噬性抗体阻断剂hbr、蛋白、多糖及多元醇等,可以进一步避免假性结果。
附图说明
下面结合附图和实施例对本发明进一步说明。
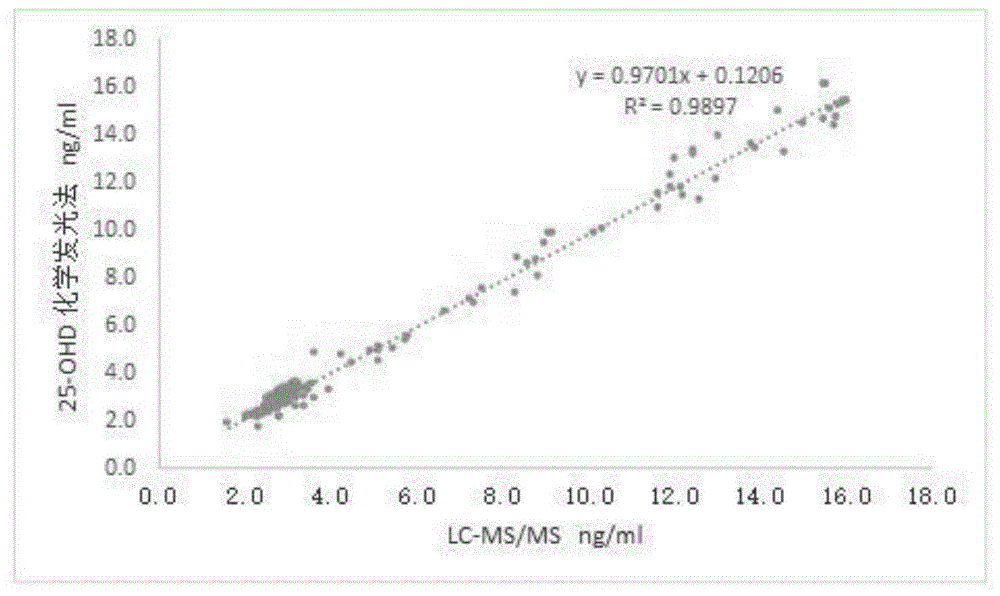
图1是本发明对比例1的方法与实施例4的方法检测的血清样本中24,25-(oh)2-vitd含量的对比图。
具体实施方式
现在结合附图对本发明作进一步详细的说明。这些附图均为简化的示意图,仅以示意方式说明本发明的基本结构,因此其仅显示与本发明有关的构成。
实施例1
本实施例提供一种24,25-双羟基维生素d免疫检测试剂盒及其制备方法,试剂盒包括:全氟辛酸工作液、生物素工作液、抗体工作液、链霉亲和素包被的磁颗粒试剂、24,25-(oh)2-vitd校准品溶液及化学发光底物液,所述抗体工作液包含鲁米诺标记的抗24,25-(oh)2-vitd绵羊单抗、未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗;
24,25-双羟基维生素d免疫检测试剂盒的制备方法为:
全氟辛酸工作液的制备:用含有5体积%乙二醇的pbs缓冲液配制成浓度为100ng/ml的全氟辛酸工作液,所述pbs缓冲液的浓度为0.05m、ph为8.5;
生物素工作液的制备:用浓度为0.05m、ph为8.5的pbs缓冲液配制成浓度为100ng/ml的生物素工作液;
抗体工作液的制备:用浓度为0.02m、ph为8.5的cbs缓冲液配制抗24,25-(oh)2-vitd绵羊单抗溶液;
将抗24,25-(oh)2-vitd绵羊单抗溶液加入鲁米诺反应0.5小时,抗24,25-(oh)2-vitd绵羊单抗与鲁米诺反应的摩尔比为1:10反应,透析去除未交联的小分子,得到鲁米诺标记的抗24,25-(oh)2-vitd免疫单抗;
将鲁米诺标记的抗24,25-(oh)2-vitd绵羊单抗用浓度为0.05m、ph为8.5的pbs缓冲液稀释,并加入未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗,得到抗体工作液,所述抗体工作液中鲁米诺标记的抗24,25-(oh)2-vitd绵羊单抗、未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗的浓度均为1mg/ml;所述pbs缓冲液中含有0.5mg/ml异噬性抗体阻断剂、0.5mg/ml白蛋白、3mg/ml果糖及5mg/ml丙三醇;
24,25-(oh)2-vitd校准品溶液的制备:用含有0.05wt%proclin300的去类固醇激素血清配制成浓度为0、0.2、0.5、2、5、20、50ng/ml系列标准溶液;
化学发光底物液的制备:化学发光底物液包括化学发光激发液1和化学发光激发液2,所述化学发光激发液1含0.1m硝酸和1wt%过氧化物,所述化学发光激发液2含0.1m氢氧化钠。
实施例2
本实施例提供一种24,25-双羟基维生素d免疫检测试剂盒及其制备方法,试剂盒包括:全氟辛酸工作液、生物素工作液、抗体工作液、链霉亲和素包被的磁颗粒试剂、24,25-(oh)2-vitd校准品溶液及化学发光底物液,所述抗体工作液包含异鲁米诺标记的抗24,25-(oh)2-vitd绵羊单抗、未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗;
24,25-双羟基维生素d免疫检测试剂盒的制备方法为:
全氟辛酸工作液的制备:用含有15体积%乙二醇的cbs缓冲液配制全氟辛酸工作液,所述cbs缓冲液的浓度为0.15m、ph为10.5;
生物素工作液的制备:用浓度为0.15m、ph为10.5的cbs缓冲液配制而成;
抗体工作液的制备:用浓度为0.08m、ph为10.5的pbs缓冲液配制抗24,25-(oh)2-vitd绵羊单抗溶液;
将抗24,25-(oh)2-vitd绵羊单抗溶液加入异鲁米诺反应1.5小时,抗24,25-(oh)2-vitd绵羊单抗与异鲁米诺反应的摩尔比为1:20反应,透析去除未交联的小分子,得到异鲁米诺标记的抗24,25-(oh)2-vitd免疫单抗;
将异鲁米诺标记的抗24,25-(oh)2-vitd绵羊单抗用浓度为0.15m、ph为10.5的cbs缓冲液稀释,并加入未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗,得到抗体工作液,所述抗体工作液中异鲁米诺标记的抗24,25-(oh)2-vitd绵羊单抗、未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗的浓度均为1mg/ml;所述pbs缓冲液中含有3mg/ml异噬性抗体阻断剂、2mg/ml酪蛋白、5mg/ml蔗糖糖及3mg/ml乙二醇;
24,25-(oh)2-vitd校准品溶液的制备:用含有0.2wt%proclin300的去类固醇激素血清配制成浓度为0、0.2、0.5、2、5、20、50ng/ml系列标准溶液;
化学发光底物液的制备:化学发光底物液包括化学发光激发液1和化学发光激发液2,所述化学发光激发液1含0.1m硝酸和1wt%过氧化物,所述化学发光激发液2含0.1m氢氧化钠。
实施例3
本实施例提供一种24,25-双羟基维生素d免疫检测试剂盒及其制备方法,试剂盒包括:全氟辛酸工作液、生物素工作液、抗体工作液、链霉亲和素包被的磁颗粒试剂、24,25-(oh)2-vitd校准品溶液及化学发光底物液,所述抗体工作液包含吖啶酯标记的抗24,25-(oh)2-vitd绵羊单抗、未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗;
24,25-双羟基维生素d免疫检测试剂盒的制备方法为:
全氟辛酸工作液的制备:用含有10体积%乙二醇的pbs缓冲液配制全氟辛酸工作液,所述pbs缓冲液的浓度为0.1m、ph为9.5;
生物素工作液的制备:用浓度为0.1m、ph为9.5的pbs缓冲液配制而成;
抗体工作液的制备:用浓度为0.05m、ph为9.5的cbs缓冲液配制抗24,25-(oh)2-vitd绵羊单抗溶液;
将抗24,25-(oh)2-vitd绵羊单抗溶液加入吖啶酯反应1小时,抗24,25-(oh)2-vitd绵羊单抗与吖啶酯反应的摩尔比为1:15反应,透析去除未交联的小分子,得到吖啶酯标记的抗24,25-(oh)2-vitd免疫单抗;
将吖啶酯标记的抗24,25-(oh)2-vitd绵羊单抗用浓度为0.05m、ph为9.5的pbs缓冲液稀释,并加入未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗,得到抗体工作液,所述抗体工作液中吖啶酯标记的抗24,25-(oh)2-vitd绵羊单抗、未标记的抗25-oh-vitd绵羊单抗、未标记的抗1,25-(oh)2-vitd绵羊单抗、未标记的抗3-epi-25oh-vitd绵羊单抗的浓度均为1mg/ml;所述pbs缓冲液中含有2mg/ml异噬性抗体阻断剂、1mg/ml酪蛋白、1mg/ml白蛋白、5mg/ml蔗糖糖及3mg/ml乙二醇;
24,25-(oh)2-vitd校准品溶液的制备:用含有0.1wt%proclin300的去类固醇激素血清配制成浓度为0、0.2、0.5、2、5、20、50ng/ml系列标准溶液;
化学发光底物液的制备:化学发光底物液包括化学发光激发液1和化学发光激发液2,所述化学发光激发液1含0.1m硝酸和1wt%过氧化物,所述化学发光激发液2含0.1m氢氧化钠。
实施例4
本实施例提供一种采用实施例3的试剂盒检测148例临床血清样本的方法,包括以下步骤:
(1)建立标准曲线:将50μl系列浓度的24,25-(oh)2-vitd校准品溶液依次与100μl全氟辛酸工作液于37℃温浴5min,之后加入100μl生物素工作液和100μl抗体工作液在37℃下孵育10min,再加入20μl链霉亲和素包被的磁颗粒试剂在37℃下孵育10min,形成磁性复合物悬浮液;
将磁性复合物悬浮液置于磁场内,洗涤所述磁性复合物;
向洗涤后的磁性复合物中注入100μl化学发光激发液1,1.5秒后,注入100μl化学发光激发液2,检测其化学发光光子强度,并由24,25-(oh)2-vitd校准品溶液的浓度与光子强度之间的对应关系建立线性标准曲线;
(2)样品分析检测:将50μl上述148例临床血清样本依次与100μl全氟辛酸工作液于37℃温浴5min,之后加入100μl生物素工作液和100μl抗体工作液在37℃下孵育10min,再加入20μl链霉亲和素包被的磁颗粒试剂在37℃下孵育10min,形成磁性复合物悬浮液;
将磁性复合物悬浮液置于磁场内,洗涤所述磁性复合物;
向洗涤后的磁性复合物中注入100μl化学发光激发液1,1.5秒后,注入100μl化学发光激发液2,检测其化学发光光子强度;
(3)结果计算:将步骤(2)所测总光子强度与步骤(2)所建立线性标准曲线进行对照,然后通过计算得到每个临床血清样本中24,25-(oh)2-vitd的含量。
对比例1
本对比例将实施例4的148例临床血清样本采用lc-ms/ms检测每个临床血清样本中24,25-(oh)2-vitd的含量,并以lc-ms/ms检测的结果为横坐标,以实施例4的方法检测结果为纵坐标,绘制散点图(如图1所示),并得到标准线性曲线,线性方程为y=0.9701x+0.1206,相关系数r2为0.9897,可见,lc-ms/ms检测临床血清样本中24,25-(oh)2-vitd含量的方法与实施例4的方法检测的结果差别较小,说明本发明的检测方法能够准确地检测样本中24,25-(oh)2-vitd的含量。
实施例5
本实施例以20ng/ml的24,25-(oh)2-vitd标准溶液为基础样本,分别添加25-oh-vitd3、25-oh-vitd2、1,25-(oh)2-vitd、1,25-(oh)2-vitd2、3-epi-25oh-vitd3、3-epi-25oh-vitd2、维生素d3、维生素d2等8个交叉反应物,依次得到样本1、样本2、样本3、样本4、样本5、样本6、样本7、样本8等8个干扰样本,每个干扰样本中交叉反应物的浓度如表1所示;
采用实施例4的方法检测8个干扰样本及基础样本24,25-(oh)2-vitd的浓度,并计算交叉反应性,所述交叉反应性%=(干扰样本浓度-基础样本浓度)/基础样本浓度*100%;
表1
由表1可以看出,本发明的试剂盒可以准确检测样本中24,25-(oh)2-vitd的浓度,样本中的维生素d及除24,25-(oh)2-vitd的其他维生素d代谢物对24,25-(oh)2-vitd的检测影响甚微。
以上述依据本发明的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项发明技术思想的范围内,进行多样的变更以及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定其技术性范围。
- 还没有人留言评论。精彩留言会获得点赞!