一种生物分子的质谱检测方法与流程
本发明属于生物分析检测技术领域,具体涉及一种生物分子的质谱检测方法。
背景技术:
质谱法是一种高特异性、高灵敏度的普适性化学分析方法,将质谱法和不同的分离方法联用,尤其是气相色谱和液相色谱与质谱的联用,已成为一种分离和鉴定复杂混合物组成及结构的可靠手段,在生物医药、公共安全及环境监测等各个领域都有着广泛的应用。在生物医药领域,基于质谱技术的组学研究方法为癌症的预测诊断、标志物发现、机理研究等提供了强有力的工具。
数据依赖性采集方法(datadependentacquisition,dda)是目前应用最为广泛的质谱采集方法,其基本原理是先利用一级全扫描检测母离子,然后按信号强度排列,将前若干位的母离子进行二级碎裂得到碎片离子,并扫描二级碎片离子,得到质谱信息。dda通常选择一级扫描中信号最强的1~10个母离子进行碎裂,因此二级碎裂图谱的归属明确、解析简单,能够为生物分析提供可靠的依据;但同时,dda先强后弱的采集方式易造成低丰度组分信息的丢失、且存在重现性不佳、定量分析准确性差的缺点。
近年来,随着质谱硬件技术的快速发展,数据非依赖性采集方法(dataindependentacquisition,dia)得到了越来越广泛的关注。dia方法初期是在离子阱中得以实现,后来主要被应用于四级杆串联飞行时间质谱仪为平台的组学分析中。dia方法中将整个全扫描范围等分为若干扫描窗口,每个窗口的宽度为10~30amu,然后循环地对每个窗口中的所有母离子进行二级碎裂及检测,从而无遗漏、无差异地获得样本中所有组分的全部碎片信息。由于其扫描点数均匀,无需指定目标分析物,使分析物在其色谱流出时间内母离子碎裂得到的子离子被多次均匀地采集到,进而利用谱图库实现定性确证和定量离子筛选,有效解决了dda方法存在的问题。此外,由于dia在一次实验中对所有的母离子进行了二级碎裂,保存了完整的定性和定量信息,使采集的数据具有永久的可回溯性。
cn109142737a公开了一种基于二甲基化标记dia策略的蛋白质定量方法,所述方法通过二甲基化标记试剂的多种同位素形式的有机组合实现肽段样品的多重标记,然后利用数据非依赖采集模式采集数据,提取每重标记相应的dia数据中多条母离子和子离子的提取离子色谱图,利用提取到的峰面积进行蛋白质的多重定量分析。cn109613253a公开了一种利用dda-dia交替采集定量筛选红颊草莓柱头差异蛋白的方法,所述方法中先用dda采集模式建立红颊草莓柱头蛋白肽段信息库,然后用dia模式采集待试样品肽段溶液中的信息,得到原始的定量数据,进而将dda得到的信息库和dia得到的原始文件导入分析软件进行匹配定量、t检验分析,实现对红颊草莓柱头差异蛋白的定量筛选。李文娟等报道了一种血液脂质分子的高通量分析方法,所述方法基于dia采集质谱技术、通过优化超高效液相色谱-飞行时间质谱联用的方法进行少量人体血液样品中脂质代谢分子的高通量分析,一次进样实时获得所有母离子信号的全面碎片信息,进而通过谱库比对进行脂质代谢分子鉴定(李文娟等,基于数据非依赖型采集质谱技术的血液脂质分子高通量分析[j],生态毒理学报,2017(2),46-55)。
dia质谱检测方法需要先对每个窗口中的所有母离子进行碰撞碎裂得到二级谱,再利用谱图库匹配的方法对数据进行解析,实现定性确证和定量离子筛选。因此,碎裂效率及产生的二级谱的质量是影响检测结果准确性的关键所在。若碎裂效率有限,无法得到富含丰富碎片信息的二级谱,则无法有效匹配谱图库而得到可靠的鉴定结果。然而在现有技术中,dia方法都采用单一的碎裂方式,包括单一的碰撞诱导解离(cid)或单一的高能碰撞解离(hcd),其中cid是离子阱质谱常用的碰撞诱导技术,但产生的二级谱存在低质量端碎片丢失(cut-off)的问题;hcd虽然能改善低质量碎片丢失效应,但在分析某些化合物时仍然存在碎片信息有限的缺陷,例如在分析磷脂酰胆碱和鞘磷脂化合物时,常常只能在低质量端产生高丰度的m/z=184的头基碎片离子,而缺乏其它可以辅助定性的碎片信息。
因此,开发一种高灵敏度的质谱检测方法、尤其是提高母离子的破碎效率和二级谱的质量,是本领域的研究重点。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种生物分子的质谱检测方法,所述质谱检测方法的循环扫描模式包括一级全扫描和数据非依赖性二级扫描,所述数据非依赖性二级扫描的碎裂模式为源内碰撞诱导解离和高能碰撞解离的混合模式,从而得到更丰富的碎片信息,提高质谱检测的灵敏度和准确性。
为达到此发明目的,本发明采用以下技术方案:
本发明提供一种生物分子的质谱检测方法,所述质谱检测方法包括以下步骤:
(1)将待测样品进行数据非依赖性质谱采集,得到质谱数据;
(2)对步骤(1)得到的质谱数据进行处理,得到检测结果。
其中,步骤(1)所述数据非依赖性质谱采集的循环扫描模式包括一级全扫描和数据非依赖性二级扫描,所述数据非依赖性二级扫描的碎裂模式为源内碰撞诱导解离和高能碰撞解离的混合碎裂。
本发明提供的质谱检测方法是基于数据非依赖性的采集方法(dataindependentacquisition,简写为dia),对所有母离子进行了二次碎裂及循环检测,从而无遗漏地获得了样品中所有组分的全部碎片信息。由于dia方法中决定检测结果准确性的关键在于二次碎裂的效率和二级谱的质量,本发明所述质谱检测方法中将源内碰撞诱导解离(简写为in-sourcecid)和高能碰撞解离(简写为hcd)相结合的混合碎裂模式应用于二级扫描的母离子碎裂中,相比于现有技术中单一的hcd碎裂模式,本发明所述质谱检测方法中的混合碎裂模式具有更高的二次碎裂效率,从而得到更丰富的碎片信息和更高质量的二级谱,有助于提高质谱检测的灵敏度和准确性。
优选地,步骤(1)所述数据非依赖性质谱采集的检测系统为高效液相色谱-四极杆-静电场轨道阱高分辨质谱系统。
优选地,所述源内碰撞诱导解离的电压为10~20ev,例如10ev、11ev、12ev、13ev、14ev、15ev、16ev、17ev、18ev、19ev或20ev,进一步优选为12ev。
优选地,所述高能碰撞解离为多阶碰撞解离或固定破碎能量的碰撞解离。
本发明提供的质谱检测方法中,高能碰撞解离的模式可以根据待测样品的种类进行调整,若检测样品为脂质等小分子样品,则高能碰撞解离的模式优选为多阶碰撞解离(steppedhcd);若检测样品为蛋白质样品,则高能碰撞解离的模式为固定破碎能量的碰撞解离,其破碎能量为25~30%。
优选地,所述多阶碰撞解离的梯度碎裂能量依次为10%、12%、15%。
优选地,所述高效液相色谱的色谱柱为c18色谱柱。
本发明提供的质谱检测方法中,高效液相色谱的色谱柱选择依据为待测样品的种类,若待测样品为脂质等小分子样品,则色谱柱优选为普通的c18色谱柱;若待测样品为蛋白质样品,则色谱柱优选为c18纳流色谱柱;若待测样品为糖类样品,则色谱柱优选为糖分析色谱柱。
优选地,所述c18色谱柱的流速为0.2~0.4ml/min,例如0.2ml/min、0.25ml/min、0.3ml/min、0.35ml/min或0.4ml/min,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为0.3ml/min。
优选地,所述c18色谱柱的进样量为5~20μl,例如6μl、7μl、8μl、9μl、10μl、11μl、13μl、15μl、17μl或19μl,进一步优选为10μl。
优选地,所述c18色谱柱的规格为:长度100mm,内径2.1mm,颗粒直径1.7μm。
优选地,所述高效液相色谱的a流动相为包含0.1%甲酸和10mm甲酸铵的乙腈-水溶液,b流动相为包含0.1%甲酸和10mm甲酸铵的异丙醇-乙腈溶液。
优选地,所述乙腈-水溶液中乙腈和水的体积比为6:4。
优选地,所述异丙醇-乙腈溶液中异丙醇和乙腈的体积比为9:1。
优选地,所述高效液相色谱的分析梯度为:0~2min,30%b流动相;2~4min,30~43%(例如31%、32%、33%、35%、37%、39%、40%、41%或42%)b流动相;4~4.5min,43~50%(例如44%、45%、46%、47%、48%或49%)b流动相;4.5~17min,50~70%(例如51%、53%、55%、57%、60%、62%、64%、66%、68%或69%)b流动相;17~23min,70~98%(例如71%、73%、75%、78%、80%、83%、85%、87%、90%、93%或95%)b流动相;23~26min,98%b流动相;26~26.1min,98~30%b流动相;26.1~30min,30%b流动相。
为简明起见,在所述分析梯度中仅指出b流动相的含量;因为高效液相色谱中每个阶段均为a流动相和b流动相的配合,例如0~2min内为30%b流动相,即在该梯度内为30%b流动相+70%a流动相,以此类推。
优选地,所述四极杆-静电场轨道阱高分辨质谱系统的离子源为电喷雾离子源或纳喷离子源,进一步优选为电喷雾离子源;扫描模式为正离子模式或负离子模式,进一步优选为正离子模式;喷雾电压为2.8~4.0kv(例如2.9kv、3.0kv、3.1kv、3.2kv、3.3kv、3.4kv、3.5kv、3.6kv、3.7kv、3.8kv或3.9kv等),进一步优选为3.5kv;离子传输管温度为280~350℃(例如285℃、290℃、295℃、300℃、305℃、315℃、320℃、325℃、330℃、345℃或350℃等),进一步优选为320℃。
优选地,所述数据非依赖性质谱采集的循环扫描模式为1个一级全扫描和7~20个数据非依赖性二级扫描,例如8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个数据非依赖性二级扫描,进一步优选为10个数据非依赖性二级扫描。
优选地,所述一级全扫描的扫描范围为m/z300~1000。
优选地,所述一级全扫描的分辨率为35000或70000,进一步优选为35000。
优选地,所述数据非依赖性二级扫描的隔离窗口宽度为35~100da,例如37da、39da、40da、42da、44da、46da、48da、50da、53da、55da、58da、60da、62da、65da、68da、70da、71da、73da、75da、78da、80da、83da、85da、88da、90da、93da、95da、98da或100da,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为70da。
优选地,所述数据非依赖性二级扫描的分辨率为17500或35000,进一步优选为17500。
优选地,所述数据非依赖性二级扫描的最大离子注入时间为35~80ms,例如36ms、38ms、40ms、43ms、45ms、47ms、50ms、53ms、55ms、57ms、60ms、63ms、65ms、67ms、70ms、73ms、75ms、77ms或79ms,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值,进一步优选为50ms。
优选地,步骤(1)所述待测样品选自脂质组学样品、多肽组学样品、蛋白质组学样品、多糖组学样品或寡糖组学样品中的任意一种,进一步优选为脂质组学样品。
优选地,所述脂质组学样品为血清脂质组学样品。
优选地,所述血清脂质组学样品的制备方法为:将血清与异丙醇混合,漩涡震荡后静置使蛋白沉淀,然后离心并取上清液冻干;冻干后的样品用溶剂复溶,得到所述血清脂质组学样品。
优选地,所述血清的体积为100μl。
优选地,所述异丙醇为-20℃预冷后的异丙醇。
优选地,所述溶剂为异丙醇、甲醇和水的混合溶液。
优选地,所述混合溶液中异丙醇、甲醇和水的体积比为50:35:15。
优选地,所述溶剂的体积为100μl。
优选地,步骤(2)所述处理包括去卷积、谱图匹配和假阳性率卡值。
优选地,所述去卷积、谱图匹配和假阳性率卡值通过软件ms-dial进行。
本发明提供的质谱检测方法中,步骤(2)所述处理过程通过软件ms-dial进行。为了兼容不同品牌的质谱设备所采集的数据可能存在的格式差异,步骤(2)所述处理还包括格式转换过程,格式转换可以通过软件ms-dial的配套软件abfconverter进行。所述通过软件ms-dial进行去卷积、谱图匹配和假阳性率卡值的具体方法参考现有技术进行,例如参考hiroshitsugawa,etal.ms-dial:dataindependentms/msdeconvolutionforcomprehensivemetabolomeanalysis.naturemethods,2015,12(6),523-526。
优选地,所述质谱检测方法具体包括以下步骤:
(1)将血清脂质组学样品用高效液相色谱-四极杆-静电场轨道阱高分辨质谱系统进行数据非依赖性质谱采集,得到质谱数据;
其中,血清脂质组学样品的制备方法为:将100μl血清与300μl预冷的异丙醇混合,漩涡震荡后静置使蛋白沉淀;离心分离,取上清液冻干;将冻干后的样品用100μl异丙醇、甲醇和水的体积比为50:35:15的混合溶液复溶,得到待测的血清脂质组学样品;
高效液相色谱的色谱条件为:色谱柱为c18色谱柱,流速为0.2~0.4ml/min,进样量为5~20μl,a流动相为包含0.1%甲酸和10mm甲酸铵的乙腈-水溶液,b流动相为包含0.1%甲酸和10mm甲酸铵的异丙醇-乙腈溶液;分析梯度为:0~2min,30%b流动相;2~4min,30~43%b流动相;4~4.5min,43~50%b流动相;4.5~17min,50~70%b流动相;17~23min,70~98%b流动相;23~26min,98%b流动相;26~26.1min,98~30%b流动相;26.1~30min,30%b流动相;
四极杆-静电场轨道阱高分辨质谱系统的质谱条件为:离子源为电喷雾离子源,扫描模式为正离子模式,喷雾电压为2.8~4.0kv,离子传输管温度为280~350℃;循环扫描模式为1个一级全扫描和7~20个数据非依赖性二级扫描;一级全扫描的扫描范围为m/z300~1000,分辨率为35000或70000;数据非依赖性二级扫描的隔离窗口宽度为35~100da,分辨率为17500或35000,最大离子注入时间为35~80ms;数据非依赖性二级扫描的碎裂模式为源内碰撞诱导解离和高能碰撞解离的混合碎裂,源内碰撞诱导解离的电压为10~20ev,高能碰撞解离为多阶碰撞解离,梯度碎裂能量依次为10%、12%、15%;
(2)对步骤(1)得到的质谱数据进行处理,通过软件ms-dial进行去卷积、谱图匹配和假阳性率卡值,得到检测结果。
相对于现有技术,本发明具有以下有益效果:
本发明通过数据非依赖性质谱采集方式对生物分子进行质谱检测,在二级扫描中采用源内碰撞诱导解离和高能碰撞解离的混合碎裂模式对母离子进行碎裂,显著提高了二次碎裂效率,得到更为丰富的碎片信息和更完善的二级谱,从而提高质谱的检测灵敏度和准确性。本发明提供的质谱检测方法用于生物分子检测、尤其是脂质组学分析时,能够将样品的单次鉴定量在现有技术基础上再提高15%以上,显著提高了生物分子、尤其是脂质的鉴定量,具有高灵敏度、高准确性以及高通量的特点。
附图说明
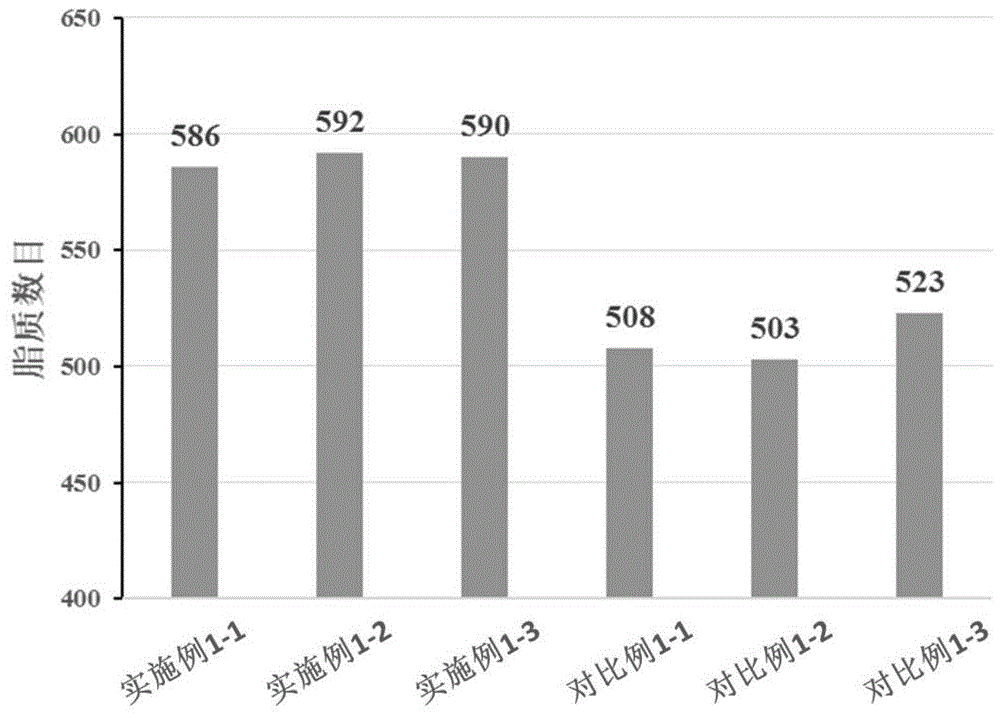
图1为本发明实施例1和对比例1中质谱检测结果的对比图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
本发明实施例1及对比例1中所用的仪器包括qexactive高分辨质谱仪(thermofisherscientific)、u3000超高效液相色谱(thermofisherscientific);色谱柱为watersacquitybehc18色谱柱;所用乙腈、异丙醇、甲酸、甲酸铵均购自上海安谱有限公司。
实施例1
本实施例提供一种脂质组学分析的质谱检测方法,具体包括以下步骤:
(1)样品制备:取100ul的血清于1.5ml的离心管中,加入300ul的-20℃预冷的异丙醇,旋涡振荡1min;混合液室温放置10min,再置于-20℃冰箱中过夜,加强蛋白沉淀;4℃条件下离心20min,取上层清液,冻干。冻干后的样品用100ul复溶液(异丙醇、甲醇、水的体积比为50:35:15)复溶,得到待测的血清脂质组学分析样品。
(2)质谱检测:采用高效液相色谱-四极杆-静电场轨道阱高分辨质谱系统对步骤(1)得到的血清脂质组学分析样品进行质谱检测,得到质谱数据;
色谱条件:色谱柱为watersacquitybehc18色谱柱(长度100mm,内径2.1mm,颗粒直径1.7μm),进样量为10μl,流速为0.3ml/min;a流动相为包含0.1%甲酸和10mm甲酸铵的乙腈-水溶液(乙腈和水的体积比为6:4),b流动相为包含0.1%甲酸和10mm甲酸铵的异丙醇-乙腈溶液(异丙醇和乙腈的体积比为9:1);分析梯度为:0~2min,30%b流动相;2~4min,30~43%b流动相;4~4.5min,43~50%b流动相;4.5~17min,50~70%b流动相;17~23min,70~98%b流动相;23~26min,98%b流动相;26~26.1min,98~30%b流动相;26.1~30min,30%b流动相。
质谱条件:离子源为电喷雾离子源,扫描模式为正离子模式,喷雾电压为3.5kv,离子传输管温度为320℃;循环模式为1个一级全扫描和10个数据非依赖性二级扫描,一级全扫描的扫描范围为m/z300~1000,分辨率为35000;数据非依赖性二级扫描的隔离窗口宽度为70da,分辨率为17500,最大离子注入时间为50ms;数据非依赖性二级扫描的碎裂模式为源内碰撞诱导解离和高能碰撞解离的混合碎裂,源内碰撞诱导解离的电压为12ev,高能碰撞解离为多阶碰撞解离,梯度碎裂能量依次为10%、12%、15%。
(3)将步骤(2)得到的质谱数据使用ms-dial(ver.3.66)进行去卷积、谱图匹配和假阳性率卡值,得到样品中的脂质种类和各类脂质分子相应的鉴定量。
为了验证实施例1所述质谱检测方法的重现性,将上述检测步骤重复进行3次,得到3组质谱数据。
对比例1
本对比例与实施例1的区别在于,步骤(2)中的质谱条件中,数据非依赖性二级扫描的碎裂模式为单一的高能碰撞解离,高能碰撞解离为多阶碰撞解离,梯度碎裂能量依次为10%、12%、15%。
将对比例1所述检测步骤重复3次,得到3组质谱数据。
将实施例1和对比例1中分别进行的3次质谱检测得到的脂质分子鉴定量进行数据统计,以每次质谱检测得到的脂质数目为纵轴进行绘图,得到的质谱检测结果的对比图如图1所示。从图1中可以得到,实施例1中的混合碎裂模式下3次质谱检测得到的脂质数目分别为586、592、590,即平均每次能鉴定到589±3个脂质分子;而对比例1中的单一高能碰撞解离模式下3次质谱检测得到的脂质数目分别为508、503、523,即平均每次能鉴定到511±10个脂质分子;因此,采用本发明提供的混合碎裂模式下dia质谱检测方法可以将脂质分子的单次鉴定量提高15%。
将实施例1和对比例1中分别进行的3次质谱检测所鉴定到的脂质分子的种类及数目进行整合比较,得到的整合结果如表1所示。
表1
从表1可知,实施例1与对比例1质谱检测得到的脂质种类基本一致,但实施例1中得到的脂质鉴定量明显高于对比例1,尤其是磷脂酰胆碱、甘油三酯、鞘磷脂及神经酰胺的鉴定量明显多于对比例1得到的鉴定量,说明本发明所述质谱检测方法中的混合碎裂模式在鉴定上述四种脂质分子时表现出比对比例1所述单一碎裂模式更为显著的优势,特别是在分析甘油三酯类化合物时,其鉴定量增加了26%,证明本发明提供的质谱检测方法具有高灵敏度和高准确性。
申请人声明,本发明通过上述实施例来说明本发明提供的生物分子的质谱检测方法,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!