ATAD2蛋白作为标志物在判断卵巢癌增殖状态中的应用的制作方法
本发明属于生物医学领域,具体涉及atad2蛋白作为标志物在判断卵巢癌增殖状态中的应用。
背景技术:
卵巢癌是女性生殖系统的肿瘤,占女性所有恶性肿瘤发病率的2.5%,但由于存活率低,其死亡率占女性癌症死亡的5%。据估计,2018年美国有22,240例新确诊的卵巢癌病例和14,070例卵巢癌死亡病例。尽管手术技术和辅助疗法取得了一定进步,但卵巢癌的生存率几乎没有改变。因此,迫切需要发现更精确的致癌机制,并开发新的有效治疗方法,以提高卵巢癌患者的生存情况。
对于细胞增殖能力强、肿瘤生长速度快的卵巢癌患者,其肿瘤恶性程度往往更高,病程进展更快,常常导致病人失去手术机会,生存时间更短。因此,标记处于增殖状态的卵巢癌细胞,判断卵巢癌的生长情况,有利于更好的控制肿瘤进展。目前,ca125(即抗卵巢癌蛋白125)、he4(即人附睾分泌蛋白)、ca199(粘蛋白型糖类蛋白质肿瘤标记物)等血清标志物主要用于辅助筛查诊断卵巢癌,但并不能指示卵巢癌细胞的恶性程度和细胞增殖能力。
atad2蛋白(atpasefamilyaaadomain-containingprotein2)是atpase家族的成员之一,是一个新发现的致癌蛋白。atad2蛋白包含两个保守域:一个负责组蛋白结合的bromodomain结构域和一个在调节atp酶活性和蛋白多聚中起重要作用的atpase结构域。编码atad2蛋白的基因(即atad2基因)定位于8q24.13号染色体。
技术实现要素:
本发明的目的为标记处于增殖状态的卵巢癌细胞。
本发明首先保护用于检测atad2蛋白表达量和/或活性的物质在制备产品中的应用;所述产品的功能可为如下a1)至a3)中的至少一种:a1)判断待测卵巢癌细胞增殖状态;a2)预测卵巢癌的肿瘤进展;a3)预测卵巢癌患者预后。
本发明还保护“用于检测atad2蛋白表达量和/或活性的物质”和装置在制备产品中的应用;所述产品的功能可为如下a1)至a3)中的至少一种:a1)判断待测卵巢癌细胞增殖状态;a2)预测卵巢癌的肿瘤进展;a3)预测卵巢癌患者预后。所述装置可为装置甲和/或装置乙和/或装置丙。
所述装置甲可包括数据输入设备1、数据记录模块1、数据比较模块1-1和结论输出模块1-1;
数据输入设备1用于输入atad2蛋白的表达量和/或活性数值;
数据记录模块1用于存储atad2蛋白的表达量和/或活性数值;
数据比较模块1-1用于将待测卵巢癌细胞中atad2蛋白的表达量和/或活性和对照卵巢细胞中atad2蛋白的表达量和/或活性进行比较;
结论输出模块1-1用于显示结论,即如果待测卵巢癌细胞中atad2蛋白的表达量和/或活性高于对照卵巢细胞中atad2蛋白的表达量和/或活性,则结论输出模块1-1显示待测卵巢癌细胞为增殖状态;如果待测卵巢癌细胞中atad2蛋白的表达量和/或活性低于对照卵巢细胞中atad2蛋白的表达量和/或活性,则结论输出模块1-1显示待测卵巢癌细胞不为增殖状态;
所述对照卵巢细胞可为健康人卵巢细胞或卵巢癌患者的癌旁正常卵巢细胞。
所述装置甲具体可由数据输入设备1、数据记录模块1、数据比较模块1-1和结论输出模块1-1组成。
所述装置乙可包括数据输入设备1、数据记录模块1、数据比较模块1-2和结论输出模块1-2;
数据比较模块1-2用于将若干卵巢癌患者的卵巢癌组织中atad2蛋白的表达量和/或活性进行比较;
结论输出模块1-2用于显示结论,即卵巢癌组织中atad2蛋白的表达量和/或活性越高,则卵巢癌的分期和/或分级越高;
所述装置乙具体可由数据输入设备1、数据记录模块1、数据比较模块1-2和结论输出模块1-2组成。
所述装置丙可包括数据输入设备1、数据记录模块1、数据比较模块1-2和结论输出模块1-3;
结论输出模块1-3用于显示结论,即卵巢癌组织中atad2蛋白的表达量和/或活性越高,则卵巢癌患者的预后越差。
所述装置丙具体可由数据输入设备1、数据记录模块1、数据比较模块1-2和结论输出模块1-3组成。
本发明还保护用于检测atad2基因表达量的物质在制备产品中的应用;所述产品的功能可为如下a1)至a3)中的至少一种:a1)判断待测卵巢癌细胞增殖状态;a2)预测卵巢癌的肿瘤进展;a3)预测卵巢癌患者预后。
本发明还保护“用于检测atad2基因表达量的物质”和装置在制备产品中的应用;所述产品的功能可为如下a1)至a3)中的至少一种:a1)判断待测卵巢癌细胞增殖状态;a2)预测卵巢癌的肿瘤进展;a3)预测卵巢癌患者预后。所述装置为装置1和/或装置2和/或装置3。
所述装置1可包括数据输入设备2、数据记录模块2、数据比较模块2-1和结论输出模块2-1;
数据输入设备2用于输入atad2基因的表达量数值;
数据记录模块2用于存储atad2基因的表达量数值;
数据比较模块2-1用于将待测卵巢癌细胞中atad2基因的表达量和对照卵巢细胞中atad2基因的表达量进行比较;
结论输出模块2-1用于显示结论,即如果待测卵巢癌细胞中atad2基因的表达量高于对照卵巢细胞中atad2基因的表达量,则结论输出模块2-1显示待测卵巢癌细胞为增殖状态;如果待测卵巢癌细胞中atad2基因的表达量低于对照卵巢细胞中atad2基因的表达量,则结论输出模块2-1显示待测卵巢癌细胞不为增殖状态;
所述对照卵巢细胞可为健康人卵巢细胞或卵巢癌患者的癌旁正常卵巢细胞。
所述装置1具体可由数据输入设备2、数据记录模块2、数据比较模块2-1和结论输出模块2-1组成。
所述装置2可包括数据输入设备2、数据记录模块2、数据比较模块2-2和结论输出模块2-2;
数据比较模块2-2用于将若干卵巢癌患者的卵巢癌组织中atad2基因的表达量进行比较;
结论输出模块2-2用于显示结论,即卵巢癌组织中atad2基因的表达量越高,则卵巢癌的分期和/或分级越高。
所述装置2具体可由数据输入设备2、数据记录模块2、数据比较模块2-2和结论输出模块2-2组成。
所述装置3可包括数据输入设备2、数据记录模块2、数据比较模块2-2和结论输出模块2-3;
结论输出模块2-3用于显示结论,即卵巢癌组织中atad2基因的表达量越高,则卵巢癌患者的预后越差。
所述装置3具体可由数据输入设备2、数据记录模块2、数据比较模块2-2和结论输出模块2-3组成。
本发明还保护一种试剂盒,其可包括用于检测atad2蛋白表达量和/或活性的物质,和/或,用于检测atad2基因表达量的物质;所述试剂盒具有如下a1)至a3)中的至少一种:a1)判断待测卵巢癌细胞增殖状态;a2)预测卵巢癌的肿瘤进展;a3)预测卵巢癌患者预后。
本发明还保护d1)-d14)中的至少一种。
d1)atad2蛋白作为标志物在制备判断待测卵巢癌细胞增殖状态的产品中的应用。
d2)atad2蛋白作为标志物在判断卵巢癌细胞增殖状态中的应用。
d3)atad2蛋白作为标志物在制备预测卵巢癌的肿瘤进展的产品中的应用。
d4)atad2蛋白作为标志物在预测卵巢癌的肿瘤进展中的应用。
d5)atad2蛋白作为标志物在制备预测卵巢癌患者预后的产品中的应用。
d6)atad2蛋白作为标志物在预测卵巢癌患者预后中的应用。
d7)atad2蛋白作为标志物在区分原发卵巢癌和胃癌转移卵巢癌中的应用。
d8)atad2基因作为标志物在制备判断待测卵巢癌细胞增殖状态的产品中的应用。
d9)atad2基因作为标志物在判断待测卵巢癌细胞增殖状态中的应用。
d10)atad2基因作为标志物在制备预测卵巢癌的肿瘤进展的产品中的应用。
d11)atad2基因作为标志物在预测卵巢癌的肿瘤进展中的应用。
d12)atad2基因作为标志物在制备预测卵巢癌患者预后的产品中的应用。
d13)atad2基因作为标志物在预测卵巢癌患者预后中的应用。
d14)atad2基因作为标志物在区分原发卵巢癌和胃癌转移卵巢癌中的应用。
本发明还保护一种判断待测卵巢癌细胞增殖状态的方法,可为方法q1)或方法q2)。
所述方法q1)可包括如下步骤:
(q1-1)检测待测卵巢癌细胞中的atad2蛋白的表达量和/或活性;
(q1-2)根据atad2蛋白的表达量和/或活性判断待测卵巢癌细胞增殖状态。
上述方法q1)中,根据atad2蛋白的表达量和/或活性判断待测卵巢癌细胞增殖状态的原则可为:atad2蛋白的表达量和/或活性越高,则待测卵巢癌细胞增殖越快。
所述q2)包括如下步骤:
(q2-1)检测待测卵巢癌细胞中的atad2基因的表达量;
(q2-2)根据atad2基因的表达量判断待测卵巢癌细胞增殖状态。
上述方法q2)中,根据atad2基因的表达量判断待测卵巢癌细胞增殖状态的原则可为:atad2基因的表达量越高,则待测卵巢癌细胞增殖越快。
本发明还保护一种预测卵巢癌的肿瘤进展的方法,可为方法r1)或方法r2)。
所述方法r1)可包括如下步骤:
(r1-1)检测待测卵巢癌组织中的atad2蛋白的表达量和/或活性;
(r1-2)根据atad2蛋白的表达量和/或活性预测卵巢癌的肿瘤进展。
上述方法r1)中,根据atad2蛋白的表达量和/或活性预测卵巢癌的肿瘤进展的原则可为:atad2蛋白的表达量和/或活性越高,则卵巢癌的肿瘤进展越快。
所述方法r2)可包括如下步骤:
(r2-1)检测待测卵巢癌组织中的atad2基因的表达量;
(r2-2)根据atad2基因的表达量预测卵巢癌的肿瘤进展。
上述方法r2)中,根据atad2基因的表达量预测卵巢癌的肿瘤进展的原则可为:atad2基因的表达量越高,则卵巢癌的肿瘤进展越快。
本发明还保护一种预测卵巢癌患者预后的方法,可为方法t1)或方法t2)。
所述方法t1)可包括如下步骤:
(t1-1)检测待测卵巢癌组织中的atad2蛋白的表达量和/或活性;
(t1-2)根据atad2蛋白的表达量和/或活性预测卵巢癌患者的预后。
上述方法t1)中,根据atad2蛋白的表达量和/或活性预测卵巢癌患者的预后的原则可为:atad2蛋白的表达量和/或活性越高,则卵巢癌患者的预后越差。
所述方法t2)可包括如下步骤:
(t2-1)检测待测卵巢癌组织中的atad2基因的表达量;
(t2-2)根据atad2基因的表达量预测卵巢癌患者的预后。
上述方法t2)中,根据atad2基因的表达量预测卵巢癌患者的预后的原则可为:atad2基因的表达量越高,则卵巢癌患者的预后越差。
上述任一所述atad2蛋白的表达量和/或活性可根据免疫组织化学染色方法检测获得。所述免疫组织化学染色方法检测具体可为采用ihc标准方法对卵巢癌组织芯片进行检测,以评估atad2蛋白在卵巢癌组织中的表达。免疫组化后进行染色强度评分为:0(阴性)、1(弱)、2(中)、3(强);atad2阳性细胞的百分率(即atad2阳性率)按四类进行评分:0分(0-10%),1分(>10-25%),2分(>25-50%),3分(>50-75%),4分(>75-100%);atad2蛋白的免疫反应评分(即atad2ihc评分)是由染色强度和百分比分数相乘决定的,最小值为0,最大值为12。
上述任一所述atad2蛋白的表达量还可采用westernblot检测获得。
上述任一所述atad2蛋白的表达量还可通过流式细胞术检测获得。
上述任一所述atad2蛋白的表达量为atad2蛋白参比内参蛋白的相对表达量。
上述任一所述atad2基因的表达量为atad2基因参比内参基因的相对表达量。
上述任一所述预后表现为总体生存率和/或无病生存率和/或无进展生存率。
实验证明,与健康人卵巢细胞或卵巢癌患者的癌旁正常卵巢细胞相比,卵巢癌细胞中atad2蛋白的表达量和/或活性显著增加;卵巢癌细胞中atad2蛋白的表达量和/或活性越高,则卵巢癌的分期和/或分级越高,卵巢癌患者的预后也越差。本发明具有重要的应用价值。
附图说明
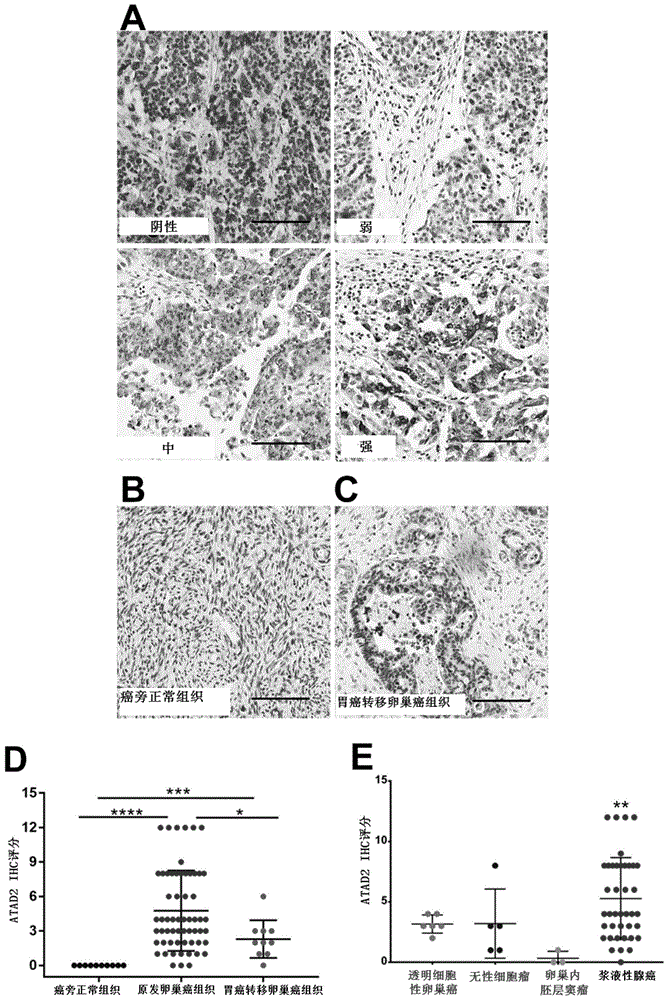
图1为与癌旁正常组织和胃癌转移卵巢癌组织相比,原发卵巢癌组织中atad2蛋白的水平显著提高。a为原发卵巢癌组织中atad2蛋白的表达情况。b为癌旁正常组织中atad2蛋白的表达情况。c为胃癌转移卵巢癌组织中atad2蛋白的表达情况。d为60个原发卵巢癌组织、10个胃癌转移卵巢癌组织和10个癌旁正常组织中atad2ihc评分的比较结果。e为不同类型原发卵巢癌组织中atad2ihc评分的比较结果。bar=100μm,*表示p<0.05,**表示p<0.01,***表示p<0.001,****表示p<0.0001。
图2为atad2mrna在卵巢癌组织中表达上调。a为atad2mrna在csiovdb数据库中正常卵巢表面上皮组织、正常输卵管组织、正常间质组织、肿瘤间质组织及原发卵巢癌组织中的表达情况。b为4个geo数据库中atad2mrna表达谱芯片数据分析结果,数据以中位数±四分位数范围表示。
图3为atad2基因拷贝数的变异导致卵巢癌基因表达上调。a为tcga数据库中卵巢癌组织、正常卵巢组织和正常血液标本的atad2基因拷贝数变化分析。b为tcga数据库中atad2mrna水平与线性化的拷贝数数值的相关性分析。c为ccle数据库中卵巢癌细胞系atad2mrna水平与log2拷贝数值的相关性分析。d为35%卵巢癌组织存在高度atad2拷贝数扩增。e为21%卵巢癌细胞系存在高度atad2拷贝数扩增。f为tcga数据库中所有癌症类型atad2基因的基因组改变分析。
图4为atad2上调与卵巢癌患者的晚期肿瘤进展和不良预后相关。atad2表达按figo分期和figo分级进行分类,在csiovdb数据库的卵巢癌患者群体中,atad2过表达与肿瘤figo分期(a)和figo分级(b)密切相关。atad2与卵巢癌分期(c)或分级(d)的相关性在gse9891卵巢癌队列中得到进一步验证。(e)kaplan-meier生存分析显示,atad2水平越高,os预后越差。(f)kaplan-meier生存分析显示,atad2水平越高,dfs预后越差。(g)meta分析图显示atad2对多个geo数据库卵巢癌患者总体生存率的不良影响。(h)meta分析图显示,atad2在多个geo数据库卵巢癌患者的无进展生存率普遍存在不良影响。
图5为大数据分析表明atad2表达量与卵巢癌增殖指数呈显著正相关。a为两个群体中atad2共表达基因高度重叠的venn图。b为对david中重叠的260个atad2共表达基因进行go分析。c为atad2与增殖标记物呈高度正相关的相关热点图。d为atad2与两个卵巢癌组的增殖指数高度相关。
图6为atad2与增殖标志物的相关性分析。
图7为atad2特异性标记临床卵巢癌样品中处于增殖状态的卵巢癌细胞。
图8为atad2通过靶向mapk通路促进卵巢癌增殖。a为atad2缺乏对细胞株skov3或细胞株a2780的细胞增殖能力影响的rtca分析;****表示p<0.0001。b为atad2缺失对克隆形成能力的影响。c为菌落形成实验的统计分析;bar=均值±sd,*p<0.05,**p<0.01。d为westernblot检测atad2缺乏对细胞株skov3和细胞株a2780的mapk通路激活的影响。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中,除另有说明外,所有统计分析均采用graphpadprism7.0或spssstatistics22进行。非参数数据采用mann-whitneyu检验,参数数据采用student’st检验。所有分析均认为p值小于0.05为有统计学意义。
人卵巢癌细胞株skov3和人卵巢癌细胞株a2780均由国家实验细胞资源共享服务平台(北京,中国)提供。在下文中,人卵巢癌细胞株skov3简称为细胞株skov3,人卵巢癌细胞株a2780简称为细胞株a2780。
培养细胞株skov3或细胞株a2780的培养基为:含10%(v/v)胎牛血清的dmem培养基(hyclone;gehealthcarelifesciences,logan,ut,usa)。
培养细胞株skov3或细胞株a2780的培养条件为:37℃,5%co2。
实施例1、atad2蛋白在卵巢癌组织(原发卵巢癌组织或胃癌转移卵巢癌组织)中的表达水平明显上调
卵巢癌组织芯片(alenabio公司(中国西安))包含60个原发卵巢癌组织(即原发灶)、10个胃癌转移卵巢癌组织(即胃转移灶)和10个癌旁正常组织。
1、采用ihc标准方法对卵巢癌组织芯片进行检测,以评估atad2蛋白在卵巢癌组织中的表达。具体步骤依次如下:
(1)脱蜡、水化
将石蜡切片置于60℃的烤箱中,烘烤60min,切片取出后,依次放入二甲苯i、二甲苯ii、二甲苯iii中脱蜡三次,每次10min。然后依次置入无水乙醇、95%乙醇水溶液、90%乙醇水溶液、80%乙醇水溶液和70%乙醇水溶液中,每次2min,最后使用自来水冲洗2次。
(2)抗原修复
将切片置于耐高温高压的抗原修复盒中,向盒内加入200ml柠檬酸盐修复液(ph=6.0)(中杉金桥,北京),先用微波炉高火加热45s,然后转中低火15min,室温自然冷却后用蒸馏水冲洗,最后用pbs缓冲液(索莱宝,北京)洗涤3次,每次5min。
(3)阻断内源性过氧化物酶
擦干切片组织周围的pbs缓冲液,然后滴加3%h2o2溶液(中杉金桥,北京)以使3%h2o2溶液覆盖整张切片,室温孵育30min,用pbs缓冲液洗涤3次,每次5min。
(4)孵育一抗
向切片滴加atad2一抗溶液(1:500,sigma-aldrich,merckkgaa,darmstadt,germany)以使atad2一抗溶液覆盖切片组织,然后将切片置于湿盒内,4℃冰箱孵育过夜。
(5)孵育二抗
将切片于室温放置30min复温;去除一抗后,用pbs缓冲液洗涤3次,每次5min;滴加山羊抗兔二抗(中杉金桥,北京),置于湿盒内室温孵育30min后,pbs缓冲液洗涤3次,每次5min。
(6)显色
将dab显色剂(1ml显色底物和1ml显色浓缩液混合而成,显色底物和显色浓缩液均为北京中杉金桥的产品)滴加在切片上显色,在普通光学显微镜下观察,适时终止反应,将切片置于pbs缓冲液中。
(7)复染
将切片用苏木素染色60s后自来水充分冲洗,然后在分化液(sigma-aldrich,美国)中上下涮洗2次后自来水冲洗,最后在返蓝液(sigma-aldrich,美国)中染色20s后自来水冲洗。
(8)脱水和封片
将切片依次用10%乙醇水溶液、30%乙醇水溶液、50%乙醇水溶液、70%乙醇水溶液、90%乙醇水溶液和无水乙醇脱水,每次2min,然后置于二甲苯中,放置10min后使用中性树胶(中杉金桥,北京)封片,显微镜下拍照。
(9)染色强度评分
免疫组化后进行染色强度评分为:0(阴性)、1(弱)、2(中)、3(强);atad2阳性细胞的百分率(即atad2阳性率)按四类进行评分:0分(0-10%),1分(>10-25%),2分(>25-50%),3分(>50-75%),4分(>75-100%);atad2蛋白的免疫反应评分(即atad2ihc评分)是由染色强度和百分比分数相乘决定的,最小值为0,最大值为12。
实验结果见图1。结果表明,原发卵巢癌组织中atad2阳性率高达83.3%(50/60),其中低表达(atad2ihc评分为0-1分,28/60)阳性率为46.67%,中表达(atad2ihc评分为5-8分,15/60)阳性率为25.00%,高表达(atad2ihc评分为9-12分,7/60)阳性率为11.67%(见图1中a)。与此相反,未检测到癌旁正常组织(0/10,0%)有atad2蛋白的表达(见图1中b)。来自其它原发恶性肿瘤的转移性卵巢癌占全部卵巢恶性肿瘤的5-30%,其中胃癌转移卵巢癌是最常见的转移性卵巢癌之一。在此,本发明的发明人发现atad2蛋白在70%(7/10)的胃癌转移卵巢癌组织(见图1中c)中也是阳性表达,包括60%(6/10)低表达(atad2ihc评分为0-1分)和10%(1/10)中表达(atad2ihc评分为5-8分)。
比较60个原发卵巢癌组织(包括3个卵巢内胚层窦瘤、5个无性细胞瘤、6个透明细胞性卵巢癌和40个浆液性腺癌)、10个胃癌转移卵巢癌组织和10个癌旁正常组织中atad2ihc评分。结果如下:原发卵巢癌组织中atad2蛋白的水平显著高于癌旁正常组织(p<0.0001);胃癌转移卵巢癌组织中atad2蛋白的水平显著高于癌旁正常组织(p<0.0001)且显著低于原发卵巢癌组织(p<0.05)(见图1中d);原发卵巢癌组织的各个亚型中,atad2蛋白在浆液性腺癌中表达量相对较高(见图1中e)。
上述结果表明,atad2蛋白在卵巢癌组织(原发卵巢癌组织或胃癌转移卵巢癌组织)中的表达水平明显上调。atad2蛋白可能用作诊断标记来区分原发卵巢癌和胃癌转移卵巢癌。
实施例2、利用公共数据库数据验证atad2蛋白在卵巢癌组织中上调表达
1、为了验证atad2蛋白在卵巢癌组织中的上调表达,本发明的发明人评估了csiovdb数据库(tantz,yangh,yej,etal.csiovdb:amicroarraygeneexpressiondatabaseofepithelialovariancancersubtype.oncotarget.2015.6(41):43843-52.)中卵巢组织(包括卵巢癌组织和正常卵巢组织)的atad2mrna的表达水平。csiovdb数据库包括3431例卵巢癌组织和正常卵巢组织的转录组数据。
实验结果见图2中a。
2、为了验证atad2mrna在卵巢癌组织中的表达是否高于正常水平,本发明的发明人使用geo2r在线工具(网址为:https://www.ncbi.nlm.nih.gov/geo/geo2r/),进一步分析了atad2在其它四个独立的geoprofile(gse12470、gse14407、gse18520和gse26712)中卵巢组织(包括卵巢癌组织和正常卵巢组织)的atad2mrna的表达水平。
实验结果见图2中b-e。
上述结果表明,卵巢癌组织中atad2mrna水平显著高于正常卵巢组织。由此可见,atad2蛋白、atad2mrna或atad2基因可以作为诊断卵巢癌的潜在标志物。
实施例3、atad2基因拷贝数的变异导致atad2基因表达上调
1、使用gistic2.0为tcga数据集确定的假定的拷贝数调用,用于拷贝数变化(cnv)分析(mermelch,schumacherse,hillb,meyersonml,beroukhimr,getzg.gistic2.0facilitatessensitiveandconfidentlocalizationofthetargetsoffocalsomaticcopy-numberalterationinhumancancers.genomebiol.2011.12(4):r41.)。拷贝数值:-2=纯合缺失;-1=半合缺失;0=中性/无变化;1=获得;2=扩增。
2、采用oncomine分析(rhodesdr,yuj,shankerk,etal.oncomine:acancermicroarraydatabaseandintegrateddata-miningplatform.neoplasia.2004.6(1):1-6.)对tcga数据集中607例卵巢癌组织、130例正常卵巢组织和431对正常血液标本的拷贝数进行比较。
实验结果见图3中a。结果表明,卵巢癌组织中atad2基因的拷贝数明显高于正常卵巢组织和正常血液标本(p=8.19e-104)。
3、为了评价拷贝数变异在卵巢癌肿瘤发生过程中对atad2基因上调的作用,本发明的发明人使用cbioportal癌症基因组学(http://www.cbioportal.org/)在线工具(gaoj,aksoyba,dogrusozu,etal.integrativeanalysisofcomplexcancergenomicsandclinicalprofilesusingthecbioportal.scisignal.2013.6(269):pl1.)分析tcga数据库和ccle数据库中atad2mrna的表达水平与拷贝数值的相关性。
结果表明,tcga数据库中高达74%(429/579)的卵巢癌组织存在atad2拷贝数增加(高度扩增+低水平上调),并且atad2mrna水平与其线性拷贝数值高度相关(见图3中b);ccle数据库中64%(30/47)的卵巢癌细胞株也发生了atad2拷贝数增加,并且同样验证了atad2mrna与拷贝数值的高相关性(见图3中c)。由此可见,拷贝数增加是卵巢癌组织中atad2过表达的主要原因。
进一步分析发现,34%卵巢癌组织(见图3中d)和21%卵巢癌细胞系(见图3中e)存在高度atad2拷贝数扩增。此外,tcga数据集中所有癌症类型的泛癌基因组改变分析显示,atad2扩增的在卵巢癌中发生频率最高(见图3中f,横坐标表示tcga中的不同肿瘤类型,ovarian为卵巢癌,esophagus为食管癌,breast为乳腺癌,uterinecs为子宫癌肉瘤,uvealmelanoma为葡萄膜黑素瘤,liver为肝癌,stomach为胃癌,stomach/esophageal为胃/食管癌,head&neck为头颈肿瘤,bladder为膀胱癌,pancreas为胰腺癌,nsclc为非小细胞肺癌,uterine为子宫内膜癌,lungsqu为肺鳞癌,lungadeno为肺腺癌,melanoma为黑色素瘤,glioma为神经胶质瘤,prostate为前列腺癌,colorectal为结直肠癌,cholangiocarcinoma为胆管癌,sarcoma为肉瘤,cervical为宫颈癌,acc为肾上腺皮质癌,dlbc为弥漫性大b细胞淋巴瘤,testiculargermcell为睾丸生殖细胞癌,gbm为多形性成胶质细胞瘤,mesotherlioma为间皮瘤,thymoma为胸腺瘤,ccrcc为透明细胞肾癌,thyroid为甲状腺癌,pcpg为嗜铬细胞瘤和副神经节瘤,aml为急性髓性白血病,prcc为肾乳头状细胞癌),表明atad2扩增是卵巢癌基因组的特征性变异。
实施例4、atad2上调与卵巢癌患者的肿瘤进展和不良预后显著相关
总体生存率:没有包括任何限制条件,不论是否进展,只要患者没有死亡,都算总体生存率。
无病生存率:病人临床达到cr(完全缓解),在治疗结束后依然没有复发的概率。
无进展生存率:包括了完全缓解的患者在一定时间内不复发和部分缓解或疾病未恶化的患者在一定时间内疾病不进展,也就是说疾病不继续恶化的概率。
1、利用csiovdb数据库中卵巢癌样本的表达数据,分析atad2表达与卵巢癌figo分级或figo分期的关系,并在gse9811数据集(包含285例卵巢癌患者)进行进一步验证。
结果表明,atad2上调表达与肿瘤figo分级(见图4中a)和figo分期(见图4中b)的进展密切相关,具体的,g3期肿瘤中atad2表达量显著高于g1和g2期,而g2期又显著高于g1期,提示atad2表达量随着肿瘤分级的发展不断升高;同样atad2表达量也随着肿瘤分期的发展而不断升高。gse9811数据集进一步验证同样表明atad2表达与卵巢癌肿瘤分级和分期具有显著相关性,其表达量在高分级和分期卵巢癌组织中表达显著升高(见图4中c和d)。
2、使用kaplanmeierplotter在线工具(gyorffyb,lánczkya,szállásiz.implementinganonlinetoolforgenome-widevalidationofsurvival-associatedbiomarkersinovarian-cancerusingmicroarraydatafrom1287patients.endocrrelatcancer.2012.19(2):197-208.)分析atad2对卵巢癌患者的预后价值,该工具整合了1816例卵巢癌样本的基因表达、无病生存(dfs)和总体生存(os)数据。生存曲线采用kaplan-meier法计算,log-rank检验统计学意义。计算95%置信区间的危险度比(hr)。
结果表明,atad2表达量越高,卵巢癌患者总体生存率(os)越差(见图4中e,hr95%可信区间为1.8(1.46-2.22),logrankp=3.2e-8),同时无病生存率(dfs)也越差(见图4中f,hr95%可信区间为1.57(1.29-1.9),logrankp=6.8e-6)。atad2对卵巢癌患者总体生存率(见图4中g)和无进展生存率(图4中h)的不利影响在大多数分析的geo卵巢癌数据集中均得到了证实。
实施例5、atad2可以特异性标记处于增殖状态的卵巢癌细胞
为了阐明atad2在卵巢癌中的可能作用,本发明的发明人首先转向基因共表达网络分析寻找线索。基因共表达网络对于描述基因功能、识别一组以协调方式对环境或疾病条件作出反应的基因以及探索调控关系至关重要。
1、根据r值分别提取tcga和gse9891卵巢癌数据集中atad2正相关的前500个基因。交集分析共产生260个重叠基因(260;52.0%;见图5中a)。
2、对这260个重叠基因在david6.8数据库(https://david.ncifcrf.gov/)中进行go分析,具体使用david6.8在线工具(huangdaw,shermanbt,lempickira.systematicandintegrativeanalysisoflargegenelistsusingdavidbioinformaticsresources.natprotoc.2009.4(1):44-57.)。
结果表明(见图5中b),260个重叠基因显著富集于细胞增殖相关的生物学过程,如细胞分裂、细胞周期、细胞有丝分裂和dna复制等等。由此可见,atad2可能参与调节卵巢癌细胞增殖。
3、atad2共表达基因分析采用geo数据库tcga卵巢癌队列(n=307)和另一个大型卵巢癌队列(gse9891,n=285),利用r2:基因组分析可视化平台(http://r2.amc.nl)进行共表达数据挖掘分析,主要对两个数据库中atad2与经典增殖标记物mki67、pcna和mcm家族基因进行表达量相关性分析
实验结果见图5中c、图6(a、b、c和d为tcga卵巢癌队列(n=307),e、f、g和h为大型卵巢癌队列(gse9891,n=285))和表1。结果表明,atad2表达与经典标志物表达量高度正相关。
表1
上述结果同样在ccle数据集(见表2)中的47个卵巢癌细胞系中得到了证实。
表2
atad2与两个数据集中的细胞增殖指数高度正相关(见图5中d)。增殖指数为mki67、pcna和mcm2-10的表达值之和。
上述结果表明,atad2可以标记处于增殖状态的卵巢癌样本。
实施例6、atad2特异性标记临床卵巢癌样品中处于增殖状态的肿瘤细胞
为了更直接阐明atad2对于快速增殖状态中的卵巢癌细胞的特异性标记情况,本发明的发明人用针对atad2的特异性抗体和细胞增殖标志物ki-67对临床卵巢癌样品进行了多光谱免疫组化染色分析。具体步骤如下:采用opaltm4-colormanualihc试剂盒(perkinelmer,ma)检测atad2和ki67在卵巢癌组织切片中的共表达。切片首先在室温下与特异性atad2抗体(sigma-aldrich)孵育1h,然后与山羊抗兔igg孵育1h,最后用opal520荧光试剂(perkinelmer)标记。ki-67染色采用抗ki67抗体(zsgb-bio,北京,中国),并用opal690荧光团(perkinelmer)标记。最后,用dapi(perkinelmer)染色细胞核,抗褪色封片剂封片。使用inform软件(perkinelmer)对多光谱图像进行分析。
实验结果见图7(a为atad2低表达的卵巢癌组织中atad2和ki67共同表达,其中atad2-low为atad2低表达的肿瘤组织中atad2的表达,dapi为细胞核染料(指示细胞核),atad2为该组织中atad2表达情况的荧光显示,ki67为该组织中ki67表达情况的荧光显示,merge(左)为atad2和ki67表达的二者的重叠显示,merge(右)为atad2、ki67和dapi三者的重叠显示;b为atad2高表达的卵巢癌组织中atad2和ki67的共同表达,其中atad2-high为atad2高表达肿瘤组织中atad2的表达,dapi为细胞核染料(指示细胞核),atad2为该组织中atad2表达情况的荧光显示,ki67为该组织中ki67表达情况的荧光显示,merge(左)为atad2和ki67表达的二者的重叠显示,merge(右)为atad2、ki67和dapi三者的重叠显示)。结果表明,atad2高表达(atad2ihc评分为9-12分)的卵巢癌组织同样高表达ki-67,而且无论是atad2-低表达(atad2ihc评分为0-1分)还是atad2-高表达的卵巢癌组织,atad2都明确标记了ki67高表达的增殖细胞亚群。
上述结果表明,atad2是处于增殖状态的卵巢癌细胞的特异性标记物。
实施例7、crispr-cas9介导的atad2基因编辑可以显著抑制卵巢癌细胞株的增殖和克隆形成能力
为了研究atad2在卵巢癌细胞增殖中的作用,本发明的发明人使用crispr-cas9基因组编辑技术,分别特异性的敲除了细胞株skov3和细胞株a2780中的atad2基因;然后进行rtca分析细胞增殖情况和菌落形成实验,观察atad2敲除对卵巢癌细胞株体外增殖的影响。
一、敲除atad2基因的卵巢癌细胞株的获得
1、根据atad2基因的核苷酸序列,选定sgrna靶点序列1和sgrna靶点序列2。
sgrna靶点序列1为:5’-gaaacaactgataatcaaga-3’(序列表中序列1)。
sgrna靶点序列2为:5’-taggcagttggccagacagc-3’(序列表中序列2)。
2、合成包含sgrna靶点序列1的oligo-1f:5’-caccggaaacaactgataatcaaga-3’(序列表中序列3)和oligo-1r:3’-cctttgttgactattagttctcaaa-5’(序列表中序列4)。合成包含sgrna靶点序列2的引物oligo-2f:5’-caccgtaggcagttggccagacagc-3’(序列表中序列5)和oligo-2r:3’-catccgtcaaccggtctgtcgcaaa-5’(序列表中序列6)。oligo-1f、oligo-1r、oligo-2f和oligo-2r均为单链dna分子。
3、双链dna分子1和双链dna分子2的制备
(1)制备反应体系。反应体系为10μl,由1μloligo-1f水溶液(浓度为100μm)、1μloligo-1r水溶液(浓度为100μm)、1μl10×t4ligationbuffer(neb)、0.5μlt4pnk酶(neb)和6.5μl水组成。
(2)将步骤(1)制备的反应体系置于pcr仪,退火,得到双链dna分子1。
反应条件为:37℃30min;95℃5min,然后以5℃/min的速率梯度降温至25℃。
按照上述方法,将oligo-1f替换为oligo-2f,oligo-1r替换为oligo-2r,其它步骤均不变,得到双链dna分子2。
4、载体骨架的制备
(1)制备酶切体系。酶切体系为50μl,由5μl限制性内切酶bsmbi(neb)、5μglenticrisprv2质粒载体(addgeneplasmid,货号为#52961,其含有cas9蛋白的编码基因)、5μl10×nebbuffer(neb)和水组成。
(2)取步骤(1)制备的酶切体系,55℃反应20min。
(3)向完成步骤(2)的体系中加入6μlfastap(neb)和6μl10×apbuffer(neb)(目的为使质粒脱磷酸化),得到消化产物。
(4)将步骤(3)得到的消化产物进行10%(m/v)琼脂糖凝胶电泳,然后利用dna胶提取试剂盒(bioflux)回收约13kb的载体骨架。
5、重组质粒lenticrisprv2-sgrna1和重组质粒lenticrisprv2-sgrna2的构建
(1)将载体骨架和双链dna分子1用t4dna快速连接酶(neb)连接,得到重组质粒lenticrisprv2-sgrna1。
将重组质粒lenticrisprv2-sgrna1进行测序。测序结果表明,重组质粒lenticrisprv2-sgrna1为将序列1所示的dna分子插入lenticrisprv2质粒载体的限制性内切酶bsmbi的酶切位点,且保持lenticrisprv2质粒载体的其它序列不变得到的载体。
(2)将载体骨架和双链dna分子2用t4dna快速连接酶(neb)连接,得到重组质粒lenticrisprv2-sgrna2。
将重组质粒lenticrisprv2-sgrna2进行测序。测序结果表明,重组质粒lenticrisprv2-sgrna2为将序列2所示的dna分子插入lenticrisprv2质粒载体的限制性内切酶bsmbi的酶切位点,且保持lenticrisprv2质粒载体的其它序列不变得到的载体。
6、敲除atad2基因的卵巢癌细胞株的获得
(1)将125μlopti-mem(gibco)和7.5μllipofectaminetm3000(invitrogen)混匀,得到体系1;将125μlopti-mem(gibco)、1.25μg重组质粒lenticrisprv2-sgrna1、1.25μg重组质粒lenticrisprv2-sgrna2、1.88μg包装质粒pax2、0.63μg包装质粒pmd2g和5μlp3000tmreagent(invitrogen)混匀,得到体系2;将体系1和体系2混匀,转染hek293t细胞(atcc,crl-11268,usa)。
(2)取完成步骤(1)的hek293t细胞,37℃、5%co2培养48h,收集上清液;然后将上清液经0.45μm滤膜(machereynagel)过滤,得到crispr-atad2慢病毒溶液(简称crispr-atad2)。
(3)用crispr-atad2慢病毒溶液感染细胞密度为70%的卵巢癌细胞株(细胞株skov3或细胞株a2780),继续培养48h,向完全培养基内加入嘌呤霉素(gibco),使其终浓度为2μg/ml,至少筛选7天,直至细胞系稳定生长,获得敲除atad2基因的卵巢癌细胞株。
按照上述步骤,将重组质粒lenticrisprv2-sgrna2和重组质粒lenticrisprv2-sgrna1均替换为lenticrisprv2质粒载体,其它步骤均不变,得到转空载病毒溶液(简称crispr-nc)。用转空载病毒溶液感染卵巢癌细胞株,得到对照卵巢癌细胞株。
二、检测敲除atad2基因的卵巢癌细胞株中atad2的敲除情况
采用westernblot分析待测卵巢癌细胞株中atad2的敲除情况。westernblot的步骤依次如下:
1、采用ripa裂解缓冲液(solarbio,shanghai)提取待测卵巢癌细胞株(敲除atad2基因的细胞株skov3、敲除atad2基因的细胞株a2780、对照细胞株skov3或对照细胞株a2780)的全细胞蛋白,采用bca蛋白检测试剂盒(thermofischer,waltham,ma,usa)定量。
2、使用10%sds-page凝胶进行蛋白分离,蛋白质上样量(40μg/泳道);然后使用半干转方法(15v,2h)转移至pvdf膜(millipore,bedford,ma,usa)。
3、将pvdf膜用抗体atad2(sigma-aldrich)进行4℃孵育;二抗孵育后,用ecl试剂盒(applygentechnologiesinc.,peking,china)曝光检测。
实验结果见图8中d。结果表明,敲除atad2基因的细胞株skov3中atad2蛋白几乎全部敲除;敲除atad2基因的细胞株a2780中atad2蛋白敲除水平达3/4。对照细胞株skov3和对照细胞株a2780中atad2蛋白未敲除。
三、rtca分析细胞增殖情况
对待测卵巢癌细胞株(敲除atad2基因的细胞株skov3、敲除atad2基因的细胞株a2780、对照细胞株skov3或对照细胞株a2780)进行rtca,分析细胞增殖情况。具体方法如下:使用实时细胞分析仪系统(rtca)(xcelligence;aceabiosciences,sandiego,ca,usa)来监测待测卵巢癌细胞的实时增殖情况(liuj,liuz,liuq,etal.clec3bisdownregulatedandinhibitsproliferationinclearcellrenalcellcarcinoma.oncolrep.2018.40(4):2023-2035.)。该系统测量电阻抗变化,并以反映细胞增殖的细胞指数的形式给出结果。对于每个细胞株,每孔接种3000细胞。细胞指数每隔15min自动记录一次。所记录的曲线表示为细胞指数的平均值±标准误差。
分析结果见图8中a(p<0.0001,时间单位为小时)。结果表明,与对照细胞株skov3相比,敲除atad2基因的细胞株skov3的细胞增殖能力显著下降;与对照细胞株a2780相比,敲除atad2基因的细胞株a2780的细胞增殖能力显著下降。由此可见,atad2基因的缺失显著降低了细胞株skov3或细胞株a2780中细胞的增殖能力。
四、菌落形成实验
将待测卵巢癌细胞株(敲除atad2基因的细胞株skov3、敲除atad2基因的细胞株a2780、对照细胞株skov3或对照细胞株a2780)以500个细胞/孔的密度接种于6孔板中,培养14d后用0.5%结晶紫染色(sigma-aldrich)。只有含有50个以上细胞的细胞克隆被计数。计算相对克隆形成数量。相对克隆形成数量=敲除组细胞克隆数量/对照组细胞克隆数量。
实验结果见图8中b和c。结果表明,与对照细胞株skov3相比,敲除atad2基因的细胞株skov3的克隆形成能力显著降低;与对照细胞株a2780相比,敲除atad2基因的细胞株a2780的克隆形成能力显著降低。由此可见,atad2基因的缺失显著降低了细胞株skov3(p<0.01)和细胞株a2780(p<0.05)的克隆形成能力。
上述结果表明,atad2在维持卵巢癌细胞增殖过程中是不可或缺的。
实施例8、atad2缺失使jnk-mapk通路失活
为了解释atad2维持卵巢癌细胞增殖的机制,本发明的发明人进一步研究了atad2缺失对mapk通路的影响。
(1)采用ripa裂解缓冲液(solarbio,shanghai)提取待测卵巢癌细胞株(敲除atad2基因的细胞株skov3、敲除atad2基因的细胞株a2780、对照细胞株skov3或对照细胞株a2780)的全细胞蛋白,采用bca蛋白检测试剂盒(thermofischer,waltham,ma,usa)定量。
(2)使用10%sds-page凝胶进行蛋白分离,蛋白质上样量(40μg/泳道);然后使用半干转方法(15v,2h)转移至pvdf膜(millipore,bedford,ma,usa)。
(3)将pvdf膜用抗体atad2(sigma-aldrich)、jnk(cellsignalingtechnology,danvers,ma,usa)、p-jnk(cellsignalingtechnology)、erk(cellsignalingtechnology)、p-erk(cellsignalingtechnology)、p-38(cellsignalingtechnology)、p-p38(cellsignalingtechnology)或gapdh(cellsignalingtechnology)进行4℃孵育;二抗孵育后,用ecl试剂盒(applygentechnologiesinc.,peking,china)曝光检测。
检测结果见图8中d。结果表明,与对照细胞株skov3相比,敲除atad2基因的细胞株skov3的mapk子通路中,jnk、erk和p-38的磷酸化水平均显著降低;与对照细胞株a2780相比,敲除atad2基因的细胞株a2780的mapk子通路中,jnk、erk和p-38的磷酸化水平均显著降低。也就是说,atad2基因的缺失显著降低了mapk子通路中所有三个关键成员jnk、erk和p-38的磷酸化水平,其中jnk在卵巢癌细胞系中受影响最明显。
上述结果表明,atad2对卵巢癌细胞中mapk通路的激活是必不可少的,尤其是jnk-mapk通路的激活,从而为atad2在维持卵巢癌细胞增殖中的作用提供了可能的解释。
<110>首都医科大学附属北京朝阳医院
<120>atad2蛋白作为标志物在判断卵巢癌增殖状态中的应用
<160>6
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>artificialsequence
<400>1
gaaacaactgataatcaaga20
<210>2
<211>20
<212>dna
<213>artificialsequence
<400>2
taggcagttggccagacagc20
<210>3
<211>25
<212>dna
<213>artificialsequence
<400>3
caccggaaacaactgataatcaaga25
<210>4
<211>25
<212>dna
<213>artificialsequence
<400>4
cctttgttgactattagttctcaaa25
<210>5
<211>25
<212>dna
<213>artificialsequence
<400>5
caccgtaggcagttggccagacagc25
<210>6
<211>25
<212>dna
<213>artificialsequence
<400>6
catccgtcaaccggtctgtcgcaaa25
- 还没有人留言评论。精彩留言会获得点赞!