一种同时检测外泌体内蛋白和RNA、外泌体膜蛋白的方法与流程
本发明属于外泌体检测技术领域,具体涉及一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法。
背景技术:
外泌体(exosomes),是一种能被大多数细胞分泌的微小膜泡,直径大约30-150nm,具有脂质双层膜结构,能很好地保护其包被的物质。这种微小膜泡中含有宿主细胞来源的特异的蛋白、核酸和脂质,能作为信号分子传递给其他细胞,是细胞之间通讯的重要媒介,可使受体细胞发生多种生物学功能的改变。所有细胞均可产生外泌体,但不同细胞分泌的外泌体组份和含量不同,选择性地将特定的基因产物装入外泌体中,通过在不同细胞之间转移生物活性分子参与受体细胞的生物学功能调节。外泌体最有用的特性之一,其含量丰富,内含物来源特异、稳定,逐渐成为细胞生物学研究的热点。
外泌体作为液体活检的三大领域之一,其潜在的生物靶标众多,但能同时将微量核酸和蛋白,尤其是原位检测外泌体内含有的蛋白质作为靶标的检测系统却未见报道。
技术实现要素:
针对现有技术存在的问题,本发明的目的在于设计提供一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法的技术方案。
本发明通过以下技术方案实现:
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,所述rna包括mrna、mirna、lncrna和circrna,其特征在于包括以下步骤:
1)取沉淀法得到的粗制细胞外囊泡,在15~90v直流电场下,采用外泌体原位捕获芯片,直接捕获样品中的外泌体;
2)在步骤1)中捕获的外泌体膜上结合目标抗体,通过抗原和抗体结合,发出标记的a种荧光信号,检测相应的膜蛋白;
3)制备纳米颗粒,通过纳米颗粒包裹需检测靶标的rna分子信标和荧光单抗;
4)将步骤3)中得到的已包裹rna分子信标和荧光单抗的纳米颗粒与步骤2)的外泌体融合,rna分子信标和荧光单抗进入外泌体内,rna分子信标与相应的标靶基因结合,信标茎环结构打开,在激光激发下发出标记的b种荧光信号,检测相应的rna;抗原和抗体结合,在激光激发下发出标记的c种荧光信号,检测相应的蛋白;
5)全内反射荧光显微镜拍照成像,数据分析处理。
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,其特征在于所述步骤1)中的外泌体原位捕获芯片为:包被亲和素、生物素标记的外泌体特异性捕获抗体的原位捕获芯片。
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,其特征在于所述的亲和素、生物素标记的特异性捕获抗体为公认的外泌体膜上标志抗体cd63和cd9。
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,其特征在于所述步骤2)中所述目标抗体为能结合外泌体膜上抗原的特异性抗体。
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,其特征在于所述步骤3)中所述纳米颗粒通过以下步骤制得:
1)将dotma、dspe-peg-2000和胆固醇按3:1:4充分混匀后,超声5min,室温静置2小时,即可获得稳定的阳离子脂质体;
2)将适量分子信标和荧光单抗及上述阳离子脂质体在pbs中充分吹打混匀后,超声5min;
3)取步骤1)的混合溶液,快速注入至含适量pbs的ep管中,涡旋10s,超声5min,室温静置2小时,即可获得稳定的纳米颗粒。
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,其特征在于所述步骤3)中纳米颗粒中分子信标和荧光单抗的摩尔比1:2~1:5。
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,其特征在于所述步骤3)中rna分子信标为5’端茎和环与靶基因完全互补,3’端茎与5’端茎部分互补,5’端和3’端分别用荧光基团和淬灭基团修饰,环上部分碱基用锁核酸修饰。
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,其特征在于所述步骤3)中的荧光单抗为针对特定外泌体内靶蛋白的荧光素标记的单克隆抗体。
所述的一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法,其特征在于所述步骤4)中融合条件为异种电荷相吸和膜融合原理,在15~90v直流电场下,4~60℃条件下进行融合。
与现有技术相比,本发明具有以下有益效果:
1)本发明能够在同一技术平台上实现同时检测外泌体内蛋白和rna、外泌体膜蛋白(三位一体),从标本处理到检测、分析、报告出具仅需6小时,并可制造成生物产业通用的96孔、384孔等多种规格的外泌体原位捕获芯片,高效、经济、便捷。外泌体作为液体活检的三大领域之一,其潜在的生物靶标众多,但能同时将微量核酸和蛋白作为靶标的检测系统却未见报道。外泌体保护下的核酸(rna)和蛋白十分稳定,非常适合作为检测标靶,将这两种生物大分子有机结合起来,更能反映标本状态,进一步提高检测的特异性和敏感度。而现有的方法需要使用3种技术方能实现外泌体内蛋白和rna、外泌体膜蛋白的分类检测:检测外泌体蛋白通常采用免疫印迹(westernblot、简称wb),耗时费力,需要1-3天,且无法严格区分蛋白是在外泌体内还是膜上;检测外泌体膜蛋白通常采用流式细胞仪,需要使用特种磁珠,耗材和仪器都很昂贵;检测外泌体核酸常用荧光定量pcr技术,rna提取过程复杂而冗长,需要扩增,样本容易污染,结果不稳定。
2)本发明能够对从同一样品中分离纯化的外泌体,分别采用纳米颗粒分子信标和特异性荧光单抗实现对外泌体微量核酸和蛋白多靶标的同时检测,外泌体被捕获后与纳米颗粒发生膜融合形成脂膜复合体,融合后外泌体和纳米颗粒的内容物混合,特异性分子信标将与其靶标rna杂交,茎环结构打开,荧光与淬灭基团分离;与此同时外泌体原有的内蛋白和膜蛋白将发生重分布,但不影响其抗原性,当与特异性荧光单抗温浴后,二者将发生特异性结合,分子信标与荧光单抗在激光的激发下而发出各自特定荧光信号,使用全内反射荧光显微镜(totalinternalreflectionfluorescencemicroscope,简称tirfm)技术实现高分辨率显微成像,利用成像具有超微和对荧光信号超敏感的特性实现了对外泌体这种纳米级囊泡的直接成像及其靶标的半定量测定,通过对外泌体内和膜表面相关标靶蛋白分布的信号强度分析检测并判断样本差异。单孔单样品外泌体微量核酸和蛋白多靶标的同时检测,多维度分析判断,大大提高了标本检测的准确性。与现有的高通量测序ngs及定量pcr等常规手段相比,不仅降低了单样本多靶标的检测成本,还进一步提高了对标本检出的敏感性。
3)本发明采用特定的外泌体提取、纯化、捕获方法,实现高敏微量的外泌体原位捕获,可保持外泌体原有形态,并获得高纯度的外泌体,提高了效率,实现了高通量,降低了外泌体提取成本。而且,在满足芯片检测所需的微量外泌体基础上,将外泌体纯度提高到了一个新的高度,使特异性靶标的荧光信噪比进一步增大,提高了检测敏感度。而现有的外泌体提取、纯化、捕获方法主要有:超速和密度梯度离心法,通量低,耗时长(仅样本处理就需要3小时),且对外泌体物理性能影响较大;基于聚合物的沉淀法,杂质多,对外泌体的有效成份破坏大;免疫分离法,通量低,不适用于大量样品。此外,分离的囊泡可能失去功能活性。
4)本发明带正电荷的能与带负电荷的外泌体融合的纳米颗粒,内含分子信标和荧光单抗,通过合理的纳米颗粒结构设计、合适的荧光单抗与分子信标的摩尔配比,能对单个外泌体内蛋白和rna进行直接原位结合和荧光成像,特异性更强,无需rna提取和扩增,避免了外泌体的结构被裂解破坏,因而更精准、更便捷,性价比更高。
5)本发明采用超薄(厚度为0.17-0.19mm)、超低荧光、超高透光性的特种玻璃,粗糙度几何平均值(rmsroughness)<100nm,玻璃表面包被亲和素、生物素化和抗体,通过linker分子高亲结合及多级放大效应,能均匀高效地将样品中的外泌体原位捕获,并能根据实验需要调整纳米颗粒中分子信标和荧光单抗的负载浓度,实现对外泌体内蛋白和rna、膜蛋白的高效检测。
6)本发明高清全内反射荧光显微镜成像,基于人工智能的高效算法和荧光图像分析处理。高分辨率显微成像,具有超微和对荧光信号超敏感的特性,能实现对外泌体这种纳米级的囊泡表面物质的动态观察、微小结构和单分子及细胞结构高分辨率直接成像及其靶标的含量测定,通过对外泌体内和膜表面相关标靶分布的信号强度分析检测并判断样本差异。通过对已经完成的大样本实验获得的海量图片的分类和标记,已经建立了超过1000000张(512x512像素/张)的荧光图像分类数据库,并用此数据库用于训练基于深度学习的图片智能筛选模块,实现了对异常荧光图像的前期筛选。此外,通过采用区域分裂合并法、graphcut等方法实现了对图像中样品的荧光信号和杂质干扰进行了更进一步的有效区分;并在上述模块基础上,结合pso(particleswarmoptimization)、dpso(darwinianpso)、fo-dpso(fractional-orderdpso)等优化算法,开发了一套异常图片筛选、样本荧光体形态分离和最优阈值选取的样本图像综合优化程序。
附图说明
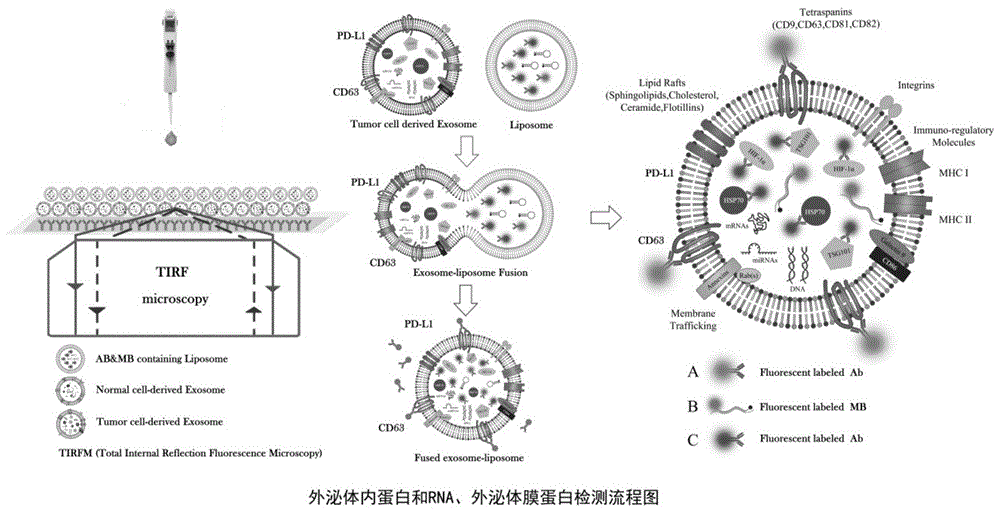
图1为公认外泌体内蛋白tsg101、hsp70、hif-1a、afp及代表性rna:mir-21、afpmrna,外泌体膜蛋白cd63、pd-l1检测为例的检测原理示意图;
图2、3、4、5、6、7为实施图中的检测结果图。
如图1所示:本发明是一种全新的外泌体原位捕获与检测技术,尤以同时检测外泌体内蛋白及rna、外泌体膜蛋白见长(三位一体)。其以经活化处理后的超低荧光、超高透光性,包被有外泌体特异性捕获抗体cd63和cd9的特种玻璃为载体,可原位捕获各种生物样品中的外泌体,溶液中的荧光单抗将与外泌体膜蛋白cd63、pd-l1(antibody,简称ab)等结合,发出a种标记荧光信号;通过包裹有特异性荧光单抗和特异识别靶基因的分子信标(自行设计)的阳离子脂质纳米颗粒,与被芯片捕获的带负电荷的外泌体融合后,分子信标(molecularbeacon,简称mb)与靶基因mir-21、afpmrna等结合,发出b种标记荧光信号。与此同时,特异性荧光单抗与融合体内的靶蛋白tsg101、hsp70、hif-1a、afp(antibody,简称ab)等结合,发出c种标记荧光信号在激光的激发下而产生荧光信号,被tirfm检测,信号强度与相应靶标含量成正比,从而判断样本差异。
具体实施方式
结合实施例对本发明作进一步的说明。
实施例1:外泌体原位捕获芯片处理
1)采用超薄(厚度为0.17-0.19mm)、超低荧光、超高透光性、粗糙度几何平均值(rmsroughness)<100nm的特种玻璃,用高纯度电子级酒精,在24-200℃洁净条件下反复清洗后用高纯氮气吹干;
2)用piranhasolution反复清洗后,保持洁净、干燥;
3)玻璃表面和带官能团的有机硅氧烷(organosiloxanewithfunctionalgroups)置于真空容器内,真空度须<10mmhg,24-180℃条件下气相沉积6-24小时;
4)将亲和素、生物素适量配比1:7-1:30,低速混匀,静置30-60分钟,用pbs、buphtmphosphatebufferedsaline和超纯水(约18兆欧)配制缓冲液、0.01-1%tween20反复清洗后放在ep管中,提高结合效率,避光置于冰箱4℃冷藏6-12小时;
5)将ep管中结合好生物素和亲和素的液体取出,将标记好cd9或cd63抗体的生物素适量配比1:5-1:25,低速混匀,均匀地包被于上述处理好的玻璃上,轻微振动,充分结合,避光,在24℃-60℃条件下孵育1-3小时;
6)包被好的玻片、生物素、亲和素、外泌体捕获特定抗体cd9或cd63在上述反应条件下,linker分子高亲结合及多级放大效应呈现,原位捕获外泌体。
实施例2:纳米颗粒制备及抗体包被
1)将dotma(氯化三甲基-2,3-二油烯氧基丙基铵)、dspe-peg-2000(1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺-聚乙二醇2000)和胆固醇按3:1:4充分混匀后,超声5min,室温静置2小时,即可获得稳定的阳离子脂质体;
2)将适量分子信标、荧光单抗(rna分子信标和抗体可在过量的基础上按摩尔比1:2~1:5与纳米颗粒进行混合包裹)及上述阳离子脂质体在pbs中充分吹打混匀后,超声5min,所述分子信标为5’端茎和环与靶基因完全互补,3’端茎与5’端茎部分互补,5’端和3’端分别用荧光基团和淬灭基团修饰,环上部分碱基用锁核酸修饰,所述荧光单抗为针对特定外泌体内靶蛋白的荧光素标记的单克隆抗体;
3)取步骤1)的混合溶液,快速注入至含适量pbs的ep管中,涡旋10s,超声5min,室温静置2小时,即可获得稳定的纳米颗粒。
实施例3:一种同时检测外泌体内蛋白和rna、外泌体膜蛋白的方法
1)取沉淀法得到的粗制细胞外囊泡,在15~90v直流电场下,采用外泌体原位捕获芯片(实施例1方法制得),直接捕获样品中的外泌体;
2)在步骤1)中捕获的外泌体膜上结合目标抗体,通过抗原和抗体结合,发出标记的a种荧光信号,检测相应的膜蛋白;
3)取包裹需检测靶标的rna分子信标和荧光单抗的纳米颗粒(实施例2方法制得);
4)将步骤3)中得到的已包裹rna分子信标和荧光单抗的纳米颗粒与步骤1)捕获的外泌体融合,rna分子信标和荧光单抗进入外泌体内,rna分子信标与相应的标靶基因结合,信标茎环结构打开,在激光激发下发出标记的b种荧光信号,检测相应的rna;抗原和抗体结合,在激光激发下发出标记的c种荧光信号,检测相应的蛋白;
5)全内反射荧光显微镜(totalinternalreflectionfluorescencemicroscope,简称tirfm)拍照成像,数据分析处理。
实施例4:检测试验(分别以现有公认靶标外泌体内蛋白tsg101、hsp70、hif-1a、afp及代表性rna:mir-21、afpmrna,外泌体膜蛋白cd63、pd-l1为例)
一、样品前处理
1、取200ul样品(细胞培养上清,离体的实验动物血浆、血清,离体的人血浆、血清、尿液等体液或排泄物样品),室温200×g离心10min,去除细胞;
2、取上清室温2000×g离心10min,去除碎片;
3、取上清室温12000×g离心30min,去除血小板和大囊泡;
4、用孔径0.45um的滤器中速过滤上清;
5、加入外泌体沉淀试剂混匀,4℃静置1小时;
6、12000×g离心10min,弃上清;
7、用1×pbs重悬沉淀物,备用。
二、外泌体捕获
1、取出外泌体捕获芯片(该芯片由实施例1制得,该芯片中每孔已包被外泌体特异性捕获抗体cd63和cd9),将上述获得的待测样品加入样品孔中;
2、将阴、阳性对照品(阴、阳性对照品是从pd-l1、cd63过表达的h1299细胞上清中分离得到的外泌体,或已知表达丰度的健康和病人血浆外泌体样品)加入后续样品孔中;
3、37℃孵育2小时后,用1×pbs洗板3次;
4、外泌体捕获条件:15~90v直流电场。
三、纳米颗粒融合及靶标检测
1、将包裹有针对外泌体内靶蛋白tsg101、hsp70、hif-1a、afp荧光单抗,及针对外泌体内mir-21、afpmrna分子信标的阳离子纳米颗粒加入全部样品孔中;
2、37℃孵育4小时后,用1×pbs洗板3次;
3、用5%bsa室温封闭30min;
4、加入cd63、pd-l1荧光单抗稀释液,37℃孵育2小时;
5、用1×pbs洗板3次后,用tirf显微镜采集荧光图片;
6、用dximagev1软件分析图片,自动设置cut-off值,自动判读待测样品结果。
四、特异性分子信标设计(以靶标mir-21、afpmrna为例)
设计检测靶基因的特异性分子信标,对于外泌体捕获孔板或芯片检测特异性核酸至关重要。为此,结合靶基因的特征,申请人设计了特殊茎环结构的分子信标,5’端茎和环与靶基因完全互补,3’端茎与5’端茎部分互补,5’端和3’端分别用荧光基团和淬灭基团修饰,环上部分碱基用锁核酸修饰,特异性mir-21、pd-l1mrna分子信标具体序列如表1所示,seqidno.1所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第36位碱基bhq1修饰,所述seqidno.2所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第35位碱基bhq1修饰,所述seqidno.3所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22和25位碱基lna修饰和第34位碱基bhq1修饰,所述seqidno.4所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第35位碱基bhq1修饰,所述seqidno.5所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第35位碱基bhq1修饰,所述seqidno.6所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第36位碱基bhq1修饰,所述seqidno.7所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第36位碱基bhq1修饰,所述seqidno.8所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第36位碱基bhq1修饰,所述seqidno.9所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第36位碱基bhq1修饰。特异性pd-l1分子信标具体序列如表2所示,seqidno.10所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第35位碱基bhq1修饰,所述seqidno.11所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25、28和31位碱基lna修饰和第38位碱基bhq1修饰,所述seqidno.12所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22和25位碱基lna修饰和第35位碱基bhq1修饰,所述seqidno.13所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25、28和31位碱基lna修饰和第40位碱基bhq1修饰,所述seqidno.14所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25、28和31位碱基lna修饰和第38位碱基bhq1修饰,所述seqidno.15所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第35位碱基bhq1修饰,所述seqidno.16所示序列其碱基修饰方式为:第1位碱基6fam修饰,第10、13、16、19、22、25和28位碱基lna修饰和第36位碱基bhq1修饰。
本发明设计的特异性分子信标最大程度地提高了分子信标与靶基因结合的特异性,同时降低了反应的背景荧光强度。分子信标合成后,为了验证其与相应靶基因结合的特异性和最佳工作温度,我们设计了如下表3,根据最高信噪比选取最佳分子信标及其工作温度。
表1mir-21探针序列
表2afpmrna探针序列
五、已包裹rna分子信标和荧光单抗的纳米颗粒与步骤2)的外泌体融合条件:5~90v直流电场下,4-60℃条件下进行融合。
六、检测结果
本发明分别从外泌体表征检测、细胞上清外泌体膜蛋白和mrna表达对比实验、人血浆外泌体特异性检测、人血浆外泌体膜蛋白对比实验、多样本人血浆外泌体膜内蛋白、rna及膜蛋白检测方面进行了验证并与现有公认的检测技术进行了对比实验。
(一)外泌体表征检测
本发明采用现有公认的外泌体的表征方式:动态光散射(dynamiclightscattering,简称dls)法。
如图2所示:通过本发明处理获得的血浆外泌体,经dls动态光散射和tem透射电镜技术检测,其粒径范围是101.8±41nm,zeta电位测量结果显示带负电,所带电荷为-3.25mv,电镜图显示为杯状或碗状结构,与文献报道基本一致。
(二)细胞上清外泌体膜蛋白和mrna表达对比实验
本发明采用与现有公认的检测外泌体蛋白和rna的免疫印迹(westernblot,简称wb)和荧光定量pcr技术,同时检测转染h1299肺癌细胞系的细胞上清来源的外泌体中pd-l1蛋白和mrna的表达作为对比实验。
如图3所示:dls粒度分析结果显示,转染h1299细胞上清液中的外泌体粒径范围是205.3±69.6nm左右,zeta电位测量结果显示evs带负电,所带电荷为13.0mv。
如图4所示:a是pcr、b是wb、c和d是本发明的芯片的实验结果。将对照和pd-l1表达质粒分别转染h1299肺癌细胞系,提取细胞总rna和蛋白质,经荧光定量pcr和wb技术检测,与对照组相比,pd-l1mrna和蛋白均实现了过表达。将上述细胞培养的上清通过本发明前述步骤提取、纯化得到的外泌体,加入外泌体原位捕获芯片上,并经本发明纳米颗粒包被分子信标pd-l1mrna及其膜蛋白检测,经tirfm成像显示,与对照组相比,细胞培养上清来源的外泌体中,pd-l1mrna和蛋白表达均显著升高。此对比实验表明:对于同一样本同时检测的相同标志物pdl1膜蛋白和mrna,本发明与检测外泌体蛋白和rna的免疫印迹(westernblot,简称wb)和荧光定量pcr技术的结果一致。
(三)人血浆外泌体特异性检测
本发明用pbs、人血浆分离的纯外泌体(空白对照、exonly)、同型对照(exisotype)和抗体(exabs)分别检测公认的外泌体内蛋白tsg101、hsp70、膜蛋白cd63和pd-l1。
如图5所示:通过本发明方法从人血浆中分离获得的外泌体,加入外泌体原位捕获芯片上,经后续膜蛋白cd6(图c)3和pd-l1(图d)、外泌体内蛋白tsg101(图a)、hsp70(图b)靶标检测,经tirfm成像显示,与pbs、空白对照、同型对照及抗体相比,cd63和pd-l1荧光单抗的特异性较好。
(四)人血浆外泌体膜蛋白对比实验
本发明采用现有公认的流式细胞术检测健康人(normal)和肺癌患者(patient)血浆外泌体膜蛋白cd63和pd-l1作为对比实验。
如图6所示:采用cd63单抗包被的磁珠捕获健康对照和肺癌患者血浆中的外泌体,经cd63-af488和pd-l1-af647荧光单抗结合外泌体膜上的cd63和pd-l1膜蛋白,通过流式细胞术检测发现,肺癌患者血浆外泌体数量及其膜上cd63、pd-l1蛋白的表达量均较健康对照组显著增多。
(五)多样本人血浆外泌体膜内蛋白、rna及膜蛋白检测
运用本发明,选取公认外泌体内蛋白hsp70、afp、hif-1a及代表性rna:mir-21、afpmrna,外泌体膜蛋白pd-l1,采用健康人(normal,图中以jk表示)和肺癌患者(patient,图中以pt表示)血浆样本各30例分离外泌体进行检测,分别为:肺癌检测外泌体内蛋白hsp70(图a)、hif-1a(图b)、外泌体膜蛋白pd-l1(图d)、mir-21(图e);肝癌检测外泌体内蛋白afp(图c)、afpmrna(图f),均同时检测健康对照。
如图7所示:使用本发明中提取、纯化外泌体的方法,从健康人(jk)和癌症患者(pt)各30例血浆中分离获得的外泌体,加入外泌体原位捕获芯片上,经包裹有靶向外泌体内蛋白hsp70、hif-1a、afp的荧光单抗,和靶向afpmrna及mir-21的分子信标的纳米颗粒融合,和靶向外泌体膜蛋白pd-l1荧光单抗结合,经tirfm成像显示,与健康对照组相比,肺癌和肝癌患者血浆标本中,外泌体内蛋白hsp70、afp、hif-1a、及代表性rna:mir-21、afpmrna,外泌体膜蛋白pd-l1,总的荧光强度均高于健康人,表达量均显著升高。
本发明分别从外泌体表征检测、细胞上清外泌体膜蛋白和mrna表达对比实验、人血浆外泌体特异性检测、人血浆外泌体膜蛋白对比实验、多样本人血浆外泌体膜内蛋白、rna及膜蛋白检测方面进行了验证,并与现有公认的检测外泌体蛋白和rna及膜蛋白的免疫印迹(westernblot,简称wb)、荧光定量pcr技术和流式细胞术进行了比对实验,显示出本发明技术对于同一样本同时检测的相同标志物检测结果与上述公认技术的一致性,且本发明该技术可同时检测外泌体内蛋白、rna及外泌体膜蛋白,并判断样本差异。
- 还没有人留言评论。精彩留言会获得点赞!