双柱LC-MS系统及其使用方法与流程
本发明总体涉及用于改进的蛋白质测序的系统和方法。
背景技术:
在胰蛋白酶消化后通过液相色谱-质谱(lc-ms)分析来确认治疗性单克隆抗体(mabs)的一级序列是生物技术行业常规进行的必要测定法。完整的序列覆盖对于治疗性单克隆抗体的肽作图分析非常合乎需要,但并不总是能仅通过胰蛋白酶消化而实现。在常用的c18色谱柱上保留性差或不保留的小的和/或疏水性的肽经常会错过ms检测,从而导致覆盖图中出现缺口。如果错过的序列属于关键互补决定区,则尤其会产生问题。为了达到100%的覆盖率,经常需要二次酶促消化。作为另一种选择,新兴的毛细管区带电泳-质谱联用(ce-ms)技术可以实现100%的覆盖率,但此类平台的取得仍然受到限制。
因此,本发明的目的是提供用于获得蛋白质的完整氨基酸序列的系统和方法。
技术实现要素:
提供了一种双柱液相色谱-质谱(lc-ms)系统及其使用方法。一个实施方案提供了一种双柱液相色谱系统,其包括:与第一多端口切换导流阀流体连通的第一柱;与所述第一多端口切换导流阀流体连通的第二柱;与所述第一多端口切换导流阀流体连通的第二多端口切换导流阀;与所述第二多端口切换导流阀流体连通的质谱仪;与所述第二多端口切换导流阀流体连通的收集容器;和与所述双柱色谱系统电气连通的计算机,其用于藉由将所述第一和第二多端口切换导流阀的端口配置成多种构造来控制通过所述系统的流体流。该系统可任选包括检测器(例如紫外检测器)和/或质谱仪,以及收集容器。典型地,第一柱装填有用于分离非极性和疏水性肽的材料,第二柱装填有用于分离极性肽的材料。例如,第一柱可以是c18柱,第二柱可以是多孔石墨柱。
在另一个实施方案中,多端口切换导流阀被配置成允许来自第一柱的流体流过第二柱。在又一个实施方案中,多端口切换导流阀被配置成允许来自第一柱的流体绕过第二柱而流至质谱仪。
另一个实施方案提供了藉由消化蛋白质以产生蛋白质的肽片段、在一定条件下将所述肽片段上样到第一高效液相色谱柱上来测定蛋白质的序列的方法,在所述条件下肽片段中的一些保留在第一柱上而肽片段中的一些不保留在第一柱上。不保留在第一柱上的肽直接流入第二高效液相色谱柱中,其中不保留在第一柱上的肽的至少一部分保留在第二柱上。该方法包括以一定方式洗脱保留在第一柱上的肽,在所述方式中洗脱的肽绕过第二柱。藉由质谱分析洗脱的肽以测定肽的氨基酸序列。也从第二柱洗脱肽并藉由质谱进行分析,以测定洗脱的肽的氨基酸序列。来自第一柱和第二柱的洗脱的肽的组合序列提供蛋白质的完整氨基酸序列。在一个实施方案中,被测序的蛋白质是抗体,例如单克隆抗体,或者是融合蛋白。
在另一个实施方案中,第一柱装填有用于分离非极性肽的材料,而第二柱装填有用于分离极性肽的材料。例如,第一柱可以是c18柱,第二柱可以是多孔石墨柱。在某些实施方案中,蛋白质在消化之前经还原和烷基化。典型以酶促(例如使用胰蛋白酶)消化蛋白质。
在一个实施方案中,藉由质谱以300至2000m/z的扫描范围分析从cl8柱洗脱的肽,并且藉由质谱以200至2000m/z的扫描范围分析从pgc柱洗脱的肽。
附图说明
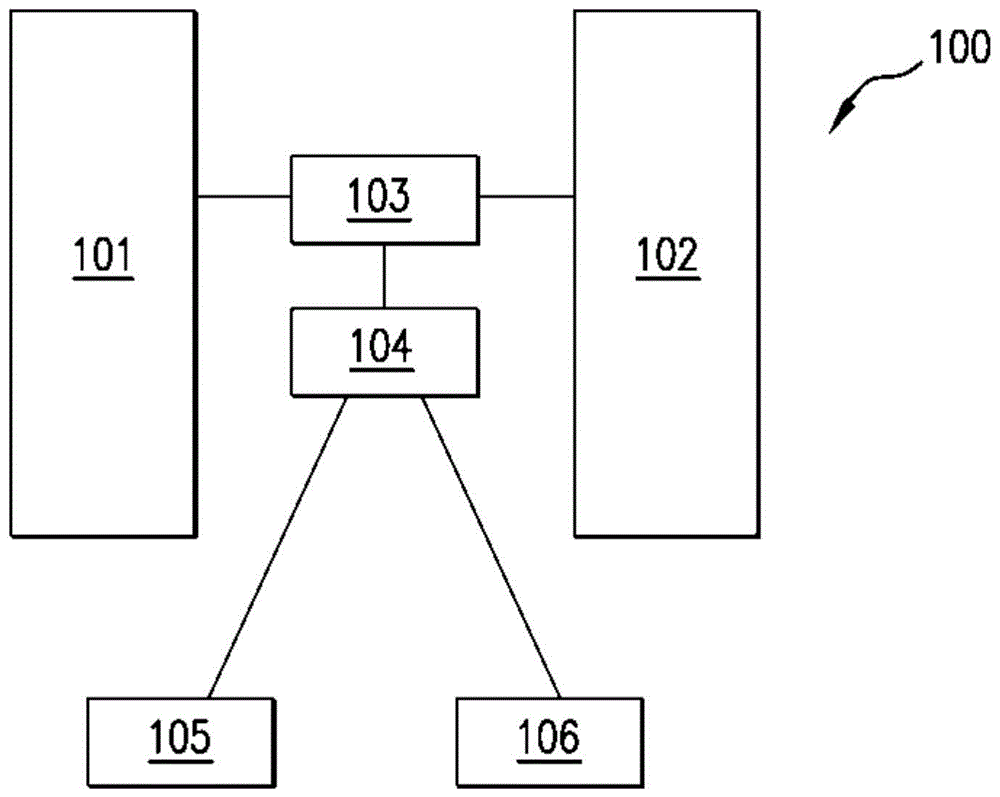
图1是示例性的双柱lc-ms系统的图。
图2a-2c是双导流阀构造的示意图。线条表示导流阀被配置成“上样”模式、“c18洗脱”模式或“pgc洗脱”模式时的溶剂流路。“l-x/l-x”位置分别是指导流阀1的端口位置和导流阀2的端口位置。
图3是用户界面的图像,其示出了用于双柱pgc-c18构造的数据采集的示例性质谱仪方法设置。
图4是示出c18-pgc洗脱梯度的代表性实例的表。
图5a和5b是第一多端口切换导流阀置于第二多端口切换导流阀之上的照片。
图6a是示出cl8洗脱的参数的用户界面屏幕截图。图6b是示出pgc洗脱的参数的用户界面屏幕截图。
图7a-7b是c18-pgc肽作图分析的示例性总离子色谱图(tic)。
具体实施方式
i.定义
如本文所用,“肽作图”是指表征蛋白质并阐明其一级氨基酸结构的技术。其为广泛用以表征单克隆抗体和其他重组蛋白质药物的技术。
如本文所用,“胰蛋白酶切肽”是指藉由使用丝氨酸蛋白酶胰蛋白酶将较大的蛋白质消化为较小的肽而产生的肽。胰蛋白酶藉由水解精氨酸和赖氨酸氨基酸残基的羧基末端侧的肽键,将蛋白质切割成平均大小为700至1500道尔顿的肽。
如本文所用,“多孔石墨碳(pgc)柱”是指由多孔石墨碳构成的色谱柱。由于其对十分极性的化合物有独特的保留和分离性,在液相色谱中是良好的固定相。
如本文所用,“cl8柱”是指液相色谱中通常使用的反相色谱柱。cl8柱由键合至柱内二氧化硅颗粒上的碳链组成。这些柱通常用于分离疏水性和非极性分子,这些分子与所述二氧化硅的碳链结合。
如本文所用,“液相色谱法(lc)”是指用于分离、鉴定和定量混合物中的组分的技术。在柱液相色谱法中,液体流动相通过色谱柱,流动相中的组分与固体固定相相互作用。可以在分离运行过程中改变流动相的组成,以改变所关注化合物的相互作用强度。随着流动相继续流过色谱柱,典型地按级分收集洗脱液,同时监测从色谱柱洗脱的化合物随时间推移的浓度以产生洗脱曲线,或色谱图。
液相色谱法通常与质谱法联用,以藉由测量氨基酸色氨酸在280nm处的吸光度来连续测量来自色谱柱的蛋白质洗脱物。色谱图上的每个显著峰皆代表由色谱柱解析的独特组分,峰下面积对应于从色谱柱洗脱出的化合物的量。单个峰可能含有多种蛋白质,因此经常有必要对洗脱的级分进行进一步分析。
如本文所用,“固定相”是指保持固定在柱中的物质。最常用的固定相色谱柱是碳链键合的二氧化硅、苯基键合的二氧化硅和氰基键合的二氧化硅。
如本文所用,“流动相”和“液相”可以互换使用,是指用于从色谱柱洗脱化合物的水或含水缓冲液与有机溶剂的混合物。最常见的流动相溶剂包括但不限于乙腈、甲醇、四氢呋喃、乙醇或异丙醇。
如本文所用,“洗脱”和“进行洗脱”是指藉由用溶剂洗涤而将一种材料从另一种材料提取出来的过程。
如本文所用,“总离子色谱图(tic)”是藉由归总属于同一扫描的所有质谱峰的强度而生成的一种色谱图。tic包括背景噪音以及样品组分。
如本文所用,“tfa”是三氟乙酸的缩写,其是在反相液相色谱中用于肽分离的常用改性剂。改性剂是添加到流动相中的物质,其与固定相和样品均相互作用以改变保留性。
术语“lc-ms”是指将液相色谱法(或hplc)的物理分离能力与质谱法(ms)的质量分析能力相结合的分析化学技术。
ii.双柱lc-ms系统
在标准的肽作图构造中,肽保留在安装于液相色谱系统上的cl8柱上,并使用一个6端口切换导流阀将其洗脱至质谱仪,该阀在直接lc流动到质谱仪或到废弃物容器之间切换。
一个实施方案提供了一种双柱液相色谱系统,其包括:与第一多端口切换导流阀流体连通的第一柱;与所述第一多端口切换导流阀流体连通的第二柱;与所述第一多端口切换导流阀流体连通的第二多端口切换导流阀;与所述第二多端口切换导流阀流体连通的质谱仪;与所述第二多端口切换导流阀流体连通的收集容器;和与所述双柱色谱系统电气连通的计算机,其用于藉由将所述第一和第二多端口切换导流阀的端口配置成多种构造来控制通过所述系统的流体流。
该系统可任选包括检测器(例如紫外检测器)和或质谱仪,以及收集容器。典型地,第一柱装填有用于分离非极性肽的材料,第二柱装填有用于分离极性肽的材料。例如,第一柱可以是c18柱,第二柱可以是多孔石墨柱。
在另一个实施方案中,多端口切换导流阀被配置成允许来自第一柱的流体流过第二柱。在又一个实施方案中,多端口切换导流阀被配置成允许来自第一柱的流体绕过第二柱而流至质谱仪。
图1是示例系统100的图。系统100包含柱101。柱101典型是装填有用于分离非极性和/或疏水性肽的材料的hplc柱。柱101与多端口切换导流阀103流体连通。系统100还包括也与多端口切换导流阀103流体连通的第二柱102。多端口103与第二多端口切换导流阀104流体连通。多端口切换导流阀104与质谱仪106和收集容器105流体连通。
a.双导流阀
在图2a至图2c中示出了两个切换导流阀的代表性构造。图5a和5b是示例性双导流阀的照片。导流阀的第一位置称为“1-6”,其中溶剂流通过端口1进入,并通过端口6离开。导流阀的第二位置是“1-2”,其中溶剂流通过端口1进入并通过端口2离开。“l-x/l-x”位置分别是指导流阀1的端口位置和导流阀2的端口位置。因此,例如“1-6/1-6”表示来自lc的溶剂进入导流阀1的端口1并从导流阀1的端口6离开,然后进入导流阀2的端口1并从导流阀2的端口6离开。设置第一导流阀的管路,使得“1-6”位置将引导来自lc的液流穿过pgc柱并进入第二导流阀的入口。与pgc柱的连接位于导流阀1的端口6和端口3处,如图2a所示。更具体而言,来自lc的出口管线连接到导流阀1的端口1,pgc柱在端口3和端口6处连接,其中流向为从端口6到端口3,并且具有自导流阀1的端口2的出口管线,其连接到导流阀2的端口1。设置第二导流阀的管路,使得“1-6”位置引导来自导流阀1的出口的液流并进入质谱仪,而“1-2”位置将液流重定向到废弃物。更具体而言,导流阀1的出口管线在端口1处连接,导流阀2的出口管线将端口2连接至质谱仪,并且一出口管线将端口6连接至废弃物。可以在“1-6/1-6”位置将肽上样到c18柱和pgc柱二者上。
将在“1-2/1-2”位置进行从c18柱洗脱胰蛋白酶切肽,如图2b所示。将在“1-6/1-2”位置进行从pgc柱洗脱肽,如图2c所示。
在一个实施方案中,通过双柱lc-ms系统的流速可以是0.25ml/min。本领域技术人员将理解,典型的lc-ms中使用的其他流速可用于所公开系统中。
在一个实施方案中,流动相是水中的0.05%tfa(用于上样)和乙腈中的0.045%tfa(用于洗脱相)。图4中示出了代表性的洗脱梯度。
在一个实施方案中,0.1%甲酸(fa)用于上样,乙腈中的0.1%甲酸用于洗脱。
导流阀位置的切换可以在质谱仪设置中控制,如图3所示。切换的时序与c18-pgclc梯度相关联,其实例在图3中示出。
b.肽洗脱
在一个实施方案中,使用本文所公开的双柱lc-ms系统对蛋白质进行测序。通常将蛋白质用tcep还原并用碘乙酰胺使其烷基化,然后用胰蛋白酶消化以产生胰蛋白酶切肽。可以依序实现将胰蛋白酶切肽在c18柱和pgc柱上上样并洗脱。例如,将胰蛋白酶消化物注入lc-ms,然后利用处于“1-6/1-6”位置的导流阀上样至c18柱和pgc柱二者。胰蛋白酶切肽首先保留在cl8柱上。然后将不保留在cl8柱上的亲水肽洗脱到下游的pgc柱上并保留在pgc柱上。图6a和6b示出了示例性的洗脱参数。在上样步骤之后,首先在c18柱上进行肽洗脱,其中导流阀被设置为使用“1-2/1-2”位置绕过pgc柱。c18柱上的洗脱完成后,将梯度平衡至初始条件。藉由使用处于“1-6/1-2”位置的导流阀,引导液流通过pgc柱来进行pgc柱的洗脱。cl8洗脱必须在绕过下游pgc柱时进行,以避免pgc柱被cl8柱上保留的较大胰蛋白酶切肽堵塞或掩盖pgc柱上保留的小的亲水性肽的信号。
c.质谱分析
来自cl8柱和pgc柱二者的肽洗脱液均流至质谱仪以供ms分析。在一个实施方案中,将cl8洗脱液的扫描范围设置为300至2000m/z以维持正常的tic基线。在一个实施方案中,将pgc洗脱液的扫描范围设置为200至2000m/z以检测小肽。已显示所公开的方法对所有测试分子均提供100%的序列覆盖率。
可以对当前的cl8肽作图设置进行小的改良即可实现双柱lc-ms系统,同时产生更高的序列覆盖范围和有价值的信息。因此,所述双柱lc-ms系统提供了一种简单的解决方案来在单次lc-ms分析中实现mab的完整序列覆盖。
实施例
实施例1:序列覆盖率分析
方法:
首先用tcep还原单克隆抗体样品并用碘乙酰胺烷基化,然后用胰蛋白酶消化。然后将消化混合物注入由c18柱和pgc柱构成的双柱lc-ms系统上。在上样步骤期间,胰蛋白酶切肽首先保留在c18柱上。将不保留在该柱上的亲水性肽洗脱并保留在下游pgc柱上。首先在导流阀使液流绕过pgc柱的同时在cl8柱上进行洗脱。在完成cl8柱上的洗脱并将梯度平衡至初始条件后,藉由引导液流通过pgc柱开始在pgc柱上的肽洗脱。
结果:
观察到保留在pgc柱上而不在cl8柱上的常见肽是含有c端lys或arg的二肽。藉由使用hcd碎片化过程中的精确ms1质量和特征性亚胺离子,可以确信地确认那些短肽的身份。使用nistmah参考标准品和多种内部的mah分子,证明所公开的方法可以为所有测试分子提供100%的序列覆盖率。图7示出了被测序的示例性蛋白质的总离子色谱图。
- 还没有人留言评论。精彩留言会获得点赞!