预测人体免疫反应的方法与流程
相关申请案
本申请案主张于2018年5月11日申请的美国临时申请第62/670,105号案的优先权,该案经由引用完整并入本案。
本发明涉及一种预测人体对于治疗性癌症疫苗的免疫反应的方法。该方法包括一系列培养程序和经修饰的elispot(酶联免疫斑点)试验,以检测来自人类个体pbmc的抗原特异性抗体产生能力。
背景技术:
治疗性癌症疫苗是一种新兴概念,可经由刺激患者自身的免疫反应而提供长期保护。与仰赖患者免疫反应的任何其他治疗方法一样,例如pd-1/pd-l1,辨识出可由此治疗中受益的反应性群体至关重要。就癌症疫苗而言,患者是否能够产生抗原特异性抗体将是重要的指标。
有数种表面碳水化合物会在恶性肿瘤细胞中表达。例如,碳水化合物抗原globoh(fucα1→2galβ1→3galnacβ1→3galα1→4galβ1→4glc)是于1984年首度从乳癌mcf-7细胞中分离及辨识出的连接神经酰胺的糖脂(bremeregetal.(1984)jbiolchem259:14773-14777)。先前的研究亦显示于乳癌细胞和乳癌干细胞上观察到globoh和阶段特异性胚胎抗原3(galβ1→3galnacβ1→3galα1→4galβ1→4glcβ1)(ssea-3,也称为gb5)(wwchangetal.(2008)procnatlacadsciusa,105(33):11667-11672)。此外,ssea-4(阶段特异性胚胎抗原-4)(neu5acα2→3galβ1→3galnacβ1→3galα1→4galβ1→4glcβ1)已被普遍使用作为多能人类胚胎干细胞的细胞表面标记物,并已用于分离间充质干细胞和富集神经祖细胞(kannagiretal.(1983)emboj,2:2355-2361)。这些发现支持globo系列抗原(globoh、ssea-3和ssea-4)是癌症治疗的独特标靶,可用于引导治疗药剂有效靶向癌细胞。
技术实现要素:
本发明目的之一是提供一种在将碳水化合物抗原实际投予受试者之前,评估该受试者对于碳水化合物抗原或其免疫原性片段的反应性的方法。另一目的是测定癌症疫苗对受试者的治疗功效。
为了达到目的,本发明提供一种获取信息的方法,其可用于测定和预测怀疑患有具碳水化合物抗原的癌症的患者的体液免疫反应,包含以下步骤:(a)从患者取得样品,(b)培养来自样品的细胞,(c)离体将细胞暴露于一或多种抗原,(d)辨识该患者为反应者或无反应者;以及(e)若患者为反应者,则继续进一步治疗。
本发明提供一种评估受试者对碳水化合物抗原或其免疫原性片段的反应性的方法,包含:a.自该个体取得外周血单个核细胞;b.在酶联免疫斑点试验(enzyme-linkedimmunospot)中,藉由使用经碳水化合物抗原涂覆的板,离体将该细胞暴露于该碳水化合物抗原或其免疫原片段;以及c.依据该试验测定生物活性,以评估该反应性。
本发明方法为一种对人类外周血单个核细胞(pbmc)进行的离体免疫原性方法,用于监测由聚糖靶向性癌症疫苗诱发产生的抗原特异性抗体。于此描述的方法包含以碳水化合物抗原刺激pbmc的暴露程序,然后经由elispot试验评估反应性。斑点数可代表受试者的免疫反应,其可用于评估受试者对于碳水化合物抗原的反应性。
本发明涉及globo系列抗原(globoh、ssea-3和ssea-4)疫苗,包括含有佐剂的医药组合物。
本发明亦提供一种测定癌症疫苗治疗功效的方法,包含:(a)提供取自该个体的样品;(b)培养由该样品收集到的细胞;(c)接触该细胞并评估抗体结合至抗原的结合情况;以及(d)测定该抗肿瘤药剂的疗效。
附图说明
当结合随后的详细描述时,通过参考附图可获得对本发明更完整的理解。附图中示范的实施方案仅旨在举例说明本发明,而不应被解释为将本发明限制于所示实施方案。
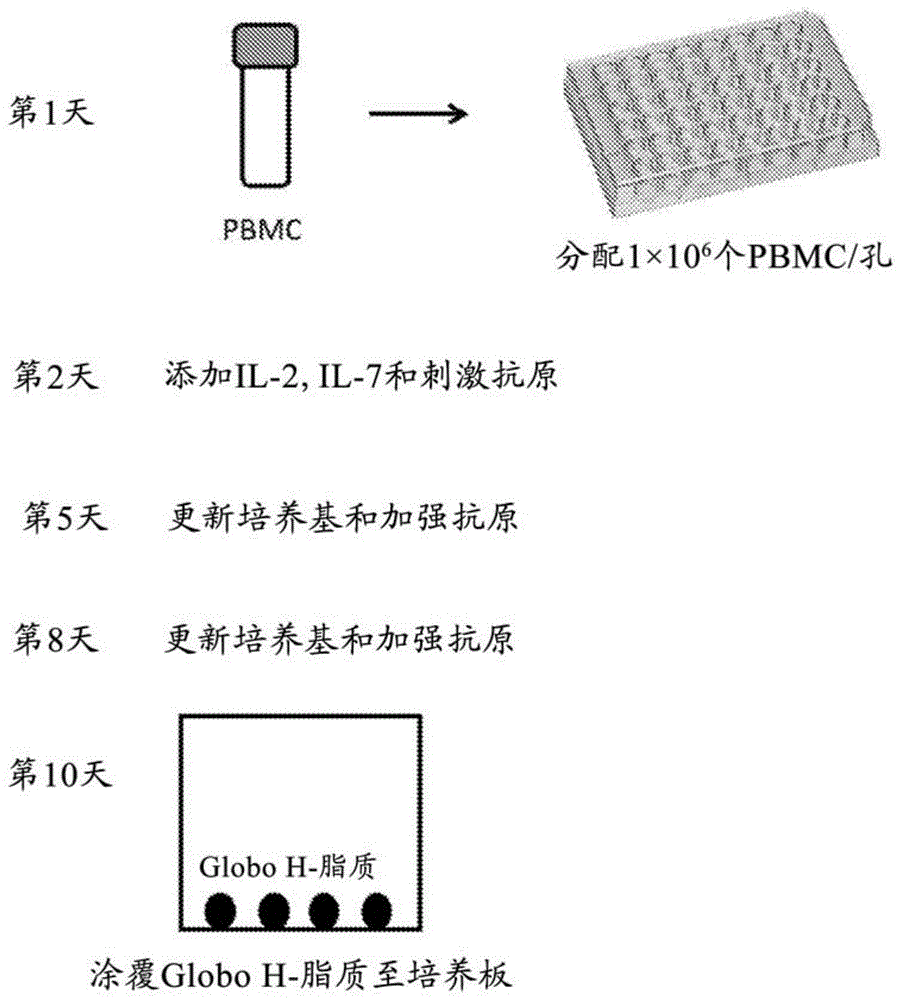
图1。离体免疫原性试验流程的方案,说明对未免疫的人类外周血单个核细胞的癌症疫苗处理以及培养流程。
图2。常规的和经修饰的抗globohigm的elispot检测结果的比较(a组:无抗原;b组:b-poly-stm;c组:obi-821佐剂;d组:obi-821佐剂+obi-822疫苗;e组:仅培养基)。每种处理接种三重复。
图3。经修饰的抗-globohigmelispot的方法准确性。图3a为在接种日(第11天)经由流式细胞术分析说明转染效率(仅pmbc、仅zsgreen和共转染)。图3b显示以不同的接种cho细胞转染进行的抗-globohigmelispot。接种的cho细胞数范围为0至5×104个细胞/孔。每种处理接种三重复。图3c显示抗globohigmelispot定量结果。
图4。对患者pbmc施行obi-833/821免疫程序后的总igm、抗globohigm和ifn-γ的倍数变化。图4a、b和c分别显示了与无抗原治疗组相较,总igmelispot、抗globohelispot和ifn-γ诱发的倍数变化。
图5。离体免疫原性试验结果与患者临床抗-globohigm反应之间的相关性。图5a、b和c分别显示在obi-833/821免疫后的总igmelispot、抗globohigmelispot或ifn-γ的诱发,与患者最大抗-globohigm反应之间的相关性。
图6。离体免疫原性试验结果与患者临床抗-globohigg反应之间的相关性。图6a、b和c分别显示在obi-833/821免疫后的总igmelispot、抗globohigmelispot或ifn-γ的诱发,与患者最大抗-globohigg反应之间的相关性。
具体实施方式
对于本文和所附权利要求书的描述,单数形式“一”和“一个”包括复数指示物,除非上下文另有明确说明。因此,例如提及“一种蛋白质”包括一种以上的蛋白质,提及“一种化合物”是指一种以上的化合物。“包含(comprise)”、“包含(comprises)”、“包含(comprising)”、“包括(include)”、“包括(includes)”和“包括(including)”的使用是可互换的,并非旨在进行限制。应进一步理解,在各种实施方案描述中使用术语“包含”的情况下,本领域技术人员将理解,在一些特定情况下,可以使用“基本上由......组成”或“由......组成”的语言来替代性地描述该实施方案。
本发明提供一种获取信息的方法,其可用于测定和预测怀疑患有具碳水化合物抗原的癌症的患者的体液免疫反应,包含以下步骤:(a)从患者取得样品;(b)从样品中培养细胞;(c)离体将细胞暴露于一或多种抗原,(d)辨识该患者为反应者或无反应者;以及(e)若患者为反应者,则继续进一步治疗。
本发明提供一种评估受试者对碳水化合物抗原或其免疫原性片段的反应性的方法。该方法包含:a.自该个体取得外周血单个核细胞;b.在酶联免疫斑点试验(enzyme-linkedimmunospot)中,藉由使用经碳水化合物抗原涂覆的板,离体将细胞暴露于该碳水化合物抗原或其免疫原片段;以及c.依据该试验测定生物活性,以评估该反应性。
本发明亦提供一种用于测定癌症疫苗的治疗功效的方法,包含:(a)提供取自该患者的样品;(b)培养由该样品收集到的细胞;(c)接触该细胞并评估抗体结合至抗原的结合情况;以及(d)测定该抗肿瘤药剂的疗效。
本文使用的术语“患者”不仅限于患有该疾病(例如癌症)的人,还包括怀疑患有该疾病的人。在一个优选实施方案中,进一步的治疗可包括使用抗原(碳水化合物抗原)。
本文使用的术语“反应者”是指暴露于碳水化合物抗原的反应超过阈值的人。阈值(在某些情况下可被视为截止值(cut-offvalue))可根据疾病类型、同伴群体的平均生物活性、医生的意见等而变化。术语“无反应者”与上述“反应者”的定义相反。
术语“反应性”是指个体回应于碳水化合物抗原暴露的程度。在一个实施方案中,反应性代表由碳水化合物抗原直接或间接诱发的生物活性。术语“生物活性”可经由任何效应分子的产物,包括但不限于igm、对抗碳水化合物抗原的igm、细胞因子或其组合,的生物学变化来定义。在一个实施方案中,反应性可具有治疗意义。在一个特定实施方案中,反应性可用于确定碳水化合物抗原对个体的治疗功效。在一个优选实施方案中,反应性可经由比较生物活性与阈值来评估,若生物活性超过阈值,则将该个体辨识为对碳水化合物抗原有反应。在一个特定实施方案中,经由酶联免疫斑点试验的斑点数测定生物活性。
术语“细胞因子”是由一种细胞群释放且作用于另一细胞以作为细胞间介体(intercellularmediator)的蛋白质的通称。此类细胞因子的范例为淋巴因子、单核因子和传统的多肽激素。细胞因子包括生长激素,如人类生长激素;副甲状腺素;甲状腺素;胰岛素;胰岛素原;松弛素(relaxin);松弛素原;糖蛋白激素,如促卵泡激素(fsh)、促甲状腺激素(tsh)和黄体生成素(lh);肝生长因子;纤维母细胞生长因子;催乳素;胎盘催乳素;缪勒管抑制物质(mullerian-inhibitingsubstance);小鼠促性腺激素相关肽;抑制素;激活素;血管内皮生长因子;整联蛋白(integrin);血小板生成素(tpo);神经生长因子如ngf-β;血小板生长因子;转化生长因子(tgfs)如tgf-α和tgf-β;胰岛素样生长因子-i和-ii;促红细胞生成素(epo);骨诱导因子;干扰素如干扰素-α、-β和-γ;集落刺激因子(csfs),如巨噬细胞-csf(m-csf);粒细胞-巨噬细胞-csf(gm-csf);以及粒细胞-csf(g-csf);白介素(ils),如il-1、il-1α、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-11、il-12;肿瘤坏死因子如tnf-α或tnf-β;以及其他多肽因子,包括lif和kit配体(kl)。如本文所用,术语细胞因子包括来自天然来源或来自重组细胞培养物的蛋白质和原始序列细胞因子的生物活性等同物。
在一个实施方案中,经碳水化合物抗原涂覆的板是不含pvdf的板。在碳水化合物抗原为globo系列抗原的特定实施方案中,该经碳水化合物抗原涂覆的板为经globo系列抗原-脂质涂覆的板。在一个示范性实施方案中,经碳水化合物抗原涂覆的板是可购得的平面白色板。
在一个优选实施方案中,碳水化合物抗原或其免疫原性片段是globo系列抗原。有数种表面碳水化合物在恶性肿瘤细胞中表达。例如,碳水化合物抗原globoh(fucα1→2galβ1→3galnacβ1→3galα1→4galβ1→4glc)系于1984年首度从乳癌mcf-7细胞中分离及辨识出的连接神经酰胺的糖脂(bremeregetal.(1984)jbiolchem259:14773-14777)。先前的研究亦显示于乳癌细胞和乳癌干细胞上观察到globoh和阶段特异性胚胎抗原3(galβ1→3galnacβ1→3galα1→4galβ1→4glcβ1)(ssea-3,也称为gb5)(wwchangetal.(2008)procnatlacadsciusa,105(33):11667-11672)。此外,ssea-4(阶段特异性胚胎抗原-4)(neu5acα2→3galβ1→3galnacβ1→3galα1→4galβ1→4glcβ1)已被普遍使用作为多能人类胚胎干细胞的细胞表面标记物,并已用于分离间充质干细胞和富集神经祖细胞(kannagiretal.(1983)emboj,2:2355-2361)。这些发现支持globo系列抗原(globoh、ssea-3和ssea-4)是癌症治疗的独特标靶,并且可用于引导治疗药剂有效靶向癌细胞。
在一个优选实施方案中,dt为白喉毒素交叉反应物质(dt-crm)或白喉类毒素。dt-crm是指突变的白喉毒素,例如经由突变或经由化学修饰,使其不再具有足够的adp-核糖基。dt-crm的非限制性范例包括dt-crm30、dt-crm45、dt-crm176、dt-crm197和dt-crm228。白喉类毒素是经甲醛-失活的白喉毒素。dt可购得或可藉由本领域已知的方法制备,例如美国专利no.5,614,382中描述的重组dna技术,其内容经由引用完整并入。
在一个特定实施方案中,该碳水化合物抗原或其免疫原性片段与载体蛋白缀合;其中,该载体蛋白可为但不限于klh(钥孔虫戚血蓝蛋白(keyholelimpethemocyanin))、dt-crm197(白喉毒素交叉反应材料197)或其组合。
实际上,该碳水化合物抗原可能与佐剂一起配制成癌症疫苗。佐剂包含但不限于皂苷、弗氏佐剂、α-半乳糖基神经酰胺(α-galcer)佐剂、磷酸铝、氢氧化铝、mf59(4.3%w/v角鲨烯、0.5%w/v聚山梨醇酯80(tween80)、0.5%>w/v脱水山梨糖醇三油酸酯(span85)、含cpg的核酸、qs21(皂苷佐剂)、α-半乳糖基神经酰胺或其合成类似物(例如,c34,参见us8,268,969)、mpl(单磷酰脂质a)、3dmpl(3-o-脱酰化mpl)、aquilla的萃取物,iscoms(请参见如,sjolanderetal.(1998)andj.leukocytebiol.64:713)、lt/ct突变体,聚(d,l-丙交酯-共-乙交酯)(plg)微粒、quila、qs-21(来自皂树(quillajasaponaria)树皮的皂苷)、白介素、弗氏佐剂、n-乙酰基-胞壁酰-l-苏氨酰基-d-异谷氨酰胺(thr-mdp)、n-乙酰基-正-胞壁酰-l-丙氨酰基-d-异谷氨酰胺(cgp11637,亦称为正-mdp)、n-乙酰胞壁酰-l-丙氨酰基-d-异谷氨酰胺-l-丙氨酸-2-(-2'-二-新戊酰基-sn-甘油基-3-羟基磷酰氧基)-乙胺(cgp19835a,称为mtp-pe),和ribi,其含有从细菌提取的三种成分,单磷酰脂质a、海藻糖二霉菌酸酯和细胞壁骨架(mpl+tdm+cws),溶于2%>角鲨烯/tween80乳剂中,或其组合。
在一个特定实施方案中,该癌症疫苗用于预防或治疗表达globo系列抗原的癌症,该癌症包括但不限于肉瘤、皮肤癌、白血病、淋巴瘤、脑癌、胶质母细胞瘤、肺癌、乳癌、口腔癌、头颈癌、鼻咽癌、食道癌、胃癌、肝癌、胆管癌、胆囊癌、膀胱癌、胰腺癌、肠癌、结肠直肠癌、肾癌、子宫颈癌、子宫内膜癌、卵巢癌、睾丸癌、颊癌、口咽癌、喉癌和前列腺癌。
特定地,该癌症疫苗可为obi-822/821、obi-833/821、obi-833/834、obi-866/821或obi-866/834。示范性obi-822(globoh-klh糖缀合物)如wo2015/159118、wo2016/044326和wo2017/185089专利申请案中所述,在此完整并入本案以作为参考资料。示范性obi-833(globoh-dt糖缀合物)如wo2010/005598和wo2014/107652专利申请案中所述,在此完整并入本案以作为参考资料。示范性obi-866(ssea4-klh糖缀合物)如wo2018/022933专利申请案中所述,在此完整并入本案以作为参考资料。示范性obi-821为皂苷佐剂,并且obi-834为α-半乳糖基神经酰胺(α-galcer)佐剂。
在某些实施方案中,该治疗性癌症疫苗为obi-822(globoh-klh糖缀合物,obipharma,inc.)与佐剂obi-821(皂苷佐剂,obipharma,inc.)组合,用于治疗人类pbmc,以测试它们的免疫原性能力,尤其是抗原特异性抗-globohigm和igg诱发的能力。
在某些实施方案中,治疗性癌症疫苗为obi-833(globoh-dt糖缀合物,obipharma,inc.)与佐剂obi-821(皂苷佐剂,obipharma,inc.)组合,用于治疗人类pbmc,以观察其刺激免疫球蛋白产生的能力,尤其是抗原特异性抗-globohigm和igg诱发的能力。
在某些实施方案中,该样品是由患者收集的体液(血清、唾液、淋巴结液、尿液、阴道拭子或口腔拭子)。在一个实施方案中,术语“疫苗”、“癌症疫苗”和“抗肿瘤剂”在本说明书中是可互换的。
实施例
在以下代表性实施例中说明了本发明的各种特征和实施方案,这些实施例旨在说明而非限制。本领域技术人员将容易理解,具体范例仅说明本发明,其在所附权利要求书中更全面地描述。申请案中描述的每个实施方案和特征应该被理解为可与包含在其中的每个实施方案互换和组合。
实施例1:实验流程
人类pbmc的培养
完整处理流程如图1所示。将来自健康提供者或取自患者的人类pbmc的冷冻小瓶解冻,并立即使用完全培养基(rpmi-1640,含10%fbs、1%丙酮酸钠、1%l-谷氨酰胺、0.1%2-me、1%非必需氨基酸和1%青霉素-链霉素)洗涤一次。将细胞沉淀物重新悬浮于完全培养基中,并计数细胞数和细胞存活率。在确认细胞存活率大于80%后,将pbmc接种到48孔培养板中(目录号150687;thermofisherscientificinc.),细胞密度为1×106个细胞/孔,含有0.5ml完全培养基。将培养板在37℃、5%co2下温育整夜。在第2天,于每孔中加入等体积的含有抗原和il-2、il-7的培养基。将培养板温育于37℃直至使用。在第5天,更换含有抗原和细胞因子的培养基,之后将培养板在37℃下温育直至使用。在第8天,接种细胞,收集pbmc并转移到新48孔板,于37℃,5%co2。
总igm的测量
使用市售的总igmelispot试剂盒(cellulartechnologyltd.)评估总igm诱发状态。在第10天,将涂有人类ig捕捉抗体的96孔板,在4℃下温育整夜。将板以pbs洗涤一次,并用于接种经处理过的pbmc,以每孔2.5×104个细胞的密度接种。将板在37℃温育整夜,避免摇动。在第12天,以pbs洗涤该板两次,然后以0.05%pbst(含0.05%tween-20的pbs溶液)洗涤两个循环。将80μl经生物素标记的抗-igm检测抗体加入各孔中,并在室温下温育2小时。将板以0.05%pbst洗涤三次,并于每孔中加入80μl三级溶液(tertiarysolution)。在室温下温育1小时。将板以0.05%pbst洗涤两次,然后以ddh2o洗涤两个循环。每孔加入80μl混合蓝色显影剂溶液,并在室温下温育15分钟,同时避免曝光。以自来水冲洗该板,并倒置以风干。使用ccd摄影机进行96孔板的成像,并经由
抗-globohigm的测量
使用市售的总igmelispot试剂盒(cellulartechnologyltd.)评估抗globohigm。在第10天,以100μl的含有0.2μggloboh-脂质(c78h144n2o33,mw1637.9716)的乙醇涂覆平底96孔板(目录号3917;corningincorporated)的每一孔。将板在室温下温育整夜,其中乙醇完全挥发。对培养板的每孔加入200μl完全培养基,并在室温下温育1小时。
培养板用于接种经处理的pbmc,密度为每孔2×105个细胞。将培养板在37℃温育整夜,避免摇动。在第12天,以pbs洗涤培养板两次,然后以0.05%pbst洗涤两个循环。于板中每孔加入100μl经过滤的山羊抗人类igm-生物素抗体(目录号109-067-043;jacksonimmunoresearchinc.)溶液,其溶于含有1%bsa的pbs中(以1:1000稀释)。将板在室温下温育2小时。以0.05%pbst洗涤该板三次。于各孔中加入100μl链霉抗生物素蛋白-hrp(目录号dy998;r&dsystems,inc.),其溶于1%bsa缓冲液中,以1:200稀释。将该板在室温下温育1小时。以0.05%pbst进行两次洗涤步骤,然后进行两次ddh2o洗涤。板的每孔加入100μl混合底物溶液(目录号ctl-str10;cellulartechnologyltd.),并在室温下温育15分钟,同时避免曝光。以自来水冲洗该板并倒置风干。使用ccd摄影机进行96孔板的成像,并经由
ifn-γ的测量
在第11天,将培养过pbmc的上清液收集到15ml试管中(目录号430791;corningincorporated),并在室温下以400g离心5分钟。将上清液转移到新的1.5ml小管中(目录号mct-150-c;corningincorporated),并储存在-80℃。经由msdv-plex人类促发炎细胞因子试剂盒(目录号k151a0h-2;mesoscalediagnostic,llc)测量ifn-γ。根据制造商的说明书进行实验程序。结果由mesosectors600(mesoscalediagnostic,llc)获得。
实施例2:经修饰的抗-globohigmelispot试验
平行比较常规的和经修饰的elispot试验(a组:无抗原;b组:b-poly-stm(目录号#ctl-hbpolys-200;cellulartechnologyltd.);c组:obi-821佐剂;d组:obi-821佐剂+obi-822疫苗;e组:仅培养基)。使用pvdf底96孔板(目录号msips4510;merckkgaa)和白色平底96孔板分别进行常规的和经修改的elispot试验。两种试验中的涂覆条件和pmbc接种细胞数是相同的。图2显示与常规方法相较,经修饰的elispot试验具有更高的可见性和灵敏度。
实施例3:经修饰的抗-globohigmelispot的准确性
将expicho-s细胞(目录号a29127;thermofisherscientificinc.)培养于expicho表达培养基。当细胞密度达到4×106至6×106个活细胞/ml时,透过expifectaminecho转染试剂盒,在30mlexpicho表达培养基中,使1.8×108细胞与15μg质粒zsgreen和抗人类globoh-igm抗体进行共转染。转染8天后,收集细胞用于试验。将三种类型的细胞,包括仅cho细胞、以zsgreen荧光蛋白序列(seqidno.1)转染的cho细胞,和以zsgreen和人类globohigm共转染的cho细胞,进行接种,用于抗-globohigmelispot试验。图3a说明经由流式细胞术评估,在接种日(第11天)的转染效率为55%至61%。图3b和c说明只有以zsgreen和人类globohigm共转染的cho细胞具有可检测的斑点,这证实经修饰的globohigmelispot试验具选择性和准确性。
实施例4:经obi-833/821接种疫苗的患者的血清抗-globohigm或igg浓度
在第一期临床研究(试验标识号#nct02310464)中,以obi-833/821免疫患者。使用聚糖芯片测量抗-globohigm和igg浓度。每一样品的最大血清globohigm和igg浓度(μg/ml)总结在表1中。患者的血清中抗-globohigm和igg浓度将用于与离体免疫原性试验结果进行比较。
表1.经obi-833/821接种疫苗的患者的血清抗globohigm或igg浓度。
*lloq:定量下限
实施例5:由患者pbmc中得到的离体免疫原性试验结果
总igm与globohigm反应
在obi-833/821疫苗接种之前收集患者的pbmc并冷冻保存。按照图1所示的方案进行离体免疫原性试验。由已知健康提供者提供的pbmc作为实验对照组。经由elispot试验测定的总igm和抗globohigm的相对于无抗原治疗组标准化的斑点数目和倍数变化值摘录在表2中。
表2.来自患者pbmc的总igm与抗-globohigmelispot结果。
来自5例患者pbmc的总igm和globohigm反应分别示于图4a和b。结果显示,透过该离体免疫原性培养程序,患者的pbmc会诱发不同含量的总igm及/或globohigm。
ifn-γ反应
除了抗体反应之外,使用离体免疫原性培养程序评估细胞因子例如ifn-γ的产生。在培养上清液中检测到的ifn-γ浓度(pg/ml),以及相对于无抗原处理组进行标准化的倍数变化,分别示于表3和图4c中。结果显示,经由离体免疫原性培养程序,患者的pbmc可诱发不同含量的ifn-γ。
表3.由患者pbmc诱发ifn-γ的结果
实施例6:离体免疫原性试验结果与临床反应之间的关联
患者最大血清抗-globohigm浓度(μg/ml)与总igm、抗-globohigm和ifn-γ细胞因子诱发相较的相关性,分别见于图5a、5b和5c。elispot结果以及ifn-γ诱发以倍数变化表示,其相对于无抗原治疗组进行标准化。观察结果与患者血清抗-globohigm含量之间呈正相关。
此外,患者最大血清抗globohigg浓度(μg/ml)与总igm、抗-globohigm和ifn-γ细胞因子诱发相较的相关性,分别见于图6a、6b和6c。
总体而言,结果显示抗-globohigm较抗-globohigg的相关性更明显。患者可能具有延迟的igg反应,尚未观察到相关性。
除非另外定义,否则本文使用的所有技术和科学术语以及任何首字母缩略词,具有与本发明领域的普通技术人员通常理解的含义相同的含义。尽管用于传递与本文所述相似或等同信息的任何组合物、方法、试剂盒和装置可用于实施本发明,但本文描述用于传递信息的优选组合物、方法、试剂盒和装置。
本文引用的所有参考文献在法律允许的最大范围内经由引用并入本文。对这些参考文献的讨论仅仅是为了总结其作者所作的声明。而非承认任何参考文献(或任何参考文献的一部分)为相关的先前技术。申请人保留质疑任何引用参考文献的准确性和针对性的权利。
序列表
<110>台湾浩鼎生技股份有限公司
<120>预测人体免疫反应的方法
<130>19p0347
<160>1
<170>patentinversion3.5
<210>1
<211>696
<212>dna
<213>人工序列
<220>
<223>荧光蛋白
<400>1
atggcccagtccaagcacggcctgaccaaggagatgaccatgaagtaccgcatggagggc60
tgcgtggacggccacaagttcgtgatcaccggcgagggcatcggctaccccttcaagggc120
aagcaggccatcaacctgtgcgtggtggagggcggccccttgcccttcgccgaggacatc180
ttgtccgccgccttcatgtacggcaaccgcgtgttcaccgagtacccccaggacatcgtc240
gactacttcaagaactcctgccccgccggctacacctgggaccgctccttcctgttcgag300
gacggcgccgtgtgcatctgcaacgccgacatcaccgtgagcgtggaggagaactgcatg360
taccacgagtccaagttctacggcgtgaacttccccgccgacggccccgtgatgaagaag420
atgaccgacaactgggagccctcctgcgagaagatcatccccgtgcccaagcagggcatc480
ttgaagggcgacgtgagcatgtacctgctgctgaaggacggtggccgcttgcgctgccag540
ttcgacaccgtgtacaaggccaagtccgtgccccgcaagatgcccgactggcacttcatc600
cagcacaagctgacccgcgaggaccgcagcgacgccaagaaccagaagtggcacctgacc660
gagcacgccatcgcctccggctccgccttgccctga696
- 还没有人留言评论。精彩留言会获得点赞!