用于针对形态学特征和生物标志物表达而制备和分析细胞样品的方法和系统与流程
用于针对形态学特征和生物标志物表达而制备和分析细胞样品的方法和系统
1.相关专利申请的交叉引用
2.本国际申请要求2018年11月20日提交的美国临时专利申请第62/770,072号的权益,该临时专利申请的内容全文以引用方式并入本文。
3.通过引用并入序列表
4.本申请在此通过引用并入以计算机可读格式随本文提交的序列表,该序列表具有文件名“sequence_listing_st25”,创建于2019年10月24日,其大小为85,700字节。
技术领域
5.本发明涉及用于检测、表征和列举细胞样品中的离散的细胞群体的方法和系统。
6.相关技术的描述
7.细胞样品经常用于诊断,包括筛查和诊断血液、淋巴系统、子宫颈、肺和乳腺的癌症。在典型的工作流程中,样品的一部分用于形态学分析。这些形态学染色的样品通常不重复使用。在许多情况下(诸如用于诊断血癌),通过流式细胞术评估样品的分离部分,以用于分子诊断。这是耗时且昂贵的工作流程。此外,它不允许可能在形态学上已被鉴定为异常的细胞与分子染色剂之间进行一对一比较。
8.在其他情况下,例如通过免疫细胞化学法针对生物标志物来对样品的分离部进行评估,因而使得需要额外的样品(其可能并不总是可用的)并且不允许可能在形态学上已被鉴定为异常的细胞与分子染色剂之间进行一对一比较。
技术实现要素:
9.本公开总体上涉及自动化平台在用于显微分析的生物标志物染色的细胞样品的制备中的用途以及此类染色的细胞在某些病症的诊断中的用途。
10.本文公开了一种在自动化高级染色系统上对romanowsky型染色的样品进行亲和染色的方法。通常,在使样品与生物标志物特异性试剂(诸如抗体或原位杂交探针)接触之前的处理步骤期间,对样品进行脱色。在一些实施例中,使用在自动化高级染色平台上具有额外用途的试剂对样品进行脱色,诸如细胞前处理溶液(cell conditioning solution)(其可用于例如抗原修复)、洗涤溶液、阻断溶液(其可用于例如阻断生物标志物特异性试剂可非特异性地结合的内源性位点)、内源性抑制剂溶液(其可用于阻断内源性酶的活性)、稀释剂等。作为具体实例,样品在细胞前处理步骤期间至少部分地脱色。这些方法可用于各种样品类型的诊断工作流程中,所述样品类型包括组织切片、体液样品、体液级分、细针抽吸物、洗涤液以及刮片或取样刷采集的样品。
11.本文还公开了处理体液样品以用于形态学和生物标志物分析的方法。体液样品以薄层沉积到一个或多个固体支持物上。对样品中的至少一者用romanowsky型染色剂进行染色并评估细胞形态,并且针对用于对样品的一种或多种细胞进行分类的一种或多种生物标志物,对样品中的至少一者进行染色。在某一实施例中,用romanowsky型染色剂染色的样品
也是针对一种或多种生物标志物而被染色的样品,所述染色可以是单一染色或多重染色。在一些实施例中,在不执行单独的脱色步骤的情况下,对romanowsky型染色的样品执行生物标志物染色。在另一实施例中,针对一种或多种生物标志物,对未染色的样品进行染色。当对多于一种的生物标志物单独进行评估时,可针对每种生物标志物提供单独的样品,或者可针对所有生物标志物以多重形式对单一打印的样品进行染色,或者可以使用单一和多重染色的打印的样品的组合。在具体实施例中,该方法用于鉴定血液样品中的细胞群体。
12.通过回顾本公开,其他特征和实施例将是显而易见的。
附图说明
13.专利或申请文件含有至少一幅彩色附图。在提出请求并支付必要的费用后,专利局将提供带有一幅或多幅彩图的本专利或专利申请公布的拷贝。
14.图1示出了对romanowsky型染色的样品中的一种或多种生物标志物进行脱色与亲和染色的示例性工作流程。
15.图2示出了对细胞学样品进行染色和评估的示例性工作流程。
16.图3a示出了使用基于薄层的自动化cbc/diff和自动化高级染色对全血样品进行染色和评估的示例性诊断工作流程。
17.图3b示出了使用基于薄层的自动化cbc/diff和自动化高级染色对全血样品进行染色和评估的另一示例性诊断工作流程。阴影线框表示涉及图像分析的步骤。阴影线箭头表示替代步骤。
18.图4是使用自动化ihc/ish载玻片染色平台对打印的血液样品中的免疫细胞进行评估的工作流程的图示。
19.图5是在正常的血液打印的载玻片上使用dab检测法对cd3生物标志物进行免疫酶染色的图示。
20.图6是在正常的血液打印的载玻片上使用dab检测法对cd8生物标志物进行免疫酶染色的图示。
21.图7是在正常的血液打印的载玻片上使用dab检测法对cd45生物标志物进行免疫酶染色的图示。
22.图8是在正常的血液打印的载玻片上使用dab检测法对cd68生物标志物进行免疫酶染色的图示。
23.图9是对被鉴定为b细胞恶性患者血液的pax5生物标志物进行阳性免疫酶染色的图示。
24.图10是再次使用romanowsky型染色的载玻片进行免疫酶评估的工作流程。
25.图11是romanowsky型染色的血液打印的载玻片(左列),以及在自动化平台上用cd45和生色团discovery purple进行重新染色的同一载玻片(右列)。顶行是甲醇固定的样品。底行是中性缓冲福尔马林固定的样品。
26.图12是romanowsky型染色的血液打印的载玻片(左列),以及在自动化平台上用cd45和生色团discovery teal进行重新染色的同一载玻片(右列)。顶行是甲醇固定的样品。底行是中性缓冲福尔马林固定的样品。
27.图13是romanowsky型染色的血液打印的载玻片(左列),以及在自动化平台上用
cd45和生色团discovery yellow进行重新染色的同一载玻片(右列)。顶行是甲醇固定的样品。底行是中性缓冲福尔马林固定的样品。
28.图14是被cc1和rb逐渐地脱色的romanowsky型染色的血液打印的载玻片。顶行示出了从romanowsky型染色(a)到用cc1部分地脱色(b)的变化。底行示出了用cc1部分地脱色(a)到用反应缓冲液完全地脱色(b)。
29.图15是使用血液打印的载玻片进行5种免疫生物标志物的5
‑
plex免疫酶评估的工作流程。
30.图16:针对cll血液打印的样品测试的五种免疫生物标志物。
31.图17:所提出的使用打印的血液载玻片对cbc载玻片和后续生物标志物表达进行评估的工作流程。
32.图18:在标记有非典型细胞的单个载玻片上进行的cd5、cd2、cd8、cd4和cd45生物标志物的多重染色。
33.图19:在标记有非典型细胞的单个载玻片上进行的cd5、cd3、cd23、cd10和细胞周期蛋白d1生物标志物的多重染色。在多个细胞中观察到细胞周期蛋白d1(绿色)核染色。在该fov中在某些细胞中观察到了cd5(橙色)、cd23(红色)和cd10(品红色)的共配准。
34.图20:在标记有非典型细胞的单个载玻片上进行的pax5、cd5、cd23、细胞周期蛋白d1和cd3生物标志物的多重染色。cd5阳性细胞(浅绿色)与pax5(橙色)细胞和细胞周期蛋白d1(品红色)核染色的共染色已生成了合并的白色染色。
35.图21:在标记有非典型细胞的单个载玻片上进行的cd3、cd5、cd38、cd23和zap
‑
70生物标志物的多重染色。在fov中见到共配准所有5种生物标志物(cd3、cd5、cd38、cd23和zap
‑
70)的细胞。cd38也将血小板染色,显示为红点。
36.图22:5
‑
plex测定设计的工作流程,用以对all和aml病例进行分层(stratify,区分)。
37.图23:显示如何使用该工作流程将aml与all分层的流程图,以及对all和aml两者的示例性染色,包括示例性aml和all染色。
38.图24:体液染色工作流程。
39.图25a:在自动化组织染色平台上染色的单个滑液载玻片上的多种生物标志物的实例。
40.图25b:滑液载玻片的四重(4
‑
plex)合并的图像。
41.图26:在bal打印的载玻片中的某一细胞中见到由cd45(绿色)、cd8(红色)和cd3(浅绿色)组成的3重合并的图像。
42.图27:在血液打印的载玻片上进行血小板染色的工作流程。
43.图28:在自动化组织染色平台上染色的血涂片上的血小板染色的实例。
44.图29:fish对打印的载玻片进行染色的示例性工作流程。
45.图30:在自动化组织染色平台上染色的血涂片上的12号染色体fish染色的实例。
46.图31:在自动化组织染色平台上染色的血涂片上的met fish染色的实例。
47.图32:一种快速周转测定设计,用以确定疾病预后。
48.图33:在自动化组织染色平台上进行染色的pax5和cd3标志物的荧光双染色。
49.图34:在自动化组织染色平台上进行染色的pax5和cd3标志物的显色双染色。
具体实施方式
50.i.定义
51.除非另外定义,否则本文所用的科学技术术语具有如本领域的普通技术人员通常理解的相同意义。参见例如,lackie,dictionary of cell and molecular biology,elsevier(第4版.2007);sambrook等人,molecular cloning,a laboratory manual,cold springs harbor press(cold springs harbor,n.y.1989)。术语“一个”或“一种”旨在表示“一个或多个/一种或多种。”在列举步骤或要素之前,术语“包括”、“包含”和“含有”旨在表示添加进一步的步骤或要素是任选的,而非排除性的。除非另有说明,否则本文所述的所有ph值均为如buck等人所述的在25℃测得的ph值。
52.亲和力测定:一种过程,该过程涉及通过以某种方式将生物标志物特异性试剂与样品内的生物标志物结合而对细胞样品中的生物标志物进行染色,该方式是在样品上将可检测部分沉积在与其结合的生物标志物特异性试剂附近,从而使含有生物标志物的样品区域可通过显微镜被检测到。实例包括免疫组织化学(ihc)法、免疫细胞化学(icc)法、显色原位杂交(cish)、荧光原位杂交(fish)和银染原位杂交(sish)。
53.亲和酶促反应:一种亲和力测定法,其中生物标志物特异性试剂将一种酶(诸如过氧化物酶或磷酸酶)定位到含有生物标志物的样品区域,并使一组检测试剂与该酶反应以在该样品上沉积染料。
54.抗体:本文的术语“抗体”以最广泛的含义使用,并且包括各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出所需的抗原结合活性即可。
55.抗体片段:“抗体片段”是指除了完整抗体以外的分子,其包含完整抗体的一部分且结合完整抗体结合的抗原。抗体片段的实例包括但不限于fv、fab、fab
′
、fab
′‑
sh、f(ab
′
)2;双体抗体;线性抗体;单链抗体分子(例如,scfv);以及由抗体片段形成的多特异性抗体。
56.生物标志物:如本文所用,术语“生物标志物”应指在生物样品中发现的任何分子或分子组,所述任何分子或分子组可用于表征生物样品或从中获得生物样品的受试者。例如,生物标志物可以是一种分子或分子组,其存在、缺失或相对丰度为:特定细胞或组织类型或状态的特征;和/或特定病理状况或状态的特征;和/或指示病理状况的严重程度、病理状况进展或消退的可能性、和/或病理状况将对特定治疗有应答的可能性。作为另一实例,生物标志物可为细胞类型或微生物(诸如细菌、分枝杆菌、真菌、病毒等),或者取代基分子或其分子的组。
57.生物标志物特异性试剂:一种能够直接与细胞样品中的生物标志物特异性地结合的特异性检测试剂。实例包括与样品的生物标志物免疫反应的一级抗体以及与样品的核酸生物标志物互补的核酸杂交探针。
58.明场标记:一种可检测部分,其适于明场显微术的细胞样品染色。实例包括显色染料、金相染料和含发色团的染料,它们能够从不附着于细胞样品的物种转变为能够附着于细胞样品的物种(诸如dab)。
59.细胞样品:如本文所用,术语“细胞样品”是指任何含有完整细胞的样品,诸如细胞培养物、体液样品或手术样品,采集该细胞样品以用于病理、组织学或细胞学解释。
60.可检测部分:可产生可检测信号(诸如视觉、电子或其他方式)的分子或材料,该可
检测信号指示沉积在样品上的可检测部分的存在(即定性分析)和/或浓度(即定量分析)。可检测信号可由任何已知或尚未发现的机制生成,该机制包括光子(包括射频、微波频率、红外频率、可见频率和紫外频率光子)的吸收、发射和/或散射。术语“可检测部分”包括显色、荧光、磷光和发光分子和材料,将一种物质转化为另一种物质以提供可检测差异(诸如通过将无色物质转化为有色物质,反之亦然,或者通过产生沉淀或增加样品浊度)的催化剂(诸如酶)。在一些实例中,可检测部分为荧光团,该荧光团属于若干常见化学类别,其包括香豆素、荧光素(或荧光素衍生物和类似物)、罗丹明、试卤灵、发光团和花菁。荧光分子的额外实例可参见molecular probes handbook—a guide to fluorescent probes and labeling technologies,molecular probes,eugene,or,thermofisher scientific,第11版。在其他实施例中,可检测部分为可经由明场显微术检测的分子,诸如包括二氨基联苯胺(dab)、4
‑
(二甲基氨基)偶氮苯
‑4′‑
磺酰胺(dabsyl)、四甲基罗丹明(discovery purple)、n,n
′‑
双羧基戊基
‑
5,5
′‑
二磺酸根基
‑
吲哚二碳菁(cy5)和罗丹明110(rhodamine)的染料。在其他实例中,可检测部分是纳米粒子,诸如金纳米粒子或银纳米粒子。其他可检测部分也存在或将来可能被开发,并应考虑在“可检测部分”的范围内。
61.检测试剂:“检测试剂”为用于在结合至细胞样品的生物标志物特异性试剂的附近沉积染色剂的任何试剂。非限制性实例包括二级检测试剂(诸如能够与一级抗体结合的二级抗体)、三级检测试剂(诸如能够与二级抗体结合的三级抗体)、与生物标志物特异性试剂直接或间接相关联的酶、与此类酶反应以影响荧光或显色染色剂的沉积的化学物质、在染色步骤之间使用的洗涤试剂等。
62.荧光标记:一种可检测部分,其适于荧光显微术的生物标志物染色。实例包括荧光和磷光染料以及纳米材料(诸如量子点)。
63.免疫酶测定:一种亲和酶测定法,其中生物标志物特异性试剂为抗体。
64.单克隆抗体:从基本上同质的抗体群体获得的抗体,即,除了可能的变异抗体(例如,包含天然存在的突变或在单克隆抗体制剂的生产过程中产生,此类变体通常以微量存在)之外,包括该群体的各个抗体是相同的和/或结合相同的表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂中的每种单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆”表示抗体的特征是从基本上同质的抗体群体获得的,并且不应解释为需要通过任何特定方法产生抗体。例如,根据本发明使用的单克隆抗体可通过多种技术制备,包括但不限于杂交瘤方法、重组dna方法、噬菌体展示方法,以及利用包含全部或部分人免疫球蛋白基因座的转基因动物的方法或它们的组合。
65.多重染色:一种亲和力测定法,其中将与不同生物标志物结合的多种生物标志物特异性试剂施加于单个切片并用不同颜色的染色剂进行染色。
66.romanowsky型染色剂:一种用于对细胞学样品进行染色的异染性染色剂,其中该染色剂包括阳离子噻嗪类染料(诸如多色亚甲基蓝、天青a、天青b、天青c、天青iv、sym
‑
二甲基硫堇、硫堇、亚甲基紫bernsthen、甲基硫堇、甲苯胺蓝以及它们的组合)和阴离子卤代荧光素染料(诸如曙红a、曙红y、曙红g及它们的组合)。
67.样品:如本文所用,术语“样品”应指从能够被测试生物标志物的存在或不存在的受试者获得的任何材料。
68.二级检测试剂:能够与生物标志物特异性试剂特异性地结合的特异性检测试剂。
69.单一染色:一种亲和力测定法,其中施加于样品的每种生物标志物特异性试剂都用相同的染色剂进行染色。
70.特异性检测试剂:任何能够与在细胞样品的背景下的靶标化学结构特异性地结合的物质组合物。如本文所用,术语“特异性结合”、“特异性地结合”或“具有特异性”或其他类似迭代是指介于靶标与特异性检测试剂之间的可测量和可再现的相互作用,在存在分子(包括生物分子)的异质群体的存在下,其确定靶标的存在。例如,与靶标特异性地结合的抗体为与其结合至其他靶标相比具有更大亲和力、亲合力、更容易和/或持续时间更长的结合该靶标的抗体。在一个实施例中,特异性检测试剂与无关靶标的结合程度小于所测得的抗体与靶标的结合(例如通过放射性免疫测定(ria))的约10%。在某些实施例中,与靶标特异性地结合的生物标志物特异性试剂的解离常数(kd)≤1μm、≤100nm、≤10nm、≤1nm或≤0.1nm。在另一实施例中,特异性结合可以包括但不要求排他结合。示例性的特异性检测试剂包括:对特定核苷酸序列具有特异性的核酸探针;抗体及其抗原结合片段;以及工程化特异性结合组合物,包括adnectin(基于第10fn3纤连蛋白的支架;bristol
‑
myers
‑
squibb co.)、affibody(基于来自金黄色葡萄球菌(s.aureus)的蛋白a的z结构域的支架;affibody ab,solna,sweden)、avimer(基于结构域a/ldl受体的支架;amgen,thousand oaks,ca)、dab(基于vh或vl抗体结构域的支架;glaxosmithkline plc,cambridge,uk)、darpin(基于锚蛋白重复序列蛋白的支架;molecular partners ag,z
ü
rich,ch)、anticalin(基于脂质运载蛋白的支架;pieris ag,freising,de)、nanobody(基于vhh(骆驼科ig)的支架;ablynx n/v,ghent,be)、trans
‑
body(基于转铁蛋白的支架;pfizer inc.,new york,ny)、smip(emergent biosolutions,inc.,rockville,md)以及tetranectin(基于c型凝集素结构域(ctld)的支架,四联凝集素;borean pharma a/s,aarhus,dk)。由wurch等人,development of novel protein scaffolds as alternatives to whole antibodies for imaging and therapy:status on discovery research and clinical validation,current pharmaceutical biotechnology,第9卷,第502
‑
509页(2008)对此类工程化特异性结合结构的描述进行综述,其内容通过引用并入。
71.染色/染色剂(stain):当用作名词时,术语“染色剂(stain)”应指可用于使细胞样品中的特定分子或结构可视化以用于显微分析的任何物质,该显微分析包括明场显微术、荧光显微术、电子显微术等。当用作动词时,术语“染色(stain)”应指导致染色剂在细胞样品上沉积的任何过程。
72.受试者:如本文所用,术语“受试者”或“个体”为哺乳动物。哺乳动物包括但不限于驯养的动物(例如牛、绵羊、猫、犬和马)、灵长类动物(例如人和非人灵长类动物,诸如猴)、兔以及啮齿类动物(例如小鼠和大鼠)。
73.ii.对romanowsky型染色的样品进行亲和染色的方法
74.令人惊讶的是,可以在自动化高级染色系统上直接对romanowsky型染色的样品执行生物标志物亲和染色。图1中示出了对romanowsky型染色的样品进行亲和染色的示例性工作流程。在一定的温度及一段时间内,在自动化高级染色系统100上使romanowsky型染色的样品101与第一溶液110接触,该温度和时间使得样品至少部分地脱色。在一些实施例中,第一溶液110是细胞前处理溶液。在一些实施例中,第一溶液110是细胞前处理溶液,并且在对表位修复以及使样品的至少部分地脱色均有影响的条件下使样品与细胞前处理溶液接
触。如果需要,使样品与一种或多种额外溶液111进一步接触以获得完全脱色的样品102。然后,用一组或多组生物标志物特异性试剂和检测试剂120对脱色的样品102进行亲和染色,以获得生物标志物染色的样品103。亲和染色可以是以单一形式或多重形式。
75.ii.a.romanowsky型染色的样品
76.在某一实施例中,romanowsky型染色的样品101是细胞样品,诸如组织样品或细胞学样品。在示例性实施例中,样品是福尔马林固定的、石蜡包埋的组织样品(ffpet)。在示例性实施例中,romanowsky型染色的样品101是细胞学样品。在某一实施例中,细胞学样品来自选自由以下项组成的组的样品类型:体液样品(诸如全血、骨髓、尿液、精液、唾液、痰、乳头溢液、母乳、滑液、脑脊髓液(csf)、腹水、腹膜液、心包液、胆汁、胃液、粘液、淋巴液、汗液、泪液、呕吐物、胸膜液、耳垢、鼻腔排出物或分泌物、或skene腺液),体液级分(诸如血液级分,包括血浆、血沉棕黄层和红细胞级分),细针抽吸物(诸如骨髓抽吸物),洗涤液(诸如支气管灌洗液、支气管肺泡灌洗液、鼻腔灌洗液、冲洗液或灌肠剂),以及刮片或取样刷采集的样品(诸如用刮片或取样刷从子宫颈、肛门、口腔、食道、胃或细支气管采集的样品)。
77.romanowsky型染色的样品101可以用任何romanowsky型染色剂进行染色。可以在例如bain、horobin、krafts i和kraffts ii找到关于romanowsky型染色剂的历史以及制造和使用romanowsky型染色剂的各种具体方法的概述,它们各自通过引用整体并入。在某一实施例中,romanowsky型染色剂包括天青b和曙红a或曙红y(或它们的组合)。在某一实施例中,romanowsky型染色剂选自由romanowsky染色剂、malachowski染色剂、giemsa染色剂、may
‑
gruenwald染色剂、may
‑
gruenwald
‑
giemsa(mgg)染色剂、jenner染色剂、wright染色剂、leishman染色剂和diff
‑
quick(专有的改良wright染色剂)组成的组。
78.ii.b.固体支持物
79.在某一实施例中,将romanowsky型染色的样品101沉积在固体支持物120上。通常,固体支持物120可实现为多种不同的样品载体的任何一种。样品载体可以是平面的(例如显微镜载玻片、盖玻片、板、托盘和在二维上延伸且厚度相对较薄的其他构件)。可替代地,样品载体可以是非平面的并且可实现为杯、管、小瓶和其他类似的容器,其横截面形状包括但不限于圆形、椭圆形、方形、矩形、三角形和其他多边形形状。所使用的样品载体的类型可以取决于样品类型和制备工作流程中的工艺要求。例如,为了支持组织样品,可以使用平面显微镜载玻片和盖玻片。在样品包括相对高比例的液体的情况下,具有一个或多个孔或杯的样品载体(例如,单孔或多孔样品板)可能更方便。
80.通常,样品载体用于在各个处理站承载(例如,容纳或支撑)样品。样品载体可以由多种材料构成,所述材料包括但不限于玻璃、塑料、金属以及诸如云母、石英和蓝宝石的天然材料。
81.在某些实施例中,样品载体包括一个或多个基准标记(mark,标记物)、指示剂或参考标记。这些标记可用于在自动化样品处理和制备系统的坐标系内配准样品载体的位置和/或建立与仪器无关的坐标系。在具有多个处理站的系统中,可以定位标记并将其用于确定坐标转换,可以将所述坐标转换施用于将一个处理站的坐标转换为另一处理站的坐标。
82.在某一实施例中,固体支持物120与显微评估兼容。在某一实施例中,固体支持物与明场或荧光显微术兼容,并允许目标细胞的大部分在本文所述的整个染色过程中保持粘附于固体支持物。在某一实施例中,固体支持物是显微镜载玻片。
83.ii.c自动化高级染色平台
84.romanowsky染色的载玻片的脱色和脱色的样品的亲和染色在自动化高级染色平台100上执行。自动化高级染色平台通常包括至少:用于染色方案中的各种试剂的储存器、与储存器进行流体连通以用于将试剂分配至载玻片上的试剂分配单元、用于从固体支持物上移除使用过的试剂和其他废料的废料移除系统、以及协调试剂分配单元和废料移除系统的活动的控制系统。除了执行染色步骤外,许多自动化高级染色平台还可以执行染色辅助步骤(或与执行此类辅助步骤的单独系统兼容),包括:载玻片烘烤(用于将样品粘附到载玻片上)、脱蜡(也称为脱石蜡)、抗原修复、复染、脱水和清除以及盖上盖玻片。prichard(通过引用整体并入本文)描述了自动化高级染色平台的若干具体实例及其各种特征,其包括intellipath (biocare medical)、wave(celerus diagnostics)、dako omnis和dako autostainer link 48(agilent technologies)、benchmark(ventana medical systems,inc.)、leica bond以及lab vision autostainer(thermo scientific)自动化载玻片染色仪。另外,ventana medical systems,inc.为多项美国专利的受让人,这些专利公开了用于执行自动化分析的系统和方法,其包括美国专利号5,650,327、5,654,200、6,296,809、6,352,861、6,827,901和6,943,029,以及美国已公布的专利申请号20030211630和20040052685,所述专利中的每项均通过引用整体并入本文。可商购获得的染色单元通常按以下原理中的一个进行操作:(1)开放式单个载玻片染色,其中载玻片水平定位,并且试剂作为水坑分配在包含组织样品的载玻片表面(诸如在dako autostainer link 48(agilent technologies)和intellipath(biocare medical)染色仪上实施);(2)液体覆盖技术,其中试剂受到沉积在样品上方的惰性流体层覆盖或通过沉积在样品上方的惰性流体层进行分配(诸如ventana benchmark和discovery染色仪上实施);(3)毛细管间隙染色,其中将载玻片表面放置在另一表面(可为另一载玻片或盖板)附近以创建狭窄间隙,毛细力通过该间隙使液体试剂与样品接触并加以保持(诸如由dako techmate、leica bond和dako omnis染色仪使用的染色原理)。一些毛细管间隙染色的迭代不混合间隙中的流体(诸如在dako techmate和leica bond上)。在称为动态间隙染色的毛细管间隙染色的变体中,毛细力用于将样品应用到载玻片上,然后在孵育过程中,平行表面相对于另一个表面进行平移以搅动试剂,以实现试剂混合(诸如在dako omnis载玻片染色仪(agilent)上实施的染色原理)。在平移间隙染色中,一个可平移的头部定位在载玻片上方。头部的下表面与载玻片间隔足够小的第一间隙,以允许在载玻片的平移过程中从载玻片上的液体形成液体弯月面。具有小于载玻片宽度的横向尺寸的混合延伸部从可平移的头部的下表面延伸,以限定小于混合延伸部与载玻片之间的第一间隙的第二间隙。在头部的平移过程中,混合延伸部的横向尺寸足以在载玻片上的液体中生成在通常从第二间隙延伸至第一间隙的方向上的横向运动。参见wo 2011
‑
139978a1。近来有人提出使用喷墨技术在载玻片上沉积试剂。参见wo2016
‑
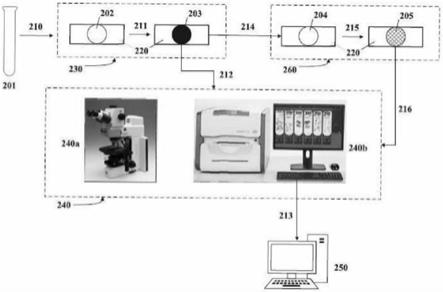
170008a1。此染色技术列表并不旨在具有全面性,并且旨在经由亲和染色的任何用于执行生物标志物染色的全自动化或半自动化系统。
85.ii.d.脱色&细胞前处理
86.将具有romanowsky型染色的样品101的固体支持物120加载到自动化载玻片染色平台100上,并使用第一溶液110和任选的额外试剂111脱色以获得完全脱色的样品102。如本文所用,“完全脱色的样品”是符合以下条件的样品:其中romanowsky型染色剂以基本上
不干扰生物标志物特异性试剂与该样品中含有的生物标志物之间的结合的水平保留在该样品上。除非另有说明或要求保护,否则使样品与第一溶液110和任选的附加溶液111接触的步骤无需以任何特定顺序执行,只要最终结果是可用于进行亲和染色的完全脱色的样品即可。在某一实施例中,在使样品与生物标志物特异性试剂接触之前获得完全脱色的样品102。
87.在某一实施例中,第一溶液110和任选的附加溶液111是除了用于脱色之外还在自动化高级染色平台100上用于某种目的的试剂。在自动化高级染色平台上具有额外效用的示例性试剂包括:细胞前处理溶液(其可用于例如抗原修复)、洗涤溶液、阻断溶液(其可用于例如阻断生物标志物特异性试剂可非特异性地结合的内源性位点)、内源性抑制剂溶液(其可用于阻断内源性酶的活性)、稀释剂等。在某一实施例中,第一溶液110和任选的额外溶液111选自由细胞前处理溶液、洗涤溶液、阻断溶液和内源性抑制剂溶液组成的组。在某一实施例中,第一溶液110包括细胞前处理溶液,而额外溶液111包括洗涤溶液。
88.在某一实施例中,作为细胞前处理步骤的一部分,对福尔马林固定的细胞样品执行脱色,其中所述细胞前处理步骤包括在第一溶液110存在下执行抗原修复,其中第一溶液是细胞前处理溶液,并在一种或多种额外溶液111存在下执行一个或多个额外的步骤。细胞前处理步骤通常通过执行表位修复过程(也称为抗原修复)来制备样品以接受生物标志物特异性试剂。示例性的表位修复过程包括:热诱导的表位修复(hier),其涉及在不同ph水平的各种溶液中加热样品(通常在80℃
‑
125℃的范围内);基于蛋白酶的表位修复(pber),其中在染色之前由蛋白水解酶消化样品;以及hier和pber的组合。由shi等人、d
′
amico等人、yamashita等人、vinod等人和warford等人对各种特异性表位修复过程进行了综述,尽管这并不详尽。是否执行待使用的表位修复以及特定形式的表位修复取决于所选择的特定生物标志物特异性试剂,并且可能需要对所使用的每种生物标志物特异性试剂进行经验性确定。
89.在某一实施例中,细胞前处理溶液是与hier兼容的碱性细胞前处理溶液,例如,具有在约ph 8至约ph 10的范围内的ph。碱性细胞前处理溶液的示例性类型包括基于乙二胺四乙酸(“edta”)的溶液、基于三(羟甲基)氨基甲烷(“tris”)的溶液、基于edta/tris的溶液以及基于tris缓冲盐水的溶液。示例性可商购获得的碱性细胞前处理溶液包括ventana细胞前处理溶液1(cc1),它是ph为8.5的基于tris的溶液(roche);envision flex target retrieval,高ph(agilent),它是ph为9的基于tris/edta的溶液;ebioscience
tm ihc抗原修复溶液
‑
高ph(thermofisher),它是ph为9的基于tris/edta的溶液;bond表位修复溶液2(leica biosystems),它是ph为8.9
‑
9.1的基于edta的溶液;bond novocastra
tm
表位修复溶液ph8,它是ph为8的基于edta的溶液;以及bond novocastra
tm
表位修复溶液ph 9,它是ph为9的基于tris/edta的溶液。
90.在另一实施例中,细胞前处理溶液是与hier兼容的酸性细胞前处理溶液,例如,具有在约ph 1至约ph 6.5的范围内的ph。在一些实施例中,酸性细胞前处理溶液是弱酸性的,在约ph 5至约ph 6.5的范围内。弱酸性hier细胞前处理溶液的示例性类型包括基于柠檬酸盐的细胞前处理溶液和柠檬酸盐
‑
edta细胞前处理溶液。示例性可商购获得的酸性细胞前处理溶液包括ventana ultra细胞前处理溶液2(cc2),它是ph为6的基于柠檬酸盐的溶液(roche,另见us 6,855,552);envision flex target retrieval,高ph(agilent),它是ph
为6.1的基于柠檬酸盐的溶液;ebioscience
tm ihc抗原修复溶液
‑
低ph(thermofisher),它是ph为6的基于柠檬酸盐的溶液;bond表位修复溶液2(leica biosystems),它是ph为6.0的基于柠檬酸盐的溶液;bond novocastra
tm
表位修复溶液ph 6,它是ph为6的基于柠檬酸盐的溶液。
91.在某一实施例中,细胞前处理步骤111包括一个或多个洗涤步骤,其中一种或多种额外溶液111的至少一种包括洗涤溶液。洗涤步骤可以在细胞前处理步骤的任何前述过程之前和/或之后,通过施加和然后去除一次或多次的洗涤溶液执行。洗涤溶液通常为缓冲盐水溶液,其还可含有少量的洗涤剂。示例性洗涤溶液包括例如磷酸盐缓冲盐水(pbs)、pbs
‑
tween20(聚山梨醇酯20)、tris缓冲盐水(tbs)、tbs
‑
tween20、tris
‑
hcl、tris
‑
hc
‑
tween20、磷酸盐溶液(pb)、ap溶液等。在某一具体实施例中,细胞前处理步骤包括hier,之后是一个或多个洗涤步骤。在某一具体实施例中,细胞前处理步骤包括使用碱性细胞前处理溶液的hier,之后是一个或多个洗涤步骤。在另一具体实施例中,细胞前处理步骤包括使用酸性细胞前处理溶液的hier,之后是一个或多个洗涤步骤。在某一具体实施例中,细胞前处理步骤包括pber,之后是一个或多个洗涤步骤。在某一具体实施例中,细胞前处理步骤包括使用碱性细胞前处理溶液的pber,之后是一个或多个洗涤步骤。在另一具体实施例中,细胞前处理步骤包括使用酸性细胞前处理溶液的pber,之后是一个或多个洗涤步骤。
92.在某一实施例中,细胞前处理步骤111进一步包括阻断内源性蛋白质的活性的步骤(本文称为“内源性抑制步骤”),其中一种或多种额外溶液111中的至少一种进一步包含抑制剂。例如,在检测试剂取决于生物素和生物素结合蛋白的情况下,可能有必要使用例如游离的、未标记的生物素结合蛋白来阻断内源性生物素。同样,许多检测方案依赖于酶的活性,该酶包括磷酸酶和过氧化物酶,这需要中和具有类似活性的内源性酶。用于这样执行此类抑制过程的试剂盒是可商购获得的,例如,内源性生物素阻断试剂盒(目录号e21390,thermofisher scientific)、内源性亲和素/生物素阻断试剂盒(目录号ab64212,abcam,plc.)、内源性生物素阻断试剂盒目录号760
‑
050,ventana medical systems,inc.)、过氧化氢阻断试剂(目录号ab64218,abcam plc.)、过氧化物酶和碱性磷酸酶阻断试剂(代码s2003,agilent technologies)等。
93.在某一实施例中,细胞前处理步骤进一步包括阻断生物标志物特异性试剂可能非特异性地结合的样品上的位点的步骤(在本文中称为“阻断步骤”),其中一种或多种额外溶液111包含阻断剂。常见的阻断剂包括正常血清、脱脂奶粉、bsa(牛血清白蛋白)和明胶的缓冲溶液,以及可商购获得的阻断剂,诸如ebioscience
tm
免疫酶/icc阻断溶液
‑
高蛋白(目录号00
‑
4952
‑
54,thermofisher scientific)、ebioscience
tm
免疫酶/icc阻断溶液
‑
低蛋白(目录号00
‑
4953
‑
54,thermofisher scientific)、discovery抗体阻断剂(目录号760
‑
4204,ventana medical systems,inc.)等。
94.ii.e.单一和多重亲和染色
95.在某一实施例中,通过单一方法对脱色的样品102进行亲和染色以获得单一染色的生物标志物染色的样品103。在某一实施例中,单一方法包括使脱色的样品102与一组生物标志物特异性试剂和检测试剂112反应,这导致在目标生物标志物附近具有荧光标记或明场标记的生物标志物染色的样品103。在某一实施例中,单一方法用于根据表1的样品类型中的生物标志物:
[0096][0097]
[0098]
表1
[0099]
在一些实施例中,生物标志物特异性试剂和检测试剂112以多重染色方法进行施加。
[0100]
在多重方法中,生物标志物特异性试剂和检测试剂112以允许对不同生物标志物进行差异性标记的方式进行施加。一种完成不同生物标志物的差异标记的方法是选择生物标志物特异性试剂和检测试剂112的组合,这些组合不会导致不同生物标志物特异性试剂或检测试剂之间的脱靶交叉反应性(称为“组合染色”)。例如,在使用二级检测试剂的情况下,每种二级检测试剂能够与在切片上使用的生物标志物特异性试剂的仅一种结合。例如,可以选择衍生自不同动物物种(诸如小鼠、兔、大鼠和山羊抗体)的一级抗体,在这种情况下,可以使用物种特异性的二级抗体。作为另一实例,每种一级抗体或核酸原位杂交探针可包括不同的半抗原或表位标签,并且选择二级特异性检测试剂(诸如二级抗体)以与半抗原或表位标签特异性结合。另外,每组检测试剂应适于在切片上沉积不同的可检测实体,诸如通过在每种生物标志物特异性试剂附近沉积不同的酶或不同的荧光实体。在us 8,603,765中示出了此类布置的实例。此类布置具有潜在的优点,即能够使每组生物标志物特异性试剂和相关的特异性结合试剂同时存在于样品上和/或用生物标志物特异性试剂和检测试剂的混合物执行染色,从而减少了染色步骤的数量。然而,由于试剂可能与不同的酶交叉反应,并且各种抗体可能彼此交叉反应,导致异常染色,因此此类布置可能并不总是可行的。
[0101]
完成不同生物标志物的差异标记的另一方法是依次对每种生物标志物进行样品染色。在此类实施例中,使第一生物标志物特异性试剂与切片反应,之后将二级检测试剂与第一生物标志物特异性试剂和其他检测试剂反应,导致第一可检测实体的沉积。然后对切片进行处理,以从切片中去除生物标志物特异性试剂和相关的检测试剂,同时将已沉积的染色留在原处。对随后的生物标志物特异性试剂重复该过程。在从样品中洗脱生物标志物特异性试剂和相关的检测试剂的溶液的存在下,通过加热样品除去生物标志物特异性试剂和相关的检测试剂,同时保留沉积的染料的方法的实例(称为“热灭活法”),诸如stack和pct/ep2016/057955所公开的方法,其内容通过引用并入本文。
[0102]
如本领域技术人员将理解的,可以将组合染色法和顺序染色法进行组合。例如,在只有一部分生物标志物特异性试剂与组合染色兼容的情况下,可以修饰顺序染色法,其中使用组合染色法将与组合染色兼容的生物标志物特异性试剂施加于样品,并且其余的生物标志物特异性试剂采用顺序染色法进行施加。
[0103]
在一些实施例中,多重方法是荧光多重方法。在一些实施例中,多重方法是明场多重方法。表2列出了可用于多重染色的示例性生物标志物组合。
[0104][0105]
表2
[0106]
在某一实施例中,一组生物标志物特异性试剂和检测试剂112包括根据表2的组合执行荧光多重法的试剂。
[0107]
ii.f.生物标志物特异性试剂和检测试剂
[0108]
通过使脱色的样品102与生物标志物特异性试剂和一组检测试剂112反应来实现
单一和多重两者的样品的染色,导致在样品上可检测部分沉积在样品内含有的生物标志物附近。
[0109]
在一些实施例中,可检测部分与生物标志物特异性试剂直接缀合,因此在生物标志物特异性试剂与其靶标结合时沉积在样品上(通常称为直接标记方法)。直接标记法通常是更直接地可量化的,但可能对应用(application,应用程序)没有足够的敏感性。
[0110]
在其他实施例中,可检测部分的沉积通过使用与生物标志物特异性试剂缔合的二级检测试剂来实现(通常称为间接标记法)。间接标记法增加了可沉积在生物标志物特异性试剂附近的可检测部分的数量,并因此通常比直接标记法更敏感,尤其是与染料结合使用时。
[0111]
间接法的一个实例使用定位于生物标志物特异性试剂上的酶促反应来沉积可检测部分。用于此类反应的合适的酶是众所周知的,并且包括但不限于氧化还原酶、水解酶和过氧化物酶。明确包括的特定酶为辣根过氧化物酶(hrp)、碱性磷酸酶(ap)、酸性磷酸酶、葡萄糖氧化酶、β
‑
半乳糖苷酶、β
‑
葡萄糖醛酸酶和β
‑
内酰胺酶。酶可直接与生物标志物特异性试剂缀合,或者可经由标记缀合物间接与生物标志物特异性试剂相关联。如本文所用,“标记缀合物”包括:
[0112]
(a)特异性检测试剂;以及
[0113]
(b)与特异性检测试剂缀合的酶,其中酶在适当的反应条件下与生色团或荧光团、信号传导缀合物或酶活性染料反应,以实现染料的原位生成和/或染料在组织样品上的沉积。
[0114]
在非限制性实例中,标记缀合物的特异性检测试剂可为二级检测试剂(诸如与一级抗体结合的物类特异性二级抗体、与半抗原缀合性一级抗体结合的抗半抗原抗体、或与生物素化一级抗体结合的生物素结合蛋白)、三级检测试剂(诸如与二级抗体结合的物类特异性三级抗体、与半抗原缀合性二级抗体结合的抗半抗原抗体、或与生物素化二级抗体结合的生物素结合蛋白)或其他此类布置。由此,定位至样品结合的生物标志物特异性试剂的酶然后可用于多个方案中以沉积可检测部分。在一些情况下,该酶与显色化合物/底物反应。显色化合物/底物的特定非限制性实例包括4
‑
硝基苯磷酸盐(pnpp)、固红、溴氯吲哚磷酸酯(bcip)、硝基四氮唑蓝(nbt)、bcip/nbt、固红、ap橙、ap蓝、四甲基联苯胺(tmb)、2,2
′‑
联氮
‑
双
‑
[3
‑
乙基苯并噻唑啉磺酸盐](abts)、邻联茴香胺、4
‑
氯萘酚(4
‑
cn)、硝基苯基
‑
β
‑
d
‑
吡喃半乳糖苷(onpg)、邻苯二胺(opd)、5
‑
溴
‑4‑
氯
‑3‑
吲哚基
‑
β
‑
吡喃半乳糖苷(x
‑
gal)、甲基伞形酮酰
‑
β
‑
d
‑
吡喃半乳糖苷(mu
‑
gal)、对硝基苯基
‑
α
‑
d
‑
吡喃半乳糖苷(pnp)、5
‑
溴
‑4‑
氯
‑3‑
吲哚基
‑
β
‑
d
‑
葡糖苷酸(x
‑
gluc)、3
‑
氨基
‑9‑
乙基卡咔唑(aec)、品红、碘硝基氯化四氮唑蓝(int)、四唑蓝或四唑紫。
[0115]
在一些实施例中,酶可用于金相检测方案。金相检测方法包括使用酶(诸如碱性磷酸酶)与水溶性金属离子和酶的氧化还原失活底物组合。在一些实施例中,底物由酶转化为氧化还原活性剂,并且氧化还原活性剂还原金属离子,使其形成可检测沉淀。(参见例如2004年12月20日提交的美国专利申请号11/015,646,pct公开号2005/003777和美国专利申请公开号2004/0265922;所述专利中的每一项均通过引用整体并入本文)。金相检测方法包括与水溶性金属离子、氧化剂和还原剂一起使用氧化还原酶(诸如辣根过氧化物酶),再次用于形成可检测沉淀。(例如,参见美国专利号6,670,113,其通过引用整体并入本文)。在一
些实施例中,酶促作用发生在酶与染料本身之间,其中反应将染料从非结合物类转化为沉积在样品上的物类。例如,dab与过氧化物酶(诸如辣根过氧化物酶)的反应使dab氧化,使其沉淀。在其他实施例中,可检测部分经由包含潜伏反应性部分的信号传导缀合物加以沉积,该潜伏反应性部分配置为与酶反应以形成可与样品或与其他检测成分结合的反应性物类。这些反应性物类能够在其生成物的近端,即在酶附近与样品反应,但迅速转化为非反应性物类,使得信号传导缀合物并不沉积在远离酶沉积位点的位点处。潜伏反应性部分的实例包括:醌甲基化物(qm)类似物,诸如在wo2015124703a1描述的那些醌甲基化物类似物;以及酪酰胺缀合物,诸如在wo2012003476a2描述的那些酪酰胺缀合物,所述专利中的每一项均在此通过引用整体并入本文。在一些实例中,潜伏反应性部分直接与染料(诸如n,n
′‑
双羧基戊基
‑
5,5
′‑
二磺酸根基
‑
吲哚二碳菁(cy5)、4
‑
(二甲基氨基)偶氮苯
‑4′‑
磺酰胺(dabsyl)、四甲基罗丹明(disco purple)和罗丹明110(rhodamine))缀合。在其他实例中,潜伏反应性部分与特异性结合对的一个成员缀合,并且染料连接至特异性结合对的另一个成员。在其他实例中,潜伏反应性部分连接至特异性结合对的一个成员,并且酶连接至特异性结合对的另一个成员,其中酶(a)与显色底物反应以实现染料的生成,或(b)与染料反应以实现染料的沉积(诸如dab)。特异性结合对的实例包括:
[0116]
(1)连接至潜伏反应性部分的生物素或生物素衍生物(诸如脱硫生物素),以及连接至染料或连接至酶的生物素结合实体(诸如亲和素、链霉亲和素、脱糖基化亲和素(诸如neutravidin)、或在其生物素结合位点上具有硝化酪氨酸的生物素结合蛋白(诸如captavidin)),该酶与显色底物反应或与染料反应(例如,当染料为dab时,连接至生物素结合蛋白的过氧化物酶);以及
[0117]
(2)连接至潜伏反应性部分的半抗原,以及连接至染料或连接至酶的抗半抗原抗体,该酶与显色底物反应或与染料反应(例如,当染料为dab时,连接至生物素结合蛋白的过氧化物酶)。
[0118]
适用于本方法的可商购获得的检测试剂或包含检测试剂的试剂盒的非限制性实例包括:ventana ultraview检测系统(与酶缀合的二级抗体,所述酶包括hr和ap);ventana iview检测系统(生物素化的抗物类二级抗体和链霉亲和素缀合的酶);ventana optiview检测系统(optiview)(与半抗原缀合的抗物类二级抗体和与酶多聚体缀合的抗半抗原三级抗体);ventana扩增试剂盒(未缀合的二级抗体,该未缀合的二级抗体可与前述ventana检测系统中的任何一种一起使用,以扩增沉积在一级抗体结合位点处的酶的数量);ventana optiview扩增系统(与半抗原缀合的抗物类二级抗体、与酶多聚体缀合的抗半抗原三级抗体以及与相同半抗原缀合的酪酰胺。在使用中,使二级抗体与样品接触,以实现与一级抗体的结合。然后使用抗半抗原抗体孵育样品,以实现酶与二级抗体的联合。然后使用酪酰胺孵育样品,以实现额外的半抗原分子的沉积。然后使用抗半抗原抗体再次孵育样品,以实现额外的酶分子的沉积。然后使用可检测部分孵育样品以实现染料沉积);ventana discovery、discovery omnimap、discovery ultramap抗半抗原抗体、二级抗体、生色团、荧光团和染料试剂盒,上述产品中的每种均可从ventana medical systems,inc.(tucson,arizona)获得;powervision和powervision+免疫酶检测系统(直接与hr或ap聚合成携带高比率的酶比抗体的紧凑型聚合物的二级抗体);以及dako envision
tm
+系统(与二级抗体缀合的酶标记聚合物)。
[0119]
具体地包括表3中列出的生物标志物特异性试剂与检测试剂组合112的非限制性实例。
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
[0129]
[0130]
[0131]
[0132]
[0133][0134]
表3
[0135]
在具体实施例中,表3中列出的生物标志物特异性试剂和特异性检测试剂112是抗体、用于基因组原位杂交的探针或用于mrna原位杂交的探针。如本领域的普通技术人将认识到的,用于生物标志物特异性试剂中的每种的检测方案可为相同的,或可为不同的。在某一实施例中,亲和染色剂是根据表1的单一染色剂,使用根据表3的检测方案。在某一实施例中,亲和染色剂是根据表2的多重染色剂,使用组合染色和根据表3的检测方案。在某一实施例中,亲和染色剂是根据表2的多重染色剂,使用热灭活法以及根据表3的染色和检测方案。
[0136]
表4提供了可以在本方法中检测到的一些生物标志物。
[0137]
[0138][0139]
表4
[0140]
如本文所用,与表4中提及的多肽结合的蛋白质特异性生物标志物特异性试剂应意指与包括针对生物标志物反映的所列举的seq id no的多肽或包含其的蛋白质结合的生物标志物特异性试剂。如本文所用,与编码表4中提及的生物标志物的基因或mrna结合的核酸特异性生物标志物特异性试剂应意指针对生物标志物反映的能够与编码所列举的seq id no的核酸杂交的生物标志物特异性试剂。所述生物标志物的某些是2个或更多个多肽链的复合物。例如,cd3是细胞表面受体复合物,经常被用作具有t细胞谱系的细胞的定义性生物标志物。cd3复合物由4条不同的多肽链组成:cd3
‑
γ链、cd3
‑
δ链、cd3ε链和cd3
‑
ζ链。cd3
‑
γ和cd3
‑
δ各自与cd3
‑
ε形成异二聚体(εγ
‑
同二聚体和εδ
‑
异二聚体),而cd3
‑
ζ形成同二聚体(ζζ
‑
同二聚体)。在功能上,εγ
‑
同二聚体、εδ
‑
异二聚体和ζζ
‑
同二聚体与t细胞受体复合物形成信号传导复合物。如本文所用,术语“人cd3蛋白生物标志物”或“cd3”涵盖具有规范
的人序列及其维持规范序列的功能的天然变体的任何cd3
‑
γ链、cd3
‑
δ链、cd3ε链和cd3
‑
ζ链多肽;包括具有规范的人序列及其维持规范序列的功能的天然变体的cd3
‑
γ链、cd3
‑
δ链、cd3ε链和cd3
‑
ζ链多肽中的一种或多种的εγ
‑
同二聚体、εδ
‑
异二聚体和ζζ
‑
同二聚体;以及包括前述cd3同二聚体或异二聚体的一种或多种的任何信号传导复合物。如本文所用,人cd3蛋白生物标志物特异性试剂涵盖与规范cd3
‑
γ链多肽、cd3
‑
δ链多肽、cd3
‑
ε链多肽或cd3
‑
ζ链多肽内的结构(诸如表位)特异性结合的任何生物标志物特异性试剂,或与位于εγ
‑
同二聚体、εδ
‑
异二聚体或ζζ
‑
同二聚体内的结构(诸如表位)结合的任何生物标志物特异性试剂。作为另一实例,cd8是异二聚体、二硫化物连接的跨膜糖蛋白,其存在于细胞毒性抑制剂t细胞亚群、于胸腺细胞、于某些自然杀伤细胞以及存在于骨髓细胞亚群中。cd8受体的人α
‑
链和β
‑
链的示例性序列(以及其同种型和变体)可以在uniprot登录号p01732(其规范氨基酸序列在本文中以seq id no:6公开)以及p10966(其规范氨基酸序列在本文中以seq id no:24公开)中分别找到。如本文所用,术语“人cd8蛋白生物标志物”或“cd8”涵盖具有规范的人序列及其维持规范序列的功能的天然变体的任何cd8
‑
α链多肽;具有规范的人序列及其维持规范序列的功能的天然变体的任何cd8
‑
β链多肽;任何二聚体,包括具有规范的人序列及其维持规范序列的功能的天然变体的cd8
‑
α链多肽和/或具有规范的人序列及其维持规范序列的功能的天然变体的cd8
‑
β链多肽。在一些实施例中,人cd8蛋白生物标志物特异性试剂涵盖与cd8
‑
α链多肽、cd8
‑
β链多肽内的结构(诸如表位)特异性结合的任何生物标志物特异性试剂,或与位于cd8二聚体内的结构(诸如表位)结合的任何生物标志物特异性试剂。
[0141]
在某一实施例中,样品是血液样品,并且亲和染色剂是使用根据表3的检测方案的根据表1的单一染色剂,其中生物标志物特异性试剂对根据表4的蛋白质或编码根据表4的蛋白质的mrna具有特异性。在某一实施例中,样品是血液样品,亲和染色剂是使用根据表3的组合染色和检测方案的根据表2的多重染色剂,并且其中生物标志物特异性试剂对根据表4的蛋白质或编码根据表4的蛋白质的mrna具有特异性。在某一实施例中,样品是血液样品,亲和染色剂是使用根据表3的热灭活法和染色以及检测方案的根据表2的多重染色剂,并且其中生物标志物特异性试剂对根据表4的蛋白质或编码根据表4的蛋白质的mrna具有特异性。
[0142]
ii.g复染
[0143]
如果需要,可以对生物标志物染色的载玻片103进行复染,以帮助手动或自动地鉴定用于鉴定roi的形态学相关的区域。复染剂的实例包括显色核复染剂,诸如romanowsky型染色剂(染色为紫色)、苏木精(染色为蓝色至紫色)、亚甲基蓝(染色为蓝色)、甲苯胺蓝(染色为细胞核深蓝色和多糖粉红色至多糖红色)、核固红(也称为kernechtrot染料,染色为红色)和甲基绿(染色为绿色);非核显色染色剂,诸如曙红(染色为粉红色);荧光核染色剂,其包括4
′
,6
‑
二氨基
‑2‑
苯基吲哚(dapi,染色为蓝色)、碘化丙啶(染色为红色)、hoechst染色剂(染色为蓝色)、核绿dcs1(染色为绿色)、核黄(hoechst s769121,在中性ph值下染色为黄色,并且在酸性ph值下染色为蓝色)、draq5(染色为红色)、draq7(染色为红色);荧光非核染色剂,诸如荧光团标记鬼笔环肽,(对丝状肌动蛋白进行染色,颜色取决于缀合荧光团)。
[0144]
iii.用于细胞学样品的染色和分析的方法和系统
[0145]
在某一实施例中,用于对romanowsky染色的细胞学样品进行亲和染色的系统和方
法被整合到用于细胞学样品的细胞学分析和生物标志物分析的工作流程中。
[0146]
图2示出了示例性工作流程。获得细胞样品201并将210施加至固体支持物220上,以获得细胞学制片202。用romanowsky型染色剂211对细胞学制片202染色,以获得romanowsky型染色的细胞学样品203。然后将romanowsky型染色的细胞学样品203成像在成像平台240上用于形态学分析212,其可以包括人工显微评估240a和/或生成romanowsky型染色的细胞学样品203的数字图像240b。在获得数字图像的情况下,形态学分析212可以进一步包括图像分析平台250上的数字图像分析213。将固体支持物220放置在自动化高级染色平台260上,并对romanowsky型染色的细胞学样品203进行脱色步骤214,以获得完全脱色的细胞学样品204。然后用多组生物标志物特异性试剂和检测试剂215对完全脱色的细胞学样品204进行亲和染色,以获得生物标志物染色的细胞学样品205。然后针对生物标志物表达216对生物标志物染色的细胞学样品205进行评估(其可以包括人工显微评估240a和/或在扫描平台240b上生成生物标志物染色的细胞学样品205的数字图像)。在获得数字图像的情况下,生物标志物分析216可以进一步包括图像分析平台250上的数字图像分析213。
[0147]
iii.a样品
[0148]
在某一示例性实施例中,细胞样品201来自选自由以下项组成的组的样品类型:体液样品(诸如全血、骨髓、尿液、精液、唾液、痰、乳头溢液、母乳、滑液、脑脊髓液(csf)、腹水、腹膜液、心包液、胆汁、胃液、粘液、淋巴液、汗液、泪液、呕吐物、胸膜液、耳垢、鼻腔排出物或分泌物、或skene腺液),体液级分(诸如血液级分,包括血浆、血沉棕黄层和红细胞级分),细针抽吸物(诸如骨髓抽吸物),洗涤液(诸如支气管灌洗液、支气管肺泡灌洗液、鼻腔灌洗液、冲洗液或灌肠剂),以及刮片或取样刷采集的样品(诸如用刮片或取样刷从子宫颈、肛门、口腔、食道、胃或细支气管采集的样品)。
[0149]
iii.b固体支持物
[0150]
用于本方法和系统中的固体支持物220通常是与明场或荧光显微术兼容的那些固体支持物。在一些实施例中,选择固体支持物220,其保留来自细胞样品201的大部分目标细胞以在本文所述的整个染色过程中保持粘附于固体支持物220上。在某一实施例中,固体支持物220是显微镜载玻片。显微镜载玻片通常是薄的(0.085
‑
2.0mm)玻璃或塑料基底,其具有平坦的平行表面,用于附着细胞以进行分析。取决于最终用途,显微镜载玻片可以镀膜或不镀膜。更通常地,固体支持物220可实现为多种不同的样品载体中的任何一种。样品载体可以是平面的(例如显微镜载玻片、盖玻片、板、托盘和在二维上延伸且厚度相对较薄的其他构件)。可替代地,样品载体可以是非平面的并且可实现为杯、管、小瓶和其他类似的容器,其横截面形状包括但不限于圆形、椭圆形、方形、矩形、三角形和其他多边形形状。所使用的样品载体的类型可以取决于样品类型和制备工作流程中的工艺要求。例如,为了支持组织样品,可以使用平面显微镜载玻片和盖玻片。在样品包括相对高比例的液体的情况下,具有一个或多个孔或杯的样品载体(例如,单孔或多孔样品板)可能更方便。
[0151]
通常,样品载体用于在各个处理站承载(例如,容纳或支撑)样品。样品载体可以由多种材料构成,所述材料包括但不限于玻璃、塑料、金属以及诸如云母、石英和蓝宝石的天然材料。
[0152]
在某些实施例中,样品载体包括一个或多个基准标记(mark,标记物)、指示剂或参考标记。这些标记可用于在自动化样品处理和制备系统的坐标系内配准样品载体的位置
和/或建立与仪器无关的坐标系。在具有多个处理站的系统中,可以定位标记并将其用于确定坐标转换,可以将所述坐标转换施用于将一个处理站的坐标转换为另一处理站的坐标。
[0153]
iii.c获得薄层
[0154]
将细胞样品201以获得细胞学制片的方式施加到固体支持物220上。在某一实施例中,细胞学制片202是薄层细胞学制片。从细胞样品获得薄层细胞学制片的示例性方法包括细胞离心、过滤器
‑
转移、重力沉降和细胞打印。
[0155]
在细胞离心技术中,提供细胞样品201作为液体样品(诸如在载体溶液中的悬浮液或诸如体液样品),将其放置成与固体支持物220接触,然后进行离心。通过离心生成的力使细胞沉降在固体支持物220的表面上,从而形成细胞学制片202。通过细胞离心获得的薄层的品质和内容物可以通过例如在离心之前处理样品来优化,例如通过调节细胞浓度、液化或稀释粘性样品、去除沉淀物或碎片、溶解血液样品中的红细胞、固定样品等。通常参见stokes。典型的细胞离心系统包括离心室组件和转子。离心室组件通常包括固体支持物和用于承载细胞样品201的悬浮液的容器。当组装时,容器使悬浮液的表面与固体支持物220的表面接触。离心室通常可分为两类:在沉降过程中有助于去除流体的室(例如,通过在容器和固体支持物之间的界面附近放置吸收性材料)以及在整个离心过程中有助于保留液体的室(例如,通过在容器和固体支持物表面之间的界面周围放置密封件)。可在f1的stokes看到此类布置的图示,通过引用并入本文。在操作中,组装的离心室以一定的方向附接到转子,使得转子的旋转引起细胞样品201的细胞沉降在固体支持物220的表面上。示例性可商购获得的细胞离心系统包括来自thermo scientific的cytospin系统。用于执行细胞离心的示例性方案可在例如koh找到。在一些具体实施例中,样品是通过细胞离心到显微镜载玻片上来制备的。
[0156]
在过滤器
‑
转移细胞学制片技术中,使细胞样品201通过过滤器。确定过滤器中的孔的大小,以使样品中的细胞碎片和其他碎屑通过过滤器,而细胞则保留在过滤器的表面上。然后将过滤器的表面压在固体支持物的表面上,从而在固体支持物220上沉积细胞薄层以获得细胞学制片202。用于过滤器
‑
转移细胞学制片的典型系统包括过滤器(在某些情况下为一次性过滤器)以及用于使液体样品与过滤器表面接触的容器。在一些情况下,液体在重力作用下流动通过过滤器。在其他情况下,该系统包括用于向过滤器施加外力以将流体抽吸通过过滤器的装置(诸如离心机或真空)。示例性可商购获得的过滤器
‑
转移细胞学制片系统包括来自hologic(原来的cytyc corporation)的thinprep系统。在zahniser和hurley可找到用于执行过滤器
‑
转移细胞学制片技术的示例性注意事项。在一些具体实施例中,样品是通过过滤器转移到显微镜载玻片上来制备的。在一些具体实施例中,样品是通过过滤器
‑
转移法制备的宫颈细胞学样品。
[0157]
在重力沉降细胞学制片技术中,将液体细胞样品201放置在固体支持物的表面上方,并且使样品中的细胞在重力下沉降到固体支持物220的表面上,以获得细胞学制片202。用于执行重力沉降细胞学制片技术的系统通常包括至少一个室,该室可安装在固体支持物的顶部上,以将液体样品201保持在固体支持物220的表面附近。在一些情况下,还提供了由某种材料制成或涂覆有某种材料的固体支持物220,该材料改善了细胞对该固体支持物的表面的粘附性。示例性可商购获得的重力沉降细胞学制片系统包括surepath系统和prepstain系统,两者均来自bd biosystems,inc.。在一些实施例中,通过重力沉降到显微
镜载玻片上来制备样品。
[0158]
在细胞打印法中,将少量体积(例如0.1至10μl)的液体细胞样品201沉积在固体支持物220的表面上离散的位置处,并且将沉积的样品在该表面上干燥,以获得细胞学制片202。例如,液体样品201可流动通过相对于固体支持物的表面(例如,在固体支持物的表面上以平行的行或以同心圆)移动的施加器尖端,从而形成固体支持物220的表面上的具有基本上均匀的细胞分布的单层。用于执行细胞打印的示例性系统通常包括至少一个施加器尖端(该施加器尖端用于分配已知体积的液体细胞样品201)以及用于改变施加器尖端相对于固体支持物220的表面的位置的装置(例如,用于移动该尖端的装置,用于移动固体支撑物的装置,或两者)。示例性可商购获得的细胞打印系统包括roche的cobas m 511集成式血液分析仪,其各个方面在美国专利号8,815,537、9,116,087、9,217,695和9,602,777中进行了描述,其中每个专利均通过引用整体并入本文。使用细胞打印系统来生成细胞学载玻片的示例性方法可在bruegel找到。在一些具体实施例中,样品是打印在载玻片上的体液样品。在一些具体实施例中,样品是打印在载玻片上的全血样品。
[0159]
在诸如cobas m 511系统的细胞打印系统中,以液体培养基中的细胞悬浮液为特征的样品在样品载体(诸如显微镜载玻片)上进行制备以用于分析。在样品对应于全血样品或流体中的血液成分的悬浮液的情况下,细胞打印系统会在样品载体上制备细胞层。在某些实施例中,有效沉积的细胞层对应于其中细胞近似均匀地分布的单层。细胞层可包括红细胞、白细胞和血小板中的任何一者或多者。
[0160]
为了将样品沉积在样品载体上,系统可任选地稀释样品(例如,用缓冲溶液、染色剂溶液或更通常地,任何稀释剂材料),并且将稀释的样品的等分试样施加到样品载体上。施加样品后,样品内的细胞开始沉降到样品载体的表面。如果在某些条件下施加,则沉降的细胞不会重叠,而是形成所需的单层。
[0161]
通常,诸如cobas m 511集成式血液分析仪的细胞打印系统包括施加器以及支撑样品载体的载物台。当在施加器和载物台之间发生相对运动时,样品从施加器中释放。通过仔细控制施加器和载物台的相对位置(以及各种其他系统参数),可以以可再现的方式将样品施加到样品载体上。
[0162]
在一些实施例中,将样品以一系列的行的形式施加至样品载体的表面。例如,可将施加器放置在样品载体上样品区域的左上角,并且当样品从施加器中释放时,施加器和载物台在一个方向(例如x方向)上会发生相对运动,一行样品沉积到样品载体上。在该行的末尾,施加器和载物台的相对运动发生在正交方向(例如y方向)上,以开始新的样品行。单个样品行在最初施加于样品载体时的宽度可介于300微米至1000微米之间。通常,当流体从施加器流出的流速增加和/或施加器相对于载物台的平移速度减小时,行厚度(即,样品释放期间在与施加器和载物台的相对运动正交的方向上测量)增加。
[0163]
如上所述,当所施加的样品以在液体培养基中悬浮的细胞为特征时,在将细胞施加到表面后的几秒钟内,该细胞会沉降到样品载体的表面上。根据前述方法施加到样品载体上的细胞数量可以基于样品中每单位体积的细胞数量以及将样品释放到样品载体上之前的任何稀释步骤而显著变化。例如,假设以1∶3的血液:稀释剂比例分析全血,则将在载玻片上放置约900,000个红细胞、45,000个血小板和1,000个白细胞。
[0164]
对于血液样品,沉积在样品载体上的样品的显微外观类似于准备充分的血液“涂
片”的外观。然而,尽管许多手动制备的涂片通常呈楔形形状
‑
边缘处具有的细胞分布不同
‑
使用自动化细胞打印系统施加于样品载体的样品即使在边缘处也通常具有更均匀的细胞分布。此外,白细胞和红细胞的形态学通常不会改变,因为它可能出现在人工制备的血涂片中。
[0165]
在一些实施例中,在将样品施加到样品载体的表面之前将其稀释。根据样品的性质,可使用各种稀释剂,包括(但不限于)盐溶液和蛋白质溶液。盐溶液的范围从“生理盐水”(0.9n)到复杂的盐混合物,再到实际上模拟人血清中发现的所有盐的商业制剂plasmalyte。蛋白质溶液的范围可以从简单的牛白蛋白溶液到(具有选定的人血浆蛋白的商业制剂)。此类制剂可以在蛋白质浓度、缓冲液、ph、渗透压、渗透浓度、缓冲能力和各种类型的添加剂方面变化。也可以使用这些溶液的合成或“替代”版本,包括或dextran或其他多糖。可以使用其他替代品。稀释剂的一个实例是以4∶1的比例的plasmalyte加(plasmalyte:)。稀释剂的另一实例是5%白蛋白。当从全血制备样品时,可以使用2份血液对1份稀释剂的稀释液,其中稀释剂是生理性兼容的溶液,但可以使用的稀释范围为0∶1(无稀释)至10∶1(稀释剂∶血)。
[0166]
为了将样品(稀释或未稀释的)施加到样品载体上,须控制流经施加器的流体流量。通过施加器的流速、施加器在样品载体上方的高度以及施加器与样品载体之间的相对平移速度均被控制以调节样品在样品载体表面上的分布。
[0167]
如上所述,可以通过在施加器和载物台之间的相对运动期间从施加器释放样品来以行的模式将样品施加到样品载体上。更通常地,样品可以以各种不同的模式施加到样品载体上。此类模式的实例包括但不限于牛耕式模式、光栅模式、连续螺旋模式、多个同心圆模式、多个平行线模式以及蛇形模式。
[0168]
在一些实施例中,在样品包括细胞的情况下,可以将样品施加到样品载体上以形成细胞单层(例如,约一个细胞厚度的细胞层)。所施加的样品层的高度可以在小于1微米到10微米或更大的范围内。样品可以以一种连续流的形式施加,也可以以间隔开或并排甚至彼此接触的多个流的形式施加。
[0169]
在某些实施例中,从施加器分配的样品的流速可以是每秒0.1微升,而施加器相对于样品载体的表面以每秒30毫米的速度平移,高度为约5至100微米,例如15至50微米、10至15微米、20至40微米、5至15微米、约12微米。作为另一实例,当将未稀释的血液样品施加到样品载体的表面时,通过施加器的样品流速可以是大约每秒0.04微升,例如每秒0.02至0.10、0.02至0.05、或0.03至0.04微升,而施加器相对于样品载体表面的平移速度为每秒约50毫米,例如每秒10至100、20至80、30至70毫米,而施加器的高度为在样品载体表面上方10、12、14、15、20或25微米。
[0170]
某些类型的细胞(诸如红细胞)在大量存在时趋于聚集,导致堆积,这在分配的样品前几行中比在随后分配的行中更普遍,从而导致样品载体表面上细胞分布不均匀。为了减轻细胞堆叠,可以增加样品施加器相对于样品载体(即,相对于支撑样品载体的载物台)的平移速率。通常,可以使用多种技术使样品施加器相对于样品载体平移。例如,在一些实施例中,支撑样品载体的载物台是平移的,而样品施加器基本上保持固定在位置。在某些实施例中,在安装在载物台上的样品载体基本上保持固定在位置的同时,平移施加器。在一些
实施例中,施加器和载物台两者均被平移。每种前述技术均导致样品施加器相对于样品载体的平移。进一步应该理解,除非本文另外具体公开,否则“平移”施加器的引用意味着施加器相对于载物台和样品载体的相对平移,并且可以通过如下实现:通过在样品载体基本上保持固定在位置的同时平移施加器,通过在施加器基本上保持固定在位置的同时平移载物台,以及通过平移施加器和载物台两者。
[0171]
在一些实施例中,施加器与在载物台上的样品载体之间的相对平移速度可以在40mm/s至90mm/s之间(例如,在50mm/s至80mm/s之间、在60mm/s至70mm/s之间),以显著减少或消除细胞在样品载体上的堆积。
[0172]
在某些实施例中,“靶”细胞(即具有凹陷的中心苍白区的细胞)可以由在分配到样品载体的表面上后干燥太慢的红细胞在样品载体上形成。为了减少或消除靶细胞的形成以及红细胞中心苍白区形状的丧失,可以通过调节通过施加器的样品分配速率来控制细胞干燥速率。将分配速率调整到适当的高值也有助于阻止细胞堆积。在一些实施例中,例如,通过施加器的流体分配速率为0.020μl/s或更高(例如,0.030μl/s或更高、0.035μl/s或更高、0.040μl/s或更高、0.050μl/s或更高、0.060μl/s或更高、0.070μl/s或更高、0.075μl/s或更高、0.080μl/s或更高、0.090μl/s或更高、0.100μl/s或更高),以减少靶细胞的形成以及细胞在样品载体的堆积。在某些实施例中,可以使用属于以上公开的范围内的样品分配速率的范围。例如,通过施加器的样品分配速率可介于0.035μl/s至0.075μl/s之间。
[0173]
更通常地,样品分配速率和施加器的相对平移速度彼此匹配,以产生足够品质的样品。如果施加器相对于样品载体表面是以相对于样品分配速率太高的速率进行平移,则样品被从施加器“拉出”,导致在样品载体表面上样品(即细胞)的分布不均匀以及细胞的自然形状的损失(例如,苍白形状的损失)。相反,如果以相对于样品分配速率太低的速率平移施加器,则样品流体在施加器尖端附近集中(pools,形成池),这也会导致不均匀的细胞分布。因此,组合选择施加器的平移速度和样品分配速率,以确保将细胞均匀地沉积,确保他们保持其自然形状,并确保整个沉积过程在适当的短时间内发生。
[0174]
对于以行模式施加到样品载体表面的样品,可利用调整行间距(例如,通过控制在相邻行中的样品分配之间的施加器的位移)来补偿几种影响制备的样品的品质的现象。通常,随着相邻行重叠的量增加,样品载体上的样品层的均匀性增加。然而,当重叠的量增加时,在样品载体上,沉积的细胞需要更长时间来干燥,这可能导致形状失真(例如,中央苍白区的丧失和/或靶细胞的形成)。通常,可以使用介于0.20mm和0.60mm之间的行间距(例如,介于0.25mm和0.55mm之间、0.30mm和0.40mm之间)来补偿此类因素。
[0175]
样品流体的粘度不同,并且甚至特定类型的流体(诸如血液)的不同样品也可能具有不同的粘度。调整行间距可以补偿样品之间的此类差异。通常,随着样品粘度的增加,相邻行的间距增加(例如,相邻行之间的重叠程度降低),以避免形成细胞浓度明显大于非重叠区域细胞浓度的重叠区域;由于粘性较大的流体无法像粘性较小的溶液那样自由流动,因此样品载体上细胞的不均匀分布不像粘性较小的溶液那样容易分散。已经观察到,对于一般的血液样品,约0.4mm的行间距产生的行彼此相向流动并且刚好接触,从而产生高度均匀的样品。
[0176]
分配到样品载体上的样品的粘度在沉积过程中可能会变化,因此分配的前几行的粘度与最后几行的粘度有所不同。例如,如果分配的最后几行具有较低的粘度,则它们将一
起流动并比前几行重叠程度更大。为了补偿这种变化,可以在将样品分配到样品载体上的过程中调整相邻行之间的间距。例如,在分配样品期间可以增加相邻行之间的间距,使得尽管粘度不同,但是相邻行之间的重叠量保持大致相同。可以在连续的行之间以线性方式调整间距。可替代地,可以以非线性方式(例如,根据指数函数)调节间距。
[0177]
在将样品行分配到样品载体上的过程中保持“湿边缘”可能是样品沉积过程的重要方面,以确保沉积的样品均匀。“湿边缘”是指先前分配的行的边缘,该边缘最接近当前正被分配到样品载体表面上的样品行。保持“湿”边缘是指确保在沉积当前行之前,最接近当前行的先前分配的样品行的边缘没有完全干燥,因此会与当前正在分配的行一起流动,从而这些行彼此接触。通过确保前一行未完全干燥,当沉积当前行时,前一行和当前行的样品可以一起流动,从而在随后干燥样品时导致细胞在样品载体表面上的分布更加均匀。
[0178]
更通常地,保持“湿边缘”是指调节流体沉积系统的特性,以确保在分配后续样品行之前,每行样品仅干燥一定长度的时间,从而确保相继分配的行一起流动到相互接触,并且在样品分配完毕且样品干燥之后,在样品载体表面上形成在表面上相对均匀的细胞分布。因为保持“湿边缘”是确保沉积的细胞保持其形状并均匀分布的重要方面,所以行长度的调整可用于直接影响施加到基底载体的样品的品质。
[0179]
通常,调整行的长度,以使分配的样品行占据样品载体表面上可用面积的百分比。在一些实施例中,例如,样品载体表面为矩形形状,并且分配的流体行沿矩形表面较长尺寸的60%或更多(例如,70%或更多、80%或更多、90%或更多、95%或更多、99%或更多)延伸。可以在分配过程中调整行的长度,以使并非所有的样品行都具有相同的长度。例如,可以改变行长度以考虑样品沉积期间样品的组成、温度和/或湿度的变化。
[0180]
在某些实施例中,可以沿不同方向将样品行分配在样品载体的表面上。例如,为了缩短具有矩形表面的样品载体上的行长度,可以通过在平行于矩形表面的较短尺寸的方向上平移施加器来沉积样品行。更通常地,可以通过在相对于样品载体表面的平面的任何方向上平移施加器来沉积样品行。因此,例如,为了分配长度在矩形样品载体表面的短尺寸和长尺寸之间的中间长度的样品行,可以将样品行以相对于两个表面边缘成一定角度的方式分配;可以选择角度以调整连续行之间的时间延迟。
[0181]
当沿平行于矩形表面的较短尺寸的方向平移施加器时,某些行长度会提供特别有利的条件,以在样品沉积过程中保持“湿边缘”,并用于干燥沉积的样品。尤其是,当分配的样品行沿样品载体的矩形表面的较短尺寸的80%或更多(例如85%或更多、90%或更多、95%或更多)延伸时,可获得高品质的制剂(例如,细胞均匀沉积在其上并保留了细胞形态学的样品载体)。
[0182]
iii.d固定
[0183]
在某一实施例中,细胞学制片202可以是固定的或未固定的。
[0184]
在某一实施例中,固定是化学固定过程,包括起沉淀作用的固定剂和/或交联固定剂。示例性的起沉淀作用的固定剂包括醇(诸如甲醇和乙醇)、丙酮和苦味酸。示例性的交联固定剂包括醛,诸如基于戊二醛和/或基于福尔马林的溶液。用于固定的醛和常见工作浓度的实例包括:甲醛(大多数细胞样品的标准工作浓度为5
‑
10%福尔马林,尽管某些组织使用的浓度高达20%福尔马林);乙二醛(标准工作浓度为17至86mm);以及戊二醛(标准工作浓度为200mm)。表5列出了常见固定剂溶液的具体实例:
[0185][0186]
[0187]
表5
[0188]
在某一实施例中,固定剂选自表5的固定剂之一。在某一实施例中,样品用包含福尔马林的固定剂固定。在另一具体实施例中,固定剂是中性缓冲的福尔马林(nbf)。在另一实施例中,固定剂是10%nbf。在另一具体实施例中,固定剂包含甲醇。在另一实施例中,固定剂是从90%至100%的甲醇,诸如90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或无水甲醇。在另一实施例中,固定剂是从90%至100%的乙醇,诸如90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或无水乙醇。固定可能发生在样品沉积在固体表面上之前或之后。在某一实施例中,首先将细胞样品201固定,然后经由自动化细胞学制片系统230沉积在固体支持物上,以获得细胞学制片202。例如,在prepstain系统上,收集细胞样品201,然后将其放于固定剂溶液中进行运输。进入实验室后,经由密度梯度离心法富集固定的细胞样品201,并且经由重力沉降将富集的细胞样品沉积在固体支持物220上,以获得细胞学制片202。在一些实施例中,首先经由自动化细胞学制片系统230将样品沉积在固体支持物上,然后进行固定。例如,首先打印在cobas m 511平台(roche)上处理过的全血样品,风干然后固定在固体支持物上。
[0189]
iii.e薄层的romanowsky型染色
[0190]
在一些实施例中,用romanowsky型染色剂对细胞学制片202进行染色,以获得romanowsky型染色的样品204。如本文所用,术语“romanowsky型染色剂”是指一种用于对细胞学样品进行染色的异染性染色剂,其中该染色剂包括阳离子噻嗪类染料(诸如多色亚甲基蓝、天青a、天青b、天青c、天青iv、对二甲基硫堇、硫堇、亚甲基紫伯恩斯汀、甲基硫堇、甲苯胺蓝以及它们的组合)和阴离子卤代荧光素染料(诸如曙红a、曙红y、曙红g及它们的组合)。示例性romanowsky型染色剂包括原始romanowsky染色剂(即多色亚甲基蓝+曙红y)、malachowski染色剂、giemsa染色剂、may
‑
gmenwald染色剂、may
‑
gruenwald
‑
giemsa(mgg)染色剂、jenner染色剂、wright染色剂、leishman染色剂和diff
‑
quick(专有改良的wright染色剂),仅举几例。可以在例如bain、horobin、krafts i和kraffts ii找到关于romanowsky型染色剂的历史以及制造和使用romanowsky型染色剂的各种具体方法的概述。在某一实施例中,通过在醇溶剂中用包含天青b和曙红a或曙红y的romanowsky型染色剂对细胞学制片202进行染色来获得romanowsky型染色的样品203。romanowsky型染色剂可以手动施加,也可以作为自动化工作流程的一部分施加。romanowsky型染色可以在固定之前或之后执行。在一些实施例中,可以在将样品210沉积在固体支持物220上的过程中执行romanowsky型染色。在一些实施例中,romanowsky型染色被并入自动化细胞学载玻片沉积平台230中。
[0191]
作为实例,在一些实施例中,cobas m 511自动化血液分析仪可以用于对沉积在样品载体上的样品进行染色和固定。如前所论及,该系统还可用于沉积样品,并且可对多种沉积参数进行控制以确保将均匀、高品质的样品施加到样品载体上。通常,在cobas分析仪中,将样品沉积在其上的样品载体放置在具有多个集成端口的平台上方。平台可以任选地包括多个偏移(offset),以维持样品载体和平台之间的间隔。通过使流体在样品载体和平台之间的空间内循环,可将各种流体(包括染色剂、固定剂和冲洗溶液)施加到样品载体上的样品上。作为目标样品的制备工作流程的一部分,如前所论及,在将样品施加到样品载体后,在检查之前将样品固定以保留其生物学和化学结构。可用于该目的的固定剂包括用于保护生物学样品免于腐烂的化学物质,并且此类固定剂可以阻碍在样本中发生的生化反应并增
加样本的机械强度和稳定性。为了将固定剂溶液施加到样品上,泵将固定剂溶液引导通过平台表面上的一个或多个端口并进入平台和样品载体之间的空间中。固定剂溶液在空间内循环,然后通过连接到平台表面上的一个或多个额外端口的泵从空间中泵出。取决于样品类型,可使用相同或不同的固定剂溶液重复将固定剂溶液引入和去除的过程。进一步,每个固定阶段的频率和流速可依赖样品的性质而变化。固定之后,作为样品处理工作流程的一部分,可将一种或多种染色剂施加到样品上。可单独或组合施加多种不同的染色剂和染料。通常,泵将染色剂溶液引导通过平台中的一个或多个端口并进入平台和样品载体之间的空间中。染色剂溶液在空间内循环以确保与样品载体上的样品均匀接触,然后通过连接到平台上的一个或多个端口的泵将其去除。第一染色阶段之后,延迟(例如,3秒与10秒之间的延迟,诸如五秒的延迟)后可重复染色和排出阶段。而且,可以以类似的方式将额外的染色剂施加到样品上。可调整每种染色溶液的频率、延迟时间和流速,以控制将每种染色剂施加到样品上的方式。流速可在例如每秒70到140微升的范围内,或者可小于或大于该范围的外部限制(例如每秒10到500微升),前提是流速足以克服在平台和样品载体之间的空间内的染色溶液中存在的表面张力。在固定和/或染色阶段之后,在一些实施例中,可使用一种或多种冲洗溶液以从样品中去除残留的染色溶液和/或固定剂溶液。冲洗溶液可在样品处理期间(例如,与染色和/或固定阶段穿插)施加,或者随后在一个或多个冲洗阶段施加。例如,可希望从样品以及从固定阶段之间、染色阶段之间和/或固定阶段和染色阶段之间的平台和样品载体之间的空间中去除残留和/或过量的流体。可使用的冲洗溶液包括但不限于:蒸馏水;缓冲水溶液;有机溶剂;以及具有或不具有缓冲作用的水性溶剂和有机溶剂的混合物。为了冲洗样品,连接到平台表面上的一个或多个端口的泵通过该一个或多个端口将冲洗溶液递送进入平台和样品载体表面之间的空间中。冲洗溶液在空间内循环一段时间,然后通过连接到平台表面上的一个或多个额外端口的泵从空间中泵出。可以以例如每秒70微升的流速引入冲洗溶液持续例如五秒的时间。与固定和染色阶段一样,可以调整每个冲洗阶段的持续时间和流速以及冲洗阶段的数量。例如,冲洗阶段可以在所有固定阶段完成之后发生一次,而第二冲洗阶段可以在所有染色阶段完成之后发生一次。可替代地,冲洗阶段可穿插在两个或更多个固定阶段之间或两个或更多个染色阶段之间。在固定、染色和冲洗阶段的任何阶段期间,引入平台和样品载体之间空间中的溶液都可以以多种方式循环。在一些实施例中,例如,溶液/流体可以通过一个或多个平台端口以脉冲方式被引入,并通过一个或多个额外的平台端口被去除。非恒定的脉动流可以有效地起到使溶液/流体在空间内循环的作用,从而使样品区域相对均匀地暴露。在某些实施例中,可使用机械搅动来使溶液/流体在平台和样品载体之间的空间内循环。可通过调节基底载体的位置以改变基底载体与平台表面之间的间距来执行搅动。搅动可作为一个或多个搅动阶段的一部分发生,搅动阶段可与上面论及的其他样品处理阶段交错进行。为了执行搅动阶段,可将样品载体相对于平台表面垂直地从其样品处理位置移开,然后随后返回到样品处理位置。搅动阶段可发生三次,每个固定、染色和冲洗阶段之后一次。每个搅动循环和/或阶段的搅动频率和距离可根据期望的搅动程度而变化,以确保流体在平台样品载体空间中的适当循环。例如,搅动阶段内每个循环的搅动频率可介于10hz和20hz之间。可使用搅动距离(即,样品载体从样品处理位置的位移)和频率的各种组合。例如,在一些实施例中,搅动距离是5微米或更大(例如,15微米或更大,25微米或更大,50微米或更大,100微米或更大,150微米或更大,200微米或
更大,250微米或更大,300微米或更大,500微米或更大,700微米或更大,1mm或更大)。在某些实施例中,搅动距离介于35微米与350微米之间。在一些实施例中,搅动循环频率是每秒一个循环或更多(例如,每秒两个循环或更多,每秒三个循环或更多,每秒四个循环或更多,每秒五个循环或更多,每秒七个循环或更多,每秒十个循环或更多)。
[0192]
iii.f显微评估、数字成像和图像分析
[0193]
在romanowsky型染色后,通过显微镜对romanowsky型染色的样品203进行评估212。同样,在生物标志物染色后,通过显微镜对生物标志物染色的样品205进行评估216。在一些实施例中,显微评估可包括例如在扫描平台240b上扫描一个或多个样品,以产生romanowsky型染色的和/或生物标志物染色的细胞的高分辨率数字图像。在基本层面上,典型的扫描平台240b至少包括:(1)带有物镜的显微镜,(2)光源(诸如卤素、发光二极管、白光和/或多光谱的光源,具体取决于染料),(3)使载玻片周围移动的(或者使光学元件在载玻片周围移动的)制动操作装置(robotics,机器人),(4)一个或多个用于图像捕获的数码相机,(5)控制制动操作装置并操纵、管理和查看数字载玻片的计算机和相关软件。通过相机的电荷耦合装置(ccd)捕获载玻片上许多不同的x
‑
y位置(以及在一些情况下,在多个z平面上)的数字数据,并将图像合并在一起以形成整个扫描表面的合成图像。实现该目的的常用方法包括:
[0194]
(1)基于图块的扫描,其中载玻片载物台或光学元件以非常小的增量移动以捕获正方形的图像帧,这些图像帧与相邻的正方形略有重叠。然后将捕获的正方形自动地彼此匹配以构建合成图像;以及
[0195]
(2)基于行的扫描,其中载玻片载物台在采集过程中在单个轴上移动以捕获多个合成图像“条”。然后可将图像条彼此匹配以形成较大的合成图像。
[0196]
可在farahani等人的whole slide imaging in pathology:advantages,limitations,and emerging perspectives,pathology and laboratory medicine int’1,vol.7,p.23
‑
33(2015年6月)中找到各种扫描仪(荧光和明场两者)的详细概述,其内容通过引用整体并入。在一些实施例中,扫描平台是独立平台。可商购获得的载玻片扫描仪的实例包括:3dhistech pannoramic scan ii;digipath pathscope;hamamatsu nanozoomer rs、ht和xr;huron tissuescope 4000、4000xt和hs;leica scanscope at、at2、cs、fl和scn400;mikroscan d2;olympus vs120
‑
sl;omnyx vl4和vl120;perkinelmer lamina;philips ultra
‑
fast scanner;sakura finetek visiontek;unic precice 500和precice 600x;ventana iscan coreo、ventana iscan ht和ventana dp200;以及zeiss axio scan.z1。其他的示例性系统和特征可在例如wo2011
‑
049608)或在2011年9月9日提交的标题为“imaging systems,cassettes,and methods of using the same”的美国专利申请no.61/533,114中找到,其内容通过引用全部并入本文。在其他实施例中,扫描平台与自动化细胞学制片系统集成,诸如,例如cobas m 511平台(将载玻片打印、固定、染色和图像采集整合到单个自动化工作流程中(roehe))。在一些实施例中,romanowsky型染色的样品202和生物标志物染色的样品205在相同扫描平台240b上成像。在其他实施例中,romanowsky型染色的样品202和生物标志物染色的样品205在不同的扫描平台240b上成像。
[0197]
可分析通过扫描平台240b生成的图像,以在图像分析系统250上鉴定一种或多种类型的目标细胞。图像分析系统250可包括一个或多个计算装置,诸如台式计算机、便携计
算机、平板电脑、智能手机、服务器、专用计算装置或能够执行本文所述的技术和/或操作的任何其他类型的一种或多种电子装置。在一些实施例中,图像分析系统250可实现为单个装置。在其他实施例中,图像分析系统250可实现为两个或多个装置的组合,一起实现本文讨论的各种功能。例如,图像分析系统250可以包括经由一个或多个局域网和/或诸如因特网的广域网彼此可通信地耦合的一台或多台服务器计算机和一台或多台客户端计算机。图像分析系统250可包括存储器、处理器和显示器。存储器可包括任何类型的易失性或非易失性存储器的任何组合,诸如随机存取存储器(ram)、只读存储器(诸如电可擦可编程的只读存储器(eeprom)、闪存、硬盘驱动器、固态驱动器、光盘等)。处理器可包括一个或多个任何类型的处理器,诸如中央处理器(cpu)、图形处理器(gpu)、专用信号或图像处理器、现场可编程门阵列(fpga)、张量处理器(tpu)等等。可使用任何合适的技术来实现显示器,诸如lcd、led、oled、tft、等离子等。
[0198]
存储器含有在染色的样品的数字图像上由处理器实施的一组指令,以执行图像分析213。对于romanowsky型染色的样品,图像分析指令组通常包括细胞或细胞成分(即核、细胞质和/或膜)的形态学评估,以对样品中发现的细胞类型进行分类。例如,当样品是血液样品时,形态学分析可包括全血细胞计数(cbc)分析。cbc包括对每种组成细胞类型的数量的定量
‑
红细胞、白细胞(总白细胞以及嗜中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞的相对数量)和血小板(总数,以及大小范围和平均血小板体积)的数量的定量。对于生物标志物染色的样品205,图像分析213通常包括生物标志物染色的细胞的鉴定和/或细胞内生物标志物染色的定位(即核、细胞质或膜)和/或染色模式(即均质或点状)和/或染色强度(例如强、中或弱)和/或每个细胞的ish信号的数量。例如,当样品是血液样品时,图像分析213可包括根据表6评估表达一种或多种蛋白质生物标志物的细胞的染色:
[0199]
[0200][0201]
表6
[0202]
在另一实施例中,图像分析213是针对表7的一组蛋白质生物标志物染色的血液样品:
[0203]
[0204][0205]
表7
[0206]
在另一实例中,通过针对单个基因组基因座的原位杂交对样品染色,并且图像分析213包括对每个细胞的多个基因组ish信号进行计数。在另一实例中,样品是通过对单个基因组基因座和预期在其上发现基因组基因座的染色体的着丝粒区域进行原位杂交(称为双重ish测定)而染色的血液样品,并且图像分析213包括基因组ish信号和着丝粒信号之间的比率进行计数,诸如,例如her2和17号染色体着丝粒之间的比率。在另一实施例中,样品是在已知涉及染色体易位事件的基因组基因座上通过原位杂交进行染色的血液样品,其中基因组基因座的区域在染色体易位事件的断点的5
′
侧被第一可检测实体染色以及在断点的3
′
侧被第二可检测实体染色(称为ish分离测定),并且其中图像分析213包括基于1
st
和2
nd
可检测实体的共定位的易位事件的检测。parker&zhang和nickoloff等人详细讨论了与癌症有关的示例性易位事件。另外,还存在一些在线数据库来整理癌症中的不同易位事件,诸如,由wellcome sanger institute维护的cosmic数据库。
[0207]
在一些实施例中,图像分析213进一步包括在数字图像中对单独鉴定的细胞的位置进行注释。在一些实施例中,对每种生物标志物染色的细胞的位置进行注释,并且对每种生物标志物的每种细胞的状态进行注释。在一些实施例中,将该信息与在romanowsky型染色的图像中针对相同细胞获得的信息进行比较。例如,将romanowsky型染色的样品203和生
物标志物染色的样品205在相同的自动化成像平台240b上成像,其中对在romanowsky型染色的样品中的每种细胞的x
‑
y坐标进行注释,以及在生物标志物染色的样品205的图像中对相同x
‑
y坐标处的生物标志物状态进行注释。作为另一实例,将romanowsky型染色的样品203和生物标志物染色的样品205在相同的自动化成像平台240b上成像,其中图像分析系统250鉴定一种或多种具有异常形态学的细胞,并且对在romanowsky型染色的样品中的具有异常形态学的每种细胞的x
‑
y坐标进行注释,并且还对在生物标志物染色的样品205中的相同x
‑
y坐标处的生物标志物状态进行注释。用于染色的样品的自动化分析的方法和系统可以在例如blom、kumar、nickoloff、pajor和van der logt中找到。用于自动化cbc分析的软件包包括例如,bloodhound系统(与cobas m 511系统(roche)集成)和cellavision(cellavision ab,瑞典),它们使用数字形态学分析来对cbc分析的组成细胞进行鉴定和计数。可以在本发明的方法和系统中使用的其他示例性的可商购获得的图像分析软件包包括:ventana virtuoso(roche);definiens tissue studio、developer xd和image miner;以及visopharm biotopix、oncotopix和stereotopix软件包。
[0208]
iv.薄层体液样品上的诊断性工作流程以及用于执行该工作流程的系统
[0209]
在具体实施例中,提供了用于针对特定疾病状态的薄层体液样品的细胞学和生物标志物分析的工作流程。
[0210]
在某一实施例中,体液样品以薄层形式沉积到一个或多个固体支持物上。对样品中的至少一者用romanowsky型染色剂进行染色并评估细胞形态,并且针对用于对样品的一种或多种细胞进行分类的一种或多种生物标志物,对样品中的至少一者进行染色。在某一实施例中,用romanowsky型染色剂染色的样品也是针对一种或多种生物标志物而被染色的样品,所述染色可以是单一染色或多重染色。在一些实施例中,在不执行单独的脱色步骤的情况下,对romanowsky型染色的样品执行生物标志物染色。在另一实施例中,针对一种或多种生物标志物,对未染色的样品进行染色。当对多于一种的生物标志物单独进行评估时,可针对每种生物标志物提供单独的样品,或者可针对所有生物标志物以多重形式对单一打印的样品进行染色,或者可以使用单一和多重染色的打印的样品的组合。
[0211]
在具体实施例中,该方法用于鉴定血液样品中的细胞群体。在图3a和3b中示出了示例性方法。
[0212]
图3a示出了其中由病理学家评估cbc/diff结果而触发生物标志物染色的方法。在图3a中,将全血样品加载到用于生成薄层的自动化系统上301,并且将血液样品以薄层形式沉积到一个或多个固体支持物302上,其中至少一个固体支持物被形态学染色剂303(诸如,例如romanowsky型染色剂、苏木精、曙红等)染色。生成形态学染色的染色样品的数字图像并在图像分析系统上进行分析,以生成自动化全血细胞计数和差异分析(cbc/diff)304,以对样品中的至少总红细胞、白细胞和血小板进行形态学鉴定和量化。对结果进行分析305,并且如果正常,则生成包括cbc/diff结果的报告306a。如果cbc/diff异常,则对由图像分析系统鉴定的任何不规则细胞进行分类307并标记以供病理学家审查308。如果病理学家审查308指示不需要生物标志物组,则然后生成含有cbc/diff和病理学家注释的报告306b。如果在病理学家审查308之后要求了生物标志物组,则将一个或多个薄层载玻片302加载到自动化高级染色仪器上310。将单层打印的一个或多个载玻片染色以用于一个或多个生物标志物311,任选地将其数字化并在图像分析系统上进行分析,将生物标志物染色的载玻片(或
其数字化图像和/或图像分析结果)由病理学家审查312和生成含有cbc/diff结果和病理学家审查的报告306c。
[0213]
图3b示出了其中无论形态学染色的结果如何都执行生物标志物染色的方法。例如,在需要进一步表征血液成分的情况下(例如,通过使用染色剂区分白细胞、单核细胞等的类别),此类方法可能是有用的。在图3b中,将全血样品加载到用于生成薄层的自动化系统上301,并将血液样品以薄层形式沉积到一个或多个固体支持物302上。至少一层薄层用形态学染色剂303(诸如,例如,romanowsky型染色剂、苏木精、曙红等)染色,并且至少一层薄层在自动化高级染色系统上对于一种或多种生物标志物染色311,并获得染色的样品的数字图像。在一些实施例中,获得用于形态学染色剂303和生物标志物染色剂311的具有薄层的单独的固体支持物(通过302和311之间以及302和303之间的单独的实线箭头示出)。在其他实施例中,首先将固体支持物用形态学染色剂303进行染色,获取形态学染色的样品的图像(未示出),然后将相同样品用生物标志物染色剂311进行染色(通过303和311之间的指向左的虚线箭头示出)。在此类实施例中,生物标志物染色可以包括脱色步骤(诸如本公开中描述的romanowsky脱色方法),或者可以在不将样品脱色的情况下施加生物标志物特异性试剂。在其他实施例中,首先将固体支持物用生物标志物染色剂311染色,然后将其用形态学染色剂染色以获得形态学染色的303(通过311和303之间的指向右的虚线箭头示出)。在一些实施例中,形态学染色是在生物标志物染色期间施加的复染,在这种情况下,在执行形态学染色之前或之后可以获得生物标志物染色的载玻片的数字图像。在其他情况下,可以在形态学染色之前对生物标志物染色的样品311进行脱色,在这种情况下,在形态学染色之前获得生物标志物染色的样品311的数字图像。在任一种情况下,都获得了形态学染色的样品303的数字图像。将形态学染色的样品的数字图像在图像分析系统上进行分析,以生成自动化全血细胞计数和差异分析(cbc/diff)304,以对样品中的至少总红细胞、白细胞和血小板进行形态学鉴定和量化。如果cbc/diff异常,则对由图像分析系统鉴定的任何不规则细胞进行分类307。在图像分析系统上对生物标志物染色的样品的数字图像进行分析,以鉴定生物标志物染色的细胞313。在相同样品上执行生物标志物染色和形态学染色的情况下,可以将数字图像相互比较,从而可以确定形态学染色的样品中不规则细胞或其他细胞亚群的生物标志物信号。比较可以包括,例如,将图像彼此配准,或者其中图像内的x
‑
y位置彼此关联,从而鉴定两个图像内特定x
‑
y位置处的细胞。在不脱色地施加生物标志物染色剂和形态学染色剂的情况下,可以使用染色的特定照射形式同时或顺序地检测标志物的形态学和存在。然后,可以由病理学家审查308/312cbc/diff结果、系统鉴定出的任何不规则细胞以及生物标志物染色的结果。该审查可以包括例如cbc/diff结果的确认、不规则细胞的审查和/或注释、生物标志物染色的评估等。然后可以生成报告306c,包括cbc/diff结果、不规则细胞鉴定、和生物标志物染色分析和/或病理学家做的任何注释或其他标记。
[0214]
可用于从全血中生成薄层的示例性自动化系统(以下称为“样品制备系统”)包括细胞打印系统(诸如roche的cobas m 511集成血液分析仪)、楔形涂片系统(诸如sysmex sp
‑
50滑片染色仪)、细胞离心系统(诸如thermo scientific的cytospin系统)。在某一实施例中,样品制备系统是细胞打印系统。
[0215]
形态学染色可以在用于生成薄层的相同系统上执行,也可以在单独的系统上执行。例如,cobas m 511集成式血液分析仪在单个工作流程中对细胞进行沉积和染色两者。
id no:6)、cd19(seq id no:19)和cd27(seq id no:20)的共有野生型序列的生物标志物特异性试剂)来选择生物标志物组以筛查degeorge综合征。
[0223]
在另一具体实施例中,在cbc/diff指示可能存在血癌的情况下,生物标志物染色包括对用于血癌的鉴别诊断的一种或多种生物标志物的染色。例如,可以例如通过使用对pax5(seq id no:16)的共有野生型序列的生物标志物特异性试剂来选择生物标志物组以区分t细胞和b细胞淋巴瘤。在某一实施例中,对pax5染色的载玻片可以是romanowsky型染色的载玻片,或者可以是不同的打印的载玻片。在另一具体实施例中,至少一种样品用根据表9的生物标志物特异性试剂组之一的多重染色剂进行染色:
[0224][0225]
表9
[0226]
在某一实施例中,多重染色的载玻片可以是romanowsky型染色的载玻片,或者可以是不同的、未染色的打印的载玻片。对于组1,cd45鉴定所有白细胞,cd2用于鉴定外周t细胞,cd8和cd4用于表征非典型细胞群体中的t细胞的分布(分别为细胞毒性细胞和辅助细胞),cd5用于确认样品为淋巴瘤/白血病病例。组5用于将aml与all分层,其中cd7+/tdt+/pax5+细胞的存在指示all的存在,而cd34+/mpo+细胞的存在指示aml的存在。作为另一实例,生物标志物组可以包括原位杂交以检测血癌细胞(诸如在慢性淋巴细胞性白血病(cll)细胞)中的染色体变化。在cll中,由于tp53基因内的17p13基因座的缺失和/或一个或多个突变而导致的tp53基因缺陷与对化学免疫疗法的抗性有关,并且临床效果特别令人沮丧。基于这些理由,tp53畸变分析已被纳入常规临床诊断中,以改善患者分层并优化治疗决策。tp53畸变的预测意义在新型靶向疗法时代即b细胞受体(bcr)信号传导抑制剂和抗凋亡bcl2家族成员中具有重要意义,这是由于它们在患有tp53缺陷的患者中的功效。
[0227]
在另一具体实施例中,在cbc/diff指示可能存在心脏病症的情况下,生物标志物染色包括对用于心脏病症的鉴别诊断的一种或多种生物标志物的染色。例如,可以例如通过使用对cd38(seq id no:16)的共有野生型序列的生物标志物特异性试剂来选择生物标志物组以鉴定活化的血小板。
[0228]
在另一具体实施例中,其中cbc/diff指示可能存在微生物引起的疾病,并且其中生物标志物染色包括针对可用于潜在的微生物引起的疾病的鉴别诊断的一种或多种生物标志物进行染色,所述潜在的微生物引起的疾病诸如细菌性疾病、分枝杆菌病、病毒性疾病和寄生虫病。
[0229]
在另一具体实施例中,其中cbc/diff指示可能的败血症,并且其中生物标志物染色包括对可用于败血症的鉴别诊断的一种或多种生物标志物的染色。
[0230]
在另一具体实施例中,其中cbc/diff指示可能的循环肿瘤细胞,并且其中生物标
志物染色包括对可用于鉴定循环肿瘤细胞的一种或多种生物标志物的染色。
[0231]
如果将生物标志物染色的样品数字化,则可以使用扫描系统生成数字图像,诸如上文第iii.f节所述的那些。在某一实施例中,在相同的扫描平台上生成数字图像与形态学染色的样品。在进一步实施例中,在相同图像分析系统上对生物标志物染色的载玻片和形态学染色的载玻片的数字图像进行分析。在其中形态学染色的样品用于生成生物标志物染色的样品的实施例中,各个数字图像可以彼此匹配。例如,在wo/2014/140070、wo/2015/049233和wo2018/189039等中描述了使数字图像彼此匹配(也称为“配准”)的示例性方法。通过匹配生物标志物染色的图像和形态学染色的图像,图像分析系统可以显示观察到的每个不规则细胞的生物标志物信息。
[0232]
在某一实施例中,样品制备系统和/或成像系统和/或图像分析系统和/或高级染色系统被集成到单个设备或模块化系统中,从而允许全自动化或半自动化的工作流程。
[0233]
v.实施例
[0234]
实例1:使用dab检测试剂盒对正常血液打印的载玻片的白细胞群体上的单个生物标志物进行自动化染色
[0235]
以下实例说明了用于评估具有突出显示非典型细胞存在的cbc报告的打印的血液样品中生物标志物的工作流程的可行性。在典型的现有诊断工作流程中,流式细胞术用于基于血液样品来鉴定细胞群体。我们在此提出了一种快速周转的工作流程解决方案,方法是通过从标记的患者血液中打印额外的载玻片并且在具有相关生物标志物的自动化免疫酶/ish平台上执行单一免疫酶亲和测定。单重测定是一种短期操作,其大约需要3.5小时。所提出的工作流程的一个实例在图4中进行了说明。
[0236]
使用cobas m 511集成血液学系统(roche)将人类全血样品(1μl)打印在载玻片上。未染色的载玻片用nbf固定,并用romanowsky型染色剂染色。典型的载玻片包含打印在其上的红细胞、白细胞和血小板。
[0237]
[0238]
表10
[0239]
每个标志物均使用单独的载玻片。三步测定法包括目标一级抗体、标有hq半抗原的抗物种二级抗体以及作为三级抗体的抗hq hr。chromomap dab试剂盒(roche)被用于沉积二氨基联苯胺(dab)染料。chromomap dab试剂盒包括内源性过氧化物酶抑制剂、在稳定剂溶液中的dab、h2o2溶液以及硫酸铜溶液。研究设计和方案的详细信息在下表11中。
[0240][0241]
表11
[0242]
结果示于图5至图7。cd3、cd8和cd45抗体对血液中的白细胞群体进行染色。如图5至7所示,典型的免疫酶染色模式在大型圆形细胞上显示出薄膜染色。对于cd68,在细胞质区室中观察到有斑点的染色剂(图8)。为了在cbc报告后快速评估白细胞群体的数量,可以在自动化高级染色平台上使用单一dab检测试剂盒打印多个载玻片并用不同的免疫生物标志物进行染色。染色方案的周转时间为3.5hr。
[0243]
实例2:在cobas m 511血液打印的载玻片上进行单一ihc染色以鉴定疾病亚型
[0244]
cbc结果表明非典型细胞的存在需要生物标志物测试,以区分t细胞和b细胞恶性肿瘤之间是分层的第一线。在这里,我们展示了通过使用关键生物标志物进行疾病血液分层的实例。
[0245]
如实例1所述对血液载玻片进行打印。如通过cobas m 511测定评估,血液中有大量的非典型细胞。从相同的血液样品中打印新的载玻片,并在10%nbf中固定30分钟。在discovery ultra平台上进行染色,使用细胞前处理24分钟。为了鉴定异常细胞是t淋巴瘤
还是b淋巴瘤,在discovery ultra平台上对pax5(b细胞恶性肿瘤的生物标志物)执行了单一dab免疫酶测定。三步测定法包括兔抗人pax5一级抗体、抗兔hq为二级抗体、抗hq hrp为三级抗体以及chromomap dab试剂盒。研究设计和方案的详细信息在下表12中。
[0246]
参数pax5克隆sp34样品类型病血romanowsky染色/扫描是一级抗体时间32min2
nd ab/时间(min)gar
‑
hq/123
rd ab/时间(min)抗hq
‑
hrp/12chromomap dab试剂盒是苏木精时间(min)12烤蓝时间(min)4
[0247]
表12
[0248]
结果示于图9。基于阳性dab染色剂,基于结果可将血液鉴定为b细胞淋巴瘤。因此,我们已经表明,对于cbc报告表明存在非典型细胞之后的恶性亚型的快速分层,可使用单一dab检测试剂盒和自动染色仪来打印多个载玻片,并用不同的淋巴瘤生物标志物进行染色。染色方案的周转时间为3.5hr。
[0249]
实例3:通过自动化组织染色平台上的明场检测系统,重新使用romanowsky型染色的载玻片用于ihc评估
[0250]
用romanowsky型染色剂染色的血液载玻片是血液诊断的常规最终产品。我们建议使用显色检测系统在免疫酶评估中评估这些载玻片的重新使用。romanowsky型染色剂已被完全去除,并且对免疫酶染色剂没有干扰。图10示出了示例性工作流程。
[0251]
将人血液样品(1μl)打印在载玻片上。用1)甲醇或2)nbf固定正常血液打印的载玻片,并使用digimac 3染色试剂盒(roche)用romanowsky型染色剂进行染色。digimac3染色剂包由以下四(4)个单独的溶液组成,其分别施加于每个处理过的载玻片:digimac3 fix、digimac3曙红、digimac3亚甲蓝和digimac3 rinse。这些染色剂溶液的施加会产生romanowsky型染色剂,诸如通常用于全血的血液学的评估。使用ventana dp 200载玻片扫描仪对载玻片进行扫描,以鉴定白细胞群体的形态学和位置。扫描之后,使用discovery purple、discovery teal和discovery yellow检测试剂盒,将romanowsky型染色的载玻片在discovery ultra自动染色仪上重新用于cd45免疫酶染色。将细胞前处理进行16分钟。三步测定法包括一级抗体cd45、抗小鼠hq为二级抗体和抗hq hr为第三抗体。这里使用了discovery purple和discovery teal显色检测试剂盒。对于discovery yellow检测,三步测定法涉及一级抗体cd45、抗小鼠np为二级抗体和抗np
‑
ap为第三抗体。研究设计和方案的详细信息在下表13中。
[0252][0253][0254]
表13
[0255]
结果示于图11(discovery purple)、图12(discovery teal)和图13(discovery yellow)。romanowsky型染色剂已被完全冲洗掉,并且没有残留的染色剂干扰免疫酶染色。
[0256]
为了鉴定自动化染色过程的哪个部分导致样品脱色,对方案中使用的试剂评估其对romanowsky型染色的载玻片进行脱色的能力。该方案的早期阶段涉及使用cc1和多轮反应溶液(rb)进行细胞前处理的步骤。cc1包括:di水、tris(碱)、硼酸、edta(无水二钠)、tween
‑
20、proclin 950、6n hcl、6n naoh、二氧化硅纳米颗粒,并且ph为8.5。反应溶液包含di水、tris、冰乙酸、brij 35、溶胶、proclin 300和6n naoh,并且ph为7.5。为了测试这些试剂是否负责脱色,将romanowsky型染色的载玻片放在cc1中15分钟,然后进行扫描。然后将浸有cc1的载玻片置于rb中5分钟并进行扫描。如图14所示,cc1处理导致载玻片的部分脱色,而rb处理导致载玻片的完全脱色。
[0257]
因此,在自动化高级染色系统上进行细胞前处理步骤和至少一个洗涤步骤足以将romanowsky型染色剂脱色。进一步,通过在romanowsky型染色剂后重新使用相同的载玻片并保留扫描记录,给出了在生物标志物染色剂后查看相同的细胞机会。扫描仪中记录的x
‑
y坐标使得可以更容易地鉴定在细胞学分析过程中标记的任何非典型细胞。
[0258]
实例4:在正常和患病的血液打印的载玻片上对多种免疫生物标志物进行染色和成像
[0259]
在5
‑
plex多重实验方案中对用正常或患病的血液打印的载玻片针对cd3、cd4、
cd20、cd45和cd68进行染色,以评估在打印的血液载玻片上执行多重处理(multiplexing)的可行性。图15示出了示例性工作流程。表14讨论了检测到的标志物、由标志物鉴定的细胞群体以及细胞区室中每个生物标志物的染色位置。
[0260]
生物标志物染色细胞预测的位置cd3泛t细胞细胞膜cd4效应t细胞细胞膜cd20泛b细胞细胞膜cd45泛白细胞细胞膜cd68巨噬细胞细胞膜
[0261]
表14
[0262]
使用cobas m 511集成血液学系统(roche)将人血液样品(3μ l)打印在载玻片上。在romanowsky型染色剂之前,未染色的载玻片用nbf固定。典型的载玻片含有打印在其上的rbc、wbc和血小板。然后使用单个未染色的血液打印的载玻片在discovery ultra平台上执行5
‑
plex多重免疫酶染色。生物标志物克隆信息记录在表15中(roche的所有试剂):
[0263][0264]
表15
[0265]
下表16中列出了用于染色的荧光团:
[0266][0267]
表16
[0268]
dapi被用作复染。表17列出了用于5
‑
plex染色的大量试剂:
[0269]
主体roche产品编号wash(ruo)discovery950
‑
510/07311079001液体盖玻片(高温)650
‑
010/05264839001discovery cc1950
‑
500/06414575001ultra细胞前处理(ultra cc2)950
‑
223/05424542001反应溶液(10x)950
‑
300/05353955001
[0270]
表17
[0271]
表18列出了用于5
‑
plex的检测试剂:
[0272]
分配机 discovery goat ig block760
‑
6008/07988214001抑制剂,discovery760
‑
4840/0717944001qd dapi,discovery760
‑
4196/05268826001disc.omnimap抗rb hrp ruo760
‑
4311/5269679001disc.omnimap抗ms hrp ruo760
‑
4310/5269652001
[0273]
表18
[0274]
使用zeiss m2显微镜对染色的细胞进行成像,并在zeiss axio扫描仪上进行扫描。
[0275]
该测定法包括5轮相继的一级抗体染色剂,每轮之间进行热失活步骤。在20分钟的短暂细胞前处理步骤之后,将每种一级抗体孵育32分钟,并将二级抗体孵育8分钟。组中检测的抗体荧光团对为:(1)cd20:r6g(2)cd3:dcc(3)cd4:red610(4)cd68:cy5(5)cd45:fam.研究设计于表19所述。
[0276][0277]
表19
[0278]
结果示于图16。5
‑
plex测定方案成功地在单个载玻片上同时对所有5种生物标志物进行染色。白细胞群体用cd45,泛白细胞标志物(绿色)进行染色。观察到cd45与cd3(蓝色)和cd4(品红色)的不同亚群的共配准。血液中cd20染色的b细胞很少。cd45阳性泛白细胞的亚群也用cd68泛巨噬细胞生物标志物以及cd3和泛t细胞标志物两者进行染色。血液打印的载玻片上有5分之4的生物标志物染色,这为将romanowsky型染色技术与自动化染色平台结合提供了巨大的潜力。
[0279]
实例5:使用自动化染色平台上的四个不同的5
‑
plex组对cll血液中的白细胞群体进行设计和染色
[0280]
图17示出用于使用打印的血液载玻片对cbc载玻片和后续生物标志物表达进行评估的拟议工作流程。使用自动化血液载玻片打印平台打印cbc载玻片和一些额外的载玻片。当在cbc载玻片中鉴定出异常细胞时,对一种或多种额外的血液载玻片进行用于一组生物标志物的免疫酶染色。通过多重免疫酶染色,可将5种生物标志物同时在单个血液打印的载玻片上进行染色。通过在相同细胞和相同载玻片上进行免疫荧光多重处理来对多个生物标志物共配准,可通过在逐个细胞基础上进行表型评估来帮助准确进行疾病分层。进一步,通过流量报告不太可能的生物标志物共同染色的独特情况下,在同一细胞上利用免疫荧光多重处理验证的共同表达模式是对该技术的独特应用。
[0281]
为了测试该工作流程,使用cobas m 511集成血液学系统(roche)在载玻片上打印的人血液样品(1μ l)上测试了多个5
‑
plex组。在romanowsky型染色剂之前,未染色的载玻片用nbf固定。典型的载玻片含有打印在其上的rbc、wbc和血小板。
[0282]
5a.材料和设备
[0283]
此实例中使用的一级抗体记录在表20中(全部来自roche):
[0284]
[0285]
[0286][0287]
表20
[0288]
此实例中使用的荧光团记录在表21中(全部来自roche):
[0289][0290]
表21
[0291]
此实例中载玻片染色仪上使用的其他试剂记录在表22中(全部来自roche):
[0292]
试剂roche目录编号wash(ruo)discovery950
‑
510/07311079001液体盖玻片(高温)650
‑
010/05264839001discovery cc 1950
‑
500/06414575001ultra细胞前处理(ultra cc2)950
‑
223/05424542001反应溶液(10x)950
‑
300/05353955001discovery goat ig block760
‑
6008/07988214001抑制剂,discovery760
‑
4840/0717944001qd dapi,discovery760
‑
4196/05268826001disc.omnimap抗rb hrp ruo760
‑
4311/5269679001disc.omnimap抗ms hrp ruo760
‑
4310/5269652001
[0293]
表22
[0294]
使用zeiss m2显微镜对染色的细胞进行成像。
[0295]
5b.组设计
[0296]
同时将多个细胞群体在血液打印的载玻片上进行染色,以鉴定非典型细胞和疾病阶段。将患者血液打印并在cobas m 511血液分析仪上进行分析,以获取cbc报告。当cbc结果表明存在非典型细胞时,通过ihc对血液样品进一步测试。使用benchmark ultra自动染色仪对四个不同的组进行染色,每个组均由5种生物标志物+dapi复染物组成。不同的白细胞和淋巴瘤生物标志物有助于鉴定疾病血液样品的状态。
[0297]
如表23所示,对四种不同的5
‑
plex组的组合进行评估:
[0298][0299]
表23
[0300]
5c.组1:cd5、cd2、cd8、cd4和cd45
[0301]5‑
plex组#1涉及5种生物标志物的荧光多重染色:cd5、cd2、cd8、cd4和cd45。下表24讨论了通过ihc鉴定的细胞群体以及细胞区室中的染色位置。cd5阳性细胞的存在{橙色}指示慢性淋巴细胞白血病(cll)血液样品。
[0302][0303]
表24
[0304]
将血液打印的载玻片在10%nbf中固定30分钟。自动染色仪中的这些载玻片上不需要去石蜡步骤。该测定法涉及5轮相继的一级抗体染色剂,每轮之间进行热失活步骤。在20分钟的短暂细胞前处理步骤之后,将每种一级抗体孵育32分钟,并将二级抗体孵育8分钟。第1组中测试的抗体荧光团对为:(1)cd5:r6g(2)cd8:dcc(3)cd2:red610(4)cd4:cy5(5)cd45:fam.研究设计于表25所述。
[0305]
表25:组1的研究设计
[0306][0307]
示例性的染色剂可见于图18。5
‑
plex测定方案成功地在单个载玻片上同时对所有5种生物标志物进行染色。白细胞群体用cd45,泛白细胞标志物(绿色)进行染色。观察到cd45与cd8(浅绿色)和cd4(品红色)的不同亚群的共配准。载玻片上高百分比的cd5阳性细胞(橙色)的染色表明慢性淋巴细胞性白血病(cll)血液样品为阳性。所有cd5阳性细胞与cd45细胞共配准。一些cd45和cd5细胞也与对所有外周血t细胞染色的cd2(红色)进行共同染色。第1组涉及cd5、cd2、cd8、cd4和cd45生物标志物的多重染色。该组鉴定了血液打印的载玻片中非典型细胞群体中的免疫细胞分布(cd8和cd4)。组中包括cd5。cd5在慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(cll/sll)和套细胞淋巴瘤(mcl)中表达。大量的cd5阳性细胞(橙色)表明血液样品为淋巴瘤/白血病病例。
[0308]
5d:组2:cd5、cd3、cd23、cd10、细胞周期蛋白d1
[0309]5‑
plex组
‑
2涉及由cd5、cd3、cd23、cd10和细胞周期蛋白d1组成的5种生物标志物的荧光多重染色。表26讨论了通过ihc鉴定的细胞群体以及细胞区室中的染色位置。
[0310]
[0311][0312]
表26
[0313]
遵循组1的染色标准,将nbf固定的血液打印的载玻片依次用5种生物标志物进行染色。组2中测试的抗体荧光团对为(1)cd5:r6g(2)cd3:dcc(3)cd23:red610(4)cd10:cy5(5)细胞周期蛋白d1:fam.研究设计在下表27中描述。
[0314][0315]
表27:组2的研究设计
[0316]
示例性的染色剂可见于图19。5
‑
plex测定方案成功地在单个载玻片上同时对所有5种生物标志物进行染色。多个细胞群体用细胞周期蛋白d1染色,细胞周期蛋白d1是鉴定b
‑
cll的关键标志物。观察到cd5(橙色)、cd10(品红色)、cd23(红色)的共配准。在各个通道中进行的密切检查表明,在相同或不同细胞上的染色方式不同。cd3阳性细胞被染成浅绿色。
[0317]
第2组涉及cd5、cd3、cd23、cd10和细胞周期蛋白d1生物标志物的多重染色。组2开启了一种新功能,即,多重处理(multiplexing)打印在载玻片上的患病血细胞。通过此类技术可以观察到独特的观察结果,例如cd5和cd10的共染色。cd5在慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(cll/sll)和套细胞淋巴瘤(mcl)中有特征性表达,而cd10在急性前体性b细胞或t细胞淋巴母细胞性白血病/淋巴瘤(all)中表达。cd5和cd10的共表达在b细胞淋巴瘤中不常见,并且具有诊断挑战性。dong等人已经报道了在b细胞淋巴瘤的各种亚型中cd5和cd10共表达的病例。载玻片上高百分比的cd5阳性细胞(橙色)染色表明淋巴瘤(cll)血液样
品呈阳性,而细胞周期蛋白d1核染色表明套细胞淋巴瘤{mcl}。已经报道了cd5阳性mcl中细胞周期蛋白d1的强烈染色{meyerson,2006}。当在同一载玻片上的相同细胞上完成多重处理时,此类共表达模式和罕见病例(al mussaed)的鉴定是可能的,这是该技术的独特应用。
[0318]
5e.组3:pax5、cd5、cd23、细胞周期蛋白d1和cd3
[0319]5‑
plex组
‑
3涉及由pax5、cd5、cd23、细胞周期蛋白d1和cd3组成的5种生物标志物的荧光多重染色。表28讨论了通过ihc鉴定的细胞群体以及细胞区室中的染色位置。
[0320][0321]
表28
[0322]
用romanowsky型染色剂将nbf固定的血液打印的载玻片染色,并在zeiss axio中捕获整个载玻片扫描。然后按照组1的染色标准,用5种生物标志物对相同的载玻片进行重新染色。组中检测的抗体:荧光团对为:(1)pax5:r6g(2)cd5:dcc(3)cd23:red610(4)细胞周期蛋白d1:cy5(5)cd3:fam.染色方案在表29中列出:
[0323][0324]
表29
[0325]
在zeiss axio扫描仪中重新扫描载玻片。使用zeiss axio拆分查看器,将来自同一位置的图像在载玻片旁放置,以进行病理学评估。
[0326]
示例性染色的载玻片在图20中。5
‑
plex测定方案成功地在单个载玻片上同时对所有5种生物标志物进行染色。大多数细胞群体都用细胞周期蛋白d1核标志物(品红色)染色,这是用于鉴定b
‑
cll的关键标志物。然而cd5阳性细胞的存在{浅绿色}指示慢性淋巴细胞白血病(cll)血液样品。观察到cd5(浅绿色)、pax5(橙色)和cd23(红色)的共配准。在fov中cd3(泛t细胞,绿色)阳性细胞与cd5(t淋巴瘤,橙色)阳性细胞共配准,表明存在t细胞淋巴瘤。另一方面,与细胞周期蛋白d1(品红色)核染色共染色的阳性pax5(橙色)细胞表明在相同血液中存在b
‑
cll。
[0327]
组3涉及pax5、cd5、cd23、细胞周期蛋白d1和cd3生物标志物的多重染色。pax5在主要用于霍奇金淋巴瘤和b细胞非霍奇金淋巴瘤的淋巴瘤的诊断和亚分类中是有价值的生物标志物。然而,pax5(b细胞标志物)与cd5(t细胞标志物)的共染色很少见,并且提示了mpal(混合表型急性白血病)并开启了该技术的额外应用。借助当前工具的可用性,血液病理学家可将急性白血病分为髓样、b淋巴样或t淋巴样谱系。然而,将5%的病例分类为起源不明确的急性白血病可能更具挑战性。它需要广泛的多参数流式细胞术和免疫表型来进行正确诊断。who现已将某些病例鉴定为混合表型的急性白血病(mpal)。porwit等人展示了一病例(#76,男,26岁),带有双(pax5/cd5)阳性细胞,并被鉴定为mpal,b/髓样{porwit,2015}。已经认识到,mpal病例的临床管理存在问题,并且重点在于准确诊断以鉴定mpal病例,而不是将其误诊为all或aml。可通过在如该组中所见的具有pax5和cd5在多个细胞中共配准的相同载玻片上使用多重染色剂来诊断此类mpal实例。steensma 2011引用了多个此类病例。
[0328]
5f.组4:cll预后组;cd3、cd5、cd38、cd23和zap
‑
70
[0329]5‑
plex组
‑
4涉及由cd3、cd5、cd38、cd23和zap
‑
70组成的5种生物标志物的荧光多重染色。表30讨论了通过ihc鉴定的细胞群体以及细胞区室中的染色位置。
[0330][0331]
表30
[0332]
遵循组1的染色标准,将nbf固定的血液打印的载玻片依次用5种生物标志物进行染色。组4中测试的抗体荧光团对为(1)cd3:r6g(2)cd5:dcc(3)cd38:red610(4)cd23:cy5
(5)以及zap
‑
70:fam.研究设计在下表31中描述。
[0333]
示例性染色的载玻片在图21中。5
‑
plex测定方案成功地在单个载玻片上同时对所有5种生物标志物进行染色。cd23阳性标志物(品红色)和cd5(浅绿色)的存在表示慢性淋巴细胞白血病(cll)血液样品。在该fov中,将多个细胞用与cd38(红色)阳性细胞共染色的zap
‑
70(绿色)进行染色。还观察到了被cd3(橙色)和cd5(浅绿色)共同染色的细胞。cd38(红色)也将血液中的活化的血小板染色,在fov中作为红点见到。
[0334][0335]
表31:组4的研究设计
[0336]
第4组涉及cd3、cd5、cd38、cd23和zap
‑
70生物标志物的多重染色。组4涉及具有预后潜力的生物标志物的选择。b细胞慢性淋巴细胞性白血病(b
‑
cll)的高度可变的临床结果从惰性转变为侵袭性,其中侵袭性结果需要立即进行强化治疗。zap
‑
70表达在更具侵袭性的临床过程中的作用已得到充分证明(roullet,admirand)。据报道,对zap
‑
70表达和cd38表达两者的评估将患者组分为预后较好或预后最差{hus,2006#13}。通过多标志物的多重处理,我们观察到cd5阳性细胞在核和zap
‑
70中表达高水平的细胞周期蛋白d1。meyerson通过流量报告了类似的结果。
[0337]
组1至4可以看出,多标志物的多重处理可以在迅速的周转时间内对患者进行分层,并有助于疾病分层。
[0338]
实例6:在自动化染色平台上用5
‑
plex组对白细胞进行设计和染色以将all与aml分层
[0339]
该实例涉及是否可以使用精心设计的5种生物标志物组对cbc打印的载玻片中报告的非典型细胞进行检测,以将all与aml分层。通过免疫荧光多重处理对相同载玻片上的不同生物标志物进行染色可能有助于在快速周转时间内对疾病亚型进行准确分层。图22示出了示例性工作流程。5
‑
plex分层组,其涉及5种生物标志物的荧光多重染色,这些生物标志物由cd7、cd34、pax5、tdt和mpo组成。下表32讨论了通过ihc鉴定的细胞群体以及细胞区室中的染色位置。
[0340]
生物标志物染色细胞预测的位置cd7t
‑
all的标志物细胞内cd34aml标志物细胞内
pax5大多数b细胞恶性肿瘤细胞内tdtt
‑
all的标志物细胞内mpo急性髓细胞性白血病的诊断细胞内
[0341]
表32
[0342]
将血液打印的载玻片在10%nbf中固定30分钟。自动染色仪中的这些载玻片上不需要去石蜡步骤。该测定法包括5轮相继的一级抗体染色剂,每轮之间进行热失活步骤。在20分钟的细胞前处理步骤之后,将每种一级抗体孵育32分钟,并将二级抗体孵育8分钟。组中检测的抗体荧光团对为:(1)cd7:r6g(2)cd34:dcc(3)pax5:red610(4)tdt:cy5(5)mpo:fam.研究设计于表33所述。
[0343][0344]
表33
[0345]5‑
plex测定方案旨在将具有非典型细胞的载玻片上的all从aml分离出来。图23是显示如何使用该工作流程将aml与all分层的流程图,以及对all和aml两者的示例性染色剂。髓过氧化物酶(mpo)是将aml与all区别的公知标志物,并表明白血病细胞源自髓系。在一些载玻片中,我们看到了mpo的强表达。另一方面,据报道大多数all病例均表达核酶末端脱氧核苷酸转移酶(tdt)(chiaretti,zini等人2014)。all可以是t
‑
all(cd34、tdt、cd7)或b
‑
all(cd34、tdt、pax
‑
5),而aml可通过cd34和mpo被鉴定。cd34是胚泡(未成熟细胞)的指示物,因此在任一种情况下都可看到。
[0346]
示例性的染色剂在图23中示出。cd7、cd34、pax5、tdt和mpo生物标志物的多重染色将all与aml分开。在某些载玻片中观察到强mpo(绿色)染色剂,并被鉴定为aml血液。在一些未显示任何mpo染色剂的载玻片中观察到cd7(橙色)与tdt(品红色)的共配准。这些载玻片被分层为all。在某些载玻片中,mpo(绿色)表达强烈,同时少数cd34阳性(红色染色剂)细胞表示aml血液。在其他载玻片上,没有mpo染色剂,但cd7(橙色)阳性细胞带有强tdt染色的(品红色)细胞。此类组合的染色剂可能是all血液。观察到pax5(红色)染色剂以及cd7和tdt,进一步将血液鉴定为b
‑
all。
[0347]
实例7:在自动化染色平台上用5
‑
plex生物标志物组对体液打印的载玻片进行设计和染色
[0348]
常规测试各种体液,例如腹膜液、滑膜液、脑脊髓液或支气管肺泡灌洗液,以鉴定炎症的根本原因。滑液分析有助于确定诸如化脓性关节炎的关节炎的根本原因。本实例测
试体液是否可以打印在载玻片上,并生成白细胞计数和分类计数。进一步,可通过亲和细胞化学染色来鉴定免疫细胞群体(t细胞、b细胞、巨噬细胞、嗜中性粒细胞)。图24示出了示例性工作流程。
[0349]
腹腔积液、滑液、脑脊髓液和支气管肺泡灌洗液的残留样品收集在红顶管中。样品等分试样的体积在2.0ml
‑
2.5ml的范围内。使用默认配置文件(cbc,diff),用cobas m 511集成血液学系统在载玻片上处理所有样品。审查载玻片的细胞结构。然后,使用特殊样品选项(special sample option)(未染色)在cobas m 511系统上处理所有样品。将未染色的载玻片在10%nbf中固定30分钟。
[0350]
7a:滑液
[0351]
在涉及5种生物标志物的荧光多重染色的滑膜样品上测试了5
‑
plex组,该生物标志物由cd3、cd8、cd45、cd68、oscar组成。在自动染色仪中的这些载玻片上无需进行脱石蜡步骤。在20分钟的短暂细胞前处理步骤之后,将每种一级抗体孵育32分钟,并将二级抗体孵育8分钟。该测定法涉及5轮相继的一级/二级抗体染色剂,每轮之间进行热失活步骤。测试的抗体荧光团对为:(1)oscar:r6g(2)cd3:dcc(3)cd8:red610(4)cd68:cy5(5)cd45:fam.研究设计于表34所述。
[0352][0353]
表34
[0354]
下表35讨论了通过免疫染色测试的细胞群体以及细胞区室中的染色位置。使用zeiss axio扫描载玻片。
[0355]
示例性染色剂在图25a和25b中。图25a是单个染色剂,而图25b是合并图像。免疫细胞如巨噬细胞、cd3阳性泛t细胞和一部分cd8阳性细胞毒性t细胞被鉴定。用cd45泛白细胞标志物对许多细胞群体进行染色(图25a)。oscar(一种细胞角蛋白抗体)没有对任何细胞染色,表明液体中不存在上皮细胞。
[0356]
[0357][0358]
表35
[0359]
7b:支气管肺泡灌洗(bal)样品
[0360]
将支气管肺泡灌洗(bal)样品打印在载玻片上,并使用测试的抗体荧光团对如上概述将载玻片染色:(1)oscar:r6g(2)cd3:dcc(3)cd8:red610(4)cd68:cy5(5)cd45:fam.图26示出在bal打印的载玻片中的细胞中看到了由cd45(绿色)、cd8(红色)和cd3(浅绿色)组成的3重合并的图像。这证明了包括用自动化高级染色系统进行染色的载玻片的工作流程可用于区分bal样品中的细胞群体。
[0361]
实例8:在自动化组织染色平台上用cd38生物标志物对血液打印的载玻片进行血小板染色
[0362]
cd38是一种跨膜蛋白,其显示涉及白细胞中的细胞粘附和信号传导的酶促活性。它在多种细胞类型中表达,包括造血前体细胞、浆细胞、生发中心b细胞(弱)、t细胞和自然杀伤细胞的亚群、红细胞、血小板、前列腺上皮细胞以及平滑和横纹肌细胞。在某些情况下,它可能是活化的标志物。cd38表达可用于淋巴增生和浆细胞增殖性疾患的诊断。通过流式细胞术确定cd38表达已被用作慢性淋巴细胞白血病的预后标志物。cd38也可用于鉴定活化的血小板,这对于血小板功能异常(遗传性或获得性疾患)的患者或对于某些具有血栓形成高风险的患者(例如心脏病或癌症患者)很有用。
[0363]
在当前实例中,我们评估了打印在载玻片上并用自动化高级染色平台染色的全血是否可用于评估血小板群体的cd38表达。图27示出了示例性工作流程。
[0364]
用cobas m 511集成血液学系统在载玻片上打印人体血液样品(1μl)。将血液打印的载玻片在10%nbf中固定30分钟,并用romanowsky染色剂进行染色。用zeiss axio载玻片扫描仪扫描romanowsky染色的载玻片。用cd38进行的单一荧光染色用于鉴定从cobas m 511血液分析仪生成的患者血液打印的载玻片中的血小板状态。将细胞前处理执行20分钟。使用抗cd38兔单克隆一级抗体、hr标记的抗兔二级抗体、花青5荧光团试剂盒(discovery cy5试剂盒)和dapi复染,以单一荧光亲和染色形式对打印的载玻片进行染色。研究设计和方案的详细信息在下表36中。
[0365]
参数cd38一级抗体克隆sp149样品类型血液romanowsky染色/扫描是一级抗体时间32min2
nd ab/时间(min)gar
‑
hrp/12mindiscovery cy5是qd
‑
dapi12
[0366]
表36
[0367]
在图28中找到示例性图像。在载玻片上看到清晰的亮红色点染色血小板。通过比
较相同载玻片的romanowsky型染色/扫描图像,证实cy5染色的点是血小板。
[0368]
该实例表明,可以将打印在载玻片上的romanowsky染色的全血样品中的血小板在自动化高级染色平台上进行亲和染色。通过在此类测定法中对cd38染色,可在载玻片上测试多种疾病的血小板分布。例如,cd38的表达已经与多种疾病相关,包括hiv感染、自身免疫疾病[例如,系统性红斑狼疮]、ii型糖尿病3、骨质疏松症和癌症。例如,cd38在多种血液系统恶性肿瘤中表达,包括多发性骨髓瘤(mm)、cl、巨球蛋白血症、原发性系统性淀粉样变性、套细胞淋巴瘤、急性淋巴细胞白血病、急性骨髓性白血病、nk细胞白血病、nk/t细胞淋巴瘤和浆细胞白血病。
[0369]
实例9:使用自动化组织染色平台在血液打印的载玻片上进行fish染色
[0370]
荧光原位杂交(fish)通常用于检测血液或骨髓细胞中的染色体变化(细胞遗传学分析)。fish有助于在显微镜下的细胞检查中鉴定可能不明显的遗传异常。在该实例中,在使用cobas m 511集成血液学系统生成的全血打印的载玻片上测试了fish测定。图29示出了示例性工作流程。
[0371]
用cobas m 511集成血液学系统在载玻片上打印人体血液样品(1μl)。将血液打印的载玻片在10%nbf中固定30分钟。在benchmark ultra平台上,使用半抗原标记的12号染色体和met探针以单一fish形式对打印的载玻片进行染色。用ish蛋白酶处理载玻片8分钟,以帮助渗透细胞膜和核膜。将洋地黄毒苷(dig)标记的12号染色体探针在正常血液载玻片上杂交6小时,然后用盐水柠檬酸钠缓冲液(ssc)进行3次严格洗涤。然后用缀合至辣根过氧化物酶(hr)的dig特异性单克隆抗体处理载玻片。罗丹明6g通过使样品与酪酰胺
‑
罗丹明6g(tsa
‑
r6g)缀合物反应20分钟而沉积。用zeiss m2系统以40x的放大倍数扫描载玻片。通过将二硝基苯基(dnp)标记的met探针杂交6小时,然后进行3次严格的ssc洗涤,在患病的cll血液打印的载玻片上重复该步骤。用缀合了hr的dnp单克隆抗体处理载玻片,并用酪酰胺
‑
fam缀合物(tsa
‑
fam)扩增60分钟。两个载玻片均用dapi进行核复染。
[0372]
方案参数在表37中:
[0373][0374]
表37
[0375]
示例性染色的载玻片在图30及seq id no:31组成的组的序列。在正常血液打印的载玻片和蓝色复染的核上观察到12号染色体的强烈橙色信号(图30)。在cll血液打印的载玻片中观察到扩增的met表达(在蓝色复染的核上显示为绿点)(图31)。
[0376]
在全血打印的载玻片上执行fish的成功开启了多个应用,包括:(1)对血液样品中增殖性疾病的诊断、预后和/或选择疗法;(2)鉴定血源性病原体;以及(3)使用骨髓或血液来监测疾病或疗法进展。
[0377]
实例10:在血液打印的载玻片上使用双重标志物染色
[0378]
血液中pax5阳性细胞的浸润表明b
‑
cll的疾病进展。为了评估cll患者中t细胞和b细胞的比率,使用荧光检测系统和显色检测系统两者测试了2种生物标志物。表38公开了组2的生物标志物信息和细胞中的染色位置:
[0379]
生物标志物染色细胞预测的位置cd3泛t细胞标志物膜pax5大多数b细胞恶性肿瘤细胞内
[0380]
表38
[0381]
图32示出了示例性工作流程。
[0382]
用cobas m 511集成血液学系统在载玻片上打印人体血液样品(1μl)。未染色的载玻片用甲醇或nbf固定。用一级抗体孵育32分钟,进行20分钟的细胞前处理。该测定法包括2轮相继的一级抗体染色剂,每轮之间进行热失活步骤。抗体/可检测的标记对为:(a)用于荧光检测:pax5/r6g和cd3/dcc双重;以及(b)用于明场检测,pax5/dab和cd3/discovery purple。使用zeiss axio扫描仪扫描整个载玻片。表39记录了荧光双重和显色双重两者的研究参数。
11,e27419。
[0406]
meyerson等人,d cyclins in cd5+ b
‑
cell lymphoproliferative disorders:cyclin d1 and cyclin d2 identify diagnostic groups and cyclin dl correlates with zap
‑
70 expression in chronic lymphocytic leukemia,am j clin pathol,2006,vol.125,issue 5,pp.241
‑
250。
[0407]
malcikova,j.,等人,eric recommendations for tp53 mutation analysis in chronic lymphocytic leukemia
‑
update on methodological approaches and results interpretation,feb.2,2018,leukemia,vol.32,issue 5,pp.1070
‑
1080。
[0408]
neklason,d.w.等人,activating mutation in met oncogene in familial colorectal cancer,bmc cancer,2011,vol.11,no.424。
[0409]
nickoloff等人,mechanisms of leukemia translocations,curr opin hematol,2008,vol.15,issue 4,pp.338
‑
345。
[0410]
pajor等人,state
‑
of
‑
the
‑
art fishing:automated analysis of cytogenetic aberrations in interphase nuclei,cytometry a,2012,volume 81a,issue 8,pp.649
‑
663。
[0411]
park等人,morphological differences between circulating tumor cells from prostate cancer patients and cultured prostate cancer cells,plos one,2014,vol.9,issue 1:e85264,https://doi.org/10.1371/journal.pone.0085264。
[0412]
parker&zhang,fusion genes in solid tumors:an emerging target for cancer diagnosis and treatment,china j.cancer,2013,vol.32,issue 11,pp.594
‑
603。
[0413]
prichard,overview of automated immunohistochemistry,arch pathol lab med.,2014,vol.138,pp.1578
‑
1582。
[0414]
schlotens等人,automated identification of circulating tumor cells by image cytometry,cytometry a,2012,vol.81,issue 2:pp.138
‑
48。
[0415]
shah,j.,等人,a dual colour fluorescence in situ hybridization(fish)assay for identifying the zoonotic malaria parasite plasmodium knowlesi with a potential application for the specific diagnosis of knowlesi malaria in peripheral
‑
level laboratories of southeast asia,parasit vectors,2017,vol.10,issue 1,pp.342。
[0416]
stack等人,multiplexed immunohistochemistry,imaging,and quantitation:a review,with an assessment of tyramide signal amplification,multispectral imaging and multiplex analysis,methods,2014,vol.70,issue 1,pp 46
‑
58。
[0417]
stokes,principles of cytocentrifugation,laboratory medicine,2004,vol.35,issue 7,pp.434
‑
437。
[0418]
van de donk,n.w.,等人,monoclonal antibodies targeting cd38 in hematological malignancies and beyond,2016,immunol rev,vol.270,issue 1,pp.95
‑
112。
[0419]
van der logt等人,fully automated fluorescent in situ hybridization
(fish)staining and digital analysis of her2 in breast cancer:a validation study,plos one,2015;vol.10,issue 4,e0123201。
[0420]
winkelman等人,a novel automated slide
‑
based technology for visualization,counting,and characterization of the formed elements of blood,arch pathol lab med,2017,vol.141,pp.1107
‑
1112。
[0421]
zahniser&hurley,automated slide preparation system for the clinical laboratory,comm.in clinical cytometry,1996,vol.26,pp.60
‑
64。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1