一种用于弧菌检测的比率型电化学传感平台及其制备方法和应用与流程
本申请涉及弧菌检测
技术领域:
,尤其涉及一种用于弧菌检测的比率型电化学传感平台及其制备方法和应用。
背景技术:
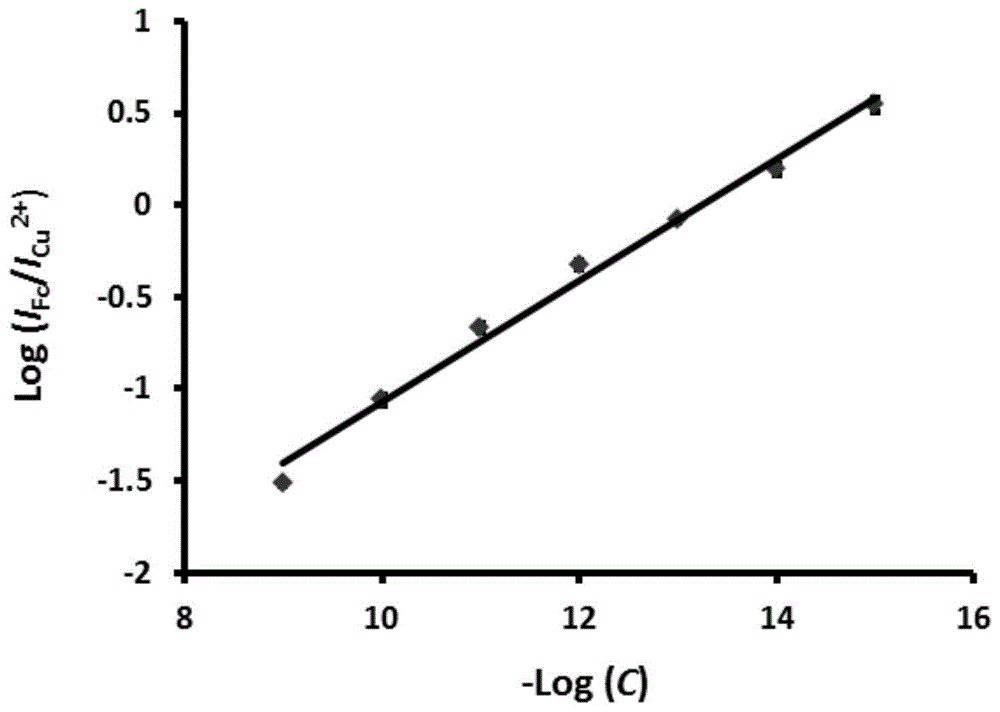
:弧菌是引发海水养殖动物疾病和人类食源性疾病的重要病原菌,发展海水及海产品中致病弧菌的先进分析检测技术意义重大。传统的微生物学检测方法需经过病原菌分离、培养、形态及生化鉴定等一系列步骤,操作繁琐,耗时长,且特异性不高(gb4789.7-2013);现代实时荧光定量pcr技术需要进行复杂的引物设计,对操作人员技术水平要求高,且荧光检测信号对样品的透明度也提出了很高的要求,难以在基层实验室中推广使用。这些方法不利于水产病害快速诊断和海产品食品安全快速检查。电化学dna生物传感器在发展仪器小型化、操作简单化、结果响应快速的即时检测技术方面存在独特优势。现代电化学dna生物传感器的核心组成部分是化学修饰电极(即电化学传感平台)。它的性质直接决定了电化学dna生物传感器的性能高低。但平行化学修饰电极间不可避免地存在自身特性(如材料形貌、电极有效表面积)、探针固定密度、非目标物引起的试剂信号变化等差异,这使得所构建的电化学dna生物传感器信号波动较大,重现性和可靠性较差,实际应用受到极大限制。技术实现要素:本发明的目的在于提供一种用于弧菌检测的比率型电化学传感平台,提高对弧菌检测的重现性和可靠性。本发明提供了一种用于弧菌检测的比率型电化学传感平台,包括工作电极和设置在所述工作电极表面的修饰层,所述修饰层包括设置在所述工作电极表面的树脂-金属螯合物层、沉积在所述树脂-金属螯合物层表面的金纳米颗粒层和固定在所述金纳米颗粒层表面的探针dna,所述探针dna为弧菌的特异性靶dna序列的互补序列,所述探针dna的3’端和5’端分别修饰有二茂铁和巯基。优选的,所述树脂-金属螯合物为树脂和金属离子经螯合反应得到的多配位螯合物,所述树脂具有孔道结构和螯合功能基团。优选的,所述螯合功能基团为氨基、亚氨基、羧基、羟基、巯基和schiff碱键中的一种或几种;所述孔道结构的孔径小于3nm。优选的,所述树脂-金属螯合物中的金属对应的金属离子为在-1.5v~1.0v的电极电位下发生氧化还原反应的金属离子。优选的,所述金属离子为cu2+、pb2+、cd2+或zn2+。本发明提供了上述技术方案所述比率型电化学传感平台的制备方法,包括以下步骤:提供树脂分散液;将所述树脂分散液与金属离子溶液混合进行螯合反应,得到树脂-金属螯合物;将所述树脂-金属螯合物分散在水中,得到树脂-金属螯合物分散液;将所述树脂-金属螯合物分散液滴涂到工作电极表面,得到螯合物修饰工作电极;将所述螯合物修饰工作电极置于氯金酸溶液中,与参比电极和对电极组成三电极体系,进行电沉积,在所述树脂-金属螯合物表面形成金纳米颗粒层,得到纳米金/螯合物修饰工作电极;在所述纳米金/螯合物修饰工作电极表面固定探针dna,所述探针dna为弧菌的特异性靶dna序列的互补序列,所述探针dna的3’端和5’端分别修饰有二茂铁和巯基,所述探针dna通过au-s键固定在所述纳米金/螯合物修饰工作电极表面,得到用于弧菌检测的比率型电化学传感平台。优选的,所述树脂-金属螯合物分散液的质量浓度为0.1~5.0mg/ml。优选的,所述滴涂到工作电极表面的树脂-金属螯合物分散液的体积为3~20μl。优选的,所述电沉积为恒电位电化学沉积或循环伏安法电化学沉积;所述恒电位电化学沉积的时间为100~800s,所述恒电位电化学沉积的电位为-0.5~0.5v;所述循环伏安法电化学沉积的循环电位区间为-0.4~0.5v,循环伏安法电化学沉积的扫速为0.01~0.1v/s,循环伏安法电化学沉积的扫描段数为10~100段。本发明提供了上述技术方案所述比率型电化学传感平台或上述技术方案所述制备方法得到的比率型电化学传感平台在弧菌检测中的应用。本发明提供了一种用于弧菌检测的比率型电化学传感平台,包括工作电极和设置在所述工作电极表面的修饰层,所述修饰层包括设置在所述工作电极表面的树脂-金属螯合物层、沉积在所述树脂-金属螯合物层表面的金纳米颗粒层和固定在所述金纳米颗粒层表面的探针dna,所述探针dna为弧菌的特异性靶dna序列的互补序列,所述探针dna的3’端和5’端分别修饰有二茂铁和巯基。在本发明中,探针dna与特定弧菌的特异性靶dna片段进行杂交,并发生构型的改变;探针dna3’端修饰的二茂铁作为信号分子,其电化学信号的改变可以指示特异性靶dna片段是否存在及其量的多少,实现对弧菌的定性和定量检测;所述电化学传感平台中的树脂-金属螯合物作为内参探针分子,提供比率型检测所需的内参信号;最终用于弧菌定性和定量检测的检测信号为二茂铁的电流信号(ifc)与树脂-金属螯合物中金属离子的电流信号(im)的比值,ifc/im.ifc/im与特定弧菌的特异性靶dna序列浓度相关,可以在一定的浓度范围内对特定弧菌的特异性靶dna序列进行定量检测;ifc/im可以减小或消除不同电极特性差异及实验条件不同所带来的误差,提高检测结果的重现性和可靠性;所述电化学传感平台中的金纳米颗粒能够提高电学传感平台的导电性和电极有效表面积,提高检测的灵敏度,并用于后续通过au-s键固定探针dna。相比于传统的微生物学检测方法,本发明提供的比率型电化学传感平台具有较低的操作复杂性,响应迅速,并具有较高检测灵敏度和特异性。相比于现代实时荧光定量pcr检测方法,本发明提供的比率型电化学传感平台检测不受样品颜色和浑浊情况影响。另外,相比于一般的电化学传感平台,本发明所制备的比率型电化学传感平台具有更高的检测结果重现性和可靠性。附图说明图1为本发明实施例2得到的比率型标准曲线;图2为本发明中比较例1得到的非比率型标准曲线;图3为本发明实施例提供的电化学传感平台重现性结果;图4为本发明实施例提供的电化学传感平台选择性结果。具体实施方式本发明提供了一种用于弧菌检测的比率型电化学传感平台,包括工作电极和设置在所述工作电极表面的修饰层,所述修饰层包括设置在所述工作电极表面的树脂-金属螯合物层、沉积在所述树脂-金属螯合物层表面的金纳米颗粒层和固定在所述金纳米颗粒层表面的探针dna,所述探针dna为弧菌的特异性靶dna序列的互补序列,所述探针dna的3’端和5’端分别修饰有二茂铁和巯基。本发明提供的比率型电化学传感平台包括工作电极,在本发明的实施例中,所述工作电极为玻碳电极。本发明提供的比率型电化学传感平台包括设置在所述工作电极表面的树脂-金属螯合物层。单位面积(cm2)的工作电极表面树脂-金属螯合物的质量优选为0.004~1.4mg。在本发明的实施例中,所述树脂-金属螯合物层优选由10μl浓度为1.0mg/ml的树脂-金属螯合物分散液得到。在本发明中,所述树脂-金属螯合物为树脂和金属离子经螯合反应得到的多配位螯合物,所述树脂优选具有孔道结构和螯合功能基团。在本发明中,所述螯合功能基团优选为氨基、亚氨基、羧基、羟基、巯基和schiff碱键中的一种或几种;所述孔道结构的孔径优选小于3nm。在本发明的实施例中,所述树脂可具体为酚醛树脂。本发明对所述酚醛树脂的种类和来源没有特殊的限制,采用本领域技术人员熟知的酚醛树脂即可。在本发明中,所述酚醛树脂的制备方法优选包括以下步骤:提供3-氨基酚溶液;将氨水溶液加入所述3-氨基酚溶液中混合并搅拌,得到碱性氨基酚溶液;将甲醛溶液加入所述碱性氨基酚溶液中混合并搅拌,进行缩合反应,得到酚醛树脂。在本发明中,所述3-氨基酚溶液中的溶剂优选为乙醇和水的混合溶剂,所述3-氨基酚溶液的浓度优选为0.1mol/l;所述乙醇和水的体积比优选为1:2.5。得到3-氨基酚溶液后,本发明将氨水溶液加入所述3-氨基酚溶液中混合并搅拌。在本发明中,所述氨水溶液中氨水的质量百分数优选为28%;所述氨水溶液与所述3-氨基酚溶液的体积比优选为1:150;所述搅拌时间优选为10分钟;所述搅拌温度优选为30℃。得到碱性氨基酚溶液后,本发明将甲醛溶液加入所述碱性氨基酚溶液中混合并搅拌,进行缩合反应,得到酚醛树脂。在本发明中,所述甲醛溶液中甲醛的质量百分数优选为37%;所述甲醛溶液与碱性氨基酚溶液的体积优选为1:135。在本发明中,所述缩合反应的时间优选为4小时;所述缩合反应的温度优选为30℃。在本发明中,所述缩合反应在搅拌条件下进行;本发明对所述搅拌的方法没有特殊的限制,采用本领域技术人员熟知的搅拌的技术方案即可,如在实验室小试时,可采用磁力搅拌;在本发明中,所述搅拌的速率优选为400转/分钟。所述缩合反应后,本发明优选将得到的反应料液进行离心,清洗所述离心得到的沉淀,得到酚醛树脂。在本发明中,所述离心的转速优选为4500rmp;所述离心的时间优选为40分钟。在本发明中,所述清洗优选为水洗;所述清洗的方法优选为超声清洗;所述超声清洗的时间为10分钟;所述离心和超声清洗的次数优选为10次。在本发明中,所述金属离子优选为在-1.5v~1.0v的电极电位下发生氧化还原反应的金属离子,具体为cu2+、pb2+、cd2+或zn2+。在本发明中,所述树脂与金属离子的螯合反应,优选包括以下步骤:提供树脂水分散液;将所述树脂水分散液与金属离子水溶液混合,进行螯合反应,得到树脂-金属螯合物。在本发明中,所述树脂水分散液的质量浓度优选为0.5mg/ml;在本发明的实施例中,用于配制所述树脂水分散液的水可具体为超纯水。得到树脂水分散液后,本发明将所述树脂水分散液与金属离子水溶液混合。在本发明中,所述金属离子优选由上述技术方案所述金属的可溶性金属盐提供;具体的,当所述金属离子优选为cu2+时,所述可溶性金属盐优选为氯化铜;当所述金属离子优选为pb2+时,对应的可溶性金属盐优选为硝酸铅;当所述金属离子优选为cd2+时,对应的可溶性金属盐优选为硝酸镉四水合物;当所述金属离子优选为zn2+时,对应的可溶性金属盐优选为硝酸锌六水合物。在本发明中,所述金属离子水溶液的摩尔浓度优选为200mmol/l。在本发明中,所述树脂水分散液与金属离子水溶液的体积比优选为1:1。在本发明中,所述螯合反应在室温条件下进行;所述螯合反应优选在搅拌的条件下进行;本发明对所述搅拌的方法没有特殊的限制,采用本领域技术人员熟知的搅拌的技术方案即可;在本发明的实施例中,所述搅拌的速率优选为500转/分钟;所述螯合反应的时间优选为4小时。所述螯合反应后,本发明优选将得到的螯合反应液离心,冲洗所述离心得到的沉淀,对所述冲洗后的沉淀再次离心,得到树脂-金属螯合物。本发明对所述离心的方法没有特殊的限制,采用本领域技术人员熟知的离心的技术方案即可;在本发明的实施例中,所述离心的条件优选为10000rmp。在本发明中,所述冲洗优选采用超纯水进行;所述冲洗、离心循环的次数优选为3次。本发明提供的比率型电化学传感平台还包括沉积在所述树脂-金属螯合物层表面的金纳米颗粒层。在本发明中,所述金纳米颗粒层提高了电化学传感平台的导电性和电极有效表面积,并用于后续通过au-s键固定探针dna。在本发明中,所述金纳米颗粒层的制备方法优选为在氯金酸溶液电沉积;所述氯金酸溶液的摩尔浓度优选为5.0mmol/l。在本发明中,所述电沉积优选为恒电位电化学沉积或循环伏安法电化学沉积;所述恒电位电化学沉积的时间优选为100~800s,更优选为150~500s,最优选为180~300s;所述恒电位电化学沉积的电位优选为-0.5~0.5v,更优选为-0.2v;所述循环伏安法电化学沉积的循环电位区间优选为-0.4~0.5v,循环伏安法电化学沉积的扫速优选为0.01~0.1v/s,更优选为0.05v/s;循环伏安法电化学沉积的扫描段数优选为10~100段,更优选为20~50段,最优选为40段。本发明提供的比率型电化学传感平台还包括固定在所述金纳米颗粒层表面的探针dna,所述探针dna为副溶血性弧菌的特异性靶dna序列(tlh)的互补序列,所述探针dna的3’端和5’端分别修饰有二茂铁和巯基。在本发明中,所述探针dna(probedna,pdna)为副溶血性弧菌的特异性靶dna序列(targetdna,tdna)的互补序列,它可以与副溶血性弧菌的tdna进行杂交,发生构型的改变。在本发明中,pdna的3’端修饰有二茂铁,5’端修饰有巯基,巯基与金纳米颗粒之间形成au-s键,从而将pdna固定在金纳米颗粒层上,二茂铁作为信号分子,其电化学信号的改变可以指示tdna分子是否存在和tdna分子的量如何,从而实现对弧菌定性和定量的测定。本发明对修饰有二茂铁和巯基的探针dna的来源没有特殊的限制,采用本领域技术人员熟知的市售渠道购买即可。在本发明中,副溶血性弧菌tlh基因片段具有下述碱基序列:pdna:tttttgatgacactgccagatgcgacgatdna:tcgtcgcatctggcagtgtcatc本发明提供的电化学传感平台的检测原理为:当pdna被固定在纳米金/螯合物修饰电极表面时,由于单链dna(ssdna)呈现“柔性”,因此pdna在修饰电极表面呈现倒伏状态。这些pdna覆盖在au-rs-m(au表示电沉积的金纳米颗粒层;rs表示树脂球;m表示螯合的金属离子)表面,阻碍了rs内部m在电极表面的电子传递,使im较小。同时由于pdna的固定,另一种信号分子二茂铁被引入,产生了二茂铁的电流信号(ifc)。并且,因为此时pdna呈现倒伏状态,位于pdna3’端的二茂铁分子离电极表面较近,使得ifc较大。当有tdna存在时,pdna会与tdna杂交,发生构型改变,由之前的“柔性”ssdna变为“刚性”的双链dna(dsdna),并在au-rs-m表面直立起来。此时,rs内部m在电极表面的电子传递增强,im增大;而pdna3’端的二茂铁分子离电极表面距离变远,ifc减小。ifc/im的大小会随着tdna的引入而发生变化,并且其变化与tdna浓度在一定范围内呈现线性关系,从而实现对tdna的定量检测。根据tdna的检测结果可对特定弧菌进行定性和定量检测。而且ifc/im可以减小或消除不同电极特性差异及实验条件不同所带来的误差,提高了检测结果的重现性和可靠性。本发明还提供了上述技术方案所述比率型电化学传感平台的制备方法,包括以下步骤:提供树脂分散液;将所述树脂分散液与金属离子溶液混合进行螯合反应,得到树脂-金属螯合物;将所述树脂-金属螯合物分散在水中,得到树脂-金属螯合物分散液;将所述树脂-金属螯合物分散液滴涂到工作电极表面,得到螯合物修饰工作电极;将所述螯合物修饰工作电极置于氯金酸溶液中,与参比电极和对电极组成三电极体系,进行电沉积,在所述树脂-金属螯合物表面形成金纳米颗粒层,得到纳米金/螯合物修饰工作电极;在所述纳米金/螯合物修饰工作电极表面固定探针dna,所述探针dna为弧菌的特异性靶dna序列的互补序列,所述探针dna的3’端和5’端分别修饰有二茂铁和巯基,所述探针dna通过au-s键固定在所述纳米金/螯合物修饰工作电极表面,得到用于弧菌检测的比率型电化学传感平台。在本发明中,所述树脂-金属螯合物的制备方法与上述技术方案所述的树脂-金属螯合物制备的技术方案一致,在此不再赘述。得到树脂-金属螯合物后,本发明将所述树脂-金属螯合物分散在水中,得到树脂-金属螯合物分散液。在本发明中,所述水优选为超纯水。所述树脂-金属螯合物分散液的质量浓度优选为1.0mg/ml。得到树脂-金属螯合物分散液后,本发明将所述树脂-金属螯合物分散液滴涂到工作电极表面,干燥后得到螯合物修饰电极。在本发明中,所述工作电极优选为玻碳电极,所述工作电极在使用前优选进行洁净处理,本发明对所述洁净处理的方法没有特殊的限制,采用本领域技术人员熟知的工作电极的前处理方法即可。在本发明中,所述滴涂到工作电极表面的树脂-金属螯合物分散液的体积优选为10μl。本发明优选将得到的滴涂有分散液的工作电极在室温条件下晾干,得到螯合物修饰工作电极。得到螯合物修饰工作电极后,本发明将所述螯合物修饰工作电极浸入氯金酸溶液中,采用三电极体系进行电化学沉积,在所述树脂-金属螯合物表面形成金纳米颗粒层,得到纳米金/螯合物修饰工作电极。在本发明中,所述三电极体系包括工作电极、参比电极和对电极,所述工作电极为上述技术方案得到的螯合物修饰工作电极,所述参比电极优选为饱和甘汞电极,所述对电极优选为铂片电极。在本发明中,所述氯金酸溶液的摩尔浓度优选为5.0mmol/l。在本发明中,所述电沉积优选为恒电位电化学沉积或循环伏安法电化学沉积;所述恒电位电化学沉积的时间优选为100~800s,更优选为150~500s,最优选为180~300s;所述恒电位电化学沉积的电位优选为-0.5~0.5v,更优选为-0.2v;所述循环伏安法电化学沉积的循环电位区间优选为-0.4~0.5v,循环伏安法电化学沉积的扫速优选为0.01~0.1v/s,更优选为0.05v/s;循环伏安法电化学沉积的扫描段数优选为10~100段,更优选为20~50段,最优选为40段。得到纳米金/螯合物修饰工作电极后,本发明在所述纳米金/螯合物修饰工作电极表面固定pdna,得到用于弧菌检测的比率型电化学传感平台。在本发明中,所述pdna为弧菌的特异性靶dna序列的互补序列,所述pdna的3’端和5’端分别修饰有二茂铁和巯基,所述pdna通过au-s键固定在所述纳米金/螯合物修饰工作电极表面。在本发明中,所述pdna在修饰电极前先进行活化,在本发明中,所述活化的方法包括以下步骤:将pdna的tris-hcl溶液与tris-hcl、三(2-羧乙基)膦(tcep)和氯化钠混合后进行超声;将所述超声后的混合体系在摇摇床反应活化。在本发明中,所述pdna的tris-hcl溶液的摩尔浓度优选为5.0×10-6mol/l,所述pdna的tris-hcl溶液由母液稀释得到,所述母液的摩尔浓度优选为1.0×10-4mol/l。在本发明中,所述混合在离心管中进行;所述混合体系中,pdna的tris-hcl溶液体积、tris-hcl的体积、tcep的质量与氯化钠的质量比优选为250μl:250μl:2.0mg:8.0mg。在本发明中,所述超声的频率优选为40khz;所述超声的时间优选为1~2分钟。在本发明中,所述摇摇床的温度设置为37℃;所述反应活化的时间优选为1小时。所述活化后,本发明将活化后的pdna溶液滴加到纳米金/螯合物修饰电极表面,常温保湿条件下进行探针固定反应,得到比率型电化学传感平台。在本发明中,所述活化后pdna溶液的浓度为2.5×10-6mol/l,所述滴加的体积优选为10μl。在本发明中,所述保湿的湿度优选为10%;所述探针固定反应的时间优选为8小时。本发明还提供了上述技术方案所述比率型电化学传感平台在弧菌检测中的应用。在本发明中,所述弧菌优选为副溶血性弧菌,所述检测的方法优选为差分脉冲伏安法扫描。在本发明中,进行定量检测前,优选先获取标准曲线,所述标准曲线的获取方法优选包括以下步骤:配制系列浓度的tdna标准工作液;将所述tdna标准工作液分别滴加到上述技术方案所述的电化学传感平台表面,孵育进行dna杂交,得到dsdna修饰电极;将所述dsdna修饰电极置于pbs缓冲溶液中进行差分脉冲伏安法扫描,得到差分脉冲伏安曲线,记录所述差分脉冲伏安曲线中二茂铁与金属离子的峰电流信号比;以所述二茂铁与金属离子电流信号比的对数为纵坐标,tdna标准工作液浓度的负对数为横坐标,绘制得到标准曲线。在本发明中,在配制标准工作液时,优选先配制tdna贮备液,将所述tdna贮备液稀释成系列浓度的tdna标准工作液。在本发明中,所述tdna贮备液的浓度优选为1.0×10-4mol/l,所述tdna贮备液中的溶剂为tris-hcl。在本发明中,标准工作液的滴加体积优选为10μl。所述孵育的温度优选为37℃,所述孵育的时间优选为2.5小时。在本发明中,所述pbs缓冲溶液的浓度优选为0.1mol/l,所述pbs缓冲溶液的ph值优选为7.4。在本发明中,所述差分脉冲伏安法扫描的条件优选为:初始电位0.5v,终止电位-0.2v,电位增量0.004v,增幅0.05v,脉冲宽度0.05s,静置时间2s。在本发明中,所述差分脉冲伏安法扫描后,优选采用tris-hcl冲洗电极。在本发明中,所述标准曲线的线性范围为1.0×10-15~1.0×10-9mol/l,检测限约为3.2×10-16mol/l(3σ/m)。在本发明中,在进行弧菌检测时,优选按照上述技术方案对提取得到的dna样品进行检测,得到样品的二茂铁与金属离子电流信号比,根据上述技术方案得到的标准曲线得到定量检测结果。下面结合实施例对本发明提供的用于弧菌检测的比率型电化学传感平台及其制备方法和应用进行详细说明,但不能把它们理解为对本发明保护范围的限定。实施例1取质量为0.1820g的3-氨基酚溶解于4.8ml乙醇+12ml水的混合溶液中,往其中加入110μl的质量浓度为28%的氨水溶液,30℃下磁力搅拌10分钟。然后,再向其中加入125μl质量浓度为37%的甲醛溶液,30℃下磁力搅拌4小时,离心、清洗得到产物-酚醛树脂球(rs)。将rs分散于超纯水配制成质量浓度为0.5mg/ml的rs分散液。取等体积的rs分散液与200mmol/l的氯化铜(cucl2)水溶液混合,室温下搅拌4小时。将混合溶液离心,用超纯水冲洗3次后,再次离心取沉淀,得到rs与cu2+的螯合物(rs-cu(ii))。将该螯合物分散在超纯水中制备质量浓度为1.0mg/ml的rs-cu(ii)分散液。将10μl上述rs-cu(ii)分散液滴涂在处理好的玻碳电极(gce)表面,室温下晾干,得到rs-cu(ii)修饰的玻碳电极,记为rs-cu(ii)/gce。将rs-cu(ii)/gce作为工作电极,接入三电极体系,在5.0mmol/l的氯金酸溶液中进行恒电位电化学沉积金,沉积电位为-0.2v,沉积时间为180s。得到au-rs-cu(ii)纳米复合材料修饰电极,记为au-rs-cu(ii)/gce。将1.0×10-4mol/lpdna用tris-hcl稀释成5.0×10-6mol/lpdna溶液,取稀释后的pdna溶液250μl放置在离心管中,再加入250μltris-hcl,加入三(2-羧乙基)膦(tcep)2.0mg,氯化钠(nacl)8.0mg,进行超声1~2分钟,放入摇摇床在37℃反应1小时进行活化。移取10μl摩尔浓度为2.5×10-6mol/l活化后的pdna滴加在au-rs-cu(ii)/gce上,常温保湿的条件下,反应进行8小时,进行dna探针的固定,得到pdna修饰电极,因为此时pdna呈现单链状态,所以记为ssdna-au-rs-cu(ii)/gce,为可用于副溶血性弧菌检测的电化学传感平台。实施例2将购买的副溶血性弧菌的tdna,按照说明以tris-hcl为溶剂配置浓度为1.0×10-4mol/l的tdna贮备液,然后再将贮备液稀释成不同浓度的tdna标准工作液。从低浓度(1.0×10-15mol/l)开始,移取10μltdna标准工作液滴加在实施例1制备得到的ssdna-au-rs-cu(ii)/gce上,37℃孵育2.5小时,进行dna的杂交,得到dsdna修饰电极,记为dsdna-au-rs-cu(ii)/gce。将该dsdna-au-rs-cu(ii)/gce电极置于0.1mol/lpbs(ph7.4)溶液中进行差分脉冲伏安法扫描,扫描时参数设置为:初始电位0.5v,终止电位-0.2v,电位增量0.004v,增幅0.05v,脉冲宽度0.05s,静置时间2s。扫描结束后,保存得到的差分脉冲伏安图,并将电极用tris-hcl进行冲洗。依次测定浓度为1.0×10-15,1.0×10-14,1.0×10-13,1.0×10-12,1.0×10-11,1.0×10-10,1.0×10-9mol/l的tdna标准工作液的差分脉冲伏安图,计算各浓度tdna标准工作液测定时得到的差分脉冲伏安图中二茂铁和铜离子的峰电流信号比(ifc/icu2+),以ifc/icu2+的对数值为纵坐标,tdna标准工作液浓度的负对数为横坐标绘制标准曲线,结果如图1所示。该方法的线性检测范围为1.0×10-15~1.0×10-9mol/l,线性方程式为log(ifc/icu2+)=-0.3308log(c)-4.386(c的单位为mol/l),线性相关系数为0.991,检测限约为3.2×10-16mol/l(3σ/m)。比较例1采用实施例2的方法构建标准曲线,不同的是,本比较例中以ifc作为检测信号,结果如图2所示,该方法的线性检测范围为1.0×10-15~1.0×10-11mol/l,线性方程式为log(ifc)=-0.1792log(c)-2.511(c的单位为mol/l),线性相关系数为0.990,检测限约为8.7×10-16mol/l(3σ/m)。通过与实施例2的结果比较可知,本发明采用比率型方法对副溶血性弧菌的特异性靶dna序列进行检测时,线性曲线的拟合度高,线性检测范围宽,检测结果精密度高。重现性试验按照实施例2的方法构建5根平行ssdna-au-rs-cu(ii)/gce,对含有1.0×10-12mol/ltdna的标准工作液进行检测,结果如图3所示,其中■曲线为比率型方法得到的结果,▲曲线为非比率型方法得到的结果,得到的ifc/icu2+的相对标准偏差为3.53%,而非比率型方法采用的检测信号ifc的相对标准偏差为16.6%。该实验结果表明,采用比率型方法可大大提高检测的重现性和可靠性。选择性试验对实施例1得到的ssdna-au-rs-cu(ii)/gce的选择性进行了考察,方案如下:分别对含有1.0×10-12mol/l的tdna,单碱基错配dna(1mtdna),三碱基错配dna(3mtdna)和完全不互补dna(ncdna)溶液进行杂交检测,1mtdna、3mtdna和ncdna的碱基序列如表1所示,检测方法如实施例2中差分脉冲伏安法的记载,并将杂交前后的检测信号进行对比,求其差值δ(ifc/icu2+)(δ(ifc/icu2+)=(ifc/icu2+)杂交后-(ifc/icu2+)杂交前)。δ(ifc/icu2+)为负值。表1选择性试验中1mtdna、3mtdna和ncdna的碱基序列1mtdnatcgtcgcatctagcagtgtcatc3mtdnatagtcgcatctagcagtgtcagcncdnaatcctttgcaattgcccagtcgg为了更直观的体现杂交前后信号变化的大小,采用-δ(ifc/icu2+)作为纵坐标对各检测溶液作图,如图4所示。从图4中可以看出,tdna杂交前后,检测信号ifc/icu2+变化最大。与之相比,1mtdna,3mtdna和ncdna杂交前后,检测信号变化幅度均显著减小。这说明,本发明所制备比率型电化学传感平台具有很好的选择性,能够对完全互补dna(即tdna)序列和碱基错配dna序列以及完全非互补dna序列进行区分。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1