手术管道泄漏测试的制作方法
本申请是2016年3月10日提交的名称为“手术管道泄漏测试”的中国专利申请201680012748.0(pct/us2016/021834)的分案申请。
本申请要求于2015年3月10日提交的美国专利申请no.62/131,134的权益,所述专利申请的全部内容以引用方式并入本文。
本公开涉及用于对手术管道进行泄漏测试、具体用于对带瓣管道进行泄漏测试的系统和方法。
背景技术:
手术带瓣管道或移植物(包括具有相关联的假体瓣膜以控制通过管道的血液流动的假体血管管道)可以用于各种目的,包括例如结合升主动脉的主动脉瓣的替换。主动脉是人体中最大的血管,其将血液从心脏的左心室运载到全身。升主动脉是主动脉的第一部分,其源自左心室并延伸到主动脉弓。主动脉瓣位于升主动脉的根部,并且通过允许血液从左心室流入升主动脉同时阻止或限制沿相反方向的血液流动来控制血液流动。
在所谓的bentall手术中,升主动脉和主动脉瓣的组合病理被替换。市场上有许多组合管道和瓣膜。与生物假体心脏瓣膜一起,先前的生物假体带瓣管道被储存在液体保存或防腐溶液中,并且因此这些管道由编织聚酯形成而不使用生物可再吸收密封剂。虽然此类管道在某些情况下是合适的,并且倾向于从组织向内生长相对快地密封到身体,但是在植入后,太多的血液最初可渗透其壁,这可能是有害的。无涂层织物(诸如聚对苯二甲酸乙二醇酯(pet))具有高泄漏速率,因此外科医生需要在使用前用患者的血液对移植物进行预凝固。其他人提出使用非生物可再吸收的密封剂层,诸如硅树脂,例如,如于2008年6月19日公开的授予ashton等人的美国专利公开no.2008/0147171中所述,但是此类层状管道倾向于是相对厚壁的并不是非常灵活,所以不是首选。例如,biovalsalvatm的猪主动脉带瓣管道(英国苏格兰伦弗鲁郡威斯泰克)包括具有内部编织聚酯、中心弹性膜和外部eptfe包的三层或没有外部eptfe层的两层。然而,此类移植物仍然产生不可接受的泄漏。
因此,一些外科医生更喜欢在其中用诸如明胶、胶原蛋白或白蛋白的生物可再吸收材料浸渍多孔管状结构(诸如编织聚酯(例如,堪萨斯州威奇托英威达的
使用包括生物假体心脏瓣膜的生物可再吸收材料密封的管道或移植物不预先组装,因为其中存储组织瓣膜的液体灭菌剂最终将生物可再吸收密封介质(明胶、胶原蛋白、白蛋白等)从可渗透管道材料冲洗掉。由于使用密封管道或移植物的益处并且由于生物假体心脏瓣膜的积极属性,外科医生在手术后期储存时将两个部件联接在一起。最近,已经开发了所谓的干燥组织心脏瓣膜,例如在美国专利no.7,972,376(dove等人)中描述的,其中生物假体心脏瓣膜在脱水和灭菌之前用醛类封端剂进行预处理。授予campbell等人的美国专利申请公开no.2013/0325111a1公开了带瓣管道,其利用连接在用生物可再吸收材料密封的管状管道内的此干燥组织瓣膜。campbell带瓣管道可以以预组装状态干燥储存,从而消除了在手术室中将两个部件固定在一起的费时过程。
仍然需要改进的带瓣管道制造技术,以确保长期的使用寿命和功效,特别是确保带瓣管道不过度泄漏。
技术实现要素:
本申请涉及用于对具有涂层或密封剂的管道移植物或主动脉带瓣管道装置进行泄漏测试的系统和方法,其中当暴露于诸如水或盐水的流体时,所述涂层或密封剂的功能可受影响,或者由于在测试之后需要干燥而不期望所述涂层或密封剂暴露于此类流体。
本文公开的泄漏测试系统和方法的实施例旨在是非破坏性的,使得如果需要,可以对每个商业产品进行测试。测试方法的一些实施例避免对暴露于测试介质的装置的部分的功能影响,不需要置备溶液且/或允许更快的测试和更简单的设置。
泄漏测试系统和方法的示例性实施例使用空气作为介质来测试部件(例如移植物或主动脉带瓣管道)的渗透性/泄漏。该部件首先被插入或夹紧在两个端部上以在每个端部上形成密封。为此可以使用各种插塞/夹具设计。组件的一端被流体地连接到泄漏测试仪的入口端口,该泄漏测试仪能够进行质量流量测试。然后用空气对该部件的管腔加压,并且执行质量空气流量测试。测试方法的此实施例使部件经受空气流动,并且所测量的空气流量变化对应于来自部件的空气泄漏速率。
在测试方法的替代实施例中,部件在第一通常较短的时间段内在内部用空气加压,允许压力在第二通常短暂的时间段内稳定或平衡,并且当空气从部件泄漏时测量压力衰减。识别压力衰减阈值以区分通过和故障部件。例如,部件可以在内部加压至约16kpa(约2.3psi),然后监测一段时间。如果管腔压力在预定时间段(诸如0.6秒)内从起始压力衰减超过50%,则该部件被认为是有缺陷的。当然,这些阈值可以根据管道的类型、应用和开始压力以及其他变量而变化。
现有的测试方法要么是破坏性的,要么部件需要干燥时间。由于本文公开的测试方法的实施例使用空气,因此它们是非破坏性的并且不需要测试后干燥时段。因此,测试方法的实施例允许对部件进行100%检查和/或对相同样品进行重复测试。根据接触移植物的夹具设计,在夹具界面/接口处可发生明胶或胶原蛋白的轻微破坏。在一些情况下,可以为进行中的移植物设计指定稍长的移植物,并且可以在泄漏检查之后修剪掉该部分,留下最终期望的移植物长度以用于最终产品。当使用空气时,不需要溶液储存或混合。该部件可以相对较快地加压,并且不需要排出或清理溶液。
还公开了制造带瓣管道的方法,其包括首先组装带瓣管道,该带瓣管道包括生物假体瓣膜,该生物假体瓣膜具有联接到用生物可再吸收介质密封的管道的生物假体组织。该方法包括使用空气对每个带瓣管道进行泄漏测试,并且在干燥包装中密封被认为可接受的管道。生物假体心脏瓣膜优选包括已被处理使得组织可以长时间地干燥储存而不使瓣膜的功能劣化的假体组织。例如,组织可以使用戊二醛或其他含醛试剂进行交联、被封端剂处理并用甘油溶液脱水。生物假体心脏瓣膜可以具有单独的牛心包小叶或整个猪瓣膜。密封管道包括用生物可再吸收介质(诸如明胶或胶原蛋白)浸渍的管状基质。心脏瓣膜可以被缝合到管道的端部或者通过卡扣配合连接而联接到该端部上,以限制对两个经处理部件的操纵并提供具有最小组装复杂度的止血密封。
附图说明
图1是其中具有手术管道的示例性泄漏测试固定装置的透视图,其中手术管道的一端部适于沿轨道自由滑动;
图2是图1的其中具有手术管道的泄漏测试固定装置的俯视图;
图3和图4a/图4b分别是示例性泄漏测试固定装置的侧视图和相反端部正视图;
图5是沿示例性泄漏测试固定装置的中线的竖直截面,并且图5a是其中的手术管道的放大视图;
图6和图7分别是歧管组件的透视分解视图和透视组装视图,其中歧管组件用于密封手术管道的两个端部并且在手术管道中的管腔内施加压力;
图8a和图8b是沿图7的线8-8截取的歧管组件的水平截面,示出在引入加压气体以夹紧和密封手术管道的两个端部之前和之后的泄漏测试固定装置;
图9a和图9b是在用气体对手术管道的内部加压而导致歧管组件的左侧部分向左移位(沿所示方向)之后的泄漏测试固定装置的俯视平面图和竖直截面视图;
图10是另选泄漏测试固定装置、带瓣管道和用于密封带瓣管道的一个端部的互补端部夹具的顶部分解平面图;
图10a和图10b是可以由本文所述的系统进行泄漏测试的示例性带瓣管道的局部剖视图;
图11和图12分别是另选歧管组件的透视分解视图和透视组装视图,该另选歧管组件用于图10的泄漏测试固定装置以用于密封带瓣管道的两个端部并对带瓣管道中的管腔加压;
图13a和13b是沿图12的线13-13截取的另选歧管组件的水平截面,示出使用加压气体夹紧和密封带瓣管道的两个端部,并且在带瓣管道的内部施加加压气体管道之后,导致另选歧管组件的左侧部分向左移位;
图14a至图14d是用于另选歧管组件的第一端部夹具的透视图和正交视图;
图15a至图15d是用于另选歧管组件的与第一端部夹具互补的第二端部夹具的透视图和正交视图;
图16a至16d是用于另选歧管组件的另选第一端部夹具的透视图和正交视图;以及
图17a至17d是用于另选歧管组件的与另选第一端部夹具互补的另选第二端部夹具的透视图和正交视图。
具体实施方式
本申请公开使用加压气体(诸如空气)作为测试流体对手术管道或移植物进行泄漏测试的若干个系统。在优选实施例中,加压空气是气体,但可以使用对被测试的特定管道而言是非破坏性的和非反应性(惰性的)的任何气体,例如氧气、氮气、氦气、氩气、二氧化碳、氢气、碳氢化合物、氢氟碳化物、碳氟化合物、氟氯烃、氢氟氯烃以及它们的组合。如本文所使用的,术语“空气”包括所有合适的气体测试流体,除非上下文另有说明。使用气体而不是液体测试流体可以保存手术管道,该手术管道可以包括多孔管状结构,诸如用生物可再吸收材料(诸如明胶、胶原蛋白和/或白蛋白)浸渍的编织聚酯(例如,堪萨斯州威奇托英威达的
术语“手术管道”是指通常管状长度的材料,其用作至少部分地替代血管或心脏的天然部段(诸如升主动脉)的功能的植入物。管道具有用于流体流动的管腔。本文所述的测试方法可用于所有类型的管道或移植物,因此该术语通常是指直的移植物、分叉移植物、分支移植物等。术语“管道”和“移植物”在本文中可替换使用,并且理解为“移植物”意指用作管道的移植物。本领域技术人员将理解,本文所述的测试固定装置可以被修改以适应管道的不同类型、形状和尺寸。
本申请的泄漏测试系统和方法特别适合于测试带瓣管道。术语“带瓣管道”是指联接于或结合单向瓣膜的手术管道。测试系统和方法特别适合于对管道移植物(诸如主动脉管道)进行泄漏测试,并且具体适合于对诸如主动脉带瓣管道的带瓣管道进行泄漏测试,其在与管道的管状部段联接的一个端部上包括假体主动脉瓣以替代升主动脉。针对本文所述的泄漏测试,也可以设想到包括侧分支的主动脉瓣管道的一些实施例,其中侧分支从管状主体延伸以联接到向外延伸的冠状动脉,例如,其中侧分支被封堵、结扎或以其他方式封闭以用于泄漏测试。有利的是,与浸渍有密封剂的管道联接的干燥生物假体心脏瓣膜可以以非破坏性方式用空气进行泄漏测试,如下文所述。
用于移植物的渗透性/泄漏测试的当前标准(iso7198)通常建议使用水或缓冲盐水作为测试流体。当用于涂覆有密封剂(诸如明胶或胶原蛋白)的移植物时,这些泄漏测试方法自然具有破坏性。将部件暴露于诸如盐水或水的流体会引发明胶/胶原蛋白的水解,这可能损害部件的体内密封性能。破坏性方法可以适用于设计验证测试,其中被测试部件不打算重新使用,但是引入限制,例如,可能期望对相同样品进行重复测试。在制造过程中的检验应当是无破坏性的。
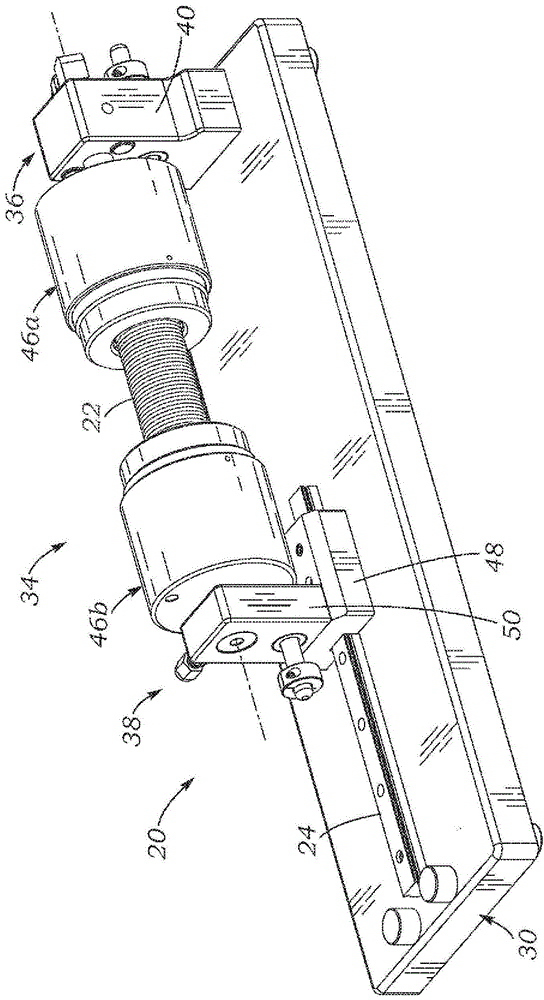
图1是示例性泄漏测试固定装置20的透视图且图2是示例性泄漏测试固定装置20的俯视图,示例性泄漏测试固定装置20具有安装在其中的手术管道22,其中允许测试固定装置的一个端部沿轨道24自由滑动。图3和图4a/图4b分别是示例性泄漏测试固定装置20的侧视图和相反端部正视图。测试固定装置20包括沿相对于宽度尺寸的长度轴线伸长的大致矩形的水平基座30。在所示实施例中,线性轨道24从近一个长端延伸到基座30的大致中点。在另一些实施例中,例如,取决于测试固定装置的基座和其他部件的相对尺寸和/或配置,线性轨道24具有其他配置。歧管组件34安装在基座30上,其中第一端部36固定到基座,并且第二端部38联接成沿轨道24在纵长方向上在基座上滑动。为了定向,测试固定装置20的右端部对应于固定的第一端部36,并且测试固定装置的左端部对应于附图中的滑动的第二端部38。
第一端部36包括固定在基座30上的直立支架40,并且具有通过其中的气流端口(图1和图2中未示出),该气流端口与外侧上的入口配件或测试气体端口42流体连通并且与内侧上的支撑轴44流体连通。支撑轴44连接到第一歧管46a并为第一歧管46a提供结构支撑。第二端部38包括托架48,托架48具有适于在直线轨道24上紧密装配并滑动的下部通道(未编号)。本领域技术人员应理解,其他布置是可能的,例如,将通道和轨道分别设置在托架和基座上。固定在托架48上的直立框架构件50为第二歧管46b提供结构支撑。具体地,在图3中所示的细长轴51连接到第二歧管46b,并且为第二歧管46b提供结构支撑。在一些实施例中,除了框架构件50之外或替代框架构件50的是,支架40被配备成纵向滑动。在对歧管部件的描述中,术语“内部”是指朝向另一个歧管的纵向方向,并且术语“外部”是指远离另一个歧管的方向。在另一些实施例中,入口配件42具有例如从支架40的一侧、从基座30、从支撑轴44或从第一歧管或从与待检测管道或移植物的管腔可流体连接的任何位置延伸的不同位置,这将通过下文清楚地了解。
第一歧管和第二歧管46a、46b具有大致圆柱形的轮廓,所述轮廓具有重合的水平轴线。本领域技术人员将理解,具有轴向对称轮廓(例如圆柱形)的歧管的特征在于简化的制造和/或组装;然而,其他轮廓在其他上下文中是有用的,并且在一些实施例中,某些部件可以具有与其他部件(例如,心轴)不同的轮廓,如下面更详细地讨论的。管道22在任一端部由第一歧管和第二歧管46a、46b保持,如下文所述。所示的手术管道22包括具有用于扭结阻抗以及纵向和弯曲柔性的圆周波纹的管状结构。在管道具有不同形状的实施例中,例如,其中端部被轴向偏移和/或其中端部是不平行的,第一歧管和第二歧管的相对位置被调节成考虑管道的形状。
现在参考图5和图5a的竖直截面以及图6的分解视图,示出歧管组件34(在图7中组装)的部件的细节。第一歧管和第二歧管46a、46b基本上相似,并且它们的部件将具有相同的元件编号,除了构造不同的一对心轴60、62以外。
如图6所示,两个歧管46a、46b都包括具有内部螺纹66的外部壳体64,内部螺纹66与管状盖70上的外部螺纹68配合。在另一些实施例中,外部壳体的至少一部分被接收在管状盖内,而在另一些实施例中,外部壳体的内表面抵靠盖的外表面,以提供基本液密密封。此外,在另一些实施例中,外部壳体64和管状盖70使用其他类型的紧固件或联接器件(例如,卡口式安装件、螺栓、销、锁定环、快速连接件、闩锁、夹子、夹具、磁体、楔形物、螺纹等的任意组合或它们中的多个)组装。在一些实施例中,另选紧固系统允许歧管的快速组装和拆卸,例如以便于清洁、维修和/或重新配置以测试不同类型的装置。一些实施例包括在外部壳体和管状盖之间的密封器件,例如垫圈或o形环。如图5a最佳所示,外部壳体64和管状盖70的组合限定内部阶梯式空腔72,其包围气动部件以密封管状管道22的两个端部。具体地,相对大的活塞74在空腔72内轴向往复运动。如图6最佳所示,每个活塞74包括大致管状的主体75,该主体75具有以恒定直径穿过其中延伸的圆柱形管腔76以及扩大的环形中心凸缘78,环形中心凸缘78具有接收主o形环80的周边凹槽。两个次o形环82也装配在主体75的减小直径端部上的外部凹槽内。图5a示出主o形环80抵靠阶梯式空腔72的较大直径部分密封,而次o形环82中的外部次o形环抵靠阶梯式空腔72的较小直径部分密封。次o形环82中的内部次o形环抵靠盖70的内部管腔密封。
仍然参考图5a,活塞主体75的内端部抵接管状盖70内的刚性圆形外垫圈90a。在其另一侧,外垫圈90a抵接一对弹性夹紧环92,该对弹性夹紧环92继而接触刚性圆形内垫圈90b。垫圈90a、90b和弹性夹紧环92的组件被夹持在活塞主体75和在盖70的内端部上的径向向内指向的颈部或唇部94之间。读者将注意到形成在活塞74的中心凸缘78和盖70的外端部之间的环形空间96。这些空间96允许活塞74具有线性向内运动以压缩弹性夹紧环92,如下文所述。应当注意,虽然在两个歧管46a、46b上示出两个夹紧环92,但是其他实施例包括在歧管46a、46b中的一个或两个上的不同数量的夹紧环,例如单个夹紧环或两个以上的夹紧环。此外,一些实施例独立地省略每个歧管上的内垫圈和外垫圈中的一个或两个。
图8a和图8b是在引入加压流体导致歧管46a、46b夹紧并密封到手术管道22的两个端部之前和之后的歧管组件34的水平截面。这里,加压流体理想地是气体,诸如空气,但也可以使用不可压缩的流体,诸如水、有机液体或碳氟化合物。使用者通过围绕相应的心轴60、62装配端部而将管道22装载到歧管组件34中,心轴60、62由相应轴44、51保持在适当的位置。管道22的外端部延伸短距离到盖70内或盖70中,并且至少远到两个弹性夹紧环92中的内部夹紧环。轴44、51相对于直立支架40和直立框架构件50(返回参考图3)固定。螺栓98在相应支架40和直立框架构件50之间延伸到对应的外部壳体64,使壳体相对于轴44、51和心轴60、62固定。此外,管状套管100紧密包围轴44、51中的每个,并且进而由活塞74紧密包围。套管100使活塞74围绕轴44、51居中,但是允许其线性位移。优选地,套管100压配在活塞74的管腔76内,并且在轴44、51上轻易地滑动。在其他实施例中,套管中的所述至少一个与相应活塞或轴整体形成。
仍参考图8a和图8b,两个外部壳体64都具有从其外部(例如外表面)延伸至与相应的内部阶梯式空腔72连通的流动通道110。更具体地,流动通道110中的每个在径向定向阶梯112(参见图8b)处向对应空腔72打开,径向定向阶梯112最初与活塞74的中心凸缘78的外表面相对。作为在所示实施例中的弯管配件,致动流体端口114附接到壳体64的外表面,并且提供用于附接软管(未示出)的联接点,该软管用于将加压气体输送到流动通道110,并且用于排放或释放致动气体压力。其他实施例包括用于排放压力的单独端口。
图8a示出在将加压气体引入到流动通道110之前的处于其第一或外部位置的活塞74。读者将注意到弹性环92与心轴60、62以及在其上的手术管道22中的每个的外部之间的微小径向间隙。再次,在活塞74的中心凸缘78和盖70的外端部之间示出的环形空间96实现或允许活塞的向内位移。
两个心轴60、62优选地包括相同的主体,每个主体具有从外端部到内端部逐渐的阶梯式半径。在其中管道的至少一个端部具有不同的半径和/或不同直径的实施例中,相应的心轴相应地成形。参考图6,心轴的外圆柱形部段120具有最大半径,并且与稍小的中间圆柱形部段122分离开一个小的向内阶梯(未编号)。另一小向内阶梯导致尺寸减缩到其内端部126的内部部段124。手术管道22具有围绕中间圆柱形部段122紧密配合的直径,抵接或接触在所示实施例(图8a、图8b)中的最大直径外圆柱形部段120开始处的小阶梯。两个心轴60、62具有在内孔130处开始的阶梯式直径的轴向通孔,内孔130通向接收相应的轴44、51的逐渐变大的外孔(未编号)。螺母特征132或其他这样的插塞构件(其任选地螺纹连接以与内孔130中的互补螺纹相配合)封闭第二心轴62中的通孔,使得与管道22内的管腔134没有气体连通。其他实施例不包括插塞,只要歧管46b基本上密封或无泄漏即可。另一方面,不对第一心轴60提供此插塞构件,使得其通孔朝向管腔134打开并在第一心轴的内端部126处提供内部端口,以将加压气体引入其中。
图8b示出在通过致动气体端口114将加压气体引入两个流动通道110中之后,活塞74向内移位,如由叠加在每个活塞上的一对箭头所示。虽然可以提供一个以上的流动通道,但活塞74的中心凸缘78的轴对称性以及套管100所提供的同心度使得加压气体围绕活塞环状分布并且对其施加基本上相等的轴向力。如前所述,活塞主体75的内端部抵接管状盖70内的圆形外垫圈90a。活塞74的向内移位凭借盖70相对于外部壳体64固定来挤压刚性垫圈90a、90b之间的弹性环92。因此,弹性环92如图8a和图8b所示径向向内变形,以便接触两个心轴60、62和手术管道22并抵靠它们进行密封。也就是说,弹性环92抵靠刚性心轴60、62且具体抵靠其中间圆柱形部段122将手术管道22夹紧并密封。校准气体压力使得活塞74的力足以致使环92在其端部处形成抵靠管道22的内部的气密密封。每个活塞74可独立致动和/或可一起致动。在一些实施例中,活塞74通过另一种方法(例如,气动、液压、电动、磁性或机械致动的任意组合)在相应歧管中致动或移动。引入管道管腔134中的任何加压气体到达管道22的内壁、至少远到锥形内圆柱形部段124周围的区域。此时,准备好泄漏测试固定装置20来测试管道22。
图9a和图9b是在引入加压气体到手术管道22的管腔134之后的泄漏测试固定装置的俯视平面图和竖直截面图。更具体地,将加压气体提供到入口配件42,入口配件42通过支撑轴44与中空管腔140连通。在所示实施例中,入口配件42用于对测试固定装置加压和排气。其他实施例包括用于从测试固定装置排出测试气体的独立端口。如上所述,轴44的内端部接合第一心轴60中的通孔,使得加压气体继续进入手术管道22的管腔134中。小的o形环142在轴44的外部和第一心轴60中的通孔之间提供密封,并且在其他实施例中是任选的。由于第二心轴62由螺母或插塞132密封,并且管道的两个端部被密封,所以加压气体仅能够通过管道的壁逸出。当前测试系统测量任何这样的泄漏。用于泄漏测试的加压气体理想地是诸如空气的惰性气体。
如图9a和图9b中的移动箭头所示,当管道延长时,对管道管腔134加压导致歧管组件34的左侧或第二端部38在基座30上沿轨道24在纵长方向上滑动。波纹管道22的延伸允许这种移动,并且因此管道从其伸长处径向略微收缩,如图9a中箭头所示。如果歧管组件34的第二端部38被限制滑动,则管道22将倾向于由于长度变化而弯曲并且可能扭结,这可能导致额外泄漏(其中折叠等使泄漏暴露或以其他方式扩大)和/或掩盖泄漏(管道表面的以其他方式泄漏的部分被扭结或折叠的管道表面覆盖或压缩)。在一些实施例中,在泄漏测试期间,管道22的长度不明显改变。如上所述,如果密封管道22上的密封剂(例如明胶或胶原蛋白)的破坏发生在夹紧界面/接口处,则可以指定略长的移植物,并且在泄漏检验之后可以修整掉端部部分,留下用于最终产品的最终期望的移植物长度。
对管道进行泄漏测试的方法是流量测试,例如,质量空气流量测试。在流量测试的一些实施例中,管道保持在基本恒定的气体压力下,并且例如使用质量流量计来测量流率。然后基于流率将管道分级,例如通过或未通过/故障,或以所测量的流率分级。在一个实施例中,测试固定装置20的测试或入口配件42例如经由软管或管道(未示出)流体地连接到空气或气体泄漏测试器150的端口(在图9a中示意性地示出),其中测试器150能够进行质量流量测试。然后,在第一或填充时间段内用空气或测试气体通过入口42将管道22加压到基本恒定的目标压力,并且在第二或测试时间段内在目标压力下执行质量流量测试。最后,管道的管腔被减压或排气。该测试方法使被测试部件经受空气流动,并且测量的空气流量变化对应于通过测试样品的空气泄漏速率。
目标压力取决于各种因素,包括所使用的测试气体的类型、管道的结构特性、密封剂的性质等。在一些实施例中,选择目标压力以用于精确且可再现的泄漏测试测量。例如,在低压下,管道的物理定向的微小差异可以导致不同的所测量泄漏速率,例如,由于管道的堵塞泄漏路径的重叠部分。另一方面,过高的目标压力可能损坏密封剂层,产生新的泄漏路径。此外,所选择的目标压力也取决于测试设备的性质。例如,在一些实施例中,质量流量计同时测量气体流量并调节气体压力。因此,目标压力选自质量流量计针对待测试管道的典型范围能够在测试时间内保持的压力范围,所述典型范围例如管道的至少3sigma或至少4sigma或至少5sigma。在一些实施例中,目标压力为从约3.5kpa(约0.5psi或约25mmhg)至约70kpa(约10psi或约520mmhg),或从约7kpa(约1psi或约50mmhg)至约35kpa(约5psi或约150mmhg),或从约14kpa(约2psi或约100mmhg)至约28kpa(约4psi或约200mmhg)。在一些实施例中,目标压力包括小的压力范围,例如,其中质量流量计以离散或量化的方式控制压力,例如通过打开和关闭控制加压气体源在恒定压力下的瓣膜,所述恒定压力高于目标压力。
选择填充时间以将管道快速加压到目标压力,而不引起例如由于突然的压力变化导致的任何损坏。在一些实施例中,在填充时间期间加压速率是非线性的,例如,当管道中的压力接近目标压力时处于较慢的速率。例如,在一些实验中,加压速率是s形(sigmoidal),包括三个填充阶段,分别是较慢的初始填充速率、较快的主填充速率和较慢的最终填充速率。其他实施例包括两个填充阶段,例如较快的初始填充速率和较慢的最终填充速率。在一些实施例中,填充时间将取决于被测试管道的泄漏。填充时间的实施例为从约0.1至500秒、从约1至60秒、从约2至30秒或从约5至15秒。
测试时间足够长以获得稳定、精确且可重现的流率,并且因此测试时间将取决于待检测管道以及流量计的特性。测试时间的实施例为从约0.1至500秒、从约1至60秒、从约2至30秒或从约5秒至15秒。选择排气时间以用于快速排出压力而不损坏管道,该损坏例如由于管道突然纵向收缩引起的机械应力所造成的损坏。排气时间的实施例为从约1至30秒或从约5至10秒。在一个实施例中,使用约16kpa(约2.32psi或约120mmhg)的目标压力、约10秒的填充时间、约10秒的测试时间和约8秒的排气时间。
另一种测试方法是静态测试,其包括:将测试部件安装到测试固定装置20上,如上所述;用空气或气体对部件加压第一时间段(例如,短时间);允许压力稳定第二时间段(例如,短时间);以及当空气从部件泄漏第三时间段时测量压力衰减。识别压力衰减阈值以区分通过部件和故障部件。在一个实施例中,使用约16kpa(约2.32psi,或约120mmhg)的目标压力、约10秒的填充时间、约0.1秒的稳定时间和在约0.1至0.8秒之间的测试时间。
在完成泄漏测试之后,例如通过释放致动流体端口114处的流体压力来退动(deactuate)活塞74。在所示实施例中,环形空间96中的气体使活塞74从图8b中所示的第二位置返回到图8a中所示的第一位置。任选地,减小的压力(例如真空源)流体连接到致动流体端口以使活塞缩回。其他实施例包括用于使活塞返回到第一位置的部件或机构,例如,弹簧、机械、气动、液压、电动或磁性机构或致动器中的至少一个。在释放活塞压力之后,弹性环92松弛回到它们的未压缩状态,从而从其释放管道22的端部,从而允许从相应的心轴62移除移植物22的端部。
泄漏测试系统的一些实施例至少部分自动化,例如夹紧管道、松开管道、对管道进行泄漏测试或记录泄漏测试结果的任何组合。
迄今为止,已经在测试直管管道22(例如,由均质移植材料形成的管道)的背景下描述了泄漏测试系统20。如上所述,可以通过对系统进行促进测试的某些修改(例如用于将测试部件安装到测试固定装置)来测试其他管道。例如,图10至图15示出用于对带瓣管道222进行泄漏测试的经修改系统220。系统220的一些方面与先前描述的系统20是共同的,并且此类特征将具有相同的元件编号,但增加200(例如,心轴60=心轴260)。除非另有规定或显而易见,否则结合泄漏测试固定装置20讨论的另选配置或布置也适用于泄漏测试固定装置220。
图10是经修改泄漏测试固定装置220、带瓣管道222和用于密封带瓣管道的每个端部的互补端部夹具226、228的局部分解俯视图。图11和图12分别是另选固定装置220的透视分解视图和组装视图。
测试固定装置220包括沿相对于宽度维度的长度轴线伸长的大致矩形的水平基座230。线性轨道224从基座230的近一个长端延伸到大致中点。歧管组件安装在基座230上,其中第一端部236固定到基部,并且第二端部238联接成在基座上沿轨道224在纵长方向上滑动。
歧管组件的第一端部236包括直立支架240,直立支架240固定在基座230上并且具有通过其中的在外侧上与入口配件242且在内侧上与支撑轴244连通的气流端口。支撑轴244连接到第一歧管246a并且为第一歧管246a提供结构支撑。第二端部238包括具有下部通道(未编号)的托架,所述下部通道适于紧密装配在直线轨道224上并在其上滑动。固定在托架上的直立框架构件250和轴251为第二歧管246b提供结构支撑。在图10中,带瓣管道222被示出为从两个歧管246a、246b之间分解开,并且两侧分别是互补的端部夹具226、228。如将要说明的,端部夹具226、228在一起围绕缝合凸缘252密封,缝合凸缘252位于第二歧管246b内的管道222的一端部上,而管道的相反端部在心轴260上延伸并且被密封在第一歧管246a内。在一些实施例中,第一歧管和第二歧管的位置互换。
现在参考图10a和图10b,带瓣管道222优选地包括管状移植部分253和包括附接到移植部分的第一端部的单向流动瓣膜的子组件。单向流动瓣膜允许流体从管状移植部分253的一端部流向另一端部,但阻止沿相反方向的流动。在一些实施例中,单向流动瓣膜是假体心脏瓣膜。在一些实施例中,对包括完全组装的单向流动瓣膜子组件的带瓣管道进行泄漏测试。在其他实施例中,有利和/或有效的是,仅测试附接到(诸如通过手术缝合线的)管状移植部分253的单向流动瓣膜子组件的那些部件,以验证带瓣管道不在其外部周围泄漏。部件诸如瓣叶通常在周围支撑结构的内部,因此不直接连接到移植部分253,并且因而通常不是额外泄漏源。因此,在一些实施例中,流动瓣膜子组件中的一些或所有内部部件可以在泄漏测试之后添加,而不影响管道222的完整性。
在所示实施例中,单向流动瓣膜包括生物假体心脏瓣膜,其具有围绕周边支撑结构255的缝合凸缘252和多个柔性生物假体组织小叶254(图10a和图10b中未示出),所述多个柔性生物假体组织小叶附接到支撑结构并且向内延伸以提供空气流动阻塞表面。支撑结构255可以采取各种形式,但是通常包括具有轴向部件的金属环或塑料环,以对柔性小叶254提供周边支撑。例如,瓣膜的一些实施例具有基本上可商购获得的假体心脏瓣膜的结构,例如carpentier-edwards
所示管道222尤其适于附接在主动脉环和升主动脉内,并且因此与主动脉根部解剖结构紧密匹配,并且包括三个部段:具有轴向波纹或褶皱的窦形部段257,具有圆周波纹或褶皱的主动脉部段258,以及用于将移植部分联接到瓣膜或其外部部件的裙状部段259(图10b)。主动脉部段258的圆周波纹侧壁提供纵向柔性和径向可压缩性,同时确保移植物在流过其中的血液的压力下不过度径向扩张。窦形部段257的纵向波纹比圆周褶皱更加可以径向扩张,以允许在该位置处扩张到与主动脉瓣相邻的valsalva窦内。管道222理想地具有从几厘米到约10至15厘米的总长度。在优选实施例中,管道222包括用生物可再吸收介质诸如明胶或胶原蛋白密封的纹理结构,诸如编织和/或非编织pet(堪萨斯州威奇托英威达的
关于图10b的放大图,裙状部段259被示出为在缝合凸缘252和瓣膜的周边支撑件255之间延伸,并且包裹在缝合凸缘下面(在图10b中的左侧)。周边支撑件255通常具有一个或多个织物覆盖物,其包括延伸的部段261,该延伸的部段261在缝合凸缘252下面包裹在裙状部段259的外侧上,并且用缝线262构成的周边线固定到其上。可以在各种织物部段之间提供额外的缝线,但在管道222的管状区域中优选避免缝线,以减少通过由此形成的任何孔的泄漏。两个圆周缝合线263(图10a)将窦形部段257连接到主动脉部段258和裙状部段259两者。在其他实施例中,裙状部段以不同的方式固定到单向瓣膜子组件。如下文所述,泄漏测试固定装置220并且具体是端部夹具226、228提供缝合凸缘252周围的液密密封,使得加压气体可以仅通过管状管道222的壁逸出。
图11示出分解以更好地理解两个歧管246a、246b之间的差异的经修改歧管组件的部件。在所示实施例中,在相对于基座230固定的端部上的第一歧管246a装纳围绕管道222的管状主动脉部段258的端部密封的部件。在该实施例中,第一歧管246a优选具有与上述用于密封直管状移植物22的端部的歧管46a、46b相同的结构。具体地,外壳体264具有与在盖270上的外部螺纹配合的内部螺纹。外壳体264和盖270的组合限定内腔,该内腔内安装有具有通孔的活塞274,该通孔接收在轴244(图10)上滑动的管状套管300。如上所述,活塞274接触并压缩内垫圈290a和外垫圈290b以及弹性环292构成的被夹持组件。最后,如在图13a和图13b中所示,上述心轴260安装到轴244的内端部。
第二歧管246b也包括外壳体264,内盖270通过螺纹联接到外壳体264。在由壳体264和盖270限定的空腔内,安装到管状套管300的活塞274被布置成轴向滑动。因为管道222的第二端部具有单向瓣膜,并且具体是外向缝合凸缘252,所以活塞274作用于两个端部夹具226、228的组合上,而不是平垫圈或环上,如下面将更详细描述的。第二歧管246b的外壳体264和内盖270的一些实施例包括经配置用于将其快速组装和拆卸的紧固件系统或联接器件,如上文结合歧管46a、46b所描述的,其用途将变得显而易见。
现在参考图13a和13b,沿图12的线13-13截取的另选歧管组件的水平截面首先示出引入加压气体以夹紧和密封带瓣管道222的两个端部,以及然后引入加压气体以用于泄漏测试。同样,用于夹紧的加压气体和用于泄漏测试的加压气体两者都优选为空气。图13a示出加压气体进入两个歧管246a、246b上的两个入口配件314中的每个。如在先前描述的夹紧配置中,加压气体使相应的活塞向内或朝向组件的中间移位。在第一歧管246a中,活塞274使得两个弹性环292轴向压缩并径向向内膨胀,如上文详细描述。这抵靠心轴260夹紧管道222的管状端部。在第二歧管246b中,活塞274使得两个端部夹具226、228压缩在其间的弹性缝合凸缘252。两个端部夹具228的外部具有固体或封闭的中央部段或中心,并且因此封闭并密封具有部分组装或完全组装的单向瓣膜子组件的管道222的端部。因为管道222的两个端部被密封,所以加压气体仅能够通过管道的壁逸出。
图13b示出在带瓣管道222的内部引入加压气体。更具体地,加压气体将通过图10所示的入口配件242引入,入口配件242与轴244的内部管腔340流体连通。管腔340进而通向心轴260中的通孔,该通孔朝向管道222的内部管腔334打开。以这种方式对管道222的内部加压导致管道222随主动脉部段258中的褶皱展开而延长。因此,如图13b中的移动箭头所示,可移动的第二歧管246b在轨道224上向左侧滑动,以适应延长的管道222。同样,这些歧管中的一个的这种线性位移防止管道222弯曲、扭结或以其他方式扭曲。此外,管道222的延长使得主动脉部段258的直径略微地收缩。
用于带瓣管道222中的泄漏的测试方法与上述方法类似。也就是说,可以执行质量空气或气体流量测试,其使管道222经受空气或气体流动,并且所测量的空气流量变化对应于来自测试样品的空气泄漏速率。另选地,在静态测试中,带瓣管道222可以在短时间段内用空气加压,并且然后当空气从管道泄漏时测量压力衰减。应当注意的是,将缝合凸缘252夹紧在端部夹具226、228之间有效地隔离了带瓣管道222的中心管状部分以及窦形部段257和缝合凸缘252之间的接合点,以进行泄漏测试。因此,测试集中在管道222的最容易泄漏的那些部分,即带瓣管道的外部部分,而不是较不易泄漏的部分,例如,单向瓣膜内部的缝合线或缝合。当植入时,缝合凸缘252将带瓣管道222的一个端部锚固到诸如主动脉环的解剖位置。在凸缘252和周围解剖结构之间的泄漏通常是由于外科医生的技术,而不是管道自身中的任何固有泄漏。因此,泄漏测试系统的端部夹具226、228从泄漏测量有效去除了在缝合凸缘252和组织之间的泄漏。一旦完成泄漏测试,就从固定装置释放管道,如上所述。
图14a至图14d示出第一端部夹具226,而图15a至图15d示出用于另选歧管组件的与第一端部夹具互补的第二端部夹具228。第一端部夹具和第二端部夹具226、228具有互补波状相对表面,所述表面大致适形于带瓣管道缝合凸缘252并且将凸缘夹紧在其间以提供对抗泄漏的足够密封。
更具体地,图14a至图14d的第一或内端部夹具226具有大致环形主体350,其具有通过其中的管腔352。参考图11和图13a,内端部夹具226紧密地装配在带瓣管道222的管状主动脉部段258周围。夹具226的外表面上的波状凸沿354接触缝合凸缘252的内侧并且反映其形状/与其形状镜像,例如,在所示实施例中反映起伏形状。更具体地,缝合凸缘252理想地具有与主动脉环相匹配的形状,其中环的三个合缝处的三个峰在窦形区域的三个谷中间。图14a示出尺寸和形状设计成与缝合凸缘252的三个峰相匹配的三个下凹凹陷356,以及尺寸和形状设计成与三个谷相匹配的三个凸起区域358。缝合凸缘的其他实施例具有不同的轮廓,例如针对具有二叶主动脉瓣的患者具有两个峰和两个谷,并且夹具226'的外表面与缝合凸缘的轮廓互补。
图15a至图15d的第二端部夹具228包括环形主体360,环形主体360具有从其向外突出的轴向定向的环形柱362。环形主体360的内表面的一部分包括波状密封表面364,波状密封表面364与缝合凸缘252的外侧接触并且模拟其起伏形状。具体地,围绕密封表面364周边的交替凸起峰366和下凹凹陷368的尺寸和形状设计成紧密地适形于缝合凸缘252的峰和谷。
夹具226、228不需要螺钉和螺母将两件连接在一起,并且是相对轻质且用户友好的。具体地,如图10所示,围绕带瓣管道222放置夹具226、228,并且使用它们的匹配起伏几何形状而相对于缝合环252被旋转定向。另选地,夹具226、228经由对准销(未示出)被旋转地定向,其中所述对准销从一个夹具延伸到另一个夹具的盲孔中。然后,将在带瓣管道222的瓣膜端部周围的夹具226、228的组件插入盖270(图11)中,然后使用其中的活塞274和管状套管300将盖270拧入外壳体264中。当盖270被接合时,活塞274施加一些张力,以将组件保持在适当的位置。同样,在图13a和图13b中以截面示出组装的部件。
图16a至图16d和图17a至图17d分别是另选第一端部夹具226'和第二端部夹具228'的实施例的透视图和正交视图。图16a至图16d所示的第一或内端部夹具226'具有大致环形的主体370,主体370具有穿过其中的圆柱形管腔372。与夹具226、228的第一实施例非常相似,并且相对于图11和图13a,内端部夹具226'紧密地装配在带瓣管道222的管状主动脉部段258周围。夹具226'的外表面上的波状凸沿374接触缝合凸缘252的内侧并且反映其形状,例如在所示实施例中反映起伏形状。更具体地,缝合凸缘252理想地具有与主动脉环相匹配的形状,其中环的三个合缝处的三个峰在窦形区域的三个谷中间。图16a示出尺寸和形状设计成与缝合凸缘252的三个峰相匹配的三个凹陷376,以及尺寸和形状设计成与三个谷相匹配的三个凸起区域378。缝合凸缘的其他实施例具有不同的轮廓,例如针对具有二叶主动脉瓣的患者具有两个峰和两个谷,并且夹具226'的外表面与缝合凸缘的轮廓互补。端部夹具226'与其周边边缘相邻地在环形主体370中进一步包括一系列轴向通孔379。
在图17a至图17d中所示的第二或外端部夹具228'包括环形主体380,环形主体380具有从其向外突出的轴向定向的轴柱382。环形主体380的内表面的一部分包括波状密封表面384,波状密封表面384与缝合凸缘252的外侧接触并且模拟其起伏形状。具体地,围绕密封表面384周边的交替凸起峰386和下凹凹陷388的尺寸和形状设计成紧密地适形于缝合凸缘252的峰和谷。端部夹具228'与其周边边缘相邻地在环形主体380中还包括一系列轴向通孔390,通孔390与第一夹具226'中的通孔379对准。虽然未示出,但是互补的螺钉或螺栓和螺母被插入到对准的通孔379、390中,以将两个夹具226'、228'对准并固定在一起。
与首先描述的夹具226、228一样并且参考图13b,端部夹具226'、228'和缝合凸缘252构成的组件被夹持在活塞274和盖270的内端部上的径向向内指向的颈部(未编号)之间。将加压气体引入到第二歧管246b上的入口配件314使得压缩在端部夹具226'、228'之间的缝合凸缘252。提供波状凸沿374和密封表面384有助于提供缝合凸缘252周围的有效密封,并且避免凸缘变形,否则凸缘变形可能影响凸缘的植入后功能。轴柱382被示出为少量在管状套管300的管腔内,这有助于夹紧组件居中。
本申请提供特别用于测试具有密封管道的可植入瓣膜且具体是生物假体心脏瓣膜的技术,其中所述生物假体心脏瓣膜已干燥且不需要储存在防腐溶液中。术语“干燥的”或“干燥”生物假体心脏瓣膜通常是指生物假体心脏瓣膜适于在无需浸没在液体或溶液中(例如,包括防腐剂如戊二醛的溶液)的情况下储存,并且具体是长时间的在没有生物假体瓣膜的功能损失或退化的情况下的干燥储存。有许多提出的用于制造干燥的生物假体心脏瓣膜的方法和用于制造适用于其的干燥组织的方法,并且本申请提供测试带瓣管道的非破坏性方法,其中所述带瓣管道具有通过这些方法中的任一种处理的此类干燥瓣膜。从瓣膜且具体是组织中去除一定百分比的水并用甘油和乙醇代替水允许装置被“干燥”(即,甘油化)储存。包括干燥的生物假体瓣膜的带瓣管道准备植入,而不需要在盐水中进行临床冲洗,从而缩短植入时间。在一些实施例中,“干燥”生物假体组织具有小于约70%的水含量。在实际的再水合方面,功能瓣膜具有至少约70%的水含量。然而,“干燥”瓣膜(或其中的组织)的重要区别在于它们可以长时间(有时是几年)干燥储存,而无瓣膜功能的退化。
如果使用空气或其他惰性气体作为用于测试的加压介质,则在制造过程中能够快速测试每个带瓣管道。也就是说,泄漏测试是非破坏性的,并且通过使用所示的系统,能够在相对短的时间内完成测试。联接到被密封管道的“干燥”生物假体瓣膜能够针对泄漏被测试,并且如果通过测试,则能够立即干燥包装以进行运输和运送。或者,优选地,可以在管道内测试瓣膜的外部部件,并且然后在密封到无菌包装中之前组装剩余的瓣膜组件。因此,所公开的系统的实施例提供100%质量控制。
虽然已经参考特定实施例描述了系统、装置和方法,但是应当理解,在不脱离本公开的范围的情况下,可以进行各种改变和附加变化,并且可以使用等同物替代其元件。此外,在不脱离本发明的本质范围的情况下,可以进行许多修改以使特定情况或装置适应于本文的教导。因此,本公开旨在不限于本文公开的特定实施例,但是包括落入所附权利要求的范围内的所有实施例。
- 还没有人留言评论。精彩留言会获得点赞!