一种检测5F-AMB体内生物标记物及其应用的制作方法
本发明涉及确证一种合成大麻素5f-amb生物标记物,特别应用高效液相串联静电轨道离子阱高分辨质谱检测结合肝微粒体体外孵育实验,通过筛查5f-amb体外代谢产物,分析5f-amb的生物标记物,并通过大鼠体内实验验证。
背景技术:
合成大麻素是一类对人体作用机理与天然大麻素四氢大麻酚(tetrahydrocannabinol,thc)相似的新精神活性物质,主要通过结合人体内的中枢型受体cb1和末梢型受体cb2发挥作用,相比于天然大麻素,合成大麻素在人体内发挥的药效更强,危害更大。从结构上来说,很多合成大麻素与经典大麻素无关;按照结构来分,合成大麻素大致可分为七类,萘甲酰基吲哚类(jwh-018)、萘甲基吲哚类、萘甲酰基吡咯类、萘甲基茚类、苯乙酰基吲哚类(jwh-250)、环乙基苯酚类(cp47,497)和传统大麻素。与合成大麻素严峻形势相对的是目前对于合成大麻素药理学和毒理学研究报告较少,同时检测方法滞后。
合成大麻素是一类亲脂性较强的化合物,在体内代谢速度较快,生物检材中的母体药物含量一般较低,因此确定合成大麻素的生物标记物尤为重要。目前国内外对合成大麻素代谢物的研究可以分为体内代谢和体外代谢,体外代谢方法主要包括人肝细胞培养和肝微粒体孵育实验,体内代谢则以大鼠模型和斑马鱼模型为主。肝微粒体体外孵育实验具有操作简单,成本低等优点。
5f-amb为吲唑-3-甲酰胺类合成大麻素类新精神活性物质,是5f-ab-pinaca的结构衍生物。从2013年11月至2014年5月,在日本非法产品调查中,发现了19种新分布的设计药物,其中就包括5f-amb。2015年,日本报告了两起因多种药物死亡的病例,包括ab-chminaca,5f-amb和联苯甲醚。5f-amb被定为中国、新加坡、日本的非法药物。
因此本发明拟开发一种简单易操作的体外孵育实验结合大鼠体内实验,用于合成大麻素5f-amb代谢物的研究及生物标记物的确证。
技术实现要素:
本发明的第一个目的是针对现有技术的不足,提供一种检测合成大麻素5f-amb的体内生物标记物。确定5f-amb的生物标记物,通过高效液相串联静电轨道离子阱高分辨质谱检测结合化肝微粒体体外孵育实验的方法,得到5f-amb体外代谢产物,通过筛查代谢产物,对5f-amb的生物标记物进行分析,并采用大鼠体内实验验证。
表1:检测合成大麻素5f-amb的体内生物标记物
本发明的第二个目的是提供上述利用上述体内生物标记物在非诊断目的的检测合成大麻素5f-amb应用。
本发明的第三个目的是提供上述利用上述体内生物标记物的非诊断目的的合成大麻素5f-amb检测方法,具体是:
(1)取100μl尿液加入3倍体积的乙腈,涡旋,时间不少于30s,大于12000rpm的转速离心一定时间,取上清液;
(2)将上述滤液进行高效液相串联静电轨道离子阱高分辨质谱检测,若同时检测到表1三种标记物则认为事先服用合成大麻素5f-amb。
所述液相色谱条件:
色谱柱:watersuplchsst3;
柱温:30℃;
流动相:流动相a为0.1%甲酸水,流动相b为0.1%甲酸乙腈;
流动相洗脱梯度:0-1min为95%流动相a+5%流动相b、1-8.5min为95%流动相a+5%流动相b逐步替换到100%流动相b、8.5-11min为90%流动相a+10%流动相b,11-11.1min为100%流动相b逐步替换到95%流动相a+5%流动相b,11.1-13min为95%流动相a+流动相b,流速为0.3ml/min;
质谱条件:采用电喷雾电离源(esi),正离子采集模式;离子源参数:碰撞气为氮气,喷射电压3800v,雾化温度320℃,雾化气压力35arb,辅助气压力15arb,传输毛细管温度300℃;
采用fullms-ddms2扫描模式采集数据;全扫描数据采集参数:分辨率140000,自动增益控制(agc)3e6,最大注射时间(maximumit)50ms,扫描范围160to600m/z;二级质谱数据采集参数:分辨率35000,目标物agc1e5,最大it50ms,isolationwindows4.0m/z,碰撞能量为10、25、35ev。
本发明的第四个目的是提供一种试剂盒,包括上述标记物的标准品和/或检测标记物的检测试剂。
本发明具有如下优点:
1)本发明克服合成大麻素5f-amb在体内代谢速度快,在生物检材中的母体药物含量一般较低,提供一种利用体内代谢标记物进行检测,精确度高,灵敏度高,结果准确可靠。
2)本发明所需的检测样本生物量较少,仅为100μl。
附图说明:
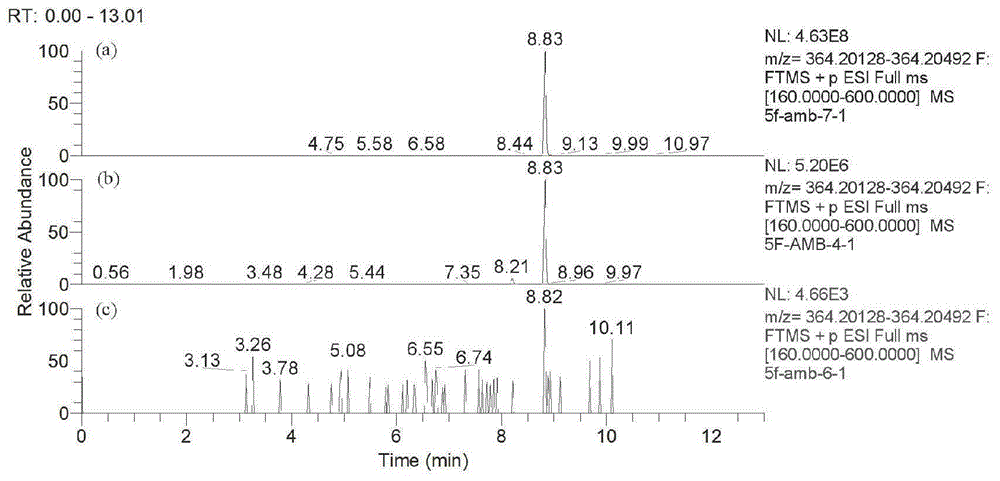
图1是5f-amb的色谱图,其中(a)标准溶液,(b)孵育60min的样品,(c)空白溶液;
图2是5f-amb的二级质谱图;
图3是肝微粒体体外代谢产物色谱图;
图4是肝微粒体体外代谢产物二级质谱图及推导碎裂模式;其中(a)m1-a,(b)m2-a,(c)m3-a,(d)m4-a,(e)m4-b,(f)m4-c,(g)m5-a,(h)m6-a,(i)m7-a;
图5是肝微粒体体外代谢途径示意图;
图6是5f-amb峰面积随时间变化曲线;
图7是大鼠体内代谢产物色谱图;
图8是大鼠体内代谢产物二级质谱图及推导碎裂模式;其中(a)m1-a,(b)m4-a,(c)m5-a;
图9是大鼠体内代谢产物峰面积随时间变化曲线;其中(a)酯水解,(b)酯水解+氧化,(c)酯水解+脱氟氧化;
图10是大鼠空白对照组色谱图。
具体实施方式
下面结合具体实施例和附图对本发明做进一步地分析。
实施例1:高效液相串联静电轨道离子阱高分辨质谱检测结合化肝微粒体体外孵育实验的方法,得到5f-amb体外代谢产物:
(1)取rlm(鼠肝微粒体)先-20℃解冻10min,再4℃解冻待用;
(2)精确称取1mg的5f-amb,以dmso为溶剂,配置1mg/ml的5f-amb标准品溶液;取20.4724mgnadp+(氧化型辅酶ⅱ钠盐)于1ml的pbs中,得到0.026mmol/mlnadp+储备液;取20.0706mgg-6-p(6-磷酸葡萄糖二钠)1ml的pbs中,得到0.066mmol/mlg-6-p储备液;将1000u的g-6-pdh(葡萄糖-6-磷酸脱氢酶)溶于10ml的pbs,得到100u/mlg-6-pdh储备液;称取0.02852g的mgcl2溶于30ml的pbs中,得到10mm的mgcl2储备液;
(3)体外孵育
3.1取一个2ml的离心管,加入10μlnadp+储备液、10μlg-6-p储备液、8μlg-6-pdh储备液、66μlmgcl2储备液混合均匀,37℃水浴5min,得到nadph再生系统;
3.2另取一个2ml的离心管中加入96μl的pbs缓冲盐溶液、1μl的(1mg/ml)5f-amb标准品溶液、10μl20mg/ml的rlm混合均匀,37℃水浴5min;
3.3在步骤3.2混合液中加入nadph再生系统,开始启动体外孵育反应(终体积为200μl,其中,1.3mmol/lnadp+,3.3mmol/lg-6-p,0.4u/mlg-6-pdh,3.3mmol/lmg2+)。同时将未加入5f-amb以及未加入肝微粒体的孵育系统作为对照分析。
体外孵育反应温度为37℃,孵育时间为5min、10min、30min、60min、120min。孵育结束加入200μl乙腈,涡旋离心取上清液用高效液相串联静电轨道离子阱高分辨质谱检测。
通过比较不同孵育时间得到的代谢物的种类以及响应强度,最终选择孵育时间为60min;孵育60min后得到5f-amb的9种代谢产物(见表1)。
色谱方法:色谱柱为watersuplchsst3(100×2.1mm,1.8μm),柱温为30℃,流动相a为0.1%甲酸水溶液、b为0.1%甲酸乙腈溶液;梯度洗脱程序:0.0-1.0min:95%a,1.0-8.5min:95%a-0%a,8.5-11min:保持90%a,11-11.1min:0%a-95%a,11.1-13min:保持95%a,流速为0.3ml/min。
质谱方法:采用电喷雾电离源(esi),正离子采集模式。离子源参数:碰撞气:氮气,喷射电压:3800v,雾化温度:320℃,雾化气压力:35arb,辅助气压力:15arb,传输毛细管温度:300℃。采用fullms-ddms2扫描模式采集数据;全扫描数据采集参数,分辨率:140000,自动增益控制(agc):3e6,最大注射时间(maximumit):50ms,扫描范围:160to600m/z;二级质谱数据采集参数,分辨率:35000,目标物agc:1e5,最大it:50ms,isolationwindows:4.0m/z,碰撞能量为10、25、35ev。
实施例2:分析5f-amb体外代谢物
在总离子流图中输入母药精确质量数,提取色谱峰;对比标准品、未加标准目标物和经孵育60min后样品的色谱峰响应值,得到母药经孵育代谢后的变化量,见图15f-amb的色谱图,其中(a)标准溶液,(b)孵育60min的样品,(c)空白溶液。
图2是5f-amb的二级质谱图;
图3是肝微粒体体外代谢产物色谱图;
图4是肝微粒体体外代谢产物二级质谱图及推导碎裂模式;
图5是肝微粒体体外代谢途径示意图;
图6是5f-amb峰面积随时间变化曲线;
图7是大鼠体内代谢产物色谱图;
图8是大鼠体内代谢产物二级质谱图及推导碎裂模式;
图9是大鼠体内代谢产物峰面积随时间变化曲线;
图10是大鼠空白对照组色谱图。
表25f-amb肝微粒体孵育1h的代谢产物
5f-amb分子式为c19h26fn3o3,质荷比为m/z364.20310;二级质谱图主要碎片离子为m/z304.18158(脱去酯基)、m/z251.11877、m/z233.10826、m/z213.10210、m/z145.03955。m/z251.11877为m/z233.10826加上一个h2o所得。
图4-a的m1-a为5f-amb经酯水解后的代谢产物,主要碎片有m/z304、251、233、213。酯水解代谢产物m/z为350.18716,质荷比与母药相比少了14da,因为酯水解丢失ch2所得。
m2-a为5f-amb的氧化代谢产物,如图4-b所示,该代谢产物主要碎片有m/z320、267、249、145;320为314氧化加氧得来,249是在吲唑侧链结构的233上氧化加氧,同时出现145的碎片,说明吲唑结构未发生变化,氧化位点发生在戊基侧链上。
m3-a为5f-amb的脱氟氧化代谢产物,如图4-c所示,主要碎片有m/z302、231、213,145,m/z302、231为吲唑侧链上的氟脱氟氧化得来。
m4为5f-amb的酯水解加氧化的代谢产物,如图4-d所示,m4-a的主要碎片离子为m/z320、267、249、145,m/z249是在碎片离子为233的吲唑侧链结构的上氧化加氧,m/z145说明吲唑结构未发生变化,所以推测氧化反应位于戊基侧链上。如图4-e所示,m4-b的主要碎片离子为m/z320、251、233、213、145,出现m/z233、213、145的碎片表明戊基侧链以及吲唑结构都未发生变化,m/z320为m/z304氧化加氧得来,表明氧化发生在丁烷上。如图4-f所示,m4-c的主要碎片离子为m/z320、267、249、161,m/z161为吲唑结构氧化得到的碎片,故氧化反应位于吲唑结构上。
m5-a为5f-amb的酯水解加脱氟氧化的代谢产物,如图4-g所示,主要碎片离子为m/z302、231、213、145;m/z302为m/z304脱氟氧化得到的碎片离子。
m6-a为5f-amb的酯水解脱氢加脱氟氧化的代谢产物,如图4-h所示,代谢产物主要碎片有m/z318、231、213;
m7-a为5f-amb的脱氟氧化成羧酸的代谢产物,如图4-i所示,主要碎片离子有m/z358、316、245、227、217、145。m/z358为m/z304脱氟氧化为羧酸得到的碎片离子。
通过分析,总共得到9种5f-amb代谢产物,其中酯水解反应代谢物1种,氧化代谢物1种,脱氟氧化代谢物1种,合并酯水解和氧化代谢物3种,合并酯水解和脱氟氧化代谢物1种,合并酯水解脱氢和脱氟氧化代谢物1种,脱氟氧化为羧酸代谢物1种。
实施例3:大鼠体内实验验证生物标记物
以聚氧乙基代蓖麻油和无水乙醇1:1为溶剂,配置5mg/ml的5f-amb溶液,生理盐水稀释到1.25mg/ml待用。雄性的sd大鼠2只,给药前12小时禁止大鼠进食但可自由饮水;大鼠体重约200g。
通过尾静脉注射0.8ml样品,给药剂量为5mg/kg,尾静脉注射后收集0h-4h、4h-8h、8h-24h、24h-48h、48h-72h大鼠尿液。在分析实验之前保存在-80℃,最后对大鼠进行处死。采用注射空白溶剂的大鼠作为对照分析。
取一定体积的尿液加入3倍体积的乙腈,涡旋,时间不少于30s,大于12000rpm的转速离心一定时间,取上清液装入进样小瓶进样。
通过建立大鼠体内实验模型,收集不同时间点的大鼠尿液,使用高效液相串联静电轨道离子阱高分辨质谱检测。由图6可知,随着代谢时间的增加,大鼠尿液中母药含量逐渐下降;代谢超过48h后,大鼠尿液中已检测不到母药。
通过compounddiscover软件进行分析处理后的尿液样品,得到四种ⅰ相代谢产物,包括酯水解代谢产物、酯水解加氧化代谢产物、酯水解加二氧化代谢产物、酯水解加脱氟氧化代谢产物。其中酯水解、酯水解加氧化、酯水解加脱氟氧化代谢产物均在肝微粒体体外实验中被检测到,且空白对照组的大鼠尿液并未检测到酯水解、酯水解加氧化、酯水解加脱氟氧化三种代谢产物。随着代谢时间的增长,三种代谢产物响应降低,但在注射样品72h后,表1三种代谢产物m1-a、m4-a、m5-a均有良好的响应,见图9。在体外肝微粒体及体内大鼠实验中,表1三种代谢产物m1-a、m4-a、m5-a保留时间及二级碎片离子一致,具体信息见图6、图7;因此将表1三种代谢产物m1-a、m4-a、m5-a作为5f-amb生物标记物。
实施例4:动物实验设置不同给药剂量,验证5f-amb三种代谢产物作为生物标记物的检测灵敏度
采用实施例3实验方案,设置2.5mg/kg、5mg/kg两个给药剂量,注射药物后收集大鼠尿液,得到5f-amb三种生物标记物峰面积见表3。
表3不同给药剂量生物标记物峰面积
当给药剂量为2.5mg/kg时,在大鼠尿液中可检测到5f-amb的三种生物标记物,且响应良好;说明5f-amb三种生物标记物有较好的检测灵敏度,可以实现对摄入微量5f-amb的检测。
实施例5:排他检测
本发明需同时检测到5f-amb酯水解、酯水解加氧化、酯水解加脱氟氧化三种代谢产物,即可确定人体吸食了合成大麻素5f-amb。查阅文献可得,合成大麻素amb经酯水解加氧化可产生和5f-amb经酯水解加脱氟氧化相同的代谢产物;5f-ab-pinaca经酰胺水解的代谢产物和5f-amb酯水解产生的代谢产物相同;5f-ab-pinaca经酰胺水解加氧化生成和5f-amb酯水解加氧化分子式相同的代谢产物。因而将5f-amb的其中一种代谢产物作为其生物标记物,将不能确定人体是否吸食了合成大麻素5f-amb。因此在尿液中同时检测到5f-amb酯水解、酯水解加氧化、酯水解加脱氟氧化三种代谢产物,即可确定人体吸食了合成大麻素5f-amb。
上述实施例并非是对于本发明的限制,本发明并非仅限于上述实施例,只要符合本发明要求,均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!