基于免疫组化空间电化学检测样品中抗原含量的方法与流程
本发明属于生物技术领域,尤其是涉及一种基于免疫组化空间电化学检测样品中抗原含量的方法。
背景技术:
免疫组织化学检测,简称免疫组化检测,是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素等)显色来确定组织细胞抗原(多肽,蛋白质,病原体等),对其进行定位、定性及相对定量的研究,分为免疫组织化学技术(immunohistochemistry)和免疫细胞化学技术(immunocytochemistry)。根据标记物的种类,免疫组化可大致分为免疫荧光细胞化学技术,免疫酶细胞化学技术以及免疫胶体金技术。
在常规肿瘤病理诊断中,部分病例仅靠he染色难以对其形态做出准确诊断。而免疫组化,可以借助于特异性抗原与抗体的结合,对很多疑难肿瘤做出明确诊断,其在低分化/未分化肿瘤鉴别诊断准确率达50%-75%。免疫组化主要可以用于恶性肿瘤的鉴别诊断,确定转移性恶性肿瘤的原发部位,肿瘤病理分型,软组织肿瘤的治疗,发现微小转移灶等。
免疫组化因其特异性强,敏感性高以及定位准确等优点,近年来,已成为医学肿瘤诊断上的“金标准”。但由于其操作复杂:对病理技师的技术要求较高;灵敏度相对不高:由于光学的限制,微量的抗原有时无法准确观察;无法定量:免疫组化的片子只能相对定量,且需要几位专家给出统一结论,人为因素较多;耗费时间:由于免疫组化的操作流程较多,需要2~3天,才能给临床病人给出准备的病理报告,容易影响后续的治疗进度。
所以,现有技术中免疫组化检测还存在无法完全定量、操作复杂等缺点。
技术实现要素:
本发明的目的在于提供基于免疫组化电化学检测样品中抗原含量的方法,以及基于免疫组化空间电化学检测样品中抗原含量的方法。
本发明通过电化学信号强弱反应抗原的含量并实现空间匹配,为免疫组化的定量检测提供可能。
本发明的目的可以通过以下技术方案来实现:
本发明提供基于免疫组化电化学检测样品中抗原含量的方法,包括以下步骤:将电化学信号修饰到抗体上,将电化学信号修饰后的抗体与待测抗原含量的样品混合,进行抗原抗体的结合,使用电化学仪检测与抗原结合的抗体的电化学信号或检测未与抗原结合的抗体电化学信号,将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得待测样品中抗原的含量。
进一步地,当待测抗原含量的样品为待测抗原含量的组织时,将待测抗原含量的组织与电化学信号修饰后的抗体混合后,共孵育,进行抗原抗体的结合,去除待测抗原含量的组织,使用差分脉冲伏安法检测未结合的抗体电化学信号,将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得待测抗原含量的组织中抗原的含量。
进一步地,当待测抗原含量的样品为待测抗原含量的细胞时,将待测抗原含量的细胞与电化学信号修饰后的抗体混合后,共孵育,进行抗原抗体的结合,离心去除未结合的抗体,使用差分脉冲伏安法检测细胞表面电化学信号,将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得待测抗原含量的组织中抗原的含量。
当使用电化学仪检测与抗原结合的抗体的电化学信号时,测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得与抗原结合的抗体的含量,根据与抗原结合的抗体的含量,计算得出检测样品中抗原含量;
当使用电化学仪检测未与抗原结合的抗体电化学信号时,将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得未与抗原结合的抗体的含量,根据与待测抗原样品混合之前的电化学信号修饰的抗体的总量计算与抗原结合的抗体的含量,根据与抗原结合的抗体的含量,计算得出检测样品中抗原含量。
进一步地,电化学信号的标准曲线是通过以下方法制作的:使用电化学仪检测三元电池法下不同浓度的电化学信号,以浓度的log值为x轴,所对应的电流值为y轴,制作线性曲线,即为电化学信号的标准曲线。
进一步地,以上方法中,通过使用不同电化学信号修饰不同抗体,可以实现相应抗原的同时检测。
进一步地,所述电化学信号选自二茂铁或量子点,所述量子点选自zns、cds、cdte、cdse或pbs等。
进一步地,使用电化学仪检测电化学信号时,使用的电极为表面修饰有树枝状金和导电高分子的电极。
具体而言,表面修饰有树枝状金和导电高分子的电极是指在电极的表面电镀有树枝状金,树枝状金的表面电镀有导电高分子。
其中,所述导电高分子是薄薄地电镀在树枝状金表面,电镀后的电极可大大提高其稳定性和导电性。
进一步地,表面修饰有树枝状金和导电高分子的电极的获得方法为:使用电镀的方法先将树枝状金修饰在电极的表面,然后使用电镀的方法将导电高分子修饰在树枝状金的表面。
进一步地,表面修饰有树枝状金和导电高分子的电极的获得方法,包括以下步骤:
(1)在氯金酸、硫酸钠溶液中,使用计时电流法对电极表面进行电镀后获得树枝状金;
(2)将导电高分子单体与四丁基高氯酸铵溶于乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将导电高分子电镀在树枝状金表面,获得表面修饰有树枝状金和导电高分子的电极。
其中,优选地,步骤(1)中,氯金酸的浓度为30mm,硫酸钠溶液的浓度为0.1mna2so4。
其中,优选地,所述导电高分子选自乙烯二氧噻吩、噻吩乙酸以及吡咯等。
进一步地,将不同的电化学信号修饰到抗体上的方法为:将电化学信号(例如二茂铁、量子点等),在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺存在的条件下与特异性抗体共孵育。
以上方法可以根据电化学信号的强弱直接对应抗原的数量,实现待测样品中全定量检测。
本发明还提供基于免疫组化空间电化学检测样品中抗原含量的方法,包括以下步骤:
a.将电化学信号修饰到抗体上;
b.将电化学信号修饰后的抗体加入待测组织中,共孵育,进行抗原抗体的结合;
c.去除待测抗原含量的组织,使用差分脉冲伏安法检测未结合的抗体电化学信号;
d.将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得待测抗原含量的组织中抗原的含量;
e.提取其他部分区域组织,重复上述检测方法,获得不同区域组织的电化学信号值;
f.将不同区域得出的电化学信号值转化为热图,通过与he(苏木素-伊红)图组合实现空间免疫组化电化学检测。
进一步地,步骤f中,将不同区域得出的电化学信号值转化为热图是空间检测的常规方法,根据热图中点的颜色的变化,直观表达出不同区域组织中抗原含量的多少,抗原高表达的地方热图中点的颜色越深,抗原低表达的地方热图中点的颜色越浅。
与现有技术相比,本发明具有以下优点及有益效果:
(1)使用不同量子点修饰不同抗体,可以实现相应抗原的同时检测;
(2)电化学的强弱直接对应抗原的数量,实现全定量检测;
(3)电化学检测步骤相较于免疫组化来说,操作简单,对操作员技术要求不高;
(4)修饰后的电极可以大大提高灵敏度,实现抗原的微量检测。
附图说明
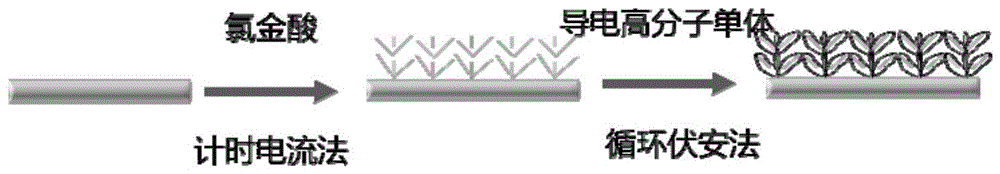
图1:电极修饰流程图。
图2:实施例1中树枝状金的扫描电镜图。
图3:实施例1中树枝状金后的循环伏安法和电化学阻抗法图。
图4:电化学信号的标准曲线。
图5:结直肠癌组织切片处理后获得的免疫组化图。
图6:未结合的抗体电化学信号与标准曲线进行比较获得待测样品中抗原的含量。
图7:实施例1中二茂铁修饰的抗体,用于组织表面抗原的电化学检测流程图。
图8:实施例3中二茂铁修饰的抗体,用于细胞表面抗原的电化学检测流程图。
图9:实施例4中不同量子点修饰的抗体,用于细胞表面抗原的电化学检测流程图。
图10:实施例5、6中不同量子点修饰的抗体,用于组织表面抗原的电化学检测流程图。
图11:组织切片处理方法及其电化学检测流程图。
具体实施方式
本发明提供表面修饰有树枝状金和导电高分子的电极的获得方法,参考图1,表面修饰有树枝状金和导电高分子的电极是指在电极的表面电镀有树枝状金,树枝状金的表面电镀有导电高分子。其中,所述导电高分子是薄薄地电镀在树枝状金表面,电镀后的电极可大大提高其稳定性和导电性。
参考图1,表面修饰有树枝状金和导电高分子的电极的获得方法为:
(1)在氯金酸、硫酸钠溶液中,使用计时电流法对电极表面进行电镀后获得树枝状金;
(2)将导电高分子单体与四丁基高氯酸铵溶于乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将导电高分子电镀在树枝状金表面,获得表面修饰有树枝状金和导电高分子的电极。
优选地,步骤(1)中,氯金酸的浓度为30mm,硫酸钠溶液的浓度为0.1mna2so4。优选地,所述导电高分子选自乙烯二氧噻吩、噻吩乙酸以及吡咯等。
本发明提供基于免疫组化电化学检测样品中抗原含量的方法,包括以下步骤:将电化学信号修饰到抗体上,将电化学信号修饰后的抗体与待测抗原含量的样品混合,进行抗原抗体的结合,使用电化学仪检测与抗原结合的抗体的电化学信号或检测未与抗原结合的抗体电化学信号,将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得待测样品中抗原的含量。
当待测抗原含量的样品为待测抗原含量的组织时,将待测抗原含量的组织与电化学信号修饰后的抗体混合后,共孵育,进行抗原抗体的结合,去除待测抗原含量的组织,使用差分脉冲伏安法检测未结合的抗体电化学信号,将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得待测抗原含量的组织中抗原的含量。
当待测抗原含量的样品为待测抗原含量的细胞时,将待测抗原含量的细胞与电化学信号修饰后的抗体混合后,共孵育,进行抗原抗体的结合,离心去除未结合的抗体,使用差分脉冲伏安法检测细胞表面电化学信号,将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得待测抗原含量的组织中抗原的含量。
当使用电化学仪检测与抗原结合的抗体的电化学信号时,测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得与抗原结合的抗体的含量,根据与抗原结合的抗体的含量,计算得出检测样品中抗原含量;
当使用电化学仪检测未与抗原结合的抗体电化学信号时,将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得未与抗原结合的抗体的含量,根据与待测抗原样品混合之前的电化学信号修饰的抗体的总量计算与抗原结合的抗体的含量,根据与抗原结合的抗体的含量,计算得出检测样品中抗原含量。
其中,电化学信号的标准曲线是通过以下方法制作的:
使用电化学仪检测三元电池法下不同浓度的电化学信号,以浓度的log值为x轴,所对应的电流值为y轴,制作线性曲线,即为电化学信号的标准曲线。
以上方法中,通过使用不同电化学信号修饰不同抗体,可以实现相应抗原的同时检测。
其中,所述电化学信号选自二茂铁或量子点,所述量子点选自zns、cds、cdte、cdse或pbs等。
将电化学信号修饰到抗体上的方法为:将电化学信号(例如二茂铁、量子点等),在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺存在的条件下与特异性抗体共孵育。
以上方法可以根据电化学信号的强弱直接对应抗原的数量,实现待测样品中全定量检测。
本发明还提供基于免疫组化空间电化学检测样品中抗原含量的方法,包括以下步骤:
a.将电化学信号修饰到抗体上;
b.将电化学信号修饰后的抗体加入待测组织中,共孵育,进行抗原抗体的结合;
c.去除待测抗原含量的组织,使用差分脉冲伏安法检测未结合的抗体电化学信号;
d.将测得的电化学信号跟电化学信号的标准曲线进行比较,计算获得待测抗原含量的组织中抗原的含量;
e.提取其他部分区域组织,重复上述检测方法,获得不同区域组织的电化学信号值;
f.将不同区域得出的电化学信号值转化为热图,通过与he(苏木素-伊红)图组合实现空间免疫组化电化学检测。
进一步地,步骤f中,将不同区域得出的电化学信号值转化为热图是空间检测的常规方法,根据热图中点的颜色的变化,直观表达出不同区域组织中抗原含量的多少,抗原高表达的地方热图中点的颜色越深,抗原低表达的地方热图中点的颜色越浅。
下面结合附图和具体实施例对本发明进行详细说明。
实施例1
电极修饰流程图如图1所示,取30mmhaucl4,0.1mna2so4,在氯金酸、硫酸钠溶液中,使用计时电流法对电极表面进行电镀后获得树枝状金,所得树枝状金形貌如图2所示。使用循环伏安法和电化学阻抗法比较树枝状金修饰前后,电极的电流电阻值,如图3所示。
将导电高分子单体(本实施例中为乙烯二氧噻吩)与四丁基高氯酸铵溶于无水乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将导电高分子电镀在树枝状金表面,获得表面修饰有树枝状金和导电高分子的电极。
其中,导电高分子单体与四丁基高氯酸铵在乙腈中的浓度为7.5mm和50mm,循环伏安法的电压范围0.65-1.7v,扫描速率50mv/s,循环次数为20次。
使用差分脉冲伏安法检测不同浓度电化学信号(二茂铁,1μm,10μm,50μm,100μm,500μm,1mm)的电流值,以浓度的log值为x轴,所对应的电流强度值为y轴,制作线性曲线,即为电化学信号的标准曲线如图4所示。
将结直肠癌组织切片处理,获得免疫组化图,如图5所示。
将电化学信号(二茂铁),在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺存在的条件下在乙腈中与特异性抗体(本实施例中为ki67)共孵育,得到电化学信号修饰后的抗体。
其中,电化学信号(二茂铁)与1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺在乙腈中的浓度分别为1mm,20mm.20mm,抗体稀释浓度比为1:100。
将电化学信号修饰后的抗体加入待检测的石蜡切片组织的载玻片中,共孵育,进行抗原抗体的结合,去除载玻片,使用差分脉冲伏安法检测检测溶液中未结合的抗体电化学信号,与标准曲线进行比较,获得待测样品中抗原的含量。如图6。
其中,电化学信号的标准曲线是通过以下方法制备的:使用电化学仪检测三元电池法下不同浓度的电化学信号,以浓度的log值为x轴,所对应的电流强度值为y轴,制作线性曲线,即为电化学信号的标准曲线。
本实施例的总流程如图7所示。
实施例2
取30mmhaucl4,0.1mna2so4,使用计时电流法电镀后获得树枝状金,将导电高分子单体如乙烯二氧噻吩,噻吩乙酸以及吡咯等与四丁基高氯酸铵溶于无水乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将高分子电镀在树枝状金表面。在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺溶液中加入二茂铁与特异性抗体共培养,随后将待检测的冰冻切片组织的载玻片浸入溶液中,共孵育,去除载玻片,检测溶液中未结合的抗体电化学信号,流程如图7所示。
实施例3
取30mmhaucl4,0.1mna2so4,使用计时电流法对电极表面进行电镀后获得树枝状金。将导电高分子单体如乙烯二氧噻吩,噻吩乙酸以及吡咯等与四丁基高氯酸铵溶于乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将导电高分子电镀在树枝状金表面,获得表面修饰有树枝状金和导电高分子的电极。将电化学信号(二茂铁),在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺存在的条件下在乙腈中与特异性抗体共孵育,得到电化学信号修饰后的抗体。将电化学信号修饰后的抗体加入待检测的细胞中,共孵育,进行抗原抗体的结合,离心去除未结合的抗体,差分脉冲伏安法检测细胞表面电化学信号,将待测样品中的电化学信号跟电化学信号的标准曲线进行比较,获得待测样品中抗原的含量。流程如图8所示。
实施例4
取30mmhaucl4,0.1mna2so4,使用计时电流法电镀后获得树枝状金,将导电高分子单体如乙烯二氧噻吩,噻吩乙酸以及吡咯等与四丁基高氯酸铵溶于无水乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将高分子电镀在树枝状金表面。在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺溶液中加入a’量子点与特异性抗体a共培养,在含有edc,nhs溶液中加入b’量子点与特异性抗体b共培养,在含有edc,nhs溶液中加入c’量子点与特异性抗体c共培养。随后加入待检测的细胞中,共孵育,离心去除未结合的抗体,使用dpv检测细胞表面电化学信号,流程如图9所示。
实施例5
取30mmhaucl4,0.1mna2so4,使用计时电流法电镀后获得树枝状金,将导电高分子单体如乙烯二氧噻吩,噻吩乙酸以及吡咯等与四丁基高氯酸铵溶于无水乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将高分子电镀在树枝状金表面。在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺溶液中加入a’量子点与特异性抗体a共培养,在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺溶液中加入b’量子点与特异性抗体b共培养,在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺溶液中加入c’量子点与特异性抗体c共培养。随后将待检测的石蜡切片组织的载玻片浸入溶液中,共孵育,去除载玻片,检测溶液中未结合的抗体电化学信号,使用针头提取部分区域组织,加入抗体孵育后,检测电化学信号值,将不同区域得出的电化学信号值转化为热图,通过与苏木精-伊红染色法所得图片组合实现空间免疫组化电化学检测,所得图片可以与免疫组化对比,流程如图10所示。
实施例6
取30mmhaucl4,0.1mna2so4,使用计时电流法电镀后获得树枝状金,将导电高分子单体与四丁基高氯酸铵溶于无水乙腈中,通入氮气,去除溶液中空气,使用循环伏安法将高分子电镀在树枝状金表面。在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺溶液中加入a’量子点与特异性抗体a共培养,在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺溶液中加入b’量子点与特异性抗体b共培养,在含有1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺溶液中加入c’量子点与特异性抗体c共培养。随后将待检测的冰冻切片组织的载玻片浸入溶液中,共孵育,去除载玻片,检测溶液中未结合的抗体电化学信号如图10所示,使用针头提取部分区域组织,加入抗体孵育后,检测电化学信号值,将不同区域得出的电化学信号值转化为热图,通过与苏木精-伊红染色法所得图片组合实现空间免疫组化电化学检测,所得图片可以与免疫组化对比,流程如图10所示。
以上实施例中,组织切片处理方法及其电化学检测流程图如图11所示:
1.石蜡切片(ihc染色)
a.制备石蜡切片
1)将刚取出的新鲜组织放入包埋盒中,4%多聚甲醛溶液中固定。
2)自动生物组织脱水机脱水。
b.ihc染色
1)脱蜡:二甲苯1(25min)→二甲苯2(25min)。
2)水化:梯度酒精水化,无水乙醇1(15min)→无水乙醇2(10min)→95%乙醇(5min)→90%乙醇(5min)→80%乙醇(5min)。
3)抗原修复:
高温高压修复法:在高压锅中加入适量的柠檬酸盐缓冲溶液,放入载玻片,修复时间5-20min。
4)阻断内源性过氧化物酶活性:
将载玻片放入预热的3%h2o2-甲醇溶液中,用于消除内源性过氧化物酶,37℃,30min。
5)封闭
组织处加上10%bsa,放置于湿盒中,37℃,1h。
2.冰冻切片(ihc染色)
a.冰冻切片
1)取出新鲜组织,蔗糖溶液脱水,oct包埋剂包埋组织。
2)将切片厚度调为7μm进行切片。
b.ihc染色
1)丙酮固定和水化:切片先经丙酮固定,再经pbs短暂水化。
2)抗原修复:
高温高压修复法:在高压锅中加入适量的柠檬酸盐缓冲溶液,放入载玻片,修复时间5-20min。
3)阻断内源性过氧化物酶活性:
将载玻片放入预热的3%h2o2-甲醇溶液中,用于消除内源性过氧化物酶,37℃,30min。
4)封闭
组织处加上10%bsa,放置于湿盒中,37℃,1h。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!